Screening of Leuconostoc Strains with Antibacterial Activity from Fermented Vegetables and Mining of Bacteriocin Gene Cluster
-
摘要: 为提高发酵蔬菜的安全性和保藏性,从来自云南传统发酵蔬菜的8株明串珠菌中筛选出1株对食源性致病菌和引起泡菜过酸化的细菌抑制效果好的肠膜明串珠菌AP7。通过排除酸和H2O2影响及蛋白酶敏感性确定AP7的主要抑菌物质,分析其酸稳定性和热稳定性,根据AP7的全基因组序列挖掘潜在的细菌素基因簇。结果表明:排除酸及H2O2的影响后,菌株的发酵上清液仍具有明显抑菌活性,经蛋白酶处理后,抑菌效果明显下降,推测AP7发酵上清液浓缩液中的抑菌物质为细菌素;该细菌素对pH变化敏感,热稳定性高,分子质量在6.51~14.4 kDa;全基因组测序表明,菌株AP7全基因组包含1条染色体(1948310 bp)和2个质粒(37366和20698 bp),GC含量37.7%;存在1个以Enterocin_X_chain_beta细菌素为核心的基因簇,其编码产物预测为带正电的亲水性稳定蛋白,二级结构以α-螺旋为主,三级结构主要由两端松散肽链和中间α-螺旋构成。综上,产细菌素的肠膜明串珠菌AP7具有优良抑菌性能,有潜力应用于酸性食品的发酵和防腐。Abstract: In order to improve the safety and preservability of fermented vegetables, strain Leuconostoc mesenteroides AP7, with potent inhibitory effects on foodborne pathogens and bacteria causing paocai over-acidification, was selected from 8 Leuconostoc strains derived from traditional fermented vegetables in Yunnan, China. The main antimicrobial substance of AP7 was determined by eliminating the effects of organic acid and H2O2 and through protease sensitivity. The acid stability and thermal stability were analyzed and potential bacteriocin gene clusters were mined from the whole genome sequence of AP7. The results showed that the culture supernatant still had obvious antibacterial activity after excluding the influence of acid and H2O2, and after protease treatment, the antibacterial effect decreased significantly. It was speculated that the antibacterial substance in the concentrated culture supernatant was bacteriocin. The bacteriocin was sensitive to pH changes, had high thermal stability, and had a molecular weight of 6.51~14.4 kDa. Whole genome sequencing showed that the whole genome of AP7 contained 1 chromosome (1948310 bp) and 2 plasmids (37366 and 20698 bp), with a GC content of 37.7%. There was a gene cluster with Enterocin_X_chain_beta bacteriocin as the core. Its encoded product was predicted to be a positively charged hydrophilic stable protein, the secondary structure was dominated by α-helix, and the tertiary structure was mainly composed of loose peptide chains at both ends and an α-helix in the middle. In summary, the bacteriocin-producing Leuconostoc mesenteroides AP7 has excellent antibacterial properties and has the potential to be applied to the fermentation and preservation of acidic foods.
-
新鲜蔬菜经不同微生物发酵,形成风味独特、营养价值高、保质期长的发酵蔬菜,发酵蔬菜中的菌群决定了产品的风味特征,营养功能和安全性,同时也影响成品的保藏性[1]。蔬菜发酵过程中的优势乳酸菌包括魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)和乳杆菌属(Lactiplantibacillus)[2]。同型发酵的乳杆菌耐酸能力强,在泡菜储存过程中会继续发酵,产生乳酸,导致泡菜的后酸化[3−4];此外,发酵蔬菜在生产、加工及贮藏过程中易受到微生物的污染,导致软化、变色、变味和腐败变质,通常采用高盐腌渍和添加防腐剂延长发酵蔬菜保质期,但高盐和防腐剂不利于人身体健康[5]。
乳酸菌合成的细菌素是一种抗菌肽,是其自身的次生代谢产物。通常细菌素的分子量低,翻译修饰后,易被蛋白水解,对人体无害。因此,开发具有生物拮抗性能的天然发酵菌种以保持泡菜品质显得尤为重要。明串珠菌具有广谱抑菌性,能防止发酵蔬菜过酸,抑制食源性致病菌延长其保藏期,常被用作泡菜发酵剂[6−7]。CHANG等[6]用植物乳植杆菌(Lactiplantibacillus plantarum)诱导柠檬明串珠球菌(Leuconostoc citreum)GJ7产生细菌素,诱导后的GJ7对植物乳植杆菌(L. plantarum)有较好的抑制效果;用诱导后的GJ7发酵韩国泡菜,7 ℃下发酵27 d,发酵前期,自然发酵泡菜的总酸比GJ7发酵泡菜增加的慢,但最终自然发酵泡菜的总酸1.0%(pH3.98)超过了GJ7发酵泡菜0.86%(pH4.18)。BAJPAI等[8]从韩国泡菜里分离的肠膜明串珠菌(Leuconostoc mesenteroides)无细胞上清液对食源性致病菌有显著的抑制作用,最低抑菌浓度为250~2000 µg/mL。
明串珠菌存在蔬菜早期发酵阶段,在蔬菜发酵过程中产生CO2、乙醇和甘露醇作为代谢产物,产酸速率慢,赋予发酵蔬菜微酸、清爽和愉快的味道,感官品质较好[9]。而过酸发酵蔬菜中含有大量L. plantarum和清酒广布乳杆菌(Latilactobacillus sakei)[10−11]。目前,乳酸乳球菌(Lactococcus lactis)对引起发酵蔬菜过酸的L. plantarum和清酒广布乳杆菌(L. sakei)抑制的研究较多[10,12−13]。有关明串珠菌对引起泡菜过酸菌抑菌特性的研究较少。目前,对产细菌素乳酸菌筛选的研究多集中于乳杆菌属[14−16],本研究从分离自云南传统发酵蔬菜样品的8株明串珠菌中,筛选一株抑菌效果好且产细菌素的明串珠菌,并对其进行抑菌特性的研究和细菌素基因簇的挖掘,以期为工业开发蔬菜专用发酵剂提供备选菌株。
1. 材料与方法
1.1 材料与仪器
明串珠菌 分离自云南不同地区自制发酵蔬菜,AP7、LPC-1、JD3-3、FYF-1、FYF-3、STJ-2、G26、L-1均保存于云南省农业科学院发酵食品微生物菌种库(表1);大肠杆菌(Escherichia coli ATCC25922)、金黄色葡萄球菌(Staphylococcus aureus ATCC25923)、MRS肉汤培养基、MRS固体培养基、NB肉汤培养基、BHI液体培养基、LB液体培养基、LB固体培养基 青岛高科技工业园海博生物技术有限公司;L. sakei、L. plantarum 分离自云南传统发酵过酸泡菜样品,保存于云南省农业科学院发酵食品微生物菌种库;氯化钠、氢氧化钠、盐酸 天津市风船化学试剂科技有限公司;过氧化氢酶(酶活力≥3000 U/mg) 上海生工生物工程股份有限公司;蛋白酶K(酶活力40 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(1:10000,酶活力≥250 U/mg) 分析纯,北京索莱宝科技有限公司;草酸标准品、柠檬酸标准品、酒石酸标准品、苹果酸标准品、琥珀酸标准品、乳酸标准品、乙酸标准品 色谱纯,北京索莱宝科技有限公司。
表 1 实验菌株Table 1. Test strains菌株编号 相似菌株 种名 16S相似度(%) NCBI AP7 Ln. mesenteroides subsp. jonggajibkimchii strain 1980 肠膜明串珠菌亚种 100 MT597785.1 LPC-1 Ln. mesenteroides strain 4622 肠膜明串珠菌 100 MT545113.1 JD3-3 Ln. mesenteroides strain ATCC 8293 肠膜明串珠菌 100 ON937320.1 FYF-1 Ln. lactis strain 4574 乳明串珠菌 99.72 MT545082.1 FYF-3 Ln. lactis strain Le2-1 乳明串珠菌 99.65 EU794734.1 STJ-2 Ln. mesenteroides subsp. jonggajibkimchii strain DRC1506 肠膜明串珠菌亚种 99.93 NR_157602.1 G26 Ln. citreum strain 4367 柠檬明串珠菌 100 MT544904.1 L-1 Ln. mesenteroides subsp. dextranicum strain JCM 9700 肠膜明串珠菌亚种 100 NR_113254 Universal 320R高速冷冻离心机 德国Hettich公司;SW-CJ-2FD超净台 苏州安泰空气技术有限公司;HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;YXQ-75SL高压灭菌锅 上海博迅实业有限公司医疗设备厂;S210 pH计 梅特勒托利多科技(中国)有限公司;JA1003电子天平 上海舜宇恒平科学仪器有限公司;WPL-125BE电热恒温培养箱 天津市泰斯特仪器有限公司;JY-SCZ2+垂直电泳系统 北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 高效抑菌活性明串珠菌初筛
利用agar-spot-on law[17]方法筛选有抑菌效果的明串珠球菌。将实验菌株经活化2代,以3%的接种量接入MRS肉汤培养基中,37 ℃静置培养15 h。将培养物振荡混匀,取10 μL滴加在MRS固体培养皿上,置于37 ℃,培养24 h。将含有浓度为108 CFU/mL的指示菌的固体培养基倒在长有乳酸菌单菌落的MRS培养基上,37 ℃培养20 h,观察结果。
1.2.2 明串珠菌发酵上清液的制备
将筛选获得的高抑菌活性菌株活化2代,以3%的接种量加入MRS肉汤培养基中,37 ℃过夜培养后,7000 r/min、4 ℃离心10 min,取无细胞发酵上清液,进行冷冻干燥得到固体粉末,用0.85%的生理盐水溶解固体粉末,配制浓度为0.25 g/mL的AP7发酵上清浓缩液。
1.2.3 酸抑制作用的排除
参考王娜等[18]的方法,将AP7发酵上清浓缩液用盐酸调节pH至5.0,用盐酸、乳酸、乙酸调节MRS肉汤培养基pH至5.0作为对照组。采用牛津杯琼脂扩散法,分别向培养皿底部倾倒15 mL水琼脂,冷却凝固后,放上牛津杯,向培养皿中分别倒入10 mL混有108 CFU/mL指示菌(E. coli ATCC25922、S. aureus ATCC25923、L. sakei和L. plantarum)的固体培养基,冷却凝固后取出牛津杯,向孔内加入150 μL AP7发酵上清浓缩液。于37 ℃培养20 h,测量抑菌圈直径,所有实验均重复3次。
1.2.4 酶敏感性实验
将AP7发酵上清浓缩液分别用NaOH溶液和HCl溶液调节至酶的最佳pH,胃蛋白酶pH2.0,胰蛋白酶、蛋白酶K pH7.4,过氧化氢酶pH7.0,分别添加至AP7发酵上清浓缩液使其工作浓度为1 mg/mL。37 ℃处理2 h,沸水浴5 min终止反应,调节pH至上清浓缩液初始pH3.85,以未处理的发酵上清浓缩液作为对照,按照1.2.3的方法进行测定。
1.2.5 酸稳定性
用NaOH或盐酸溶液将AP7发酵上清浓缩液调节到pH2.0、3.0、5.0、6.0、7.0,对照组为未进行pH调节的原始浓缩液,按照1.2.3的方法进行测定。
1.2.6 热稳定性
取AP7发酵上清浓缩液5 mL,分别于60、80、100 ℃下处理20 min,以未处理的AP7发酵上清浓缩液作为对照,按照1.2.3的方法进行测定。
1.2.7 细菌素的Tricine-SDS-PAGE分子量测定与原位抑菌活性检测
将1.2.2中配制的AP7上清浓缩液通过Tricine-SDS-PAGE电泳测定细菌素分子量。电泳完成将凝胶切成2份,一份用于考马斯亮蓝染色,另外一份参考张晓妍等[16]的方法用于凝胶原位检测,将凝胶置于灭菌后平皿中,加入用灭菌后的超纯水配制的1% Triton-x于摇床摇动20 min,弃去试剂并用无菌水漂洗2次,加入0.1 mol/L pH7.2的磷酸缓冲液再摇动30 min,弃去缓冲液,加入20 mL含108 CFU/mL指示菌(E. coli ATCC25922)的LB培养基,待凝固后,37 ℃过夜培养,观察抑菌条带。
1.2.8 菌株AP7全基因组测序及细菌素基因簇挖掘
采用PacBio Illumina HiSeq测序平台对菌株AP7进行全基因组测序,使用Hifiasm软件进行组装,通过Circlator v1.5.5软件进行环化和调整起始位点,采用Pilon v1.22软件利用二代数据进一步进行纠错,得到准确度高的基因组。所得全基因组序列对比GO(Gene Ontology)、KEGG(Kyoto Encyclopedia of Genes and Genomes)、NR(Non-Redundant Protein Database)等数据库进行功能注释。使用在线软件BAGEL4(http://bagel4.molgenrug.nl/index.php)对AP7全基因组中潜在的编码细菌素的基因簇进行挖掘。
1.2.9 细菌素结构预测
利用ExPASy(http://web.expasy.org/protparam/)对细菌素的理化性质进行分析; 用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)对跨膜结构域进行预测;用SOPMA(http://npsapbil.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_gor4.html)对二级结构进行分析;用在线软件SWISS-MODEL(http://swissmodel.expasy.org/)分析三级结构。
1.3 数据处理
实验数据采用SPSS Statistics 26软件进行统计分析,以平均值±标准差表示。
2. 结果与分析
2.1 高效抑菌活性乳酸菌筛选
如表2所示,8株明串珠菌对不同的指示菌抑制效果不同,其中AP7、LPC-1对E. coli ATCC25922、S. aureus ATCC25923、L. sakei和L. plantarum均有抑制效果。8株菌对E. coli ATCC25922均有显著抑制效果,AP7效果最好。对S. aureus ATCC25923,AP7、LPC-1和JD3-3效果较好,其次是FYF-3和STJ-2,G26、FYF-1及L-1无抑菌效果。对导致泡菜后熟L. sakei和L. plantarum[12],AP7、LPC-1均有较好的抑菌效果。AP7所产抑菌物质具有较为宽广的抑菌谱,对食源性致病菌和导致泡菜后熟菌均存在明显的抑制作用,进一步分析AP7的主要抑菌物质。
表 2 8株明串珠菌的抑菌能力Table 2. Antimicrobial effects of 8 Leuconostoc strains2.2 肠膜明串珠菌抑菌谱分析
2.2.1 酸作用的排除
由表3可知,当pH为5.0时,发酵上清浓缩液对4种指示菌均有明显的抑菌效果,但用乳酸、乙酸、盐酸分别调节MRS肉汤pH为5.0时,对4种指示菌均无抑菌效果,这说明上清浓缩液里对4种指示菌的抑菌作用不是酸作用的结果,而是其他物质。
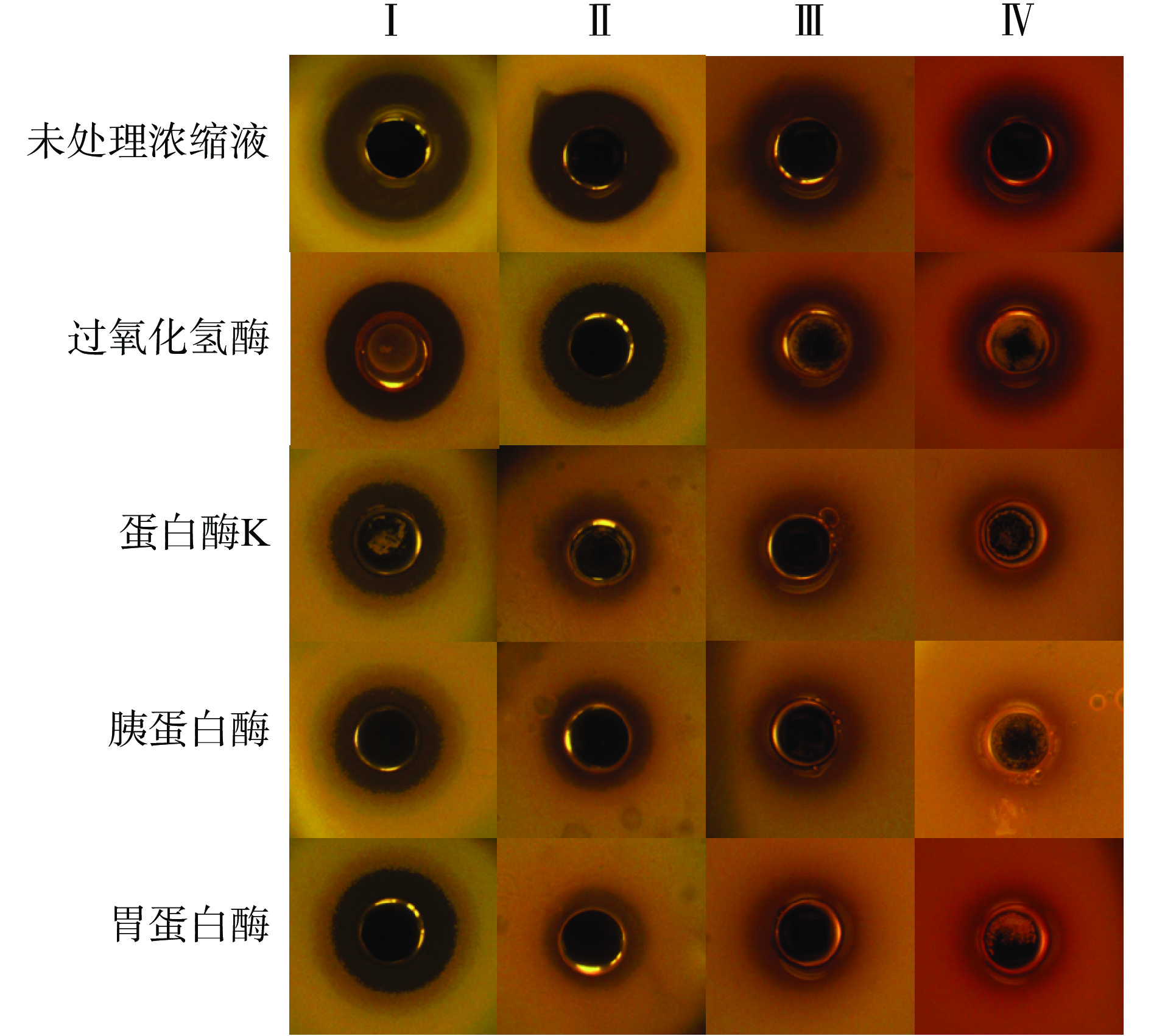
2.2.2 酶敏感性
表4、图1显示,AP7发酵上清浓缩液加入过氧化氢酶处理后,AP7对E. coli ATCC25922、S. aureus ATCC25923、L. sakei和L. plantarum的抑菌圈直径略有下降,但变化不显著(P>0.05),说明AP7发酵上清液浓缩液中的过氧化氢不是主要的抑菌物质,还有其他物质对指示菌起到抑制作用。用蛋白酶K、胰蛋白酶和胃蛋白酶处理AP7的上清浓缩液后,观察到菌株上清液对E. coli ATCC25922、S. aureus ATCC25923、L. sakei和L. plantarum产生的抗菌活性极显著或显著降低(P<0.01或P<0.05),表明AP7产生的细菌素对蛋白酶敏感,由此推测AP7上清浓缩液中包含蛋白质或者肽类物质。
表 4 不同酶处理对发酵上清浓缩液的抑菌活性影响Table 4. Effects of different enzyme treatment on the antibacterial activity of culture supernatant concentrate酶处理 抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 未处理浓缩液 22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 过氧化氢酶 21.66±0.61 20.87±0.76 16.93±0.48 17.02±0.16 蛋白酶K 17.73±0.73** 16.69±0.33** 14.03±0.54** 14.92±0.65** 胰蛋白酶 17.29±0.74** 16.78±0.44** 15.22±0.31** 14.20±0.05** 胃蛋白酶 20.73±0.51* 15.63±0.89** 15.37±0.66** 15.10±0.55** 注:同列“*”表示相对于未处理浓缩液,抑菌圈有显著性差异(P<0.05),“**”表示差异极显著(P<0.01);表5~表6同。 2.2.3 酸稳定性
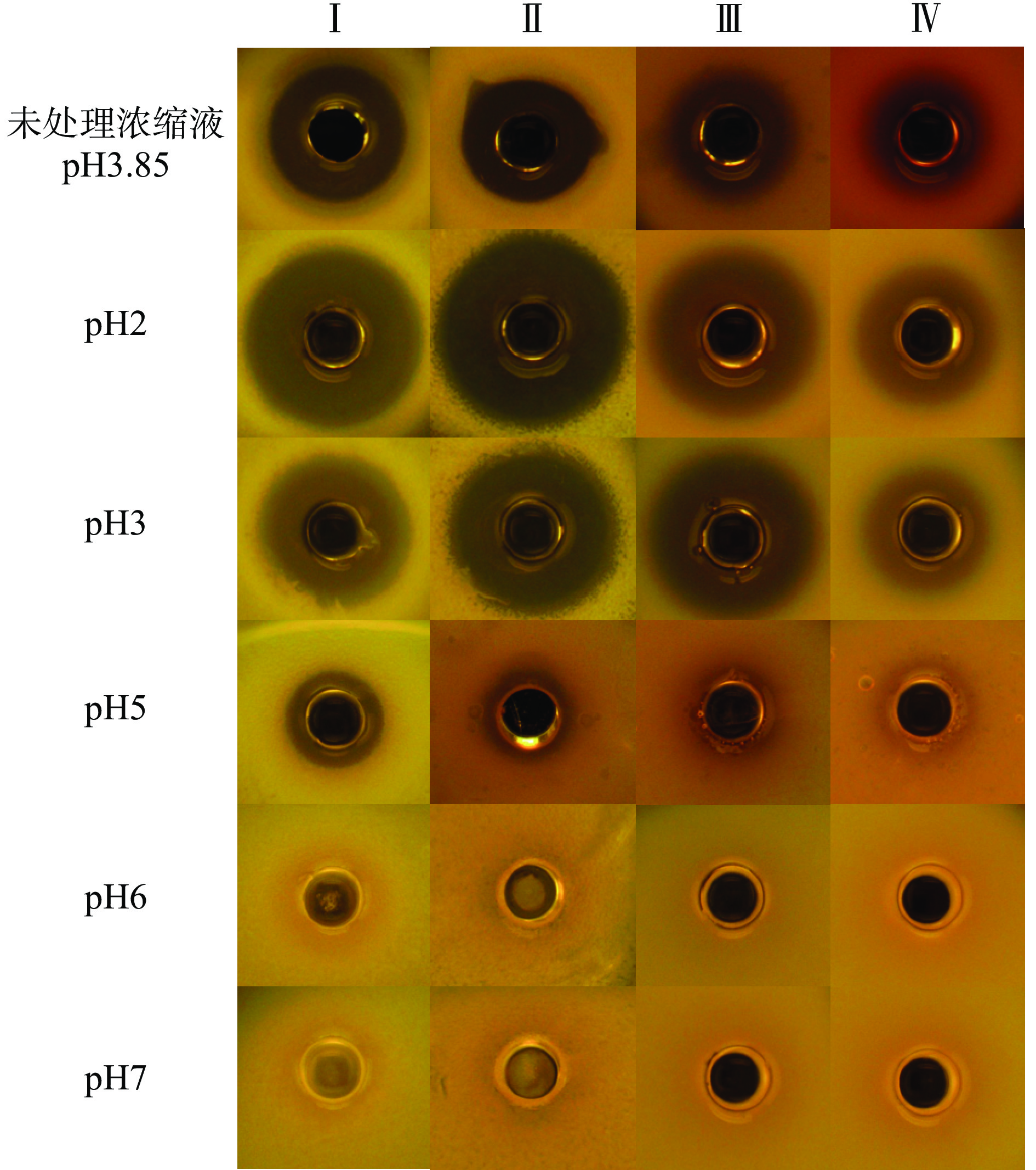
由表5、图2可知,对照组为AP7的原始未处理发酵浓缩液,pH为3.85。pH为2.0和3.0时,AP7对4种指示菌的抑菌活性都显著或极显著提高(P<0.05或P<0.01),这可能是细菌素与酸协同作用的结果[19]。pH5.0与原始发酵浓缩液(pH3.85)相比,抑菌活性显著或极显著降低(P<0.05或P<0.01),pH大于6.0以后抑菌活性消失,说明该菌株所产的细菌素在酸性条件下活性较强。
表 5 不同pH对发酵上清浓缩液的抑菌活性影响Table 5. Effects of different pH conditions on the antibacterial activity of culture supernatant concentratepH 抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 3.85(未处理
浓缩液)22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 2.0 25.02±0.41* 27.19±0.81** 22.06±0.10** 20.02±0.53** 3.0 23.96±0.73* 24.25±0.33* 21.38±0.54** 18.22±0.18** 5.0 14.16±0.41** 13.07±0.91* 11.67±0.44** 11.18±1.26** 6.0 − − − − 7.0 − − − − 2.2.4 热稳定性
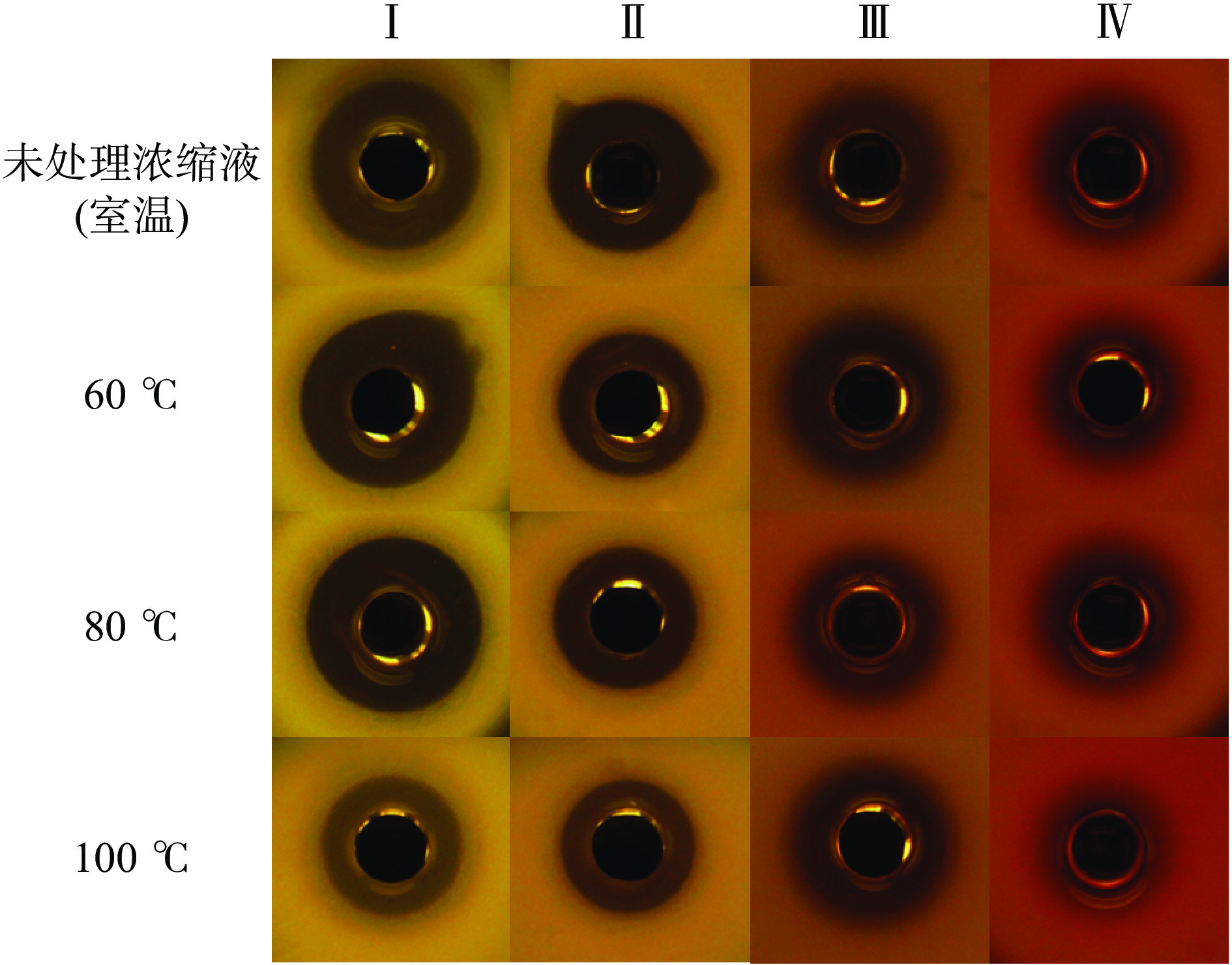
经不同温度处理后,发酵上清浓缩液抑菌效果如表6、图3所示。AP7发酵上清浓缩液经60和80 ℃高温处理20 min后,对4种指示菌的抑菌活性无明显影响,抑菌圈直径与未处理浓缩液相比无显著差异(P>0.05);100 ℃高温处理20 min,对E. coli ATCC25922的抑菌能力显著下降(P<0.05),但对S. aureus ATCC25923、L. sakei和L. plantarum抑制活性几乎无影响,菌株AP7所产抗菌活性物质能在较宽的温度范围保持较强的抗菌活性,说明AP7所产生的细菌素具有良好的热稳定性。
表 6 高温处理对发酵上清浓缩液抑菌活性的影响Table 6. Effects of high temperature treatment on the antibacterial activity of culture supernatant concentrate温度
(℃)抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 室温(未处理
浓缩液)22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 60 22.75±0.25 21.83±0.74 17.84±0.14 17.22±0.59 80 22.35±0.84 21.83±0.47 16.77±0.56 17.10±0.47 100 20.33±0.26* 21.13±0.76 17.32±0.36 16.58±0.87 2.3 细菌素的分子量与原位抑菌活性
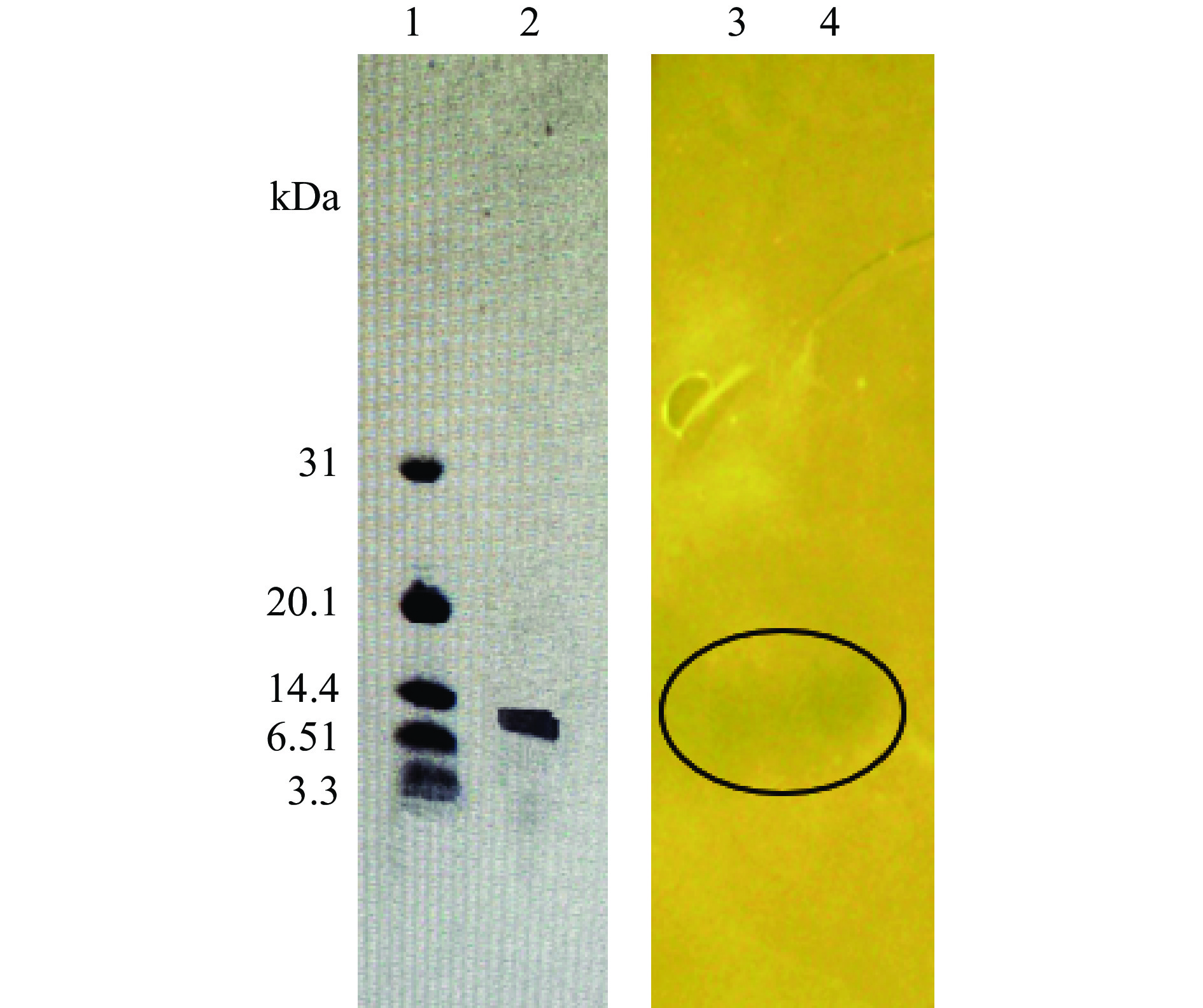
如图4所示,通过Tricine-SDS-PAGE 电泳显示清晰良好的条带,分子质量范围在6.51~14.4 kDa内,凝胶原位活性检测和电泳条带相对应位置处出现明显的指示菌抑菌带,表明得到的条带为小分子肽类细菌素,可初步确定AP7产生的抑菌物质为细菌素。
2.4 肠膜明串珠菌AP7全基因组分析
分析Ln. mesenteroides AP7全基因组测序(NCBI登录号:JAVJJA000000000)结果发现,菌株AP7全基因组(0 gaps)由1个染色体(1948310 bp)和2条质粒(37366和20698 bp)组成,GC含量37.7%;预测得到1979个编码基因,总长度达1778910 bp,平均长度898 bp;非编码区rRNA和tRNA的数量分别为12和71。
使用GO、KEGG、NR 等数据库对菌株AP7基因组进行注释(图5)。其中,GO数据库注释的基因有1655个,占总注释基因的83.6%,主要分为细胞组成、分子功能和生物过程3大类,和转运相关的基因有166个;KEGG数据库注释的基因有1129个,占总注释基因的57.0%,分为3大部分,新陈代谢(Metabolism,757个基因)、遗传信息处理(Genetic information processing,151个基因)、环境信息处理(Environmental information processing,118个基因),与ABC转运蛋白相关的基因66个。NR数据库注释的基因有1965个,占总注释基因的99.3%,含有9个与细菌素相关编码基因,大部分与Ⅱ类细菌素相关(见表7),AP7中存在已经报道的有关细菌素的生物合成基因,且一致性比对结果中,除与肠球菌素A的部分合成基因entA的一致性为98.44%外,其余均为100%,一致性很高。上述结果表明,AP7存在细菌素生物合成基因,其代谢产物中很有可能存在对应的抗菌物质。
表 7 肠膜明串珠菌AP7潜在的细菌素相关基因Table 7. Potential bacteriocin related genes of Ln. mesenteroides AP7基因编号 基因功能描述 基因位置 GE000050 细菌素 57750~57920 GE000064 细菌素分泌辅助蛋白 70094~71443 GE000066 Ⅱb类细菌素两肽之一Lactobin A 73839~74015 GE000067 Ⅱb类细菌素两肽之一Lactobin A 74046~74207 GE000069 Ⅱb类细菌素两肽之一Lactobin A 74666~74803 GE000070 Ⅱb类细菌素两肽之一Lactobin A 74818~74997 GE000071 Ⅱb类细菌素两肽之一Lactobin A 75159~75335 GE001723 肠球菌素A免疫蛋白 1765524~1765910 GE001819 细菌素免疫蛋白 1862806~1863093 2.5 肠膜明串珠菌AP7的潜在细菌素基因簇
通过BAGEL4数据库挖掘菌株合成细菌素的种类及相关基因的位置。结果显示Ln. mesenteroides AP7染色体有1个热点区域(表8),以Enterocin_X_chain_beta细菌素为核心的基因簇(图6)。Enterocin_X_chain_beta基因簇共有19个ORF(Open reading frame),核心肽为Enterocin_X_chain_beta,氨基酸序列为MEKLSEQELAKVSGGFPLLPIVGPIIAGGATYVAKDAWNHLDQIRSGWRKAGNSKW,序列与来源于Ln. mesenteroides str. KFRI-Mg的bacteriocin序列(AHF 18265.1)有100%匹配度。在编码细菌素基因的下游,存在2种编码ABC转运蛋白的基因,ABC转运蛋白是细菌素合成的核心蛋白[20]。
表 8 Ln. mesenteroides AP7细菌素合成基因分析Table 8. Bacteriocin synthesis gene analysis of Ln. mesenteroides AP7AOI Start End Class Conting00001.0.AOI 01 47756 67906 97.2;Enterocin_X_chain_beta 2.6 Enterocin_X_chain_beta的结构预测
通过Expasy分析AP7所产Enterocin_X_chain_beta的一级结构,此抗菌肽有56个氨基酸组成,分子式为C277H434N76O77S1,分子质量为6093.02 Da,理论等电点(PI)为9.30,带负电残基数(Asp+Glu)为5,带正电荷残基数(Arg+Lys)为7,脂肪系数88.93,亲水系数−0.243,不稳定系数为34.58,小于40,归为稳定蛋白,良好的稳定性有助于抗菌肽的加工和保存[21]。由图7可知,Enterocin_X_chain_beta跨膜螺旋中氨基酸残基数为21.94209,存在1个预测跨膜区,肽链一端在膜内,一端在膜外,N端在细胞膜内的可能性为0.89344。
如图8所示,Enterocin_X_chain_beta二级结构以α-螺旋为主,α-螺旋、延伸链、β-转角、无规则卷曲分别由29个、7个、6个、14个氨基酸参与形成。α-螺旋和β-转角比例之和为62.5%。二级结构中α-螺旋和β-转角比例越高蛋白质稳定性越好,说明Enterocin_X_chain_beta具有较好的稳定性。通过SWISS-MODEL预测Enterocin_X_chain_beta三级结构,以A0A5M8XC73.1.A为模板建模,两者序列相似度达100%,主要由两端松散肽链和中间α-螺旋构成。
3. 讨论
发酵蔬菜具有较长的保存期,乳酸菌菌种对蔬菜发酵过程和产品保藏性具有重要影响,但发酵蔬菜来源的肠膜明串珠产细菌素的报道不多。本研究从云南传统发酵蔬菜中筛选出一株具有高抑菌活性的肠膜明串珠菌AP7,对食源性病原菌(E. coli ATCC25922和S. aureus ATCC25923)和引起泡菜过酸菌(L. sakei和L. plantarum)都具有较好的抑菌效果,具有广谱抑菌特性。在排除有机酸、H2O2的干扰和经蛋白酶处理后,初步确定AP7发酵上清液中的抑菌物质为蛋白质或者肽类物质。TODOROV等[22]筛选得到一株Ln. mesenteroides,对枯草芽孢杆菌(Bacillus subtilis)、粪肠球菌(Enterococcus faecalis)、几种乳酸杆菌、乳酸乳球菌乳脂亚种(Lalactis subsp. cremoris)、李斯特菌(Listeria innocua)、单核增生李斯特菌(Listeria monocytogenes)、戊糖片球菌(Pediococcus pentosaceus)、S. saureus和嗜热链球菌(Streptococcus thermophilus)的生长均有抑制作用,证实其抑制作用是由细菌素引起的,用硫酸铵沉淀法回收到一种单肽细菌素mesentericin ST99。ERKAYA等[23]从香肠中筛选出Ln. mesenteroides对肠球菌(Enterococcus faecalis)、痢疾杆菌(Shigella dysenteriae)和E. coli O157:H7有明显的抑制作用,利用特异性PCR检测到菌株携带产细菌素mecentericin的基因。
AP7所产生的细菌素在酸性条件下能保持较好的抗菌能力,随pH的升高,抑菌能力减弱至消失,AP7更适合在酸或弱酸条件下使用,与LÜ等[24]报道的细菌素在pH2.5~5.5间较稳定结果一致;高兆建等[25]研究发酵乳杆菌所产的细菌素BLF52在pH7.0以下的酸性范围抑菌效果更好,可能是因为弱酸体系有助于蛋白吸附在靶细胞上,高pH会改变乳酸菌素的蛋白结构[18]。AP7菌株产生的细菌素在60、80和100 ℃条件下处理20 min,显示出良好的热稳定性,明串珠菌株产生抗李斯特菌/乳酸菌的II类细菌素[26],II类细菌素分子量小于10 kDa,热稳定好[27]。王冬梅等[28]从和田地区酸奶中筛选出了Ln. mesenteroides A3,产生的细菌素具有广谱抑菌活性,对热稳定,在酸性条件下表现出很好的抑菌活性;LEE等[11]从泡菜中分离到对L. sakei有抑制作用的明串珠菌,进一步研究发现,抗菌活性物质对蛋白酶敏感,证实为细菌素,该细菌素121 ℃处理15 min后抑菌效果极稳定,在pH4~7范围内具有活性。Tricine-SDS-PAGE电泳条带相应位置出现指示菌抑菌圈,初步确定AP7产生的抑菌物质为细菌素(蛋白类物质)。
QI等[29]对副干酪乳杆菌(Lactobacillus paracasei)WX322进行了全基因组测序,得到1条染色体和8个质粒,通过BAGEL4挖掘编码细菌素的基因序列,鉴定出3个细菌素簇和7种细菌素。郭行[30]将鼠李糖乳杆菌(Lactobacillus Rhamnosus)全基因组的2835个蛋白编码基因应用到BAGEL4和antiSMASH数据库中进行相似性鉴定,发现了5个细菌素生物合成基因簇,虽无前导肽,但具有转运蛋白和免疫蛋白。本研究对Ln. mesenteroides AP7进行了全基因组测序,由1条染色体和2个质粒构成,基因组全长1948310 bp,GC含量37.7%,基因组序列完整性高,将基因组数据与GO、KEGG和NR等数据库进行功能注释,从分子生物学的角度探究了该菌株的生物学特性及基因组功能特性,重点研究了编码细菌素的基因。通过GO和KEGG注释分析,分别发现166个、66个ABC转运蛋白基因,ABC转运蛋白可将细菌素释放到细胞外[31]。在NR数据库中注释到9个与细菌素合成相关的基因,其中5个基因编码Ⅱb类细菌素Lactobin A,与温度稳定性实验结果一致。通过BAGEL4挖掘编码细菌素的基因序列,鉴定出1个细菌素生物合成基因簇,为Enterocin_X_chain_beta基因簇,核心肽段为Enterocin_X_chain_beta,在线分析Enterocin_X_chain_beta的理化性质,该肽分子质量为6093.02 Da,带正电荷,呈亲水性,结构稳定的蛋白,亲水性与二级结构中存在大量的α-螺旋有关[31];存在1个跨膜螺旋结构,符合细菌素跨过细胞膜分泌蛋白的特点;二级结构由α-螺旋、延伸链、β-转角和无规则卷曲构成,具备抗菌肽二级结构特点[32];三级结构预测显示主要由两端松散肽链和中间α-螺旋构成,α-螺旋可能是膜渗透和抗菌活性必需的,并且只有当α-螺旋抗菌肽序列超过一定长度,才足以跨越整个细胞膜,形成通道杀死细菌[21]。
4. 结论
本研究考察了蔬菜来源明串珠菌的抑菌性能,以期得到能提高发酵蔬菜品质的菌种。对筛选出肠膜AP7的抑菌机制进行初步研究,证实其产II类细菌素。AP7全基因组中具有多个参与细菌素合成和分泌的关键基因,从基因角度证实了AP7具备合成分泌细菌素的能力。基因组分析结合表型实验研究,Ln. mesenteroides AP7存在多种细菌素,抑菌能力强。本研究为了解发酵蔬菜中Ln. mesenteroides抑菌特性提供了新的视角,接下来的研究中,将克隆表达与细菌素合成分泌相关的基因,分离纯化细菌素,进一步研究AP7产生的细菌素的抑菌机制;此外,接种该菌对发酵蔬菜菌群演替和产品品质、安全性保藏性影响有待研究。
-
表 1 实验菌株
Table 1 Test strains
菌株编号 相似菌株 种名 16S相似度(%) NCBI AP7 Ln. mesenteroides subsp. jonggajibkimchii strain 1980 肠膜明串珠菌亚种 100 MT597785.1 LPC-1 Ln. mesenteroides strain 4622 肠膜明串珠菌 100 MT545113.1 JD3-3 Ln. mesenteroides strain ATCC 8293 肠膜明串珠菌 100 ON937320.1 FYF-1 Ln. lactis strain 4574 乳明串珠菌 99.72 MT545082.1 FYF-3 Ln. lactis strain Le2-1 乳明串珠菌 99.65 EU794734.1 STJ-2 Ln. mesenteroides subsp. jonggajibkimchii strain DRC1506 肠膜明串珠菌亚种 99.93 NR_157602.1 G26 Ln. citreum strain 4367 柠檬明串珠菌 100 MT544904.1 L-1 Ln. mesenteroides subsp. dextranicum strain JCM 9700 肠膜明串珠菌亚种 100 NR_113254 表 2 8株明串珠菌的抑菌能力
Table 2 Antimicrobial effects of 8 Leuconostoc strains
表 3 发酵上清浓缩液排酸实验
Table 3 Acid eliminnation test of culture supernatant concentrate
表 4 不同酶处理对发酵上清浓缩液的抑菌活性影响
Table 4 Effects of different enzyme treatment on the antibacterial activity of culture supernatant concentrate
酶处理 抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 未处理浓缩液 22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 过氧化氢酶 21.66±0.61 20.87±0.76 16.93±0.48 17.02±0.16 蛋白酶K 17.73±0.73** 16.69±0.33** 14.03±0.54** 14.92±0.65** 胰蛋白酶 17.29±0.74** 16.78±0.44** 15.22±0.31** 14.20±0.05** 胃蛋白酶 20.73±0.51* 15.63±0.89** 15.37±0.66** 15.10±0.55** 注:同列“*”表示相对于未处理浓缩液,抑菌圈有显著性差异(P<0.05),“**”表示差异极显著(P<0.01);表5~表6同。 表 5 不同pH对发酵上清浓缩液的抑菌活性影响
Table 5 Effects of different pH conditions on the antibacterial activity of culture supernatant concentrate
pH 抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 3.85(未处理
浓缩液)22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 2.0 25.02±0.41* 27.19±0.81** 22.06±0.10** 20.02±0.53** 3.0 23.96±0.73* 24.25±0.33* 21.38±0.54** 18.22±0.18** 5.0 14.16±0.41** 13.07±0.91* 11.67±0.44** 11.18±1.26** 6.0 − − − − 7.0 − − − − 表 6 高温处理对发酵上清浓缩液抑菌活性的影响
Table 6 Effects of high temperature treatment on the antibacterial activity of culture supernatant concentrate
温度
(℃)抑菌圈直径(mm) E. coli ATCC25922 S. aureus ATCC25923 L. sakei L. plantarum 室温(未处理
浓缩液)22.93±0.83 22.04±0.61 17.37±0.27 17.30±0.35 60 22.75±0.25 21.83±0.74 17.84±0.14 17.22±0.59 80 22.35±0.84 21.83±0.47 16.77±0.56 17.10±0.47 100 20.33±0.26* 21.13±0.76 17.32±0.36 16.58±0.87 表 7 肠膜明串珠菌AP7潜在的细菌素相关基因
Table 7 Potential bacteriocin related genes of Ln. mesenteroides AP7
基因编号 基因功能描述 基因位置 GE000050 细菌素 57750~57920 GE000064 细菌素分泌辅助蛋白 70094~71443 GE000066 Ⅱb类细菌素两肽之一Lactobin A 73839~74015 GE000067 Ⅱb类细菌素两肽之一Lactobin A 74046~74207 GE000069 Ⅱb类细菌素两肽之一Lactobin A 74666~74803 GE000070 Ⅱb类细菌素两肽之一Lactobin A 74818~74997 GE000071 Ⅱb类细菌素两肽之一Lactobin A 75159~75335 GE001723 肠球菌素A免疫蛋白 1765524~1765910 GE001819 细菌素免疫蛋白 1862806~1863093 表 8 Ln. mesenteroides AP7细菌素合成基因分析
Table 8 Bacteriocin synthesis gene analysis of Ln. mesenteroides AP7
AOI Start End Class Conting00001.0.AOI 01 47756 67906 97.2;Enterocin_X_chain_beta -
[1] 史巧, 刘毕琴, 汤回花, 等. 发酵蔬菜菌种应用及菌群调控研究进展[J]. 食品与发酵工业,2021,47(5):273−281. [SHI Q, LIU B Q, TANG H H, et al. Research progress on the application of starter strains and the regulation of microflora in vegetable fermentation[J]. Food and Fermentation Industries,2021,47(5):273−281.] SHI Q, LIU B Q, TANG H H, et al. Research progress on the application of starter strains and the regulation of microflora in vegetable fermentation[J]. Food and Fermentation Industries, 2021, 47(5): 273−281.
[2] 陈功, 张其圣, 李恒, 等. 中国泡菜发酵态相对稳定性的研究及应用[J]. 食品与发酵科技,2020,56(1):54−63,72. [CHEN G, ZHANG Q S, LI H, et al. Research and application of the stable fermentation stage of Chinese Paocai[J]. Food and Fermentation Science & Technology,2020,56(1):54−63,72.] CHEN G, ZHANG Q S, LI H, et al. Research and application of the stable fermentation stage of Chinese Paocai[J]. Food and Fermentation Science & Technology, 2020, 56(1): 54−63,72.
[3] KIM D W, KIM B M, LEE H J, et al. Effects of different salt treatments on the fermentation metabolites and bacterial profiles of kimchi[J]. Journal of Food Science,2017,82(5):1124−1131. doi: 10.1111/1750-3841.13713
[4] 陈功, 唐垚, 张其圣, 等. 泡菜浅发酵与冷加工的研究及应用[J]. 食品与发酵科技,2022,58(2):1−8. [CHEN G, TANG Y, ZHANG Q S, et al. Research and application of shallow fermentation and cold processing of Paocai[J]. Food and Fermentation Science & Technology,2022,58(2):1−8.] CHEN G, TANG Y, ZHANG Q S, et al. Research and application of shallow fermentation and cold processing of Paocai[J]. Food and Fermentation Science & Technology, 2022, 58(2): 1−8.
[5] 李院, 魏新元, 王静, 等. 抑制青霉菌乳酸菌的分离、鉴定及抑菌物质分析[J]. 食品科学,2015,36(21):150−155. [LI Y, WEI X Y, WANG J, et al. Isolation and identification of lactic acid bacteria inhibiting Penicillium and analysis of their antimicrobial components[J]. Food Science,2015,36(21):150−155.] LI Y, WEI X Y, WANG J, et al. Isolation and identification of lactic acid bacteria inhibiting Penicillium and analysis of their antimicrobial components[J]. Food Science, 2015, 36(21): 150−155.
[6] CHANG J Y, CHANG H C. Improvements in the quality and shelf life of kimchi by fermentation with the induced bacteriocin-producing strain, Leuconostoc citreum GJ7 as a starter[J]. Journal of Food Science,2010,75(2):M103−M110.
[7] CHANG J Y, CHANG H C. Growth inhibition of foodborne pathogens by kimchi prepared with bacteriocin-producing starter culture[J]. Journal of Food Science,2011,76(1):M72−M78.
[8] BAJPAI V K, RATHER I A, MAJUMDER R, et al. Characterization and antibacterial mode of action of lactic acid bacterium Leuconostoc mesenteroides HJ69 from kimchi[J]. Journal of Food Biochemistry,2017,41(1):e12290. doi: 10.1111/jfbc.12290
[9] MOON S H, KIM C R, CHANG H C. Heterofermentative lactic acid bacteria as a starter culture to control kimchi fermentation[J]. LWT-Food Science and Technology,2018,88:181−188. doi: 10.1016/j.lwt.2017.10.009
[10] CHOI H J, KIM Y J, LEE N R, et al. Selection of lactic acid bacteria with antibacterial activity for extension of kimchi shelf-life[J]. Journal of the Korean Society of Food Science Nutrition,2014,43(2):328−332. doi: 10.3746/jkfn.2014.43.2.328
[11] LEE K H , LEE J H. Characterization of the bacteriocin produced by a Leuconostoc mesenteroides strain inhibiting the growth of Lactobacillus sakei[J]. Microbiology Biotechnology Letters,2011,39(4):390−396.
[12] JANG J Y, LEE M E, LEE H W, et al. Extending the shelf life of kimchi with Lactococcus lactis strain as a starter culture[J]. Food Science Biotechnology Bioengineering,2015,24(3):1049−1053. doi: 10.1007/s10068-015-0134-8
[13] KIM M J, LEE H W, LEE M E, et al. Mixed starter of Lactococcus lactis and Leuconostoc citreum for extending kimchi shelf-life[J]. Journal of Microbiology,2019,57(6):479−484. doi: 10.1007/s12275-019-9048-0
[14] ES-SBATA I, ELOIRDI S, LAKHLIFI T, et al. Biopreservation of yogurt against fungal spoilage using cell-free supernatant of Lactiplantibacillus pentosus 22B and characterization of its antifungal compounds[J]. Food Biotechnology,2021,35(4):327−348. doi: 10.1080/08905436.2021.1980004
[15] 吕懿超, 李香澳, 王凯博, 等. 乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J]. 食品科学,2021(19):281−290. [LÜ Y C, LI X A, WANG K B, et al. Antimicrobial mechanism of lactic acid bacteria as biopreservative organisms and their application in food industry:A review[J]. Food Science,2021(19):281−290.] LÜ Y C, LI X A, WANG K B, et al. Antimicrobial mechanism of lactic acid bacteria as biopreservative organisms and their application in food industry: A review[J]. Food Science, 2021(19): 281−290.
[16] 张晓妍, 沙沈菲, 郭丽丹, 等. 一株后生元菌株的抑菌特性研究及其细菌素基因簇的挖掘[J]. 食品工业科技,2022,43(17):1−10. [ZHANG X Y, SHA S F, GUO L D, et al. Antimicrobial properties of a postbiotic strain and gene cluster mining of its bacteriocin[J]. Science and Technology of Food Industry,2022,43(17):1−10.] ZHANG X Y, SHA S F, GUO L D, et al. Antimicrobial properties of a postbiotic strain and gene cluster mining of its bacteriocin[J]. Science and Technology of Food Industry, 2022, 43(17): 1−10.
[17] OMAR N B, ABRIOUEL H, LUCAS R, et al. Isolation of bacteriocinogenic Lactobacillus plantarum strains from ben saalga, a traditional fermented gruel from Burkina Faso[J]. International Journal of Food Microbiology,2006,112(1):44−50. doi: 10.1016/j.ijfoodmicro.2006.06.014
[18] 王娜, 李慧, 戴伶俐, 等. 产细菌素乳酸菌的筛选与鉴定[J]. 中国食品学报,2020,20(12):248−255. [WANG N, LI H, DAI L L, et al. Screening and identification of bacteriocin-producing lactic acid bacteria[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(12):248−255.] WANG N, LI H, DAI L L, et al. Screening and identification of bacteriocin-producing lactic acid bacteria[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(12): 248−255.
[19] PASTERIS S E, VERA PINGITORE E, ALE C E, et al. Characterization of a bacteriocin produced by Lactococcus lactis subsp. lactis CRL 1584 isolated from a Lithobates catesbeianus hatchery[J]. World Journal of Microbiology and Biotechnology,2014,30:1053−1062. doi: 10.1007/s11274-013-1524-9
[20] JONATHAN I, TIETZ, CHRISTOPHER J, et al. A new genome-mining tool redefines the lasso peptide biosynthetic landscape[J]. Nature Chemical Biology,2017,13:470−478. doi: 10.1038/nchembio.2319
[21] 张婧, 吴影, 古绍彬, 等. 凝结芽孢杆菌CGMCC 9951新型抗菌肽的挖掘、表达及活性测定[J]. 食品与发酵工业,2022,48(17):71−78. [ZHANG J, WU Y, GU S B, et al. Genome mining, expression and activity determination of a novel antimicrobial peptide from Bacillus coagulans CGMCC 9951[J]. Food and Fermentation Industries,2022,48(17):71−78.] ZHANG J, WU Y, GU S B, et al. Genome mining, expression and activity determination of a novel antimicrobial peptide from Bacillus coagulans CGMCC 9951[J]. Food and Fermentation Industries, 2022, 48(17): 71−78.
[22] TODOROV S D, DICKS L M T. Characterization of mesentericin ST99, a bacteriocin produced by Leuconostoc mesenteroides subsp. dextranicum ST99 isolated from boza[J]. Journal of Industrial Microbiology and Biotechnology,2004,31(7):323−329. doi: 10.1007/s10295-004-0153-6
[23] ERKAYA E, GENC B, AKBULUT S, et al. Bacteriocin producing bacteria isolated from turkish traditional sausage samples[J]. Journal of Pure and Applied Microbiology,2020,14(2):1567−1576. doi: 10.22207/JPAM.14.2.55
[24] LÜ X, MA H, SUN M, et al. A novel bacteriocin DY4-2 produced by Lactobacillus plantarum from cutlassfish and its application as bio-preservative for the control of pseudomonas fluorescens in fresh turbot (Scophthalmus maximus) fillets[J]. Food Control, 2018:22−31.
[25] 高兆建, 张艳秋, 宋玉林, 等. 筛选自泡菜的发酵乳杆菌细菌素纯化及抑菌特性分析[J]. 食品工业科技,2021,42(3):201−207. [GAO Z J, ZHANG Y Q, SONG Y L, et al. Purification and antibacterial properties of bacteriocin produced by Lactobacilus fermentum isolated from pickled vegetables[J]. Science and Technology of Food Industry,2021,42(3):201−207.] GAO Z J, ZHANG Y Q, SONG Y L, et al. Purification and antibacterial properties of bacteriocin produced by Lactobacilus fermentum isolated from pickled vegetables[J]. Science and Technology of Food Industry, 2021, 42(3): 201−207.
[26] PAPATHANASOPOULOS M A, KRIER F, REVOL-JUNELLES A M, et al. Multiple bacteriocin production by Leuconostoc mesenteroides TA33a and other Leuconostoc/Weissella strains[J]. Current Microbiology,1997,35(6):331−335. doi: 10.1007/s002849900264
[27] KLAENHAMMER T R. Genetics of bacteriocins produced by lactic acid bacteria[J]. FEMS Microbiology Reviews,1993,12(1−3):39−85. doi: 10.1016/0168-6445(93)90057-G
[28] 王东梅, 刘飞, 马翠云, 等. 和田地区酸奶中产细菌素乳酸菌的筛选及细菌素特性的研究[J]. 食品科技,2012,37(7):26−29. [WANG D M, LIU F, MA C Y, et al. Screening of bacteriocin-producing lactic acid bacteria from Hetian yoghourt and characterization of the bacteriocin[J]. Food Science and Technology,2012,37(7):26−29.] WANG D M, LIU F, MA C Y, et al. Screening of bacteriocin-producing lactic acid bacteria from Hetian yoghourt and characterization of the bacteriocin[J]. Food Science and Technology, 2012, 37(7): 26−29.
[29] QI T, WANG S, DENG L, et al. Controlling pepper soft rot by Lactobacillus paracasei WX322 and identification of multiple bacteriocins by complete genome sequencing[J]. Food Control,2021,121(1):107629.
[30] 郭行. 鼠李糖乳杆菌LS-8中新型细菌素的挖掘及抑菌机制的研究[D]. 杨凌:西北农林科技大学, 2020. [GUO X. Mining novel bacteriocins from Lactobacillus rhamnosus LS-8 and study of their antibacterial mechanism[D]. Yangling:Northwest A&F University, 2020.] GUO X. Mining novel bacteriocins from Lactobacillus rhamnosus LS-8 and study of their antibacterial mechanism[D]. Yangling: Northwest A&F University, 2020.
[31] 汪立平, 贾爽, 张晓妍, 等. 泡菜源植物乳杆菌HY41产细菌素性质及其基因簇挖掘[J]. 东北农业大学学报,2022,53(6):76−87. [WANG L P, JIA S, ZHANG X Y, et al. Characteristics of bacteriocin produced by Lactobacillus plantarum HY41 from pickles and its gene cluster mining[J]. Journal of Northeast Agricultural University,2022,53(6):76−87.] WANG L P, JIA S, ZHANG X Y, et al. Characteristics of bacteriocin produced by Lactobacillus plantarum HY41 from pickles and its gene cluster mining[J]. Journal of Northeast Agricultural University, 2022, 53(6): 76−87.
[32] 马佳歌, 于微, 李佳君, 等. 干酪乳杆菌细菌素的抗菌机制分析[J]. 食品科学,2018,39(10):193−198. [MA J G, YU W, LI J J, et al. Antibacterial mechanism of bacteriocin from Lactobacillus casei[J]. Food Science,2018,39(10):193−198.] MA J G, YU W, LI J J, et al. Antibacterial mechanism of bacteriocin from Lactobacillus casei[J]. Food Science, 2018, 39(10): 193−198.
-
期刊类型引用(4)
1. 孙怀竹,梁金玲,许天阳,于澎. 干燥对不同药用部位中草药化学成分影响的研究进展. 中华中医药学刊. 2025(02): 246-250 .  百度学术
百度学术
2. 王慧,杨馥源,王玉龙,邢普,闫艳,杜晨晖. 基于多指标综合分析酸枣仁最佳采收期的质量标志物研究. 中国野生植物资源. 2024(04): 1-9+21 .  百度学术
百度学术
3. 刘天悦,滕晓祎,田永涛,么亚妹,王琰博,王文蜀. 灯笼果叶片、宿萼和果实化学成分分析及抗氧化活性评价. 食品与发酵工业. 2024(20): 243-251 .  百度学术
百度学术
4. 谢玉蓉,邵大畏,贺建红. 扶正益气方对乳腺癌术后化疗患者不良反应的影响及改善生活质量的状况. 辽宁中医杂志. 2024(11): 138-141 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:




 下载:
下载:



