Research Progress of Cold Plasma-induced Inactivation of Bacterial Spores
-
摘要: 芽孢是某些细菌营养体在环境胁迫条件下形成的休眠体,广泛存在于自然界中。芽孢结构致密,对热、紫外线辐射等环境胁迫具有较强的抗性,很难被食品工业中常规的杀菌方法所杀灭,是影响食品安全的重要因素。近年来,非热加工技术在杀灭芽孢中的应用受到广泛关注。冷等离子体是一种新型非热杀菌技术,具有杀菌效率高、能耗低、无二次污染等优点,在食品工业中有广阔的应用前景。本文综述了冷等离子体杀灭食品中细菌芽孢的研究进展,总结了冷等离子体杀灭芽孢的作用机制,分析了影响冷等离子体作用效果的因素,并展望了今后的研究方向,以期为冷等离子体在食品安全控制领域的实际应用提供理论基础。Abstract: Spores are the main dormant forms of some bacteria under harsh environment conditions, which are widely distributed in nature. Bacterial spores have a rigid structure, which helps resist to environmental stresses such as heat and ultraviolet radiation. At present, it is difficult to inactivate bacterial spores by the conventional sterilization methods used in the food industry. Therefore, bacterial spores are one of the most important factors influencing the food safety. In recent years, the application of non-thermal processing technologies in killing spores has received great deal of attention. Cold plasma is a novel non-thermal physical sterilization technology, which has a broad application prospect in the food industry due to its various advantages such as high bactericidal efficiency, low energy consumption, and secondary pollution-free. In this paper, the application of cold plasma in the inactivation of bacterial spores in foods is reviewed, and the underlying mechanisms are also summarized in detail. Moreover, the effects of diverse factors on cold plasma-induced spores inactivation are analyzed, and the future research direction is also prospected. This article provides important theoretical basis for the practical application of cold plasma in food safety and quality control.
-
Keywords:
- cold plasma /
- bacterial spores /
- inactivation /
- mechanism /
- influencing factors
-
芽孢(spore)又称为内生孢子(endospore),是芽孢杆菌属(Bacillus spp.)、梭状芽孢杆菌属(Clostridium spp.)[1]、芽孢乳酸菌属(Sporolaetobacilbs spp.)[2]和少数球菌[3]等在环境胁迫条件下所形成的内生休眠体。芽孢结构极为复杂,其对高温、高压、干燥、紫外线辐射和强酸、强碱等极端条件具有很强的抗逆性,很难被常规杀菌技术有效杀灭[4]。此外,芽孢对外界环境极为敏感,能够在适宜的环境条件重新萌发成为具有代谢功能的营养态细胞并大量繁殖,从而引起食品腐败变质或食源性疾病。因此,有效杀灭芽孢是保障食品安全的关键环节[5]。然而,巴氏杀菌[6]、超高温杀菌[7]等传统热杀菌技术虽能够较好地杀灭细菌芽孢,但同时会造成食品中营养物质的损失并对其色泽、风味和质地等造成不良影响。因此,如何在保持食品品质的条件下有效杀灭芽孢是食品工程领域的研究热点[8]。
近年来,冷等离子体作为一种新型的非热物理杀菌技术在食品工业中的应用受到广泛关注。作为一种新型非热加工技术,冷等离子体具有安全、高效、无污染等优点,在食品杀菌保鲜[9]、农药[10]及真菌毒素降解[11]等领域均具有广阔的应用前景。本文综述了冷等离子体杀灭食品中细菌芽孢的研究进展,总结了冷等离子体杀灭细菌芽孢的作用机制及影响冷等离子体作用效果的因素,以期为该技术在食品芽孢污染控制领域的实际应用提供参考。
1. 冷等离子体对芽孢的杀灭作用
1.1 冷等离子体概述
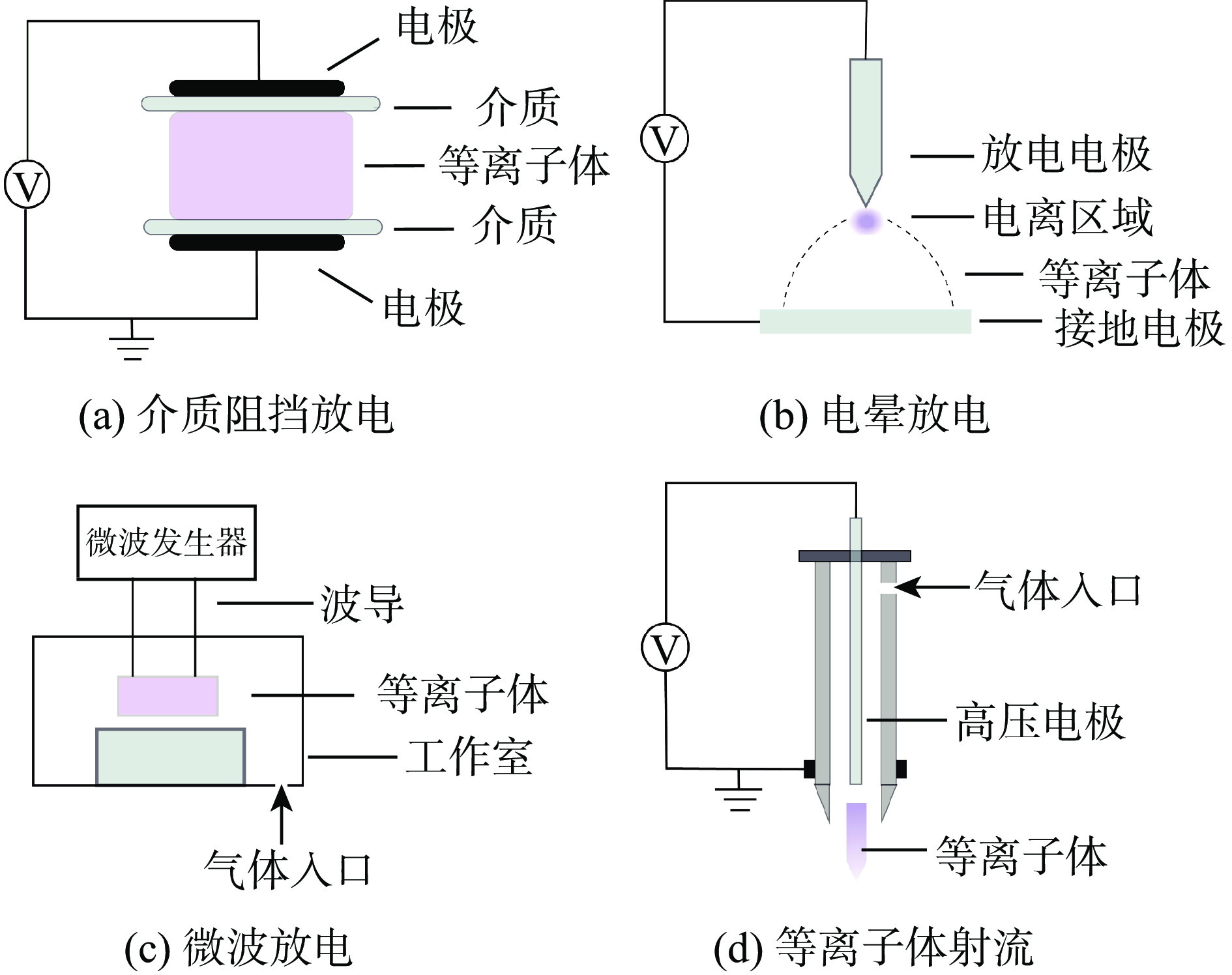
等离子体是不同于固体、液体和气体的物质第四态,由部分或完全离子化,整体呈现电中性的多种活性粒子如原子、电子、正负离子、自由基等组成[12]。可根据温度、放电类型、粒子密度、热力学平衡状态、电离程度等进行分类。在农业和食品领域[13],应用较多的是大气压冷等离子体(atmospheric cold plasma,ACP)[14]。ACP通常是指在大气压下通过各种放电方法产生的气体温度接近室温的冷等离子体[15],其产生方式主要包括介质阻挡放电(dielectric barrier discharge,DBD)、滑动弧放电(gliding discharge,GD)、电晕放电(corona discharge,CD)、微波放电(microwave,MW)、射频放电(radio frequency discharge,RF)和表面微放电(surface-microdischarge,SMD)等[16](图1)。
1.2 冷等离子体对细菌芽孢的杀灭作用
大量研究发现,冷等离子体能够有效杀灭各类细菌芽孢(表1)。例如,Huang等[17]发现,经电压为2.3 kV、频率为29 kHz所产生的DBD等离子体处理6 min后,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)芽孢由初始的8.7 lg CFU/mL降低至检测限以下。Reineke等[18]研究了冷等离子体射流对接种于无菌玻璃培养皿表面的枯草芽孢杆菌(Bacillus subtilis)和萎缩芽孢杆菌(Bacillus atrophaeus)芽孢(初始值为5.0 lg CFU/cm2)的杀灭效果。结果表明,经以氩气为放电气体,频率为27.1 MHz,功率为30 W的冷等离子体处理5 min后,B. subtilis和B. atrophaeus芽孢分别降低了2.4和3.1 lg CFU/cm2。综上所述,冷等离子体对各种细菌芽孢具有较好的杀灭效果,且杀灭效果与芽孢种类、处理条件等有关。
表 1 冷等离子体对细菌芽孢的杀灭作用Table 1. Cold plasma-induced inactivation of bacterial spores细菌芽孢类型 冷等离子体类型 处理条件 杀灭效果 参考文献 枯草芽孢杆菌(B. subtilis)芽孢 RF等离子体 He+O2(0.2%),75 W,13.6 MHz,2 min B. subtilis芽孢由初始的5.0 lg CFU/mL
降低至检测限以下[19] 枯草芽孢杆菌(B. subtilis)芽孢 DBD等离子体 空气,20 kV,60 kHz,25 s B. subtilis芽孢由初始的5.5 lg CFU/mL
降低至0.2 lg CFU/mL[20] 枯草芽孢杆菌(B. subtilis)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. subtilis芽孢由初始的7.2 lg CFU/mL
降低至6.2 lg CFU/mL[21] 凝结芽孢杆菌(B. coagulans)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. coagulans芽孢由初始的6.5 lg CFU/mL降低至3.2 lg CFU/mL [21] 嗜热脂肪芽孢杆菌(B. stearothermophilus)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. stearothermophilus芽孢由初始的
6.2 lg CFU/mL降低至4.3 lg CFU/mL[21] 枯草芽孢杆菌(B. subtilis)芽孢 SMD等离子体 空气,1.1 W,10 kHz,7 min B. subtilis芽孢由初始的4.8 lg CFU/mL
降低至0.8 lg CFU/mL[22] 1.3 冷等离子体对食品中芽孢的杀灭作用
研究发现,冷等离子体对谷物、香辛料、鲜切果蔬等污染的芽孢也具有良好的杀灭效果,并能够较好地维持其色泽、质构等品质指标[23](表2)。例如,Kim等[24]研究了微波放电冷等离子体(放电功率为900 W,频率为2.5 GHz,放电气体为氦气)对接种于红椒片表面蜡样芽孢杆菌(B. cereus)芽孢的杀灭效果。经0.3 W/cm2的微波放电冷等离子体处理20 min后,样品表面B. cereus芽孢降低了1.5 lg CFU/cm2;与未处理组样品相比,冷等离子体处理组样品贮藏期间的抗氧化活性、色泽参数(L*、a*和b*)、辣椒素和二氢辣椒素含量均未发生显著变化。Butscher等[25]发现,经DBD等离子体(电压为8 kV,频率为10 kHz,以氩气为放电气体)处理10 min后,接种于小麦表面的B. amyloliquefaciens芽孢由初始的6.0 lg CFU/cm2降低了5.0 lg CFU/cm2。此外,与未处理组样品相比,DBD等离子体处理组小麦所制备的面团稳定性和膨胀性显著升高,并能较好地保持α-淀粉酶的活性。综上所述,冷等离子体处理能够在有效杀灭食品中污染的细菌芽孢的同时,最大限度地保持食品的营养和感官品质。
表 2 冷等离子体对食品中细菌芽孢的杀灭作用Table 2. Cold plasma-induced inactivation of bacterial spores in foods食品类型 细菌芽孢 冷等离子体类型 处理条件 杀灭效果 参考文献 玉米淀粉 枯草芽孢杆菌(B. subtilis)芽孢 SMD等离子体 空气,10 kHz,1.3 W,5 min 接种于玉米淀粉表面的B. subtilis芽孢由初始的4.8 lg CFU/g降低至2.2 lg CFU/g [22] 年糕 蜡样芽孢杆菌(B. cereus)芽孢 DBD等离子体 空气,30 W,4 min 接种于年糕表面的B. cereus芽孢由初始的
5.3 lg CFU/g降低至3.9 lg CFU/g[26] 黑胡椒 枯草芽孢杆菌(B. subtilis)芽孢 MW等离子体 空气,2.5 GHz,1.2 kV,30 min 接种于黑胡椒表面的B. subtilis芽孢由初始的7.0 lg CFU/g降低至4.6 lg CFU/g [27] 黑胡椒 萎缩芽孢杆菌(B.
atrophaeus)芽孢MW等离子体 空气,2.5 GHz,1.2 kV,30 min 接种于黑胡椒表面的B. atrophaeus芽孢由初始的7.0 lg CFU/g降低至4.2 lg CFU/g [27] 小麦 萎缩芽孢杆菌(B.
atrophaeus)芽孢DBD等离子体 空气,80 kV,50 Hz,20 min 接种于小麦表面的B. cereus芽孢由初始的
6.5 lg CFU/g降低至5.6 lg CFU/g[28] 鲜切苹果 萎缩芽孢杆菌(B. atrophaeus)芽孢 MW等离子体 空气,2.5 GHz,1.1 kW,7 s 接种于鲜切苹果表面的B. atrophaeus芽孢减少了5.5 lg CFU/g [29] 2. 冷等离子体杀灭芽孢的作用机制
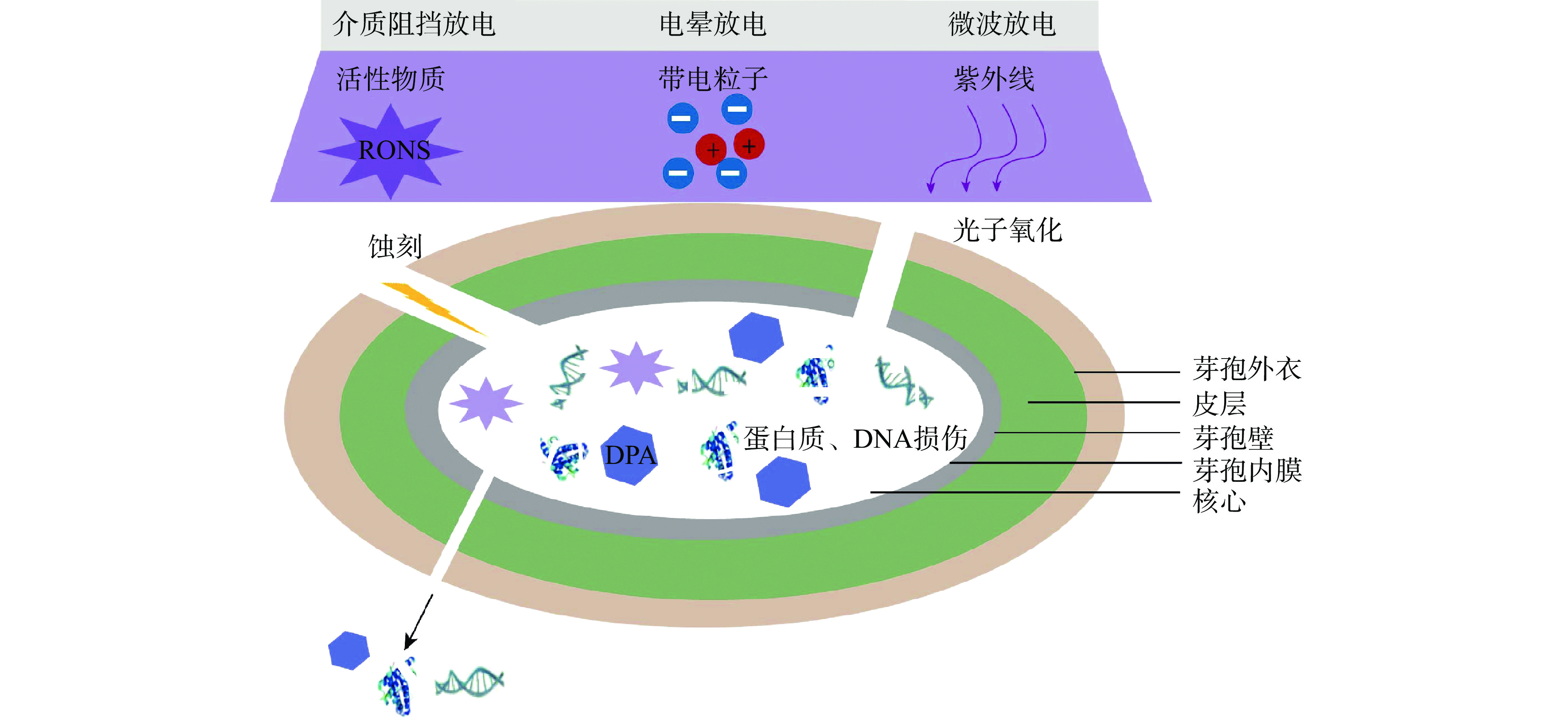
由于细菌芽孢结构的特殊性并且冷等离子体成分极为复杂,目前冷等离子体杀灭细菌芽孢的作用机制尚未完全阐明。目前的研究普遍认为冷等离子体放电过程中产生的活性物质、带电粒子及紫外线等能够与细菌芽孢发生一系列复杂反应,从而导致其死亡(图2)。
2.1 活性物质的氧化损伤杀菌机制
冷等离子体在放电过程中能够通过电离气体从而产生大量的活性物质,包括以原子氧(O)、超氧阴离子(O2−)、单线态氧(1O2)、羟基自由基(•OH)、臭氧(O3)等为代表的活性氧(reactive oxygen species,ROS)和以原子氮(N)、一氧化氮(NO)、二氧化氮(NO2)和过氧亚硝酸盐(ONOO−)等为代表的活性氮(reactive nitrogen species,RNS)[30]。上述活性物质能够诱导细菌芽孢发生氧化或硝化损伤,导致细胞膜表面发生脂质氧化,出现蚀刻现象,从而导致细胞膜穿孔,细胞内物质流出,最终导致细菌芽孢死亡。例如,吡啶2,6-二羧酸钙(DPA-Ca)是细菌芽孢核心的主要成分,其释放表明芽孢内膜和芽孢层完整性的丧失。Tseng等[31]发现,经以氦气为放电气体的冷等离子体射流处理后,B. subtilis芽孢中DPA的释放量随处理时间的延长而显著升高。经冷等离子体射流处理20 min后,B. subtilis芽孢中DPA释放量升高至43.0 μg/mL,显著高于未处理组(仅为8.0 μg/mL)。Liu等[32]采用SYTO 16/PI双染色法研究了冷等离子体射流杀灭B. cereus芽孢的作用机制,也得到了类似的结果。
此外,ROS、RNS等活性物质能够通过破损的细胞膜进入细菌芽孢内部,并与蛋白质、DNA等生物大分子发生一系列复杂反应,使芽孢产生不可逆的损伤,从而导致其死亡[33]。例如,冷等离子体放电产生的活性物质能与细菌芽孢表面脂质成分发生氧化反应,破坏膜结构与功能特性,导致膜流动性丧失。Wang等[34]发现,经冷等离子体处理6 min后,脂环芽孢杆菌(A. contaminans)芽孢的丙二醛浓度为2.5 μmol/L;当处理时间延长至9 min时,活性物质诱导脂质氧化,丙二醛浓度升高至3.2 μmol/L;傅里叶变换红外光谱结果表明,冷等离子体处理组芽孢在1535和1656 cm−1处的峰值下移,表明蛋白质的α-螺旋结构发生变化,这可能与活性物质通过破损的细胞膜进入芽孢内而造成的蛋白氧化损伤有关。
以上研究表明,冷等离子体放电产生的活性成分在杀灭细菌芽孢的过程中发挥了重要作用。但在今后的研究中,仍需进一步揭示不同活性物质在冷等离子体杀灭芽孢中的作用及其靶点,并构建活性物质靶向调控技术,以增强冷等离子体对芽孢的杀灭效果。
2.2 带电粒子的静电干扰作用
冷等离子体放电产生的各种带电粒子能够轰击芽孢表面,并损伤芽孢的细胞壁和细胞膜,使蛋白质、DNA等内容物泄露,最终导致其死亡[35]。例如,Shi等[19]通过透射电子显微镜观察DBD等离子处理前后B. subtilis芽孢的内部形态变化。结果表明,未处理的芽孢呈圆形,表面光滑,体积较大,外壳较厚,电子密度较高,核区明显,电子密度均匀,而经等离子体处理35 s后,B. subtilis芽孢外壳局部变薄,遭到破坏。因此,推测冷等离子体电离气体所产生的带电粒子在引起细菌芽孢的死亡中起到重要的作用。
2.3 紫外线辐射杀菌机制
研究发现,冷等离子体放电过程中能够产生紫外线,主要包括UVA(320~400 nm)、UVB(290~320 nm)和UVC(200 nm以下)[36]。紫外线辐射能够诱导芽孢衣发生光子氧化作用,从而进入芽孢内部破坏细胞DNA复制以及蛋白质、脂质等,从而导致其死亡[37]。例如,酸溶性小分子蛋白(small acid soluble proteins,SASP)是分布于细菌芽孢核心中的一种特有抗逆蛋白。SASP是与DNA双螺旋紧密结合的关键成分,其带正电荷的氨基酸残基能与带负电荷的双链DNA发生非特异结合,并导致其构象由A型转化为B型,从而保证基因正常的复制和转录活动并保护芽孢DNA免受湿热、干热、辐射和化学物质等造成的损害。Hertwig等[38]发现以氮气为放电气体的冷等离子体对SASP基因敲除突变型B. cereus芽孢具有较高的致死率,这可能是因为放电产生的紫外线辐射诱导芽孢DNA损伤,从而导致其死亡。然而,一些研究认为冷等离子体放电所产生的紫外线剂量较低,对细菌芽孢的损伤较小。例如,Van等[39]研究发现,经以氮气为放电气体的等离子体射流处理20 min后,玻璃培养皿中的B. cereus芽孢悬液(初始值为6.0 lg CFU/mL)降低了3.7 lg CFU/mL。同时,在玻璃皿上方覆盖石英玻璃(允许紫外线透过,而能够阻止自由基、离子等的透过),相同实验条件下的冷等离子体处理后,未检测到B. cereus芽孢的灭活。因此,关于冷等离子体产生的紫外线对细菌芽孢的灭活没有统一的结论,还需要进行深入研究。
综上所述,冷等离子体对细菌芽孢的杀灭作用可能与放电过程中产生的活性物质、带电粒子及紫外线等有关。在今后的研究中,应综合运用蛋白质组学、代谢组学和转录组学等实验技术,在基因和分子水平系统揭示冷等离子体杀灭细菌芽孢的作用靶点和机制。
3. 影响冷等离子体杀灭细菌芽孢作用效果的因素
研究证实,冷等离子体对细菌芽孢的杀灭效果受多种因素的影响,主要包括产生设备类型和参数(电压、电流、功率等)、放电气体(组成、流速、相对湿度等)、处理参数和方式(时间、接触方式等)以及样品特性(食品、玻璃培养皿等)等。
3.1 冷等离子体产生设备类型和参数
冷等离子体产生设备类型和放电参数是影响其杀灭细菌芽孢作用效果的重要因素。Hertwig等[27]比较了RF等离子体和MW等离子体对接种于黑胡椒颗粒表面B. subtilis和B. atrophaeus芽孢的杀灭效果,RF等离子体使用氩气(10 L/min),频率为27.1 MHz;MW等离子体采用空气(15 L/min),频率为2.5 GHz。结果表明,RF等离子体对B. subtilis和B. atrophaeus芽孢的杀灭效果明显优于MW等离子体。这可能与采用的两种冷等离子体产生方法及放电气体不同,造成所产生活性物质的种类和浓度存在较大差异,进而影响了对细菌芽孢的杀灭效果。
此外,冷等离子体对细菌芽孢的杀灭效果一般随放电功率和电压的升高而增强。例如,Deng等[40]发现,经放电电压分别为3.5和6.5 kV的DBD等离子体处理10 min后,B. subtilis芽孢分别降低了1.8和4.0 lg CFU/mL。Yang等[41]研究发现,微波MW等离子体对B. stearothermophilus芽孢的杀灭效果随放电功率的增加而增强;经放电功率分别为600和800 W的MW等离子体(放电气体为N2)处理120 s后,B. stearothermophilus芽孢由初始的7.0 lg CFU/mL分别降低了4.0和5.1 lg CFU/mL。造成上述结果的原因可能是,随着放电功率和电压的升高,放电过程中所产生的ROS、RNS等活性物质的浓度也逐渐升高,从而增强了冷等离子体对细菌芽孢的杀灭效果[32]。但在实际应用中,提高电压和功率等装置参数时,还需考虑设备的能耗、经济成本及对食品品质的影响等问题。
3.2 放电气体特性
目前,产生冷等离子体常用的气体主要包括空气、氮气、氧气和惰性气体等。研究证实,放电气体的组成、流速及相对湿度等显著影响冷等离子体对细菌芽孢的杀灭效果。例如,Patil等[42]比较了不同放电气体所产生DBD等离子体对B. atrophaeus芽孢的杀灭效果。结果表明,经空气、90% N2+10% O2和65% O2+30% CO2+5% N2所产生的DBD等离子体(功率为40 W)处理30 s后,B. atrophaeus芽孢分别降低了2.2、1.1和6.2 lg CFU/mL。Hertwig等[38]也发现以N2为放电气体所产生的冷等离子体对B. subtilis芽孢的杀灭效果最好,O2次之,空气最差。经空气、O2和N2所产生的冷等离子体分别处理 7 min 后,B. subtilis 芽孢分别降低了 3.5、4.0 和 5.3 lg CFU/mL。造成上述结果的原因可能是不同气体在放电过程中所产生的活性物质和浓度存在差异,进而影响其对细菌芽孢的杀灭效果。此外,有研究发现,在冷等离子体的放电气体中添加微量氧气可提高其对细菌芽孢的杀灭效果,这可能是氧气在放电过程中能够分解产生O3、•OH和O2−等活性成分,从而提高了冷等离子体对芽孢的杀灭效果。但需要指出的是,当氧气含量达到一定浓度时,能够激发产生的含氧活性物质是有限的,即达到饱和状态,此时如果处理条件不变,即使提高氧气浓度,也不会继续增强冷等离子体杀灭芽孢的效果[43]。
此外,当放电气体流速较小时,半衰期较短的活性物质可能无法到达细菌芽孢表面,从而导致其对芽孢杀灭效果较弱;适当提高气体流速可增强活性物质与细菌芽孢相互作用,进而增强杀灭效果。但也有一些研究发现,放电气体流速过高会缩短冷等离子体与细菌芽孢的相互作用时间,从而降低其杀灭效果[44]。因此,在实际应用中应针对不同芽孢污染食品的特性,系统优化放电气体的组成和流速等参数,以达到最佳的杀灭效果并有效保持食品的营养和感官品质。
放电气体的相对湿度也是影响冷等离子体杀菌效果的因素之一。例如,Patil等[42]发现,随着放电气体相对湿度的增加,冷等离子体对细菌芽孢的杀灭效果也随之增强。经相对湿度分别为3%、10%和30%的空气所产生的DBD等离子体直接处理60 s后,B. atrophaeus芽孢分别降低了5.0、6.0和6.4 lg CFU/strip。造成上述结果的原因是,当冷等离子体放电气体相对湿度较高时,其放电过程产生的•OH等活性成分浓度会升高,从而增强其对细菌芽孢的杀灭作用。
3.3 处理时间和方式
冷等离子处理时间和方式也是影响其杀灭细菌芽孢效果的重要因素。例如,Patil等[42]研究发现,随着放电时间的增加,冷等离子体对细菌芽孢的杀灭效果显著增强。经DBD等离子体(放电气体为65% O2+30% CO2+5% N2)分别处理30 s和60 s后,B. atrophaeus芽孢分别降低了3.5和6.0 lg CFU/mL。在冷等离子体处理食品时也发现了类似的结果。例如,Lee等[26]发现,经DBD等离子体(功率为30 W)处理3和4 min后,接种于年糕表面的B. cereus芽孢分别降低了1.6和2.2 lg CFU/g。这是因为抵达细菌芽孢表面的活性物质浓度会随着冷等离子体处理时间的延长而逐渐升高,进而增强其对细菌芽孢的杀灭效果[45]。
大量研究表明,冷等离子体处理方式显著影响其对芽孢的杀灭作用。冷等离子体处理细菌芽孢的方式一般分为直接处理和间接处理两大类。直接处理是指将样品放置在冷等离子体放电区域内,所产生自由基能够直接作用于样品表面。间接处理是指处理时将样品放置在冷等离子体周围区域,而非直接置于冷等离子体放电区域。例如,Mendes-oliveira等[46]发现,经空气放电所产生冷等离子体直接或间接处理30 s后,B. subtilis芽孢(初始浓度为6.4 lg CFU/strip)分别降低了1.4和0.1 lg CFU/strip 。Patil等[42]也发现,经DBD等离子体(放电气体为空气)直接或间接处理60 s,B. atrophaeus芽孢分别降低了6.0和2.2 lg CFU/mL。造成这一现象的主要原因是间接处理时,放电过程中产生的半衰期较短的活性物质难以到达待处理样品表面,从而降低其对芽孢的杀灭效果。因此,相对于间接处理,冷等离子体直接处理表现出对芽孢更高的杀灭效率。
3.4 样品特性
待处理样品自身特性也显著影响冷等离子体对细菌芽孢的杀灭效果。Pina-perez等[22]发现,冷等离子体对B. subtilis芽孢的杀灭作用随待处理样品表面粗糙度的增加而降低。经SMD等离子体处理7 min后,接种于无菌玻璃培养皿和玉米淀粉的B. subtilis芽孢分别降低了4.0和2.6 lg CFU/cm2。Hertwig等[47]也发现,经射频驱动冷等离子体射流处理(功率为30 W,放电气体为氩气)5 min后,接种于无菌玻璃皿、无菌玻璃珠和黑胡椒颗粒表面的B. subtilis芽孢分别降低了2.7、2.1和1.0 lg CFU/cm2。研究证实,当接触材料表面较为粗糙时,更有易于细菌芽孢形成密集的堆积结构,保护部分芽孢免受冷等离子体放电产生的活性物质、带电粒子及紫外线等杀菌因子的影响从而降低冷等离子体的杀菌效率。
此外,食品的相对表面积、水分含量等也是影响冷等离子体杀灭细菌芽孢效果的重要因素。例如,Kim等[48]发现,冷等离子体对红椒片表面B. cereus芽孢的杀灭效果随样品相对表面积的升高而降低。造成上述结果的原因可能是,当样品的相对表面积较高时,冷等离子体放电产生的ROS、RNS等活性成分可以分布至单位表面积的含量减少,进而降低了其对芽孢的杀灭效果。Liu等[32]也发现食品的水分含量显著影响冷等离子体对待处理样品的灭活效果。水分含量较高的食品在冷等离子体放电过程中能够产生更高浓度的•OH、O3、过氧化羟基自由基(•HO2)等活性物质,从而提高冷等离子体对芽孢的杀灭效果。
综上所述,冷等离子体类型和处理参数、放电气体特性以及样品特性等均能显著影响其对细菌芽孢的杀灭效果。因此,在将冷等离子体应用于食品中芽孢杀灭处理时,应根据待处理样品性质等优化冷等离子体处理参数,从而有效杀灭芽孢并有效保持食品的营养和感官品质。
4. 结语
芽孢对环境胁迫具有很强的抗逆性,难以在食品加工过程中被杀灭,从而导致果蔬、谷物和水产品等食品发生腐败并引发食源性疾病。大量研究证实,冷等离子体能够有效杀灭存在于食品中的细菌芽孢,并有效保持其营养和感官品质。目前,冷等离子体杀灭细菌芽孢效率的影响因素已较为明确,但其杀灭细菌芽孢的作用机制尚未完全阐明。在今后的研究中,应综合运用蛋白质组学、转录组学等多组学技术,在基因和分子水平深入阐释冷等离子体杀灭芽孢的作用靶点及分子机制。同时,还应研究冷等离子体协同其他技术手段(超高压、超声波、UV等)处理对食品中细菌芽孢的杀灭效果及品质的影响规律。此外,目前冷等离子体设备存在处理量小、自动化程度低、成本高等问题,难以满足实际应用的需求。因此,还应研发适用于食品产业化应用的冷等离子体装备,从而推动此技术在食品工业中的商业化应用。
-
表 1 冷等离子体对细菌芽孢的杀灭作用
Table 1 Cold plasma-induced inactivation of bacterial spores
细菌芽孢类型 冷等离子体类型 处理条件 杀灭效果 参考文献 枯草芽孢杆菌(B. subtilis)芽孢 RF等离子体 He+O2(0.2%),75 W,13.6 MHz,2 min B. subtilis芽孢由初始的5.0 lg CFU/mL
降低至检测限以下[19] 枯草芽孢杆菌(B. subtilis)芽孢 DBD等离子体 空气,20 kV,60 kHz,25 s B. subtilis芽孢由初始的5.5 lg CFU/mL
降低至0.2 lg CFU/mL[20] 枯草芽孢杆菌(B. subtilis)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. subtilis芽孢由初始的7.2 lg CFU/mL
降低至6.2 lg CFU/mL[21] 凝结芽孢杆菌(B. coagulans)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. coagulans芽孢由初始的6.5 lg CFU/mL降低至3.2 lg CFU/mL [21] 嗜热脂肪芽孢杆菌(B. stearothermophilus)芽孢 DBD等离子体 空气,3.5 W,10 kHz,84 s B. stearothermophilus芽孢由初始的
6.2 lg CFU/mL降低至4.3 lg CFU/mL[21] 枯草芽孢杆菌(B. subtilis)芽孢 SMD等离子体 空气,1.1 W,10 kHz,7 min B. subtilis芽孢由初始的4.8 lg CFU/mL
降低至0.8 lg CFU/mL[22] 表 2 冷等离子体对食品中细菌芽孢的杀灭作用
Table 2 Cold plasma-induced inactivation of bacterial spores in foods
食品类型 细菌芽孢 冷等离子体类型 处理条件 杀灭效果 参考文献 玉米淀粉 枯草芽孢杆菌(B. subtilis)芽孢 SMD等离子体 空气,10 kHz,1.3 W,5 min 接种于玉米淀粉表面的B. subtilis芽孢由初始的4.8 lg CFU/g降低至2.2 lg CFU/g [22] 年糕 蜡样芽孢杆菌(B. cereus)芽孢 DBD等离子体 空气,30 W,4 min 接种于年糕表面的B. cereus芽孢由初始的
5.3 lg CFU/g降低至3.9 lg CFU/g[26] 黑胡椒 枯草芽孢杆菌(B. subtilis)芽孢 MW等离子体 空气,2.5 GHz,1.2 kV,30 min 接种于黑胡椒表面的B. subtilis芽孢由初始的7.0 lg CFU/g降低至4.6 lg CFU/g [27] 黑胡椒 萎缩芽孢杆菌(B.
atrophaeus)芽孢MW等离子体 空气,2.5 GHz,1.2 kV,30 min 接种于黑胡椒表面的B. atrophaeus芽孢由初始的7.0 lg CFU/g降低至4.2 lg CFU/g [27] 小麦 萎缩芽孢杆菌(B.
atrophaeus)芽孢DBD等离子体 空气,80 kV,50 Hz,20 min 接种于小麦表面的B. cereus芽孢由初始的
6.5 lg CFU/g降低至5.6 lg CFU/g[28] 鲜切苹果 萎缩芽孢杆菌(B. atrophaeus)芽孢 MW等离子体 空气,2.5 GHz,1.1 kW,7 s 接种于鲜切苹果表面的B. atrophaeus芽孢减少了5.5 lg CFU/g [29] -
[1] NIEDŹWIEDŹ I, WAŚKO A, PAWŁAT J, et al. The state of research on antimicrobial activity of cold plasma[J]. Polish Journal of Microbiology,2019,68(2):153−164. doi: 10.33073/pjm-2019-028
[2] PATANGE A, BOEHM D, GILTRAP M, et al. Assessment of the disinfection capacity and eco-toxicological impact of atmospheric cold plasma for treatment of food industry effluents[J]. Science of the Total Environment,2018,631:298−307.
[3] LEGGETT M J, MCDONNELL G, DENYER S P, et al. Bacterial spore structures and their protective role in biocide resistance[J]. Journal of Applied Microbiology,2012,113(3):485−498. doi: 10.1111/j.1365-2672.2012.05336.x
[4] 白妍, 葛雨珺, 向迎春, 等. 非热杀菌技术杀灭食品中芽孢效能及机理研究进展[J]. 食品科学,2019,40(15):314−322. [BAI Yan, GE Yujun, XIANG Yingchun, et al. Progress in research on the efficacies and mechanisms of action of various non-thermal sterilization technologies in inactivation of microbial spores in foods[J]. Food Science,2019,40(15):314−322.] BAI Yan, GE Yujun, XIANG Yingchun, et al. Progress in research on the efficacies and mechanisms of action of various non-thermal sterilization technologies in inactivation of microbial spores in foods[J]. Food Science, 2019, 40(15): 314−322.
[5] LIAO X Y, CULLEN P J, MUHAMMAD A I, et al. Cold plasma–based hurdle interventions:New strategies for improving food safety[J]. Food Engineering Reviews,2020,12:321−332. doi: 10.1007/s12393-020-09222-3
[6] ANDRÉ S, VALLAEYS T, PLANCHON S. Spore-forming bacteria responsible for food spoilage[J]. Research in Microbiology,2017,168(4):379−387. doi: 10.1016/j.resmic.2016.10.003
[7] BARTULA K, BEGLEY M, LATOUR N, et al. Growth of food-borne pathogens Listeria and Salmonella and spore-forming Paenibacillus and Bacillus in commercial plant-based milk alternatives[J]. Food Microbiology,2023,109:104143. doi: 10.1016/j.fm.2022.104143
[8] LÜ R L, LIU D H, ZHOU J W. Bacterial spore inactivation by non-thermal technologies:Resistance and inactivation mechanisms[J]. Current Opinion in Food Science,2021,42:31−36. doi: 10.1016/j.cofs.2020.12.014
[9] ASL P J, RAJULAPATI V, GAVAHIAN M, et al. Non-thermal plasma technique for preservation of fresh foods:A review[J]. Food Control,2022,134:108560. doi: 10.1016/j.foodcont.2021.108560
[10] DESAI M, CHANDEL A, CHAUHAN O P, et al. Uses and future prospects of cold plasma in agriculture[J]. Food and Humanity,2024,2:100262. doi: 10.1016/j.foohum.2024.100262
[11] KIS M, MILOSEVIC S, VULIC A, et al. Efficacy of low pressure DBD plasma in the reduction of T-2 and HT-2 toxin in oat flour[J]. Food Chemistry,2020,316:126372. doi: 10.1016/j.foodchem.2020.126372
[12] HOFFMANN C, BERGANZA C, ZHANG J. Cold atmospheric plasma:Methods of production and application in dentistry and oncology[J]. Medical Gas Research,2013,3(1):1−15. doi: 10.1186/2045-9912-3-1
[13] PANKAJ S K, KEENER K M. Cold plasma:Background, applications and current trends[J]. Current Opinion in Food Science,2017,16:49−52. doi: 10.1016/j.cofs.2017.07.008
[14] 相启森, 张嵘, 范刘敏, 等. 大气压冷等离子体在鲜切果蔬保鲜中的应用研究进展[J]. 食品工业科技,2021,42(1):368−372. [XIANG Qisen, ZHANG Rong, FAN Liumin, et al. Research progress of atmospheric cold plasma in fresh-cut fruits and vegetables preservation[J]. Science and Technology of Food Industry,2021,42(1):368−372.] XIANG Qisen, ZHANG Rong, FAN Liumin, et al. Research progress of atmospheric cold plasma in fresh-cut fruits and vegetables preservation[J]. Science and Technology of Food Industry, 2021, 42(1): 368−372.
[15] OLATUNDE O O, SHIEKH K A, BENJAKUL S. Pros and cons of cold plasma technology as an alternative non-thermal processing technology in seafood industry[J]. Trends in Food Science & Technology,2021,111:617−627.
[16] BOURKE P, ZIUZINA D, BOEHM D, et al. The potential of cold plasma for safe and sustainable food production[J]. Trends in Biotechnology,2018,36(6):615−626. doi: 10.1016/j.tibtech.2017.11.001
[17] HUANG Y H, YE X F P, DOONA C J, et al. An investigation of inactivation mechanisms of Bacillus amyloliquefaciens spores in non-thermal plasma of ambient air[J]. Journal of the Science of Food and Agriculture,2019,99(1):368−378. doi: 10.1002/jsfa.9198
[18] REINEKE K, LANGER K, HERTWIG C, et al. The impact of different process gas compositions on the inactivation effect of an atmospheric pressure plasma jet on Bacillus spores[J]. Innovative Food Science & Emerging Technologies,2015,30:112−118.
[19] SHI X M, YUAN Y K, SUN Y Z, et al. Experimental research of inactivation effect of low-temperature plasma on bacteria[J]. Plasma Science and Technology,2006,8(5):569−572. doi: 10.1088/1009-0630/8/5/16
[20] 石兴民, 张冠军, 袁育康, 等. 低温等离子体对细菌芽孢的灭活研究[J]. 南方医科大学学报,2009,29(10):2033−2036. [SHI Xingmin, ZHANG Guanjun, YUAN Yukang, et al. Inactivation of bacterial spores using low-temperature plasma[J]. Journal of Southern Medical University,2009,29(10):2033−2036.] SHI Xingmin, ZHANG Guanjun, YUAN Yukang, et al. Inactivation of bacterial spores using low-temperature plasma[J]. Journal of Southern Medical University, 2009, 29(10): 2033−2036.
[21] BEYRER M, SMEU I, MARTINET D, et al. Cold atmospheric plasma inactivation of microbial spores compared on reference surfaces and powder particles[J]. Food and Bioprocess Technology,2020,13:827−837. doi: 10.1007/s11947-020-02438-5
[22] PINA-PEREZ M C, MARTINET D, PALACIOS-GORBA C, et al. Low-energy short-term cold atmospheric plasma:Controlling the inactivation efficacy of bacterial spores in powders[J]. Food Research International,2020,130:108921. doi: 10.1016/j.foodres.2019.108921
[23] FAROOQ S, DAR A H, DASH K K, et al. Cold plasma treatment advancements in food processing and impact on the physiochemical characteristics of food products[J]. Food Science and Biotechnology,2023,32(5):621−638. doi: 10.1007/s10068-023-01266-5
[24] KIM J E, OH Y J, SONG A Y, et al. Preservation of red pepper flakes using microwave-combined cold plasma treatment[J]. Journal of the Science of Food and Agriculture,2019,99(4):1577−1585. doi: 10.1002/jsfa.9336
[25] BUTSCHER D, SCHLUP T, ROTH C, et al. Inactivation of microorganisms on granular materials:Reduction of Bacillus amyloliquefaciens endospores on wheat grains in a low pressure plasma circulating fluidized bed reactor[J]. Journal of Food Engineering,2015,159:48−56. doi: 10.1016/j.jfoodeng.2015.03.009
[26] LEE H S, LEE H, RYU S, et al. In-package cold plasma treatment for microbial inactivation in plastic-pouch packaged steamed rice cakes[J]. International Journal of Food Microbiology,2023,389:110108. doi: 10.1016/j.ijfoodmicro.2023.110108
[27] HERTWIG C, REINEKE K, EHLBECK J, et al. Decontamination of whole black pepper using different cold atmospheric pressure plasma applications[J]. Food Control,2015,55:221−229. doi: 10.1016/j.foodcont.2015.03.003
[28] LOS A, ZIUZINA D, BOEHM D, et al. Effects of cold plasma on wheat grain microbiome and antimicrobial efficacy against challenge pathogens and their resistance[J]. International Journal of Food Microbiology,2020,335:108889. doi: 10.1016/j.ijfoodmicro.2020.108889
[29] SCHNABEL U, NIQUET R, SCHLÜTER O, et al. Decontamination and sensory properties of microbiologically contaminated fresh fruits and vegetables by microwave plasma processed air (PPA)[J]. Journal of Food Processing and Preservation,2015,39(6):653−662. doi: 10.1111/jfpp.12273
[30] MANDAL R, SINGH A, SINGH A P. Recent developments in cold plasma decontamination technology in the food industry[J]. Trends in Food Science & Technology,2018,80:93−103.
[31] TSENG S, ABRAMZON N, JACKSON J O, et al. Gas discharge plasmas are effective in inactivating Bacillus and Clostridium spores[J]. Applied Microbiology & Biotechnology,2012,93(6):2563−2570.
[32] LIU Y, SUN Y Y, WANG Y H, et al. Inactivation mechanisms of atmospheric pressure plasma jet on Bacillus cereus spores and its application on low-water activity foods[J]. Food Research International,2023,169:112867. doi: 10.1016/j.foodres.2023.112867
[33] NWABOR O F, ONYEAKA H, MIRI T, et al. A cold plasma technology for ensuring the microbiological safety and quality of foods[J]. Food Engineering Reviews,2022,14(4):535−554. doi: 10.1007/s12393-022-09316-0
[34] WANG Z W, ZHAO Q N, GAN Y, et al. Inactivation of Alicyclobacillus contaminans spores by dielectric barrier discharge plasma and its biological mechanism[J]. Innovative Food Science & Emerging Technologies, 2023:103415.
[35] ZHU Z S, BASSEY A P, HUANG T R, et al. The formation, germination, and cold plasma inactivation of bacterial spore[J]. Food Chemistry Advances,2022,1:100056. doi: 10.1016/j.focha.2022.100056
[36] LAROQUE D A, SEÓ S T, VALENCIA G A, et al. Cold plasma in food processing:Design, mechanisms, and application[J]. Journal of Food Engineering,2022,312:110748. doi: 10.1016/j.jfoodeng.2021.110748
[37] LOPES R P, MOTA M J, GOMES A M, et al. Application of high pressure with homogenization, temperature, carbon dioxide, and cold plasma for the inactivation of bacterial spores:A review[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(3):532−555. doi: 10.1111/1541-4337.12311
[38] HERTWIG C, REINEKE K, RAUH C, et al. Factors involved in Bacillus spore's resistance to cold atmospheric pressure plasma[J]. Innovative Food Science & Emerging Technologies,2017,43:173−181.
[39] VAN BOKHORST-VAN DE VEEN H, XIE H Y, ESVELD E, et al. Inactivation of chemical and heat-resistant spores of Bacillus and Geobacillus by nitrogen cold atmospheric plasma evokes distinct changes in morphology and integrity of spores[J]. Food Microbiology,2015,45:26−33. doi: 10.1016/j.fm.2014.03.018
[40] DENG X T, SHI J J, KONG M G. Physical mechanisms of inactivation of Bacillus subtilis spores using cold atmospheric plasmas[J]. IEEE Transactions on Plasma Science,2006,34(4):1310−1316. doi: 10.1109/TPS.2006.877739
[41] YANG X L, CHANG X J, TEI R T, et al. Effect of excited nitrogen atoms on inactivation of spore-forming microorganisms in low pressure N2/O2 surface-wave plasma[J]. Journal of Physics D:Applied Physics,2016,49(23):235205. doi: 10.1088/0022-3727/49/23/235205
[42] PATIL S, MOISEEV T, MISRA N N, et al. Influence of high voltage atmospheric cold plasma process parameters and role of relative humidity on inactivation of Bacillus atrophaeus spores inside a sealed package[J]. Journal of Hospital Infection,2014,88(3):162−169. doi: 10.1016/j.jhin.2014.08.009
[43] KIM J E, LEE D U, MIN S C. Microbial decontamination of red pepper powder by cold plasma[J]. Food Microbiology,2014,38:128−136. doi: 10.1016/j.fm.2013.08.019
[44] FEIZOLLAHI E, MISRA N N, ROOPESH M S. Factors influencing the antimicrobial efficacy of dielectric barrier discharge (DBD) atmospheric cold plasma (ACP) in food processing applications[J]. Critical Reviews in Food Science and Nutrition,2021,61(4):666−689. doi: 10.1080/10408398.2020.1743967
[45] VARILLA C, MARCONE M, ANNOR G A. Potential of cold plasma technology in ensuring the safety of foods and agricultural produce:A review[J]. Foods,2020,9(10):1435. doi: 10.3390/foods9101435
[46] MENDES-OLIVEIRA G, JENSEN J L, KEENER K M, et al. Modeling the inactivation of Bacillus subtilis spores during cold plasma sterilization[J]. Innovative Food Science & Emerging Technologies,2019,52:334−342.
[47] HERTWIG C, STEINS V, REINEKE K, et al. Impact of surface structure and feed gas composition on Bacillus subtilis endospore inactivation during direct plasma treatment[J]. Frontiers in Microbiology,2015,6:102−110.
[48] KIM J E, CHOI H S, LEE D U, et al. Effects of processing parameters on the inactivation of Bacillus cereus spores on red pepper (Capsicum annum L.) flakes by microwave-combined cold plasma treatment[J]. International Journal of Food Microbiology,2017,263:61−66. doi: 10.1016/j.ijfoodmicro.2017.09.014
-
期刊类型引用(3)
1. 刘阳泰,董庆利,王翔,夏雪娟. 中国式现代化视域下的“食品工艺学”课程建设. 食品工业. 2024(01): 218-221 .  百度学术
百度学术
2. 梁娟,严家凤,周安,解松子,孙念霞,智楠楠,邹容欣. 新工科背景下食品类专业课程思政建设中存在的问题及应对策略. 安徽开放大学学报. 2024(01): 67-72 .  百度学术
百度学术
3. 李晓东,刘璐,李嘉钰,张秀秀,郑冬梅,崔立雪,张宏伟. 《乳品工艺学》课程思政教育的改革与实践. 食品工业科技. 2024(19): 376-382 .  本站查看
本站查看
其他类型引用(0)





 下载:
下载:
 下载:
下载:



