Preparation of Polysaccharides from Liubao Brick Tea and Its Immunomodulatory Activity
-
摘要: 目的:优化六堡砖茶多糖提取工艺,并进一步研究其免疫调节作用及其可能的调节机制。方法:采用单因素实验探究提取温度、料液比及乙醇浓度对茶多糖得率的影响,在此基础上与响应面试验相结合,对茶多糖提取工艺进行了优化。通过测定六堡砖茶多糖对RAW264.7细胞的吞噬能力及NO释放量,检测核因子κB(Nuclear factor-κB,NF-κB)和AMP依赖的蛋白激酶(AMP-dependent protein kinase,AMPK)信号通路相关基因及蛋白表达,评价纯化后的茶多糖的体外免疫调节活性。结果:六堡砖茶多糖的最佳提取工艺为:提取温度91.11 ℃,料液比1:15.45(g/mL),乙醇浓度82.84%(v/v)。在此条件下,茶多糖得率为8.62%。细胞实验显示六堡砖茶多糖可显著增强RAW264.7细胞的吞噬能力及NO释放量(P<0.05),显著激活NF-κB和AMPK信号通路(P<0.05),显著上调诱导型一氧化氮合成酶(Inducible nitric oxide synthase,iNOS)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin-1β,IL-1β)的mRNA表达水平(P<0.05)。其中,高剂量茶多糖效果更佳。结论:通过优化提取温度、料液比及乙醇浓度条件,可有效提高六堡砖茶多糖得率,并可通过激活NF-кB/AMPK通路发挥免疫调节作用。该研究结果为六堡砖茶多糖活性深入探究和应用提供了研究基础。Abstract: Objective: To optimize the extraction process of tea polysaccharides from Liubao brick tea and to further investigate the immunomodulatory effects and the possible regulatory mechanisms. Methods: A single-factor experiment was used to investigate the effects of extraction temperature, material-liquid ratio, and ethanol concentration on the yield of tea polysaccharides, based on which the extraction process was optimized by combining with response surface methodology. By measuring the phagocytosis and nitric oxide (NO) release of Liubao brick tea polysaccharides on RAW264.7 cells, detecting the expression of genes and proteins related to nuclear factor-κB (NF-κB) and AMP-dependent protein kinase (AMPK) signaling pathway, in vitro immunomodulatory activity of the purified tea polysaccharides was evaluated. Results: The optimal extraction process for the polysaccharides from Liubao brick tea were as follows: 91.11 ℃ of the extraction temperature, 1:15.45 of the solid-liquid ratio, and 82.84% of the ethanol concentration. In vitro immunomodulatory activity assay showed that Liubao brick tea polysaccharides significantly enhanced phagocytosis and NO release of RAW264.7 cells, significantly activated NF-κB and AMPK signaling pathway, and significantly up-regulated the mRNA expression levels of inducible nitric oxide synthase (iNOS), tumor necrosis factor-α (TNF-α), interleukin-6 (IL-6), and interleukin-1β (IL-1β) to exert immunomodulatory effects. Conclusion: By optimizing the extraction temperature, material-liquid ratio and ethanol concentration, the yield of Liubao brick tea polysaccharide could be effectively improved, and it could play an immunomodulatory role by activating the NF-кB/AMPK pathway. The results provide a research basis for the in-depth investigation and application of the Liubao brick polysaccharide.
-
六堡砖茶是一种由微生物发酵制造的黑茶,以广西特产大叶种茶树的叶子为原料制成,具有独特的槟榔味和香气。通过其独特的加工工艺,赋予了六堡砖茶独特的滋味和多种活性[1]。近年来的研究发现,六堡砖茶具有降血糖、降血脂、改善肠道菌群、抗氧化等多种生物功能[2−4]。
六堡砖茶中富含茶多糖[5]。研究表明,黑茶多糖通常是微生物将茶叶中的碳水化合物转化或代谢产生的,多数为酸性杂多糖[6]。由于其特殊的堆积发酵和陈化过程,黑茶多糖常与其他成分如多酚或蛋白质结合,呈现出与其他茶多糖不同的结构和活性[4,7]。茶多糖可通过多种提取方法获得,包括水提法、酸提法、碱提法,以及超声波提取法、酶提取法和阴离子反胶束体系萃取法等辅助提取方法[8]。目前,水提法是较为常用的方法。Wei等[4]采用水提醇沉法制备了六堡砖茶多糖,并进行了体外实验,发现六堡砖茶多糖具有降血糖、抗氧化和降血脂的效果。Sun等[9]发现茯砖茶多糖能够通过调节肠道菌群和代谢来发挥免疫保护作用。单磷酸腺苷激活蛋白激酶(AMP-dependent protein kinase,AMPK)是一种在能量压力下被激活的细胞能量传感器,对于维持能量平衡起着关键作用[10]。研究发现,黄芪多糖可以激活RAW264.7细胞中的AMPK活性,从而发挥抗炎活性[11]。然而,关于六堡砖茶多糖的免疫调节活性及其相关机制的研究报道还比较少。
因此,本研究以六堡砖茶为原料,通过单因素实验和正交试验优化了六堡砖茶多糖的提取工艺,并通过巨噬细胞RAW264.7模型探究了六堡砖茶多糖的体外免疫调节活性,以期为揭示六堡砖茶多糖的活性机制以及合理开发提供一定的研究基础。
1. 材料与方法
1.1 材料与仪器
六堡砖茶 六堡茶广西梧州圣源茶叶有限公司;RAW264.7巨噬细胞 中国科学院细胞生物学研究所;四氮唑蓝、二甲基亚砜、中性红、脂多糖、牛血清白蛋白、胎牛血清 上海阿拉丁生化科技股份有限公司;考马斯亮蓝G250 碧云天生物科技有限公司;TRIzol试剂、Servicebio®RT First Strand cDNA合成试剂盒 武汉赛维尔有限公司;DMEM高糖培养基 HyClone公司;0.25%胰蛋白酶-EDTA Gibco公司。
CPA 225D 分析天平 赛多利斯科学仪器(北京);RE 3000旋转蒸发器 上海亚荣生化仪器厂;DK S24水浴锅 上海岛韩实业有限公司;T6紫外分光光度计 北京普析通用仪器有限责任公司;LABCONCO冷冻干燥机 赛默飞世尔科技有限公司;细胞培养箱 Olympus 公司;AMR 100酶标仪 杭州奥盛仪器有限公司。
1.2 实验方法
1.2.1 六堡砖茶多糖提取工艺
茶多糖提取方法参考之前的报道[12]。茶叶经粉碎后过80目筛,按照1:10(g/mL)的料液比,以90 ℃热水提取2 h,重复提取两次。对水提液旋蒸浓缩至固含量为70%左右,加入乙醇至浓度为80%,4 ℃静置过夜后,离心取沉淀,冷冻干燥后得茶多糖。
茶多糖得率(%)=茶多糖质量(g)茶叶原料质量(g)×100 (1) 1.2.2 六堡砖茶多糖提取单因素实验
1.2.2.1 提取温度对多糖得率的影响
设置60、70、80、90、100 ℃五个提取温度进行实验,其余实验条件不变,每组实验重复三次,比较不同提取温度下六堡砖茶多糖的得率。
1.2.2.2 提取料液比对多糖得率的影响
设置1:5,1:10,1:15,1:20,1:25五个料液比(g/mL)进行实验,其余实验条件不变,每组实验重复三次,比较不同提取料液比下六堡砖茶多糖的得率。
1.2.2.3 乙醇浓度对多糖得率的影响
设置50%、60%、70%、80%、90%五个乙醇浓度进行实验,其余实验条件不变,每组实验重复三次,比较不同乙醇浓度下六堡砖茶多糖的得率。
1.2.3 六堡砖茶多糖提取响应面试验
通过对单因素实验结果分析得出相应水平较高的各因素值。进一步采用响应面试验法优化其提取工艺,试验设计见表1。运用Design-Expert 12软件处理得到最佳提取工艺,然后再对最佳提取工艺进行验证。
表 1 Box-Behnken设计因素水平及编码值Table 1. Factor levels and coding values of Box-Behnken水平 因素 A 提取温度(℃) B 料液比(g/mL) C 乙醇浓度(%) −1 80 1:10 70 0 90 1:15 80 1 100 1:20 90 1.2.4 六堡茶粗多糖纯化
参考Zhu等[13]的方法对经响应面优化后制备的粗茶多糖进行纯化。粗多糖溶于超纯水中配制成50 mg/mL的溶液,过0.45 μm过滤膜后,缓慢均匀加入凝胶柱中(2.5 cm×60 cm, 填料为DEAE-Sepharose Fast Flow gel)。以NaCl溶液进行梯度洗脱,使用3500 Da的透析袋对洗脱液进行透析72 h,冻干后得到六堡茶粗多糖。
1.2.5 中性糖含量测定
参照标准SN/T 4260-2015中苯酚硫酸法对中性糖进行测定。称取10.00 mg待测多糖于适量蒸馏水中溶解并定容至100 mL,吸取1 mL在冰水浴中加入0.5 mL的苯酚溶液,振荡摇匀,加入2.5 mL浓硫酸,以不放热或微量放热为宜,恒温加塞,沸水浴20 min,取出冷却10 min。以蒸馏水代替样品作为空白调零,在最大吸收波长处490 nm测定吸光度。根据回归方程计算中性糖含量。
1.2.6 糖醛酸含量测定
参照杨新河等[14]的实验方法,以半乳糖醛酸为标准品,通过硫酸咔唑法对糖醛酸含量进行测定。称取10.00 mg多糖于适量蒸馏水中溶解,定容到100 mL,吸取1.0 mL样品溶液预冷后加入6 mL四硼酸钠-浓硫酸溶液,振荡混合后于沸水浴加热5 min,置冰水浴中冷却到室温,加入100 μL间羟基联苯溶液。混合均匀后静置20 min,在520 nm处测定吸光度。根据回归方程计算糖醛酸含量。
1.2.7 茶多酚含量测定
参照标准GB/T 8313-2018[15],采用福林酚法对茶多酚含量进行测定。以没食子酸为标准品,取1 mL多糖溶液与1 mL福林酚溶液混合,静置5 min,加入3 mL 10%碳酸钠摇匀,放置2 h,在760 nm处测定吸光度,根据回归方程计算茶多酚含量。
1.2.8 茶蛋白含量测定
参照考马斯亮蓝法[16]对蛋白含量进行测定。以牛血清蛋白为标准品,取多糖溶液20 μL与2000 μL考马斯亮蓝G-250染色工作液混合均匀,室温静置2 min,在520 nm处测定吸光度,根据回归方程计算糖醛酸含量。
1.2.9 六堡砖茶多糖免疫调节活性细胞模型评价
1.2.9.1 细胞存活率测定
RAW264.7细胞以2×105细胞/孔的密度在96孔板中培养24 h,然后将培养基换为不同浓度的六堡砖茶多糖(25、50、100、200、500 μg/mL)和脂多糖(LPS)(10 μg/mL)培养36 h。弃上清,将100 μL MTT溶液(0.5 mg/mL)添加到每个孔中,再持续培养4 h。取出培养液,加入100 μL二甲亚砜,并在490 nm处读取吸光度。
1.2.9.2 吞噬能力测定
采用中性红吞噬实验[17]测定茶多糖对RAW264.7细胞吞噬能力的影响。培养方法同1.2.9.1,以DEME培养基和LPS(1 μg/mL)作为空白对照和阳性对照。培养36 h后弃上清,加入100 μL/孔 0.1%中性红生理盐水溶液,继续培养4 h。弃上清,加入100 μL/孔细胞裂解液,继续培养1 h。在540 nm处读取吸光度。
1.2.9.3 NO释放量测定
培养方法及分组同1.2.9.2,培养36 h。使用NO检测试剂盒测定活化的RAW264.7细胞中的NO水平。
1.2.9.4 RT-qPCR法检测细胞免疫调节关键基因表达
以5×105个/mL的浓度接种RAW264.7细胞到60 mm2的培养皿中,分组同1.2.9.2,培养36 h后,去上清液,PBS缓冲液洗后加入1 mL Trizol试剂。使用逆转录酶将RNA反转录成cDNA。采用qRT-PCR测定iNOS、TNF-α、IL-6、IL-1β的mRNA表达情况,以β-actin为内参,引物序列见表2。反转录及qRT-PCR参数设置参照试剂盒说明书进行。
表 2 引物序列Table 2. Sequences of the primers引物名称 引物序列 iNOS 5’端 AGCCAAGCCCTCACCTACTT 3’端 GCCTCCAATCTCTGCCTATC TNF-α 5’端 TATGGCTCAGGGTCCAACTC 3’端 GGAAAGCCCATTTGAGTCCT IL-6 5’端 CACGGCCTTCCCTACTTCAC 3’端 TGCAAGTGCATCATCGTTGT IL-1β 5’端 GTTGACGGACCCCAAAAGAT 3’端 CCTCATCCTGGAAGGTCCAC β-actin 5’端 ATGTGGATCAGCAAGCAGGA 3’端 ATGTGGATCAGCAAGCAGGA 1.2.9.5 免疫荧光法检测NF-кB蛋白表达变化
细胞培养及分组方式同1.2.9.4。25 ℃下用0.1 mol/L PBS中的4%多聚甲醛预混合细胞1 h。用PBS冲洗后,用1% Triton X-100对细胞进行渗透处理。随后,采用10%血清封闭细胞1 h,之后与抗NF-кB一抗(1:1000)一起孵育(4 ℃)过夜,而后洗涤细胞并用相应的荧光标记二抗孵育。最后,在荧光显微镜下观察结果。
1.2.9.6 Western-blot法检测AMPK及p-AMPK蛋白表达变化
细胞培养及分组方式同1.2.9.4。弃上清保留细胞沉淀,用RIPA裂解缓冲液裂解,并按照Trajkovic等[18]的方法进行免疫印迹。使用p-AMPKα1,AMPKα1作为目标蛋白基因,并参考β-肌动蛋白作为管家基因。
1.3 数据处理
使用GraphPad Prism 9.0软件进行统计分析。P<0.05为差异显著,P<0.01为差异极显著。结果使用平均值±标准差表示。
2. 结果与分析
2.1 单因素实验结果分析
2.1.1 提取温度对六堡砖茶多糖得率的影响
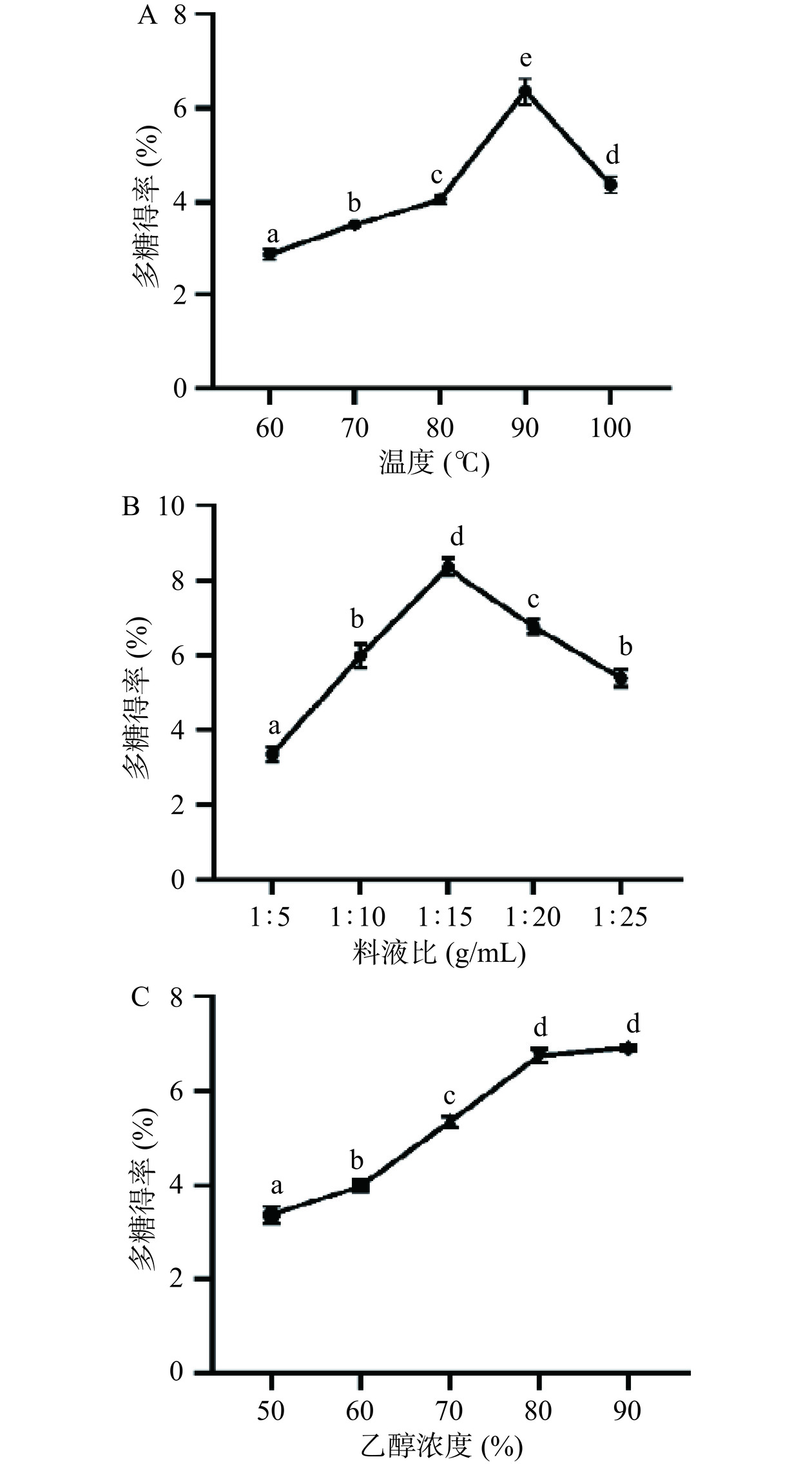
图1显示了不同提取温度、料液比和乙醇浓度对六堡砖茶多糖得率的影响。在60~90 ℃,随着提取温度的升高,多糖的得率增加,达到最高值为6.35%。然而当温度达到100 ℃时,得率开始下降。这是由于过高的温度可能会破坏多糖的结构并导致其降解,从而降低了茶多糖的得率[19]。当料液比为1:15(g/mL)时,多糖的得率最高,达到8.36%。较低的料液比会导致多糖未完全溶出,而较高的料液比会在过滤和浓缩等后续步骤中造成多糖的损失,从而降低了得率[19]。随着乙醇浓度的增加,多糖的得率逐渐增加。当乙醇浓度为80%和90%时,多糖得率无显著差异(P>0.05),表明完全沉淀水提液中多糖需要的乙醇浓度在80%~90%。综上所述,选取提取温度90 ℃,料液比1:15,乙醇浓度80%进行响应面优化试验。
2.2 响应面试验结果
提取六堡砖茶多糖的响应面试验设计及结果如表3所示。采用Design Expert 12对表3数据进行二次多项式逐步回归分析,得到六堡砖茶多糖得率与提取温度(A)、提取料液比(B)、乙醇浓度(C)之间的二次回归方程为:
表 3 响应面试验设计及结果Table 3. Design and results of response surface experimental实验号 因素 多糖得率(%) A B C 1 −1 0 −1 5.57 2 1 0 −1 6.07 3 0 0 0 8.86 4 1 −1 0 5.78 5 1 0 1 6.56 6 0 1 −1 6.83 7 0 −1 −1 6.07 8 0 −1 1 6.45 9 0 1 1 7.26 10 −1 1 0 4.85 11 0 0 0 8.41 12 0 0 0 8.56 13 −1 0 1 5.85 14 0 0 0 8.31 15 −1 −1 0 4.18 16 0 0 0 8.58 17 1 1 0 5.69 Y=8.54+0.4563A+0.2688B+0.1975C−0.1900AB+0.0525AC+0.0125BC−2.03A2−1.39B2−0.5020C2
由表4可知,该模型P值<0.01,说明该回归模型极显著;失拟项P值>0.05,可用于响应面试验优化六堡砖茶多糖的提取工艺研究。预判定系数R²为0.9848,表明该模型拟合程度高;R2Pred(0.9653)与R²Adj(0.8357)差异小于0.2,有合理的一致性。信噪比衡量的是信号与噪音的比率,信噪比为21.447>4,表明此模型可以用来设计试验[20]。
表 4 回归方程的方差分析Table 4. Analysis of variance方差来源 平方和 自由度 均方 F P 显著性 模型 31.54 9 3.5 50.47 <0.0001 显著 A-提取温度 1.67 1 1.67 23.99 0.0018 显著 B-料液比 0.5778 1 0.5778 8.32 0.0235 显著 C-乙醇浓度 0.312 1 0.312 4.5 0.0717 不显著 AB 0.1444 1 0.1444 2.08 0.1924 不显著 AC 0.011 1 0.011 0.1588 0.7021 不显著 BC 0.0006 1 0.0006 0.009 0.9271 不显著 A² 17.34 1 17.34 249.82 <0.0001 显著 B² 8.13 1 8.13 117.1 <0.0001 显著 C² 1.06 1 1.06 15.28 0.0058 显著 残差 0.4859 7 0.0694 失拟项 0.3118 3 0.1039 2.39 0.2097 不显著 纯误差 0.1741 4 0.0435 总值 32.02 16 R²= 0.9848 R²Adj=0.9653 R²Pre=0.8357 信噪比=21.4471 2.3 各因素之间的交互作用及验证试验
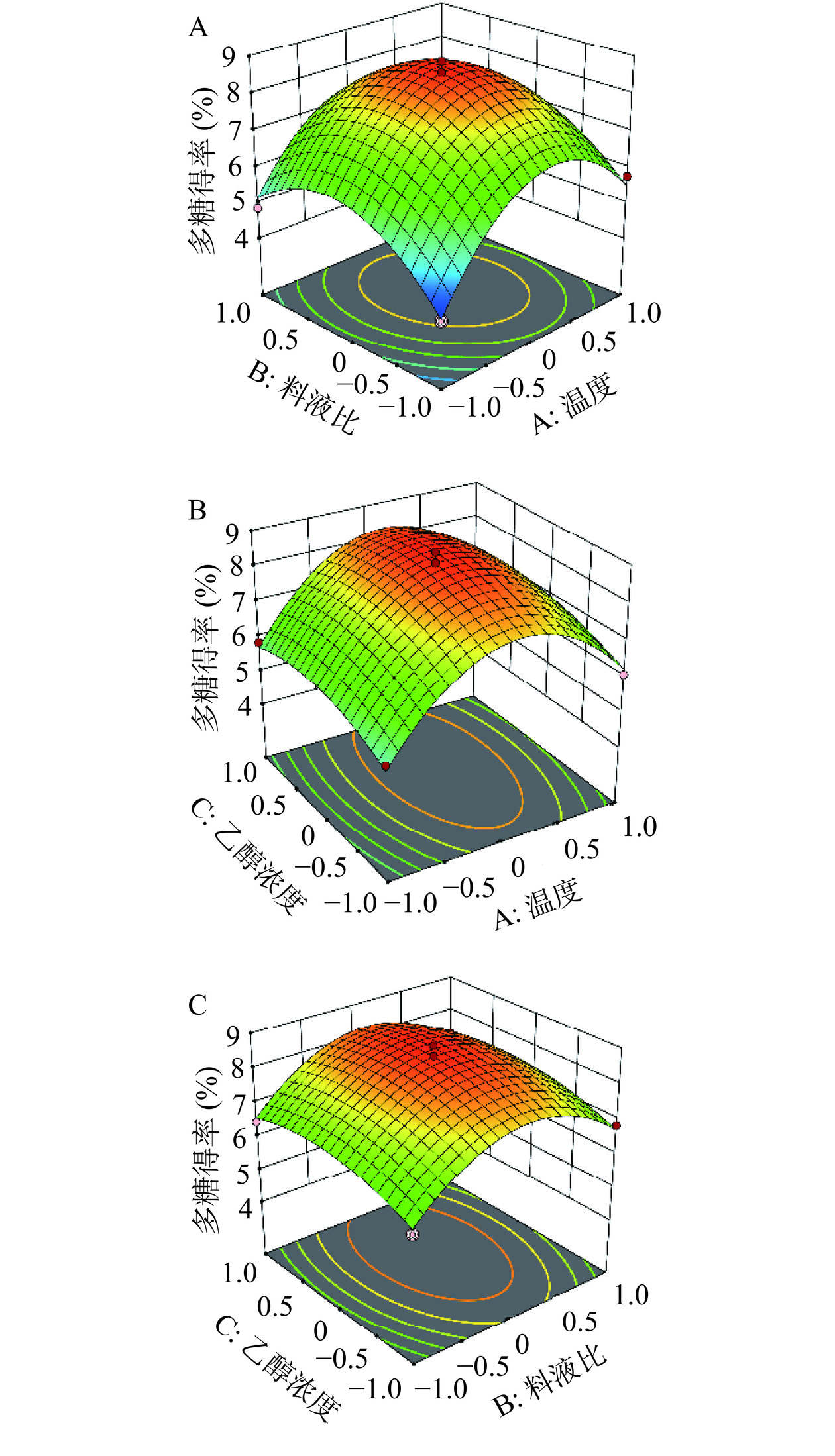
两两因素之间的相互作用见图2。响应面图越陡峭,二者之间的影响越显著,反之越小;等高线图呈椭圆,则二者交互作用越强,反之越弱[21]。由图2可知,响应面的陡峭程度大小顺序为AB>AC>BC,与表2数据一致(F值)。由以上结果可知,三因素对六堡砖茶多糖提取结果影响程度大小排序为A>B>C,即提取温度>料液比>乙醇浓度。采用响应面软件对实验结果进一步分析优化,得出六堡砖茶多糖最优提取工艺为提取温度91.11 ℃,料液比1:15.45(g/mL),乙醇浓度82.84%,在此条件下,多糖得率为8.60%。实际操作中提取温度设定91.1 ℃,料液比1:15.4 (g/mL),乙醇浓度82.8%,对此进行三次重复验证试验,实际多糖得率为8.62%±0.05%,与模型预测结果相符。
2.4 六堡砖茶多糖组成成分分析
六堡砖茶多糖的中性糖、糖醛酸、茶多酚及茶蛋白含量测定结果如表5所示。其中,中性糖含量为639.39 mg/g,糖醛酸含量为213.07 mg/g,茶多酚含量为49.11 mg/g,茶蛋白含量为87.71 mg/g。杨新河等[14]对得茯砖茶、青砖茶、六堡砖茶、康砖茶、普洱茶和千两茶6种黑茶组成成分进行分析,结果发现六种黑茶多糖中性糖、蛋白质、糖醛酸和多酚四种成分含量范围分别为502.49~632.87、45.45~104.84、183.44~229.16、14.94~100.83 mg/g,本实验结果与之相符。
表 5 六堡砖茶多糖的中性糖、多酚、糖醛酸和蛋白质含量(mg/g)Table 5. Neutral sugars, polyphenols, glucuronic acid and protein contents of Liubao brick tea polysaccharides (mg/g)样品 中性糖 糖醛酸 茶多酚 茶蛋白 六堡砖茶多糖 639.39±1.96 213.07±4.45 49.11±1.1 87.71±1.52 2.5 六堡砖茶多糖的体外免疫调节活性的研究
2.5.1 六堡砖茶多糖对小鼠巨噬细胞RAW264.7细胞活力的影响
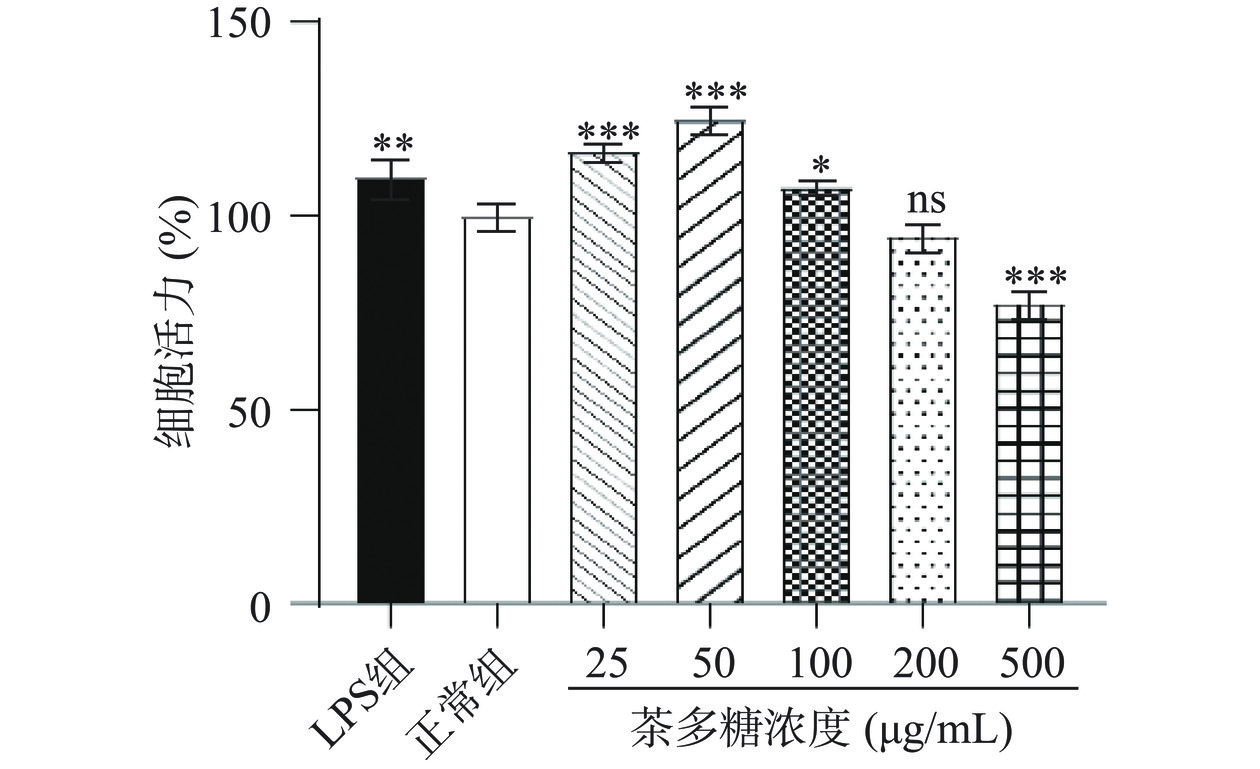
RAW264.7是一种小鼠巨噬细胞系,被广泛用于研究与代谢相关的免疫调节与炎症反应[22]。本研究通过MTT法测定六堡砖茶多糖对RAW264.7细胞存活率的影响。由图3可知,与正常组相比,六堡砖茶多糖浓度为25、50和100 μg/mL时,对细胞活力具有促进作用,细胞存活率分别为116.45%、125.82%和107.67%;当浓度为200 μg/mL时,细胞存活率为95.43%,但与正常组无显著性差异(P>0.05);当浓度为500 μg/mL时,细胞存活率为77.67%,与正常组比显著下降。因此,为更好地研究六堡砖茶多糖的免疫调节活性,选择50和200 μg/mL作为茶多糖低剂量组与高剂量组开展后续实验。
2.5.2 六堡砖茶多糖对RAW264.7细胞吞噬能力及NO产生量的影响
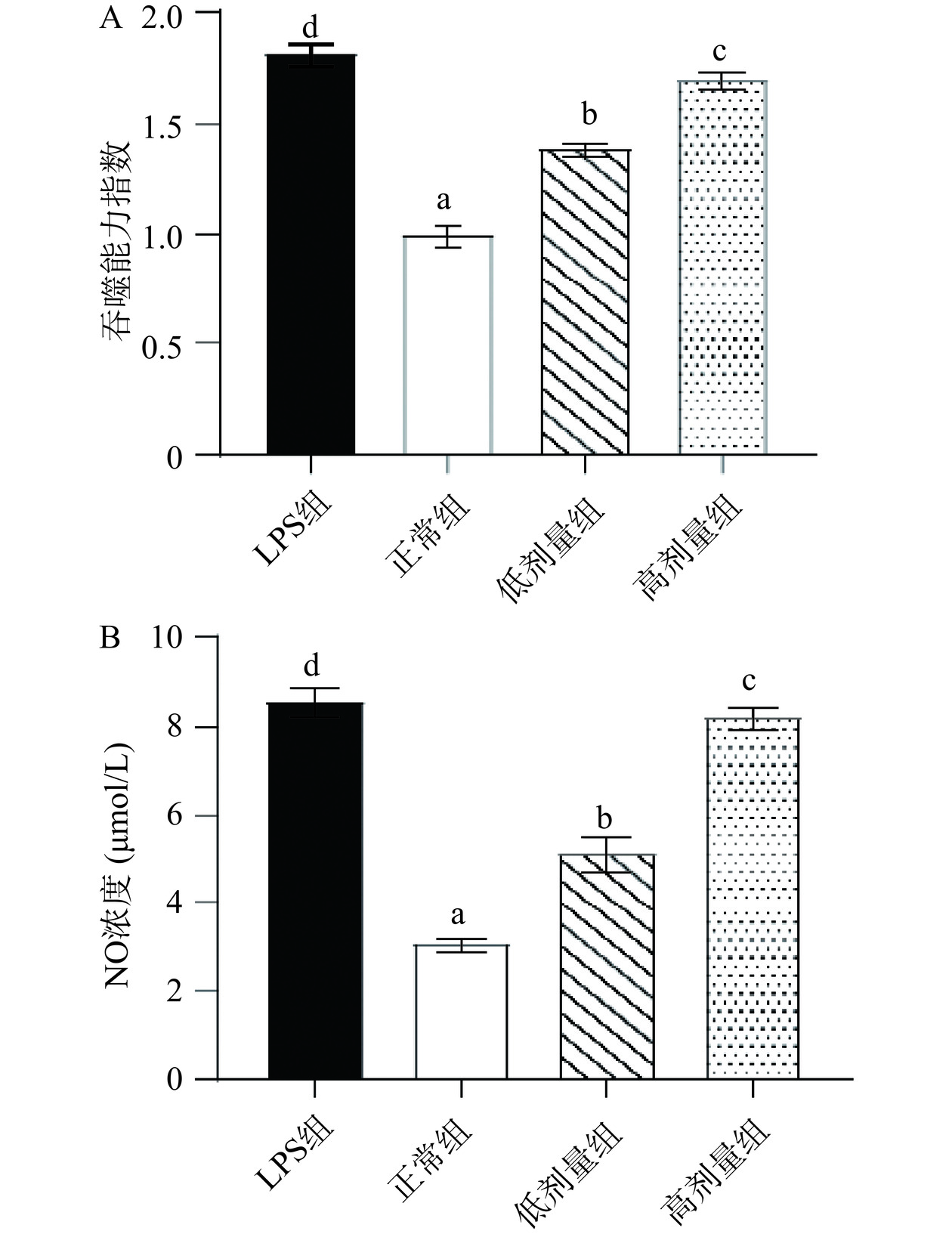
巨噬细胞在体内通过吞噬作用发挥免疫调节功能,在受到刺激时,其吞噬功能会随之发生变化,因此测定巨噬细胞的吞噬功能可以评价药物的免疫活性[23]。如图4所示,与正常组相比,六堡砖茶多糖在50和200 μg/mL浓度时,均可显著促进RAW 264.7细胞吞噬能力,分别是正常组1.39和1.70倍。同样,炎症介质NO可以促进炎症细胞因子的释放,是炎症细胞加重炎症反应的关键酶[24]。图4结果显示,与正常组NO产生量(3.08 μmoL/L)相比,六堡砖茶多糖在50和200 μg/mL浓度时,均可显著(P<0.05)促进RAW264.7细胞产生NO,其NO产生量分别为5.14和8.20 μmol/L。由此可见,高浓度六堡砖茶多糖对RAW264.7细胞吞噬能力及NO产生量的调节效果更为显著。与之相似,袁旭霜等[25]发现茯砖茶多糖可通过增强细胞吞噬能力,促进NO分泌,以此发挥免疫调节作用。
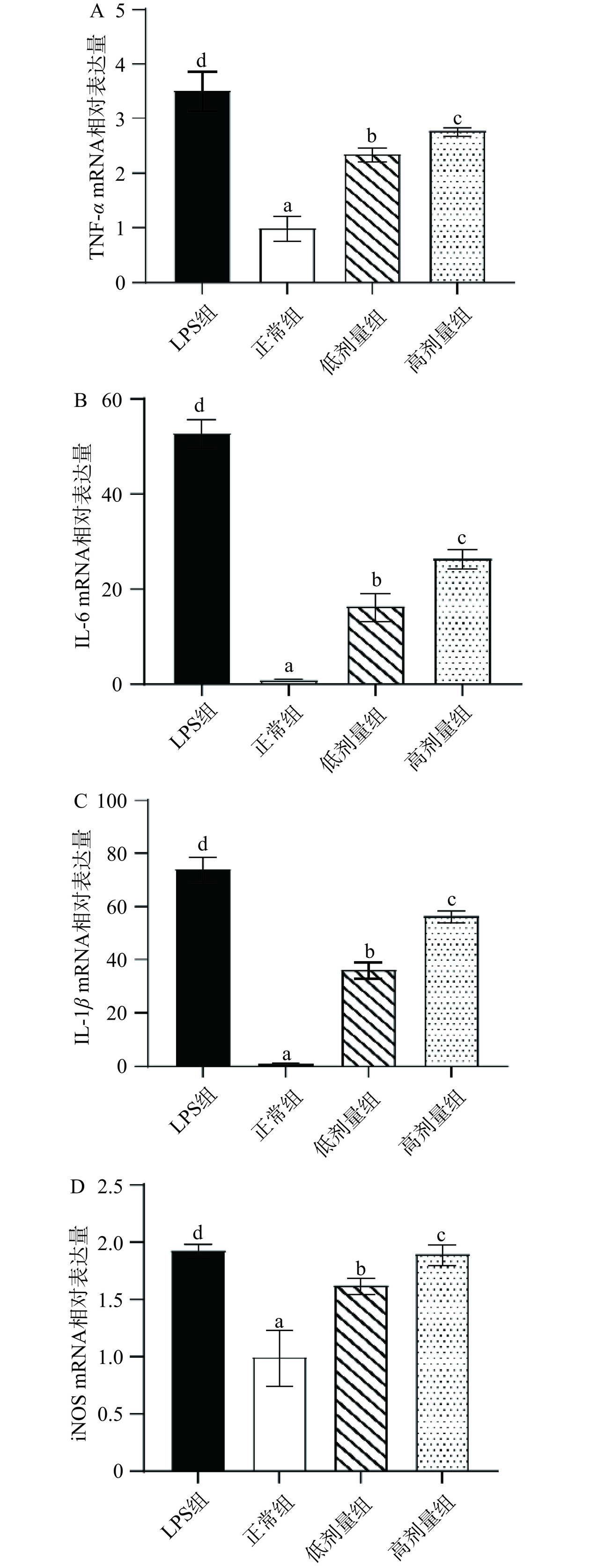
2.5.3 六堡砖茶多糖对RAW264.7细胞炎症因子mRNA表达水平的影响
本研究通过测定TNF-α、IL-6、IL-1β、iNOS mRNA的表达水平,以明晰六堡砖茶多糖对RAW264.7细胞炎症因子转录水平的调控作用。如图5所示,与正常组相比,低剂量及高剂量的六堡砖茶多糖均可显著(P<0.05)提升TNF-α、IL-6、IL-1β、iNOS mRNA的表达水平,其中高剂量即200 μg/mL浓度效果更为显著。Wu等[26]发现,六安瓜片茶多糖可以剂量依赖性地促进TNF-α、IL-6、IL-1β的释放。茯砖茶多糖显示出类似的活性[27]。RAW264.7细胞可产生NO、TNF-α、IL-6、IL-1β等各种炎症因子,这些因子的产生可有效激活其他免疫细胞,进而发挥免疫功能[28]。iNOS是NO合成的限速酶,是巨噬细胞激活的重要标志[24]。此结果表明,六堡砖茶多糖可通过调节相关炎症因子的表达,发挥免疫调节作用。
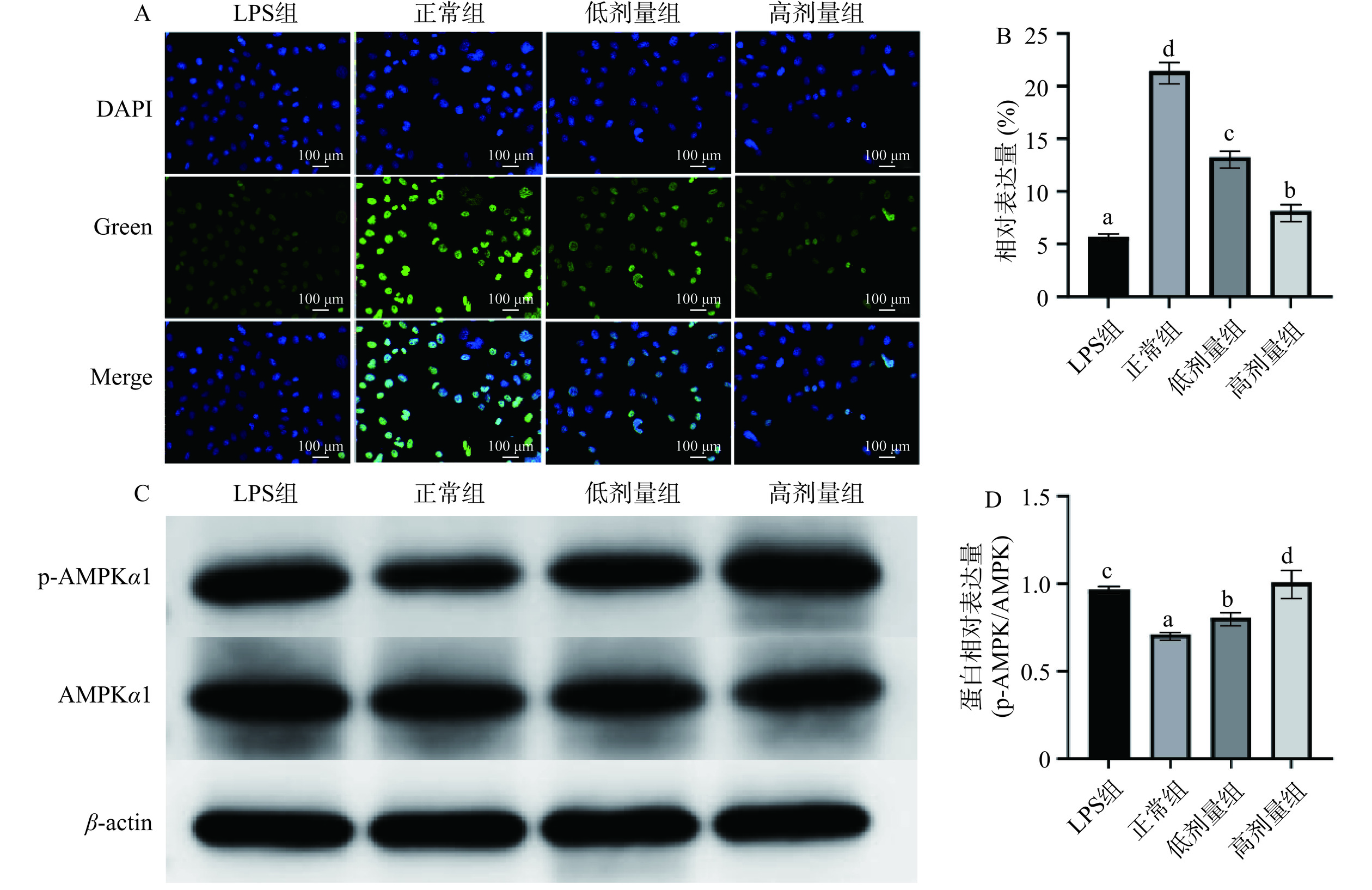
2.5.4 六堡砖茶多糖对RAW264.7细胞关键通路NF-кB/AMPK的表达
为进一步探究六堡砖茶多糖免疫调节活性的作用机制,研究通过TUNEL法检测核内蛋白NF-кB表达,Western blot检测AMPK及p-AMPK蛋白表达水平。由图6A~图6B可知,与正常组相比,50及200 μg/mL六堡砖茶多糖处理RAW264.7细胞后,能显著抑制核内蛋白NF-кB表达,图6C~图6D显示,六堡砖茶多糖可增强AMPK蛋白的磷酸化水平。NF-κB在免疫调节及炎症反应中起重要作用。NF-κB的激活会启动各种炎症因子基因的转录,致大量炎症因子的释放[29]。AMPK作为细胞能量代谢的关键调节因子,在细胞的增殖、分化、凋亡等方面都起着十分重要的作用[30]。Wang等[31]发现红花黄可通过NF-κB/SIRT1/AMPK信号通路来缓解骨关节炎并预防炎症。
3. 结论
本研究通过单因素实验及响应面优化试验,确定了六堡砖茶多糖提取最优方案:提取温度91.11 ℃,料液比1:15.45,乙醇浓度82.84%,多糖得率为8.62%。RAW264.7细胞模型实验表明,六堡砖茶多糖具有免疫调节的特性,表现在促进吞噬作用增强及NO的释放,并通过NF-кB/AMPK信号通路,上调iNOS、TNF-α、IL-6、IL-1β mRNA表达,且高剂量下效果更好。据此,通过对六堡砖茶多糖提取工艺及体外免疫活性的研究,为进一步深入挖掘其免疫机制提供一定研究基础。
-
表 1 Box-Behnken设计因素水平及编码值
Table 1 Factor levels and coding values of Box-Behnken
水平 因素 A 提取温度(℃) B 料液比(g/mL) C 乙醇浓度(%) −1 80 1:10 70 0 90 1:15 80 1 100 1:20 90 表 2 引物序列
Table 2 Sequences of the primers
引物名称 引物序列 iNOS 5’端 AGCCAAGCCCTCACCTACTT 3’端 GCCTCCAATCTCTGCCTATC TNF-α 5’端 TATGGCTCAGGGTCCAACTC 3’端 GGAAAGCCCATTTGAGTCCT IL-6 5’端 CACGGCCTTCCCTACTTCAC 3’端 TGCAAGTGCATCATCGTTGT IL-1β 5’端 GTTGACGGACCCCAAAAGAT 3’端 CCTCATCCTGGAAGGTCCAC β-actin 5’端 ATGTGGATCAGCAAGCAGGA 3’端 ATGTGGATCAGCAAGCAGGA 表 3 响应面试验设计及结果
Table 3 Design and results of response surface experimental
实验号 因素 多糖得率(%) A B C 1 −1 0 −1 5.57 2 1 0 −1 6.07 3 0 0 0 8.86 4 1 −1 0 5.78 5 1 0 1 6.56 6 0 1 −1 6.83 7 0 −1 −1 6.07 8 0 −1 1 6.45 9 0 1 1 7.26 10 −1 1 0 4.85 11 0 0 0 8.41 12 0 0 0 8.56 13 −1 0 1 5.85 14 0 0 0 8.31 15 −1 −1 0 4.18 16 0 0 0 8.58 17 1 1 0 5.69 表 4 回归方程的方差分析
Table 4 Analysis of variance
方差来源 平方和 自由度 均方 F P 显著性 模型 31.54 9 3.5 50.47 <0.0001 显著 A-提取温度 1.67 1 1.67 23.99 0.0018 显著 B-料液比 0.5778 1 0.5778 8.32 0.0235 显著 C-乙醇浓度 0.312 1 0.312 4.5 0.0717 不显著 AB 0.1444 1 0.1444 2.08 0.1924 不显著 AC 0.011 1 0.011 0.1588 0.7021 不显著 BC 0.0006 1 0.0006 0.009 0.9271 不显著 A² 17.34 1 17.34 249.82 <0.0001 显著 B² 8.13 1 8.13 117.1 <0.0001 显著 C² 1.06 1 1.06 15.28 0.0058 显著 残差 0.4859 7 0.0694 失拟项 0.3118 3 0.1039 2.39 0.2097 不显著 纯误差 0.1741 4 0.0435 总值 32.02 16 R²= 0.9848 R²Adj=0.9653 R²Pre=0.8357 信噪比=21.4471 表 5 六堡砖茶多糖的中性糖、多酚、糖醛酸和蛋白质含量(mg/g)
Table 5 Neutral sugars, polyphenols, glucuronic acid and protein contents of Liubao brick tea polysaccharides (mg/g)
样品 中性糖 糖醛酸 茶多酚 茶蛋白 六堡砖茶多糖 639.39±1.96 213.07±4.45 49.11±1.1 87.71±1.52 -
[1] ZHU M Z, LI N, ZHOU F, et al. Microbial bioconversion of the chemical components in dark tea[J]. Food Chemistry,2020,312:126043. doi: 10.1016/j.foodchem.2019.126043
[2] ZHU J X, WU M R, ZHOU H, et al. Liubao brick tea activates the PI3K-Akt signaling pathway to lower blood glucose, metabolic disorders and insulin resistance via altering the intestinal flora[J]. Food Research International,2021,148:110594. doi: 10.1016/j.foodres.2021.110594
[3] MAO Y, WEI B Y, TENG J W, et al. Polysaccharides from Chinese liupao dark tea and their protective effect against hyperlipidemia[J]. International Journal of Food Science & Technology,2018,53(3):599−607.
[4] WEI L, HUANG L, DU L J, et al. Structural characterization and in vitro antioxidant, hypoglycemic and hypolipemic activities of a natural polysaccharide from liupao tea[J]. Foods,2023,12(11):2226−2245. doi: 10.3390/foods12112226
[5] QIN H N, HUANG L, TENG J W, et al. Purification, characterization, and bioactivity of Liupao tea polysaccharides before and after fermentation[J]. Food Chemistry,2021,353:129419. doi: 10.1016/j.foodchem.2021.129419
[6] LI Q, LIU L, ZHANG J H, et al. Effects of pile fermentation on the physicochemical, functional, and biological properties of tea polysaccharides[J]. Food Chemistry,2023,410:135353. doi: 10.1016/j.foodchem.2022.135353
[7] XIANG G, SUN H P, CHEN Y Y, et al. Antioxidant and hypoglycemic activity of tea polysaccharides with different degrees of fermentation[J]. International Journal of Biological Macromolecules,2022,228:224−233.
[8] FAN Y M, ZHOU X F, HUANG G L. Preparation, structure, and properties of tea polysaccharide[J]. Chemical Biology & Drug Design,2021,99(1):75−82.
[9] SUN Y J, WANG F, LIU Y, et al. Microbiome-metabolome responses of Fuzhuan brick tea crude polysaccharides with immune-protective benefit in cyclophosphamide-induced immunosuppressive mice[J]. Food Research International,2022,157:111370. doi: 10.1016/j.foodres.2022.111370
[10] RODRÍGUEZ C, MUÑOZ M, CONTRERAS C, et al. AMPK, metabolism, and vascular function[J]. The FEBS Journal,2021,288(12):3746−3771. doi: 10.1111/febs.15863
[11] LU J Z, CHEN X, ZHANG Y Y, et al. Astragalus polysaccharide induces anti-inflammatory effects dependent on AMPK activity in palmitate-treated RAW264.7 cells[J]. International Journal of Molecular Medicine,2013,31(6):1463−1470. doi: 10.3892/ijmm.2013.1335
[12] ZHU J X, ZHOU H, ZHANG J Y, et al. Valorization of polysaccharides obtained from dark tea:preparation, physicochemical, antioxidant, and hypoglycemic properties[J]. Foods,2021,10(10):2276−2296. doi: 10.3390/foods10102276
[13] ZHU J X, CHEN Z Y, CHEN L, et al. Comparison and structural characterization of polysaccharides from natural and artificial Se-enriched green tea[J]. International Journal of Biological Macromolecules,2019,130:388−398. doi: 10.1016/j.ijbiomac.2019.02.102
[14] 杨新河, 黄明军, 马蔚, 等. 不同黑茶多糖的组成分析及其抗氧化活性[J]. 食品工业科技,2017,38(20):16−20. [YANG Xinhe, HUANG Mingjun, MA Wei, et al. Composition and antioxidant activity of polysaccharides of different dark tea[J]. Science and Technology of Food Industry,2017,38(20):16−20.] YANG Xinhe, HUANG Mingjun, MA Wei, et al. Composition and antioxidant activity of polysaccharides of different dark tea[J]. Science and Technology of Food Industry, 2017, 38(20): 16−20.
[15] 中华全国供销合作总社. GB/T 8313-2018茶叶中茶多酚和儿茶素类含量的检测方法[S]. 北京:中国标准出版社, 2018:2−5. [All China Federation of Supply and Marketing Cooperatives. GB/T 8313-2018 Determination method for the content of tea polyphenols and catechins in tea[S]. Beijing:China Standard Press, 2018:2−5.] All China Federation of Supply and Marketing Cooperatives. GB/T 8313-2018 Determination method for the content of tea polyphenols and catechins in tea[S]. Beijing: China Standard Press, 2018: 2−5.
[16] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248−254. doi: 10.1016/0003-2697(76)90527-3
[17] SUN Y J, WANG F, LIU Y, et al. Comparison of water- and alkali-extracted polysaccharides from Fuzhuan brick tea and their immunomodulatory effects in vitro and in vivo[J]. Food & Function,2022,13(2):806−824.
[18] TRAJKOVIC K, JEONG H, KRAINC D. Mutant huntingtin is secreted via a late endosomal/lysosomal unconventional secretory pathway[J]. Journal of Neuroscience,2017,37(37):9000−9012. doi: 10.1523/JNEUROSCI.0118-17.2017
[19] 燕航, 钟耀广. 影响香菇多糖提取的因素研究[J]. 现代食品科技,2006(2):179−180. [YAN Hang, ZHONG Yaoguang. The study on extraction of polysaccharides from Lentinus[J]. Modern Food Science & Technology,2006(2):179−180.] YAN Hang, ZHONG Yaoguang. The study on extraction of polysaccharides from Lentinus[J]. Modern Food Science & Technology, 2006(2): 179−180.
[20] YANG Y, YANG M H, ZHOU X, et al. Optimization of extraction process of polysaccharides MAP-2 from opuntia milpa alta by response surface methodology and evaluation of its potential as α-glucosidase inhibitor[J]. Foods,2022,11(21):3530−3547. doi: 10.3390/foods11213530
[21] 杨燕敏, 郑振佳, 高琳, 等. 红枣多糖超声波提取, 结构表征及抗氧化活性评价[J]. 食品与发酵工业,2021,47(5):120−126. [YANG Yanmin, ZHENG Zhenjia, GAO Lin, et al. Ultrasonic extraction of jujube polysaccharide and its structure and antioxidant activity characterization[J]. Food and Fermentation Industries,2021,47(5):120−126.] YANG Yanmin, ZHENG Zhenjia, GAO Lin, et al. Ultrasonic extraction of jujube polysaccharide and its structure and antioxidant activity characterization[J]. Food and Fermentation Industries, 2021, 47(5): 120−126.
[22] KHATUA S, SIMAL-GANDARA J, ACHARYA K. Understanding immune-modulatory efficacy in vitro[J]. Chemico-biological interactions,2022,352:109776. doi: 10.1016/j.cbi.2021.109776
[23] SUN Y J, GONG G P, GUO Y M, et al. Purification, structural features and immunostimulatory activity of novel polysaccharides from Caulerpa lentillifera[J]. International Journal of Biological Macromolecules,2018,108:314−323. doi: 10.1016/j.ijbiomac.2017.12.016
[24] REZAEI M, GHAFOURI H, AGHAMAALI M R, et al. Thiazolidinedione derivative suppresses LPS-induced COX-2 expression and NO production in RAW264.7 macrophages[J]. Iranian Journal of Pharmaceutical Research:IJPR,2019,18(3):1371−1379.
[25] 袁旭霜, 慕妍璐, 王凡, 等. 茯茶多糖的消化特性和体外免疫调节活性比较研究[J]. 陕西科技大学学报,2023,41(1):45−51,65. [YUAN Xushuang, MU Yanlu, WANG Fan, et al. Comparative study on digestive properties and in vitro immunomodulatory activity of Fu Brick tea polysaccharides[J]. Journal of Shaanxi University of Science & Technology,2023,41(1):45−51,65.] doi: 10.3969/j.issn.1000-5811.2023.01.007 YUAN Xushuang, MU Yanlu, WANG Fan, et al. Comparative study on digestive properties and in vitro immunomodulatory activity of Fu Brick tea polysaccharides[J]. Journal of Shaanxi University of Science & Technology, 2023, 41(1): 45−51,65. doi: 10.3969/j.issn.1000-5811.2023.01.007
[26] WU Z, WANG D, LIU C X, et al. Macrophage immunity promotion effect of polysaccharide LGP-1 from Guapian tea via PI3K/AKT and NF-κB signaling pathway[J]. Journal of Functional Foods, 2022, 89:104946.
[27] CHEN G J, BAI Y X, ZENG Z Q, et al. Structural characterization and immunostimulatory activity of heteropolysaccharides from fuzhuan brick tea[J]. Journal of Agricultural and Food Chemistry,2021,69(4):1368−1378. doi: 10.1021/acs.jafc.0c06913
[28] 杨大俏, 王锦旭, 李来好, 等. 近江牡蛎多糖的结构鉴定及免疫调节能力分析[J]. 食品科学,2020,41(10):38−46. [YANG Daqiao, WANG Jinxu, LI Laihao, et al. Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J]. Food Science,2020,41(10):38−46.] doi: 10.7506/spkx1002-6630-20190524-295 YANG Daqiao, WANG Jinxu, LI Laihao, et al. Structural analysis and immunoregulatory activity of polysaccharides from Crassostrea rivularis[J]. Food Science, 2020, 41(10): 38−46. doi: 10.7506/spkx1002-6630-20190524-295
[29] HAN B H, LEE Y J, YOON J J, et al. Hwangryunhaedoktang exerts anti-inflammation on LPS-induced NO production by suppressing MAPK and NF-κB activation in RAW264.7 macrophages[J]. Journal of Integrative Medicine,2017,15(4):326−336. doi: 10.1016/S2095-4964(17)60350-9
[30] LYONS C L, ROCHE H M. Nutritional modulation of AMPK-impact upon metabolic-inflammation[J]. International Journal of Molecular Sciences,2018,19(10):3092−3108. doi: 10.3390/ijms19103092
[31] WANG C L, GAO Y, ZHANG Z K, et al. Safflower yellow alleviates osteoarthritis and prevents inflammation by inhibiting PGE2 release and regulating NF-κB/SIRT1/AMPK signaling pathways[J]. Phytomedicine:International Journal of Phytotherapy and Phytopharmacology,2020,78:153305. doi: 10.1016/j.phymed.2020.153305
-
期刊类型引用(3)
1. 曾鸿哲,文帅,方雯雯,万丽玮,彭丽媛,杨小妹,白其娴,刘林美,饶慧,黄建安,刘仲华. 茶叶活性成分健康功能研究新进展. 中国茶叶. 2025(02): 1-13 .  百度学术
百度学术
2. 班振,许凯柔. 基于超高效液相色谱-串联四极杆静电场轨道阱质谱法对六堡茶中化学成分进行快速鉴定. 食品安全质量检测学报. 2025(04): 264-271 .  百度学术
百度学术
3. 罗雨菲,黄秀壁,苏芬安,谭义秋,陈永,刘小玲. 姑辽茶粗多糖提取工艺优化及其免疫调节活性评价. 食品工业科技. 2024(23): 161-169 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:
 下载:
下载:



