Optimization of Ultrasound Assisted Tenderizing Agents for Improving the Meat Tenderness of Eliminated Hen and Its Effects on Meat Qualities
-
摘要: 为筛选针对家禽养殖场大量淘汰蛋鸡的肉质嫩化处理方式,采用超声联合氯化钙、生物酶法对鸡胸肉进行嫩化,以剪切力为关键指标,筛选最佳超声参数,并重点分析了质构、保水性、蛋白分布、总巯基与氨基酸含量以及微观结构变化。结果显示,最佳超声参数为超声240 W、频率22 kHz、水浴温度35 ℃和处理时长10 min。相比于未处理组,超声联合蛋白酶处理后的鸡胸肉剪切力显著(P<0.05)降低64.02%。鸡胸肉的硬度、胶黏性和咀嚼性下降,其中咀嚼性显著(P<0.05)降低56.54%,降低效果明显优于氯化钙。同时,肉的蒸煮损失与离心损失程度也低于氯化钙。电泳结果显示,116 kDa附近大分子肌球蛋白重链降解,部分肌原纤维蛋白分解。其中,总巯基含量也不断降低,鸡胸肉蛋白发生氧化。当超声功率继续提升至300 W时,鸡胸肉中必需氨基酸苏氨酸、缬氨酸和赖氨酸含量显著(P<0.05)降低。微观结构观察显示,鸡胸肉的表观与截面结构发生崩解、深层肌纤维分离、分解与断裂。综上,超声联合蛋白酶处理后的鸡胸肉嫩度与品质得到显著改善。Abstract: In order to screen for meat tenderization treatment methods targeting a large number of eliminated laying hens in poultry farms, the ultrasound combined with calcium chloride and biological enzyme methods were used to tenderize chicken breast meat. The shear force was chosen as the key indicator, and the optimal ultrasound parameters were selected. The texture, water retention, protein distribution, total thiol and amino acid contents as well as the microstructure changes were mainly analyzed. Results showed that the optimal ultrasound parameters were ultrasound of 240 W, frequency of 22 kHz, water bath temperature of 35 ℃, and treatment time of 10 minutes. Compared to the untreated group, the shear force of chicken breast meat significantly decreased (P<0.05) by 64.02% after the ultrasound combined with protease treatment. The hardness, stickiness, and chewiness of chicken breast meat decreased, with a significant reduction (P<0.05) of 56.54% in chewiness, which was significantly better than that of calcium chloride. Meanwhile, the degree of cooking loss and centrifugation loss of meat were also lower than that of calcium chloride. The electrophoresis results showed that the high molecular weight myosin heavy chain was degraded near 116 kDa, indicating that some myofibrillar proteins were decomposed. Among them, the total thiol content also continuously decreased, and the chicken proteins were oxidized. When the ultrasound power continued to increase to 300 W, the content of essential amino acids threonine, valine, and lysine in chicken breast meat significantly decreased (P<0.05). Microscopic observation showed that the apparent and cross-sectional structures of chicken breast meat underwent disintegration, deep muscle fiber separation, decomposition, and fracture. In summary, the tenderness and quality of chicken breast meat were significantly improved after ultrasound combined with protease treatment.
-
Keywords:
- ultrasound /
- tenderization /
- chicken breast meat /
- protease /
- calcium chloride /
- myofibrillar protein /
- amino acid /
- microstructure
-
鸡肉是我国居民经常食用的优质禽肉类来源,鸡肉产业也是中国第二大肉类产业,城乡居民在过去20年间禽肉消费量提高了近5倍[1]。其中淘汰蛋鸡产肉量占比约13%,它是蛋鸡养殖经济收入的重要组成部分。所以提升鸡肉嫩度、提高鸡肉品质以增加淘汰蛋鸡经济价值十分必要[2]。一只肉鸡可分别产出鸡架(占比约为16%~17%)、鸡胸肉(19%~23%)、鸡腿(24%~26%)和副产品(12%~13%)等[3]。其中,鸡架由于成本低廉,可用作高汤的主要原料;鸡头、骨头、内脏、羽毛等副产品可用于脂类、酶类和蛋白质的提取;鸡腿肉由于其本身肌纤维直径小、嫩度高,是禽肉主力消费品;而鸡胸肉肌纤维较粗、肉质老、持水性与口感一般,这影响了消费者对其接受度与购买力,制约了鸡肉产业的平衡发展。因此,如何改善淘汰蛋鸡鸡胸肉品质、提高其食用嫩度,一直是家禽产业持续关注的热点问题[4]。
目前,可用于肉质嫩化、改善肌纤维中结缔组织分布、减弱肌纤维之间相互作用力的主要方法有物理加工法、化学浸泡法与生物酶解法。物理加工法包括超高压处理[5]、机械滚揉[6]、电流刺激[7]和超声加工[8]等,主要通过物理学效应达到降低肌纤维剪切力的目的。化学浸泡法可利用磷酸盐、氯化钙和氯化钠等盐离子改善肌肉组织的离子浓度与分布,降低组织剪切力[9]。生物酶解法是指通过外源添加的蛋白酶酶解作用,将肌肉中结缔组织、大分子量蛋白水解,从而减弱肌肉剪切阻力、提高嫩化品质[10]。采用单一嫩化方式处理肉制品的研究较多,效果也较好。但是单一处理方式存在设备功耗高、化学试剂残留偏高或生物试剂成本高的问题。尤其对于物理设备来说,若想取得优良的嫩化效果,调高功率带来的不仅是能耗问题,还可能引起肉样表面结构的变化,降低其感官品质。因此,采用物理手段与化学或生物试剂联合嫩化的处理方式,逐渐成为肉制品嫩化加工领域优选的方向。
超声处理过程中产生的机械与空化效应,在嫩化肉样的同时,也有利于外源生化试剂的扩散,起到增强协同的效果[11]。鉴于此,本研究采用超声联合氯化钙、生物酶法对鸡胸肉进行嫩化实验,以剪切力为关键指标,通过各因素优化的方式筛选最佳超声作用参数。同时,重点比较了超声环境下氯化钙与蛋白酶对肉样嫩度的影响,筛选出最佳嫩化剂类型与用量,并分析出肉样的质构、保水性、肌原纤维蛋白分布、总巯基含量、氨基酸含量以及表观与截面显微结构的变化,旨在保持嫩化效果的同时,最大程度地降低损耗、减少试剂残留率与使用成本、提高蛋白品质,为淘汰蛋鸡肉的高价值利用乃至鸡肉产业绿色健康发展提供基于超声低损嫩化处理的思路。
1. 材料与方法
1.1 材料与仪器
鸡胸肉 源于黄羽蛋鸡,饲料喂养,自由采食,超400日龄,产自本校红旗大道校区内的江苏现代畜牧科技园畜禽养殖基地;氯化钙、磷酸二氢钠、尿素、氯化钾、磷酸氢二钠、戊二醛、盐酸、氯化钠、乙二胺四乙酸二钠、牛血清白蛋白、无水乙醇、乙酸异戊酯、考马斯亮蓝R-250、5,5'-二硫代双(2-硝基苯甲酸,DTNB) 国药集团化学试剂有限公司;中性蛋白酶(50 U/mg) 上海阿拉丁生化科技股份有限公司;甘氨酸、三羟甲基氨基甲烷、5×蛋白上样缓冲液、Lowry法蛋白浓度测定试剂盒 生工生物工程(上海)股份有限公司;聚丙烯凝胶配制试剂盒 江苏碧云天高新技术有限公司。
KQ-300VSM型超声波设备(10 L) 昆山市超声仪器有限公司;T6型紫外可见光分光光度计 北京普析通用仪器有限责任公司;TMS-PRO型食品物性分析仪 美国FTC公司;HT9815四通道热电偶测温仪 东莞市鑫泰仪器仪表有限公司;0.1 mg精密分析天平 德国赛多利斯公司;HH-6型水浴锅 常州荣华仪器制造有限公司;Multiskan FC酶标仪 美国Thermo Fisher公司;EX30型光学显微镜 北京舜宇光学科技(集团)有限公司;F6/10 L型便携式高速匀浆机 上海净信实业发展有限公司;5810R型台式冷冻离心机 德国Eppendorf公司;LA8080全自动氨基酸分析仪 日本日立高新技术科学株式会社;JSM-7800F场发射扫描电子显微镜 日本电子株式会社。
1.2 实验方法
1.2.1 试样准备与实验分组
鸡胸肉去除表面筋膜和结缔组织,切分成30×30×30 mm肉块,吸干水分、随机分组。分为三组:未处理组:新鲜肉样;无超声组:仅添加氯化钙或中性蛋白酶的嫩化剂组,未施加超声场;超声组:60、120、180、240和300 W。表示既施加超声场,又在每个功率下协同添加氯化钙或中性蛋白酶嫩化剂。
氯化钙与中性蛋白酶配制成不同浓度的溶液后,利用注射器分5次将2.5 mL溶液均匀地注射进同一肉块内的不同部位,利用塑封袋抽真空密封后,置于超声波设备中进行嫩化。所有三组鸡胸肉在完成嫩化处理后,继续静置30 min,再进行指标测定。
1.2.2 试验参数优化与筛选
1.2.2.1 超声功率对肉样剪切力的影响
在超声处理时间为10 min,超声处理温度为15 ℃,超声处理频率为22 kHz的条件下,对样品分别进行功率为60、120、180、240和300 W的超声处理。
1.2.2.2 超声频率对肉样剪切力的影响
在超声功率为180 W、超声处理时间为10 min、超声处理温度为15℃的条件下,对样品分别进行单频22 kHz、单频40 kHz、22/40 kHz交替10 s、22/40 kHz交替20 s、22/40 kHz交替30 s的超声处理。超声频率的选择参考了文献[12-13]的研究方法。
1.2.2.3 超声时间对肉样剪切力的影响
在超声功率180 W、超声频率22 kHz、处理温度为15 ℃的条件下,对样品分别进行5、10、15、20和25 min的超声处理。
1.2.2.4 超声处理温度对肉样剪切力的影响
在超声功率180 W、超声频率22 kHz、超声时间10 min的条件下,对样品分别进行15、20、25、30、35、40 ℃的超声处理。
1.2.2.5 超声协同氯化钙对肉样剪切力的影响
在最佳超声功率、超声频率、超声时间和超声温度的条件下,将已均匀注射0.5%、1.0%、1.5%、2.0%、2.5%和3.0%(w/v)浓度氯化钙溶液并真空包装的鸡胸肉块放入超声设备中进行嫩化处理。
1.2.2.6 超声协同中性蛋白酶对肉样剪切力的影响
在最佳超声功率、超声频率、超声时间和超声温度的条件下,将已均匀注射0.5%、1.0%、1.5%、2.0%、2.5%和3.0%(w/v)浓度中性蛋白酶溶液并真空包装的鸡胸肉块放入超声设备中进行嫩化处理。
1.2.3 剪切力测定
剪切力测定依据NY/T 1180-2006《肉嫩度的测定 剪切力测定法》[14]进行。先擦干经过处理的肉样表面水分,将热电偶温度计探头插入待测样品中心位置,用样品袋包裹后置于80 ℃恒温水浴锅中,待肉样中心温度达到70 ℃后,取出冷却至室温。用圆形钻孔(直径Φ=1.27 cm)沿肌肉纤维方向钻切样品,采用物性分析仪(配WBS刀具)进行剪切力测定。具体条件设定:测试速度为检测速度为1 mm/s、回程速度为2 mm/s、回程距离为60 mm、初始压力1 N。
1.2.4 质构指标
质构指标的测定参考Bakhsh等[15]方法并稍作改动。使用物性分析仪二次挤压模式进行测定。设定参数如下:初始触发力量1 N、压缩比40%、测定速度30 mm/min,二次下压时间间隔为5 s、测定后抬升速度60 mm/min,探头类型为P/36R。测定结束后记录肉样的弹性、胶黏性和咀嚼性。
1.2.5 保水性测定
1.2.5.1 蒸煮损失率测定
准确称取一定质量(m0)的肉样放入蒸煮袋中,在80 ℃水浴锅中加热至中心温度达到70 ℃,冷却至室温并沥干表面水分后再次称重,记为m1。按如下公式计算蒸煮损失率:
蒸煮损失率(%)=m0−m1m0×100 (1) 1.2.5.2 离心损失率测定
准确称取一定质量(m0)的肉样,吸干表面水分后用吸水纸包裹,置于50 mL离心管内,5000×g离心10 min后再次称重,记为m1。按如下公式计算离心损失率:
离心损失率(%)=m0−m1m0×100 (2) 1.2.6 肌原纤维蛋白提取与含量测定
1.2.6.1 蛋白提取
鸡胸肉肌原纤维蛋白根据Chen等[16]的方法提取,并稍微改动。称取2.00 g肉样置于研钵中,加入20 mL 20 mmol/L的磷酸盐缓冲液Ⅰ(含0.1 mol/L NaCl,1 mmol/L EDTA,pH7.0),捣碎并混匀后进行离心10 min(3000×g,4 ℃),重复清洗2次后,弃去上清液。沉淀蛋白用20 mL 25 mmol/L的磷酸盐缓冲液Ⅱ(含0.6 mol/L NaCl,pH7.0)溶解并离心10 min(6000×g,4 ℃),所得上清液为肌原纤维蛋白溶液,4 ℃保存。
1.2.6.2 浓度测定
将牛血清白蛋白(BSA)配制成5.0 mg/mL的工作液,按0、0.5、1.0、1.5、2.0和2.5 mg/mL的浓度进行稀释,取1 mL稀释后的BSA溶液与5 mL碱性铜试剂(由A液与B液按50:1混合后得到。其中,A液为4%碳酸钠溶液与0.2 mol/L氢氧化钠溶液等体积混匀;B液为1%硫酸铜溶液与2%酒石酸钾钠溶液等体积混匀)混匀,静置10 min后再快速混入0.5 mL福林酚试剂,30 ℃下显色30 min后于750 nm下测定吸光值,绘制标准曲线。样品溶液稀释2倍后按相同操作测定A750吸光值,根据标曲公式计算最终浓度。以蒸馏水替代肉样测定空白值。
1.2.7 聚丙烯酰胺凝胶电泳(Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis,SDS-PAGE)
将肉样的肌原纤维蛋白浓度调整至1 μg/μL,吸取8 μL样品与2 μL 5×蛋白上样缓冲液充分混匀,置于沸水浴中加热5 min,与中分子量蛋白Marker一并注入凝胶体系中(5%浓缩胶与12%分离胶)进行电泳(80 V,0.5 h;110 V,2 h)。待溴酚蓝线跑至与胶底距离0.5 cm时停止电泳,经考马斯R-250染色与乙醇脱色后,进行扫胶与分析。
1.2.8 总巯基含量测定
总巯基含量参照Peng等[17]的方法进行测定并稍作修改。将肌原纤维蛋白溶液用20 mmol/L磷酸缓冲液(含600 mmol/L KCl,10 mmol/EDTA,8 mol/L尿素,pH8.0)稀释至1 mg/mL。取4 mL蛋白混合液加入20 μL 5,5'-二硫代双(2-硝基苯甲酸)(DTNB,10 mmol/L),于37 ℃避光孵育20 min,在412 nm处测定吸光值。计算公式如下:
总巯基含量(µmol/g)=A×D×73.53b×C (3) 式中,A为412 nm处吸光值;D为稀释倍数;73.53为摩尔消光系数[MEC=13600,单位:L/(mol·cm)]的倒数(1/13600×106,单位:μmol·cm/L);b为光程,1 cm;C为蛋白质浓度,g/L。
1.2.9 氨基酸分析
淘汰蛋鸡肉的水解氨基酸含量根据Wu等[18]方法测定。采用全自动氨基酸分析仪对水解后的鸡胸肉进行氨基酸分析。称取10 mg样品并添加10 mL盐酸(6 mol/L),混合置于20 mL试管中,于110 ℃下恒温水解24 h。水解后的溶液经冷却定容至50 mL后,取1.0 mL进行离心浓缩,蒸发至干。继续添加1 mL样品稀释液后,过膜(0.22 μm)、上机检测。
1.2.10 表观与截面显微结构变化
根据Gao等[19]的方法进行处理。使用超薄刀片将肉样切为10×10×10 mm的立方体,经−80 ℃超低温速冻后,再切出1 mm厚的薄片置于载玻片上进行表观结构观察。
肌纤维截面结构观察参考Wang等[20]的方法。对实验处理后的鸡胸肉在4 ℃下固定(2.5%戊二醛)过夜,PBS缓冲溶液清洗3次后,进行乙醇梯度脱水(30%、50%、70%、90%、100%),乙酸异戊酯再清洗2次,−20 ℃冷冻过夜,再−80 ℃冻干24 h。取出后切成1 mm厚的切片,粘于载物台中央,喷金处理后,进行扫描电镜观察,放大倍数为200。
1.3 数据处理
所有指标数据均采用3次重复实验获取,以平均值±标准差(¯x±s)表示。使用SPSS 19.0统计分析软件进行相关性与显著性(P<0.05)分析,采用Origin 9.0图形软件进行图像绘制。
2. 结果与分析
2.1 超声波处理对鸡胸肉剪切力的影响
2.1.1 超声功率对鸡胸肉剪切力的影响
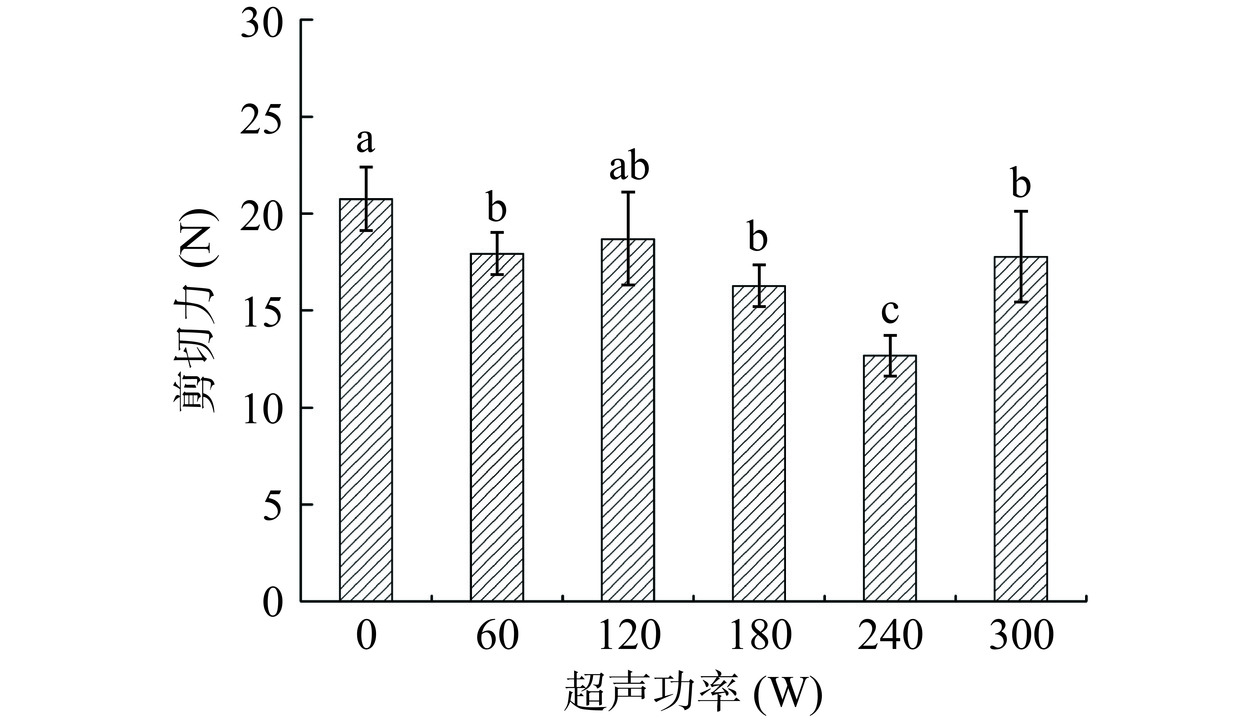
超声功率对鸡胸肉剪切力的影响见图1。与对照组相比,随着超声功率的不断增大,鸡胸肉的剪切力逐渐下降,在240 W时达到最低值12.68 N,此时肉质嫩度因超声空化效应导致的肌原纤维结构被破坏而减小。而当超声功率继续增加至300 W时,剪切力也随之提高,这是由于过高功率的超声波促使水分过多迁移与渗出,肉质保水性受到影响而下降所致[21]。因此,鸡胸肉的最佳超声嫩化功率选择为240 W。
2.1.2 超声频率对鸡胸肉剪切力的影响
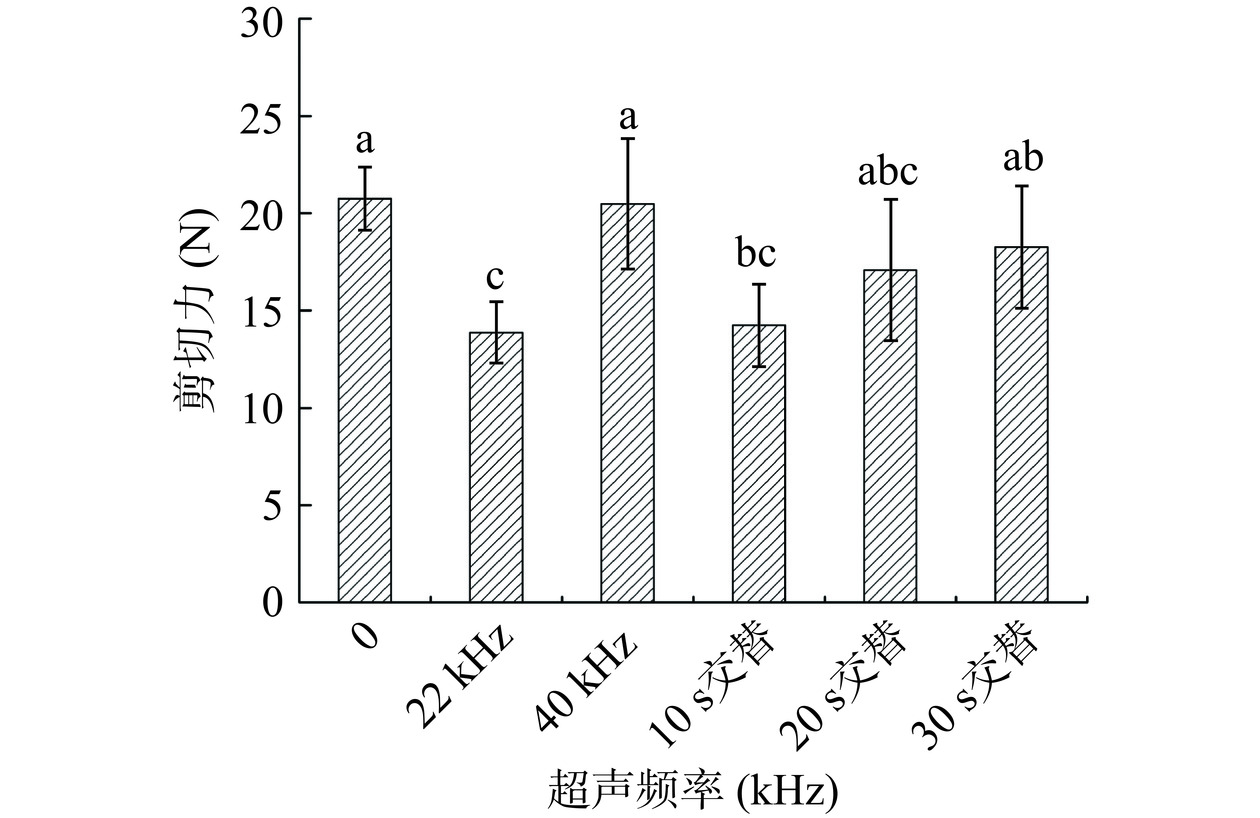
超声频率对鸡胸肉剪切力的影响见图2。在相同超声功率下,22 kHz超声频率比40 kHz对鸡胸肉剪切力的影响显著(P<0.05),这可能是由于超声在鸡肉组织中达到空化阈值的频率即为22 kHz,该处理频率与余海霞等[22]的研究结果一致。随着超声频率的增加,超声能不断增大,质点运动的加速度与超声振动频率的平方呈正比,频率增加引起的高加速度导致了肌肉组织的破坏[23],同时细胞间隙水分扩散速度也加快,逐渐压紧实的肌纤维束促使剪切力提升。在22/40 kHz交替处理模式下,22 kHz产生的空化核也可为40 kHz超声处理提供初始空化泡核心,空化效应增强[13]。频率相互交替变换的超声波能量利用率更高,传质效果更强[24],对肌纤维的拉扯能力提高。因此,在10 s交替处理时,鸡胸肉的剪切力也显著(P<0.05)下降;但20 s和30 s交替时,尽管依然呈现下降的趋势,但与40 kHz下的剪切力无显著性差异,这可能是交替时间过长,空化核在还未切换至下一频率的超声前就已经湮灭,削弱了交替双频的空化能力。考虑到超声处理的操作便捷性与实际剪切力降低效果,选择22 kHz作为鸡胸肉的超声嫩化频率。
2.1.3 超声时间对鸡胸肉剪切力的影响
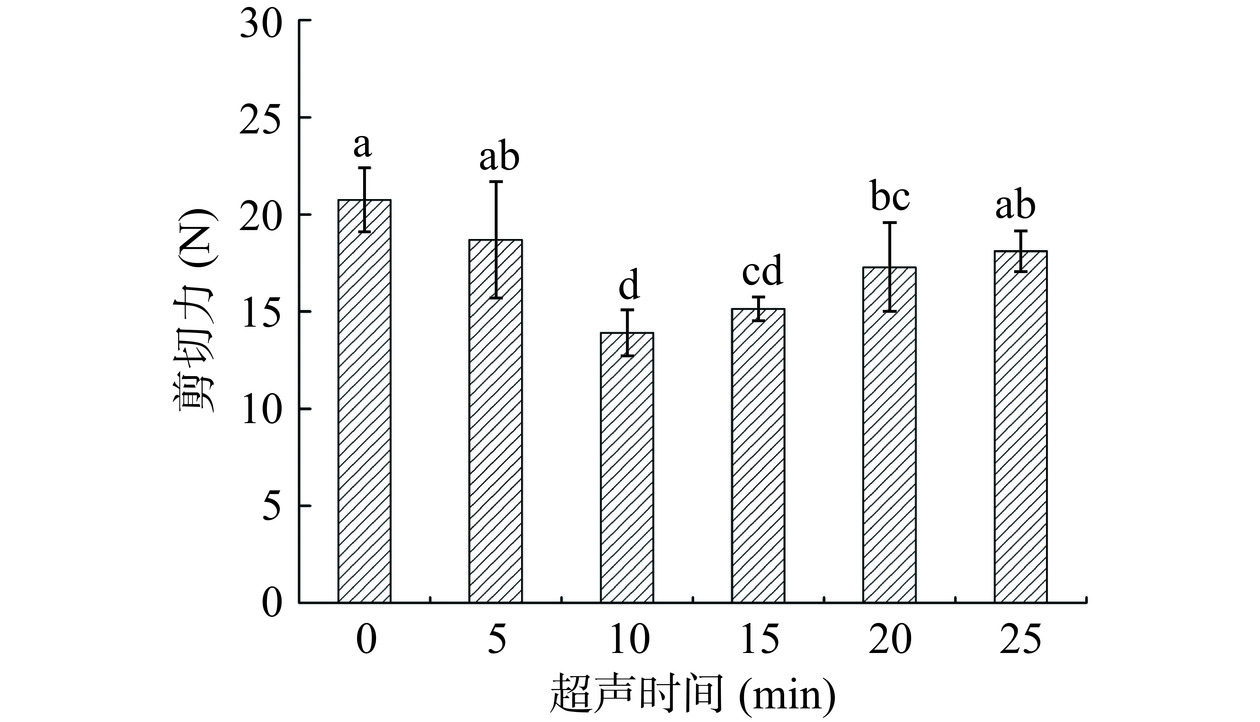
超声时间对鸡胸肉剪切力的影响见图3。随着超声时间的增加,超声物理效应导致的鸡胸肉剪切力不断降低,在10 min和15 min时达到最低值,二者无显著性差异。超声时间继续增加,剪切力缓慢回升,肉质嫩度下降。这主要由两方面原因导致,一方面长时间的超声处理,肌肉组织中水分流出量增加,保水性下降,嫩度减小;另一方面,过长的处理时间也会导致肉样蛋白质变性,剪切力升高[25]。因此,超声时间选择10 min。
2.1.4 超声温度对鸡胸肉剪切力的影响
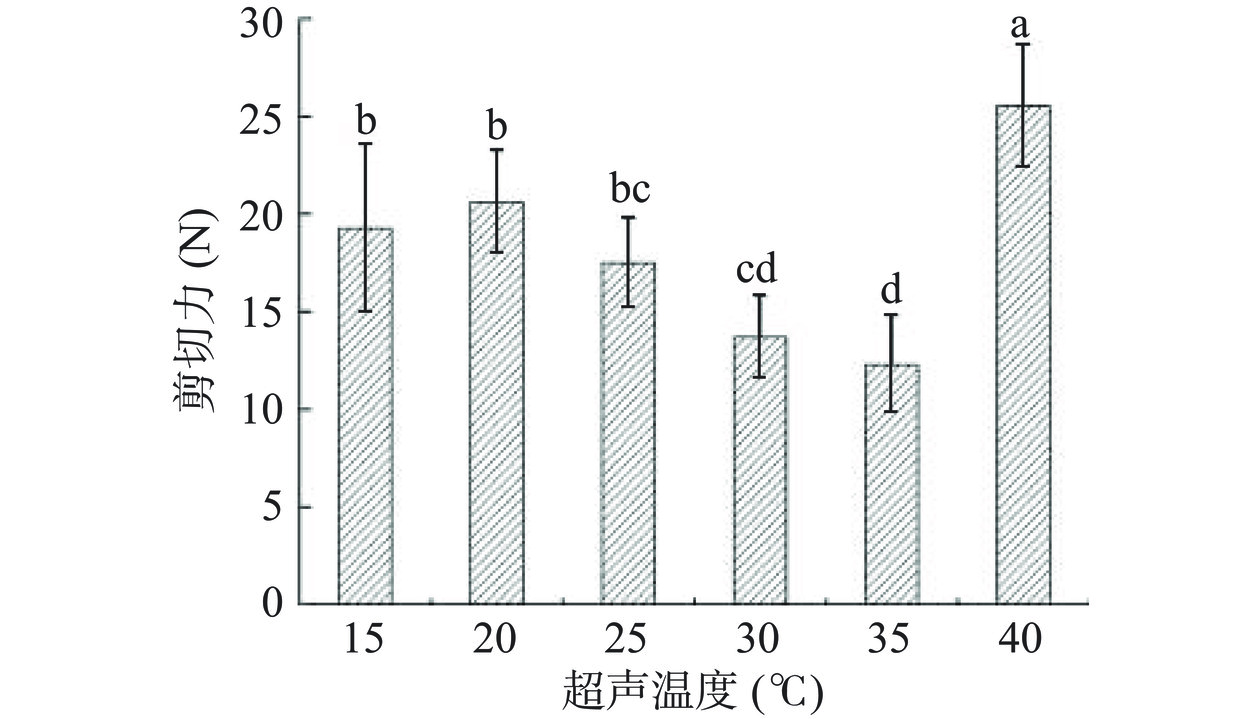
超声温度对鸡胸肉剪切力的影响见图4。在超声功率、频率与时间参数固定的条件下,随着处理温度的提高,鸡胸肉剪切力在不断降低,在35 ℃时,达到最低值(12.28 N),这说明温度对肉质的嫩化起到显著(P<0.05)作用。温度升高促进了肌肉中肌动球蛋白的解离,肉质硬度下降,嫩度提高[26]。但是温度升至40 ℃时,剪切力有一个显著(P<0.05)回升,这是因为该温度下,肌纤维有明显发白的现象,表层肌肉蛋白发生变性,影响了肉样的剪切力。因此,最佳超声温度为35 ℃。
2.2 超声作用下氯化钙与中性蛋白酶嫩化剂对鸡胸肉品质的影响
2.2.1 剪切力
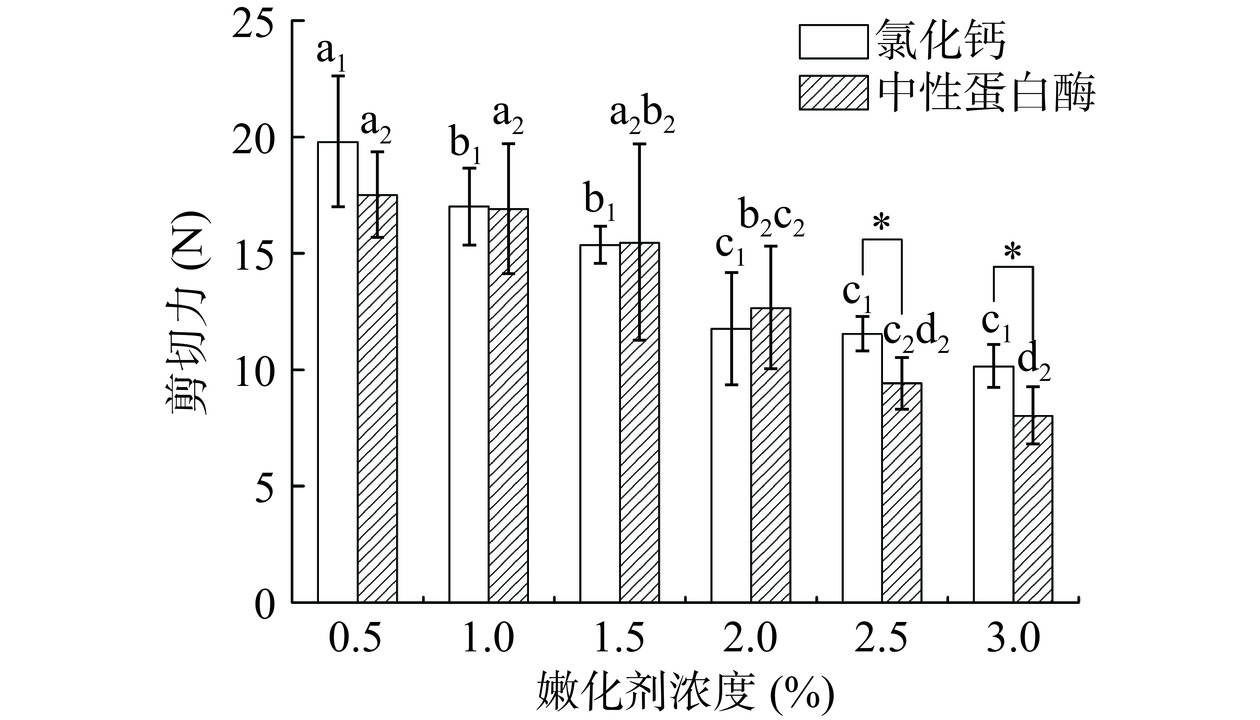
在超声最佳处理参数(240 W、22 kHz、10 min和35 ℃)下,添加外源性嫩化剂对鸡胸肉剪切力的影响如图5所示。氯化钙属于化学型嫩化剂,结合超声机械效应与空化效应,可促使氯化钙溶液快速渗透进肌肉深层组织,增强肌肉中的离子强度、改善离子分布,提高肌纤维蛋白溶解性,促使蛋白质链条发生交互盘结,形成稳定的胶体结构,增加蛋白水合与保水能力[27]。另外,钙离子还可激活细胞钙蛋白酶,蛋白质自身发生水解后,弱化了肌原纤维结构,导致肉质嫩化。随着超声渗透进肌肉中的钙离子越多,嫩化作用越显著。图5显示,随着氯化钙溶液浓度的增加,鸡胸肉剪切力逐渐降低,在浓度为2.0%时达到最低值,此时剪切力为11.75 N。再继续增加氯化钙浓度至2.5%和3.0%,剪切力无显著性变化,这一方面说明鸡胸肉的嫩度已达到平衡值,另一方面说明,氯化钙对蛋白的降解作用是有限的[28]。因此氯化钙的浓度选择2.0%。
添加中性蛋白酶,鸡胸肉剪切力同样呈现下降趋势,当添加量为2.5%时,剪切力降至9.43 N,继续增加蛋白酶浓度至3.0%,这两种浓度之间的剪切力无显著性变化。中性蛋白酶是生物嫩化剂,在超声波作用下,更有利于其向肉样的内部扩散,快速水解肌原纤维蛋白,弱化结缔组织、降低剪切力[29]。此外,超声作用对蛋白酶的活力也有一定的影响。有研究报道,100~250 W可显著提高蛋白酶活力,这与酶活性中心在超声空化效应引发的瞬时高压、微射流和剪切作用下空间结构改变、活性中心暴露有关[30]。使用2.5%和3.0%浓度的中性蛋白酶均大幅降低了鸡胸肉的剪切力,但二者之间无显著性差异,因此综合使用成本考虑,选择中性蛋白酶浓度为2.5%。
目前,将添加氯化钙与中性蛋白酶的嫩化结果横向对比发现,当嫩化剂浓度为2.5%和3.0%时,蛋白酶嫩化效果显著(P<0.05)高于氯化钙。对嫩化剂的最终选择还需通过进一步的质构与保水性指标来探索。
2.2.2 质构指标
表1是在超声环境下,以未处理组为对照,在无超声组和各超声功率组中分别添加2.0%氯化钙(CC)和2.5%中性蛋白酶(NP)对鸡胸肉质构的影响。在无超声组中,仅注入氯化钙溶液后,鸡胸肉的硬度与未处理组相比无显著性差异。当在最佳超声参数处理条件下,随着超声功率(60~240 W)的增加,鸡胸肉硬度不断下降,特别是超过120 W后,鸡胸肉的硬度为未处理组的68.45%~73.47%,但达到300 W后硬度升高,表明添加氯化钙后,在高功率的超声环境中不利于肉质的嫩化。而添加中性蛋白酶后,同样在超声功率超过120 W后,鸡胸肉的硬度仅为未处理组的37.18%~63.37%;通过本组与上一组氯化钙组数据的横向比较,结果显示中性蛋白酶组中鸡胸肉硬度下降程度显著(P<0.05)超过添加氯化钙的鸡胸肉组。特别是在300 W时,添加中性蛋白酶后,鸡胸肉的硬度为19.48 N,约为相同功率下添加氯化钙后鸡胸肉的1/2,蛋白酶降低鸡胸肉硬度的能力显著(P<0.01)高于氯化钙,这与李明奇[31]的研究结果一致。尽管氯化钙溶液中的Ca2+可增加电荷间排斥作用,引发肌纤维中的Z盘机械性断裂,诱导肌肉蛋白构象发生变化,减弱蛋白稳定性、并降低蛋白硬度,但从蛋白溶解度角度上来看,氯化钙组对肌肉蛋白的降解能力是弱于蛋白酶组的。Sharma等[32]研究认为蛋白酶的水解作用会分解一部分肌原纤维与结缔组织以提高鸡肉嫩度。再加上超声波空化效应产生的反复拉伸与压缩过程,这将更有利于外源性溶液的渗入[33]。当中性蛋白酶在超声波渗透作用下加速进入肌纤维更深的内部时,蛋白酶解效率迅速提高,这是超声协同中性蛋白酶能显著(P<0.05)降低鸡胸肉硬度的主要原因。对于弹性来说,添加氯化钙的各组之间无显著性差异;而当添加蛋白酶时,仅在无超声组发生下降,而处于超声环境中的鸡胸肉,弹性与未处理组相比无显著性差异。这表明,添加氯化钙或中性蛋白酶后,在超声场中均能保持住肉质的弹性。鸡胸肉肉质的胶黏性在仅添加蛋白酶后(无超声组),相比于仅添加氯化钙极显著(P<0.01)下降,这依然得益于中性蛋白酶较强的酶解能力。施加超声场后,氯化钙组胶黏性下降速率明显小于蛋白酶组,但随着功率的提高,二者无显著性差异。蛋白酶组在180~240 W下的胶黏性略小于氯化钙组,同时,相比于未处理组显著(P<0.05)降低58.33%~61.79%。这种胶黏性的下降与超声—蛋白酶协同作用下的蛋白质间的连接断裂有关[34]。另外,加入氯化钙或中性蛋白酶后,鸡胸肉的咀嚼性也发生明显改善。对于氯化钙来说,当超声功率达到240和300 W时,肉质咀嚼性相比于未处理组显著(P<0.05)降低25.13%~31.11%。添加中性蛋白酶的鸡胸肉在240 W超声作用下咀嚼性进一步下降,比未处理组降低了56.54%。综上,超声环境下添加氯化钙与中性蛋白酶均能降低鸡胸肉的硬度、胶黏性和咀嚼性,并保持肉质的弹性。其中,由质构指标综合分析可知,添加中性蛋白酶的鸡胸肉硬度更小、更易咀嚼、嫩度更高。
表 1 超声作用下氯化钙和中性蛋白酶对鸡胸肉质构的影响Table 1. Effects of calcium chloride and neutral protease on textures of chicken breast meat under ultrasonic treatment组别 硬度(N) 弹性(mm) 胶黏性(N) 咀嚼性(mJ) 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 未处理组 53.60±3.53a 52.39±2.41a 2.32±0.46a 2.22±0.34ab 21.13±4.24a 20.28±3.94a 39.28±5.89a 37.87±4.79a 无超声组 49.75±4.43ab 35.45±6.72b * 2.60±0.19a 1.87±0.26b ** 19.90±3.12a 8.70±1.99bc ** 36.13±1.24abc 16.63±5.88cd ** 60 W 46.05±2.87bc 36.13±2.41b 2.88±0.35a 2.49±0.08ab 17.65±3.03a 11.68±1.50b * 36.68±3.94ab 26.65±1.26b ** 120 W 39.38±4.07cd 33.20±3.64bc * 2.71±0.51a 2.33±0.57ab 10.73±4.65b 9.63±0.74bc 30.67±1.42abc 22.85±4.70bc ** 180 W 37.80±5.51d 27.93±4.37cd * 2.51±0.75a 2.59±0.46a 12.30±3.64b 7.75±1.12c 33.02±10.54abc 21.17±3.37bcd 240 W 36.69±4.01d 24.58±5.31de * 2.77±0.44a 2.09±0.14ab * 10.75±1.92b 8.45±0.90bc 29.41±2.46bc 16.46±2.59cd ** 300 W 39.21±6.84cd 19.48±1.28e ** 2.34±0.36a 2.01±0.42ab 11.50±2.05b 9.20±2.24bc 27.06±7.55c 16.08±2.85d * 注:同一列数据的小写字母上标不同,表示有显著性差异(P<0.05);P表示CC与NP横向之间的显著性差异,P<0.05时以“*”表示,P<0.01时以“**”表示;CC:Calcium Chloride,氯化钙;NP:Neutral Protease,中性蛋白酶;未处理组为新鲜肉样,未添加任何嫩化剂,其余各组均添加了氯化钙与中性蛋白酶嫩化剂。 2.2.3 保水性
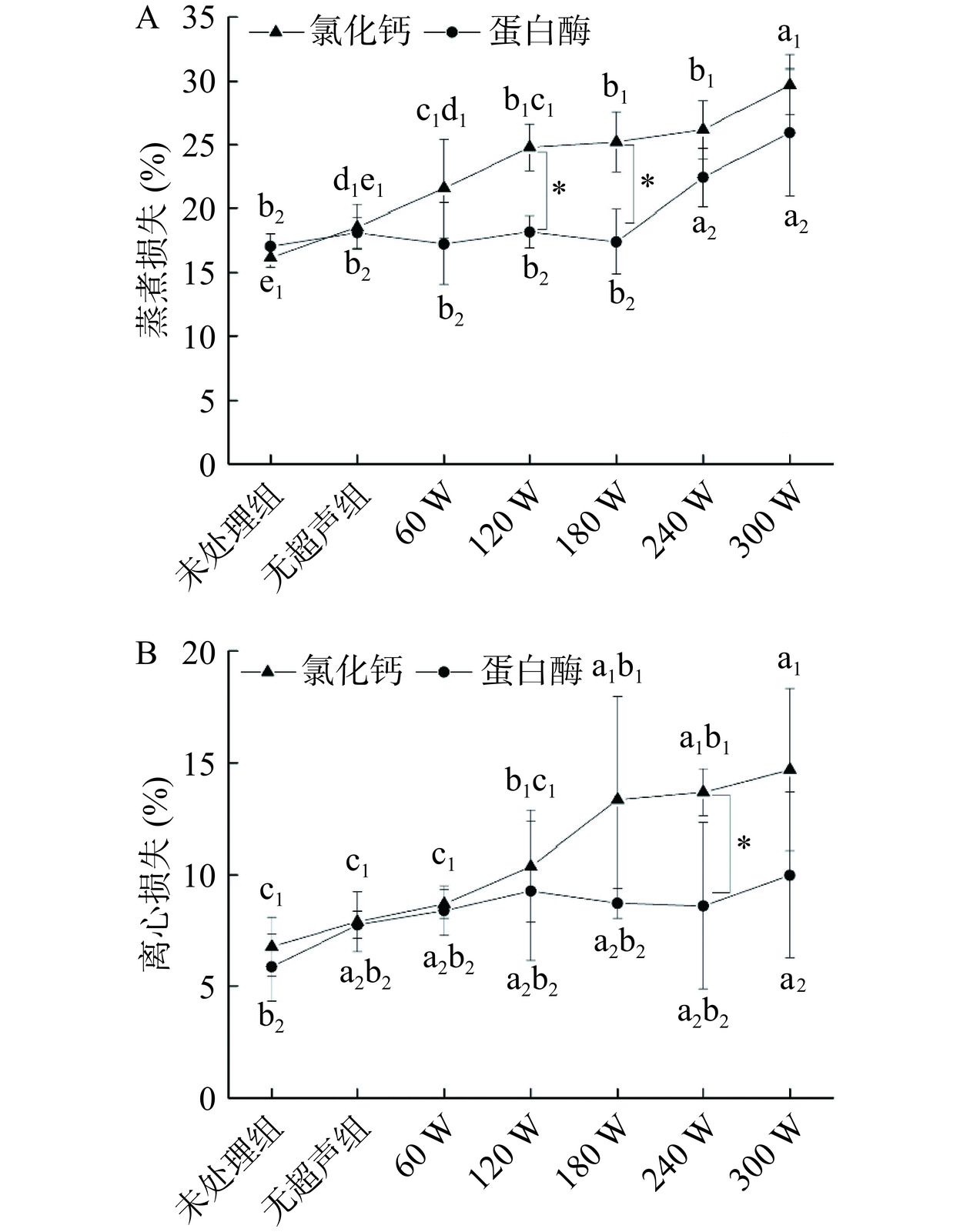
超声环境下,氯化钙(2.0%,w/v)和中性蛋白酶(2.5%,w/v)两种嫩化剂对鸡胸肉蒸煮损失和离心损失的影响如图6所示。图6A显示,随着超声波功率的递增,当达到180 W以上时,添加氯化钙嫩化剂的鸡胸肉蒸煮损失显著(P<0.05)上升,蒸煮损失超过25.22%;当达到300 W时,较高的功率进一步增加了蒸煮损失,达到了29.71%。蒸煮损失直观地反映了原料肉在加工过程中发生的水分流失和脂肪流失,是衡量肉品质的一项重要指标。蒸煮损失的提高表明,采用氯化钙嫩化的鸡胸肉水分与脂肪损失较高。一方面是因为高强度超声波作用减弱了鸡肉中蛋白质与盐离子之间的结合力,肌肉组织受到破坏、保水性能下降[35];另一方面,氯化钙盐跟随超声机械振动,进入肌肉组织中后,可能引起肌球蛋白结构的稳定性发生变化,引发疏水基团的暴露与聚集,降低了其溶解度,持水能力也随之下降,最终使得蒸煮损失升高[36]。此外,图6B显示,超声协同氯化钙不仅对鸡胸肉的蒸煮损失有影响,还显著(P<0.05)提高了其离心损失。当超声功率达到180 W时,离心损失超过了13.34%。这可能是由于高浓度的钙离子随着超声空化效应不断进入鸡肉组织内部造成的。Thongsook等[37]研究发现,食品基质中添加额外的钙,可使基质保有大量的自由水,从而导致离心后,离心损失显著提高。
对于中性蛋白酶来说,蒸煮损失与离心损失相比于氯化钙均有所降低。图6A显示,在超声环境中添加中性蛋白酶后,随着超声功率的增加,蒸煮损失在180 W前无显著性变化,特别是在120、180 W时,相比于氯化钙组显著(P<0.05)降低。而当超声功率达到240 W后,蒸煮损失才显著(P<0.05)上升,且与氯化钙组无显著性差异。这与李明琦[38]的研究结果一致,中性蛋白酶处理对肉制品的蒸煮损失影响较小。这是因为已渗入进肌肉组织中的中性蛋白酶会分解大分子蛋白质,形成可溶性的小分子多肽或氨基酸,促使肌肉组织间隙增大,提高了其容纳水的能力。但高强度也会使间隙中的水分流出,增大蒸煮损失,这就是当超声功率达到240 W后,蒸煮损失继续增加的原因;另一方面,合适的超声波强度可降低蛋白粒径,增加蛋白质与水分子之间的相互作用,从而降低了蒸煮损失[39]。添加中性蛋白酶的离心损失变化幅度也较小。图6B显示,随着超声功率的提高,当低于240 W时,离心损失无显著性变化;在240 W时,离心损失相比氯化钙组存在显著性差异(P<0.05),降低了约37.11%;而当功率达到更高的300 W时,肌肉组织间隙中容纳的自由水流失增多,离心损失才进一步增加。因此,采用中性蛋白酶对鸡胸肉进行处理,能最大程度地保证肌肉组织在超声环境的保水性能。
综合考虑,相比于氯化钙嫩化剂,采用超声联合中性蛋白酶进行嫩化处理,能显著提高鸡胸肉的品质。因此,后续蛋白分子量、总巯基含量、氨基酸分析与肌肉组织微观结构分析将采用超声协同中性蛋白酶嫩化法开展。
2.3 超声协同中性蛋白酶嫩化剂对鸡胸肉肌原纤维蛋白的影响
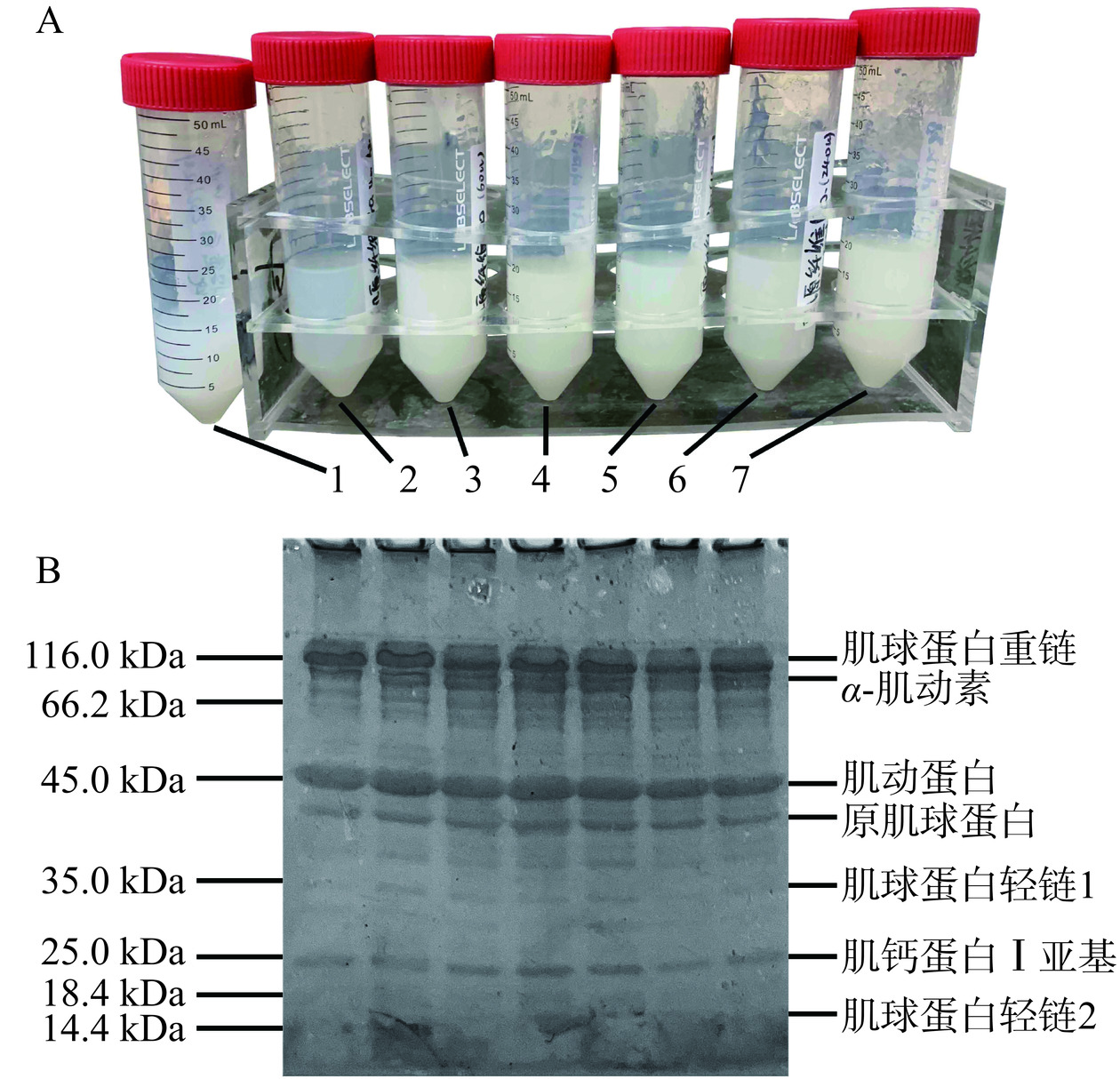
超声协同中性蛋白酶对鸡胸肉肌原纤维蛋白的影响如图7所示。鸡胸肉肌原纤维蛋白主要包括:肌球蛋白重链、α-肌动素、肌动蛋白、原肌球蛋白、肌球蛋白轻链1、肌钙蛋白I亚基和肌球蛋白轻链2。未处理组(1号)和只添加中性蛋白酶而未施加超声的无超声组(2号)肌球蛋白重链(116.0 kDa)条带厚、且颜色深,而施加超声作用后,从60~180 W(3~5号)开始肌球蛋白重链和α-肌动素等大分子蛋白条带开始变窄,颜色逐渐变浅;而低分子量的蛋白,如45.0 kDa的肌动蛋白、35.0 kDa以下的肌球蛋白轻链1以及14.4 kDa附近的肌球蛋白轻链2的条带颜色加深。这说明,在上述超声功率区间内,鸡胸肉的大分子量蛋白发生降解,形成中低分子量蛋白质,肌纤维之间的连接强度变弱,鸡胸肉的肉质剪切力降低、嫩度开始升高。这与本文的品质指标数据结果一致。当超声功率继续升高,达到240~300 W(6~7号)时,大分子肌球蛋白重链条带变得更细,而肌球蛋白轻链1和2条带的颜色也较浅,可能是因为功率的增加使得对蛋白的酶解作用效果提高,进而轻链也降解为更小的蛋白质(<14.4 kDa)。这与Zhou等[40]的研究结果一致,低频超声在250 W时能提高中性蛋白酶活性,增强蛋白酶的水解能力,这与超声波能引起酶的活性中心结构变化有关。因此,考虑到超声设备的使用寿命以及过高功率下组织水分过多渗出的问题,240 W的超声环境更适合于中性蛋白酶的嫩化处理过程。
2.4 超声协同中性蛋白酶嫩化剂对鸡胸肉肌原纤维蛋白总巯基含量的影响
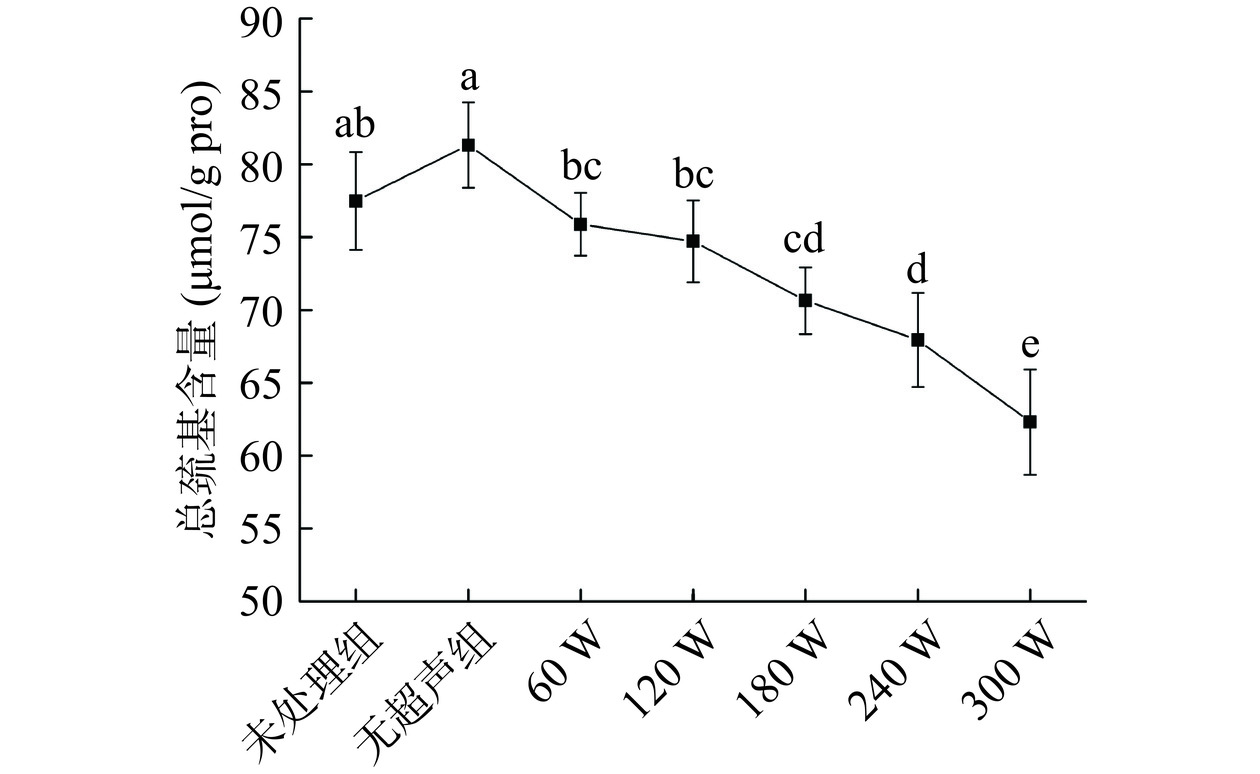
超声协同中性蛋白酶嫩化剂对鸡胸肉肌原纤维蛋白总巯基含量的影响如图8所示。相比于未处理,仅添加蛋白酶的无超声组总巯基含量升高,但无显著性差异,这是由于蛋白酶的水解作用使得鸡胸肉中肌原纤维蛋白聚合体被打开,二硫键被打断,有利于巯基的暴露[41]。引入超声处理后,随着功率的不断增加,肌原纤维蛋白的含量也在不断下降,当超声功率仅为60 W时,其总巯基含量就开始出现降低,并与未处理组下的样品中总巯基含量产生显著性(P<0.05)差异,而当超声功率升至300 W后,总巯基含量下降了19.5%。该结果表明,超声处理影响了鸡胸肉蛋白质的巯基基团的含量。这是因为一方面超声功率的增加有利于蛋白酶的水解作用,SDS-PAGE结果也提示了其中的大分子肌球蛋白重链条带部分发生降解,蛋白与蛋白之间的连接发生断裂,而形成的小分子多肽或多肽内部形成了二硫键,降低了巯基含量;另一方面,蛋白质中的半胱氨酸含有暴露的巯基,易受到超声空化效应产生的自由基影响而发生氧化,导致巯基基团减少[42]。在确保鸡胸肉嫩化效果的前提下,为避免肌原纤维蛋白的过度氧化,需降低嫩化处理时的超声功率至180~240 W。
2.5 超声协同中性蛋白酶嫩化剂处理后鸡胸肉氨基酸含量的变化
超声协同中性蛋白酶嫩化剂处理后鸡胸肉水解氨基酸含量的变化如表2所示。未处理组、无超声组以及超声组均检测出17种氨基酸。在必需氨基酸中,蛋氨酸和苯丙氨酸含量随超声功率的提高无显著性变化。蛋氨酸可参与体内甲基转移,并且作为机体谷胱甘肽和牛磺酸的前体物质,在免疫调节过程中可发挥关键作用[43]。苯丙氨酸在机体内90%可转化为酪氨酸,参与一系列神经递质和激素的合成[44−45]。而苏氨酸、缬氨酸、异亮氨酸、亮氨酸和赖氨酸含量均呈波动下降趋势,在超声介入后,这些必需氨基酸含量在60~180 W下不断降低,达到240 W时数值略微升高,但与180 W功率下无显著性差异。但当功率提高至300 W时,苏氨酸、缬氨酸和赖氨酸含量显著(P<0.05)下降。这说明高功率超声会导致肌原纤维蛋白水解后的部分氨基酸含量降低,这与超声波的机械效应导致的肌肉间隙增加有关,肌肉纤维在超声作用下不断牵扯与撕裂,造成肌肉中营养物质如蛋白质或多肽流失,引起最终的氨基酸含量的损失[46]。这三种氨基酸摄入含量的下降,会影响机体生长发育[47]、降低免疫力[48]、影响脂质代谢与葡萄糖代谢效率[49−50]等。在非必需氨基酸中,丝氨酸、丙氨酸、组氨酸、脯氨酸和酪氨酸随超声功率的增强无显著性变化。它们在机体中起到神经调节[51]、保护肝脏[52]、减轻贫血[53]、渗透保护[54]和抑制黑素生成[55]等作用。而天冬氨酸、谷氨酸、甘氨酸和精氨酸随超声的介入呈波动下降趋势。其含量在超声240 W时与60 W处理下无显著性差异,这可能是由于此超声功率刺激下引发的空化效应,释放了肌肉中部分水解酶类或脱氨酶类导致的氨基酸含量升高[56]。该结果表明,在240 W处理条件下,超声协同中性蛋白酶处理并未影响到这四种非必需氨基酸含量的变化。但是当超声功率继续升高至300 W时,天冬氨酸、谷氨酸和精氨酸含量发生显著(P<0.05)降低。这三种氨基酸摄入含量的下降,会影响机体激素分泌与神经系统发育[57]、蛋白质代谢合成[58]和血氨转化率[59]等。此外,含有巯基的半胱氨酸含量随着功率提高而发生显著(P<0.05)降低。这与总巯基含量测定结果一致,说明过高功率的超声会促使鸡胸肉蛋白氧化程度上升,进而影响鸡肉品质。康大成[60]研究超声腌渍对牛肉品质影响,也发现超声强度过高会降低含硫氨基酸的含量。综上,过高的超声功率(300 W)协同中性蛋白酶处理淘汰蛋鸡肉,会导致总氨基酸含量的下降,并显著(P<0.05)降低必需氨基酸苏氨酸、缬氨酸和赖氨酸以及非必需氨基酸天冬氨酸、谷氨酸和精氨酸的含量,降低食用品质。因此,保持较低功率的超声可降低对氨基酸流失的影响。这与Sun等[61]的研究结果一致。
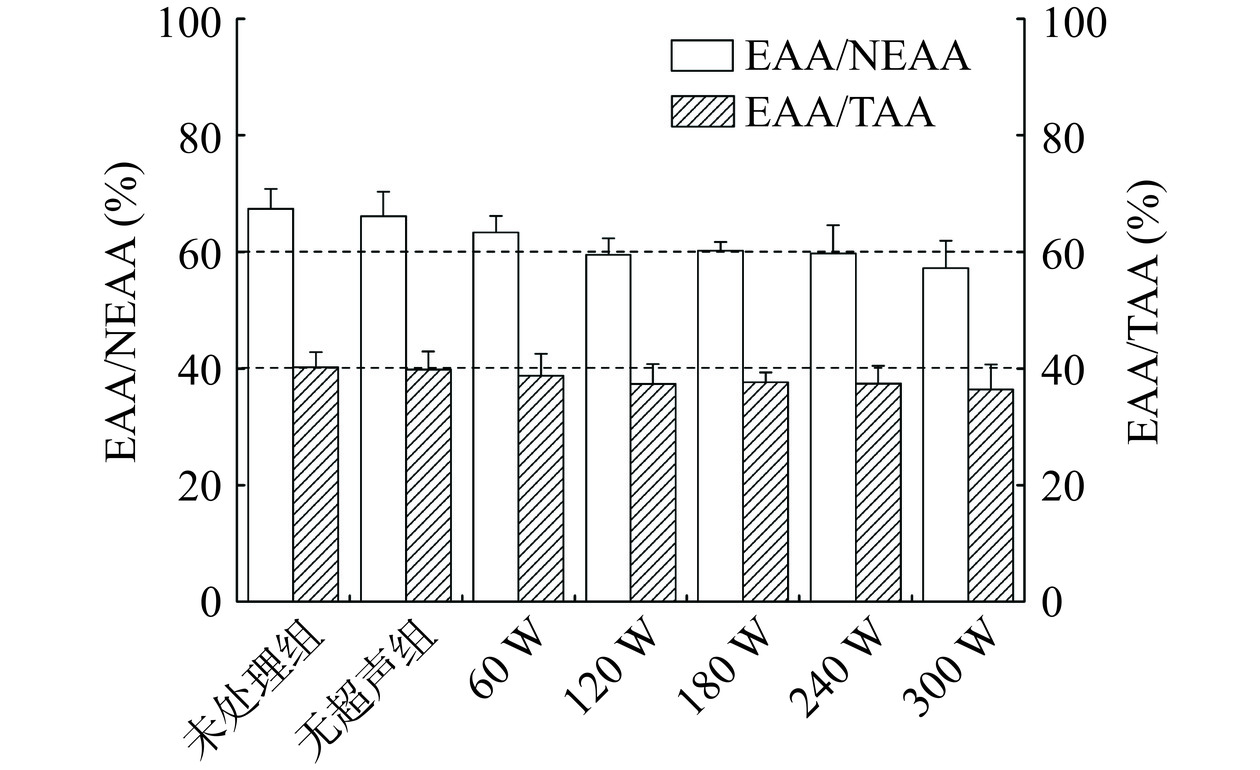
表 2 超声协同中性蛋白酶处理对鸡胸肉氨基酸组成的影响(g/100 g)Table 2. Effects of ultrasound assisted neutral protease treatment on amino acid composition of chicken breast meat (g/100 g)种类 未处理组 无超声组 60 W 120 W 180 W 240 W 300 W 天冬氨酸(Asp) 1.47±0.04b 1.38±0.02c 1.59±0.06a 1.52±0.05ab 1.45±0.03b 1.59±0.02a 1.43±0.05bc *苏氨酸(Thr) 0.73±0.01bc 0.69±0.04c 0.80±0.03a 0.74±0.02ab 0.70±0.02bc 0.76±0.03ab 0.65±0.04c 丝氨酸(Ser) 0.57±0.02 0.56±0.06 0.65±0.03 0.64±0.03 0.60±0.01 0.66±0.04 0.59±0.05 谷氨酸(Glu) 2.25±0.06bc 2.11±0.04c 2.44±0.03a 2.32±0.02b 2.17±0.04bc 2.39±0.06ab 2.08±0.05c 甘氨酸(Gly) 0.72±0.02ab 0.68±0.03ab 0.80±0.04a 0.74±0.02ab 0.63±0.02b 0.72±0.03ab 0.67±0.01ab 丙氨酸(Ala) 0.92±0.03 0.86±0.04 0.99±0.03 0.94±0.01 0.87±0.05 0.97±0.05 0.88±0.04 半胱氨酸(Cys) 0.16±0.03a 0.16±0.02a 0.15±0.02a 0.13±0.03ab 0.12±0.01b 0.13±0.02b 0.12±0.02b *缬氨酸(Val) 0.82±0.05a 0.74±0.07a 0.78±0.02a 0.64±0.04b 0.56±0.02bc 0.60±0.01b 0.49±0.03c *蛋氨酸(Met) 0.41±0.05 0.34±0.06 0.42±0.05 0.36±0.06 0.41±0.07 0.47±0.02 0.41±0.05 *异亮氨酸(IIe) 0.76±0.02a 0.68±0.01b 0.72±0.05ab 0.58±0.04c 0.52±0.05cd 0.55±0.03cd 0.45±0.04d *亮氨酸(Leu) 1.31±0.01ab 1.23±0.04ab 1.38±0.03a 1.28±0.05ab 1.21±0.01ab 1.33±0.05ab 1.16±0.02b 酪氨酸(Tyr) 0.75±0.02ab 0.68±0.02b 0.82±0.03ab 0.78±0.03ab 0.77±0.02ab 0.84±0.03a 0.77±0.03ab *苯丙氨酸(Phe) 0.68±0.06 0.62±0.08 0.69±0.03 0.63±0.02 0.60±0.01 0.66±0.04 0.59±0.06 *赖氨酸(Lys) 1.46±0.02b 1.36±0.06b 1.53±0.05a 1.39±0.02b 1.30±0.07bc 1.43±0.04b 1.22±0.05c 组氨酸(His) 0.71±0.03 0.64±0.05 0.77±0.02 0.72±0.03 0.69±0.01 0.73±0.02 0.67±0.05 精氨酸(Arg) 1.03±0.06a 0.97±0.02a 1.10±0.05a 1.01±0.03a 0.92±0.02b 1.03±0.02a 0.89±0.03b 脯氨酸(Pro) 0.62±0.04 0.56±0.07 0.67±0.05 0.64±0.05 0.55±0.06 0.63±0.03 0.59±0.02 必需氨基酸含量 6.17±0.22ab 5.66±0.36b 6.32±0.26a 5.62±0.25b 5.30±0.24bc 5.80±0.22b 4.97±0.29c 非必需氨基酸含量 9.20±0.36b 8.59±0.37c 9.98±0.36a 9.44±0.30ab 8.77±0.27bc 9.69±0.32ab 8.69±0.35bc 总氨基酸含量 15.37±0.57b 14.26±0.73b 16.30±0.62a 15.06±0.55ab 14.06±0.52b 15.49±0.54ab 13.66±0.64c 注:“*”表示必需氨基酸;同一行数据右侧不同的上标字母表示显著性差异,P<0.05。 各类氨基酸的组成比例如图9所示。初始EAA/TAA和EAA/NEAA的比例分别为40.2%和67.3%。依据FAO/WHO标准,EAA/TAA和EAA/NEAA比例分别在40%和60%以上,表示为优质蛋白质[62]。经超声协同蛋白酶处理后,EAA/TAA和EAA/NEAA组成比例不断下降,前者在60 W处理后下降至40%以下;后者在60~240 W处理后依然保持在60%左右,直至300 W处理后下降到60%以下。这表明超声波处理的功率变化会改变鸡胸肉必需氨基酸与非必需氨基酸组成,进而影响肉质蛋白质品质。尤其是在300 W超声作用下,EAA/NEAA比例下降低于60%,必需/非必需氨基酸组成平衡被破坏。因此,超声处理时功率选择在240 W以内,在确保鸡胸肉嫩度的同时,也能最大程度减少对氨基酸组成平衡的影响。
2.6 超声协同中性蛋白酶嫩化剂对鸡胸肉表观与截面结构的影响
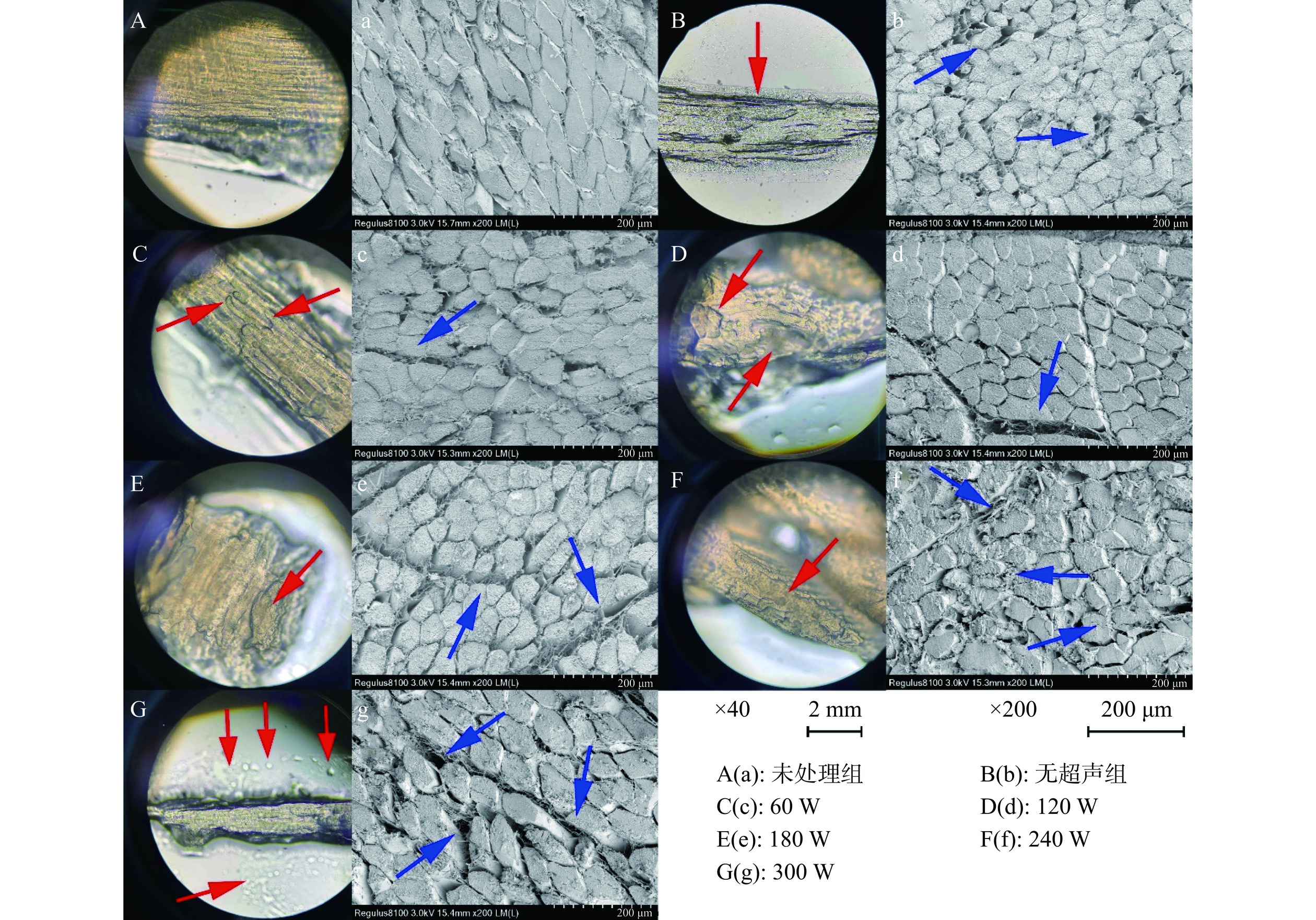
超声协同中性蛋白酶对鸡胸肉表观结构的影响如图10所示。未处理组(图10A和图10a)肌纤维结构完整,纵向肌肉组织与截面肌纤维均十分致密。只经过中性蛋白酶处理,鸡胸肉表面组织外层开始出现溶解,多处肌纤维之间紧密结合的状态开始分离(图10B和图10b)。这是因为在蛋白酶的作用下,肌肉表层以及内部肌纤维蛋白发生分解而引起的。开始施加超声后,样品受到机械振动与空化效应的影响,肌纤维发生崩解的效果随着超声强度的提高不断增加;同时,超声引发的机械振动作用有利于蛋白酶溶液向肌肉组织内部渗透,导致肌纤维发生分离与分解。在强度为60 W时,除外层肌肉因蛋白酶水解的作用而发生分解外,其内部也开始逐渐断裂(图10C),同时肌纤维截面也出现了因机械振动而引发的肌纤维间“撕扯”现象(图10c)。当超声强度达到120~240 W时(图10D~图10F),鸡胸肉出现较多的“侵蚀”痕迹,其平整度相比于未处理组来说明显降低。肌纤维截面观察结果也显示,随着超声强度的提高,肌纤维之间的“撕扯”程度显著提高,肌纤维间隙开始不断扩大(图10d~图10f)。特别是在240 W处理时,肌纤维内的中间部分区域也出现了分解现象,肌肉纤维的强度降低、嫩度增加,这与之前品质指标所呈现的结果一致。当强度达到300 W后,外层分离出去的组织增多,肌纤维也因过多地失水而蜷缩在一起(图10G)。这可能是因为肌肉中的肌小节附近产生了密集的再凝聚物质,保水性下降[63]。横截面中“撕扯”程度继续增大,甚至部分肌纤维小束发生脱离,导致肌纤维间隙进一步增加(图10g),这些过大的空隙会成为后续水分损失的滴水通道[64],从而增加蒸煮损失,这与前述的研究结果一致。过高的超声功率引起鸡胸肉的硬度升高以及剪切力的增加,导致嫩度发生下降。因此,在合适的超声功率(120~240 W)下,采用中性蛋白酶处理后,鸡胸肉的表观与截面结构发生崩解、深层肌纤维分离、分解与断裂,肉质最终的嫩度得到改善。
3. 结论
超声协同蛋白酶法处理后的淘汰蛋鸡肉硬度更小、更易咀嚼、保水性能更好。鸡胸肉中的大分子肌原纤维蛋白发生降解,肌肉纤维剪切力降低,肉质嫩度提高。同时,鸡肉中蛋氨酸和苯丙氨酸等必需氨基酸,以及丝氨酸、丙氨酸、组氨酸、脯氨酸和酪氨酸等非必需氨基酸的组成也未被破坏。只是,半胱氨酸因超声功率持续升高而流失导致了总巯基含量的下降,这表明过强的超声功率会加速蛋白质氧化。微观结构观察结果显示,高功率超声引发鸡肉束间隙进一步扩大会成为后续水分损失的滴水通道,导致蒸煮损失提高,影响鸡肉咀嚼性。因此,在确保淘汰蛋鸡肉嫩化效果的基础上,应尽量降低超声处理强度。本研究为养鸡场日龄过长且产蛋效率大幅下降的淘汰蛋鸡肉的处理,提供了基于短时低功率超声联合蛋白酶低损嫩化的思路,可显著改善原本嫩度低、咀嚼性差的鸡胸肉感官品质,进一步提高淘汰蛋鸡的经济与食用价值。
-
表 1 超声作用下氯化钙和中性蛋白酶对鸡胸肉质构的影响
Table 1 Effects of calcium chloride and neutral protease on textures of chicken breast meat under ultrasonic treatment
组别 硬度(N) 弹性(mm) 胶黏性(N) 咀嚼性(mJ) 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 2.0% CC 2.5% NP P 未处理组 53.60±3.53a 52.39±2.41a 2.32±0.46a 2.22±0.34ab 21.13±4.24a 20.28±3.94a 39.28±5.89a 37.87±4.79a 无超声组 49.75±4.43ab 35.45±6.72b * 2.60±0.19a 1.87±0.26b ** 19.90±3.12a 8.70±1.99bc ** 36.13±1.24abc 16.63±5.88cd ** 60 W 46.05±2.87bc 36.13±2.41b 2.88±0.35a 2.49±0.08ab 17.65±3.03a 11.68±1.50b * 36.68±3.94ab 26.65±1.26b ** 120 W 39.38±4.07cd 33.20±3.64bc * 2.71±0.51a 2.33±0.57ab 10.73±4.65b 9.63±0.74bc 30.67±1.42abc 22.85±4.70bc ** 180 W 37.80±5.51d 27.93±4.37cd * 2.51±0.75a 2.59±0.46a 12.30±3.64b 7.75±1.12c 33.02±10.54abc 21.17±3.37bcd 240 W 36.69±4.01d 24.58±5.31de * 2.77±0.44a 2.09±0.14ab * 10.75±1.92b 8.45±0.90bc 29.41±2.46bc 16.46±2.59cd ** 300 W 39.21±6.84cd 19.48±1.28e ** 2.34±0.36a 2.01±0.42ab 11.50±2.05b 9.20±2.24bc 27.06±7.55c 16.08±2.85d * 注:同一列数据的小写字母上标不同,表示有显著性差异(P<0.05);P表示CC与NP横向之间的显著性差异,P<0.05时以“*”表示,P<0.01时以“**”表示;CC:Calcium Chloride,氯化钙;NP:Neutral Protease,中性蛋白酶;未处理组为新鲜肉样,未添加任何嫩化剂,其余各组均添加了氯化钙与中性蛋白酶嫩化剂。 表 2 超声协同中性蛋白酶处理对鸡胸肉氨基酸组成的影响(g/100 g)
Table 2 Effects of ultrasound assisted neutral protease treatment on amino acid composition of chicken breast meat (g/100 g)
种类 未处理组 无超声组 60 W 120 W 180 W 240 W 300 W 天冬氨酸(Asp) 1.47±0.04b 1.38±0.02c 1.59±0.06a 1.52±0.05ab 1.45±0.03b 1.59±0.02a 1.43±0.05bc *苏氨酸(Thr) 0.73±0.01bc 0.69±0.04c 0.80±0.03a 0.74±0.02ab 0.70±0.02bc 0.76±0.03ab 0.65±0.04c 丝氨酸(Ser) 0.57±0.02 0.56±0.06 0.65±0.03 0.64±0.03 0.60±0.01 0.66±0.04 0.59±0.05 谷氨酸(Glu) 2.25±0.06bc 2.11±0.04c 2.44±0.03a 2.32±0.02b 2.17±0.04bc 2.39±0.06ab 2.08±0.05c 甘氨酸(Gly) 0.72±0.02ab 0.68±0.03ab 0.80±0.04a 0.74±0.02ab 0.63±0.02b 0.72±0.03ab 0.67±0.01ab 丙氨酸(Ala) 0.92±0.03 0.86±0.04 0.99±0.03 0.94±0.01 0.87±0.05 0.97±0.05 0.88±0.04 半胱氨酸(Cys) 0.16±0.03a 0.16±0.02a 0.15±0.02a 0.13±0.03ab 0.12±0.01b 0.13±0.02b 0.12±0.02b *缬氨酸(Val) 0.82±0.05a 0.74±0.07a 0.78±0.02a 0.64±0.04b 0.56±0.02bc 0.60±0.01b 0.49±0.03c *蛋氨酸(Met) 0.41±0.05 0.34±0.06 0.42±0.05 0.36±0.06 0.41±0.07 0.47±0.02 0.41±0.05 *异亮氨酸(IIe) 0.76±0.02a 0.68±0.01b 0.72±0.05ab 0.58±0.04c 0.52±0.05cd 0.55±0.03cd 0.45±0.04d *亮氨酸(Leu) 1.31±0.01ab 1.23±0.04ab 1.38±0.03a 1.28±0.05ab 1.21±0.01ab 1.33±0.05ab 1.16±0.02b 酪氨酸(Tyr) 0.75±0.02ab 0.68±0.02b 0.82±0.03ab 0.78±0.03ab 0.77±0.02ab 0.84±0.03a 0.77±0.03ab *苯丙氨酸(Phe) 0.68±0.06 0.62±0.08 0.69±0.03 0.63±0.02 0.60±0.01 0.66±0.04 0.59±0.06 *赖氨酸(Lys) 1.46±0.02b 1.36±0.06b 1.53±0.05a 1.39±0.02b 1.30±0.07bc 1.43±0.04b 1.22±0.05c 组氨酸(His) 0.71±0.03 0.64±0.05 0.77±0.02 0.72±0.03 0.69±0.01 0.73±0.02 0.67±0.05 精氨酸(Arg) 1.03±0.06a 0.97±0.02a 1.10±0.05a 1.01±0.03a 0.92±0.02b 1.03±0.02a 0.89±0.03b 脯氨酸(Pro) 0.62±0.04 0.56±0.07 0.67±0.05 0.64±0.05 0.55±0.06 0.63±0.03 0.59±0.02 必需氨基酸含量 6.17±0.22ab 5.66±0.36b 6.32±0.26a 5.62±0.25b 5.30±0.24bc 5.80±0.22b 4.97±0.29c 非必需氨基酸含量 9.20±0.36b 8.59±0.37c 9.98±0.36a 9.44±0.30ab 8.77±0.27bc 9.69±0.32ab 8.69±0.35bc 总氨基酸含量 15.37±0.57b 14.26±0.73b 16.30±0.62a 15.06±0.55ab 14.06±0.52b 15.49±0.54ab 13.66±0.64c 注:“*”表示必需氨基酸;同一行数据右侧不同的上标字母表示显著性差异,P<0.05。 -
[1] 陈琛, 戚敏, 杨秀娟, 等. 云南绒毛鸡腿肌营养成分分析与评价[J]. 食品工业科技,2019,40(24):283−290. [CHEN C, QI M, YANG X J, et al. Analysis and evaluation of nutritional components in leg muscles of rongmao chicken[J]. Science and Technology of Food Industry,2019,40(24):283−290.] CHEN C, QI M, YANG X J, et al. Analysis and evaluation of nutritional components in leg muscles of rongmao chicken[J]. Science and Technology of Food Industry, 2019, 40(24): 283−290.
[2] KUMAR P, MEHTA N, KAUR S, et al. Antioxidant and antimicrobial efficacy of Giloy (Tinospora cordifolia) stem powder in spent hen meat patties under aerobic packaging at refrigeration temperature (4±10 ℃)[J]. Journal of Food Processing and Preservation,2021,45(10):1−12.
[3] 贾友刚, 王连杰, 王文华, 等. 肉鸡品种对产品出成和综合售价影响的研究[J]. 饮食科学,2018(18):260−262. [JIA Y G, WANG L J, WANG W H, et al. A Study on the influence of broiler varieties on product production and comprehensive selling price[J]. Diet Science,2018(18):260−262.] JIA Y G, WANG L J, WANG W H, et al. A Study on the influence of broiler varieties on product production and comprehensive selling price[J]. Diet Science, 2018(18): 260−262.
[4] SABIKUN N, BAKHSH A, RAHMAN S M, et al. Evaluation of chicken nugget properties using spent hen meat added with milk fat and potato mash at different levels[J]. Journal of Food Science and Technology,2020,58(7):2783−2791.
[5] YANG H J, CHEN L H, TANG H G, et al. Tenderness improvement of reduced-fat and reduced-salt meat gels as affected by high pressure treating time[J]. Innovative Food Science & Emerging Technologies,2021,70(2):70.
[6] 于秋影, 赵宏蕾, 常婧瑶, 等. 新型滚揉技术在肉制品加工中应用的研究进展[J]. 食品科学,2022,43(17):380−388. [YU Q Y, ZHAO H L, CHANG J Y, et al. Progress in the application of new tumbling technologies in meat processing[J]. Food Science,2022,43(17):380−388.] doi: 10.7506/spkx1002-6630-20210804-052 YU Q Y, ZHAO H L, CHANG J Y, et al. Progress in the application of new tumbling technologies in meat processing[J]. Food Science, 2022, 43(17): 380−388. doi: 10.7506/spkx1002-6630-20210804-052
[7] CHEN M Y, TIAN Y, YU Q L, et al. Effect of a low-voltage electrical stimulation on yak meat tenderness during postmortem aging[J]. Animal Science Journal,2020,91(1):13410. doi: 10.1111/asj.13410
[8] CHEN L, CHAI Y W, LUO J, et al. Apoptotic changes and myofibrils degradation in post-mortem chicken muscles by ultrasonic processing[J]. LWT-Food Science and Technology,2021,142(2):1−13.
[9] HUANG F, DING Z J, ZHANG C J, et al. Effects of calcium and zinc ions injection on caspase-3 activation and tenderness in post-mortem beef skeletal muscles[J]. International Journal of Food Science and Technology,2018,53(3):582−589. doi: 10.1111/ijfs.13631
[10] WOINUE Y, CHAURASIYA R S, SHARMA R. Meat tenderization using bromelain enzyme extracted from pineapple waste[J]. Food Research,2021,5(2):363−370. doi: 10.26656/fr.2017.5(2).525
[11] 李佳麒. 超声波辅助腌制对牛肉干制品嫩度的影响及其机制探讨[D]. 郑州:河南农业大学, 2021. [LI J Q. Effect of ultrasonic-assisted pickling on tenderness of beef jerky products and its mechanism[D]. Zhengzhou:Henan Agricultural University, 2021.] LI J Q. Effect of ultrasonic-assisted pickling on tenderness of beef jerky products and its mechanism[D]. Zhengzhou: Henan Agricultural University, 2021.
[12] 曲文娟, 马海乐, 王婷, 等. 交替双频逆流超声辅助提取条斑紫菜蛋白和多糖[J]. 农业工程学报,2013,29(1):285−292. [QU W J, MA H L, WANG T, et al. Alternating two-frequency countercurrent ultrasonic-assisted extraction of protein and polysaccharide from Porphyra yezoensis[J]. Transactions of the Chinese Society of Agricultural Engineering,2013,29(1):285−292.] QU W J, MA H L, WANG T, et al. Alternating two-frequency countercurrent ultrasonic-assisted extraction of protein and polysaccharide from Porphyra yezoensis[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(1): 285−292.
[13] JIN J, MA H L, WANG K, et al. Effects of multi-frequency power ultrasound on the enzymolysis and structural characteristics of corn gluten meal[J]. Ultrasonics Sonochemistry,2015,24(1):55−64.
[14] 农业部畜禽产品质量监督检验测试中心, 北京国农工贸发展中心. NY/T 1180-2006 肉嫩度的测定 剪切力测定法[S]. 北京:农业部, 2006-10-01. [Quality Supervision, Inspection and Testing Center for Livestock and Poultry Products of the Ministry of Agriculture, Beijing National Agricultural Industry and Trade Development Center. NY/T 1180-2006 Determination of meat tenderness by shear force method[S]. Beijing:Ministry of Agriculture, 2006-10-01.] Quality Supervision, Inspection and Testing Center for Livestock and Poultry Products of the Ministry of Agriculture, Beijing National Agricultural Industry and Trade Development Center. NY/T 1180-2006 Determination of meat tenderness by shear force method[S]. Beijing: Ministry of Agriculture, 2006-10-01.
[15] BAKHSH A, LEE S J, LEE E Y, et al. A novel approach for tuning the physicochemical, textural, and sensory characteristics of plant-based meat analogs with different levels of methylcellulose concentration[J]. Foods,2021,10(3):560. doi: 10.3390/foods10030560
[16] CHEN B, ZHOU K, WANG Y, et al. Insight into the mechanism of textural deterioration of myofibrillar protein gels at high temperature conditions[J]. Food Chemistry,2020,330:127186. doi: 10.1016/j.foodchem.2020.127186
[17] PENG Z W, ZHANG Y, WANG H Q, et al. Effects of arginine-glucose Maillard reaction products on the physicochemical and gel properties of chicken myofibrillar protein[J]. LWT-Food Science & Technology,2021,152:112244.
[18] WU P, GOLLY M K, GUO Y T, et al. Effect of partial replacement of soybean meal with high-temperature fermented soybean meal in antibiotic-growth-promoter-free diets on growth performance, organ weights, serum indexes, intestinal flora and histomorphology of broiler chickens[J]. Animal Feed Science and Technology,2020,269:114616.
[19] GAO X, XUE D M, ZHANG Z H, et al. Rheological and structural properties of sea cucumber Stichopus japonicus during heat treatment[J]. Journal of Ocean University of China,2005,4(3):244−247. doi: 10.1007/s11802-005-0041-3
[20] WANG Y Y, RASHID M T, YAN J K, et al. Effect of multi-frequency ultrasound thawing on the structure and rheological properties of myofibrillar proteins from small yellow croaker[J]. Ultrasonics Sonochemistry,2021,70:105352. doi: 10.1016/j.ultsonch.2020.105352
[21] LIU Y H, ZENG Y, HU R R, et al. Effect of ultrasonic power on water removal kinetics and moisture migration of kiwifruit slices during contact ultrasound intensified heat pump drying[J]. Food and Bioprocess Technology:An International Journal,2020,13(6):430−441.
[22] 余海霞, 杨水兵, 杨志坚, 等. 超声波技术嫩化鱿鱼的研究[J]. 中国食品学报,2013,13(11):6−14. [YU H X, YANG S B, YANG Z J, et al. Influence of ultrasonic wave treatment on tenderization of squid[J]. Journal of Chinese Institute of Food Science and Technology,2013,13(11):6−14.] YU H X, YANG S B, YANG Z J, et al. Influence of ultrasonic wave treatment on tenderization of squid[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(11): 6−14.
[23] 邵建航. 超声波联合碳酸钾处理对牛肉品质及微观结构的影响[D]. 杨凌:西北农林科技大学, 2021. [SHAO J H. Effect of ultrasonic combined with potassium carbonate treatment on quality and microstructure of beef[D]. Yangling:Northwest Agriculture & Forestry University, 2021.] SHAO J H. Effect of ultrasonic combined with potassium carbonate treatment on quality and microstructure of beef[D]. Yangling: Northwest Agriculture & Forestry University, 2021.
[24] WANG Y Y, YAN J K, RASHID M T, et al. Dual-frequency sequential ultrasound thawing for improving the quality of quick-frozen small yellow croaker and its possible mechanisms[J]. Innovative Food Science & Emerging Technologies,2021,68(3):102614.
[25] ZOU Y, ZHANG K, ZHANG X X, et al. Optimization of goose breast meat tenderness by rapid ultrasound treatment using response surface methodology and artificial neural network[J]. Animal Ence Journal,2018,89(9):1339−1347.
[26] 万红兵. 高熟度牛肉嫩度特异性及其肌原纤维蛋白结构变化机制研究[D]. 北京:中国农业科学院, 2020. [WAN H B. Study on tenderness specificity and mechanism of myofibrillar protein structure change of beef with high degree of doneness[D]. Beijing:Chinese Academy of Agricultural Sciences, 2020.] WAN H B. Study on tenderness specificity and mechanism of myofibrillar protein structure change of beef with high degree of doneness[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[27] CARBALLO J, MOTA N, BARRETO G, et al. Binding properties and colour of Bologna sausage made with varying fat levels, protein levels and cooking temperatures[J]. Meat Science,1995,41(3):301−313. doi: 10.1016/0309-1740(95)00001-2
[28] 李明奇, 贺稚非, 李少博, 等. 氯化钙-无花果蛋白酶−猕猴桃蛋白酶体系对兔肉肌原纤维蛋白结构的协同作用[J]. 食品科学,2021,42(4):8−14. [LI M Q, HE Z F, LI S B, et al. Synergistic effect of calcium chloride-fig protease-kiwifruit protease blend as meat tenderizer on myofibrillar protein structure of rabbit meat[J]. Food Science,2021,42(4):8−14.] doi: 10.7506/spkx1002-6630-20191216-163 LI M Q, HE Z F, LI S B, et al. Synergistic effect of calcium chloride-fig protease-kiwifruit protease blend as meat tenderizer on myofibrillar protein structure of rabbit meat[J]. Food Science, 2021, 42(4): 8−14. doi: 10.7506/spkx1002-6630-20191216-163
[29] BUREROS K J C, DIZON E I, ISRAEL K A C, et al. Physicochemical and sensory properties of carabeef treated with Bacillus subtilis (Ehrenberg) Cohn protease as meat tenderizer[J]. Journal of Food Science and Technology,2020,57(1):310−318. doi: 10.1007/s13197-019-04062-4
[30] NADAR S S, RATHOD V K. Ultrasound assisted intensification of enzyme activity and its properties:A mini-review[J]. World Journal of Microbiology and Biotechnology,2017,33(9):170−181. doi: 10.1007/s11274-017-2322-6
[31] 李明奇. 复合嫩化剂对兔肉理化特性及贮藏品质的影响[D]. 重庆:西南大学, 2020. [LI M Q. Quality of rabbit meat and chemical properties and storage effect of compound tenderizer on physical[D]. Chongqing:Southwest University, 2020.] LI M Q. Quality of rabbit meat and chemical properties and storage effect of compound tenderizer on physical[D]. Chongqing: Southwest University, 2020.
[32] SHARMA S, VAIDYA D. Application of kiwifruit protease enzyme for tenderization of spent hen chicken[J]. Journal of Pharmacognosy and Phytochemistry,2018,7(1):581−584.
[33] OZUNA C, CÁRCEL J A, WALDE P M, et al. Low-temperature drying of salted cod (Gadus morhua) assisted by high power ultrasound:kinetics and physical properties[J]. Innovative Food Science & Emerging Technologies,2014,23(1):146−155.
[34] BAREKAT S, SOLTANIZADEH N. Improvement of meat tenderness by simultaneous application of high-intensity ultrasonic radiation and papain treatment[J]. Innovative Food Science & Emerging Technologies,2017,39(1):223−229.
[35] 付萧逸. 超声波辅助碳酸氢钠腌制对鸡肉品质的影响[D]. 合肥:安徽农业大学, 2019. [FU X Y. Effect of ultrasonic-assisted sodium bicarbonate curing on chicken quality[D]. Hefei:Anhui Agricultural University, 2019.] FU X Y. Effect of ultrasonic-assisted sodium bicarbonate curing on chicken quality[D]. Hefei: Anhui Agricultural University, 2019.
[36] 李明奇, 贺稚非, 李少博, 等. 氯化钙-无花果蛋白酶-猕猴桃蛋白酶复合嫩化剂体系改善兔肉嫩度和保水性的工艺优化[J]. 食品与发酵工业,2019,45(18):120−129. [LI M Q, HE Z F, LI S B, et al. Optimization of calcium chloride, ficin and kiwifruit protease tenderization system to improve the tenderness and water holding capability of rabbit meat[J]. Food and Fermentation Industries,2019,45(18):120−129.] LI M Q, HE Z F, LI S B, et al. Optimization of calcium chloride, ficin and kiwifruit protease tenderization system to improve the tenderness and water holding capability of rabbit meat[J]. Food and Fermentation Industries, 2019, 45(18): 120−129.
[37] THONGSOOK T, KONGBANGKERD T. Influence of calcium and silicon supplementation into Pleurotus ostreatus substrates on quality of fresh and canned mushrooms[J]. Food Science& Technology International New York,2011,17(4):351−365.
[38] 李琦. 不同蛋白酶对牦牛肉糜理化和凝胶特性的影响研究[D]. 成都:西南民族大学, 2020. [LI Q. Effects of different proteases on physico-chemical and gelation properties of yak meat patties[D]. Chengdu:Southwest University for Nationalities, 2020.] LI Q. Effects of different proteases on physico-chemical and gelation properties of yak meat patties[D]. Chengdu: Southwest University for Nationalities, 2020.
[39] HU X, WANG J Y, SUN L Y, et al. Effects of pulsed ultrasound treatment on the physicochemical and textural properties of chicken myofibrillar protein gel[J]. Food Science and Technology International,2021,28(4):309−319.
[40] ZHOU C S, MA H L, DING Q Z, et al. Ultrasonic pretreatment of corn gluten meal proteins and neutrase:Effect on protein conformation and preparation of ACE (angiotensin converting enzyme) inhibitory peptides[J]. Food & Bioproducts Processing,2013,91(4):665−671.
[41] 仪淑敏, 豁艳, 李睿智, 等. 碱性蛋白酶对鲢肌原纤维蛋白凝胶特性的影响[J]. 华中农业大学学报,2019,38(6):18−24. [YI S M, HUO Y, LI R Z, et al. Effect of alkali protease on gel properties of sliver carp myofibrillar protein[J]. Journal of Huazhong Agricultural University,2019,38(6):18−24.] YI S M, HUO Y, LI R Z, et al. Effect of alkali protease on gel properties of sliver carp myofibrillar protein[J]. Journal of Huazhong Agricultural University, 2019, 38(6): 18−24.
[42] LI Y Q, KONG B H, XIA X F, et al. Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to a hydroxyl radical-generating system[J]. Process Biochemistry,2013,48(5-6):863−870.
[43] FANG Z F, HUANG F R, LUO J, et al. Effects of dl-2-hydroxy-4-methylthiobutyrate on the first-pass intestinal metabolism of dietary methionine and its extra-intestinal availability[J]. British Journal of Nutrition,2010,103(5):643−651. doi: 10.1017/S0007114509992169
[44] 王玉珍. 低苯丙氨酸蛋清肽的制备及其吸附纯化机理研究[D]. 无锡:江南大学, 2021. [WANG Y Z. Study on the preparation and absorption purification mechanism of low phenylalanine egg white peptides[D]. Wuxi:Jiangnan University, 2021.] WANG Y Z. Study on the preparation and absorption purification mechanism of low phenylalanine egg white peptides[D]. Wuxi: Jiangnan University, 2021.
[45] PIMENTEL B F, ALVES C R, COSTA S G A, et al. Nutritional composition of low protein and phenylalanine-restricted dishes prepared for phenylketonuric patients[J]. LWT-Food Science and Technology,2014,57(1):283−289. doi: 10.1016/j.lwt.2013.12.031
[46] 涂婷, 汤晓艳, 汤舒越, 等. 不同贮藏与冻融方式对猪肉中氨基酸含量的影响[J]. 食品与发酵工业,2021,47(20):174−179. [TU T, TANG X Y, TANG S Y, et al. The effect of different storage and freeze-thaw method on the amino acids profile in pork[J]. Food and Fermentation Industries,2021,47(20):174−179.] TU T, TANG X Y, TANG S Y, et al. The effect of different storage and freeze-thaw method on the amino acids profile in pork[J]. Food and Fermentation Industries, 2021, 47(20): 174−179.
[47] 朱丽飞. 优化葡萄糖利用效率提高大肠杆菌L-苏氨酸产量[D]. 无锡:江南大学, 2019. [ZHU L F. Optimization of glucose utilization efficiency to improve the production of L-threonine in Escherichia coli[D]. Wuxi:Jiangnan University, 2019.] ZHU L F. Optimization of glucose utilization efficiency to improve the production of L-threonine in Escherichia coli[D]. Wuxi: Jiangnan University, 2019.
[48] LI Y J, ZHANG D Z, CAI N Y, et al. Betaine supplementation improved L-threonine fermentation of Escherichia coli THRD by upregulating zwf (glucose-6-phosphate dehydrogenase) expression[J]. Electronic Journal of Biotechnology,2019,39:67−73. doi: 10.1016/j.ejbt.2019.03.004
[49] LEE J H, CHO Y R, KIM J H, et al. Branched-chain amino acids sustain pancreatic cancer growth by regulating lipid metabolism[J]. Experimental and Molecular Medicine,2019,51(11):1−11.
[50] IWAI S, HASEGAWA T, IKEDA H O, et al. Branched chain amino acids promote ATP production via translocation of glucose transporters[J]. Investigative Ophthalmology & Visual Science,2022,63(9):7.
[51] TYURINA Y Y, SHVEDOVA A A, KAWAI K, et al. Phospholipid signaling in apoptosis:Peroxidation and externalization of phosphatidylserine[J]. Toxicology,2000,148(2−3):93−101. doi: 10.1016/S0300-483X(00)00199-2
[52] 孙丽曼. 大肠杆菌丙氨酸产生菌的构建及转录组分析[D]. 保定:河北大学, 2020. [SUN L M. Construction and transcriptomic analysis of E. coli alanine producing strains[D]. Baoding:Hebei University, 2020.] SUN L M. Construction and transcriptomic analysis of E. coli alanine producing strains[D]. Baoding: Hebei University, 2020.
[53] 方芮. L-赖氨酸和L-组氨酸对鸡肉蛋白质宰后磷酸化的影响[D]. 南京:南京农业大学, 2020. [FANG R. Effects of L-lysine and L-histidine on phosphorylation of post-mortem chicken proteins[D]. Nanjing:Nanjing Agricultural University, 2020.] FANG R. Effects of L-lysine and L-histidine on phosphorylation of post-mortem chicken proteins[D]. Nanjing: Nanjing Agricultural University, 2020.
[54] SAIBI W, FEKI K, YACOUBI I, et al. Bridging between proline structure, functions, metabolism, and involvement in organism physiology[J]. Applied Biochemistry and Biotechnology,2015,176(8):2107−2119. doi: 10.1007/s12010-015-1713-0
[55] 张乐, 陈润花, 门靖. 酪氨酸分析检测研究进展[J]. 精细化工中间体,2022,52(2):1−4,46. [ZHANG L, CHEN R H, MEN J. Research progress in the analysis and detection of tyrosine[J]. Fine Chemical Intermediates,2022,52(2):1−4,46.] ZHANG L, CHEN R H, MEN J. Research progress in the analysis and detection of tyrosine[J]. Fine Chemical Intermediates, 2022, 52(2): 1−4,46.
[56] PEÑA-GONZALEZ E, ALARCON-ROJO A D, GARCIA-GALICIA I, et al. Ultrasound as a potential process to tenderize beef:Sensory and technological parameters[J]. Ultrasonics Sonochemistry,2019,53:134−141. doi: 10.1016/j.ultsonch.2018.12.045
[57] 夏嗣廷, 胡睿智, 贺建华, 等. D-天冬氨酸生理功能及其在畜禽生产中的应用[J]. 动物营养学报,2019,31(10):4481−4487. [XIA S Y, HU R Z, HE J H, et al. Physiological function of D-aspartate and its application in animal production[J]. Chinese Journal of Animal Nutrition,2019,31(10):4481−4487.] XIA S Y, HU R Z, HE J H, et al. Physiological function of D-aspartate and its application in animal production[J]. Chinese Journal of Animal Nutrition, 2019, 31(10): 4481−4487.
[58] 王蜀金, 陈惠娜, 方思敏, 等. 功能性氨基酸在动物机体内的代谢利用与生理功能[J]. 家畜生态学报,2014,35(8):6−12. [WANG S J, CHEN H N, FANG S M, et al. Metabolism and physiological function of functional amino acids in animals[J]. Acta Ecologiae Animalis Domastici,2014,35(8):6−12.] WANG S J, CHEN H N, FANG S M, et al. Metabolism and physiological function of functional amino acids in animals[J]. Acta Ecologiae Animalis Domastici, 2014, 35(8): 6−12.
[59] WU G Y, BAZER F W, DAVIS T A, et al. Arginine metabolism and nutrition in growth, health and disease[J]. Amino Acids,2009,37(1):153−168. doi: 10.1007/s00726-008-0210-y
[60] 康大成. 超声波辅助腌制对牛肉品质的影响及其机理研究[D]. 南京:南京农业大学, 2017. [KANG D C. Effects and mechanism of ultrasound-assisted curing on the quality of beef[D]. Nanjing:Nanjing Agricultural University, 2017.] KANG D C. Effects and mechanism of ultrasound-assisted curing on the quality of beef[D]. Nanjing: Nanjing Agricultural University, 2017.
[61] SUN Q X, CHEN Q, XIA X F, et al. Effects of ultrasound-assisted freezing at different power levels on the structure and thermal stability of common carp (Cyprinus carpio) proteins[J]. Ultrasonics Sonochemistry,2019,54:311−320. doi: 10.1016/j.ultsonch.2019.01.026
[62] Food and Agriculture Organization of the United Nations (FAO). Food Policy and Food Science Service. Amino-acid content of foods and biological data on proteins[J]. Nutritional Studies,1968,26(24):1−285.
[63] 冷雪娇, 邓绍林, 章林, 等. 高压腌制对鸡胸肉微观结构的影响[J]. 食品科学,2015,36(1):99−103. [LENG X J, DENG S L, ZHANG L, et al. Effect of high pressure brining on microstructure of chicken breast[J]. Food Science,2015,36(1):99−103.] doi: 10.7506/spkx1002-6630-201501019 LENG X J, DENG S L, ZHANG L, et al. Effect of high pressure brining on microstructure of chicken breast[J]. Food Science, 2015, 36(1): 99−103. doi: 10.7506/spkx1002-6630-201501019
[64] LAWSON M A. The role of integrin degradation in post-mortem drip loss in pork[J]. Meat Science,2004,68(4):559−566. doi: 10.1016/j.meatsci.2004.05.019
-
期刊类型引用(6)
1. 郭玉龙,邵高耸,史轻舟,许焯,胡定煜,符式瑜. 纳米材料在食品检验鉴定中的应用研究进展. 山东化工. 2024(01): 91-94 .  百度学术
百度学术
2. 左海根,黄芷诺,李毛英,袁小珍,杜永琴,刘小玉,陈雨. 核酸适配体在雌二醇分析中的研究进展. 理化检验-化学分册. 2023(07): 862-868 .  百度学术
百度学术
3. 唐春花,杨洁,卢晓玲,陈美仑,魏铮,余鹏,赵佳. 甾体激素核酸适配体的筛选与应用. 生物化学与生物物理进展. 2023(09): 2146-2161 .  百度学术
百度学术
4. 于开宁,王润忠,刘丹丹. 水环境中新污染物快速检测技术研究进展. 岩矿测试. 2023(06): 1063-1077 .  百度学术
百度学术
5. 常嵘,叶巧燕,刘慧敏,郝欣雨,郭洪侠,郑楠. 牛奶中激素检测方法的研究进展. 食品安全质量检测学报. 2022(16): 5235-5243 .  百度学术
百度学术
6. 史学丽,高辉,周永红,赵伟. 一种基于适配体传感器的17β-雌二醇定量分析方法. 河北工业科技. 2021(05): 431-437 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:
 下载:
下载:



