Extraction Optimization of Flavonoid Compounds from Various Parts of Camellia japonica and Constituent Analysis of the Extracts
-
摘要: 目的:优化山茶花瓣、叶和花蕊三部位的黄酮提取量,比较抗氧化活性并分析其化学成分。方法:以总黄酮提取量为评价指标,通过单因素实验和正交试验优化超声波辅助酶解法黄酮提取工艺。采用DPPH、ABTS+自由基清除实验和还原力实验评价优化后总黄酮提取物的抗氧化能力。通过超高效液相色谱-四极杆飞行时间质谱联用技术(UPLC-QTOF-MS/MS)分析各部位的化学成分。结果:在最优提取工艺下,山茶各部位总黄酮提取量依次为叶(63.14 RE mg/g)>花蕊(58.77 RE mg/g)>花瓣(20.26 RE mg/g)。抗氧化活性测定结果表明,花瓣、叶、花蕊中黄酮清除DPPH自由基的IC50值分别为7.28、2.51、1.15 mg/mL,清除ABTS+自由基的IC50值分别为2.85、0.95、0.59 mg/mL,还原力分别为63.25、214.11、475.90 Trolox mg/g,其抗氧化强弱顺序为:花蕊>叶>花瓣。通过UPLC-QTOF-MS/MS从花瓣、叶、花蕊三部位共鉴定出29种化合物,且B型原花青素二聚体、表儿茶素、槲皮素-3-O-半乳糖苷等黄酮单体化合物在三个部位中的分布规律与总黄酮提取量一致。结论:超声波辅助酶法能够有效提高黄酮类化合物的提取量,且山茶的叶和花蕊部位具有较高黄酮含量及抗氧化活性。Abstract: Objective: To optimize the extraction amount of flavonoid from petals, leaves, stamens and pistils of Camellia japonica, respectively, and compare the antioxidant activity and analyze the chemical constituents of the extracts. Method: The total flavonoids extraction amount was used as evaluation index, and single-factor experiments and orthogonal tests were used to optimize the ultrasonic-assisted enzymatic extraction process of flavonoids. The antioxidant capacity of optimized flavonoids extract was evaluated by DPPH and ABTS+ free radical scavenging and reducing power experiment. And the chemical constituents of extracts from each part were qualitatively analyzed by ultra-performance-liquid-chromatography quadrupole time-of-flight mass spectrometry (UPLC-QTOF-MS/MS). Results: In the optimum extraction condition, the total flavonoids extraction amount form each part of Camellia japonica were in the order as follows: Leaves (63.14 RE mg/g)>stamens and pistils (58.77 RE mg/g)>petals (20.26 RE mg/g). Meanwhile, the results of antioxidant activity determination showed that the IC50 values of DPPH and ABTS+ free radical scavenging assay of extracts from petals, leaves, stamens and pistils were 7.28, 2.51, 1.15 mg/mL, and 2.85, 0.95, 0.59 mg/mL, respectively. And the reducing power value of extracts from petals, leaves, stamens and pistils were 63.25, 214.11, 475.90 Trolox mg/g. Therefore, the antioxidant activities of the extracts were in the order of stamens and pistils>leaves>petals. At last, a total of 29 flavonoid-related compounds were identified from the three parts by UPLC-QTOF-MS/MS, and the distribution pattern of B-type procyanidin dimer, epicatechin, quercetin-3-O-galactoside and some other flavonoid compounds in the three parts was consistent with that of total flavonoids extraction amount. Conclusion: Ultrasound-assisted enzymatic extraction effectively improved the extraction amount of flavonoids, and the leaves and stamens and pistils parts of Camellia japonica possessed higher flavonoid contents and stronger antioxidant activity.
-
山茶(Camellia japonica L.)为山茶科山茶属的植物,又名洋茶、山茶花,常绿灌木或小乔木,广泛分布于中国台湾、山东、江西等地,常作为城市绿化和校园观赏树种。同时也是现代纺织染色、化妆品及食品等领域的重要资源[1−3]。山茶具有多种药理活性,包括抗氧化、抗肿瘤、抗大鼠肝纤维化、抗血小板聚集和抑制血栓等[4]。其生物活性成分主要是黄酮、多酚和生物碱等化合物[5]。由于黄酮类化合物具有高效清除自由基和抑制活性氧的能力,被看作是自然界中抗氧化作用较强的一类天然化合物[6−8],故对山茶中黄酮类物质进行高效提取具有广阔的应用前景。研究表明,存在于植物不同部位的黄酮含量通常存在一定的差异[9−10],通过研究各部位黄酮含量可最大程度地开发天然产物的价值。近年关于山茶的研究主要集中于花瓣和种籽中化学成分的提取、鉴定及抗氧化能力评价等方面[11−13],而对山茶各部位黄酮类化合物的比较分析研究相对较少。因此,亟需系统分析对比山茶各部位的黄酮含量及化学成分,从而服务于山茶资源的全方位深度开发利用。
目前,多种从植物中提取黄酮类化合物的方法得到报道,包括超声波提取法[14]、微波提取法[15]、回流提取法[16]、酶法[17]等。超声波提取法能够促进药材中活性成分的溶出,具有缩短提取时间、提高收率和避免高温破坏活性成分等优点[18]。酶法能够破坏细胞壁从而加速有效成分的溶解,显著改善黄酮的提取量[19]。超声波辅助酶法能够结合两者优势,提高生物活性成分的提取效率及提取量,是目前从植物中提取活性成分的研究热点。超声波辅助酶法已在湖北海棠叶[20]、绿豆皮[21]、桑叶[22]等植物材料的黄酮提取过程中体现出较高效率,但尚未应用于山茶黄酮提取中。
综上所述,本实验以山茶的花瓣、叶和花蕊为研究对象,首次采用超声波辅助纤维素酶法优化提取山茶三部位中的总黄酮,并比较其抗氧化能力,通过超高效液相色谱-四极杆-飞行时间质谱联用(UPLC-QTOF-MS/MS)技术对各部位提取液物质进行定性分析,探究其化学成分组成,为山茶在食品和化妆品等领域的深度开发利用提供科学依据。
1. 材料与方法
1.1 材料与仪器
山茶‘赤丹’(Camellia japonica L. ‘chidan’,经宜春学院副教授尹培培鉴定) 采集于江西省宜春市宜春学院;甲醇、乙腈 色谱纯,天津市大茂化学试剂厂;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、水溶性维生素E(Trolox) 上海源叶生物科技有限公司;2,2联苯基-1-苦基肼基(DPPH) 上海阿拉丁生化科技有限公司;芦丁标准品 北京博奥拓科技有限公司;纤维素酶(10000 U/g) 上海化源世纪贸易有限公司;其它试剂均为分析纯。
Tecan Infinite 200多功能酶标仪 瑞士帝肯公司;UPLC-QTOF-MS/MS 美国安捷伦公司;KQ2200E超声波提取仪 昆山市超声仪器。
1.2 实验方法
1.2.1 山茶的预处理
将山茶(图1a)清水洗净后分为花瓣(图1b)、叶(图1c)和花蕊(图1d)三部分,将三组样品于105 ℃烘箱杀青15 min,置于60 ℃烘箱干燥后粉碎并称重保存至−20 ℃冰箱。
1.2.2 总黄酮的提取
准确称取山茶的花瓣、叶、花蕊样品各0.5 g,分别置于50 mL离心管中,加入10 mL纤维素酶溶液(pH4.8),50 ℃加热酶解15 min。100 ℃水浴灭酶30 s,加入10 mL 95%乙醇溶液置于恒定功率100 W超声波提取仪中,并在不同的超声温度和超声时间下进行提取,过滤得上清液,于冰箱4 ℃保存备用。
1.2.3 总黄酮提取量的测定
参考尹培培等[23]方法并稍加改动。取120 μL的芦丁标准品和样品溶液于96孔板,加入8 μL亚硝酸钠溶液(0.05 g/mL)在室温下反应6 min,再加入8 μL氢氧化铝溶液(0.1 g/mL)反应5 min,最后加入100 μL氢氧化钠溶液(0.04 g/mL)反应30 min,于410 nm波长下用酶标仪检测,每份样品重复三次。以芦丁标准溶液的浓度C(mg/L)为横坐标,吸光度值A为纵坐标,绘制得到回归方程曲线y=0.0043x+0.0551,决定系数R2=0.9997。总黄酮提取量用芦丁当量(rutin equivalent,RE)表示,表达为RE mg/g,按公式(1)计算总黄酮提取量。
总黄酮提取量(REmg/g)=(C×V×N)/m (1) 式中:C为总黄酮提取液的质量浓度,mg/mL;V为总黄酮提取液的体积,mL;N为稀释倍数;m为样品的质量,g。
1.2.4 单因素实验设计
参照1.2.2中方法进行总黄酮提取,固定其他条件(纤维素酶含量25 U/mL,超声温度40 ℃,超声时间30 min)依次考察不同超声温度(20、40、60、80 ℃)、不同超声时间(10、30、50、70 min)、不同含量的纤维素酶(15、25、35、45 U/mL)对山茶各部位总黄酮提取量的影响。提取量以1.2.3中方法进行计算。
1.2.5 正交试验设计
在单因素实验基础上,选用L9(34)正交表,以总黄酮提取量为指标,选取酶含量、超声温度和超声时间进行正交试验,以确定山茶各部位黄酮的最佳提取工艺。因素水平见表1。
表 1 正交试验因素水平表Table 1. Factors and levels of orthogonal test水平 A超声温度(℃) B超声时间(min) C酶含量(U/mL) 1 40 10 15 2 60 30 25 3 80 50 35 1.2.6 抗氧化活性的测定
1.2.6.1 DPPH自由基清除能力测定
参照尹培培等[23]的方法,稍作修改。花瓣、叶、花蕊各样品溶液按照1.2.5正交试验确定的最佳工艺进行提取,提取液以提取溶剂(47.5%乙醇)进行稀释,用于后续的抗氧化活性鉴定。取Trolox标准溶液、稀释至合适倍数的样品溶液和空白溶液各10 μL于96孔板中,依次加入40 μL的DPPH甲醇溶液和190 μL的甲醇溶液,避光静置30 min后,使用酶标仪在517 nm波长处进行检测,每组实验重复三次。以Trolox溶液浓度(μg/mL)作横坐标,DPPH自由基清除率(%)作纵坐标,绘制得到回归方程曲线y=0.2215x+0.4905,决定系数R2=0.9988。按照公式(2)计算清除率。
DPPH自由基清除率(%)=(A0−AS)/A0×100 (2) 式中:AS为提取物溶液吸光度值,A0为空白溶液吸光度值。
1.2.6.2 ABTS+自由基清除能力测定
参照尹培培等[23]的方法,样品溶液提取方法同1.2.6.1。分别取Trolox标准溶液、样品溶液和空白溶液各5 μL加入到200 μL的ABTS标准溶液中,混匀后避光静置5 min,测定其在734 nm波长处的吸光度值,每组实验重复三次。以Trolox溶液浓度(μg/mL)作横坐标,ABTS+自由基清除率(%)作纵坐标,绘制得到回归方程曲线y=0.1616x−0.8973,决定系数R2=0.9993。按照公式(3)计算清除率。
ABTS+自由基清除率(%)=(A0−AS)/A0×100 (3) 式中:AS为提取物溶液吸光度值,A0为空白溶液吸光度值。
1.2.6.3 还原力清除能力测定
参照尹培培等[23]的方法,以Trolox作标准品,样品溶液提取方法同1.2.6.1。在400 μL的样品溶液中依次加入磷酸缓冲液和铁氰化钾溶液,充分混匀后于50 ℃水浴中静置20 min;再加入500 μL三氯乙酸溶液并静置10 min。量取1000 μL上清液,加入1000 μL的蒸馏水和200 μL的氯化铁溶液充分混匀,于700 nm波长处进行检测,吸光度值越大,表明还原力越强。以Trolox浓度(μg/mL)为横坐标,吸光度值(A)为纵坐标,绘制得到回归方程曲线y=0.001x+0.0298,决定系数R2=0.9957。样品的还原力抗氧化活性表示为Trolox mg/g,按照公式(4)计算当量。
还原力(Troloxmg/g)=(C×V×N)/m (4) 式中:C为总黄酮提取液的质量浓度,mg/mL;V为总黄酮提取液的体积,mL;N为稀释倍数;m为样品的质量,g。
1.2.7 UPLC-QTOF-MS/MS成分分析
1.2.7.1 样品的制备
取花瓣、叶、花蕊各0.5 g,按照1.2.5正交试验确定的最佳工艺进行提取,将提取液过滤,取2 mL上清液涡旋2次,用微孔滤膜(0.22 μm)滤过后进样。
1.2.7.2 色谱和质谱采集条件
参照Hong等[24]的方法,稍作修改。色谱柱:Agilent C18色谱柱(2.1 mm×100 mm,1.8 μm),扫描波长为190~400 nm。流动相A为乙腈溶液,流动相B为0.1%甲酸水溶液,梯度洗脱程序:0~15 min,98%~80% B;15~20 min,80%~60% B;20~25 min,60%~20% B;25~27 min,20%~0% B;27~27.1 min,0%~98% B;27.1~30 min,98% B。流速为0.3 mL/min,提取物溶液的进样量为5 μL。
质谱条件:电喷雾离子源扫描方式,采用负离子模式(ESI−),毛细管电压为3.5 kV,离子源加热温度为320 ℃,锥孔电压为65 V,碰撞能量为25 eV,扫描范围为100~1700 m/z。根据总离子扫描图确定母离子,再通过二级质谱分析,找出二级质谱中响应信号较强的碎片离子与已有文献和Metlin、HMDB等液质数据库对比,以确定化合物的主要成分。对各化合物总离子流色谱峰进行积分得到峰面积,并对三个部位中各化合物峰面积进行整体归一化。将最小峰面积归一化为1,得到其他化合物峰面积的对应倍数,以此进行相对含量描述。
1.3 数据处理
本研究实验均重复三次,实验结果以平均值±标准差(SD)表示。采用软件SPSS 22.0进行单因素方差分析(one-way ANOVA)和IC50的计算,P<0.05被设定为差异显著。
2. 结果与分析
2.1 单因素实验
2.1.1 超声温度对总黄酮提取量的影响
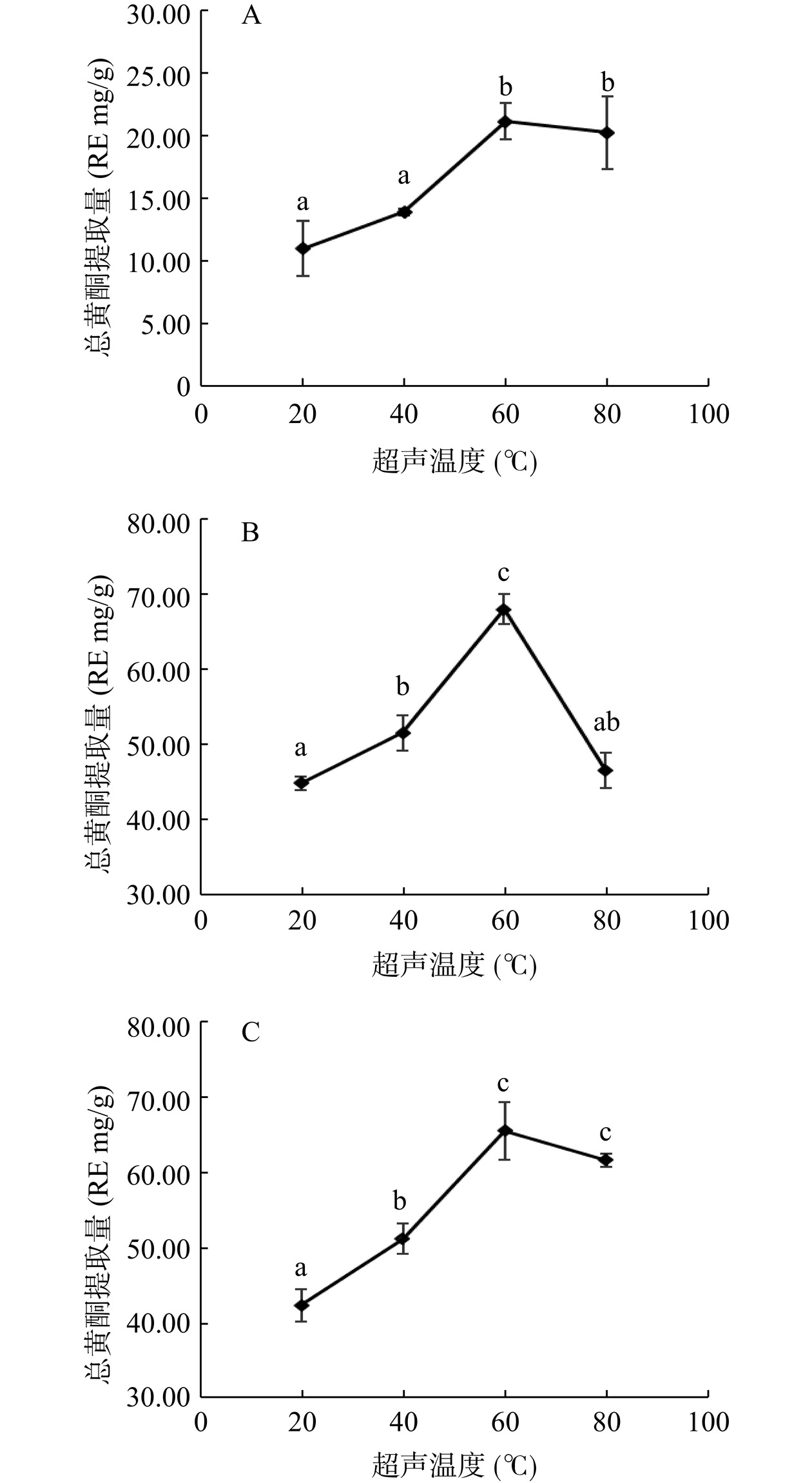
由图2可知,超声温度对山茶各部位黄酮的提取具有较大影响,在20~80 ℃范围内,花瓣(图2A)总黄酮提取量随超声温度的增加呈先上升后平稳的趋势,在60 ℃时达到最大值;叶(图2B)和花蕊(图2C)总黄酮提取量随超声温度的升高而先呈现增加趋势,在60 ℃时总黄酮提取量达到最高,此后随着温度的继续上升,样品中的黄酮类溶出量呈显著性下降(P<0.05)。高温有利于黄酮类物质的溶出,一定范围内温度上升越高,分子热运动速度越快,总黄酮提取量越高。但是当温度超出一定范围后,过高温度会导致黄酮类物质内部结构被破坏,导致提取量降低[25]。综上所述,从提取效率和条件可控性方面考虑,以超声温度40、60、80 ℃进行正交试验。
2.1.2 超声时间对总黄酮提取量的影响
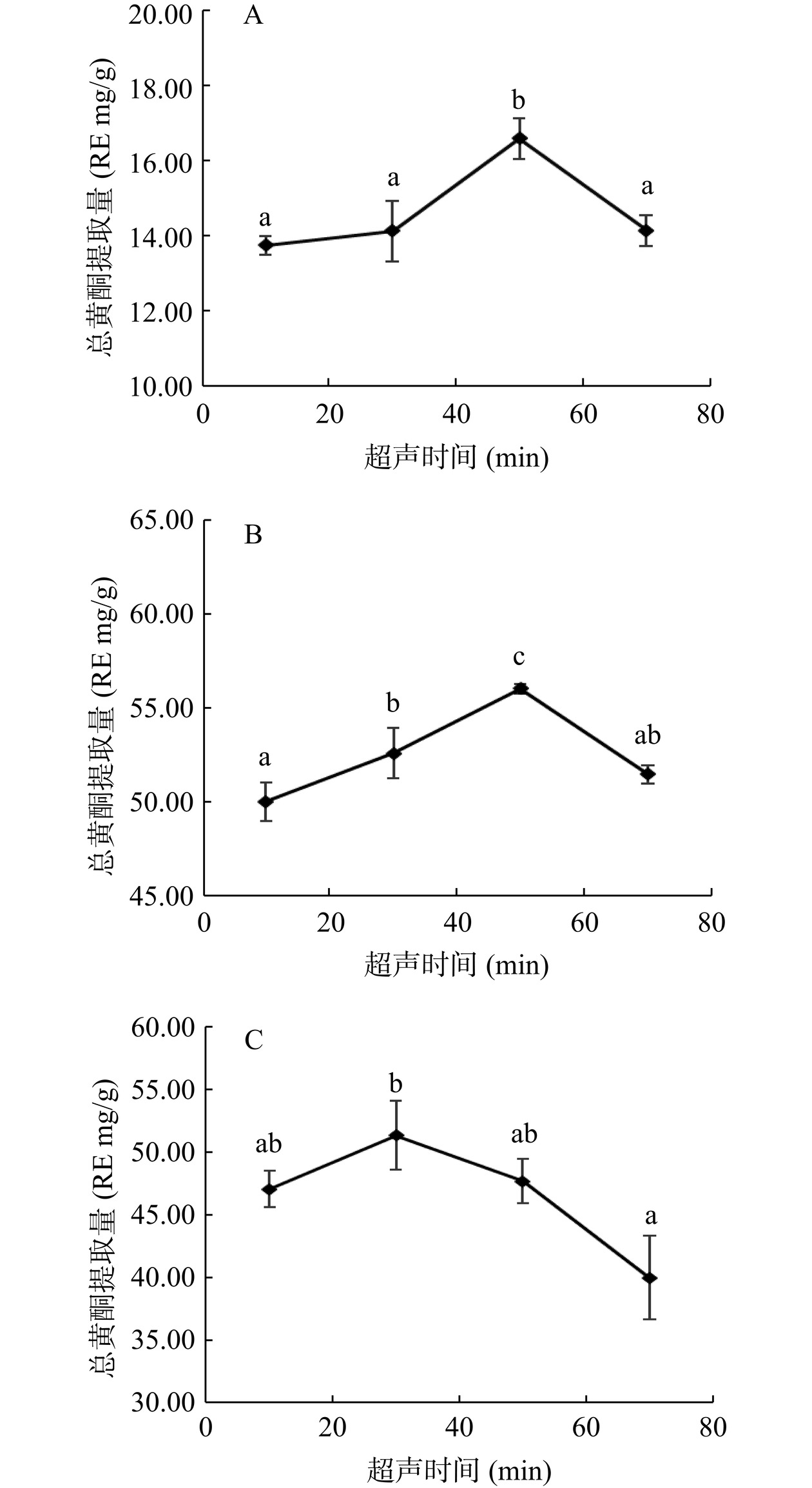
由图3可知,山茶各部位总黄酮提取量随着超声时间的增加而逐渐增加,在10~30 min范围内增长速度较快,此时花瓣、叶、花蕊细胞壁逐渐被破坏,在超声波作用下黄酮类物质不断溶出。当超声时间继续增加时,花瓣(图3A)和叶(图3B)两部位的总黄酮提取量在50 min后,花蕊(图3C)在30 min后呈下降趋势。在过长的超声时间下,黄酮类化合物会氧化、分解,致使总黄酮提取量减少[26]。综上所述,从总黄酮提取量、节约时间和成本等方面考虑,选择超声时间10、30、50 min进行正交试验。
2.1.3 酶含量对总黄酮提取量的影响
从图4中可以看出,在纤维素酶含量15~35 U/mL范围时,随着酶含量增加的越多,各部位的总黄酮提取量均呈显著上升趋势(P<0.05),这是由于纤维素酶能够催化植物细胞壁中β-D-葡萄糖苷键的水解,改变细胞的通透性,酶含量增加时,酶会促进黄酮类物质与提取溶剂的接触,使黄酮提取效率增高;当酶含量超过35 U/mL后,花瓣(图4A)、花蕊(图4C)无显著性变化,趋于平稳状态,而叶(图4B)中显著下降(P<0.05)。这可能是因为酶浓度过高的情况下,过多的酶会覆盖在山茶花各部位的表面,阻碍黄酮类物质的溶出[27]。综上所述,基于改善提取效率和节约材料的目的,选择纤维素酶含量15、25、35 U/mL进行正交试验。
2.2 正交试验
2.2.1 正交试验优化提取工艺
正交试验优化结果如表2所示,以L9(34)正交试验设计。由极差分析结果可知,影响花瓣、叶、花蕊总黄酮提取量因素大小顺序均为A(超声温度)>B(超声时间)>C(酶含量)。花瓣部位总黄酮最佳提取工艺为A2B2C2,即60 ℃、30 min和25 U/mL;叶部位为A3B2C2,即80 ℃、30 min和25 U/mL;花蕊部位为A3B1C3,即80 ℃、10 min和35 U/mL。
表 2 正交试验结果Table 2. Results of orthogonal experiment试验号 A B C 空白 总黄酮提取量(RE mg/g) 花瓣 叶 花蕊 1 1 1 1 1 15.23 47.61 52.88 2 1 2 2 2 14.25 53.56 52.74 3 1 3 3 3 14.29 47.89 52.58 4 2 1 2 3 16.79 54.78 57.6 5 2 2 3 1 18.03 58.53 56.9 6 2 3 1 2 16.31 49.80 51.27 7 3 1 3 2 15.70 59.61 59.04 8 3 2 1 3 16.78 60.84 58.67 9 3 3 2 1 17.44 60.99 55.73 花瓣 K1 14.59 15.91 16.11 16.90 K2 17.04 16.35 16.16 15.42 K3 16.64 16.01 16.01 15.95 R 2.45 0.44 0.15 1.48 叶 K1 49.69 54.00 52.75 55.71 K2 54.37 57.64 56.44 54.32 K3 60.48 52.89 55.34 54.50 R 10.79 4.75 3.69 1.39 花蕊 K1 52.73 56.51 54.27 55.17 K2 55.26 56.10 55.36 54.35 K3 57.81 53.19 56.17 56.28 R 5.08 3.31 1.90 1.93 2.2.2 正交试验结果的方差分析
对花瓣、叶、花蕊的正交试验结果进行方差分析,若P<0.05,则具有显著性差异。结果如表3所示。花瓣和花蕊的三个因素均对黄酮的提取影响不显著,叶中仅A(超声温度)对黄酮的提取影响显著(P<0.05)。影响各部位总黄酮提取量的主次因素为A(超声温度)>B(超声时间)>C(酶含量),与直观分析结果一致。
表 3 正交试验结果方差分析Table 3. Analysis of variance of orthogonal experimental results因素 偏差平方和 自由度 F值 P值 显著性 花瓣 A 10.36 2 3.07 0.25 B 0.32 2 0.10 0.91 C 0.04 2 0.01 0.99 误差 3.38 2 叶 A 175.76 2 51.52 0.02 * B 37.06 2 10.86 0.08 C 21.58 2 6.33 0.14 误差 3.41 2 花蕊 A 38.71 2 6.85 0.13 B 19.61 2 3.47 0.22 C 5.45 2 0.97 0.51 误差 5.65 2 注:“*”表明因素影响显著,P<0.05。 2.2.3 验证实验
根据正交结果分析,筛选山茶各部位总黄酮提取的最佳工艺,制备3份平行试样,得到的花瓣、叶、花蕊总黄酮提取量分别为20.26、63.14、58.77 RE mg/g,总黄酮提取量大小顺序依次为叶>花蕊>花瓣,且各部位中总黄酮提取量总体上高于正交试验表中9次结果,表明山茶黄酮提取优化工艺的可靠性和准确性。
本文采用超声波辅助酶法提取山茶的花瓣、叶、花蕊三个部位的黄酮。与传统的提取工艺相比,采用超声波辅助法提取山茶中总黄酮工艺安全可靠,能缩短提取时间,且有效提高黄酮类物质的溶出速率。尚志春等[28]采用传统溶剂法从南山茶中提取的总黄酮提取量仅达1.52%,此法不仅耗时间长,且提取效率不高;Liu等[12]采用超声辅助法提取山茶叶中总黄酮,提取量可达4.765%,奕志英等[29]同样使用此法对山茶花、叶进行提取,其黄酮提取量可达19.24 mg/g。可见,超声波辅助法在黄酮提取量上均高于传统溶剂提取法,本次实验在超声波辅助法的基础上结合酶法提取山茶各部位总黄酮,正交试验优化提取工艺下花瓣、叶、花蕊总黄酮提取量分别可达20.26、63.14、58.77 RE mg/g,表明加入适当的酶能增加提取总黄酮的有效性。
2.3 花瓣、叶、花蕊总黄酮的抗氧化活性分析
2.3.1 花瓣、叶、花蕊总黄酮对DPPH自由基清除能力
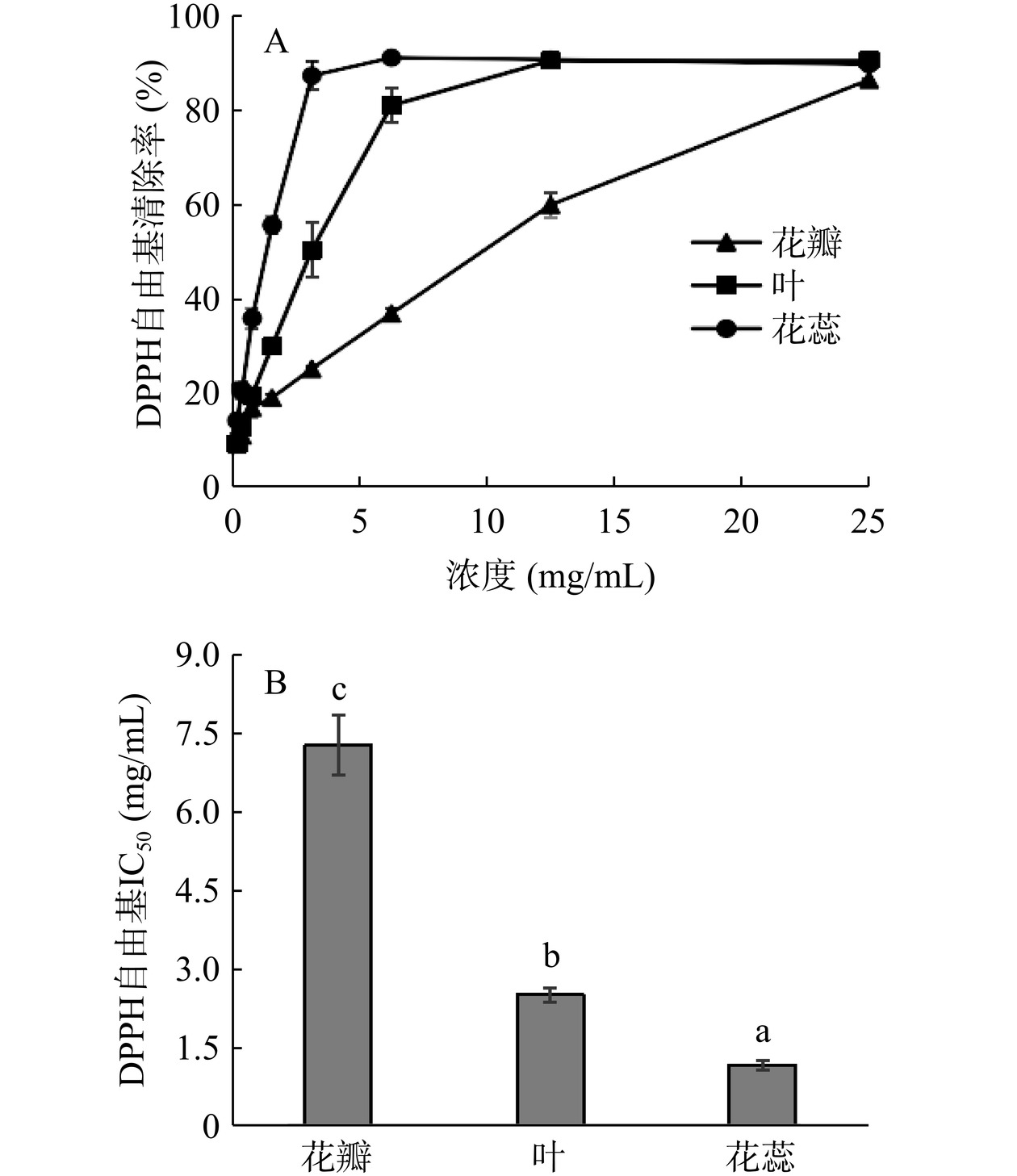
山茶各部位总黄酮对DPPH自由基的清除作用结果如图5所示。在0~25 mg/mL范围内,花瓣中总黄酮(图5A)对DPPH自由基的清除率随浓度的增加而增加,在25 mg/mL时达到最高清除率为87.44%;叶和花蕊总黄酮(图5A)随浓度的增加其自由基清除率明显提高,并随浓度继续增加趋于平缓,其DPPH自由基清除率最高可分别达90.65%和91.15%。经SPSS 22.0软件计算花瓣、叶、花蕊总黄酮对DPPH自由基清除的IC50值分别为7.28、2.51和1.15 mg/mL,叶和花蕊两部位的总黄酮对DPPH自由基的清除作用明显,清除效果显著高于花瓣(P<0.05),即花蕊>叶>花瓣。
2.3.2 花瓣、叶、花蕊总黄酮对ABTS+自由基清除能力
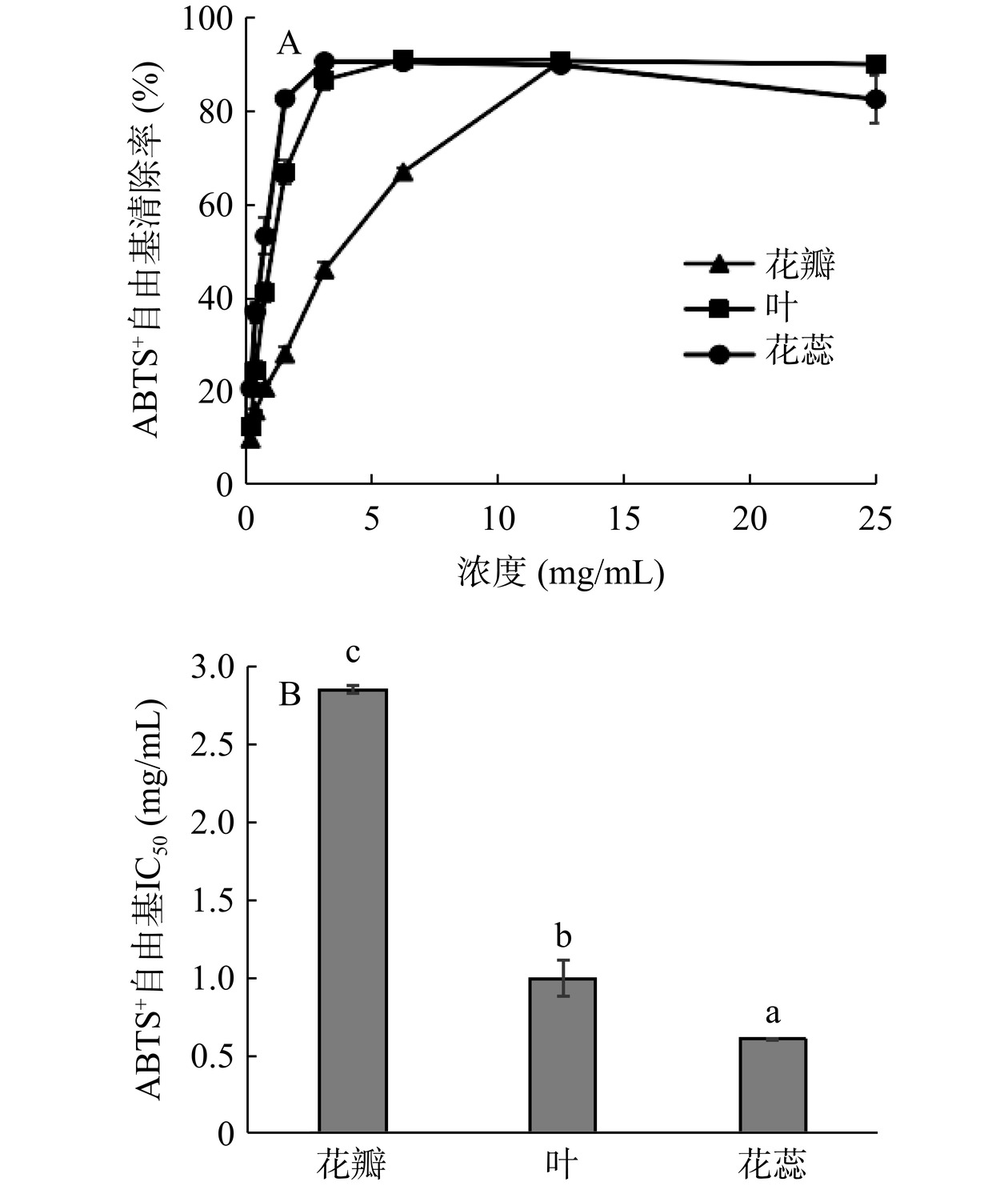
山茶各部位对ABTS+自由基的清除作用结果如图6所示,在0~25 mg/mL时,各部位溶液的ABTS+自由基清除率随浓度的增加明显增高,浓度继续增大时,花瓣和叶(图6A)各浓度间清除率趋于平稳状态,而花蕊(图6A)清除率呈下降趋势,花瓣、叶、花蕊清除率最高可分别达到90.70%、90.99%和90.60%。经SPSS 22.0软件计算花瓣、叶、花蕊总黄酮对ABTS+自由基清除的IC50值分别为2.85、0.95和0.59 mg/mL,故各部位总黄酮对ABTS+自由基清除效果为花蕊>叶>花瓣。
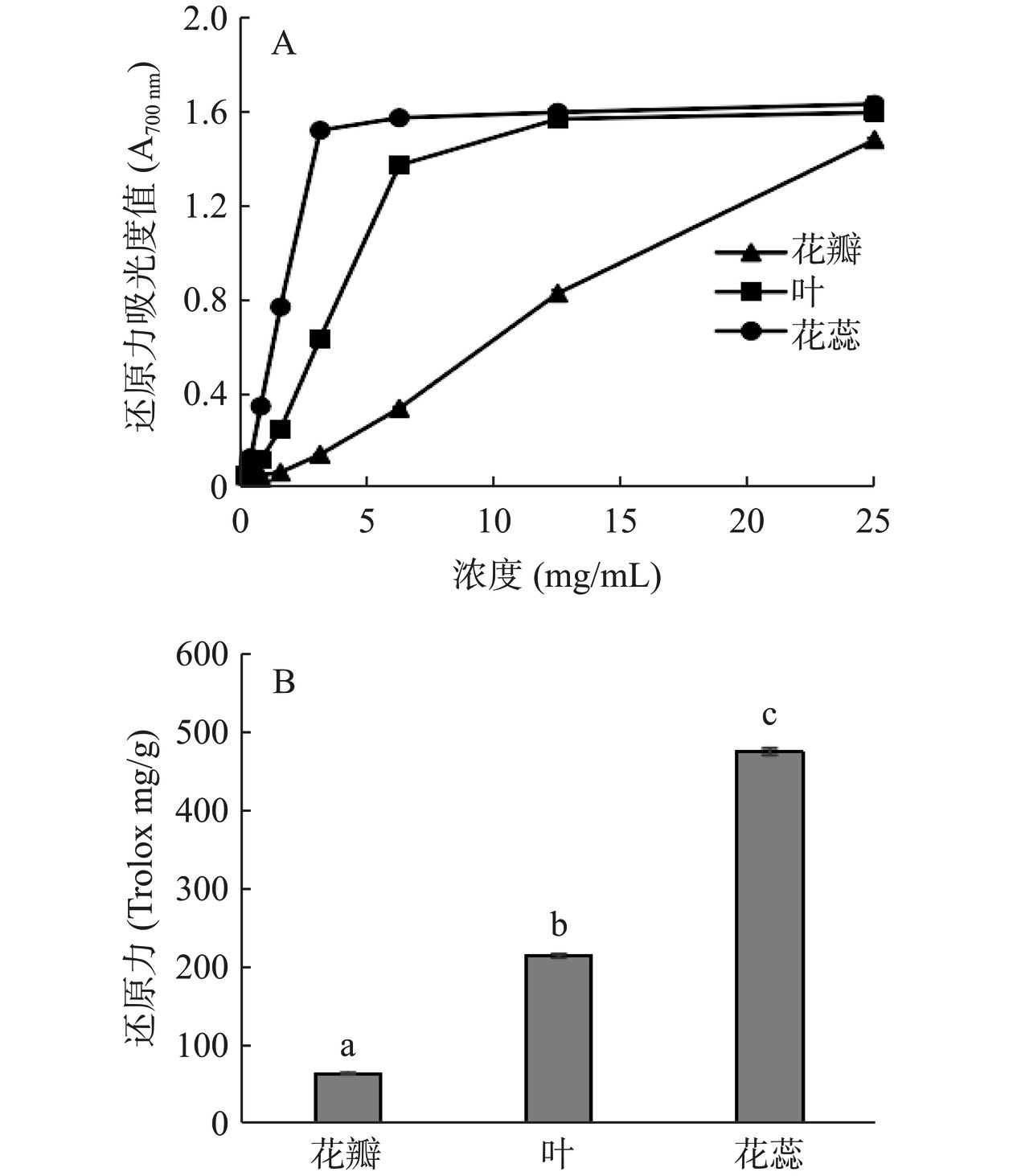
2.3.3 花瓣、叶、花蕊总黄酮还原力
山茶各部位总黄酮的还原力测定结果如图7所示,在0~25 mg/mL范围内,不同部位总黄酮的还原能力随浓度的增加而增加,提取液的浓度与总黄酮的还原力之间存在一定的量效关系,当浓度达到25 mg/mL时,花瓣、叶、花蕊(图7B)的还原能力呈最大值,分别为63.25、214.11、475.90 Trolox mg/g。经SPSS 22.0软件分析,各部位总黄酮的还原力当量存在显著性差异(P<0.05),综上可推断出还原能力顺序为花蕊>叶>花瓣。
黄酮类化合物是由植物通过次生代谢所产生的物质,由于其特有的理化性质和生物活性常用于抑制过氧化物的形成,是一类具有研究潜力的天然抗氧化剂。Liu等[12]、奕志英等[29]均通过观察山茶花对自由基的清除作用,发现提取物中总黄酮的含量与DPPH自由基和羟基自由基清除能力存在明显的相关性,结果与本研究一致。
2.4 UPLC-QTOF-MS/MS物质分析
利用UPLC-QTOF-MS/MS技术分别对山茶的花瓣、叶和花蕊提取物中活性成分首先进行定性分析,利用Qualitative Analysis 10.0质谱分析软件对总离子流图进行提取,得到各化合物的母离子流图及碎片离子图谱,结果如表4、图8~图9所示。共鉴定到29种化合物,其中10种化合物在三个样品中均被鉴定到。
表 4 山茶提取物的质谱分析Table 4. Mass spectrometry analysis of extracts from C. japonica类别 序号 保留时间(min) 化合物 分子式 分子离子
(m/z)碎片离子
(m/z)相对含量 液质鉴定
参考文献花瓣 叶 花蕊 黄酮类 1 5.222 儿茶素(Catechin) C15H14O6 289.07 109、123、137、151、203、245 18.91 9.80 35.90 An等[30] 2 6.042 B型原花青素二聚体
(B-type procyanidin dimer)C30H26O12 577.13 289、407、425、451 5.88 29.18 7.74 Da等[31] 3 6.610 原花青素B2(Procyanidin B2) C30H26O12 577.13 289、407、425、451 3.15 23.12 14.46 Da等[31] 4 7.220 表儿茶素(Epicatechin) C15H14O6 289.07 109、123、137、151、203、245 53.60 833.95 111.38 An等[30] 5 7.556 二氢山奈酚-半乳糖苷
(Dihydrokaempferol-galactoside)C21H22O11 449.10 125、151、269、287 2.77 n.d. n.d. An等[30] 6 11.216 杨梅苷(Myricitrin) C21H20O12 463.08 287、316 12.40 n.d. n.d. Yang等[32] 7 11.363 芦丁(Rutin) C27H30O16 609.14 151、300、301 1.00 318.73 24.84 Ren等[33]、
Hao等[34]8 11.510 槲皮素-3-O-半乳糖苷
(Quercetin-3-O-galactoside)C21H20O12 463.08 255、300 14.30 105.84 81.36 Yang等[32] 9 11.869 儿茶素二聚体(Catechin dimer ) C30H26O12 577.13 289、407、425、451 1.22 3.22 n.d. An等[30] 10 11.953 槲皮素-3-O-葡萄糖苷
(Quercetin-3-O-glucoside)C21H20O12 463.08 255、300 n.d. 153.30 40.77 Yang等[32] 11 12.374 槲皮素3-O-阿拉伯呋喃糖苷
(Quercetin-3-O-arabinofuranoside)C20H18O11 433.07 255、271、300 1.85 30.94 7.74 Yang等[32] 12 12.500 山奈酚-3-O-芦丁苷
(Kaemferol-3-O-rutinoside)C27H30O15 593.15 284、285 n.d. 3.68 49.76 Ren等[33]、
Shen等[35]13 12.795 木犀草苷(Luteoloside) C21H20O11 447.09 151、227、255、285、447 5.72 10.60 45.96 Ren等[33]、
Cao等[36]14 12.963 槲皮素-3-O-阿拉伯吡喃糖苷
(Quercetin-3-O-arabinopyranoside)C20H18O11 433.07 243、255、300 n.d. 12.36 n.d. Yang等[32] 15 13.468 槲皮素-鼠李糖苷
(Quercetin-rhamnosid)C21H20O11 447.09 151、301 n.d. 10.34 23.97 An等[30] 16 13.489 紫云英苷(Astragalin) C21H20O11 447.09 151、284、285 1.47 10.51 n.d. Ren等[33]、
Hao等[34]17 13.529 槲皮素-3-O-鼠李糖苷
(Quercetin-3-O-rhamnoside)C21H20O11 447.09 255、271、300 1.42 n.d. n.d. Yang等[32] 18 14.054 山奈酚-鼠李糖苷
(Kaempferol-rhamnoside)C21H20O10 431.09 151、285 1.23 n.d. n.d. An等[30] 19 15.464 山奈酚-3-O-α-L-鼠李糖苷
(Kaempferol-3-O-α-L-rhamnoside )C21H20O10 431.09 227、255、285 1.61 n.d. n.d. Yang等[32] 20 17.167 槲皮素(Quercetin) C15H10O7 301.03 243、301 n.d. n.d. 8.72 Yang等[32] 21 18.975 山奈酚(Kaempferol) C15H10O6 285.04 159、187、211、239 n.d. n.d. 11.57 An等[30] 酚酸类 22 0.912 奎尼酸(Quinic acid) C7H12O6 191.05 111、127 39.82 24.73 30.98 Yang等[32] 23 1.311 水杨酸-O-吡喃葡萄糖苷
(Salicylic acid-O-glucopyranoside )C13H16O8 299.07 137、299 1.42 n.d. n.d. Cao等[36]、
Sun等[37]24 1.394 没食子酸(Gallic acid) C7H6O5 169.01 125、169、241 n.d. n.d. 6.48 Yang等[32] 25 4.107 咖啡酸-O-吡喃葡萄糖苷
(Caffeic acid-O-glucopyranoside)C15H18O9 341.08 135、179 5.69 n.d. n.d. Sun等[37] 26 4.759 原儿茶酸(Protocatechuic acid) C7H6O4 153.01 108、109 n.d. n.d. 4.77 An等[30]、
Frolov等[38]27 5.895 对香豆酸-O-吡喃葡萄糖苷
(p-Coumaric acid-O-glucopyranoside)C15H18O8 325.09 119、163 7.23 3.95 3.63 Sun等[37] 28 6.421 对香豆酸-O-葡萄糖基酯
(p-Coumaric acid-O-glucosyl ester)C15H18O8 325.09 119、163、205、235、265 5.97 n.d. n.d. Sun等[37] 29 6.989 香草酸-O-吡喃葡萄糖苷
(Vanillic acid-O-glucopyranoside)C14H18O9 329.08 123、167 2.68 n.d. n.d. Sun等[37] 注:n.d.表示在此部位未检测到该成分。 2.4.1 黄酮类化合物
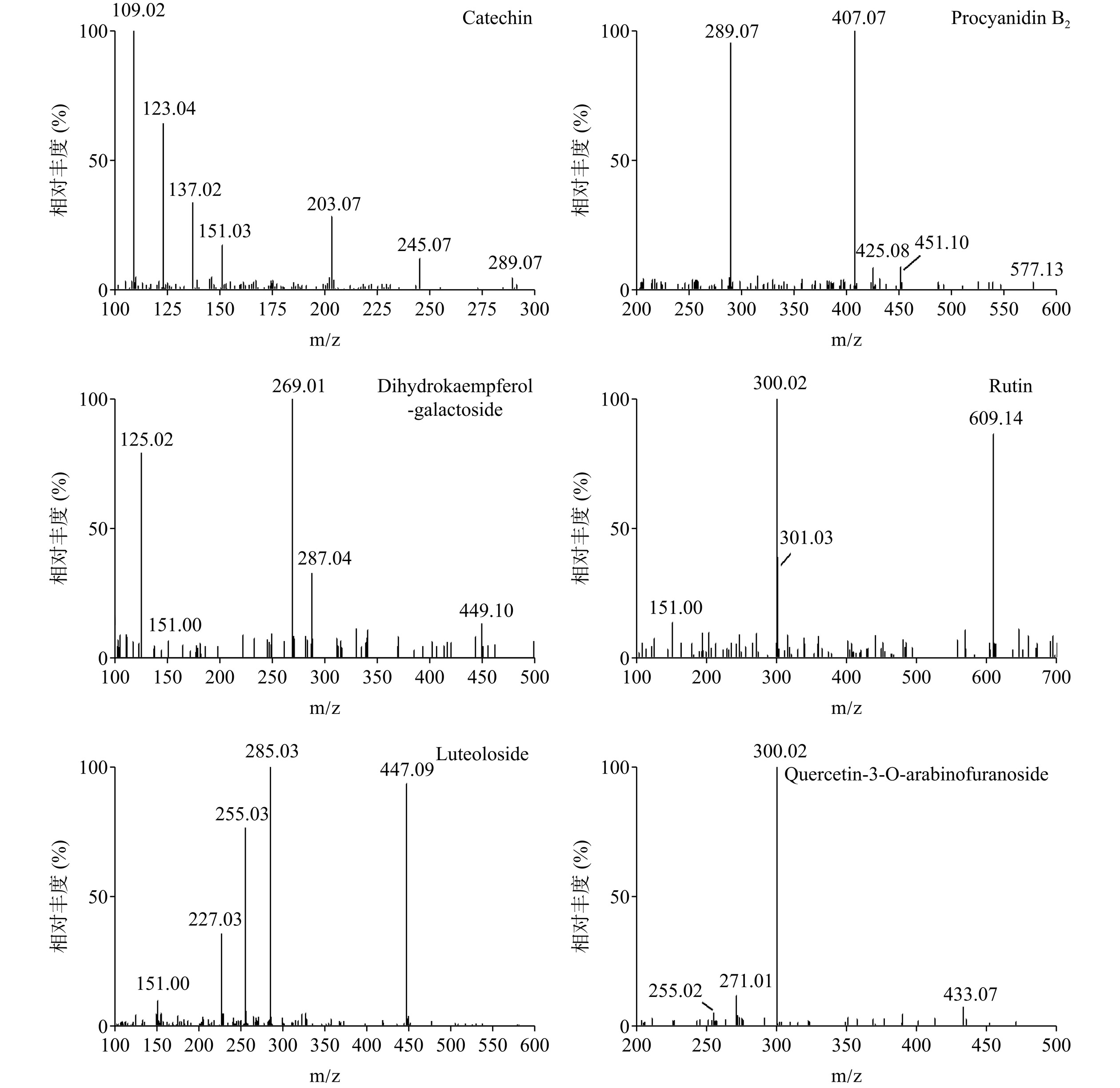
在山茶各部位中共鉴定得到21种黄酮类物质,其中在花瓣部位中鉴定得到15种,而在叶部位中鉴定得到14种,而花蕊部位中13种,各部位鉴定出8种共有黄酮类化合物。其中,儿茶素、木犀草苷成分在花蕊部位中的占比最大,B型原花青素二聚体、原花青素B2、表儿茶素、芦丁、槲皮素-3-O-半乳糖苷、槲皮素3-O-阿拉伯呋喃糖苷成分在叶部位中的占比最大。
以一级质谱中总离子流出峰时间在5.222 min的1号和7.220 min的4号化合物为例,在此时间点时均有一个质荷比m/z=289.07的较强的母离子峰,其二级质谱中带有质荷比为m/z=109、123、137、151、203和245的碎片离子,分别对应于C10H12O3、C9H10O3、C8H8O3、C7H6O3、C4H6O2和CO2的缺失,结合洗脱时间分别被鉴定为儿茶素和表儿茶素[30]。儿茶素与表儿茶素是山茶中具有代表性的黄酮类成分,报道具有多种生物活性[30]。
由2号化合物B型原花青素二聚体和3号化合物原花青素B2可知,两者一级谱图中的质核比m/z=577.13,其离子碎片m/z 451来自于1,3,5-三羟基苯,前体离子经过反应后,失去了一个(表)儿茶素单元,产生m/z 289的碎片离子,再根据m/z为407和425碎片离子鉴定以上两种化合物,保留时间分别为6.042和6.610 min[31]。植物中的原花青素是由不同数量的儿茶素或表儿茶素结合而成的一种类黄酮化合物,因具有抗氧化、抗炎症、保护心血管系统等多种药理作用可被应用于医疗领域[39]。Hong等[24]通过UPLC-QTOF-MS技术也鉴定出山茶籽饼中含有原花青素B2成分。
2.4.2 酚酸类化合物
在山茶各部位中共鉴定得到8种酚酸类物质。其中在花瓣部位中鉴定得到6种,叶部位中鉴定得到2种,而花蕊部位中4种。
以一级质谱中总离子流出峰时间在1.311 min的23号、4.107 min的25号、5.895 min的27号和6.989 min的29号化合物为例,均失去葡萄糖基后得到碎片离子,23号化合物得到质核比m/z为137和299的碎片离子,25号化合物得到质核比m/z为135和179碎片离子,27号化合物得到质核比m/z为119、163的碎片离子,29号得到质核比m/z为123、167的碎片离子,并且根据已有文献的报道,初步鉴定23号化合物为水杨酸-O-吡喃葡萄糖苷,25号化合物为咖啡酸-O-吡喃葡萄糖苷,27号化合物为对香豆酸-O-吡喃葡萄糖苷,29号化合物为香草酸-O-吡喃葡萄糖苷[37];上述四种酚酸类化合物的裂解模式在Cao等[36]研究中也有报道。
综上所述,各部位液质鉴定结果表明,B型原花青素二聚体、表儿茶素、槲皮素-3-O-半乳糖苷和槲皮-3-O-阿拉伯呋喃糖苷四种黄酮单体化合物在三个部位中的分布与总黄酮提取量一致,具有作为标志性活性物质的可能。此外,除鉴定出常见的几种黄酮类化合物之外,研究还发现了在天然山茶中少有报道的水杨酸-O-吡喃葡萄糖苷、木犀草苷和紫云英苷等化合物,且水杨酸-O-吡喃葡萄糖苷、咖啡酸-O-吡喃葡萄糖苷等均只存在于花瓣部位。
3. 结论
本研究采用超声波辅助酶法提取山茶的花瓣、叶、花蕊三个部位的黄酮,首先考察了酶含量、超声时间和超声温度等因素对总黄酮提取量的影响,并以正交试验进一步筛选出最佳提取工艺,在此条件下花瓣、叶、花蕊总黄酮提取量分别可达20.26、63.14、58.77 RE mg/g。山茶各部位总黄酮提取物的抗氧化活性表明,山茶能够有效清除DPPH自由基和ABTS+自由基,并且根据还原力测定实验,可综合判断各部位总黄酮提取物总体抗氧化活性大小依次为花蕊>叶>花瓣,说明各部位总黄酮提取物在均具有抗氧化活性的基础上,活性大小具有显著差异。通过UPLC-QTOF-MS/MS分析表明,从山茶各部位中共鉴定出29种化合物,包括儿茶素、表儿茶素、槲皮素-3-O-半乳糖苷等化学成分。其中B型原花青素二聚体、表儿茶素、槲皮素-3-O-半乳糖苷和槲皮-3-O-阿拉伯呋喃糖苷四种黄酮单体化合物在三个部位中的分布与总黄酮提取量一致,具有作为标志性活性物质的可能。
综上所述,超声波辅助酶法提取显著提升了山茶各部位总黄酮提取量,其提取物有显著的体外抗氧化作用。本研究进一步为山茶各部位的成分提取及生物活性探究提供了理论基础,并为推动山茶植物资源利用最大化进程做出贡献。
-
表 1 正交试验因素水平表
Table 1 Factors and levels of orthogonal test
水平 A超声温度(℃) B超声时间(min) C酶含量(U/mL) 1 40 10 15 2 60 30 25 3 80 50 35 表 2 正交试验结果
Table 2 Results of orthogonal experiment
试验号 A B C 空白 总黄酮提取量(RE mg/g) 花瓣 叶 花蕊 1 1 1 1 1 15.23 47.61 52.88 2 1 2 2 2 14.25 53.56 52.74 3 1 3 3 3 14.29 47.89 52.58 4 2 1 2 3 16.79 54.78 57.6 5 2 2 3 1 18.03 58.53 56.9 6 2 3 1 2 16.31 49.80 51.27 7 3 1 3 2 15.70 59.61 59.04 8 3 2 1 3 16.78 60.84 58.67 9 3 3 2 1 17.44 60.99 55.73 花瓣 K1 14.59 15.91 16.11 16.90 K2 17.04 16.35 16.16 15.42 K3 16.64 16.01 16.01 15.95 R 2.45 0.44 0.15 1.48 叶 K1 49.69 54.00 52.75 55.71 K2 54.37 57.64 56.44 54.32 K3 60.48 52.89 55.34 54.50 R 10.79 4.75 3.69 1.39 花蕊 K1 52.73 56.51 54.27 55.17 K2 55.26 56.10 55.36 54.35 K3 57.81 53.19 56.17 56.28 R 5.08 3.31 1.90 1.93 表 3 正交试验结果方差分析
Table 3 Analysis of variance of orthogonal experimental results
因素 偏差平方和 自由度 F值 P值 显著性 花瓣 A 10.36 2 3.07 0.25 B 0.32 2 0.10 0.91 C 0.04 2 0.01 0.99 误差 3.38 2 叶 A 175.76 2 51.52 0.02 * B 37.06 2 10.86 0.08 C 21.58 2 6.33 0.14 误差 3.41 2 花蕊 A 38.71 2 6.85 0.13 B 19.61 2 3.47 0.22 C 5.45 2 0.97 0.51 误差 5.65 2 注:“*”表明因素影响显著,P<0.05。 表 4 山茶提取物的质谱分析
Table 4 Mass spectrometry analysis of extracts from C. japonica
类别 序号 保留时间(min) 化合物 分子式 分子离子
(m/z)碎片离子
(m/z)相对含量 液质鉴定
参考文献花瓣 叶 花蕊 黄酮类 1 5.222 儿茶素(Catechin) C15H14O6 289.07 109、123、137、151、203、245 18.91 9.80 35.90 An等[30] 2 6.042 B型原花青素二聚体
(B-type procyanidin dimer)C30H26O12 577.13 289、407、425、451 5.88 29.18 7.74 Da等[31] 3 6.610 原花青素B2(Procyanidin B2) C30H26O12 577.13 289、407、425、451 3.15 23.12 14.46 Da等[31] 4 7.220 表儿茶素(Epicatechin) C15H14O6 289.07 109、123、137、151、203、245 53.60 833.95 111.38 An等[30] 5 7.556 二氢山奈酚-半乳糖苷
(Dihydrokaempferol-galactoside)C21H22O11 449.10 125、151、269、287 2.77 n.d. n.d. An等[30] 6 11.216 杨梅苷(Myricitrin) C21H20O12 463.08 287、316 12.40 n.d. n.d. Yang等[32] 7 11.363 芦丁(Rutin) C27H30O16 609.14 151、300、301 1.00 318.73 24.84 Ren等[33]、
Hao等[34]8 11.510 槲皮素-3-O-半乳糖苷
(Quercetin-3-O-galactoside)C21H20O12 463.08 255、300 14.30 105.84 81.36 Yang等[32] 9 11.869 儿茶素二聚体(Catechin dimer ) C30H26O12 577.13 289、407、425、451 1.22 3.22 n.d. An等[30] 10 11.953 槲皮素-3-O-葡萄糖苷
(Quercetin-3-O-glucoside)C21H20O12 463.08 255、300 n.d. 153.30 40.77 Yang等[32] 11 12.374 槲皮素3-O-阿拉伯呋喃糖苷
(Quercetin-3-O-arabinofuranoside)C20H18O11 433.07 255、271、300 1.85 30.94 7.74 Yang等[32] 12 12.500 山奈酚-3-O-芦丁苷
(Kaemferol-3-O-rutinoside)C27H30O15 593.15 284、285 n.d. 3.68 49.76 Ren等[33]、
Shen等[35]13 12.795 木犀草苷(Luteoloside) C21H20O11 447.09 151、227、255、285、447 5.72 10.60 45.96 Ren等[33]、
Cao等[36]14 12.963 槲皮素-3-O-阿拉伯吡喃糖苷
(Quercetin-3-O-arabinopyranoside)C20H18O11 433.07 243、255、300 n.d. 12.36 n.d. Yang等[32] 15 13.468 槲皮素-鼠李糖苷
(Quercetin-rhamnosid)C21H20O11 447.09 151、301 n.d. 10.34 23.97 An等[30] 16 13.489 紫云英苷(Astragalin) C21H20O11 447.09 151、284、285 1.47 10.51 n.d. Ren等[33]、
Hao等[34]17 13.529 槲皮素-3-O-鼠李糖苷
(Quercetin-3-O-rhamnoside)C21H20O11 447.09 255、271、300 1.42 n.d. n.d. Yang等[32] 18 14.054 山奈酚-鼠李糖苷
(Kaempferol-rhamnoside)C21H20O10 431.09 151、285 1.23 n.d. n.d. An等[30] 19 15.464 山奈酚-3-O-α-L-鼠李糖苷
(Kaempferol-3-O-α-L-rhamnoside )C21H20O10 431.09 227、255、285 1.61 n.d. n.d. Yang等[32] 20 17.167 槲皮素(Quercetin) C15H10O7 301.03 243、301 n.d. n.d. 8.72 Yang等[32] 21 18.975 山奈酚(Kaempferol) C15H10O6 285.04 159、187、211、239 n.d. n.d. 11.57 An等[30] 酚酸类 22 0.912 奎尼酸(Quinic acid) C7H12O6 191.05 111、127 39.82 24.73 30.98 Yang等[32] 23 1.311 水杨酸-O-吡喃葡萄糖苷
(Salicylic acid-O-glucopyranoside )C13H16O8 299.07 137、299 1.42 n.d. n.d. Cao等[36]、
Sun等[37]24 1.394 没食子酸(Gallic acid) C7H6O5 169.01 125、169、241 n.d. n.d. 6.48 Yang等[32] 25 4.107 咖啡酸-O-吡喃葡萄糖苷
(Caffeic acid-O-glucopyranoside)C15H18O9 341.08 135、179 5.69 n.d. n.d. Sun等[37] 26 4.759 原儿茶酸(Protocatechuic acid) C7H6O4 153.01 108、109 n.d. n.d. 4.77 An等[30]、
Frolov等[38]27 5.895 对香豆酸-O-吡喃葡萄糖苷
(p-Coumaric acid-O-glucopyranoside)C15H18O8 325.09 119、163 7.23 3.95 3.63 Sun等[37] 28 6.421 对香豆酸-O-葡萄糖基酯
(p-Coumaric acid-O-glucosyl ester)C15H18O8 325.09 119、163、205、235、265 5.97 n.d. n.d. Sun等[37] 29 6.989 香草酸-O-吡喃葡萄糖苷
(Vanillic acid-O-glucopyranoside)C14H18O9 329.08 123、167 2.68 n.d. n.d. Sun等[37] 注:n.d.表示在此部位未检测到该成分。 -
[1] 刘明辉, 房佳蕾, 周秋宝, 等. 桑蚕丝织物的山茶花拓染[J]. 印染,2022,48(4):30−33. [LIU M H, FANG J L, ZHOU Q B, et al. Printing of mulberry silk fabric with Camellia[J]. China Dyeing and Finishing,2022,48(4):30−33.] doi: 10.3321/j.issn.1000-4017.2022.04.007 LIU M H, FANG J L, ZHOU Q B, et al. Printing of mulberry silk fabric with Camellia[J]. China Dyeing and Finishing, 2022, 48(4): 30−33. doi: 10.3321/j.issn.1000-4017.2022.04.007
[2] MIZUTANI T, MASAKI H. Anti-photoaging capability of antioxidant extract from Camellia japonica leaf[J]. Experimental Dermatology,2014,23:23−26. doi: 10.1111/exd.12395
[3] 李留春. 云南山茶花产业发展瓶颈及突破策略探析[J]. 林业调查规划,2010,35(2):69−72. [LI L C. Analysis on bottleneck for industrial development of Camellia reticulate and corresponding measures[J]. Forest Inventory and Planning,2010,35(2):69−72.] doi: 10.3969/j.issn.1671-3168.2010.02.018 LI L C. Analysis on bottleneck for industrial development of Camellia reticulate and corresponding measures[J]. Forest Inventory and Planning, 2010, 35(2): 69−72. doi: 10.3969/j.issn.1671-3168.2010.02.018
[4] 李丕睿, 刘永芝, 翟敏, 等. 山茶属华东山茶(Camellia japonica L.)研究进展[J]. 植物遗传资源学报,2016,17(6):1022−1030,1035. [LI P R, LIU Y Z, ZHAI M, et al. Reccent advances in Camellia japonica L J]. Journal of Plant Genetic Resources,2016,17(6):1022−1030,1035.
[5] 王介华, 张文华, 肖强, 等. 长管红山茶叶片的化学成分研究[J]. 天然产物研究与开发,2023,35(2):236−241. [WANG J H, ZHANG W H, XIAO Q, et al. Chemical constituents from leaves of Camellia longituba Chang[J]. Natural Product Research and Development,2023,35(2):236−241.] WANG J H, ZHANG W H, XIAO Q, et al. Chemical constituents from leaves of Camellia longituba Chang[J]. Natural Product Research and Development, 2023, 35(2): 236−241.
[6] 苗润涵, 靳萍, 夏光辉. 发酵处理对玉竹黄酮抗氧化活性的影响研究[J]. 中国林副特产,2023(2):16−20. [MIAO R H, JIN P, XIA G H. Study on the effects of different fermentation treatments on the antioxidant activity of flavonoids of Polygonatum odoratum[J]. Forest by-Product and Speciality in China,2023(2):16−20.] MIAO R H, JIN P, XIA G H. Study on the effects of different fermentation treatments on the antioxidant activity of flavonoids of Polygonatum odoratum[J]. Forest by-Product and Speciality in China, 2023(2): 16−20.
[7] 许晓路, 戴国庆, 韦涵峰, 等. 双水相提取金银花叶总黄酮工艺优化及其抗氧化活性[J]. 食品工业科技,2023,44(13):242−248. [XU X L, DAI G Q, WEI H F, et al. Optimization of aqueous two-phase extraction technology of total flavonoids from Lonicera japonica Thunb. leaves and its antioxidant activity[J]. Science and Technology of Food Industry,2023,44(13):242−248.] XU X L, DAI G Q, WEI H F, et al. Optimization of aqueous two-phase extraction technology of total flavonoids from Lonicera japonica Thunb. leaves and its antioxidant activity[J]. Science and Technology of Food Industry, 2023, 44(13): 242−248.
[8] THITIMUTA S, PITHAYANUKUL P, NITHITANAKOOL S, et al. Camellia sinensis extract and its potential beneficial effects in antioxidant, anti-inflammatory, anti-hepatotoxic, and anti-tyrosinase activities[J]. Molecules,2017,22(3):401. doi: 10.3390/molecules22030401
[9] 郭小藤, 刘燕, 张清华, 等. 黄蜀葵花不同部位黄酮类成分含量的比较研究[J]. 食品与药品,2021,23(6):514−520. [GUO X T, LIU Y, ZHANG Q H, et al. Comparative study on contents of flavonoids in different parts of Abelmoschi Corolla[J]. Food and Drug,2021,23(6):514−520.] doi: 10.3969/j.issn.1672-979X.2021.06.007 GUO X T, LIU Y, ZHANG Q H, et al. Comparative study on contents of flavonoids in different parts of Abelmoschi Corolla[J]. Food and Drug, 2021, 23(6): 514−520. doi: 10.3969/j.issn.1672-979X.2021.06.007
[10] 刘吉爽, 张雅蓉, 徐犇, 等. 葵花盘不同产地、不同部位总黄酮含量的变化分析[J]. 吉林中医药,2020,40(8):1080−1083. [LIU J S, ZHANG Y R, XU B, et al. Analysis of the change of total flavonoids content in Helianthi Annui Rhachis from different producing areas and different tissues[J]. Jilin Journal of Traditional Chinese Medicine,2020,40(8):1080−1083.] LIU J S, ZHANG Y R, XU B, et al. Analysis of the change of total flavonoids content in Helianthi Annui Rhachis from different producing areas and different tissues[J]. Jilin Journal of Traditional Chinese Medicine, 2020, 40(8): 1080−1083.
[11] PÁSCOA R N M J, TEIXEIRA A M, SOUSA C. Antioxidant capacity of Camellia japonica cultivars assessed by near-and mid-infrared spectroscopy[J]. Planta,2019,249:1053−1062. doi: 10.1007/s00425-018-3062-z
[12] LIU Y, LUO X L, LAN Z Q, et al. Ultrasonic-assisted extraction and antioxidant capacities of flavonoids from Camellia fascicularis leaves[J]. CyTA-Journal of Food,2018,16(1):105−112. doi: 10.1080/19476337.2017.1343867
[13] 冯棋琴, 汪有存, 吴满梅, 等. 不同产地压榨山茶油活性成分比较分析[J]. 粮食与油脂,2020,33(4):54−57. [FENG Q Q, WANG Y C, WU M M, et al. Comparative analysis on active ingredients of Camellia oil from different areas[J]. Cereals & Oils,2020,33(4):54−57.] doi: 10.3969/j.issn.1008-9578.2020.04.015 FENG Q Q, WANG Y C, WU M M, et al. Comparative analysis on active ingredients of Camellia oil from different areas[J]. Cereals & Oils, 2020, 33(4): 54−57. doi: 10.3969/j.issn.1008-9578.2020.04.015
[14] 傅贤明, 卢诗, 黄欣, 等. 超声提取福鼎白茶总黄酮工艺优化及抗氧化能力研究[J]. 粮食与油脂,2022,35(12):114−118,122. [FU X M, LU S, HUANG X, et al. Study on ultrasonic extraction and antioxidant capacity of total flavonoids from Fuding white tea[J]. Cereals & Oils,2022,35(12):114−118,122.] doi: 10.3969/j.issn.1008-9578.2022.12.025 FU X M, LU S, HUANG X, et al. Study on ultrasonic extraction and antioxidant capacity of total flavonoids from Fuding white tea[J]. Cereals & Oils, 2022, 35(12): 114−118,122. doi: 10.3969/j.issn.1008-9578.2022.12.025
[15] 于秋菊, 耿凤英, 张磊磊. 微波辅助低共熔溶剂提取覆盆子总黄酮的工艺优化及活性研究[J]. 中国食品添加剂,2023,34(2):43−51. [YU Q J, GENG F Y, ZHANG L L. Optimization of microwave assisted extraction of flavonoids from raspberry with deep eutectic solvents and its activity[J]. China Food Additives,2023,34(2):43−51.] YU Q J, GENG F Y, ZHANG L L. Optimization of microwave assisted extraction of flavonoids from raspberry with deep eutectic solvents and its activity[J]. China Food Additives, 2023, 34(2): 43−51.
[16] 赫丁轩, 杨立军, 叶润, 等. 不同来源猫爪草总黄酮的提取工艺及其抗氧化活性研究[J]. 粮食与油脂,2023,36(1):101−105. [HE D X, YANG L J, YE R, et al. Study on the extraction technology and antioxidant activity of total flavonoids from different sources Ranunculus ternatus Thunb[J]. Cereals & Oils,2023,36(1):101−105.] doi: 10.3969/j.issn.1008-9578.2023.01.024 HE D X, YANG L J, YE R, et al. Study on the extraction technology and antioxidant activity of total flavonoids from different sources Ranunculus ternatus Thunb[J]. Cereals & Oils, 2023, 36(1): 101−105. doi: 10.3969/j.issn.1008-9578.2023.01.024
[17] FERRI M, RONDINI G, CALABRETTA M M, et al. White grape pomace extracts, obtained by a sequential enzymatic plus ethanol-based extraction, exert antioxidant, anti-tyrosinase and anti-inflammatory activities[J]. New Biotechnology,2017,39:51−58. doi: 10.1016/j.nbt.2017.07.002
[18] 杨盛茹, 侯银臣, 张秋双, 等. 超声波辅助提取黄粉虫中黄酮类物质的工艺优化及黄酮类物质的稳定性[J]. 江苏农业学报,2023,39(1):229−237. [YANG S R, HOU Y C, ZHANG Q S, et al. Study on optimization of ultrasonic assisted extraction process and stability of flavonoids from Tenebrio molitor[J]. Jiangsu Journal of Agricultural Sciences,2023,39(1):229−237.] doi: 10.3969/j.issn.1000-4440.2023.01.026 YANG S R, HOU Y C, ZHANG Q S, et al. Study on optimization of ultrasonic assisted extraction process and stability of flavonoids from Tenebrio molitor[J]. Jiangsu Journal of Agricultural Sciences, 2023, 39(1): 229−237. doi: 10.3969/j.issn.1000-4440.2023.01.026
[19] 朱秀红, 韩钰, 茹广欣. 超声波辅纤维素酶提取泡桐花总黄酮工艺及其抗氧化研究[J]. 饲料研究,2022,45(24):73−78. [ZHU X H, HAN Y, RU G X. Ultrasound-assisted cellulase of extraction process of Paulownia flower total flavonoids and its antioxidant research[J]. Feed Research,2022,45(24):73−78.] ZHU X H, HAN Y, RU G X. Ultrasound-assisted cellulase of extraction process of Paulownia flower total flavonoids and its antioxidant research[J]. Feed Research, 2022, 45(24): 73−78.
[20] 吕凯波, 张星雨, 乐薇, 等. 响应面优化超声波辅助酶法提取湖北海棠叶抗氧化物[J]. 食品工业科技,2023,44(4):218−225. [LÜ K B, ZHANG X Y, LE W, et al. Optimization of ultrasound-assisted enzymatic method extraction of antioxidant from Malus hupehensis leaves by response surface methodology[J]. Science and Technology of Food Industry,2023,44(4):218−225.] LÜ K B, ZHANG X Y, LE W, et al. Optimization of ultrasound-assisted enzymatic method extraction of antioxidant from Malus hupehensis leaves by response surface methodology[J]. Science and Technology of Food Industry, 2023, 44(4): 218−225.
[21] 李侠, 邹基豪, 王大为. 响应面试验优化超声波-酶法提取绿豆皮黄酮类化合物工艺[J]. 食品科学,2017,38(8):206−212. [LI X, ZOU J H, WANG D W. Optimization of ultrasonic-assisted enzymatic extraction of flavonoids from mung bean coat[J]. Food Science,2017,38(8):206−212.] doi: 10.7506/spkx1002-6630-201708032 LI X, ZOU J H, WANG D W. Optimization of ultrasonic-assisted enzymatic extraction of flavonoids from mung bean coat[J]. Food Science, 2017, 38(8): 206−212. doi: 10.7506/spkx1002-6630-201708032
[22] 董树国, 陆钊. 酶解-超声波-表面活性剂协同提取桑叶总黄酮工艺研究[J]. 中国酿造,2013,32(8):117−119. [DONG S G, LU Z. Enzymatic hydrolysis-ultrasound-surfactant extraction technology of total flavonoids from mulbery leaves[J]. China Brewing,2013,32(8):117−119.] doi: 10.3969/j.issn.0254-5071.2013.08.028 DONG S G, LU Z. Enzymatic hydrolysis-ultrasound-surfactant extraction technology of total flavonoids from mulbery leaves[J]. China Brewing, 2013, 32(8): 117−119. doi: 10.3969/j.issn.0254-5071.2013.08.028
[23] 尹培培, 杨灵光, 王桂宏, 等. 两种芦笋不同部位酚类物质及抗氧化活性研究[J]. 食品研究与开发,2018,39(21):21−27. [YIN P P, YANG L G, WANG G H, et al. Study of phenolic compounds and antioxidant activities in different part of two asparagus[J]. Food Research and Development,2018,39(21):21−27.] doi: 10.3969/j.issn.1005-6521.2018.21.004 YIN P P, YANG L G, WANG G H, et al. Study of phenolic compounds and antioxidant activities in different part of two asparagus[J]. Food Research and Development, 2018, 39(21): 21−27. doi: 10.3969/j.issn.1005-6521.2018.21.004
[24] HONG C C, CHANG C, ZHANG H, et al. Identification and characterization of polyphenols in different varieties of Camellia oleifera seed cakes by UPLC-QTOF-MS[J]. Food Research International,2019,126:108614. doi: 10.1016/j.foodres.2019.108614
[25] 章烨雯, 臧青民, 陈荣, 等. 表面活性剂辅助超声波提取橘红胎总黄酮工艺优化及其抗氧化活性[J]. 中国食品添加剂,2022,33(9):83−90. [ZHANG Y W, ZANG Q M, CHEN R, et al. Optimization of surfactant-assisted ultrasonic extraction of total flavonoids from Citri grandis exocarpium fruitlet and its antioxidant activity[J]. China Food Additives,2022,33(9):83−90.] ZHANG Y W, ZANG Q M, CHEN R, et al. Optimization of surfactant-assisted ultrasonic extraction of total flavonoids from Citri grandis exocarpium fruitlet and its antioxidant activity[J]. China Food Additives, 2022, 33(9): 83−90.
[26] 郝可欣, 胡文忠, 张清洁, 等. 响应面法优化超声辅助提取代代花总黄酮的工艺及其抗氧化活性研究[J]. 食品工业科技,2019,40(24):159−164,171. [HAO K X, HU W Z, ZHANG Q J, et al. Optimization of the ultrasonic-assisted extraction of total flavonoids from Citrus aurantium L. var daidai by response surface methodology and its antioxidant activity[J]. Science and Technology of Food Industry,2019,40(24):159−164,171.] HAO K X, HU W Z, ZHANG Q J, et al. Optimization of the ultrasonic-assisted extraction of total flavonoids from Citrus aurantium L. var daidai by response surface methodology and its antioxidant activity[J]. Science and Technology of Food Industry, 2019, 40(24): 159−164,171.
[27] 王佰灵, 陈雅烯, 谢家星, 等. 超声波辅助纤维素酶提取金荞麦总黄酮工艺优化及其抗氧化活性研究[J]. 粮食与油脂,2021,34(4):123−128. [WANG B L, CHEN Y X, XIE J X, et al. Ultrasound-assisted cellulase optimization of extraction process of total flavonoids from Fagopyrum dibotrys Hara (D. Don) and its antioxidant activity research[J]. Cereals & Oils,2021,34(4):123−128.] doi: 10.3969/j.issn.1008-9578.2021.04.029 WANG B L, CHEN Y X, XIE J X, et al. Ultrasound-assisted cellulase optimization of extraction process of total flavonoids from Fagopyrum dibotrys Hara (D. Don) and its antioxidant activity research[J]. Cereals & Oils, 2021, 34(4): 123−128. doi: 10.3969/j.issn.1008-9578.2021.04.029
[28] 尚志春, 王宝昌, 张微微, 等. 正交试验优选南山茶花中总黄酮的提取工艺[J]. 中国药房,2013,24(27):2526−2528. [SHANG Z C, WANG B C, ZHANG W W, et al. Optimization of extraction technology of total flavonoids from the flowers of Camellia semiserrata by orthogonal test[J]. China Pharmacy,2013,24(27):2526−2528.] doi: 10.6039/j.issn.1001-0408.2013.27.11 SHANG Z C, WANG B C, ZHANG W W, et al. Optimization of extraction technology of total flavonoids from the flowers of Camellia semiserrata by orthogonal test[J]. China Pharmacy, 2013, 24(27): 2526−2528. doi: 10.6039/j.issn.1001-0408.2013.27.11
[29] 奕志英, 高宏旗, 张春雷, 等. 山茶花、叶中抗氧化物质的提取及稳定性初步研究[J]. 香料香精化妆品,2020(2):12−17,21. [YI Z Y, GAO H Q, ZHANG C L, et al. Preliminary study on the extraction and stability of antioxidant substances from Camellia japonica flowers and leaves[J]. Flavour Fragrance Cosmetics,2020(2):12−17,21.] doi: 10.3969/j.issn.1000-4475.2020.02.004 YI Z Y, GAO H Q, ZHANG C L, et al. Preliminary study on the extraction and stability of antioxidant substances from Camellia japonica flowers and leaves[J]. Flavour Fragrance Cosmetics, 2020(2): 12−17,21. doi: 10.3969/j.issn.1000-4475.2020.02.004
[30] AN L, ZHANG W, MA G W, et al. Neuroprotective effects of Camellia nitidissima Chi leaf extract in hydrogen peroxide-treated human neuroblastoma cells and its molecule mechanisms[J]. Food Science & Nutrition,2020,8(9):4782−4793.
[31] DA S G S, CANUTO K M, RIBEIRO P R V, et al. Chemical profiling of guarana seeds (Paullinia cupana) from different geographical origins using UPLC-QTOF-MS combined with chemometrics[J]. Food Research International,2017,102:700−709. doi: 10.1016/j.foodres.2017.09.055
[32] YANG L G, YIN P P, FAN H, et al. Response surface methodology optimization of ultrasonic-assisted extraction of Acer truncatum leaves for maximal phenolic yield and antioxidant activity[J]. Molecules,2017,22(2):232. doi: 10.3390/molecules22020232
[33] REN M C, XU W, ZHANG Y P, et al. Qualitative and quantitative analysis of phenolic compounds by UPLC-MS/MS and biological activities of Pholidota chinensis Lindl[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,187:113350. doi: 10.1016/j.jpba.2020.113350
[34] HAO J, NA R, SUN L, et al. Chemical profile and quantitative comparison of constituents in different medicinal parts of Lactuca indica during varied harvest periods using UPLC-MS/MS method[J]. Food Chemistry:X, 2023, 20: 101031.
[35] SHEN W, LI S Y, PAN Y Q, et al. Prinsepia utilis Royle leaf extract:Ameliorative effects on allergic inflammation and skin lesions in allergic contact dermatitis and polyphenolic profiling through UPLC-MS/MS coupled to chemometric analysis[J]. Journal of Ethnopharmacology,2023,305:116093. doi: 10.1016/j.jep.2022.116093
[36] CAO S S, HU M, YANG L L, et al. Chemical constituent analysis of Ranunculus sceleratus L. using ultra-high-performance liquid chromatography coupled with quadrupole-orbitrap high-resolution mass spectrometry[J]. Molecules,2022,27(10):3299. doi: 10.3390/molecules27103299
[37] SUN H Y, LIU M X, LIN Z T, et al. Comprehensive identification of 125 multifarious constituents in Shuang-huang-lian powder injection by HPLC-DAD-ESI-IT-TOF-MS[J]. Journal of Pharmaceutical and Biomedical Analysis,2015,115:86−106. doi: 10.1016/j.jpba.2015.06.013
[38] FROLOV A, HENNING A, BÖTTCHER C, et al. An UPLC-MS/MS method for the simultaneous identification and quantitation of cell wall phenolics in Brassica napus seeds[J]. Journal of Agricultural and Food Chemistry,2013,61(6):1219−1227. doi: 10.1021/jf3042648
[39] 张媛雯, 赵琳, 谭伟. 植物原花青素的应用研究进展[J]. 中国果菜,2023,43(7):24−28,41. [ZHANG Y W, ZHAO L, TAN W. Application progress of plant proanthocyanidins[J]. China Fruit & Vegetable,2023,43(7):24−28,41.] ZHANG Y W, ZHAO L, TAN W. Application progress of plant proanthocyanidins[J]. China Fruit & Vegetable, 2023, 43(7): 24−28,41.
-
期刊类型引用(2)
1. 栗紫慧,曲映红,施文正,顾金晖,刘一漪,张震,姜昕. 利用顶空-气相色谱-离子迁移谱结合电子鼻分析黑鱼蒸制过程中挥发性风味物质的变化. 食品与发酵工业. 2025(01): 322-329 .  百度学术
百度学术
2. 胡澳,郭兵兵,章蔚,汪兰,陈胜,石柳,熊光权,李玮. 预制乌鳢鱼片的微波熟化工艺. 现代食品科技. 2024(03): 182-190 .  百度学术
百度学术
其他类型引用(2)






 下载:
下载:


 下载:
下载:
