Analysis of Phenolic Content and Its Antioxidant and Anti-inflammatory Activities during the Fermentation Process of Rosa rugosa 'Dianhong'
-
摘要: 目的:旨在分析大理白族地区使用频率最高的滇红玫瑰在发酵过程中提取物酚类物质含量及其抗氧化和抗炎活性变化。方法:采用民族植物学方法进行调查确定了药食同源玫瑰品种,以模仿传统的玫瑰糖发酵工艺为研究对象,利用DPPH和ABTS+法评价不同糖比例和发酵时间发酵滇红玫瑰提取物(Fermented Rosa rugosa ‘Dianhong’,FDR)的抗氧化活性,建立脂多糖诱导RAW264.7细胞模型(NO抑制率)评价提取物抗炎活性,并将酚类物质含量与抗氧化和抗炎活性指标进行相关性分析。结果:7种玫瑰被当地用做药食同源植物,其中滇红玫瑰的使用频率值(f)最高。滇红玫瑰经鲁氏酵母发酵的过程中,FDR-2(35%红糖、65%花瓣)和FDR-3(25%红糖、75%花瓣)的酚类物质含量(总黄酮、总酚)、DPPH和ABTS+自由基清除能力、NO抑制率均呈先上升后下降的趋势,其中,在发酵7 d时以上指标均达到最高值,即与发酵前相比能够显著(P<0.05)增加酚类物质含量,提高DPPH和ABTS+自由基的清除活性以及NO生成抑制率。然而,FDR-1(50%红糖、50%花瓣)在发酵后,酚类物质含量(总黄酮、总酚)、DPPH和ABTS+自由基清除能力、NO抑制率总体均呈下降趋势。发酵滇红玫瑰提取物酚类物质含量与DPPH和ABTS+自由基清除率、NO抑制率呈显著正相关(P<0.05)。结论:发酵滇红玫瑰在红糖比例为25%~35%,发酵时间为7 d时,酚类物质含量最高,抗氧化和抗炎能力最强。Abstract: Objective: The aim of this study was to analyze the changes of phenolic content, antioxidant and anti-inflammatory activities of fermented Rosa rugosa 'Dianhong', the most frequently used rose in Dali Bai ethnic group area. Methods: Medicinal and edible rose varieties were confirmed by investigation using ethnobotanical methods. The object of the study was to imitate the traditional rose sugar fermentation process. Antioxidant activity of fermented Rosa rugosa 'Dianhong' (FDR) with different sugar content and time were evaluated using DPPH and ABTS+ methods. Lipopolysaccharide-induced RAW 264.7 cell model (NO inhibition rate) was established to evaluate the anti-inflammatory activity of the extracts. The correlations between phenolic content and antioxidant and anti-inflammatory activities were performed. Results: Among seven rose species loccally used as medicinal and food homologous plants, the frequency value (f) of R. rugosa 'Dianhong' was highest. During the fermentation process of R. rugosa 'Dianhong' fermented by Saccharomyces rouxii, the phenolic content (total flavonoids, total phenols), DPPH and ABTS+ free radical scavenging rates and NO inhibition rates of FDR-2 (35% brown sugar, 65% petals) and FDR-3 (25% brown sugar, 75% petals) showed an increasing trend at first and then decreasing trend. All indicators of FDR-2 and FDR-3 reached the highest value at 7 d of fermentation, i.e. the phenolic content, the DPPH and ABTS+ free radical scavenging rates and NO inhibition rates significantly increased (P<0.05) compared to samples before fermentation. However, FDR-1 (50% brown sugar, 50% petals) presented decreasing the contents of phenolic (total flavonoids, total phenols), and declining rates of DPPH and ABTS+ free radical scavenging capacity, as well as NO inhibition after fermentation. Besides, in this study correlation analysis showed that the phenolic content of fermented R. rugosa 'Dianhong' extracts presented positive correlation (P<0.05), significantly with activities of antioxidant and anti-inflammatory. Conclusion: With the highest phenolic content of fermented extracts, the strongest capacity of antioxidant and anti-inflammatory carried out in this study for seven days’ fermentation is when the brown sugar ratio with R. rugosa 'Dianhong' petal is 25%~35%.
-
玫瑰是中国具有悠久历史的药食同源植物,在食品、保健品、美容产品中被广泛应用。产品种类繁多[1],主要有玫瑰花茶、鲜花饼、玫瑰糖、玫瑰酒等。云南主栽的食用玫瑰有滇红玫瑰(Rosa rugosa ‘Dianhong’)、墨红玫瑰(Rosa rugosa ‘Mohong’)、金边玫瑰(Rosa rugosa ‘Jinbian’)和紫枝玫瑰(Rosa rugosa ‘Zizhi’)等,其中滇红玫瑰在云南种植广泛,又名八街玫瑰,是法国玫瑰的变种,花朵大、香味醇厚、口感细腻[2]。有研究表明,当机体处于氧化应激状态时,易发生氧化损伤,加速皮肤衰老[3]。玫瑰中包含的酚类化合物可以通过消除自由基来防止活性氧的过量产生,抑制氧化应激的发生,延缓衰老[4]。Wang等[5]对中国12种食用花卉进行对比研究发现,玫瑰在氧自由基吸收能力和超氧阴离子自由基清除能力抗氧化模型中均表现出最强的抗氧化能力。也有研究表明,玫瑰甲醇提取物中含有没食子酸[6]、山奈酚[7]等酚类化合物,能够抑制癌细胞的生长,具有一定的抗癌功效[8],经常食用玫瑰类产品能够改善机体免疫、增强抗氧化能力,延缓衰老[9−10]。
微生物发酵将大分子物质有效降解为小分子物质,使其易于人体吸收,增强药效,在食品工业中被广泛应用[11]。通过微生物发酵可以富集玫瑰花渣中的总酚、总黄酮、蛋白质、可溶性膳食纤维,提高没食子酸、槲皮素、对香豆酸等单体酚的含量,并且发酵后新检出绿原酸[12]。赵丹等[13]发现经酿酒酵母发酵后的玫瑰发酵液具有较强的DPPH自由基清除能力,而且能够较强抑制酪氨酸酶活性,研究可为其在抗衰老及美白功效食品中的应用提供参考。有研究证明内源菌株具有较强的环境适应性,应用原料中分离出的内源菌株作为发酵剂的产品具有较高的营养价值,并且使用单一菌种发酵与自然发酵相比,可以大大缩短发酵时间,而且有利于工业化生产[14]。
现如今,相关研究集中在国外的大马士革玫瑰精油上,国内对可食用玫瑰的研究利用较少,滇红玫瑰经内源菌株发酵其在发酵过程中的生物活性研究鲜有报道。传统发酵玫瑰(Traditional fermented rose,TFR)是云南大理白族食花文化的一个具体案例,前期研究已从TFR中得到关键菌株—鲁氏酵母(Saccharomyces rouxii,TFR-1)[15],然而发酵玫瑰植物资源、发酵工艺参数和生物活性尚未得到系统验证研究。因此,本研究依托民族植物学调查,通过收集和整理云南大理白族地区玫瑰植物资源和传统的加工信息,确定发酵玫瑰品种,并利用鲁氏酵母(TFR-1)对不同糖比例滇红玫瑰进行发酵,探究发酵过程中抗氧化和抗炎活性变化及其与酚类物质之间的相关性,为滇红玫瑰资源的质量控制及深度研发提供理论支撑。
1. 材料与方法
1.1 玫瑰植物资源调查
1.1.1 研究区域概况
研究区域在云南省大理白族自治州(北纬24°41′~26°42′,东经98°52′~101°03′之间),平均海拔高度为2090 m,年平均降水量为776 mm,年平均气温为16.5 ℃[16−17]。该地区为白族的聚居地。
1.1.2 民族植物学野外调查
实地考察采用民族植物学野外调查的方法,对大理白族自治州大理县、巍山县、洱源县、剑川县和鹤庆县的15个传统社区进行实地调查,并且对关键人物(包括草药医生、种植户和中间商)等371位信息人进行访谈,信息人从事玫瑰的收集、生产、销售和使用,其中女性是玫瑰的主要关键人物,占信息人的55%(表1),利用关键人物访谈和半结构式访谈等方法,对当地玫瑰植物资源的传统利用信息进行调查,包括玫瑰资源种类、传统加工方式、传统功效等信息。
表 1 关键人物信息Table 1. Information of key individuals类别 范围 人数 所占百分比(%) 地点 大理县 83 22.37 洱源县 76 20.49 巍山县 65 17.52 剑川县 69 18.60 鹤庆县 78 21.02 年龄(岁) 26~35 82 22.10 36~45 113 30.46 46~55 109 29.38 56~65 38 10.24 66~75 21 5.66 75以上 8 2.16 性别 男 167 45 女 204 55 定量分析在调查研究基础上,计算信息共识因子(Informant consensus factor,ICF)和植物利用频率(Use frequency,f)。
ICF=R0−RR0−1 f=NmN 式中:R0为某个信息人使用某种植物的次数,R为使用某种植物总的信息人数;Nm为某个药食植物的信息人数,N为信息提供者的总人数,如果f越大,说明该植物被利用的频度越高[18−19],并以ICF和f值最高者作为发酵品种进行相关研究。
1.2 材料与仪器
滇红玫瑰花瓣 采集于2022年5月,采集地点为云南大理白族自治州,经中国科学院昆明植物研究所杨立新高级工程师鉴定为蔷薇科蔷薇属植物滇红玫瑰(Rosa rugosa ‘Dianhong’),采集后立即预冷,贮藏在−20 ℃冰箱;菌种 鲁氏酵母(Saccharomyces rouxii,TFR-1),收藏于中国普通微生物菌种保藏管理中心;没食子酸、芦丁 上海笛柏生物科技有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)、Griess Reagent、LPS、对照药物L-NMMA Sigma公司;甲醇 分析纯,天津市大茂化学试剂;福林酚试剂 北京索莱宝科技有限公司;碳酸钠、硝酸铝、蔗糖、氢氧化钠 天津市致远化学试剂有限公司;ABTS 上海麦克林生化科技有限公司;过硫酸钾 上海优耐德有限公司;酵母提取物 生工生物工程股份有限公司;蛋白胨、琼脂 北京奥博星生物技术;抗坏血酸(VC) 阿拉丁试剂公司;小鼠单核巨噬细胞RAW264.7 中科院上海细胞库;DMEM培养基、胎牛血清 BI公司。
R-1001VN旋转蒸发仪 郑州长城科工贸;KQ-500E型超声清洗器 昆山市超声仪器;YP-100ZN电子天平 河南恒信仪器设备;SW-CJ-1FD超净工作台 苏州安泰空气技术;ZCZY-CS9S组合式摇床 上海知楚仪器;LDZM-80KCS高压灭菌锅 上海楚柏公司;SPX-50B生化控温培养箱 历辰科技;M200Pro多功能酶标仪 上海普迪生物技术有限公司。
1.3 实验方法
1.3.1 微生物纯化培养
配制YPD固体培养基和YPD液体培养基,选用稀释涂布平板法和平板划线法,将TFR-1在YPD固体培养基上进行活化培养,于28 ℃恒温箱中培养36 h,纯化培养三次,显微镜下观察,确定菌株,挑取单菌落于YPD液体培养基中,在28 ℃、转速120 r/min条件下培养36 h,作为液体菌种—TFR-1菌液。取1 mL菌液利用去离子水进行稀释并计数,TFR-1菌液数为1.8×106 CFU/mL。
1.3.2 接种与发酵
将解冻的滇红玫瑰花瓣和红糖按照不同的比例揉捏,紫外灭菌消毒,10 h后接种5%(V/V)的TFR-1菌液,于30 ℃、120 r/min摇床中发酵,分别标记为FDR-1(50%红糖、50%玫瑰花瓣)、FDR-2(35%红糖、65%玫瑰花瓣)、FDR-3(25%红糖、75%玫瑰花瓣),在发酵的第0、7、14、21、28、35 d各取30 g FDR样品。
1.3.3 活性物质提取
加入150 mL甲醇溶液在超声温度25 ℃、超声功率500 W、超声时间40 min条件下提取,过滤合并两次滤液,45 ℃减压蒸干得到提取物,4 ℃冷藏备用。
1.3.4 滇红玫瑰提取物酚类物质含量测定
1.3.4.1 总黄酮含量测定
参照Aurita等[20]方法测定总黄酮含量(Total flavonoid content,TFC),并加以改进,用甲醇配制0.5 mg/mL的FDR待测样液,取40 μL与5%碳酸钠溶液(10 μL)混合在96孔板中,室温反应5 min,加入10%亚硝酸铝溶液(10 μL)室温反应5 min,再加入4%氢氧化钠溶液(40 μL),用甲醇补至200 μL混合均匀反应12 min,利用酶标仪测定其在波长765 nm处的吸光度,配制0、0.2、0.4、0.6、0.8、1 mg/mL的芦丁标准溶液,以芦丁质量浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。得到的标准曲线回归方程为:y=3.5563x+0.0429,R2=0.9990。TFC以芦丁含量计。
1.3.4.2 总酚含量测定
采用Folin-Ciocalteu法测定总酚含量(Total phenol content,TPC),参照Lang等[15]的方法并加以改进,用甲醇配制0.5 mg/mL的FDR待测样液,取8 μL与福林酚试剂(25 μL)混合在96孔板中,在室温条件下,避光反应2 min,再加入50 μL 12%碳酸钙溶液在25 ℃水浴1 h,利用酶标仪测定其在510 nm的吸光度,配制0、2、4、6、8、10 μg/mL的没食子酸(GA)标准溶液,以GA质量浓度为横坐标,以吸光度值为纵坐标,绘制标准曲线。得到的标准曲线回归方程为:y=0.0924x+0.0249,R2=0.9980。TPC以没食子酸含量计。
1.3.5 体外抗氧化活性分析
1.3.5.1 DPPH自由基清除率测试
采用DPPH(1,1-二苯基-2-三硝基苯肼)在体外清除自由基的能力,来评价FDR的抗氧化活性,参照文献[21]方法并稍作修改。将总酚粗提物用甲醇配制成不同浓度的FDR待测样液,终浓度为0.05、0.10、0.15、0.20 mg/mL。用移液枪分别量取80 μL的FDR待测样品溶液于96孔板中,加入100 μL 1×10−4 mol/mL的DPPH溶液,用甲醇补至200 μL混合均匀,避光反应30 min后在517 nm处测定吸光度,VC作为阳性对照,通过公式计算FDR样品DPPH自由基清除率。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 式中:A0为甲醇+DPPH溶液的吸光度;A1为FDR样品+DPPH溶液的吸光度;A2为FDR样品+甲醇的吸光度。
1.3.5.2 ABTS+自由基清除率测试
ABTS+自由基清除能力参照文献[22]方法并稍作修改,将总酚粗提物用甲醇配制成不同浓度的FDR待测样液,终浓度为0.05、0.0725、0.10、0.125 mg/mL。7 mmol/L的ABTS+溶液和1.4 mmol/L过硫酸钾溶液等体积混合均匀,避光12~16 h,使用时用甲醇调节吸光度值为0.7±0.02即可获得ABTS+工作液,向96孔板中加入160 μL工作液和40 μL FDR待测样液混合均匀,避光反应10 min,于734 nm波长处测定吸光度值,VC作为阳性对照,通过所测得的吸光度值计算ABTS+自由基清除率。
ABTS+自由基清除率(%)=(1−A1−A2A0)×100 式中:A0为甲醇+ABTS+溶液的吸光度;A1为FDR样品+ABTS+溶液的吸光度;A2为FDR样品+甲醇的吸光度。
1.3.6 细胞一氧化氮(NO)生成抑制率的测定
参考Najjar等[23]的方法,稍作修改,将总酚粗提物用去离子水配制成不同质量浓度的FDR待测样液(终浓度分别为200、400、600 μg/mL),将RAW264.7细胞接种至96孔板,在5% CO2、37 ℃的环境下培养24 h,实验设置非药物处理组和样品组,样品组加入FDR待测样液,用1 μg/mL脂多糖(LPS)进行诱导刺激细胞,非药物处理组加入1% DMSO培养液,不加LPS刺激细胞,两组均在5% CO2、37 ℃的细胞培养环境下培养,分别取各组的上清液,使用Griess Reagent试剂盒检测NO生成,在570 nm处测定吸光值,按照以下公式计算NO生成抑制率。
NO生成抑制率(%)=非药物处理组OD570nm−样品组OD570nm非药物处理组OD570nm×100 1.4 数据处理
每组实验平行测定3次,数据通过SPSS 27和Excel软件处理,实验结果以平均值±误差表示,利用邓肯氏检验,分析不同样品之间显著性差异,以P<0.05为差异显著。
2. 结果与分析
2.1 大理白族地区玫瑰资源调查分析
2.1.1 玫瑰资源种类及其传统用途、加工方式和可能的功效
通过民族植物学调查,对云南大理白族地区玫瑰资源及其传统应用进行整理,包括玫瑰资源种类、传统加工方式等(表2),玫瑰资源包括滇红玫瑰(Rosa rugosa ‘Dianhong’)、墨红玫瑰(Rosa rugosa ‘Mohong’)、金樱子(Rosa laevigata)、玫瑰(Rosa rugosa)、缫丝花(刺梨)(Rosa roxburghii)、法国玫瑰(Rosa gallica)和百叶蔷薇(Rosa centifolia),共7种蔷薇属植物,被广泛当作药食同源植物,在民族民间广泛使用。具体的产品包括被制作成传统发酵玫瑰糖、玫瑰葡萄酒和玫瑰花茶等,据当地人表示这些产品在民间有抗衰老、抗风湿、解毒等功效。据研究,玫瑰花瓣具有抗氧化、抗衰老的作用,能够治疗风湿病和脱水,加速血液循环,并具有解毒利尿的特性[24−25]。
表 2 云南大理白族地区玫瑰资源及其传统应用Table 2. Rose resources and traditional applications in Dali Bai communities名称 食用部位 传统加工方式 可能的传统功效 分布 ICF f 滇红玫瑰
Rosa rugosa ‘Dianhong’花瓣 玫瑰糖、玫瑰酒、
玫瑰茶降血糖血脂、抗衰老、保持皮肤光滑、护肝养胃、消除炎症等 云南西北部 0.93 0.99 金樱子
Rosa laevigata Mich叶
根
果糖浆、玫瑰酒 根:抗衰老、抗风湿、促进血液循环、杀虫;
叶:防止溃疡、烧伤海拔200~1400 m的田野边和河边灌木 0.79 0.69 墨红玫瑰
Rosa rugosa ‘Mohong’花瓣 玫瑰糖、玫瑰酒 滋养身体、保持皮肤光滑 云南西北部 0.77 0.37 玫瑰
Rosa rugosa Tunb花蕾 玫瑰花茶 促进肠胃、调和血液、缓解疼痛、缓解抑郁 云南西北部 0.67 0.54 单瓣缫丝花
Rosa roxburghii Tratt. f. normalis Rehd. et Wils果实 玫瑰糖、玫瑰酒 抗衰老 海拔500~2500 m的山
坡灌木丛0.43 0.56 法国玫瑰
Rosa gallica L.花瓣 玫瑰糖、玫瑰酒、玫瑰花茶 保持皮肤健康与光滑 云南西北部 0.36 0.12 百叶蔷薇
Rosa centifolia L.花瓣 玫瑰花茶 保持皮肤健康有光泽 云南西北部 0.11 0.08 2.1.2 大理白族地区的传统发酵玫瑰现状
一个物种信息共识因子(ICF)和使用频率(f)值越大,说明该物种在当地的文化价值和消费程度越高,通过分析云南大理白族地区可食用玫瑰植物的ICF和f值可以看出(表2),主要使用的品种是滇红玫瑰。滇红玫瑰ICF和f值均具有最高值,显示其文化价值和消费程度,主要加工成TFR(玫瑰糖)、玫瑰酒、玫瑰茶。而大理白族地区的TFR属于自然发酵,发酵周期长,缺乏具体的质量标准,其功效性和潜在的价值缺乏有力的证据。为了探究滇红玫瑰发酵传统加工方式的科学性与滇红玫瑰发酵过程中的抗氧化和抗炎活性变化,本研究采用药理活性检测技术,利用TFR-1进行发酵,建立单一的内源菌种发酵,对滇红玫瑰发酵过程中的TFC、TPC、抗氧化和抗炎活性进行深入研究。
2.2 发酵对FDR中总黄酮和总酚含量的影响
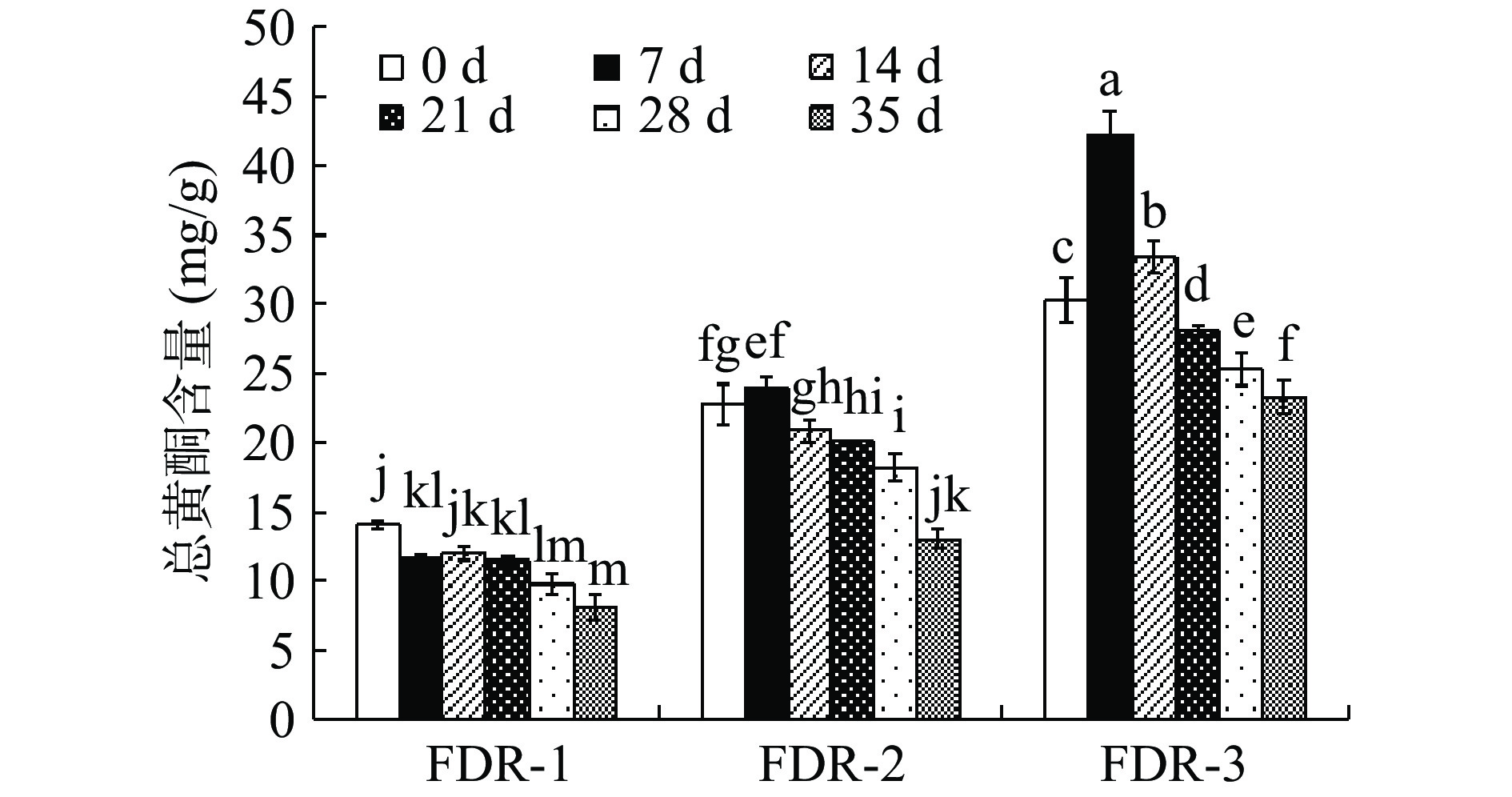
整个发酵过程FDR总黄酮含量(TFC)变化情况如图1所示,FDR-1在发酵后TFC减少,未发酵对照组第0 d含量最高(14.09±0.53)mg/g,在发酵至35 d时TFC最低,为(8.15±0.97)mg/g,对比未发酵对照组显著降低了42.16%(P<0.05);FDR-2的TFC随发酵时间呈先增加后减少的趋势,在发酵7 d时达到最高值(23.97±0.81)mg/g,对比未发酵对照组增加了5.27%。发酵14 d后TFC持续降低,35 d时降到最低含量(13.08±0.67)mg/g;同样,FDR-3的TFC随发酵时间也呈先增加后减少的趋势,对比未发酵对照组,在发酵的14 d内能够显著增加(P<0.05),且在发酵7 d时达到最高值(42.21±1.77)mg/g,增加了39.54%。发酵21 d后TFC持续减少,35 d时降到最低含量(23.27±1.17)mg/g。对比三个样品组,在同一发酵时间下FDR-3的TFC显著高于FDR-2(P<0.05),FDR-1的TFC最低。
![]() 图 1 FDR发酵过程中总黄酮含量注:不同小写字母表示差异显著(P<0.05);图2同。Figure 1. Total flavone content in the fermentation process of FDR
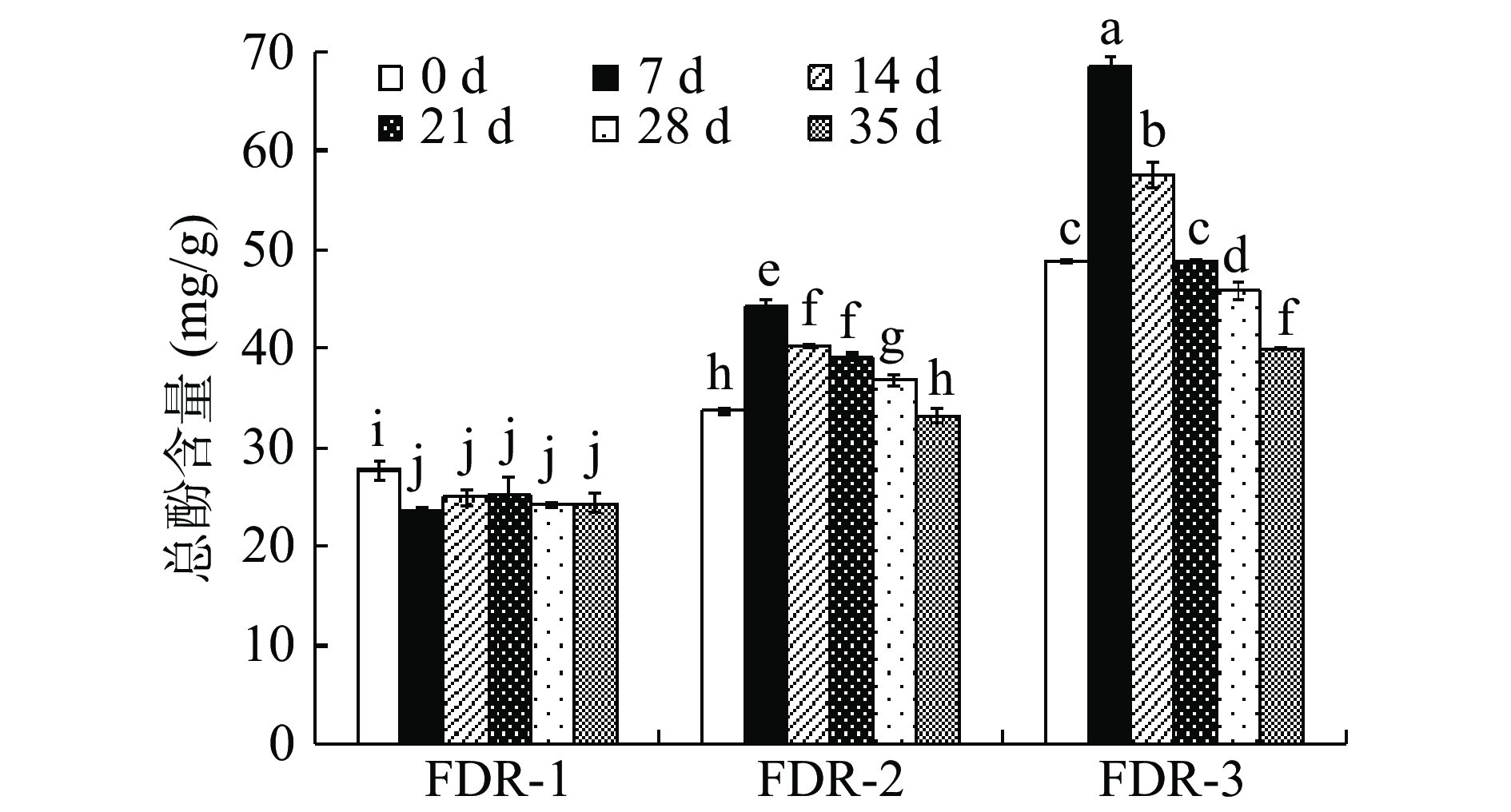
图 1 FDR发酵过程中总黄酮含量注:不同小写字母表示差异显著(P<0.05);图2同。Figure 1. Total flavone content in the fermentation process of FDR整个发酵过程FDR总酚含量(TPC)变化情况如图2所示,TPC的总体变化趋势与TFC相同,FDR-1的TPC在发酵后减少,未发酵对照组第0 d含量最高(27.70±0.93)mg/g,在发酵7 d时TPC最低,为(23.68±0.28)mg/g,显著降低了14.51%(P<0.05);FDR-2的TPC随发酵时间呈先增加后减少的趋势,对比未发酵对照组,在发酵的28 d内能够显著增加(P<0.05),且在发酵7 d时达到最高值(44.27±0.74)mg/g,增加了31.48%。发酵35 d后TPC减少1.22%;同样,FDR-3的TPC随发酵时间也呈先增加后减少的趋势,对比未发酵对照组,在发酵的14 d内显著增加(P<0.05),且在发酵7 d时达到最高值(68.58±0.83)mg/g,增加了40.53%。发酵21 d后TPC持续减少,35 d时降到最低含量(39.96±0.07)mg/g。对比三个样品组,在同一发酵时间下FDR-3的TPC显著高于FDR-2(P<0.05),FDR-1的TPC最低。
酵母菌易受到高浓度糖的胁迫,使其菌体的生长代谢受到抑制,影响发酵产物的质量[26]。FDR-1发酵后TFC和TPC减少,可能是由于在高糖环境下TFR-1生长代谢受到抑制,有研究表明部分生存能力强的微生物消耗原料中的酚类物质合成其他的代谢产物,用于自身增殖与生长,从而导致发酵后TFC和TPC下降[27]。而FDR-2和FDR-3在7 d时TFC和TPC增加至最高,其主要原因可能是发酵初期结合态酚类物质在水解酶的作用下溶出,复杂的大分子酚类物质被微生物转化成小分子物质,导致游离总黄酮和总酚含量提高,延长发酵时间可能加速了酚类物质的氧化分解,并且随着花青素类物质的逐步降解,7 d后含量出现下降趋势[28]。
2.3 体外抗氧化活性分析
2.3.1 DPPH自由基清除活性
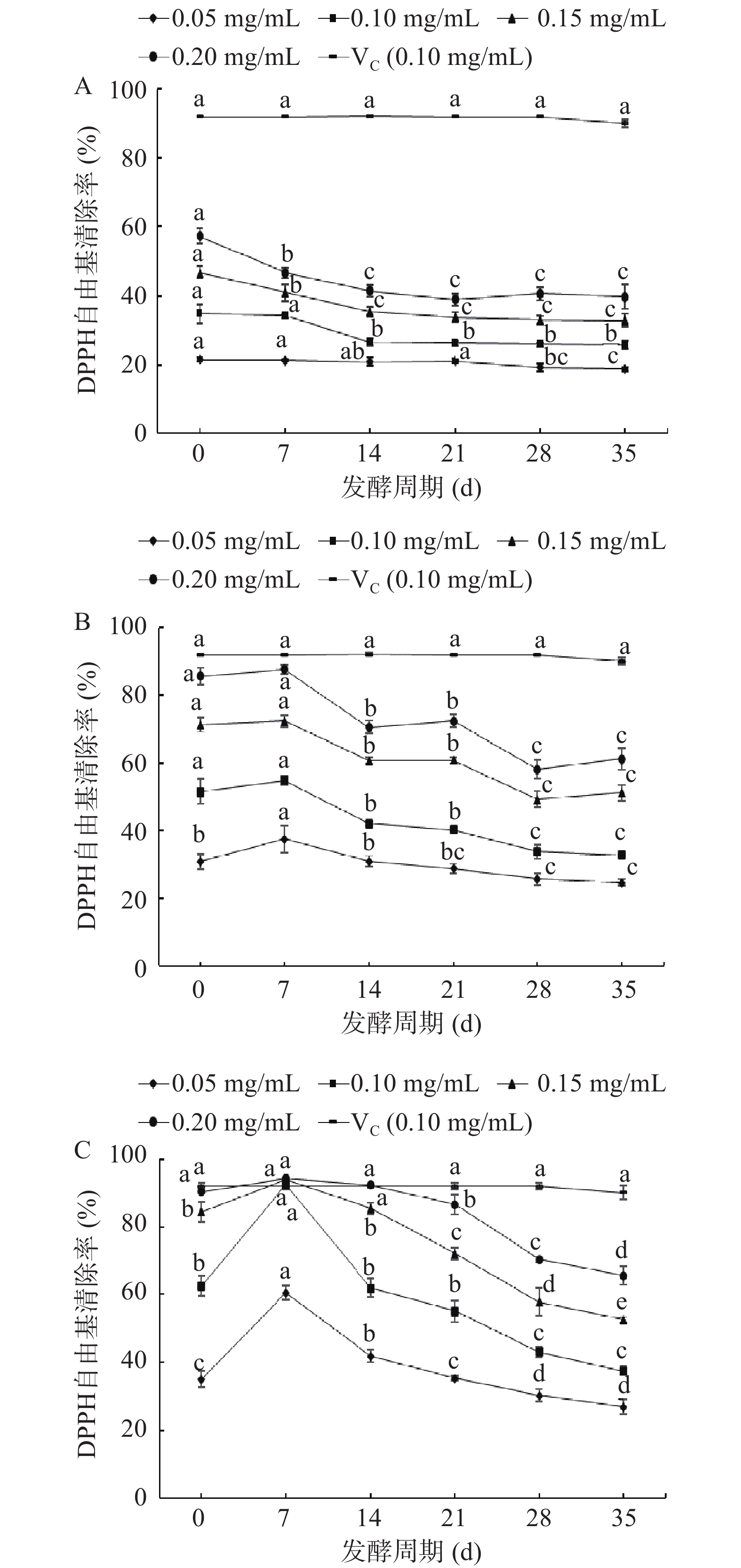
玫瑰花是天然抗氧化剂来源,其提取物具有清除体内自由基、延缓衰老的功效[29]。FDR对DPPH自由基的清除能力如图3所示,在0.05~0.20 mg/mL质量浓度下,FDR对DPPH自由基清除率与质量浓度有良好的量效关系。在质量浓度为0.10 mg/mL时,如图3A所示,FDR-1对DPPH自由基的清除率随着发酵时间的延长呈现下降趋势,未发酵对照组(0 d)清除率最高为34.66%,在发酵35 d时最低,对比未发酵对照组显著降低了25.91%(P<0.05),发酵35 d时FDR-1的IC50值为283.00 μg/mL(表3);在质量浓度为0.10 mg/mL时,如图3B所示,FDR-2对DPPH自由基的清除率随发酵时间的延长呈先上升后下降的趋势,在发酵7 d时清除自由基能力最强,为54.77%,对比未发酵对照组增强6.33%,发酵7 d时FDR-2的IC50值为86.10 μg/mL,在质量浓度为0.10 mg/mL时,发酵14 d后对DPPH自由基清除能力持续下降,发酵至35 d时最低;图3C中,FDR-3对DPPH自由基的清除率随发酵时间的延长呈先上升后下降的趋势,在质量浓度为0.10 mg/mL时,在发酵7 d时DPPH自由基清除率最强为92.38%,对比未发酵对照组显著增强了53.39%(P<0.05),清除DPPH自由基的能力与VC相当,无显著性差异(P>0.05),发酵7 d时FDR-3的IC50值为41.60 μg/mL,但低于阳性对照组VC(IC50为3.50 μg/mL)。发酵14 d后FDR-3清除自由基能力持续减弱,在发酵35 达到最低值。在质量浓度为0.10 mg/mL时,清除DPPH自由基能力由强到弱依次是:VC>FDR-3>FDR-2>FDR-1。
FDR-2和FDR-3发酵7 d能够提高其清除DPPH自由基的能力,可能与发酵前期大量的TFC和TPC等抗氧化活性物质在水解酶的作用下溶出有关,有研究表明利用乳酸菌发酵能够增加玫瑰花瓣中总黄酮、VC和游离氨基酸的含量,从而提高其抗氧化能力[30]。发酵7 d后随着鲁氏酵母大量繁殖,受到生长空间和营养成分的限制,抑制其发酵的进行,使DPPH自由基的清除能力随着发酵时间的延长而降低。这与王思溥等[27]对黑果腺肋花楸酵素的研究结果一致,随着发酵的进行,DPPH自由基清除能力呈先上升后下降的趋势。而FDR-1清除自由基的能力降低,可能是由于在较高糖浓度胁迫下TFR-1生长受到抑制,清除自由基的能力降低,有研究报道高浓度糖的胁迫,抑制了酵母菌的生长[31]。
表 3 FDR对DPPH和ABTS+自由基清除活性的IC50值Table 3. IC50 value of FDR for DPPH and ABTS+ free radical scavenging ability发酵周期(d) DPPH IC50(μg/mL) ABTS+ IC50(μg/mL) FDR-1 FDR-2 FDR-3 FDR-1 FDR-2 FDR-3 0 166.50 98.30 78.40 102.40 67.30 38.30 7 225.80 86.10 41.60 154.90 42.30 19.00 14 269.90 122.30 70.00 148.90 67.30 43.80 21 291.30 119.60 89.20 165.10 75.10 48.00 28 270.70 160.50 126.00 184.20 96.70 72.20 35 283.00 156.10 145.50 177.10 99.40 80.70 2.3.2 ABTS+自由基清除活性
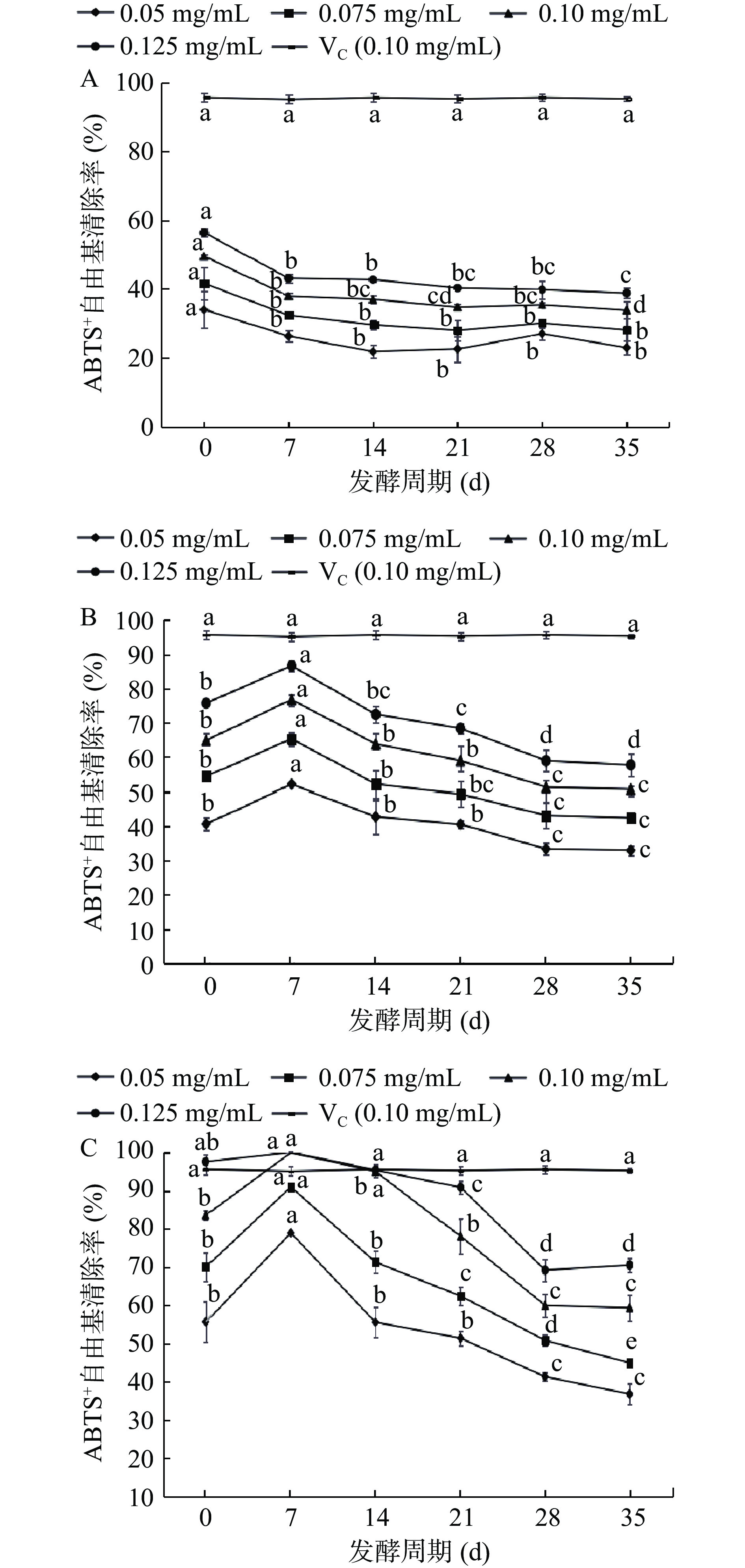
发酵过程中FDR对ABTS+自由基清除能力结果如图4所示,在质量浓度0.05~0.125 mg/mL时,FDR对ABTS+自由基的清除率与质量浓度呈量效关系。在质量浓度为0.10 mg/mL时,如图4A,FDR-1在发酵后对ABTS+自由基的清除率呈现下降的趋势,未发酵对照组(0 d)清除率最高为49.55%,在发酵35 d时最低,相比未发酵对照组降低了31.75%,发酵35 d时FDR-1的IC50值为177.10 μg/mL;如图4B,FDR-2对ABTS+自由基的清除率随着发酵时间的延长呈现先升高后下降的趋势,在质量浓度为0.10 mg/mL时,在发酵7 d时对ABTS+自由基的清除能力最强为76.81%,对比未发酵对照组显著增强了18.39%(P<0.05),略接近阳性对照组VC,发酵7 d时FDR-2的IC50值为42.30 μg/mL,但IC50低于阳性对照VC(IC50=2.30 μg/mL),发酵14 d后FDR-2清除率持续减弱,35 d时达到最低值50.72%;如图4C,FDR-3对ABTS+自由基的清除率随着发酵时间的延长呈现先升高后下降的趋势,在质量浓度为0.10 mg/mL时,在发酵7 d时达到最高值为99.92%,显著高于VC(P<0.05),对比未发酵对照组显著增强了19.36%(P<0.05),发酵7 d时FDR-3的IC50为19.00 μg/mL。发酵14 d后FDR-3清除率持续减弱,发酵到35 d时达到最低值为59.37%。在发酵第7 d,质量浓度为0.10 mg/mL时,清除ABTS+自由基能力由强到弱依次是:FDR-3>VC>FDR-2>FDR-1。
ABTS+和DPPH自由基清除能力的变化规律大致相同。FDR-1在较高糖浓度胁迫下,TFR-1细胞生长受到抑制,可能是清除自由基的能力降低的主要原因[31]。而FDR-2和FDR-3发酵7 d后能够提高清除ABTS+自由基的能力,这可能与发酵前期较高的TFC和TPC有关,发酵7 d后自由基清除能力逐渐减弱很可能与发酵样品中鲁氏酵母分解或者消耗具有清除能力的物质有关[32]。
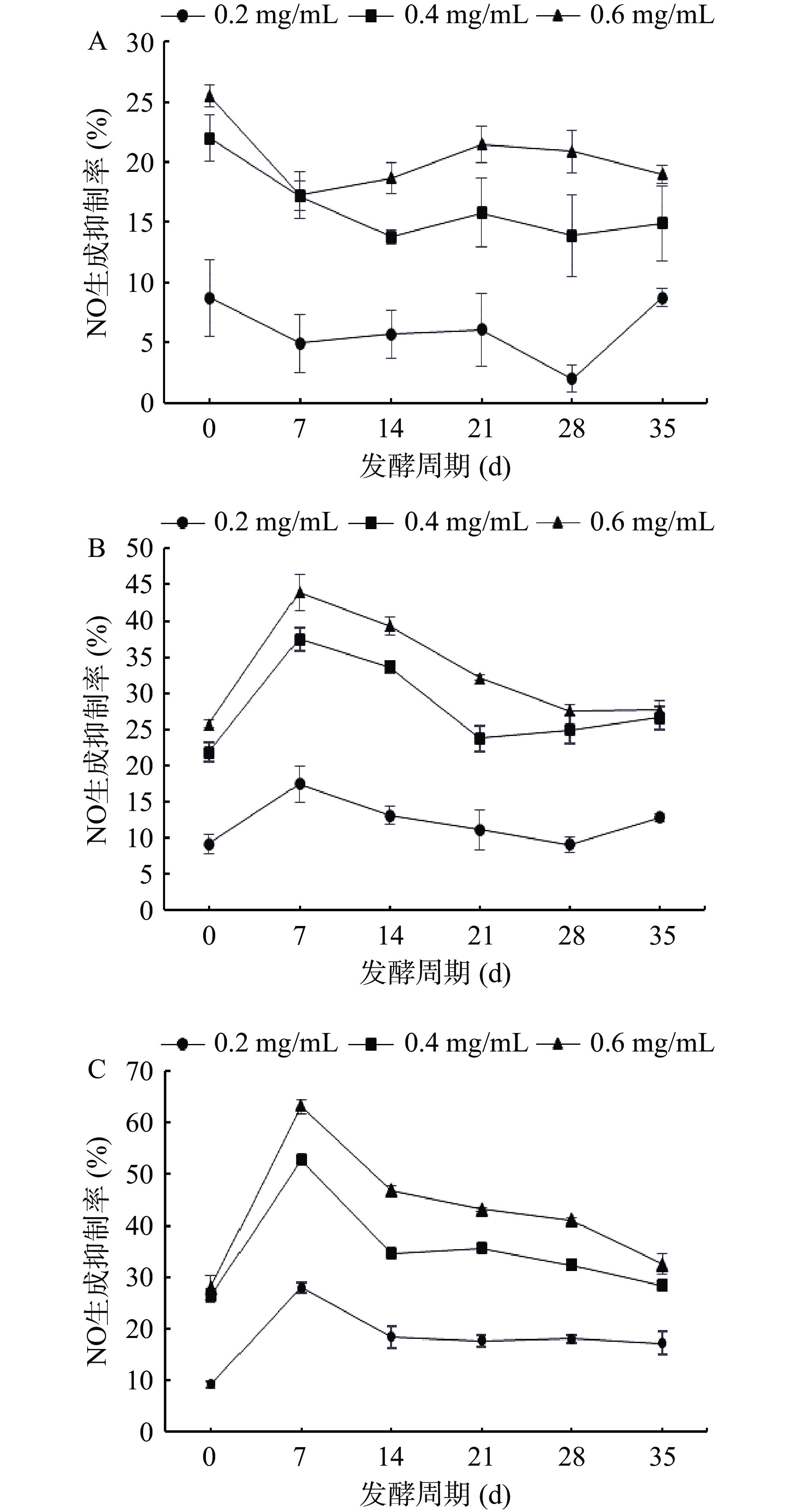
2.4 FDR提取物对LPS诱导RAW264.7细胞NO生成抑制率的影响
当免疫细胞受微生物内毒素、炎症介质等刺激时,会生成大量的诱导型一氧化氮合成酶(Induced NO Synthase,iNOS),产生NO进行免疫应答,因此抑制NO生成是化合物抗炎活性的直接指标[33]。发酵过程中FDR对LPS诱导RAW264.7细胞生成NO的影响结果如图5所示。在0.2~0.6 mg/mL质量浓度下,FDR对NO生成抑制率与质量浓度呈量效关系。在质量浓度为0.60 mg/mL,如图5A,FDR-1发酵后对NO生成抑制率减弱,抑制率在17.22%~21.48%,未发酵对照组(0 d)抑制率最高为25.50%;在质量浓度为0.60 mg/mL,如图5B,FDR-2对NO生成抑制率随着发酵时间的延长总体呈现先上升后下降的趋势,从高到低顺序为:发酵7 d>14 d>21 d>28 d>35 d>未发酵对照组(0 d),在发酵7 d时对NO生成具有最强的抑制率,为43.93%,对比未发酵对照组增强了70.67%;图5C中,FDR-3对NO生成抑制率随着发酵时间的延长呈现先上升后下降的趋势,对NO生成抑制率从高到低顺序为:发酵7 d>14 d>21 d>28 d>35 d>未发酵对照组(0 d),在发酵7 d时对NO生成抑制率最强为63.04%,是未发酵对照组的2.24倍,说明FDR-3发酵7 d后能够明显增强NO生成的抑制率。
有学者研究表明干柑橘果皮含有高浓度的类黄酮,使用枯草芽孢杆菌发酵干柑橘果皮,其提取物能够高度抑制LPS诱导的一氧化氮(NO),而不会对RAW264.7细胞产生细胞毒性作用,表现其抗炎特性[34]。对比三个不同糖比例的样品组发现,TFC、TPC、DPPH和ABTS+自由基清除能力以及NO生成抑制能力均是FDR-3最高,其次是FDR-2,最后是FDR-1。该结果可能与滇红玫瑰花瓣占比有关,Moreira等[35]在苹果与玫瑰花混合果酱的研究中发现,添加的玫瑰花瓣越多,酚类物质含量越高,抗氧化活性越强。并且在探究玫瑰酱相关性含量分析中还发现,玫瑰酱的抗氧化能力与酚类物质具有相关性[36]。
2.5 酚类物质含量与抗氧化和抗炎活性变化的相关性
为进一步探究TFR-1发酵滇红玫瑰酚类物质含量与抗氧化和抗炎活性之间的关系,对发酵后FDR-3提取物的抗氧化和抗炎能力与TPC、TFC进行相关性分析,结果如表4所示,FDR-3清除DPPH、ABTS+自由基能力与TPC极显著相关(相关系数r分别为0.952、0.903,P<0.01),对DPPH和ABTS+自由基清除率与TFC极显著相关(r分别为0.985、0.918,P<0.01),细胞NO生成抑制率与FDR-3 TPC和TFC之间存在显著相关性(r分别为0.869和0.803,P<0.05),上述研究结果表明多酚和黄酮是滇红玫瑰发酵提取物发挥抗氧化和抗炎活性的主要物质基础,发酵过程中滇红玫瑰提取物的抗氧化能力和抗炎活性的差异与其所含多酚、黄酮的含量差异有关。有研究表明总酚和总黄酮含量对金佛手的功能特性起着重要作用,发酵改变提取物的化学成分,可增加其生物活性,是生产新物质的重要生物转化过程[37],并且也表明发酵过程中总酚的积累量与其抗氧化和抗炎指标之间有明显的相关性[38]。
表 4 酚类物质含量与抗氧化和抗炎活性的相关性Table 4. Correlations between the content of phenolic substance and antioxidant and anti-inflammatory activity指标 TPC TFC DPPH·
清除率ABTS+·
清除率NO生成
抑制率TPC 1 TFC 0.986** 1 DPPH·清除率 0.952** 0.985** 1 ABTS+·清除率 0.903** 0.918** 0.902** 1 NO生成抑制率 0.869* 0.803* 0.744* 0.623 1 注:“*”表示显著P<0.05;“**”表示极显著P<0.01。 3. 结论
本文通过民族植物学调查研究发现在云南大理白族地区,7种玫瑰植物被用作药食同源植物,其中滇红玫瑰文化价值和使用频率最高,主要制作成玫瑰糖(TFR)、玫瑰酒、玫瑰茶。利用鲁氏酵母(TFR-1)对滇红玫瑰进行发酵后,FDR-2和FDR-3的酚类物质含量(总黄酮、总酚)、DPPH和ABTS+自由基清除能力、NO抑制率均呈先上升后下降的趋势,与发酵前相比,FDR-2和FDR-3在发酵7 d时显著(P<0.05)增加酚类物质含量,提高DPPH和ABTS+自由基的清除活性以及NO生成抑制率并达到最高值。而糖比例最高的FDR-1(50%)发酵后以上指标呈现下降趋势。相关性分析结果表明,发酵过程中酚类物质含量与抗氧化活性呈极显著的正相关(P<0.01),与抗炎活性呈显著的正相关(P<0.05),说明滇红玫瑰抗氧化和抗炎活性与发酵过程中产生的酚类物质密切相关。研究分析大理白族地区使用频率最高的滇红玫瑰在发酵过程中提取物酚类物质含量及其抗氧化和抗炎活性变化,下一步将进一步通过细胞实验研究其体内生物活性以及糖浓度对TFR-1生长的影响,推动食用玫瑰衍生产品的多样化开发及相关民族产业的发展。
-
图 1 FDR发酵过程中总黄酮含量
注:不同小写字母表示差异显著(P<0.05);图2同。
Figure 1. Total flavone content in the fermentation process of FDR
表 1 关键人物信息
Table 1 Information of key individuals
类别 范围 人数 所占百分比(%) 地点 大理县 83 22.37 洱源县 76 20.49 巍山县 65 17.52 剑川县 69 18.60 鹤庆县 78 21.02 年龄(岁) 26~35 82 22.10 36~45 113 30.46 46~55 109 29.38 56~65 38 10.24 66~75 21 5.66 75以上 8 2.16 性别 男 167 45 女 204 55 表 2 云南大理白族地区玫瑰资源及其传统应用
Table 2 Rose resources and traditional applications in Dali Bai communities
名称 食用部位 传统加工方式 可能的传统功效 分布 ICF f 滇红玫瑰
Rosa rugosa ‘Dianhong’花瓣 玫瑰糖、玫瑰酒、
玫瑰茶降血糖血脂、抗衰老、保持皮肤光滑、护肝养胃、消除炎症等 云南西北部 0.93 0.99 金樱子
Rosa laevigata Mich叶
根
果糖浆、玫瑰酒 根:抗衰老、抗风湿、促进血液循环、杀虫;
叶:防止溃疡、烧伤海拔200~1400 m的田野边和河边灌木 0.79 0.69 墨红玫瑰
Rosa rugosa ‘Mohong’花瓣 玫瑰糖、玫瑰酒 滋养身体、保持皮肤光滑 云南西北部 0.77 0.37 玫瑰
Rosa rugosa Tunb花蕾 玫瑰花茶 促进肠胃、调和血液、缓解疼痛、缓解抑郁 云南西北部 0.67 0.54 单瓣缫丝花
Rosa roxburghii Tratt. f. normalis Rehd. et Wils果实 玫瑰糖、玫瑰酒 抗衰老 海拔500~2500 m的山
坡灌木丛0.43 0.56 法国玫瑰
Rosa gallica L.花瓣 玫瑰糖、玫瑰酒、玫瑰花茶 保持皮肤健康与光滑 云南西北部 0.36 0.12 百叶蔷薇
Rosa centifolia L.花瓣 玫瑰花茶 保持皮肤健康有光泽 云南西北部 0.11 0.08 表 3 FDR对DPPH和ABTS+自由基清除活性的IC50值
Table 3 IC50 value of FDR for DPPH and ABTS+ free radical scavenging ability
发酵周期(d) DPPH IC50(μg/mL) ABTS+ IC50(μg/mL) FDR-1 FDR-2 FDR-3 FDR-1 FDR-2 FDR-3 0 166.50 98.30 78.40 102.40 67.30 38.30 7 225.80 86.10 41.60 154.90 42.30 19.00 14 269.90 122.30 70.00 148.90 67.30 43.80 21 291.30 119.60 89.20 165.10 75.10 48.00 28 270.70 160.50 126.00 184.20 96.70 72.20 35 283.00 156.10 145.50 177.10 99.40 80.70 表 4 酚类物质含量与抗氧化和抗炎活性的相关性
Table 4 Correlations between the content of phenolic substance and antioxidant and anti-inflammatory activity
指标 TPC TFC DPPH·
清除率ABTS+·
清除率NO生成
抑制率TPC 1 TFC 0.986** 1 DPPH·清除率 0.952** 0.985** 1 ABTS+·清除率 0.903** 0.918** 0.902** 1 NO生成抑制率 0.869* 0.803* 0.744* 0.623 1 注:“*”表示显著P<0.05;“**”表示极显著P<0.01。 -
[1] ZHANG J M, XIAO Y, GUAN Y, et al. An aqueous polyphenol extract from Rosa rugosa tea has antiaging effects on Caenorhabditis elegans[J]. Journal of Food Biochemistry,2019,43:e12796. doi: 10.1111/jfbc.12796
[2] 张红霞, 王忠泽, 杨宇涵, 等. 金边玫瑰饮料的研制及其香气、抗氧化活性评价[J]. 食品工业,2021,42(12):63−67. [ZHANG Hongxia, WANG Zhongze, YANG Yuhan, et al. Preparation of Rosa chinensis cv."Jin Bian" beverage and its antioxidant activity[J]. Food Industry,2021,42(12):63−67.] ZHANG Hongxia, WANG Zhongze, YANG Yuhan, et al. Preparation of Rosa chinensis cv."Jin Bian" beverage and its antioxidant activity[J]. Food Industry, 2021, 42(12): 63−67.
[3] LUO J, MILLS K, CESSIE L S, et al. Ageing, age-related diseases and oxidative stress:What to do next?[J]. Ageing Research Reviews,2020,57:100982. doi: 10.1016/j.arr.2019.100982
[4] PAL A, BHUSHAN B, NARWAL K R, et al. Extraction and evaluation of antioxidant and free radical scavenging potential correlated with biochemical components of red rose petals[J]. Iranian Journal of Science and Technology,2018,42(3):1027−1036. doi: 10.1007/s40995-016-0071-2
[5] WANG F, MIAO M, XIA H, et al. Antioxidant activities of aqueous extracts from 12 Chinese edible flowers in vitro and in vivo[J]. Food & Nutrition Research,2017,61:1265324.
[6] LI L, NG T B, GAO W, et al. Antioxidant activity of gallic acid from rose flowers in senescence accelerated mice[J]. Life Sciences,2005,77:230−40. doi: 10.1016/j.lfs.2004.12.024
[7] REN G, XUE P, SUN X Y, et al. Determination of the volatile and polyphenol constituents and the antimicrobial, antioxidant, and tyrosinase inhibitory activities of the bioactive compounds from the by-product of Rosa rugosa Thunb. var. plena Regal tea[J]. BMC Complementary and Alternative Medicine,2018,18:307. doi: 10.1186/s12906-018-2374-7
[8] RENATA N, MARTA O, LUKASZ P, et al. Cytotoxic, antioxidant, antimicrobial properties and chemical composition of rose petals[J]. Journal of the Science of Food and Agriculture,2014,94:560−567. doi: 10.1002/jsfa.6294
[9] LEE M H, NAM T G, LEE I, et al. Skin anti-inflammatory activity of rose petal extract (Rosa gallica) through reduction of MAPK signaling pathway[J]. Food Science & Nutrition,2018,6:2560−2567.
[10] JU S E, AH-RAM H, LEE M H, et al. Extraction conditions for Rosa gallica petal extracts with anti-skin aging activities[J]. Food Science and Biotechnology,2019,28:1439−1446. doi: 10.1007/s10068-019-00596-7
[11] HUAN X, SUN-WATERHOUSE D X, WATERHOUSE G I N, et al. Fermentation-enabled wellness foods:A fresh perspective[J]. Food Science and Human Wellness,2019,8(3):203−243. doi: 10.1016/j.fshw.2019.08.003
[12] 李涛涛. 益生菌复合发酵促进玫瑰花渣TPC及生物活性研究[D]. 北京:北京林业大学, 2019:28−38. [LI Taotao. Study on promoting polyphenol content and biological activities of rose residue by probiotics compound fermentation[D]. Beijing:Beijing Forestry University, 2019:28−38.] LI Taotao. Study on promoting polyphenol content and biological activities of rose residue by probiotics compound fermentation[D]. Beijing: Beijing Forestry University, 2019: 28−38.
[13] 赵丹, 曹玉峰, 丁文玉, 等. 玫瑰发酵液的抗氧化及美白功效探究[J]. 食品与机械,2017(9):141−145,196. [ZHAO Dang, CAO Yufeng, DING Wenyu, et al. Study on the antioxidant and whitening effect of rose fermented broth[J]. Food and Machinery,2017(9):141−145,196.] ZHAO Dang, CAO Yufeng, DING Wenyu, et al. Study on the antioxidant and whitening effect of rose fermented broth[J]. Food and Machinery, 2017(9): 141−145,196.
[14] 孙逊, 李菲, 张雨, 等. 发酵果蔬汁的发酵方式、生物活性及品质改善研究进展[J]. 食品工业科技,2023,44(19):471−480. [SUN Xun, LI Fei, ZHANG Yu, et al. Research progress on fermentation strategies, biological activities and quality improvements of fermented fruit and vegetable juices[J]. Science and Technology of Food Industry,2023,44(19):471−480.] SUN Xun, LI Fei, ZHANG Yu, et al. Research progress on fermentation strategies, biological activities and quality improvements of fermented fruit and vegetable juices[J]. Science and Technology of Food Industry, 2023, 44(19): 471−480.
[15] LANG B Y, ZHAO Y Q, YANG R, et al. Antioxidant and tyrosinase inhibitory activities of traditional fermented Rosa from Dali Bai communities, Northwest Yunnan, China[J]. Scientific Reports,2021,11:22700. doi: 10.1038/s41598-021-02160-y
[16] 范彦晓. 大理白族传统植物染色及其文化研究[D]. 昆明:西南林业大学, 2019. [FAN Yanxiao. Study on traditional plant dyeing and its culture of Bai nationality in Dali[D]. Yunnan:Southwest Forestry University, 2019.] FAN Yanxiao. Study on traditional plant dyeing and its culture of Bai nationality in Dali[D]. Yunnan: Southwest Forestry University, 2019.
[17] FAN Y X, ZHAO Y Q, LIU A Z, et al. Indigenous knowledge of dye-yielding plants among Bai communities in Dali, Northwest Yunnan, China[J]. Journal of Ethnobiology and Ethnomedicine,2018,14:74. doi: 10.1186/s13002-018-0274-z
[18] 胡仁传, 胡琦敏, 农友, 等. 我国白裤瑶饲料植物的民族植物学研究[J]. 广西植物,2023,43(1):21−31. [HU Rengchuang, HU Qimin, NONG You, et al. Ethnobotanical study on forage plants of Baiku Yao in China[J]. Plants of Guangxi,2023,43(1):21−31.] doi: 10.11931/guihaia.gxzw202111076 HU Rengchuang, HU Qimin, NONG You, et al. Ethnobotanical study on forage plants of Baiku Yao in China[J]. Plants of Guangxi, 2023, 43(1): 21−31. doi: 10.11931/guihaia.gxzw202111076
[19] LUIZ G, REINALDO D L, ULYSSES D A. Knowledge and use of medicinal plants by local specialists in an region of Atlantic Forest in the state of Pernambuco (Northeastern Brazil)[J]. Journal of Ethnobiology and Ethnomedicine,2005,1:9. doi: 10.1186/1746-4269-1-9
[20] AURITA B, RIMA U, MINDAUGAS, et al. Phenolic content and antioxidant activity in fruit of the genus Rosa L.[J]. Antioxidants,2022,11(5):912. doi: 10.3390/antiox11050912
[21] LEKOUAGHET A, BOUTEFNOUCHET A, BENSUICI C, et al. In vitro evaluation of antioxidant and anti-inflammatory activities of the hydroalcoholic extract and its fractions from Leuzea conif era L. roots[J]. South African Journal of Botany,2020,132:101−21.
[22] LOIZZO M R, PUGLIESE A, BONESI M, et al. Edible flowers:A rich source of phytochemicals with antioxidant and hypoglycemic properties[J]. Journal of Agricultural and Food Chemistry,2016,64:2467−2474. doi: 10.1021/acs.jafc.5b03092
[23] NAJJAR R S, AKHAVAN N S, POURAFSHAR S, et al. Cornus officinalis var. koreana Kitam polyphenol extract decreases pro-inflammatory markers in lipopolysaccharide (LPS)-induced RAW264.7 macrophages by reducing Akt phosphorylation[J]. Ethnopharmacol,2021,270:113734. doi: 10.1016/j.jep.2020.113734
[24] GOEUN Y, DONGSUN P, HEE L S, et al. Neuroprotective effects of a butanol fraction of Rosa hybrida petals in a middle cerebral artery occlusion model[J]. Biomolecules & Therapeutics,2013,21:454−61.
[25] 鲁雷震, 贾紫伟, 封成玲, 等. 玫瑰植物中活性物质及其功效研究进展[J]. 食品研究与开发,2021,42(20):206−213. [LU Leizheng, JIA Ziwei, FENG Chengling, et al. Review of biologically active substances in rose plants and their functions[J]. Food Research and Development,2021,42(20):206−213.] doi: 10.12161/j.issn.1005-6521.2021.20.031 LU Leizheng, JIA Ziwei, FENG Chengling, et al. Review of biologically active substances in rose plants and their functions[J]. Food Research and Development, 2021, 42(20): 206−213. doi: 10.12161/j.issn.1005-6521.2021.20.031
[26] DAKAL T C, SOLIERI L, GIUDICI P, et al. Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii[J]. International Journal of Food Microbiology,2014,185:140−57. doi: 10.1016/j.ijfoodmicro.2014.05.015
[27] 王思溥, 朱丹, 牛广财, 等. 黑果腺肋花楸酵素自然发酵过程中主要成分与抗氧化活性变化[J]. 食品工业科技,2023,44(15):93−100. [WANG Sibo, ZHU Dang, NIU Guangcai, et al. Changes of main components and antioxidant activity of blac chokeberry Jiaosu in natural fermentation[J]. Science and Technology of Food Industry,2023,44(15):93−100.] WANG Sibo, ZHU Dang, NIU Guangcai, et al. Changes of main components and antioxidant activity of blac chokeberry Jiaosu in natural fermentation[J]. Science and Technology of Food Industry, 2023, 44(15): 93−100.
[28] LI T L, JIANG T, LIU N, et al. Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J]. Food Chemistry,2021,339:127859. doi: 10.1016/j.foodchem.2020.127859
[29] ASKHAT S, KATARZYNA G B, ZURIYADDA S, et al. Rosa platyacantha Schrenk from Kazakhstan-Natural source of bioactive compounds with cosmetic significance[J]. Molecules,2021,26(9):2578. doi: 10.3390/molecules26092578
[30] 施帅, 宋慧, 马利华. 乳酸菌发酵对玫瑰花营养成分及其抗氧化性[J]. 食品工业,2019(10):168−170. [SHI Shuai, SONG Hui, MA Lihua. Lactobacillus fermentation on nutritional and antioxidant activity of rose[J]. Food Industry,2019(10):168−170.] SHI Shuai, SONG Hui, MA Lihua. Lactobacillus fermentation on nutritional and antioxidant activity of rose[J]. Food Industry, 2019(10): 168−170.
[31] 时桂芹, 任菲, 谢冰宗, 等. 高糖胁迫对酿酒酵母抗氧化活性及代谢的影响[J]. 食品工业科技,2019,40(20):94−100. [SHI Guiqin, REN Fei, XIE Bingzong, et al. Effect of high-glucose condition on antioxidant activity and metabolism of Saccharomy cescerevisiae[J]. Science and Technology of Food Industry,2019,40(20):94−100.] SHI Guiqin, REN Fei, XIE Bingzong, et al. Effect of high-glucose condition on antioxidant activity and metabolism of Saccharomy cescerevisiae[J]. Science and Technology of Food Industry, 2019, 40(20): 94−100.
[32] 朱倩, 杨松, 伍玉菡, 等. 乳杆菌发酵对生姜副产物蒸馏液活性成分及抗氧化活性的影响[J]. 食品与发酵工业,2022,48(24):131−138. [ZHU Qian, YANG Song, WU Yuhan, et al. Effects of Lactobacilus fermentation on active components and antioxidant activities of distillate of ginger by-product[J]. Food and Fermentation Industries,2022,48(24):131−138.] ZHU Qian, YANG Song, WU Yuhan, et al. Effects of Lactobacilus fermentation on active components and antioxidant activities of distillate of ginger by-product[J]. Food and Fermentation Industries, 2022, 48(24): 131−138.
[33] FACCHIN B M, DOS R G O, VIEIRA G N, et al. Inflammatory biomarkers on an LPS-induced RAW264.7 cell model:A systematic review and meta-analysis[J]. Inflammation Research,2022,71:741−758. doi: 10.1007/s00011-022-01584-0
[34] KIM C, JI J, HO B S, et al. Citrus unshiu fermented dried peel extracts exert anti-inflammatory activities in LPS-induced RAW264.7 macrophages and improve skin moisturizing efficacy in immortalized human HaCaT keratinocytes[J]. Pharmaceutical Biology,2019,57:392−402. doi: 10.1080/13880209.2019.1621353
[35] MOREIRA M C N D, ALMEIDA G L, CARVALHO E E N, et al. Quality parameters, antioxidant activity, and sensory acceptability of mixed jams of rose petals and apple[J]. Journal of Food Processing and Preservation,2019,43:15−19.
[36] 杨文清, 李梦茹, 李西西, 等. 玫瑰酱的功能特性与香气成分分析[J]. 中国调味品,2023,48(3):156−160,169. [YANG Wenqing, LI Mengru, LI Xixi, et al. Analysis of functional properties and aroma components of rose sauce[J]. Chinese Seasoning,2023,48(3):156−160,169.] doi: 10.3969/j.issn.1000-9973.2023.03.028 YANG Wenqing, LI Mengru, LI Xixi, et al. Analysis of functional properties and aroma components of rose sauce[J]. Chinese Seasoning, 2023, 48(3): 156−160,169. doi: 10.3969/j.issn.1000-9973.2023.03.028
[37] 方晟, 陈俊沲, 周瑾, 等. 金佛手酵素发酵过程中有机酸及其体外抗氧化性能分析[J]. 食品工业科技,2020,41(10):68−74. [FAN Sheng, CHENG Jundou, ZHOU Jin, et al. Analysis of organic acids and antioxidant activity in vitro of citrus medica Jiaosu during fermentation process[J]. Science and Technology of Food Industry,2020,41(10):68−74.] FAN Sheng, CHENG Jundou, ZHOU Jin, et al. Analysis of organic acids and antioxidant activity in vitro of citrus medica Jiaosu during fermentation process[J]. Science and Technology of Food Industry, 2020, 41(10): 68−74.
[38] 蒋增良, 毛建卫, 黄俊, 等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报,2014,14(10):29−34. [JIANG Zengliang, MAO Jianwei, HUANG Jun, et al. Changes in antioxidant activity of grape-ferment in vitro during natural fermentation process[J]. Chinese Journal of Food Science,2014,14(10):29−34.] JIANG Zengliang, MAO Jianwei, HUANG Jun, et al. Changes in antioxidant activity of grape-ferment in vitro during natural fermentation process[J]. Chinese Journal of Food Science, 2014, 14(10): 29−34.





 下载:
下载:
 下载:
下载:
