Optimization of the Enzyme-assisted Extraction and Tyrosinase Inhibition of the Flavonoids from Thinned Fruits of Guanxi Pummelo (Citrus grandis (L.) Osbeck)
-
摘要: 本论文旨在探讨β-葡萄糖苷酶法辅助提取琯溪蜜柚疏果黄酮的工艺及提取得到的黄酮对酪氨酸酶抑制作用。以总黄酮提取量为指标,采用单因素实验及响应面试验对β-葡萄糖苷酶酶活力、酶解pH、温度及时间进行优化,并研究总黄酮提取物对酪氨酸酶的抑制作用。结果表明,通过单因素实验和响应面试验优化得到琯溪蜜柚疏果黄酮提取的最优条件是:β-葡萄糖苷酶酶活力0.0128 U/mL、酶解pH4.4、酶解温度35 ℃、酶解时间4.8 h,在该工艺条件下疏果总黄酮提取量为34.0 mg/g;该黄酮提取物对酪氨酸酶的半抑制浓度(IC50)为0.31 mg/mL。本研究结果说明酶法工艺可显著提高琯溪蜜柚疏果黄酮的提取量,且琯溪蜜柚疏果黄酮具有较强的酪氨酸酶抑制作用,研究结果为琯溪蜜柚疏果黄酮提取及应用提供了参考依据,有利于促进琯溪蜜柚的高值化利用。Abstract: The aim of this paper was to explore the process of β-glucosidase-assisted extraction of flavonoids from thinned fruits of Guanxi pummelo and the inhibitory effect of the extracted flavonoids on tyrosinase. In this paper, the extraction amount of total flavonoids was used as the index, and the β-glucosidase activity, enzymatic hydrolysis pH, temperature and time were optimized by single factor and response surface experiments, and the inhibitory effect of total flavonoids extract on tyrosinase was studied. The results showed that the optimal conditions for the extraction of flavonoids from thinned fruits of Guanxi pummelo were as follows: β-Glucosidase enzyme activity 0.0128 U/mL, enzymolysis pH4.4, temperature 35 ℃, time 4.8 h. Under these conditions, the extraction amount of total flavonoids was 34.0 mg/g, the half maximal inhibitory concentration (IC50) of the flavonoids extract on tyrosinase was 0.31 mg/mL. The results of this study showed that the enzymatic process could significantly improve the extraction amount of flavonoids from thinned fruits of Guanxi pummelo, and the flavonoids from thinned fruits of Guanxi pummelo had strong tyrosinase inhibition. The results of this study provided a reference for the extraction and application of flavonoids from thinned fruits of Guanxi pummelo, which was conducive to promoting the high-value utilization of Guanxi pummelo.
-
Keywords:
- Guanxi pummelo /
- thinned fruits /
- flavonoid /
- β-glucosidase /
- tyrosinase inhibition
-
琯溪蜜柚(Citrus grandis (L.) Osbeck),属芸香科柑橘属一种水果,气味芳香浓郁,口感多汁柔软,清甜微酸,营养成分丰富,在福建省平和县等地区广泛种植,年产量约185万吨[1]。琯溪蜜柚每年标准化种植过程中约产生20%~30%疏果[2],主要是病果、畸形果、密弱果和小果[3]。研究[4]表明,蜜柚疏果中富含多种生物活性成分,如黄酮类化合物、多酚、精油、柠檬苦素等,具有良好的综合深加工利用价值。其中,黄酮类化合物是一类以C6-C3-C6为基本碳架的化合物[5],广泛存在于植物中,具有抗肿瘤、抗氧化、抗过敏、抗炎、美白等药理活性[6−9]。除了在食品和药品行业具有广泛应用之外,黄酮类化合物还可通过抑制酪氨酸酶的活性而减少黑色素的生成[10],在美白化妆品领域具有重要用途。近年来,研究证实以疏果为代表的未成熟柚类水果中含有大量的黄酮类物质[11],但对其开发利用研究尚不充分。因此,对柚类疏果黄酮物质进行提取及抑制酪氨酸酶活性的研究是琯溪蜜柚精深加工的重要途径。
目前,黄酮类化合物的提取方法包括碱提法、有机溶剂提取法、超声波/微波辅助提取法、酶水解辅助法等[12]。杜丽娟等[13]利用饱和Ca(OH)2溶液浸提和HCl溶液沉淀的方法提取柚皮中的黄酮类物质,提取率为8.95%。晏幸等[14]通过超声波辅助乙醇提取琯溪蜜柚中黄酮,提取率为4.90%。黄波等[15]通过微波辅助乙醇法提取柚皮中的黄酮类化合物,提取率为11.40%。相较于碱提法、有机溶剂提取法和超声波辅助提取法,酶水解辅助提取法具有反应体系温和、提取效率高、安全无毒、溶出杂质少、成本低等优点[16−17];尤其是酶水解辅助与乙醇联用技术对植物黄酮提取具有正向协同作用[18],是目前植物黄酮提取利用的绿色提取技术研发方向。
β-葡萄糖苷酶是一种水解酶,能作用于末端非还原性的β-D-葡萄糖苷键,生成β-D-葡萄糖及相应配基[19],从而使纤维素降解,促进不溶性结合酚类物质及黄酮类化合物从原料中释放[20],从而提高植物黄酮类化合物的提取得率。基于此,本研究以福建省平和县琯溪蜜柚疏果为原料,采用β-葡萄糖苷酶辅助乙醇浸提技术提取其总黄酮;通过单因素实验和响应面法优化黄酮酶解提取条件,并评价提取产物对酪氨酸酶的抑制作用,为琯溪蜜柚疏果中的黄酮类物质开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
琯溪蜜柚疏果 采于漳州平和县;β-葡萄糖苷酶(100 U/g) 上海源叶生物科技有限公司;酪氨酸酶(1250 U/mg) 美国Sigma公司;芦丁(浓度≥95.0%)、L-酪氨酸(BR) 国药集团化学试剂有限公司;其他试剂均为国产分析纯。
JP-500C高速粉碎机 永康市久品工贸有限公司;EL104分析天平、FE28-CN pH计 梅特勒-托利多有限公司;HH-4型数显恒温水浴锅 上海精宏实验设备有限公司;Epoch 2T酶标仪 美国伯腾仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;Pilot 10-15S真空冷冻干燥机 博医康仪器有限公司;TS200微孔板恒温振荡器 杭州瑞诚仪器有限公司。
1.2 实验方法
1.2.1 原材料预处理
选取直径为60~70 mm的琯溪蜜柚疏果,切粒,50 ℃恒温烘干至恒重后粉碎,过60目筛制成柚子粉备用。
1.2.2 单因素实验
参考王立升等[21]的研究方法,提取工艺流程为:称取1.00 g柚子粉于50 mL离心管,加入经0.2 mol/L磷酸盐缓冲液(pH5.0)溶解的β-葡萄糖苷酶溶液5 mL,在设定的酶解温度(℃)、酶解时间(h)下进行酶解;酶解后以料液比1:40 g/mL加入40 mL体积分数80%的乙醇,60 ℃水浴浸提20 min,经过滤取其滤液用80%的乙醇溶液定容至40 mL得总黄酮提取液。
1.2.2.1 β-葡萄糖苷酶酶活力对琯溪蜜柚疏果总黄酮提取量的影响
准确称取1.00 g柚子粉,固定酶解pH5.0、酶解温度45 ℃和酶解时间2 h,β-葡萄糖苷酶酶活力分别设为0.0025、0.0075、0.0125、0.0175、0.0225 U/mL等5个水平提取琯溪蜜柚疏果总黄酮,计算总黄酮提取量。
1.2.2.2 酶解pH对琯溪蜜柚疏果总黄酮提取量的影响
准确称取1.00 g柚子粉,固定β-葡萄糖苷酶酶活力为0.0125 U/mL、酶解温度45 ℃和酶解时间2 h,酶解pH分别3.0、4.0、5.0、6.0、7.0等5个水平提取琯溪蜜柚疏果总黄酮,计算总黄酮提取量。
1.2.2.3 酶解温度对琯溪蜜柚疏果总黄酮提取量的影响
准确称取1.00 g柚子粉,固定β-葡萄糖苷酶酶活力为0.0125 U/mL、酶解pH5.0和酶解时间2 h,酶解温度分别25、35、45、55、65 ℃等5个水平提取琯溪蜜柚疏果总黄酮,计算总黄酮提取量。
1.2.2.4 酶解时间对琯溪蜜柚疏果总黄酮提取量的影响
准确称取1.00 g柚子粉,固定β-葡萄糖苷酶酶活力为0.0125 U/mL、酶解pH5.0和酶解温度45 ℃,酶解时间分别2、3、4、5、6 h等5个水平提取琯溪蜜柚疏果总黄酮,计算总黄酮提取量。
1.2.3 响应面优化试验
基于单因素实验结果,采用Box-Behnken试验设计自变量为酶活力、酶解pH、酶解温度、酶解时间,响应值为琯溪蜜柚疏果总黄酮提取量的响应面试验。试验设计见表1。
表 1 Box-Behnken试验因素水平设计Table 1. Factors and level of Box-Behnken design因素 水平 −1 0 1 A酶活力(U/mL) 0.0075 0.0125 0.0175 B酶解pH 3 4 5 C酶解温度(℃) 35 45 55 D酶解时间(h) 4 5 6 1.2.4 总黄酮提取量测定
以芦丁为黄酮对照品按照NaNO2-Al(NO2)3-NaOH法[22]绘制标准曲线。测定样品溶液在510 nm波长处的吸光度,以吸光度(y)为纵坐标,芦丁对照标准溶液质量浓度(x)为横坐标,绘制标准曲线,得到回归方程为:y=0.0062x+0.042,R2=0.9996。在芦丁质量浓度0~180 μg/mL范围内,质量浓度与吸光度有良好的线性关系。
准确吸取1 mL适当稀释倍数的琯溪蜜柚疏果总黄酮提取液于10 mL容量瓶中,以不加样品溶液为空白,在波长510 nm处测得吸光度,并按式(1)计算琯溪蜜柚疏果中总黄酮提取量。
总黄酮提取量(mg/g)=C×V×NM×1000 (1) 式中,C:总黄酮质量浓度(μg/mL);V:定容体积(mL);N:稀释倍数;M:样品质量(g)。
1.2.5 琯溪蜜柚疏果总黄酮对酪氨酸酶抑制作用的研究
以响应面优化最佳工艺条件提取琯溪蜜柚疏果总黄酮,将黄酮提取液于45 ℃进行浓缩、冷冻干燥,得黄酮粉末(黄酮含量为32.80%),向其添加80%乙醇配制成黄酮粉末浓度为10、100、500、1000、1500、2000 μg/mL的样品,分析酪氨酸酶活性抑制率。参考文献[22]的方法,按表2顺序依次精密吸取a、b、c、d四组中的PBS缓冲液(pH6.8)、样品溶液、80%乙醇和酪氨酸酶(250 U/mL)于25 ℃恒温振荡10 min,加入40 μL浓度为0.85 mmol/L的L-酪氨酸溶液,继续25 ℃培养10 min,在492 nm波长下测定吸光值。平行3次实验取平均值,按公式(2)计算酪氨酸酶抑制率。
表 2 反应液组成Table 2. Compositions of reaction solution成分 PBS(μL) 样品(μL) 80%乙醇(μL) 酪氨酸酶(μL) L-酪氨酸(μL) a 40 40 − 40 40 b 80 40 − − 40 c 40 − 40 40 40 d 80 − 40 − 40 酪氨酸酶抑制率(%)=(1−a−bc−d)×100 (2) 式中,a为有样品、酪氨酸酶和L-酪氨酸的溶液体系测定的吸光值;b为有样品和L-酪氨酸的溶液体系测定的吸光值;c为有溶解样品的溶剂、酪氨酸酶和L-酪氨酸的溶液体系测定的吸光值;d为有溶解样品的溶剂和L-酪氨酸的溶液体系测定的吸光值。
1.3 数据处理
实验中所有样品均进行3次平行实验,通过Office Excel 2019软件进行平均值、标准偏差的计算,以及折线图的绘制。采用IBM SPSS Statistics 20软件对单因素实验结果进行显著性分析(P<0.05)。采用Design-Expert 8软件对响应面优化试验结果进行回归及分析。
2. 结果与分析
2.1 单因素结果
2.1.1 β-葡萄糖苷酶酶活力对琯溪蜜柚疏果总黄酮提取量的影响
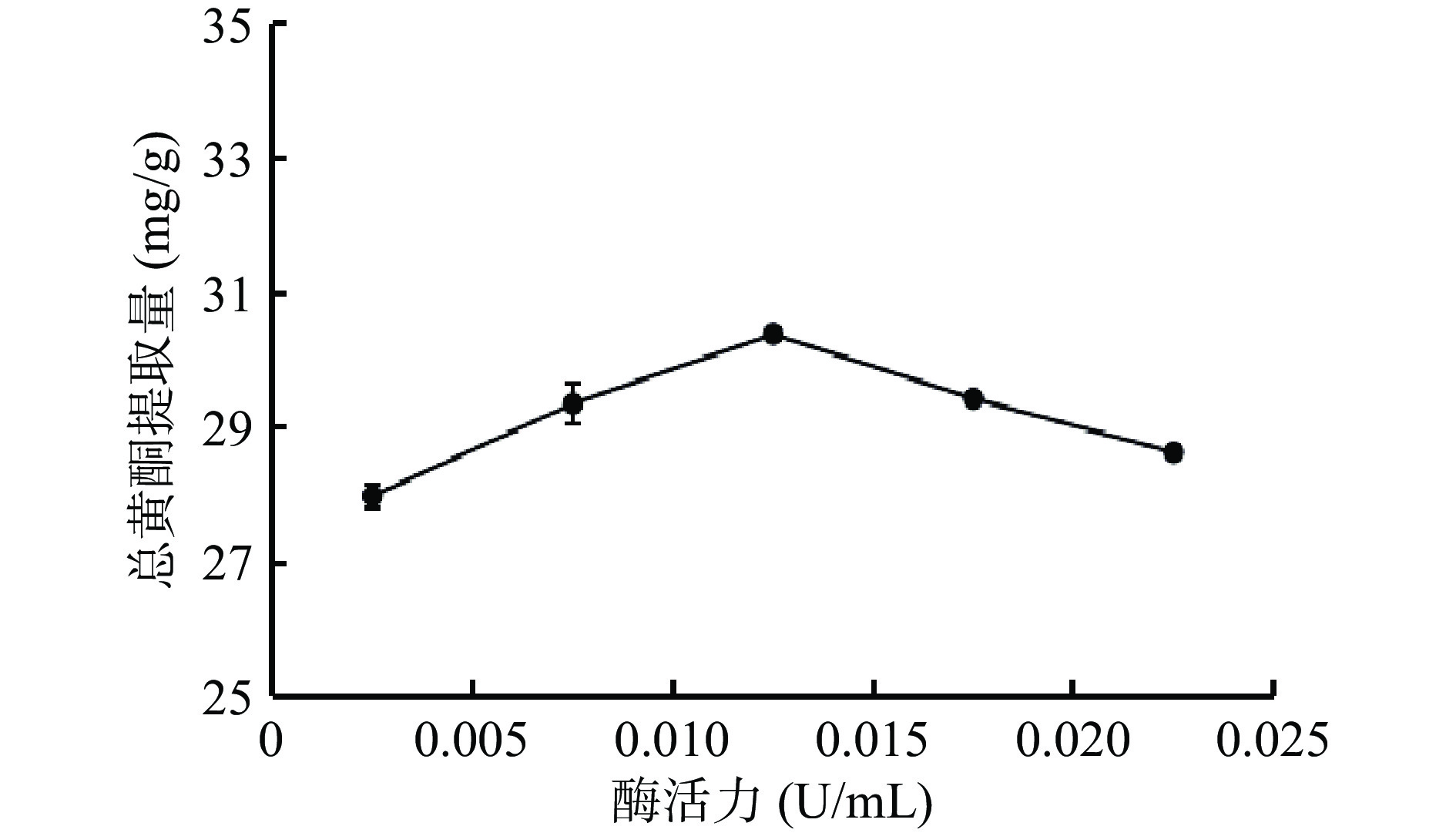
由图1可知,琯溪蜜柚疏果总黄酮提取量随着β-葡萄糖苷酶酶活力的增加呈现先增加后减少的趋势,当β-葡萄糖苷酶的酶活力达到0.0125 U/mL时,总黄酮提取量最大为30.39 mg/g;当β-葡萄糖苷酶的酶活力大于0.0125 U/mL时,总黄酮提取量呈现下降趋势。可能原因是β-葡萄糖苷酶属于纤维素酶类,是可水解结合于末端、非还原性的β-葡萄糖苷键,并释放相应的配基和葡萄糖的酶,降解纤维素等多糖类物质从而使细胞壁水解破裂增加细胞通透性[23],有利于黄酮类化合物的溶出,提高总黄酮提取量。当β-葡萄糖苷酶的酶活力超过0.0125 U/mL后,可能出现多酶竞争一个底物的现象,从而引起总黄酮提取量下降。因此,选择β-葡萄糖苷酶酶活力0.0075、0.0125、0.0175 U/mL作为后续响应面试验三水平。
2.1.2 β-葡萄糖苷酶酶解pH对琯溪蜜柚疏果总黄酮提取量的影响
由图2可知,酶解pH在3.0~7.0时,琯溪蜜柚疏果总黄酮提取量随着pH的增加先缓慢上升后急速下降,并且在pH5.0时酶解效率达到最大,此时总黄酮提取量为31.91 mg/g。王晓林等[24]的研究表明,当pH5.0时纤维素酶辅助提取刺玫果的总黄酮提取量最高。原因可能是pH通过影响酶的构象进而影响黄酮提取得量[25],当pH5.0时,酶处于最适pH区间里,β-葡萄糖苷酶的活力能够最大发挥,使之最大限度作用于细胞壁的纤维素β-1,4葡萄糖苷键,破坏细胞壁,减小传质阻力,加速黄酮类化合物的溶出效率[26]。因此,将酶解pH3.0、4.0、5.0作为后续响应面试验三水平。
2.1.3 β-葡萄糖苷酶酶解温度对琯溪蜜柚疏果黄酮提取量的影响
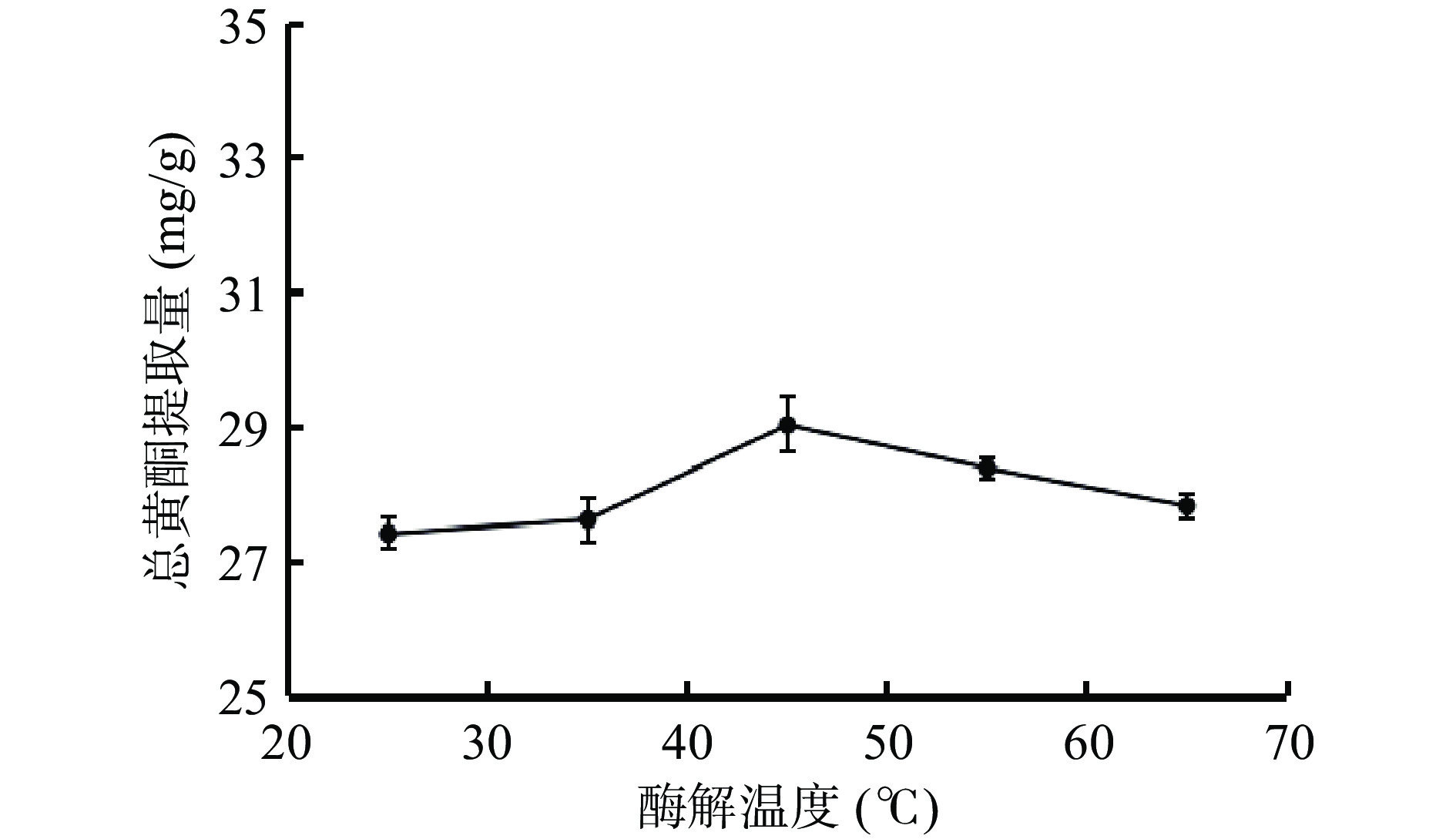
由图3可知,酶解温度在25~45 ℃时,琯溪蜜柚疏果总黄酮提取量随着温度的增加逐渐提高,并且在温度达到45 ℃时总黄酮提取量达到最大值,此时总黄酮提取量为29.05 mg/g;之后,随着酶解温度的升高,总黄酮提取量逐渐下降。欧阳辉等[27]的研究表明,纤维素酶提取椪柑皮中总黄酮,最佳酶解温度应在45 ℃左右。这可能是由于温度较低时,β-葡萄糖苷酶活性较弱,分子间热交换较慢,随着反应温度升高,酶活性增强,且分子热交换速率加快,黄酮加速溶出[28]。当温度过高时,酶分子结构被破坏而失活[29],导致总黄酮提取量的逐渐下降。因此,选择酶解温度35、45、55 ℃作为后续响应面试验三水平。
2.1.4 β-葡萄糖苷酶酶解时间对琯溪蜜柚疏果总黄酮提取量的影响
由图4可知,酶解时间为5 h时,琯溪蜜柚疏果总黄酮提取量达到最大值,此时总黄酮提取量为29.61 mg/g,之后呈下降趋势。这可能是在反应初期,酶解时间增加导致细胞壁降解程度增大,从而使总黄酮提取量随时间增加而增大。当酶解时间大于5 h后,总黄酮提取量显示一定程度的下降,可能是因为随着酶解时间的延长,黄酮可能全部溶出,其提取量不再增加,但部分黄酮类化合物可能发生降解[30]。此趋势与刘媛洁等[31]的研究结果相似,柚子皮中总黄酮得率随着酶解时间的延长,呈现先增加后缓慢减少的趋势。因此,将酶解时间4、5、6 h作为后续响应面试验三水平。
2.2 Box-Behnken响应面试验
2.2.1 响应面试验设计及结果
根据单因素实验结果,采用4因素3水平的响应面试验设计对β-葡萄糖苷酶酶活力(A)、酶解pH(B)、酶解温度(C)、酶解时间(D)进一步优化,采用每个因素设三个水平,以总黄酮提取量为响应值,试验设计的因素水平及编码如表1所示,响应面试验设计及试验结果如表3所示。
表 3 响应面试验设计及结果Table 3. Experimental design and results for response surface analysis试验号 A B C D 总黄酮提取量(mg/g) 1 −1 −1 0 0 27.44 2 1 −1 0 0 29.65 3 −1 1 0 0 32.78 4 1 1 0 0 30.37 5 0 0 −1 −1 32.05 6 0 0 1 −1 30.59 7 0 0 −1 1 32.00 8 0 0 1 1 29.70 9 −1 0 0 −1 30.38 10 1 0 0 −1 32.20 11 −1 0 0 1 27.63 12 1 0 0 1 29.50 13 0 −1 −1 0 32.28 14 0 1 −1 0 33.35 15 0 −1 1 0 30.76 16 0 1 1 0 29.76 17 −1 0 −1 0 31.99 18 1 0 −1 0 32.46 19 −1 0 1 0 31.66 20 1 0 1 0 30.79 21 0 −1 0 −1 30.90 22 0 1 0 −1 31.88 23 0 −1 0 1 28.74 24 0 1 0 1 29.02 25 0 0 0 0 32.27 26 0 0 0 0 33.67 27 0 0 0 0 33.50 28 0 0 0 0 33.63 29 0 0 0 0 33.45 2.2.2 响应面回归模型的建立与分析
根据表3的试验结果,以总黄酮提取量(Y)为响应值,对各因素进行多元二次回归分析,得到二次多元回归方程如下:Y=33.30+0.26A+0.62B−0.91C−0.95D−1.15AB−0.34AC+0.012AD−0.52BC−0.17BD−0.21CD−1.54A2−1.53B2−0.22C2−1.82D2(R2=0.8395)。
二次回归方程的F检验和失拟性检验如表4所示,总黄酮提取量的模型方程F=5.23,P=0.0019(P<0.01)说明该模型与实际数据相关性较好;失拟性检验F=3.66,P=0.1116(P>0.05)说明回归方程与实际情况拟合性好。方程的决定系数R2=0.8395>0.8,说明该模型与试验因素拟合良好。二次项中D2达到极显著性水平(P<0.001);一次项中C、D和二次项中A2、B2以及交互项因素AB具有高度显著或显著影响(P<0.01或P<0.05),其余项不显著(P>0.05)。根据该回归模型方差分析及F值,各因素对总黄酮提取量影响的大小依次为:酶解时间(D)>酶解温度(C)>酶解pH(B)>β-葡萄糖苷酶酶活力(A)。
表 4 响应面回归模型的方差分析Table 4. Analysis of variance for response surface regression model来源 平方和 自由度 均方 F值 P值 显著性 模型项 72.64 14 5.19 5.23 0.0019 ** A 0.80 1 0.80 0.80 0.3855 B 4.55 1 4.55 4.59 0.0502 C 9.85 1 9.85 9.93 0.0071 ** D 10.85 1 10.85 10.94 0.0052 ** AB 5.34 1 5.34 5.38 0.0360 * AC 0.45 1 0.45 0.45 0.5120 AD 6.250×10−4 1 6.250×10−4 6.303×10−4 0.9803 BC 1.07 1 1.07 1.08 0.3162 BD 0.12 1 0.12 0.12 0.7305 CD 0.18 1 0.18 0.18 0.6796 A2 15.40 1 15.40 15.53 0.0015 ** B2 15.20 1 15.20 15.33 0.0016 ** C2 0.32 1 0.32 0.33 0.5771 D2 21.56 1 21.56 21.75 0.0004 *** 残差 13.88 14 0.99 失拟项 12.51 10 1.25 3.66 0.1116 不显著 纯误差 1.37 4 0.34 总和 86.52 28 R2=0.8395,R2adj=0.6791 注:*P<0.05表示显著;**P<0.01表示高度显著;***P<0.001表示极显著。 2.2.3 响应面交互作用分析
为了更直观地反映各因素对琯溪蜜柚疏果总黄酮提取量的影响,以及最佳工艺参数和参数间的交互作用,采用响应面及其等高线图分析,响应面陡峭表明该因素对总黄酮提取量的影响较强,曲面平缓表明影响较弱;等高线的形状可反映出各因素间交互效应的强弱,趋于椭圆形表明两因素的交互作用显著,而圆形表明不显著[32],结果如图5所示。由图5可知,比较响应面的陡峭程度以及各个因素交互作用的等高线,各因素对总黄酮提取量影响大小顺序为:酶解时间(D)>酶解温度(C)>酶解pH(B)>β-葡萄糖苷酶酶活力(A),酶活力与酶解pH(AB)交互作用显著,其结论同表4方差分析结论一致。
2.2.4 提取工艺参数优化及模型验证
由回归方程优化得出最适提取工艺为:β-葡萄糖苷酶酶活力0.0128 U/mL、酶解pH4.36、酶解温度35 ℃、酶解时间4.78 h,在该条件下预测总黄酮提取量为34.29 mg/g。根据实际的操作条件,将最优条件参数进行修正为:β-葡萄糖苷酶酶活力0.0128 U/mL、酶解pH4.4、酶解温度35 ℃、酶解时间4.8 h。对优化后的提取工艺进行3次平行实验验证,结果显示总黄酮提取量为34.0±0.33 mg/g,与理论值较为接近,说明拟合程较好,因此模型能有效指导琯溪蜜柚疏果总黄酮提取的条件优化。为了对比该条件与传统乙醇提取法的提取效果,对该验证实验相同的原料采用传统乙醇法进行提取对照(料液比1:30 g/mL、70%乙醇溶液、35 ℃、100 W、30 min),得到的总黄酮提取量(27.37 mg/g)。该结果说明,本研究利用β-葡萄糖苷酶提取琯溪蜜柚疏果黄酮,其总黄酮提取量高于传统乙醇提取法(提高率为24.22%),该结果为柚类疏果黄酮的高效提取提供了新技术参考。
2.3 琯溪蜜柚疏果总黄酮对酪氨酸酶的抑制作用
不同浓度琯溪蜜柚疏果黄酮样品溶液对酪氨酸酶抑制率的影响如图6所示。经最优工艺优化提取总黄酮粗提物冻干粉的黄酮含量为32.80%,其不同浓度对酪氨酸酶呈现出明显的抑制作用,且抑制率随浓度的增加而增大。当提取物浓度为10 μg/mL和2 mg/mL时,经酶解的总黄酮提取物对酪氨酸酶抑制率为33.0%和88.9%。琯溪蜜柚疏果总黄酮提取物对酪氨酸酶的半抑制质量浓度(IC50)为312 μg/mL(0.31 mg/mL)左右,总黄酮粗提物中黄酮换算为纯黄酮对酪氨酸酶的半抑制质量浓度(IC50)为101 μg/mL(0.10 mg/mL)左右。有研究报道,蒲公英[33]、枇杷叶[34]黄酮提取物对酪氨酸酶的半抑制浓度(IC50)分别为2.5、0.43 mg/mL,相比较而言,琯溪蜜柚疏果总黄酮提取物的IC50较低,表明经β-葡萄糖苷酶酶解样品提取得到的总黄酮提取物对酪氨酸酶有较好的抑制作用,为蜜柚疏果黄酮的高值利用提供了参考。
3. 结论
本研究表明β-葡萄糖苷酶酶活力、酶解pH、酶解温度、酶解时间对琯溪蜜柚疏果黄酮提取具有显著影响。经过响应面试验优化提取工艺条件后,总黄酮提取量为34.0 mg/g;该黄酮提取物对酪氨酸酶具有显著的抑制作用,半抑制浓度(IC50)为0.31 mg/mL。本研究的总黄酮提取量及对酪氨酸酶抑制效果优于传统乙醇提取方法的结果,为琯溪蜜柚疏果黄酮的提取及在化妆品中的应用提供了参考。今后,还要对琯溪蜜柚疏果黄酮类物质的化学结构特征及生物活性开展进一步深入研究,为琯溪蜜柚疏果黄酮的高值开发利用提供参考依据。
-
表 1 Box-Behnken试验因素水平设计
Table 1 Factors and level of Box-Behnken design
因素 水平 −1 0 1 A酶活力(U/mL) 0.0075 0.0125 0.0175 B酶解pH 3 4 5 C酶解温度(℃) 35 45 55 D酶解时间(h) 4 5 6 表 2 反应液组成
Table 2 Compositions of reaction solution
成分 PBS(μL) 样品(μL) 80%乙醇(μL) 酪氨酸酶(μL) L-酪氨酸(μL) a 40 40 − 40 40 b 80 40 − − 40 c 40 − 40 40 40 d 80 − 40 − 40 表 3 响应面试验设计及结果
Table 3 Experimental design and results for response surface analysis
试验号 A B C D 总黄酮提取量(mg/g) 1 −1 −1 0 0 27.44 2 1 −1 0 0 29.65 3 −1 1 0 0 32.78 4 1 1 0 0 30.37 5 0 0 −1 −1 32.05 6 0 0 1 −1 30.59 7 0 0 −1 1 32.00 8 0 0 1 1 29.70 9 −1 0 0 −1 30.38 10 1 0 0 −1 32.20 11 −1 0 0 1 27.63 12 1 0 0 1 29.50 13 0 −1 −1 0 32.28 14 0 1 −1 0 33.35 15 0 −1 1 0 30.76 16 0 1 1 0 29.76 17 −1 0 −1 0 31.99 18 1 0 −1 0 32.46 19 −1 0 1 0 31.66 20 1 0 1 0 30.79 21 0 −1 0 −1 30.90 22 0 1 0 −1 31.88 23 0 −1 0 1 28.74 24 0 1 0 1 29.02 25 0 0 0 0 32.27 26 0 0 0 0 33.67 27 0 0 0 0 33.50 28 0 0 0 0 33.63 29 0 0 0 0 33.45 表 4 响应面回归模型的方差分析
Table 4 Analysis of variance for response surface regression model
来源 平方和 自由度 均方 F值 P值 显著性 模型项 72.64 14 5.19 5.23 0.0019 ** A 0.80 1 0.80 0.80 0.3855 B 4.55 1 4.55 4.59 0.0502 C 9.85 1 9.85 9.93 0.0071 ** D 10.85 1 10.85 10.94 0.0052 ** AB 5.34 1 5.34 5.38 0.0360 * AC 0.45 1 0.45 0.45 0.5120 AD 6.250×10−4 1 6.250×10−4 6.303×10−4 0.9803 BC 1.07 1 1.07 1.08 0.3162 BD 0.12 1 0.12 0.12 0.7305 CD 0.18 1 0.18 0.18 0.6796 A2 15.40 1 15.40 15.53 0.0015 ** B2 15.20 1 15.20 15.33 0.0016 ** C2 0.32 1 0.32 0.33 0.5771 D2 21.56 1 21.56 21.75 0.0004 *** 残差 13.88 14 0.99 失拟项 12.51 10 1.25 3.66 0.1116 不显著 纯误差 1.37 4 0.34 总和 86.52 28 R2=0.8395,R2adj=0.6791 注:*P<0.05表示显著;**P<0.01表示高度显著;***P<0.001表示极显著。 -
[1] 栗方亮, 孔庆波, 张青, 等. 琯溪蜜柚叶片氮素含量多种高光谱估算模型对比研究[J]. 果树学报,2022,39(5):882−891. [LI F L, KONG Q B, ZHANG Q, et al. Comparative study on several hyperspectral estimation models of nitrogen contents in Guanxi honey pomelo leaves[J]. Journal of Fruit Science,2022,39(5):882−891.] LI F L, KONG Q B, ZHANG Q, et al. Comparative study on several hyperspectral estimation models of nitrogen contents in Guanxi honey pomelo leaves[J]. Journal of Fruit Science, 2022, 39(5): 882−891.
[2] 胡阳, 晏幸, 伍菱, 等. 琯溪蜜柚幼果中柚皮苷含量变化规律[J]. 食品科学,2021,42(12):159−165. [HU Y, YAN X, WU L, et al. Variation of naringin content in young guanxi honey pomelo (Citrus grandis) fruit[J]. Food Science,2021,42(12):159−165.] doi: 10.7506/spkx1002-6630-20200423-307 HU Y, YAN X, WU L, et al. Variation of naringin content in young guanxi honey pomelo (Citrus grandis) fruit[J]. Food Science, 2021, 42(12): 159−165. doi: 10.7506/spkx1002-6630-20200423-307
[3] 王叶萍. 昌江黎族自治县三红蜜柚高产栽培技术[J]. 中国农技推广,2021,37(11):53−54. [WANG Y P. Cultivation techniques for high yield of Sanhong honey pomelo in Changjiang Li autonomous county[J]. China Agricultural Technology Extension,2021,37(11):53−54.] doi: 10.3969/j.issn.1002-381X.2021.11.020 WANG Y P. Cultivation techniques for high yield of Sanhong honey pomelo in Changjiang Li autonomous county[J]. China Agricultural Technology Extension, 2021, 37(11): 53−54. doi: 10.3969/j.issn.1002-381X.2021.11.020
[4] TOCMO R, PENA-FRONTERAS, J, CALUMBA K F, et al. Valorization of pomelo (Citrus grandis Osbeck) peel:A review of current utilization, phytochemistry, bioactivities, and mechanisms of action[J]. Comprehensive Reviews in Food Science and Food Safety,2020,19(4):1969−2012. doi: 10.1111/1541-4337.12561
[5] 赵雪巍, 刘培玉, 刘丹, 等. 黄酮类化合物的构效关系研究进展[J]. 中草药,2015,46(21):3264−3271. [ZHAO X W, LIU P Y, LIU D, et al. Research progress in structure-activity relationship of flavoniods[J]. Chinese Traditional and Herbal Drugs,2015,46(21):3264−3271.] ZHAO X W, LIU P Y, LIU D, et al. Research progress in structure-activity relationship of flavoniods[J]. Chinese Traditional and Herbal Drugs, 2015, 46(21): 3264−3271.
[6] OLIVEIRA A P, SILVA A L N, VIANA L G F C, et al. β-Cyclodextrin complex improves the bioavailability and antitumor potential of cirsiliol, a flavone isolated from Leonotis nepetifolia (Lamiaceae)[J]. Heliyon,2019,5(10):e01692. doi: 10.1016/j.heliyon.2019.e01692
[7] BONIFACE P K, ELIZABETH F I. Flavones as a privileged scaffold in drug discovery:Current developments[J]. Current Organic Synthesis,2019,16(7):968−1001. doi: 10.2174/1570179416666190719125730
[8] PANDURANGAN N, BOSE C, BANERJI A. Synthesis and antioxygenic activities of seabuckthorn flavone-3-ols and analogs[J]. Bioorganic & Medicinal Chemistry Letters,2011,21(18):5328−5330.
[9] ZOU L Q, WANG C X, KUANG X J, et al. Advance in flavonoids biosynthetic pathway and synthetic biology[J]. China Journal of Chinese Materia Medica,2016,41(22):4124−4128.
[10] FENOLL L G, PENALVER M J, RODRIGUEZ-LOPEZ J N, et al. Tyrosinase kinetics:Discrimination between two models to explain the oxidation mechanism of monophenol and diphenol substrates[J]. International Journal of Biochemistry & Cell Biology,2004,36(2):235−246.
[11] LIU G, HOU T, GUO S L, et al. Comprehensive utilization of immature honey pomelo fruit for the production of value-added compounds using novel continuous phase transition extraction technology[J]. Biology,2021,10(8):815. doi: 10.1016/j.foodchem.2005.12.042
[12] 李靓, 朱涵彬, 李长滨, 等. 橘皮中类黄酮化合物提取工艺研究进展[J]. 包装与食品机械,2021,39(4):58−62. [LI L, ZHU H B, LI C B, et al. Progress in research of extraction technology of flavonnoids from orange peel residue[J]. Packaging and Food Machinery,2021,39(4):58−62.] doi: 10.3969/j.issn.1005-1295.2021.04.010 LI L, ZHU H B, LI C B, et al. Progress in research of extraction technology of flavonnoids from orange peel residue[J]. Packaging and Food Machinery, 2021, 39(4): 58−62. doi: 10.3969/j.issn.1005-1295.2021.04.010
[13] 杜丽娟, 陈锦玉, 和丽忠, 等. 柚皮中黄酮物质的提取及测定[J]. 农产品加工(学刊),2011(8):76−78. [DU L J, CHEN J Y, HE L Z, et al. Extraction and determination of flavonoids in pummmelo peel[J]. Academic Periodical of Farm Products Processing,2011(8):76−78.] DU L J, CHEN J Y, HE L Z, et al. Extraction and determination of flavonoids in pummmelo peel[J]. Academic Periodical of Farm Products Processing, 2011(8): 76−78.
[14] 晏幸, 戴宇琪, 欧丽明, 等. 溪蜜柚柚皮黄酮提取工艺优化[J]. 食品工业科技,2020,41(17):135−140. [YAN X, DAI Y Q, OU L M, et al. Optimization of flavonoids extraction from Guanxi honey pomelo peel[J]. Science and Technology of Food Industry,2020,41(17):135−140.] YAN X, DAI Y Q, OU L M, et al. Optimization of flavonoids extraction from Guanxi honey pomelo peel[J]. Science and Technology of Food Industry, 2020, 41(17): 135−140.
[15] 黄波, 卢婉容, 熊周婷, 等. 微波辅助醇法提取柚皮中黄酮类化合物[J]. 科技视界,2015(33):11−12,8. [HUANG B, LU W R, XIONG Z T, et al. Research of extraction process of flavonoids from shaddock peel by microwave ethanol method[J]. Science & Technology Vision,2015(33):11−12,8.] doi: 10.3969/j.issn.2095-2457.2015.33.004 HUANG B, LU W R, XIONG Z T, et al. Research of extraction process of flavonoids from shaddock peel by microwave ethanol method[J]. Science & Technology Vision, 2015(33): 11−12,8. doi: 10.3969/j.issn.2095-2457.2015.33.004
[16] 王银霞, 王宏社. 酶在天然产物活性成分提取中的应用[J]. 广东化工, 2020, 47(11):141,169. [WANG Y X, WANG H S. Application of enzymatic extraction of active substances from natural products[J]. Guangdong Chemical Industry, 2020, 47(11):141,169.] WANG Y X, WANG H S. Application of enzymatic extraction of active substances from natural products[J]. Guangdong Chemical Industry, 2020, 47(11): 141,169.
[17] ZHANG R, WANG Y, SONG X, et al. Eco-friendly mechanobiological assisted extraction of phenolic acids and flavonoids from chrysanthemum[J]. Journal of Pharmaceutical and Biomedical Analysis,2020,186:113327. doi: 10.1016/j.jpba.2020.113327
[18] 魏凤玉, 王欣. 纤维素酶-乙醇协同提取黄芩总黄酮[J]. 天然产物研究与开发,2014,26(4):575−578. [WEI F Y, WANG X. Extraction of total flavonoids from scutellariaby cellulose assisted aqueous ethanol[J]. Natural Products Research and Development,2014,26(4):575−578.] WEI F Y, WANG X. Extraction of total flavonoids from scutellariaby cellulose assisted aqueous ethanol[J]. Natural Products Research and Development, 2014, 26(4): 575−578.
[19] 潘利华, 罗建平. β-葡萄糖苷酶的研究及应用进展[J]. 食品科学,2006(12):803−807. [PAN L H, LUO J P. Advance in research and application of β-D-glucosidase[J]. Food Science,2006(12):803−807.] doi: 10.3321/j.issn:1002-6630.2006.12.210 PAN L H, LUO J P. Advance in research and application of β-D-glucosidase[J]. Food Science, 2006(12): 803−807. doi: 10.3321/j.issn:1002-6630.2006.12.210
[20] 柯文林, 杨韧强. 复合酶辅助提取杜仲叶多酚及其应用[J]. 食品工业,2021,42(12):224−228. [KE W L, YANG R Q. Extraction of polyphenols from Eucommia ulmoides leaves by compound enzyme and its application[J]. The Food Industry,2021,42(12):224−228.] KE W L, YANG R Q. Extraction of polyphenols from Eucommia ulmoides leaves by compound enzyme and its application[J]. The Food Industry, 2021, 42(12): 224−228.
[21] 王立升, 周中杰, 梁鹏云, 等. 一种酶辅助微波提取枸杞中类黄酮方法:广西, CN201810432650.1[P]. 2018-08-14. [WANG L S, ZHOU Z J, LIANG P Y, et al. An enzyme-assisted microwave extraction method for flavonoids in Lycium barbarum:Guangxi, CN201810432650.1[P]. 2018-08-14.] WANG L S, ZHOU Z J, LIANG P Y, et al. An enzyme-assisted microwave extraction method for flavonoids in Lycium barbarum: Guangxi, CN201810432650.1[P]. 2018-08-14.
[22] 胡大强, 侯丽娜, 傅若秋, 等. 白芷提取分离物体外对酪氨酸酶的抑制作用[J]. 中国药师,2012,15(4):457−459. [HU D Q, HOU L N, FU R Q, et al. Inhibiton of extracts from angelica dahurica on tyrosinase in vitro[J]. China Pharmacist,2012,15(4):457−459.] doi: 10.3969/j.issn.1008-049X.2012.04.007 HU D Q, HOU L N, FU R Q, et al. Inhibiton of extracts from angelica dahurica on tyrosinase in vitro[J]. China Pharmacist, 2012, 15(4): 457−459. doi: 10.3969/j.issn.1008-049X.2012.04.007
[23] NADAR S S, RAO P, RATHOD V K, et al. Enzyme assisted extraction of biomolecules as an approach to novel extraction technology:A review[J]. Food Research International,2018,108:309−330. doi: 10.1016/j.foodres.2018.03.006
[24] 王晓林, 钟方丽, 薛健飞, 等. 酶法提取刺玫果总黄酮工艺研究[J]. 北方园艺,2015,331(4):136−139. [WANG X L, ZHONG F L, XUE J F, et al. Study on the extraction technology of total flavonoids in fruit of Rosa davurica Pall. with enzymes method[J]. Northern Horticulture,2015,331(4):136−139.] WANG X L, ZHONG F L, XUE J F, et al. Study on the extraction technology of total flavonoids in fruit of Rosa davurica Pall. with enzymes method[J]. Northern Horticulture, 2015, 331(4): 136−139.
[25] 吴梅林, 周春山, 陈龙胜, 等. 酶法提取银杏黄酮类化合物研究[J]. 天然产物研究与开发,2004(6):557−560. [WU M L, ZHOU C S, CHEN L S, et al. Study on the extraction of total flavonoids from ginkgo leaves by enzyme hydrolysis[J]. Natural Products Research and Development,2004(6):557−560.] doi: 10.3969/j.issn.1001-6880.2004.06.019 WU M L, ZHOU C S, CHEN L S, et al. Study on the extraction of total flavonoids from ginkgo leaves by enzyme hydrolysis[J]. Natural Products Research and Development, 2004(6): 557−560. doi: 10.3969/j.issn.1001-6880.2004.06.019
[26] 苏东林, 单杨, 李高阳, 等. 酶法辅助提取柑桔皮总黄酮的工艺优化研究[J]. 农业工程学报,2008(4):240−245. [SU D L, SHAN Y, LI G Y, et al. Technology optimization of extracting total flavonoids from citrus peel by enzyme-assisted technique[J]. Journal of Agricultural Engineering,2008(4):240−245.] doi: 10.3321/j.issn:1002-6819.2008.04.047 SU D L, SHAN Y, LI G Y, et al. Technology optimization of extracting total flavonoids from citrus peel by enzyme-assisted technique[J]. Journal of Agricultural Engineering, 2008(4): 240−245. doi: 10.3321/j.issn:1002-6819.2008.04.047
[27] 欧阳辉, 余佶, 张永康. 纤维素酶提取湘西椪柑皮中总黄酮的工艺优化研究[J]. 食品科学,2010,31(12):67−70. [OUYANG H, YU J, ZHANG Y K. Extraction of total flavonoids from the peel of ‘Ponkan’ mandarin (Citrus reticulata Blanco) by optimized cellulase hydrolysis[J]. Food Science,2010,31(12):67−70.] OUYANG H, YU J, ZHANG Y K. Extraction of total flavonoids from the peel of ‘Ponkan’ mandarin (Citrus reticulata Blanco) by optimized cellulase hydrolysis[J]. Food Science, 2010, 31(12): 67−70.
[28] 王家皓, 贲蕾洁, 符茜, 等. 南苜蓿叶总黄酮提取及抑菌抗氧化活性[J]. 江苏农业科学,2020,48(17):201−205,214. [WANG J H, BEN L J, FU X, et al. Extraction of total flavonoids from leaves of Medicago hispida and its antibacterial and antioxidant activities[J]. Jiangsu Agricultural Sciences,2020,48(17):201−205,214.] WANG J H, BEN L J, FU X, et al. Extraction of total flavonoids from leaves of Medicago hispida and its antibacterial and antioxidant activities[J]. Jiangsu Agricultural Sciences, 2020, 48(17): 201−205,214.
[29] 张杨洋, 朱肖月, 仁增措姆, 等. 超声辅助酶法提取银杏叶总黄酮的研究[J]. 中国食品添加剂,2020,31(3):70−75. [ZHANG Y Y, ZHU X Y, RENZIN T M, et al. Ultrasonic assisted enzymatic extraction of total flavonoids from Ginkgo biloba leaves[J]. China Food Additives,2020,31(3):70−75.] ZHANG Y Y, ZHU X Y, RENZIN T M, et al. Ultrasonic assisted enzymatic extraction of total flavonoids from Ginkgo biloba leaves[J]. China Food Additives, 2020, 31(3): 70−75.
[30] 陈红玲, 张兴桃, 周丹红, 等. 响应面法优化微波辅助提取枇杷叶中黄酮类化合物[J]. 基因组学与应用生物学,2019,38(7):3200−3207. [CHEN H L, ZHANG X T, ZHOU D H, et al. Optimization of microwave-assisted extraction of flavonoids from loquat leaves by response surface methodology[J]. Genomics and Applied Biology,2019,38(7):3200−3207.] CHEN H L, ZHANG X T, ZHOU D H, et al. Optimization of microwave-assisted extraction of flavonoids from loquat leaves by response surface methodology[J]. Genomics and Applied Biology, 2019, 38(7): 3200−3207.
[31] 刘媛洁, 张良. 响应面法优化复合酶辅助超声波提取柚子皮总黄酮工艺[J]. 食品工业科技,2019,40(23):143−150. [LIU Y J, ZHANG L. Optimization of enzymatic assisted ultrasonic extraction of total flavonoids from grapefruit peel by response surface methodology[J]. Science and Technology of Food Industry,2019,40(23):143−150.] LIU Y J, ZHANG L. Optimization of enzymatic assisted ultrasonic extraction of total flavonoids from grapefruit peel by response surface methodology[J]. Science and Technology of Food Industry, 2019, 40(23): 143−150.
[32] MURALIDHAR R V, CHIRUMAMILA R R, MARCHANT R, et al. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J]. Biochemical Engineering Journal,2001,9(1):17−23. doi: 10.1016/S1369-703X(01)00117-6
[33] 吴颖, 王佳其, 唐文, 等. 蒲公英黄酮对酪氨酸酶的抑制机理[J]. 食品工业,2021,42(6):283−287. [WU Y, WANG J Q, TANG W, et al. Inhibitory effect of tyrosinase on flavonoids from dandelion[J]. Food Industry,2021,42(6):283−287.] WU Y, WANG J Q, TANG W, et al. Inhibitory effect of tyrosinase on flavonoids from dandelion[J]. Food Industry, 2021, 42(6): 283−287.
[34] 傅贤明, 许丽兰, 郑瑶滨. 超声波提取莆田枇杷叶总黄酮及其对酪氨酸酶活性的影响[J]. 九江学院学报(自然科学版),2020,35(1):80−85. [FU X M, XU L L, ZHENG Y B. Ultrasonic extraction of total flavonoids from putian loquat leaves and its effect on tyrosinase activity[J]. Journal of Jiujiang University(Natural Science Edition),2020,35(1):80−85.] FU X M, XU L L, ZHENG Y B. Ultrasonic extraction of total flavonoids from putian loquat leaves and its effect on tyrosinase activity[J]. Journal of Jiujiang University(Natural Science Edition), 2020, 35(1): 80−85.
-
期刊类型引用(3)
1. 张文宽,王志华,孙世民,包敖民,贾朝爽,谭焕光. 不同厚度PE保鲜袋结合1-MCP缓释剂对塞外红苹果贮藏期品质的影响. 中国果树. 2025(03): 9-16 .  百度学术
百度学术
2. 郑太极,沈袁媛,王保忠,朱海亮,赵卫民,张莹,王忠长. 青梅蛹虫草发酵酒的品质分析及保健效果研究. 中国酿造. 2024(07): 177-183 .  百度学术
百度学术
3. 郑太极,王保忠,朱海亮,沈袁媛,张莹. 青梅和蛹虫草培养基复合发酵酒的制备工艺及其抗氧化效果. 酿酒. 2024(06): 46-51 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:




 下载:
下载:



