Isolation, Identification and Growth Characteristics of Spoilage Fungi from Stropharia rugosoannulata
-
摘要: 目的:为避免微生物生长引起的大球盖菇褐变和腐败,亟待开展大球盖菇腐败菌种类的相关研究,并为探究贮藏保鲜技术提供理论依据。方法:对大球盖菇的腐败菌进行分离、纯化,通过致腐性分析筛选出优势腐败菌并对其进行形态学鉴定、分子生物学鉴定及生长特性研究。结果:分离得到镰刀菌属16株、曲霉属14株,根霉属4株。通过致腐性分析筛选出四种致腐性强的腐败菌,经形态学和分子生物学手段鉴定其分别为假嗜花镰刀菌(Fusarium pseudoanthophilum)、黑曲霉(Aspergillus niger)、单孢根霉菌(Rhizopus azygosporus)和产紫蓝状菌(Talaromyces purpureogenus)。对四种腐败菌的生长特性进行分析,发现其最适生长温度为25~28 ℃。温度为4~10 ℃和35~55 ℃时腐败菌生长缓慢,60 ℃时腐败菌无法生长。其最适生长pH为7.0左右,pH为13.0时腐败菌无法生长。结论:大球盖菇采后贮藏在低温和适当的碱性环境可抑制腐败菌的生长繁殖,利于大球盖菇贮藏保鲜。Abstract: Objective: To avoid browning and spoilage caused by microbial growth, there is an urgent need to carry out researches related to the spoilage species of Stropharia rugosoannulata, and to provide a theoretical basis for exploring storage and preservation techniques. Methods: The spoilage fungi of S. rugosoannulata were isolated and purified, and the dominant spoilage fungi were selected by corrosivity analysis and identified by morphology and molecular biology methods. Results: The spoilage fungi from S. rugosoannulata were carried out to 16 strains of Fusarium, 14 strains of Aspergillus and 4 strains of Rhizopus among them. Four decay-causing fungi were selected to have a rot-causing effect, and identified by morphology and molecular biology as Fusarium pseudoanthophilum, Aspergillus niger, Rhizopus azygosporus and Talaromyces purpureogenus, respectively. The growth characteristics showed that the optimal temperature was 25~28 ℃. The spoilage fungi grew slowly with the temperature of 4~10 ℃ and 35~60 ℃, and the lethal temperature was 60 ℃. The optimal pH was about 7.0 and the spoilage fungi could not grow when the pH was 13.0. Conclusion: Post-harvest storage at low temperature and suitable alkaline environment could inhibit the growth and reproduction of spoilage fungi, which was conducive to the storage and preservation of S. rugosoannulata.
-
Keywords:
- Stropharia rugosoannulata /
- spoilage fungi /
- isolation /
- identification
-
大球盖菇(Stropharia rugosoannulata),又称皱环球盖菇和酒红大球盖菇,属于担子菌门,层菌纲,伞菌目,球盖菇科,球盖菇属[1−2],因其广泛的药用价值,被称为“山中珍品”[3]。大球盖菇作为我国食用菌产业的后起之秀,2010年在我国产量为4.74万吨,到2020年增长到了20.10万吨,2021年产量约28.75万吨[4]。
有研究表明,在杏鲍菇、平菇和香菇贮藏过程中均检测到酵母菌和霉菌,且平均计数分别为3.2和3.4 log CFU/g[5]。Santana等[6]发现香菇在储藏过程中的致腐微生物为霉菌、假单胞菌、嗜温菌及酵母。姜天甲[7]发现平菇和金针菇易受霉菌和酵母菌的侵染腐败而失去商品价值。朱晓玲[8]对二次培养后受霉菌污染的香菇菌块进行分离纯化,得到木霉属、短密青霉(Penicillium brevicompactum)和总状毛霉(Mucor racemosus)。冯智红[9]和崔丽红[10]在香菇和香菇菌棒上分离到不同种类的镰刀菌、曲霉和根霉。兰玉菲等[11]在罹病香菇菌棒中曾发现七种曲霉和米根霉(Rhizopus oryzae)。由此可见,不同种类的食用菌其优势腐败菌各不相同,霉菌占比较多。其中曲霉和根霉是食品发酵工业中常用的菌种,在腐败变质的食用菌中也经常发现该菌[12]。此外,镰刀菌也是一个庞大而复杂的属,可引起多种植物疾病,产生单端孢霉烯族毒素类等真菌毒素,并日益被认为是一种重要的人类病原体[13],易对人体健康造成危害。
目前国内外针对大球盖菇腐败菌的分离、鉴定研究较少。因此,为了解大球盖菇在贮藏时的优势腐败真菌,预防和控制大球盖菇在贮运过程中发生腐败问题,本文将储藏至腐败的新鲜大球盖菇用传统培养方法与ITS测序及分析方法对腐败菌进行分离、纯化和鉴定,筛选出优势腐败菌并研究其生长特性,以期为后续抑制腐败菌的生长繁殖及大球盖菇的贮藏保鲜提供一定的参考价值。
1. 材料与方法
1.1 材料与仪器
大球盖菇 湖北省武汉市蔡甸区蘑菇蜀黍食用菌基地和河南省洛阳市智慧食用菌产业园提供;马铃薯葡萄糖培养基(PDA)、马铃薯葡萄糖水培养(PDB) 青岛高科技工业园海博生物技术有限公司;Tris-酚 上海钰博生物科技有限公司;氯仿、75%酒精、异戊醇 分析纯,国药集团化学试剂有限公司。
DEM生物显微镜 上海莱卡显微系统有限公司;ABI 2720 PCR仪 上海普迪生物技术有限公司;HZQ-F160生化培养箱 太仓市华美生化仪器厂;GYMJ-436高压灭菌锅 上海东亚压力容器制造有限公司;SCI-VS漩涡混合器 宁波新芝生物科技股份有限公司;D1008E小型离心机 大龙兴创实验仪器(北京)股份公司;96孔核酸提取仪 武汉纳磁生物科技有限公司;NanoDrop 8000超微量分光光度计 赛默飞世尔科技公司;DYY-6C电泳仪 北京六一生物科技有限公司;GelDocTMXR+紫外分析仪 伯乐生命医学产品(上海)有限公司;3730xl测序仪 美国应用生物系统中国公司。
1.2 实验方法
1.2.1 大球盖菇腐败时间的确定
将两批产地不同(湖北武汉、河南洛阳)的新鲜大球盖菇同时放入消毒后的聚乙烯塑料保鲜盒中,于4 ℃条件下敞口保存,通过感官评价来确定大球盖菇的腐败时间点。感官评价小组针对大球盖菇的气味、色泽、菌盖和菌柄形态打分,并对腐败特征进行描述,最后计算平均分。当任一指标评分低于5分为感官接受临界点,低于5分表示该样品感官品质不可接受[14−15]。参考商立超[16]的方法,制定了感官指标评价标准表(表1)。
表 1 大球盖菇感官评定标准Table 1. Evaluation criteria for the sensual sense of S. rugosoannulata评分 色泽 开伞 表面黏度 异味 质地 8~10 洁白 无 无 无 丰满、有弹性 5~7 轻微褐变 轻微开伞 稍发黏 轻微异味 稍软、稍失弹性 2~4 明显褐变 明显开伞 发黏明显 明显异味 变软 1 褐变严重 严重开伞 发黏严重 严重异味 严重软烂 1.2.2 大球盖菇腐败菌的分离与纯化
参照牛耀星[17]的方法并略作修改。取大球盖菇腐败组织接种于PDA培养基上,放入26 ℃培养箱中培养3~5 d。挑取具有代表性的菌落边缘菌丝接种到新的PDA培养基上培养,重复2~3次以确保得到纯化菌株。
1.2.3 大球盖菇腐败菌的鉴定
1.2.3.1 致腐性分析
参照王莹[18]的方法并略作修改。按照柯赫准则进行返接试验以验证菌株的致腐能力。用直径为5 mm的打孔器取腐败菌菌丝块,分别在新鲜大球盖菇的菌柄和菌盖处接种,于26 ℃培养箱中培养,观察接种处的变化。每组处理设3个重复,另设不接种菌株的大球盖菇作为对照。在培养5 d后观察每组大球盖菇的腐败情况、腐败速度及腐败症状,并按照1.2.2的方法在子实体腐败处分离纯化腐败菌,与所接种菌株进行比较,判断接种菌株是否为大球盖菇的优势腐败菌。
1.2.3.2 形态学鉴定
将优势腐败菌接种于PDA平板上,于26 ℃下恒温培养,待长出菌落后对菌落形态、质地、正反颜色等性状进行观察。在倒置显微镜下观察菌丝、孢子梗、产孢结构、孢子的形态和大小,记录观察结果并拍照,根据《真菌鉴定手册》[19]对真菌进行形态学鉴定。
1.2.3.3 分子生物学鉴定
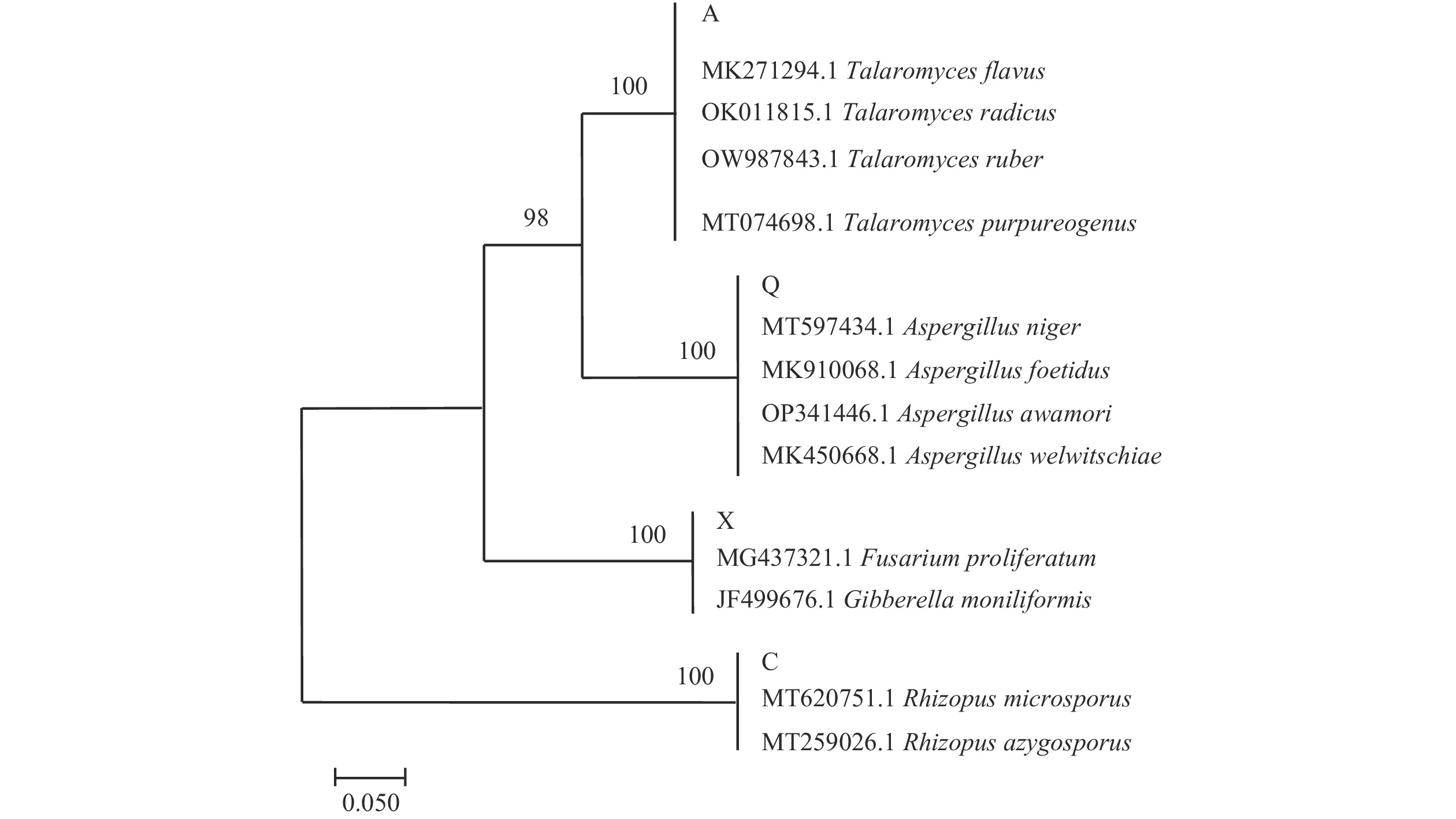
将纯化后的菌株送至武汉天一华煜基因科技有限公司,委托公司测序鉴定。主要操作步骤如下:a.DNA提取:采用CTAB方法提取菌丝DNA,电泳检测合格后于−20 ℃冰箱中保存待用。b.PCR扩增:分别使用真菌rDNA ITS的通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)、ITS4(5’-TCCTCCGCTTATTGATATGC-3’)对菌株进行PCR扩增。PCR反应体系及程序见表2。为确保PCR扩增的特异性,将扩增完成后的PCR产物进行琼脂糖凝胶电泳检测(1%浓度),通过带型来判断各样本扩增产物的特异性。c.DNA测序:将条带符合标准的PCR产物送Sanger测序。处理后的序列在NCBI数据库(https://www.ncbi.nlm.nih.gov.)中进行BLAST分析,比较其同源性。d.系统发育树的构建:将测得的ITS序列与GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank)中已有的ITS序列进行比对,将同源性>97%的物种名称、基因登录号和序列号保存。利用软件MEGA5中的邻接法(Neighbor-joining)构建系统发育树,通过自展法(Bootstrap)检验,重复次数为1000次。
表 2 PCR反应体系和循环条件Table 2. PCR reaction system and cycling conditions试剂名称 体积(μL) 步骤 时间 循环 2×Taq PCR Master Mix 15 95 ℃预变性 5 min 0 基因组DNA
(~20 ng)1 95 ℃变性 30 s 35 上游引物
(浓度10 pmol/μL)1 58 ℃退火 30 s 35 下游引物
(浓度10 pmol/μL)1 72 ℃延伸 45 s 35 dd H2O 12 72 ℃终延伸 5 min 0 总体积 30 16 ℃ 1 min 0 1.2.4 大球盖菇腐败菌的生长特性研究
1.2.4.1 腐败菌生长曲线的绘制
采用干重法[20−21]测定腐败菌的生长曲线。在无菌条件下制备优势腐败菌的孢子悬液,并将其浓度调为106 CFU/mL。取1 mL接种于200 mL PDB培养液中,在26 ℃、180 r/min恒温箱中培养,于4 ℃,10000 r/min下离心20 min,将沉淀放入105 ℃干燥箱中烘干至恒重,记录菌丝干重。每种腐败菌做3个平行,每隔12 h测一次,直至达到腐败菌的稳定期。
1.2.4.2 不同培养温度对菌丝生长的影响
参照石浩[22]的方法并略作修改。将直径为5 mm的菌饼接种于PDA培养基中,设置4、5、10、15、20、25、28、30、35 ℃不同温度,于不同温度下培养5 d,每个处理重复3次。采用十字交叉法测量菌落直径,记录菌丝密集度并计算菌丝生长速率。
1.2.4.3 不同pH对菌丝生长的影响
参照石浩[22]的方法并略作修改。分别将PDA培养基的pH调整为5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0。将直径为5 mm的菌饼分别接种于PDA培养基中,于26 ℃下培养5 d,每个处理重复3次。采用十字交叉法测量菌落直径,记录菌丝密集度并计算菌丝生长速率。
1.2.4.4 腐败菌致死温度的测定
参照丁仁惠等[23]的方法并略作修改。将直径为5 mm的菌饼置于装有5 mL无菌水的离心管中并分别放入50~65 ℃(温度梯度为5 ℃)的恒温水浴锅中处理30 min,迅速冷却后接种在PDA培养基中,以未经处理的菌丝块接种于PDA培养基中作为空白对照,于26 ℃下培养5 d,每个处理重复3次。采用十字交叉法测量菌落直径,记录菌丝密集度并计算菌丝生长速率和菌丝抑制率(MGI)。菌丝生长速率及MGI计算公式如下:
菌落直径(mm)=菌落总直径−菌饼直径 (1) 生长速率(mm/d)=菌落直径培养天数 (2) MGI(%)=对照菌落直径−处理菌落直径对照菌落直径×100 (3) 1.3 数据处理
所有试验均做3次平行,使用Microsoft excel 2019整理数据,Origin 2021软件作图,IBM SPSS Statistics 26进行方差分析,Duncan’s法进行显著性分析,P<0.05为显著性差异判别标准,实验数据用“平均值±标准差”表示。
2. 结果与分析
2.1 大球盖菇腐败时间的确定
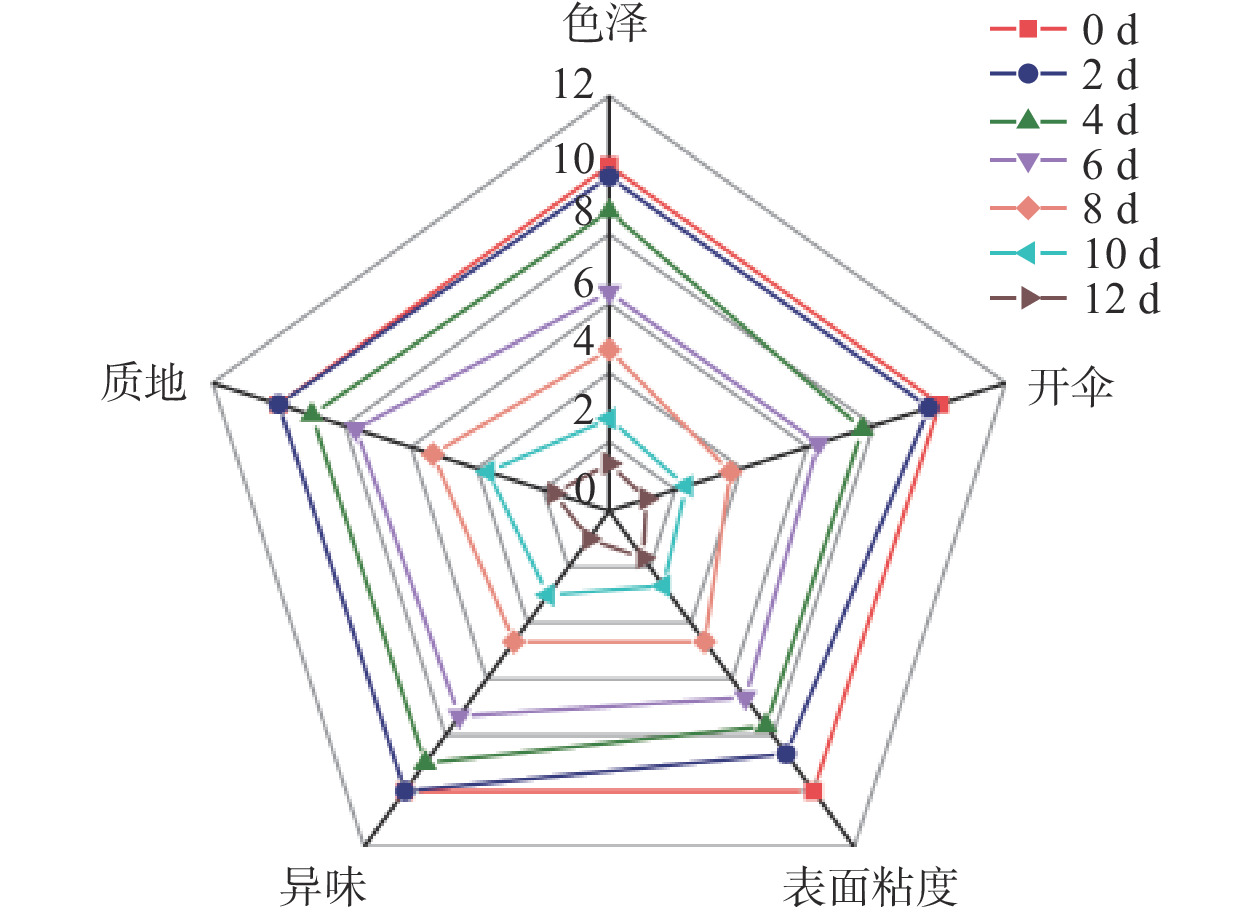
大球盖菇的感官评价如图1所示。贮藏于4 ℃的大球盖菇在第8 d时,除质地外,其他指标的感官评分均低于5,判断腐败时间为8 d。此时菌盖开伞明显,组织稍微软化,表面略微发黏并产生轻微异味。谭志勇等[24]报道称,贮藏于4 ℃冷库的鸡腿菇在第6 d时各项指标正常,8 d后菌盖开始软化、开裂,但无异味,12 d后菌盖顶部开始变黑并伴有明显异味。姜红波[25]研究发现茶树菇在5 ℃下贮藏8 d后便出现腐败现象。本研究结果与上述结果接近。
2.2 大球盖菇腐败菌的分离与鉴定
通过传统培养对两批产地不同(湖北武汉、河南洛阳)的大球盖菇进行腐败菌的分离,共得到75个菌株。其中镰刀菌属16株、曲霉属14株,根霉属4株。通过致腐性分析,取其中致腐性较强的菌株进行形态学鉴定和分子生物学鉴定。
2.2.1 致腐性分析结果
2.2.1.1 子实体回接
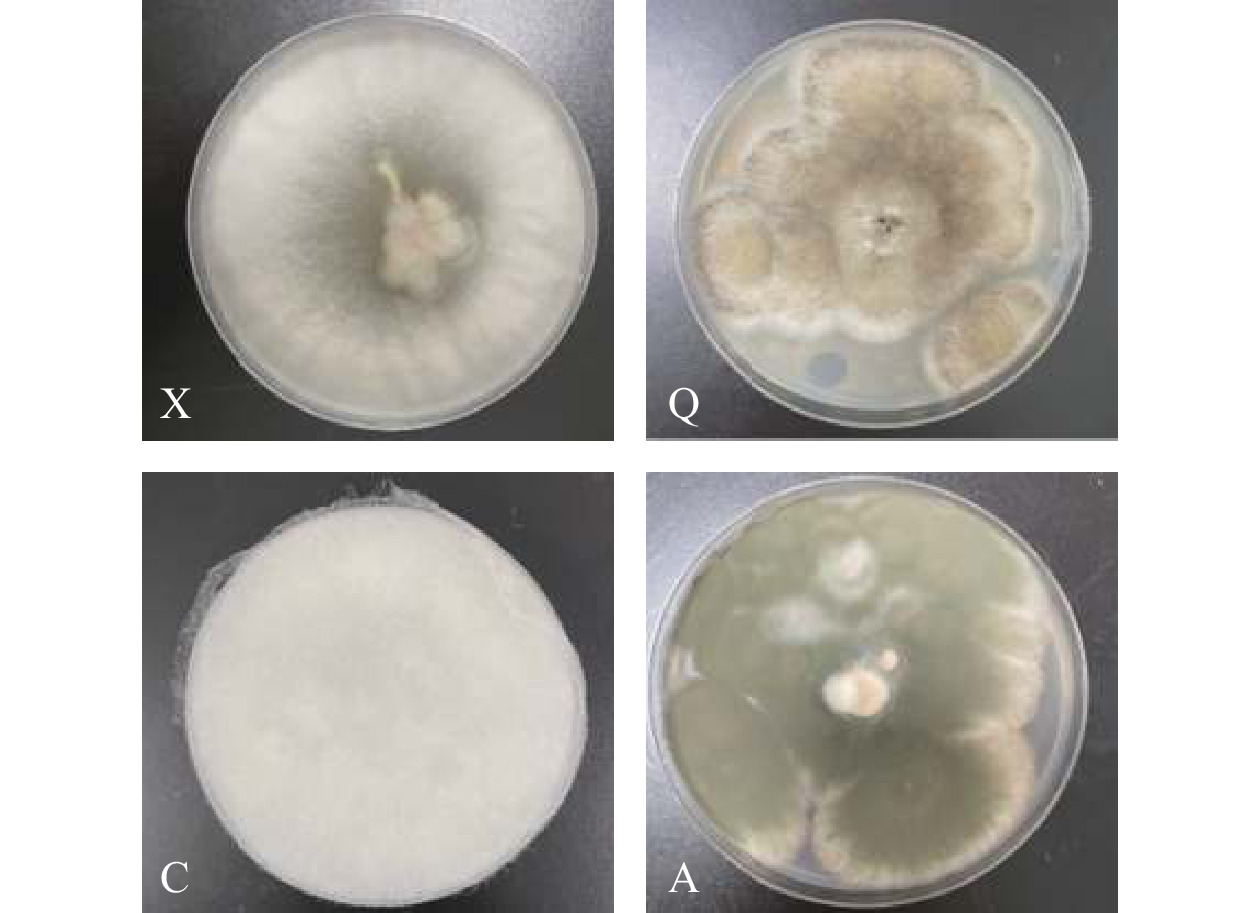
将得到的菌株回接至健康的大球盖菇子实体上,其对大球盖菇子实体的生长影响如图2所示。回接试验结果表明,其中四种菌株对大球盖菇具有较强的致腐性,分别命名为X、Q、C和A。健康的大球盖菇子实体接种X后,菌盖处会产生凹陷,菌柄和菌盖均产生白色腐烂病斑,并呈现水渍状,组织软烂;接种Q后,菌柄和菌盖严重黑化,5 d后子实体逐渐变黑,接种处出现明显凹陷且表面变得湿润,渗出黑色恶臭味汁液;接种C后,菌盖和菌柄表面均出现稠密的白色菌丝,5 d后菌丝开始蔓延至整个菌盖;接种A后,菌盖、菌柄处出现明显的腐败现象,菌盖收缩并产生腐败汁液,菌柄处产生淡黄色病斑。而对照组中的大球盖菇除了菌体表面颜色稍微加深外,并无其他症状,菇体质地保持不变,无异味和汁液渗出。
2.2.1.2 回接后腐败菌的分离与对比
回接前后腐败菌菌落形态对比如图3所示。结果证实上述四种腐败菌对大球盖菇子实体均有强烈致腐性。经过形态学鉴定,发现由回接致腐的子实体中分离、纯化得到的腐败菌(图3x、q、c、a)与回接前的腐败菌(图3X、Q、C、A)一致,确定上述四种腐败菌为大球盖菇的优势腐败菌。
2.2.2 形态学鉴定结果
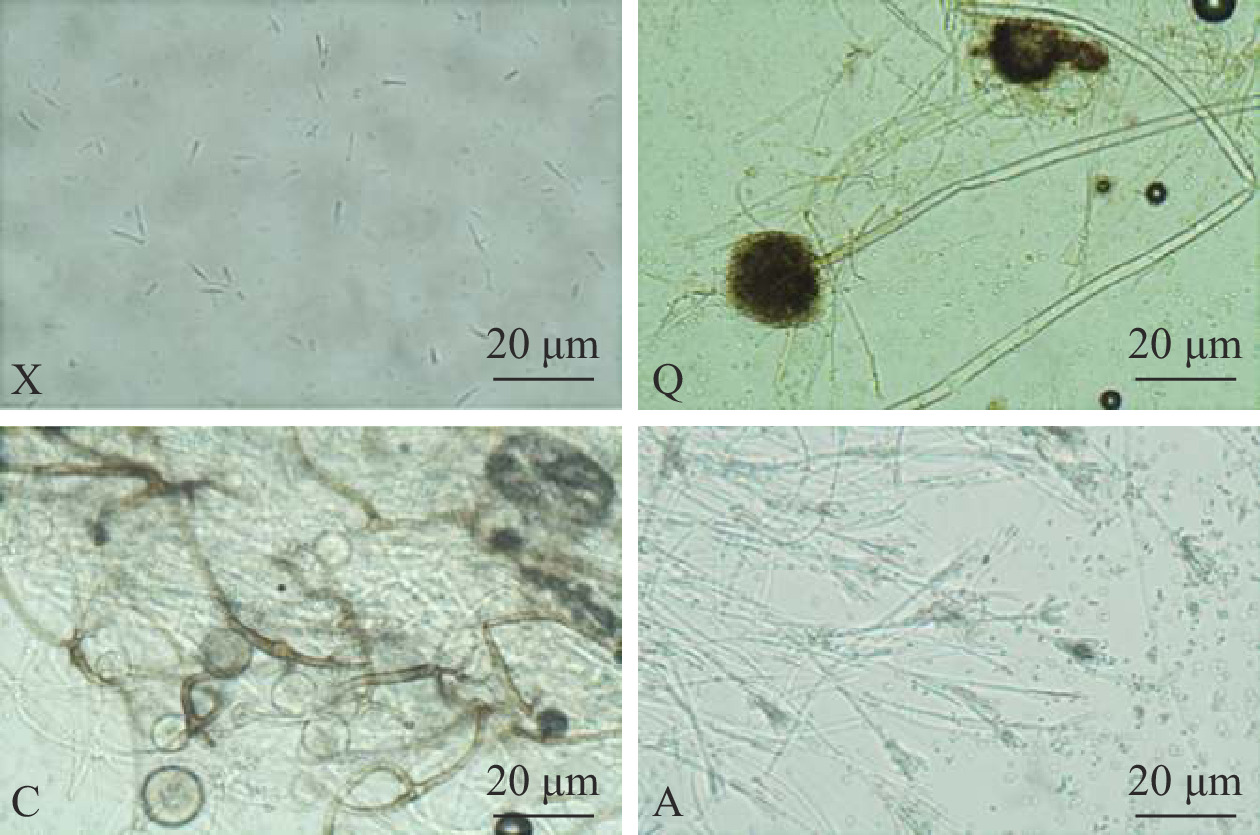
腐败菌的菌落形态图和显微镜观察图如图4和图5所示。菌株X在PDA培养基平板上培养5 d,菌落中央产生密集的白色棉絮状气生菌丝,呈放射状蔓延至整个平板。菌落背面呈淡黄色。菌株多产生小型的无色分生孢子,多为卵形、椭圆形的单细胞,偶见双胞;大型分生孢子多为3~5分隔,两端尖细弯曲,呈镰刀形、纺锤形等。初步推测菌株X属于半知菌亚门,丝孢纲,瘤座孢目,瘤座孢科,镰刀菌属。
菌株Q在PDA培养基平板上培养5 d,菌落生长迅速,出现青褐色菌丛,表面平滑或粗糙。菌落背面呈褐色。菌丝结构复杂,具有多个分枝,是一种具有隔膜的多核多细胞真菌。其厚实的足细胞形成的分生孢子梗顶端膨大,呈囊状。双层小梗从泡囊表面或顶部呈放射状生出,其顶端分布有串状或“菊花”状的青褐色分生孢子。初步推测菌株Q为半知菌亚门,丝孢纲,丝孢目,丛梗孢科,曲霉属。
菌株C在PDA培养基平板上培养5 d后,形成初为白灰色后为灰褐色的菌落。菌落可以快速覆盖平板表面,呈“棉花糖”状生长。菌落背面呈白色。菌丝体稠密,产生无色匍匐菌丝。假根分布错综复杂,较发达。孢囊梗略微弯曲,其顶端有时膨大为球形或椭圆形的泡囊,有时产生褐色分枝。孢子囊和胞囊孢子均呈球形或近球形,老后呈暗褐色。可见大量形状、大小不一的厚垣孢子,无接合孢子。初步推测为接合菌亚门,接合菌纲,毛霉目,毛霉科,根霉属。
菌株A在PDA培养基平板上培养5 d,菌落生长缓慢,一开始呈白色,慢慢变成绿色,且中间夹杂淡黄色菌丛。菌落背面呈橘黄色。菌落直径为2~4 cm,表面粗糙,边界呈圆弧状,中间凸起。菌丝有横隔,顶端产双轮或单轮扫帚状的分生孢子梗。菌株产生的分生孢子呈球形或卵形,直径为2.5~3.5 μm。初步推测为子囊菌亚门,不整囊菌纲,散囊菌目,散囊菌科,青霉属。
以上仅是根据形态学鉴定方法推测所得结果,无法准确判断该菌的种类,故需进一步进行分子生物学鉴定。
2.2.3 分子生物学鉴定结果
2.2.3.1 PCR扩增
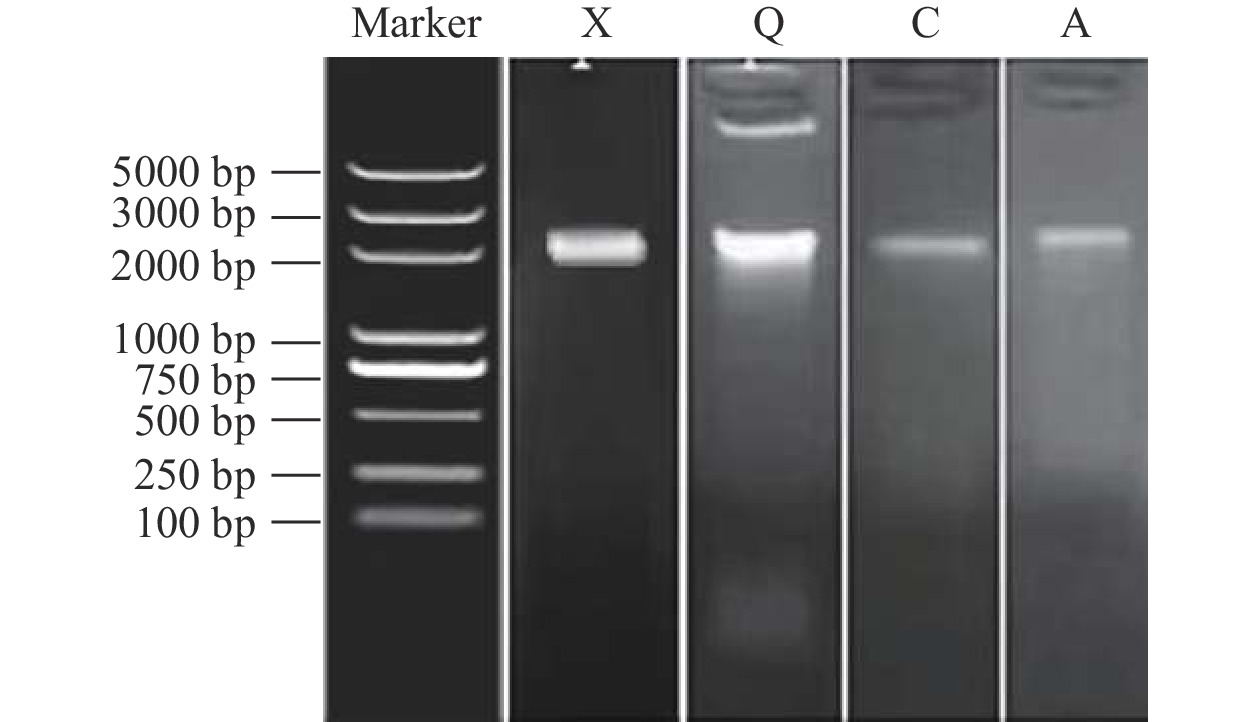
从四种纯化的腐败菌中提取DNA后,以真菌ITS通用引物进行PCR扩增,最终在2000 bp附近检测到单一且明亮的条带,达到PCR扩增预期结果。腐败菌ITS区的凝胶电泳结果如图6所示。
2.2.3.2 系统发育树的构建
将已进行PCR产物测序得到的腐败菌基因序列与NCBI数据库中的脱氧核糖核酸序列进行比对,选择与测序腐败菌基因序列相似度最高(>97%)的真菌,作为该菌株在分子生物学上的归类,并记录其基因登录号。四种腐败菌的比对结果如表3所示,通过邻接法构建系统发育树如图7所示。结果进一步表明,腐败菌株X与镰刀菌属(Fusarium sp.)的亲缘关系最近,Q与曲霉属(Aspergillus sp.)的亲缘关系最近,C与根霉属(Rhizopus sp.)的亲缘关系最近,腐败菌株A与蓝状菌属(Talaromyces sp.)的亲缘关系最近,结合其形态特征与ITS序列鉴定的结果,确定菌株X为假嗜花镰刀菌(Fusarium pseudoanthophilum),菌株Q为黑曲霉(Aspergillus niger),菌株C为单孢根霉菌(Rhizopus azygosporus),菌株A为产紫蓝状菌(Talaromyces purpureogenus)。
表 3 真菌鉴定结果Table 3. Identification results of fungus菌株编号 NCBI
序列号覆盖率(%) 同源性(%) 真菌种类 X MG437321.1 99 99.828 Fusarium pseudoanthophilum Q MT597434.1 100 99.83 Aspergillus niger C MT259026.1 95 100 Rhizopus azygosporus A MT074698.1 100 98.92 Talaromyces purpureogenus 2.3 大球盖菇腐败菌的生长特性研究
2.3.1 腐败菌的生长曲线
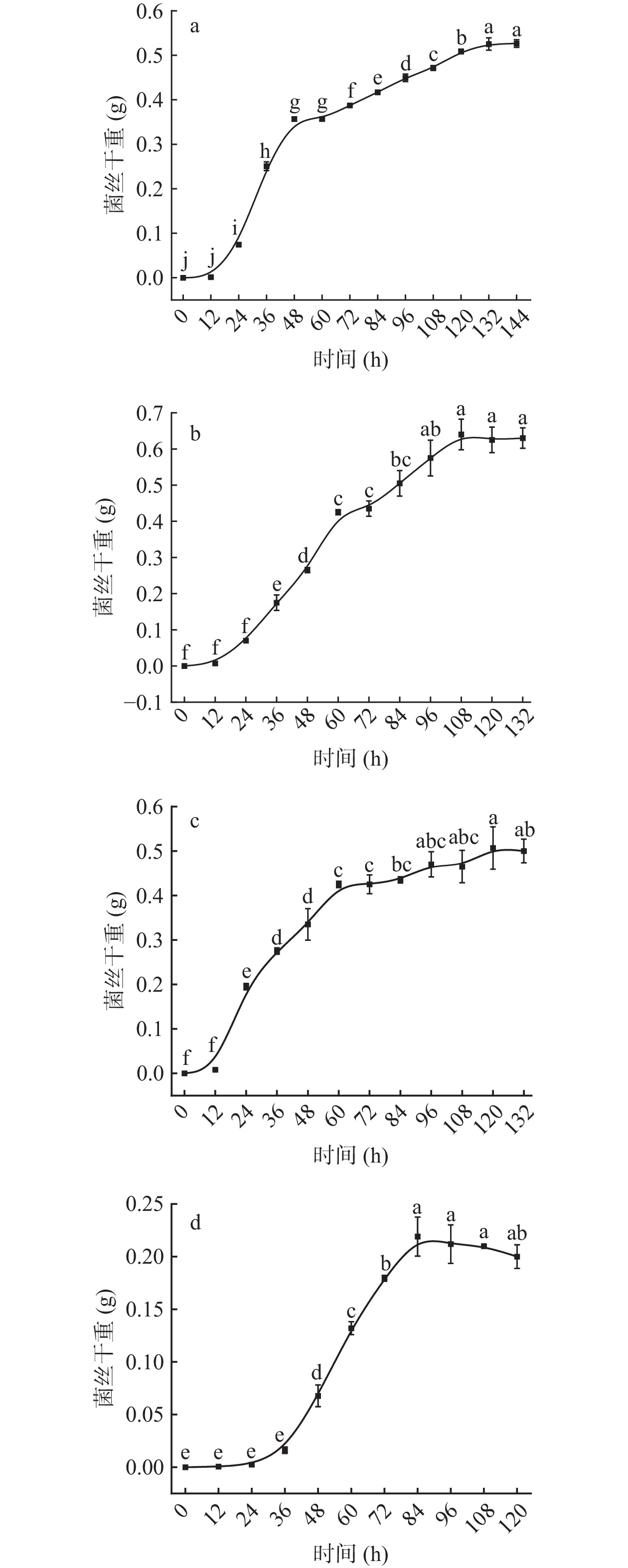
大球盖菇腐败菌的生长曲线如图8所示。其中X假嗜花镰刀菌、Q黑曲霉和C单孢根霉菌在0~12 h内菌丝干重并无显著差异(P>0.05),处于生长迟缓期;24~120 h的菌丝干重显著上升(P<0.05),为生长快速期;132 h后的菌丝干重无显著差异性(P>0.05),进入生长停滞期。这是因为随着菌体细胞的快速生长,培养基内营养物质被逐步消耗,菌体的生长速率与死亡速率达到动态平衡。而A产紫蓝状菌生长缓慢,在0~36 h内菌丝干重无显著性差异(P>0.05),处于生长迟缓期;36~84 h呈显著上升趋势,生长速率快,菌丝干重从0.02 g增至0.20 g,为生长快速期。随着时间增加,菌丝干重开始下降但无显著差异,菌体逐步进入生长停滞期。
2.3.2 腐败菌最适生长条件研究
2.3.2.1 不同培养温度对菌丝生长的影响
不同培养温度对大球盖菇腐败菌菌丝生长的影响如表4所示。当温度为4~10 ℃时,大球盖菇四种腐败菌生长缓慢,高于10 ℃后,腐败菌菌丝生长速率逐渐增加。当温度为28 ℃时,四种腐败菌的生长速率达到最大,分别为11.33 mm/d(X假嗜花镰刀菌),11.27 mm/d(Q黑曲霉),11.51 mm/d(C单孢根霉菌)和11.49 mm/d(A产紫蓝状菌)。继续增大培养温度,相较于28 ℃,四种腐败菌的生长速率在30 ℃时略微下降,在35 ℃时下降明显,分别下降60.48%(X假嗜花镰刀菌),13.89%(Q黑曲霉),16.05%(C单孢根霉菌)和13.74%(A产紫蓝状菌)。四种腐败菌的菌落直径由28 ℃时的最大直径(84.30、83.91、85.60和85.45 mm)降至54.44、70.44、73.71和73.71 mm,分别下降35.12%(X假嗜花镰刀菌),17.71%(Q黑曲霉),13.90%(C单孢根霉菌)和13.74%(A产紫蓝状菌)。表明在低温4~10 ℃和高于35 ℃下会抑制腐败菌的生长繁殖。
表 4 不同培养温度对大球盖菇腐败菌菌丝生长的影响Table 4. Effects of different temperatures on mycelial growth of S. rugosoannulata培养温度
(℃)X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度4 9.77±0.78f 0.68 — 6.02±0.71f 0.15 — 12.35±1.63f 1.05 — 7.02±0.69e 0.28 — 5 14.90±0.85ef 1.41 — 6.10±0.80f 0.16 — 13.45±1.34f 1.21 — 7.40±0.22e 0.34 — 10 16.88±0.60e 1.70 — 7.08±0.72f 0.30 — 14.70±2.12f 1.39 — 9.45±1.48e 0.64 — 15 29.40±4.38d 3.49 + 20.90±4.81e 2.27 + 53.80±1.84e 6.97 + 24.05±3.61d 2.72 — 20 64.78±3.75b 8.54 ++ 69.39±1.32d 9.20 ++ 69.40±1.27d 9.20 ++ 63.95±2.19c 8.42 + 25 79.41±4.38a 10.63 +++ 81.27±2.77ab 10.90 +++ 81.52±1.44b 10.93 +++ 79.01±2.14b 10.57 +++ 28 84.30±1.56a 11.33 ++++ 83.91±1.99a 11.27 ++++ 85.60±0.42a 11.51 ++++ 85.45±0.16a 11.49 +++ 30 82.80±3.54a 11.11 ++++ 74.71±1.65bc 9.96 +++ 84.10±2.26ab 11.30 ++++ 77.79±2.46ab 10.40 +++ 35 54.44±1.74c 7.06 ++ 70.44±3.01cd 9.35 ++ 73.71±2.37c 9.82 ++ 73.71±1.87b 9.82 ++ 注:++++表示菌丝非常浓密;+++表示菌丝浓密;++表示菌丝较为浓密;+表示菌丝稀疏,—表示几乎未长菌;不同小写字母表示组内存在显著差异(P<0.05),表5~表6同。 2.3.2.2 不同pH对菌丝生长的影响
不同pH对大球盖菇腐败菌菌丝生长的影响如表5所示。四种腐败菌菌丝在pH为5.0~12.0的培养基上均可生长,当pH增大到13.0时生长则会受到抑制。这是因为强碱环境下,真菌细胞膜及其电荷状态发生改变,抑制了真菌对营养物质的吸收[26]。X假嗜花镰刀菌在pH为7.0~8.0时生长最快,菌丝稠密,菌丝生长速率最高达到9.82 mm/d,菌落直径最大达到73.75 mm。蓝江林等[27]和秦涵淳等[28]的研究结果表明尖孢镰刀菌菌落生长的适宜pH范围很宽,在5.0~8.0范围内均可以生长,pH为7.0时最适。该结论与本研究结果相似。A产紫蓝状菌和Q黑曲霉分别在pH为6.0、7.0时生长最快,生长速率最高分别达到9.19和11.45 mm/d,菌落直径分别达到69.39和85.15 mm。C单孢根霉菌在pH为8.0~9.0时生长速度最快,生长速率最高达到11.48 mm/d,菌落直径最大达到85.33 mm。而当pH为13.0时,四种腐败菌几乎不生长。综上,大球盖菇腐败菌菌丝适合在中碱性环境尤其是pH为7.0左右时生长,而在强碱性环境下生长缓慢。
表 5 不同pH对大球盖菇腐败菌菌丝生长的影响Table 5. Effects of different pH on mycelial growth of S. rugosoannulatapH X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度5.0 52.00±0.71d 6.71 ++ 84.33±0.91ab 11.33 ++++ 83.39±1.32a 11.20 ++++ 67.50±2.83a 8.93 ++ 6.0 66.25±1.77abc 8.75 ++ 85.12±1.09a 11.45 ++++ 84.89±0.81a 11.41 ++++ 69.35±2.62a 9.19 +++ 7.0 73.75±1.77a 9.82 +++ 85.15±0.49a 11.45 ++++ 84.80±0.45a 11.40 ++++ 69.25±4.60a 9.18 +++ 8.0 70.45±6.43ab 9.35 ++ 80.89±1.01bc 10.84 +++ 85.01±0.64a 11.43 ++++ 64.90±2.90a 8.56 ++ 9.0 67.38±4.42abc 8.91 ++ 84.75±0.81a 11.39 ++++ 85.33±0.29a 11.48 ++++ 61.80±6.15ab 8.11 ++ 10.0 62.68±8.03bc 8.24 ++ 77.36±0.92c 10.34 ++ 82.65±0.66a 11.09 ++++ 63.08±2.09a 8.30 ++ 11.0 61.18±1.10cd 8.03 ++ 71.35±3.54d 9.48 +++ 80.23±1.73a 10.75 +++ 54.10±2.05b 7.01 ++ 12.0 60.30±3.54bcd 7.90 + 61.18±1.10e 8.03 ++ 48.70±9.62b 6.24 + 5.61±0.11c 0.09 -- 13.0 5.18±0.09e 0.03 — 5.29±0.21f 0.04 — 5.22±0.14c 0.03 — 5.09±0.05c 0.01 — 2.3.2.3 致死温度分析
该试验使腐败菌在较高温度下保持一定时间后探究不同腐败菌的致死温度。由于大部分真菌菌种的致死温度在50~100 ℃之间[21],因此本试验将起始温度设定为50 ℃,以5 ℃为一个温度梯度,共设置4个梯度。不同致死温度对腐败菌的生长影响如表6所示。当温度为60 ℃时,四种腐败菌均受到较大程度的抑制,其中C单孢根霉菌的菌丝抑制率达到了95.98%,菌落直径仅为6.65 mm。X假嗜花镰刀菌的菌丝抑制率达到了99.51%,菌落直径仅为接种菌饼的5 mm。在65 ℃水浴处理30 min后,四种菌均死亡。因此,可以确定大球盖菇优势腐败菌的致死温度为60~65 ℃。
表 6 大球盖菇腐败菌的致死温度Table 6. Lethal temperature of S. rugosoannulata致死温度
(℃)X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度50 11.57±4.45a 0.94 — 9.03±0.25a 0.58 — 46.80±1.34a 5.97 + 33.96±1.64a 4.14 + 55 6.61±1.32b 0.23 — 5.37±0.06b 0.05 — 32.19±2.92b 3.88 + 5.49±0.08b 0.07 — 60 5.00b 0 — 5.00b 0 — 6.65±0.19c 0.24 -- 5.17±0.07b 0.02 — 65 5.00b 0 — 5.00b 0 — 5.49±0.15c 0.07 -- 5.00b 0 — 3. 结论
本文对腐败大球盖菇采用传统培养方法分离、纯化腐败菌,通过形态学结合分子生物学手段确定腐败菌种类并对腐败菌的生长特性进行研究。发现腐败大球盖菇经分离纯化后共得到75个腐败菌株,其中镰刀菌属16株、曲霉属14株,根霉属4株。通过致腐性分析,得到四种致腐性强的腐败菌,经形态学和分子生物学鉴定其分别为假嗜花镰刀菌(Fusarium pseudoanthophilum),黑曲霉(Aspergillus niger),单孢根霉菌(Rhizopus azygosporus)和产紫蓝状菌(Talaromyces purpureogenus)。四种腐败菌的最适生长温度为25~28 ℃,在4~10 ℃和高于35 ℃下会抑制腐败菌的生长繁殖,在60~65 ℃时腐败菌无法生长。此外,腐败菌的最适生长pH为7.0左右,pH为13.0时腐败菌无法生长。因此为了避免腐败菌的生长繁殖导致大球盖菇的腐败变质,可将采后大球盖菇存放于低温和适当的碱性环境下贮藏,以期延长大球盖菇的货架期,并为进一步研究大球盖菇的贮藏保鲜技术提供了理论依据。
-
表 1 大球盖菇感官评定标准
Table 1 Evaluation criteria for the sensual sense of S. rugosoannulata
评分 色泽 开伞 表面黏度 异味 质地 8~10 洁白 无 无 无 丰满、有弹性 5~7 轻微褐变 轻微开伞 稍发黏 轻微异味 稍软、稍失弹性 2~4 明显褐变 明显开伞 发黏明显 明显异味 变软 1 褐变严重 严重开伞 发黏严重 严重异味 严重软烂 表 2 PCR反应体系和循环条件
Table 2 PCR reaction system and cycling conditions
试剂名称 体积(μL) 步骤 时间 循环 2×Taq PCR Master Mix 15 95 ℃预变性 5 min 0 基因组DNA
(~20 ng)1 95 ℃变性 30 s 35 上游引物
(浓度10 pmol/μL)1 58 ℃退火 30 s 35 下游引物
(浓度10 pmol/μL)1 72 ℃延伸 45 s 35 dd H2O 12 72 ℃终延伸 5 min 0 总体积 30 16 ℃ 1 min 0 表 3 真菌鉴定结果
Table 3 Identification results of fungus
菌株编号 NCBI
序列号覆盖率(%) 同源性(%) 真菌种类 X MG437321.1 99 99.828 Fusarium pseudoanthophilum Q MT597434.1 100 99.83 Aspergillus niger C MT259026.1 95 100 Rhizopus azygosporus A MT074698.1 100 98.92 Talaromyces purpureogenus 表 4 不同培养温度对大球盖菇腐败菌菌丝生长的影响
Table 4 Effects of different temperatures on mycelial growth of S. rugosoannulata
培养温度
(℃)X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度4 9.77±0.78f 0.68 — 6.02±0.71f 0.15 — 12.35±1.63f 1.05 — 7.02±0.69e 0.28 — 5 14.90±0.85ef 1.41 — 6.10±0.80f 0.16 — 13.45±1.34f 1.21 — 7.40±0.22e 0.34 — 10 16.88±0.60e 1.70 — 7.08±0.72f 0.30 — 14.70±2.12f 1.39 — 9.45±1.48e 0.64 — 15 29.40±4.38d 3.49 + 20.90±4.81e 2.27 + 53.80±1.84e 6.97 + 24.05±3.61d 2.72 — 20 64.78±3.75b 8.54 ++ 69.39±1.32d 9.20 ++ 69.40±1.27d 9.20 ++ 63.95±2.19c 8.42 + 25 79.41±4.38a 10.63 +++ 81.27±2.77ab 10.90 +++ 81.52±1.44b 10.93 +++ 79.01±2.14b 10.57 +++ 28 84.30±1.56a 11.33 ++++ 83.91±1.99a 11.27 ++++ 85.60±0.42a 11.51 ++++ 85.45±0.16a 11.49 +++ 30 82.80±3.54a 11.11 ++++ 74.71±1.65bc 9.96 +++ 84.10±2.26ab 11.30 ++++ 77.79±2.46ab 10.40 +++ 35 54.44±1.74c 7.06 ++ 70.44±3.01cd 9.35 ++ 73.71±2.37c 9.82 ++ 73.71±1.87b 9.82 ++ 注:++++表示菌丝非常浓密;+++表示菌丝浓密;++表示菌丝较为浓密;+表示菌丝稀疏,—表示几乎未长菌;不同小写字母表示组内存在显著差异(P<0.05),表5~表6同。 表 5 不同pH对大球盖菇腐败菌菌丝生长的影响
Table 5 Effects of different pH on mycelial growth of S. rugosoannulata
pH X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度5.0 52.00±0.71d 6.71 ++ 84.33±0.91ab 11.33 ++++ 83.39±1.32a 11.20 ++++ 67.50±2.83a 8.93 ++ 6.0 66.25±1.77abc 8.75 ++ 85.12±1.09a 11.45 ++++ 84.89±0.81a 11.41 ++++ 69.35±2.62a 9.19 +++ 7.0 73.75±1.77a 9.82 +++ 85.15±0.49a 11.45 ++++ 84.80±0.45a 11.40 ++++ 69.25±4.60a 9.18 +++ 8.0 70.45±6.43ab 9.35 ++ 80.89±1.01bc 10.84 +++ 85.01±0.64a 11.43 ++++ 64.90±2.90a 8.56 ++ 9.0 67.38±4.42abc 8.91 ++ 84.75±0.81a 11.39 ++++ 85.33±0.29a 11.48 ++++ 61.80±6.15ab 8.11 ++ 10.0 62.68±8.03bc 8.24 ++ 77.36±0.92c 10.34 ++ 82.65±0.66a 11.09 ++++ 63.08±2.09a 8.30 ++ 11.0 61.18±1.10cd 8.03 ++ 71.35±3.54d 9.48 +++ 80.23±1.73a 10.75 +++ 54.10±2.05b 7.01 ++ 12.0 60.30±3.54bcd 7.90 + 61.18±1.10e 8.03 ++ 48.70±9.62b 6.24 + 5.61±0.11c 0.09 -- 13.0 5.18±0.09e 0.03 — 5.29±0.21f 0.04 — 5.22±0.14c 0.03 — 5.09±0.05c 0.01 — 表 6 大球盖菇腐败菌的致死温度
Table 6 Lethal temperature of S. rugosoannulata
致死温度
(℃)X假嗜花镰刀菌 Q黑曲霉 C单孢根霉菌 A产紫蓝状菌 菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度菌落直径
(mm)生长速率
(mm/d)菌丝
密集度50 11.57±4.45a 0.94 — 9.03±0.25a 0.58 — 46.80±1.34a 5.97 + 33.96±1.64a 4.14 + 55 6.61±1.32b 0.23 — 5.37±0.06b 0.05 — 32.19±2.92b 3.88 + 5.49±0.08b 0.07 — 60 5.00b 0 — 5.00b 0 — 6.65±0.19c 0.24 -- 5.17±0.07b 0.02 — 65 5.00b 0 — 5.00b 0 — 5.49±0.15c 0.07 -- 5.00b 0 — -
[1] 黄年来. 大球盖菇的分类地位和特征特性[J]. 食用菌,1995(6):11. [HUANG N L. Taxonomic status and characteristic characteristics of Stropharia rugosoannulata[J]. Edible Fungi,1995(6):11.] HUANG N L. Taxonomic status and characteristic characteristics of Stropharia rugosoannulata[J]. Edible Fungi, 1995(6): 11.
[2] 刘二冬. 大球盖菇大棚生料高产栽培技术[J]. 食用菌,2019,41(4):55−56. [LIU E D. High-yield cultivation technology of raw meal in Stropharia rugosoannulata[J]. Edible Fungi,2019,41(4):55−56.] doi: 10.3969/j.issn.1000-8357.2019.04.021 LIU E D. High-yield cultivation technology of raw meal in Stropharia rugosoannulata[J]. Edible Fungi, 2019, 41(4): 55−56. doi: 10.3969/j.issn.1000-8357.2019.04.021
[3] 蒋琳. 大球盖菇多糖(SR-1)与草黄口蘑多糖(TLG-1)的制备、结构鉴定及生物活性研究[D]. 南充:西华师范大学, 2019. [JIANG L. The research on preparation, structural identification and biological activity of polysaccharide from Stropharia rugosoannulata (SR-1) and polysaccharide from Tricholoma lascivum (Fr. ) Gillet (TLG-1)[D]. Nanchong:China West Normal University, 2019.] JIANG L. The research on preparation, structural identification and biological activity of polysaccharide from Stropharia rugosoannulata (SR-1) and polysaccharide from Tricholoma lascivum (Fr. ) Gillet (TLG-1)[D]. Nanchong: China West Normal University, 2019.
[4] 骆庆, 郭涛, 孙召新, 等. 大球盖菇的生物学基础、活性成分及其应用[J]. 微生物学通报,2023,50(6):2709−2720. [LUO Q, GUO T, SUN Z X, et al. Biological basis and bioactive components of Stropharia rugosoannulata and its application[J]. Microbiology China,2023,50(6):2709−2720.] LUO Q, GUO T, SUN Z X, et al. Biological basis and bioactive components of Stropharia rugosoannulata and its application[J]. Microbiology China, 2023, 50(6): 2709−2720.
[5] SCHILL S, STESSL B, MEIER N, et al. Microbiological safety and sensory quality of cultivated mushrooms (Pleurotus eryngii, Pleurotus ostreatus and Lentinula edodes) at retail level and post-retail storage[J]. Foods,2021,10(4):816. doi: 10.3390/foods10040816
[6] SANTANA C C, VANETTI D C M, KASUYA M C M. Microbial growth and colour of minimally processed shiitake mushroom stored at different temperatures[J]. International Journal of Food Science Technology,2008,43(7):1281−1285.
[7] 姜天甲. 主要食用菌采后品质劣变机理及调控技术研究[D]. 杭州:浙江大学, 2010. [JIANG T J. Study on the mechanism and regulation of quality deterioration of main edible fungi after harvest[D]. Hangzhou:Zhejiang University, 2010.] JIANG T J. Study on the mechanism and regulation of quality deterioration of main edible fungi after harvest[D]. Hangzhou: Zhejiang University, 2010.
[8] 朱晓玲. 香菇二次培养中常见霉菌的分离鉴定及防控[D]. 南京:南京农业大学, 2015. [ZHU X L. Identification and prevention control of mold isolated from Lentinula edodes farm during secondary cultivation[D]. Nanjing:Nanjing Agricultural University, 2015.] ZHU X L. Identification and prevention control of mold isolated from Lentinula edodes farm during secondary cultivation[D]. Nanjing: Nanjing Agricultural University, 2015.
[9] 冯智红. 香菇中真菌毒素的筛查及发生规律研究[D]. 上海:上海海洋大学, 2014. [FENG Z H. Study of screening and occurrence of mycotoxins in Lentinus edodes[D]. Shanghai:Shanghai Ocean University, 2014.] FENG Z H. Study of screening and occurrence of mycotoxins in Lentinus edodes[D]. Shanghai: Shanghai Ocean University, 2014.
[10] 崔丽红. 食用菌栽培菌棒上污染真菌的分离鉴定及多样性分析[D]. 大连:辽宁师范大学, 2017. [CUI L H. Isolation, identification and diversity analysis of the contaminating fungi from the edible mushroom-growing synthetic wood logs[D]. Dalian:Liaoning Normal University, 2017.] CUI L H. Isolation, identification and diversity analysis of the contaminating fungi from the edible mushroom-growing synthetic wood logs[D]. Dalian: Liaoning Normal University, 2017.
[11] 兰玉菲, 蔚承祥, 王庆武, 等. 一种山东地栽香菇病害病原菌的分离及鉴定[J]. 中国食用菌,2015,34(6):74−76. [LAN Y F, YU C X, WANG Q W, et al. Isolation and molecular identification of a pathogen in Lentinula edodes[J]. Edible Fungi of China,2015,34(6):74−76.] LAN Y F, YU C X, WANG Q W, et al. Isolation and molecular identification of a pathogen in Lentinula edodes[J]. Edible Fungi of China, 2015, 34(6): 74−76.
[12] 韩小敏, 李凤琴. 黑曲霉群菌种多相分类和鉴定方法最新研究进展[J]. 食品与发酵工业,2020,46(23):279−285. [HAN X M, LI F Q. Advances on polyphasic classification and identification of Aspergillus niger isolates[J]. Food and Fermentation Industries,2020,46(23):279−285.] HAN X M, LI F Q. Advances on polyphasic classification and identification of Aspergillus niger isolates[J]. Food and Fermentation Industries, 2020, 46(23): 279−285.
[13] SUMMERELL B A, LAURENCE M H, LIEW E C Y, et al. Biogeography and phylogeography of Fusarium:A review[J]. Fungal Diversity,2010,44(1):3−13. doi: 10.1007/s13225-010-0060-2
[14] 张振. 壳聚糖-ε-聚赖氨酸-卡拉胶复合涂膜对冷藏中国对虾品质影响研究[D]. 沈阳:沈阳农业大学, 2020. [ZHANG Z. Effect of chitosan combined with ε-polylysine and carrageen coating on the quality of refrigerated Chinese shrimp (Fenneropenaeus chinensis)[D]. Shenyan:Shenyang Agricultural University, 2020.] ZHANG Z. Effect of chitosan combined with ε-polylysine and carrageen coating on the quality of refrigerated Chinese shrimp (Fenneropenaeus chinensis)[D]. Shenyan: Shenyang Agricultural University, 2020.
[15] 黄佳奇. 小黄鱼优势腐败菌的分离鉴定及其与品质的相关性研究[D]. 杭州:浙江大学, 2018. [HUANG J Q. Identification of specific spoilage organisms and their effects on the physiochemical properties of little yellow croaker[D]. Hangzhou:Zhejiang University, 2018.] HUANG J Q. Identification of specific spoilage organisms and their effects on the physiochemical properties of little yellow croaker[D]. Hangzhou: Zhejiang University, 2018.
[16] 商立超. 一种双孢菇复合生物保鲜剂的研制及保鲜效果研究[D]. 泰安:山东农业大学, 2023. [SHANG L C. Preparation of a compound biological preservative for agaricus bisporus and study on its preservative effect[D]. Taian:Shandong Agricultural University, 2023.] SHANG L C. Preparation of a compound biological preservative for agaricus bisporus and study on its preservative effect[D]. Taian: Shandong Agricultural University, 2023.
[17] 牛耀星. 不同温度下金针菇优势腐败细菌分析及其货架期预测模型的构建[D]. 兰州:甘肃农业大学, 2020. [NIU Y X. Analysis of dominant spoilage bacteria at different temperatures and construction of shelf life prediction model of Flammulina[D]. Lanzhou:Gansu Agricultural University, 2020.] NIU Y X. Analysis of dominant spoilage bacteria at different temperatures and construction of shelf life prediction model of Flammulina[D]. Lanzhou: Gansu Agricultural University, 2020.
[18] 王莹. 贵州香菇菌棒腐烂病病原真菌鉴定及发生规律初探[D]. 贵阳:贵州大学, 2021. [WANG Y. Identification of the pathogen of Lentinus edodes sticks rot and preliminary study on its occurrence in Guizhou[D]. Guiyang:Guizhou University, 2021.] WANG Y. Identification of the pathogen of Lentinus edodes sticks rot and preliminary study on its occurrence in Guizhou[D]. Guiyang: Guizhou University, 2021.
[19] 魏景超. 真菌鉴定手册[M]. 上海:上海科学技术出版社, 1979:58−602. [WEI J C. Fungal identification manual [M]. Shanghai:Shanghai Scientifc &Technical Puplishers, 1979:58−602.] WEI J C. Fungal identification manual [M]. Shanghai: Shanghai Scientifc &Technical Puplishers, 1979: 58−602.
[20] 柯媛. 多糖对辣条品质的影响及体外抑菌作用初探[D]. 武汉:武汉轻工大学, 2021. [KE Y. Effect of polysaccharides on the quality of spicy strip and the bacteriostatic effect in vitro[D]. Wuhan:Wuhan Polytechnic University, 2021.] KE Y. Effect of polysaccharides on the quality of spicy strip and the bacteriostatic effect in vitro[D]. Wuhan: Wuhan Polytechnic University, 2021.
[21] 郑旭蕊. 复合微生物菌剂的研制及其对尖孢镰刀菌防治效果研究[D]. 哈尔滨:哈尔滨工业大学, 2021. [ZHENG X R. Study on the preparation of compound microbial agent and its control effect on Fusarium oxysporum[D]. Harbin:Harbin Institute of Technology, 2021.] ZHENG X R. Study on the preparation of compound microbial agent and its control effect on Fusarium oxysporum[D]. Harbin: Harbin Institute of Technology, 2021.
[22] 石浩. 中药提取物对猕猴桃软腐病菌抑制分析及对果实防腐保鲜效果研究[D]. 长沙:湖南农业大学, 2020. [SHI H. Study on inhibition of Chinese medicine extracts on Actinidia soft rot pathogen and its effect on the preservation of fruits[D]. Changsha:Hunan Agricultural University, 2020.] SHI H. Study on inhibition of Chinese medicine extracts on Actinidia soft rot pathogen and its effect on the preservation of fruits[D]. Changsha: Hunan Agricultural University, 2020.
[23] 丁仁惠, 何小娥, 王文龙, 等. 柑橘采后主要病原菌的生物学特性研究[J]. 湖南农业科学,2018(12):76−81. [DING R H, HE X E, WANG W L, et al. Study on biological characteristics of main pathogens in postharvest citrus[J]. Hunan Agricultural Sciences,2018(12):76−81.] DING R H, HE X E, WANG W L, et al. Study on biological characteristics of main pathogens in postharvest citrus[J]. Hunan Agricultural Sciences, 2018(12): 76−81.
[24] 谭志勇, 何焕清, 邓海涛, 等. 不同温度和化学处理对食用菌贮藏保鲜效果的影响[J]. 广东农业科学,2005(6):73−74. [TAN Z Y, HE H J, DENG H T, et al. Effect of different temperatures and chemical treatments on the storage and preservation of edible mushrooms[J]. Guangdong Agricultural Sciences,2005(6):73−74.] doi: 10.3969/j.issn.1004-874X.2005.06.029 TAN Z Y, HE H J, DENG H T, et al. Effect of different temperatures and chemical treatments on the storage and preservation of edible mushrooms[J]. Guangdong Agricultural Sciences, 2005(6): 73−74. doi: 10.3969/j.issn.1004-874X.2005.06.029
[25] 姜红波. 茶树菇综合保鲜研究[D]. 福州:福建农林大学, 2007. [JIANG H B. The study on integrated freshness preservation of Agrocybe aegerita[D]. Fuzhou:Fujian Agriculture and Forestry University, 2007.] JIANG H B. The study on integrated freshness preservation of Agrocybe aegerita[D]. Fuzhou: Fujian Agriculture and Forestry University, 2007.
[26] 石浩, 王仁才, 王芳芳, 等. 基于响应面法对植物提取物协同抑菌活性的研究[J]. 保鲜与加工,2020,20(5):27−33. [SHI H, WANG R C, WANG F F, et al. Study on synergistic antimicrobial activity of plant extracts based on response surface methodology[J]. Storage and Process,2020,20(5):27−33.] doi: 10.3969/j.issn.1009-6221.2020.05.005 SHI H, WANG R C, WANG F F, et al. Study on synergistic antimicrobial activity of plant extracts based on response surface methodology[J]. Storage and Process, 2020, 20(5): 27−33. doi: 10.3969/j.issn.1009-6221.2020.05.005
[27] 蓝江林, 肖荣凤, 刘波, 等. pH胁迫下尖孢镰刀菌生长动力学模型[J]. 中国生态农业学,2012,20:1532−1538. [LAN J L, XIAO R F, LIU B, et al. Growth kinetic model of Fusarium oxysporum under different pH[J]. Chinese Journal of Eco-Agriculture,2012,20:1532−1538.] LAN J L, XIAO R F, LIU B, et al. Growth kinetic model of Fusarium oxysporum under different pH[J]. Chinese Journal of Eco-Agriculture, 2012, 20: 1532−1538.
[28] 秦涵淳, 杨腊英, 李松伟, 等. 培养基营养成分对香蕉枯萎病尖孢镰刀菌生长的影响[J]. 热带作物学报,2009,30(12):1852−1857. [QIN H C, YANG L Y, LI S W, et al. Effect of nutrients in medium on growth of Fusarium oxysporum f. sp. cubense causing fusarial wilt on banana[J]. Chinese Journal of Tropical Crop,2009,30(12):1852−1857.] doi: 10.3969/j.issn.1000-2561.2009.12.026 QIN H C, YANG L Y, LI S W, et al. Effect of nutrients in medium on growth of Fusarium oxysporum f. sp. cubense causing fusarial wilt on banana[J]. Chinese Journal of Tropical Crop, 2009, 30(12): 1852−1857. doi: 10.3969/j.issn.1000-2561.2009.12.026
-
期刊类型引用(1)
1. 杨敏,张密,叶贤胜,曾长立,马爱民,牛蒙亮,许丹云. 大球盖菇多肽的制备、抗氧化及抗肿瘤活性的研究. 山西农业大学学报(自然科学版). 2025(01): 123-132 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:


 下载:
下载:



