In Vitro Probiotic Properties of Human-derived Lactiplantibacillus plantarum in Yining, Xinjiang
-
摘要: 植物乳植杆菌(Lactiplantibacillus plantarum)在自然界中分布广泛,是目前开发利用最广泛的乳酸菌物种之一,大多数开发利用的植物乳植杆菌来源于发酵食品或植物基材料。本研究选用分离自新疆伊宁维吾尔族和哈萨克族健康儿童粪便样品中的植物乳植杆菌,经指纹图谱去除相同条带,挑选出20株代表菌株;指纹图谱聚类结果将菌株分为3个大类,相同民族和年龄段来源的菌株更倾向于聚集在同一小分支上;从基于groEL基因构建的系统发育树上发现相同民族来源的菌株更倾向于聚集在一起;同时对20株菌株的酸、胆盐耐受性、自聚集、疏水性(二甲苯)、抑菌能力、抗生素敏感性、碳糖利用能力进行了体外检测。结果显示,菌株YLW2L-108-29、YLW2L-61-7、YLW1L-44-7耐酸(pH2.5)能力较好,YLW1L-44-6耐胆盐(0.3%浓度)能力最优,菌株YLW2L-61-7、YLW2L-57-4、YLW2L-66-30自聚集和疏水性结果最优,所有菌株在低聚果糖、低聚半乳糖、低聚异麦芽糖、麦芽糊精、棉子糖、D-海藻糖、果胶、水苏糖和大豆低聚糖上生长良好,大部分菌株在菊粉和抗性淀粉上生长较差,在低聚木糖上生长最差。结合抑菌和抗生素耐药结果,筛选出菌株YLW2L-61-7作为潜在的益生菌菌株开展后续研究,为开发适应区域人群的优良益生菌菌株及产品奠定基础。Abstract: Lactiplantibacillus plantarum is widely distributed in nature and is one of the most widely developed and used lactic acid bacteria species at present. Most developed and used L. plantarum are derived from fermented food or plant-based materials. In this study, L. plantarum was isolated from fecal samples of healthy Uyghur and Kazakh children in Yining, Xinjiang, and 20 representative strains were selected by fingerprinting to remove the identical bands. The clustering results of fingerprinting classified the strains into three major groups, and strains of the same ethnicity and age group were more likely to be clustered in the same small branch. The phylogenetic tree based on groEL gene showed that strains of the same ethnic origin tended to cluster together. At the same time, the acid and bile salt tolerance, self-aggregation, hydrophobicity (xylene), bacteriostatic capacity, antibiotic sensitivity and carbohydrate utilization ability of 20 strains were tested in vitro. The results showed that strains YLW2L-108-29, YLW2L-61-7 and YLW1L-44-7 had better acid (pH2.5) resistance, and YLW1L-44-6 had the best bile salt tolerance (0.3% concentration). Strains YLW2L-61-7, YLW2L-57-4, YLW2L-66-30 had the best self-aggregation and hydrophobics results, and all strains grew well on fructooligosaccharide, galactooligosaccharide, isomaltooligosaccharide, maltodextrin, raffinose, D-(+)-trehalose dihydrate, pectin, stachyose tetrahydrate and soybean oligosaccharide. Most strains had poor growth on inulin and resistant starch, and worst growth on xylo-oligosaccharide. Combined with the results of bacterial inhibition and antibiotic resistance, strain YLW2L-61-7 was screened as a potential probiotic strain for subsequent studies, laying the foundation for the development of excellent probiotic strains and products suitable to regional populations.
-
Keywords:
- Lactiplantibacillus plantarum /
- probiotic properties /
- groEL gene /
- rep-PCR
-
植物乳植杆菌(Lactiplantibacillus plantarum)是革兰氏阳性细菌,是典型的“游牧”生活物种,被普遍认为是安全的物种[1],能够适应广泛的环境[2],存在于发酵食品、植物体表、动物胃肠道、土壤等环境中[3]。植物乳植杆菌的基因组较大,这就决定了其有很强的生态适应性和代谢上的灵活性,在某种程度上,植物乳植杆菌在自然界中能够广泛分布与它能够发酵多种糖有关[4]。此外,植物乳植杆菌普遍具有较强的抑菌能力,主要通过产生有机酸或细菌素来实现,其抑菌活性效果受到菌株来源和被抑制微生物类别的影响。在耐酸耐胆盐上也表现出了较强的耐受性。这些特征使其成为益生菌产品开发的一个重要选择。
在实际应用中,植物乳植杆菌是一种高度多样化和多用途的菌种。可用于各种食品和保健品,它们有特定的代谢和工艺特性,在发酵活动中发挥重要作用[5],在食品工业上既可作为自发发展的发酵微生物群落的一部分,也可作为纯发酵剂,用来改善产品风味[6],还可应用于食品保鲜,延长保质期,减少甚至取代化学添加剂[7]。植物乳植杆菌作为乳酸产率最高的乳酸菌之一,产酸使环境pH降低,一些导致食物腐败和食物中毒的微生物在低pH条件下生长会受到抑制(pH<4)[8],因此可作为天然防腐剂添加到许多发酵食品中。此外,其产生的细菌素被认为是一种天然、安全、有效的抗食源性病原体和腐败细菌的物质[9]。植物乳植杆菌还可通过保护肠道形态和通透性以及紧密连接蛋白的表达来改善肠道屏障的功能,从而预防腹泻[10],与其它益生菌联合使用可显著减轻肠易激综合症症状[11],可以显著改善急性膀胱炎[12]、预防结肠癌[13]、改善认知障碍[14]、促进皮肤伤口和烧伤感染的愈合[15]。
迄今为止,植物乳植杆菌作为人类胃肠道中潜在的促进健康微生物,是应用最多的菌种之一[16],从理论上讲,在适应人类宿主的肠道方面,从人类消化道分离出来的原生菌株比其它来源的菌株具有先天优势。此外,根据WHO的规定,只有从人类消化道中分离出来的微生物才被推荐作为益生菌使用。现在用于开发的植物乳植杆菌大多是从发酵食品或植物基材料中分离出来的。鉴于植物乳植杆菌在食品领域和作为生物治疗制剂的医药领域拥有巨大应用潜力,开发新的有潜力、适合于区域性人群的益生菌很有必要。因此,本研究收集了我国新疆伊宁维吾尔族和哈萨克族儿童的粪便样品,从中分离出了植物乳植杆菌,分析了菌株的遗传多样性与体外益生特性。为进一步研究植物乳植杆菌菌株与区域宿主人群的健康关系、开发本土化的益生菌奠定了前期基础。
1. 材料与方法
1.1 材料与仪器
18份维吾尔族和哈萨克族健康儿童粪便样品 采集自新疆维吾尔自治区伊宁县,提前联系志愿者,签订知情同意书。粪便采集前三个月内,儿童均未使用过抗生素,无益生菌摄入,无胃肠道疾病。采样时,取样人员配戴无菌手套,用取样勺采集粪便约5~10 g,粪便采集后立即放入已灭菌的取样管,贴标签后置于车载冰箱−10 ℃冷藏,快速运回实验室进行菌种分离;致病菌分别为Escherichia coli EPCC O127:K3 CICC(10411)、Escherichia coli EHEC O157:H7 CICC(21530)、Escherichia coli ETEC O8:K0 CICC(10421)、Salmonella enterica subsp. enterica serovar Typhimwium CICC(10420) 中国工业微生物菌种保藏管理中心;Listeria monocytogenes CGMCC 1.9136、Salmonella enterica subsp. enterica CGMCC 1.10754 中国普通微生物菌种保藏管理中心;改良MRS(de Man,Rogosa,Sharpe)培养基、营养肉汁培养基、蛋白胨酵母浸膏葡萄糖(Peptone yeast extract glucose,PYG)培养基、胰胨大豆琼脂(Trypcasein soy agar,TSA)培养基、苹果果胶(Pectin,70%) 北京博奥拓达科技有限公司;碳源:水苏糖(Stachyose tetrahydrate,85%)、低聚果糖(FOS)、低聚木糖(XOS,95%)、低聚半乳糖(GOS)、低聚异麦芽糖(IMO,90%)、大豆低聚糖(Soybean oligosaccharide)、D-棉子糖五水物(Raffinose)、麦芽糊精(Maltodextrin)、D-海藻糖无水(D-(+)-Trehalose dihydrate)、抗性淀粉(Resistant starch,70%) 上海源叶生物科技有限公司;菊粉(Inulin,70%) 上海易恩化学技术有限公司。
DG520厌氧培养箱 英国DS公司;TC-512 PCR仪 英国Techne公司;PoerPac Universal水平电泳仪、Gel DOC XR凝胶成像系统 美国Bio-Rad公司;GR60DA高压蒸汽灭菌锅 致微仪器有限公司;5810R高速冷冻离心机 德国Eppendorf公司。
1.2 实验方法
1.2.1 植物乳植杆菌的分离鉴定
将l g新鲜粪便用9 mL无菌生理盐水梯度稀释,选择合适梯度涂布于改良MRS固体培养基,37 ℃厌氧培养24 h,每个样品选取30个菌落,连续划线纯化直至镜检结果为纯杆。菌株DNA的提取依据苯酚-氯仿-玻璃珠击打的方法进行[17]。
提取好的DNA进行groEL基因扩增[18]:groEL-F 5’-GCYGGTGCWAACCCNGTTGG-3’;groEL 5’-RAANGTNCCVCGVATCTTGTT-3’,扩增体系:Premix Taq:12.5 μL,DNA模板:3 μL,引物(20 μmol/L):各0.5 μL,ddH2O:8.5 μL。扩增条件:预变性95 ℃ 10 min,变性95 ℃ 30 s,退火52 ℃ 40 s,延伸72 ℃ 40 s,终延伸72 ℃ 5 min,30个循环。经1.2%琼脂糖凝胶电泳后得到大约500 bp左右的清晰单一条带。扩增产物送至江苏金唯智生物有限公司进行测序,测序结果提交至GenBank数据库中进行序列同源性比对(BLAST),比对相似值大于99%初步确定菌种种属。
采用通用引物Eric:Eric1 5’-GGGGTACCTTGCGACTAACAAATATGCT-3’;Eric2 5’-TGCTCTAGACTTATTCCCTACCATCATG-3’对植物乳植杆菌DNA进行rep-PCR扩增分析,扩增体系:Premix Taq(2x):12.5 μL,DNA模板:3 μL,引物(20 μmol/L):各0.5 μL,ddH2O:8.5 μL。反应条件:预变性95 ℃ 5 min,变性95 ℃ 20 s,退火51.2 ℃ 30s,延伸72 ℃ 5 min 30 s,终延伸72 ℃ 10 min,35个循环。PCR产物进行1.2%的琼脂糖凝胶电泳,凝胶成像仪拍照并记录结果。根据指纹图谱结果,去除重复条带,挑选出代表菌株进行后续实验。
1.2.2 体外益生特性实验
1.2.2.1 耐酸能力测定
用盐酸将改良MRS培养基pH调至2.5[19],115 ℃高压蒸汽灭菌20 min,冷却备用。活化后的菌液按2%接种,37 ℃厌氧培养,分别于0、2、4 h取样,用无菌生理盐水稀释至合适梯度,涂布于固体改良MRS培养基,37 ℃厌氧培养24 h后计数。
受试菌株耐酸存活率(%)=AtA0×100 (1) 式中:At为2、4 h 测得的活菌数;A0为0 h测得的活菌数。
1.2.2.2 耐胆盐能力测定
在MRS培养基中加入牛胆盐,配制胆盐浓度3 g/L的MRS培养基[20]。将活化后的菌株按2%的接种量接种,37 ℃厌氧培养,于0、2、4 h取样,用灭菌的生理盐水稀释至合适梯度,涂布于固体MRS培养基,37 ℃厌氧培养24 h后计数。
受试菌株耐胆盐存活率(%)=AtA0×100 (2) 式中:At为2、4 h 测得的活菌数;A0为 0 h 测得的活菌数。
1.2.2.3 自聚集能力测定
活化后的菌株培养液8000 r/min,4 ℃离心10 min,用pH7.2的磷酸盐缓冲液(Phosphate buffered saline,PBS)清洗2次,重新悬浮于PBS中,调整菌悬液OD600为0.5,记为A0,取2 mL菌悬液涡旋振荡20 s,室温下静置2 h后在600 nm处测定吸光度值(取200 μL上清液测定),记为At[21]。重复进行3次独立实验,取平均值。
自聚集能力(%)=(1−AtA0)×100 (3) 1.2.2.4 表面疏水性测定
活化后的菌株培养液8000 r/min,4 ℃离心10 min,用pH7.2的PBS缓冲液清洗2次,重新悬浮于PBS中,调整菌悬液OD600为0.5,记为A0,取2 mL菌悬液加入2 mL二甲苯,涡旋振荡2 min,室温静置1 h。在600 nm处测定水相吸光度值(取200 μL测定),记为At[21]。重复进行3次独立实验,取平均值。
疏水性(%)=(1−AtA0)×100 (4) 1.2.2.5 抑菌能力测定
实验采用牛津杯法[22],以6种致病菌为指示菌,测定植物乳植杆菌代谢产物的抑菌性。活化后的菌株培养液8000 r/min离心10 min,收集上清液,用0.22 μm滤膜过滤除菌,制备无细胞上清液。将指示菌按照106 CFU/mL浓度涂布于相应的固体培养基,制备指示菌平板。用镊子将无菌牛津杯竖于涂布有致病菌液的平皿中,牛津杯中加入200 μL无细胞上清液,设置三个平行。将平皿置于4 ℃扩散4 h后,置于37 ℃培养箱中培养24 h,用游标卡尺测量抑菌圈直径。对应培养基:营养肉汁(菌株10420、10421、21530、10411);PYG培养基(菌株1.9136);TSA培养基(菌株1.10754)。
1.2.2.6 抗生素耐药实验
采用纸片扩散法(K-B法)[23],药敏片信息见表1,将活化后的菌液经合适梯度稀释后(菌液浓度约为107 CFU/mL),均匀地涂布于改良MRS平板上,用无菌镊子将药敏纸片放置其上,37 ℃培养24 h后,记录各药敏纸片的抑菌圈直径大小。重复进行3次独立实验,取平均值。按表2标准划分菌株对药物的敏感性。
表 1 药敏片信息Table 1. Information of drugs sensitive tablets缩写 中文名称 含量(μg/片) RD 利福平 5 TE 四环素 30 MH 米诺环素 30 CN 庆大霉素 10 P 青霉素 10 LEV 左氧氟沙星 5 St 链霉素 300 AMP 氨苄西林 10 CTX 头孢噻肟 30 OX 苯唑西林 1 C 氯霉素 30 FOX 头孢西丁 30 表 2 菌株对抗生素敏感性标准Table 2. Standard of antibiotic sensitivity of strains抗生素 抑菌圈直径(mm) R(耐药) I(中度敏感) S(敏感) 利福平 <17 17~29 >19 四环素 <15 15~18 >18 米诺环素 <13 13~15 >15 庆大霉素 <13 13~14 >14 青霉素 <20 20~22 >22 左氧氟沙星 <13 13~15 >22 链霉素 <12 12~14 >14 氨苄西林 <14 14~26 >16 头孢噻肟 <15 15~22 >22 苯唑西林 <11 11~12 >22 氯霉素 <13 13~17 >17 头孢西丁 <14 15~17 >18 1.2.2.7 碳源利用能力测定
配制不含葡萄糖的改良MRS基础培养基(mMRS),以20 g/L的不同碳源替换葡萄糖。将活化后的菌株8000 r/min,4 ℃离心5 min,弃上清液,用无菌生理盐水将菌体洗涤2次后,重悬于1 mL生理盐水中。以1%的接种量将菌悬液接种到含有不同碳源的改良MRS液体培养基中,以葡萄糖为阳性对照,不添加碳源为阴性对照,测定0 h的OD600吸光度值为OD1,37 ℃厌氧培养24 h,测定OD600吸光度值为OD2,最终OD600=OD1−OD2。实验重复三次取平均值。
1.3 数据处理
菌株指纹图谱使用GelCompar II v6.0软件进行聚类分析;采用MEGA v7.0软件基于groEL基因测序序列对菌株进行系统发育树的构建;耐酸、耐胆盐、自聚集、疏水性结果取平均值后用Origin 2023作条形图;碳源利用能力实验结果取平均值后用TB-tools作热图。
2. 结果与分析
2.1 植物乳植杆菌的遗传差异分析
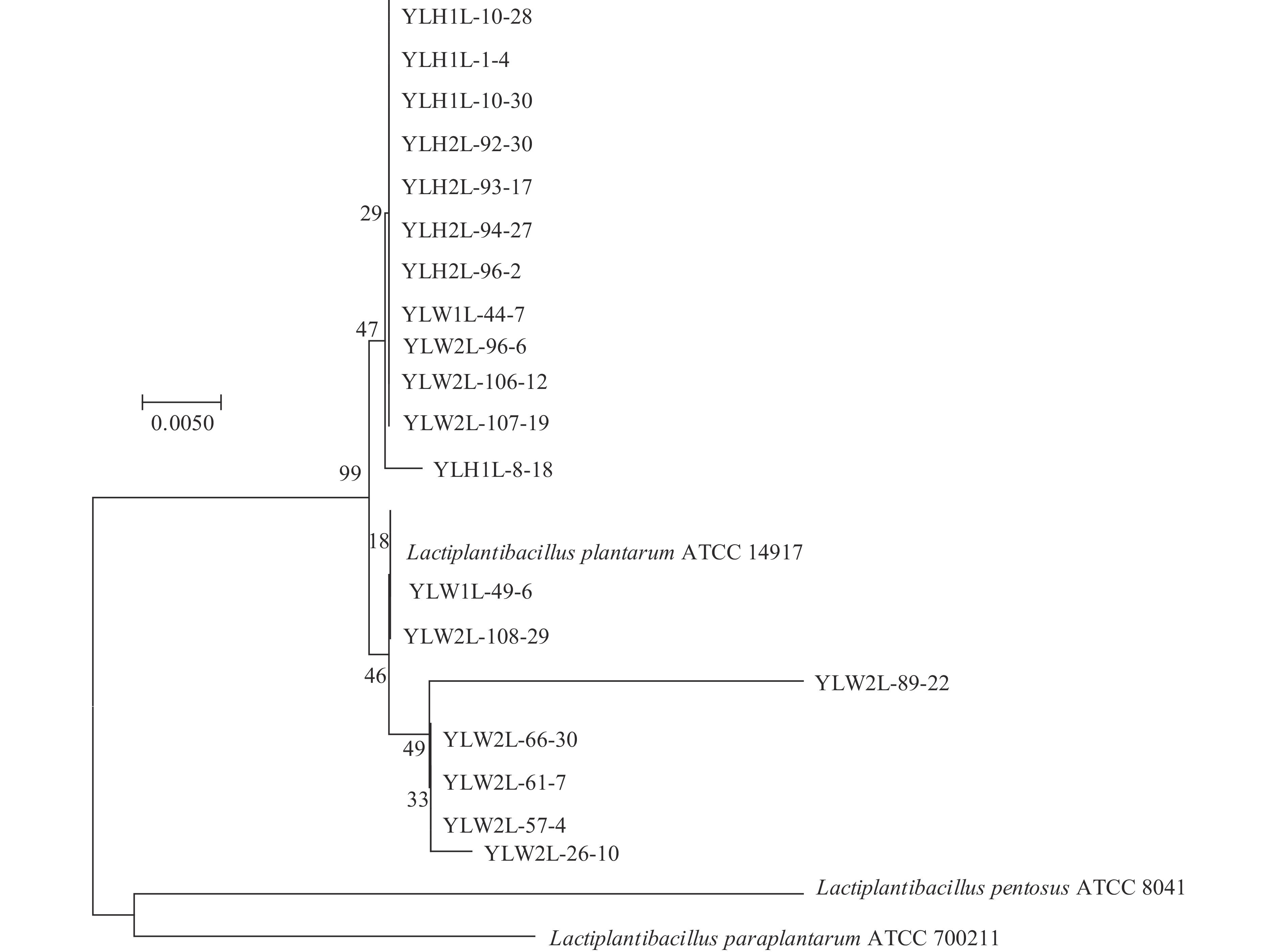
经groEL基因测序鉴定为植物乳植杆菌的菌株,经rep-PCR去重后得到20株代表菌株,代表菌株信息见表3。图1指纹图谱聚类结果显示将20株植物乳植杆菌划分为3个大类,A中分离自哈萨克族学龄儿童的菌株全部聚集在一起,分离自维吾尔族的菌株聚集在另一分支,B中全是分离自维吾尔族学龄儿童的菌株,C中则混杂着不同来源的菌株,但是同一个小的分支上都是来源相同的菌株。系统发育树如图2可看出,YLW2L-89-22、YLW2L-66-30、YLW2L-57-4、YLW2L-61-7和YLW2L-26-10聚集在同一进化分支,这一分支的菌株全都来自维吾尔族学龄儿童;YLW2L-108-29、YLW1L-49-6、YLW1L-49-3和标准菌株L. plantarum ATCC 14917聚集在同一进化分支上,这3株菌株都来自维吾尔族。剩下的8株来自哈萨克族和4株维吾尔族的菌株聚集在同一进化分支上。与植物乳植杆菌亲缘关系较近的Lactiplantibacillus pentosus和Lactiplantibacillus paraplantarum的模式菌株单独在另一分支。在同一分支上的菌株亲缘关系更近,从发育树上可看出相同民族来源的菌株更倾向于聚集在一起。
表 3 实验菌株信息Table 3. Information of experimental strains编号 民族来源 年龄段来源 YLW2L-61-7 维吾尔族 学龄 YLW2L-89-22 维吾尔族 学龄 YLW2L-107-19 维吾尔族 学龄 YLW2L-106-12 维吾尔族 学龄 YLW2L-108-29 维吾尔族 学龄 YLW2L-26-10 维吾尔族 学龄 YLW2L-66-30 维吾尔族 学龄 YLW2L-57-4 维吾尔族 学龄 YLW2L-96-6 维吾尔族 学龄 YLW1L-49-6 维吾尔族 学龄前 YLW1L-44-7 维吾尔族 学龄前 YLW1L-49-3 维吾尔族 学龄前 YLH2L-96-2 哈萨克族 学龄 YLH2L-94-27 哈萨克族 学龄 YLH2L-92-30 哈萨克族 学龄 YLH2L-93-17 哈萨克族 学龄 YLH1L-10-28 哈萨克族 学龄前 YLH1L-10-30 哈萨克族 学龄前 YLH1L-1-4 哈萨克族 学龄前 YLH1L-8-18 哈萨克族 学龄前 2.2 耐酸耐胆盐分析
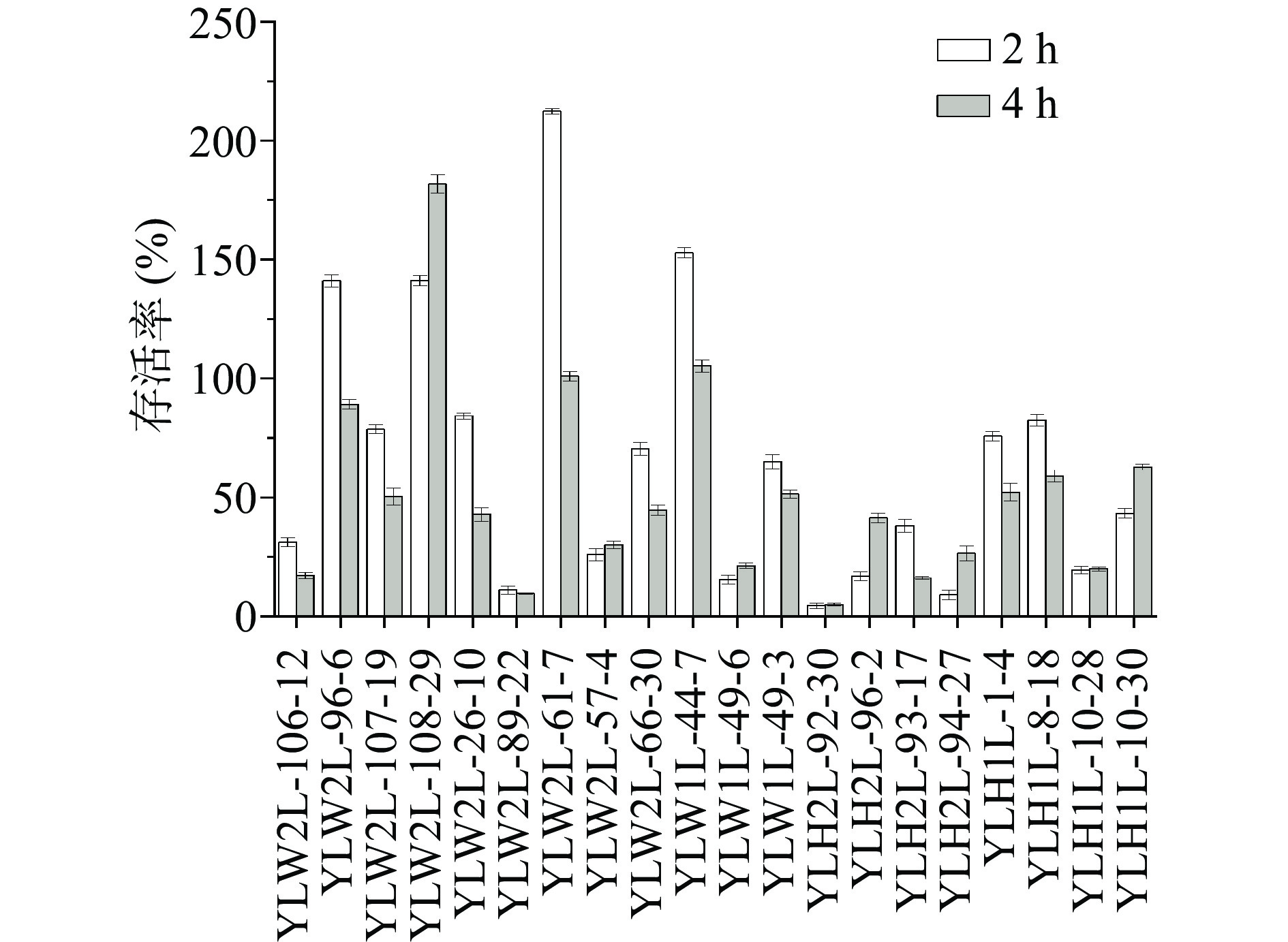
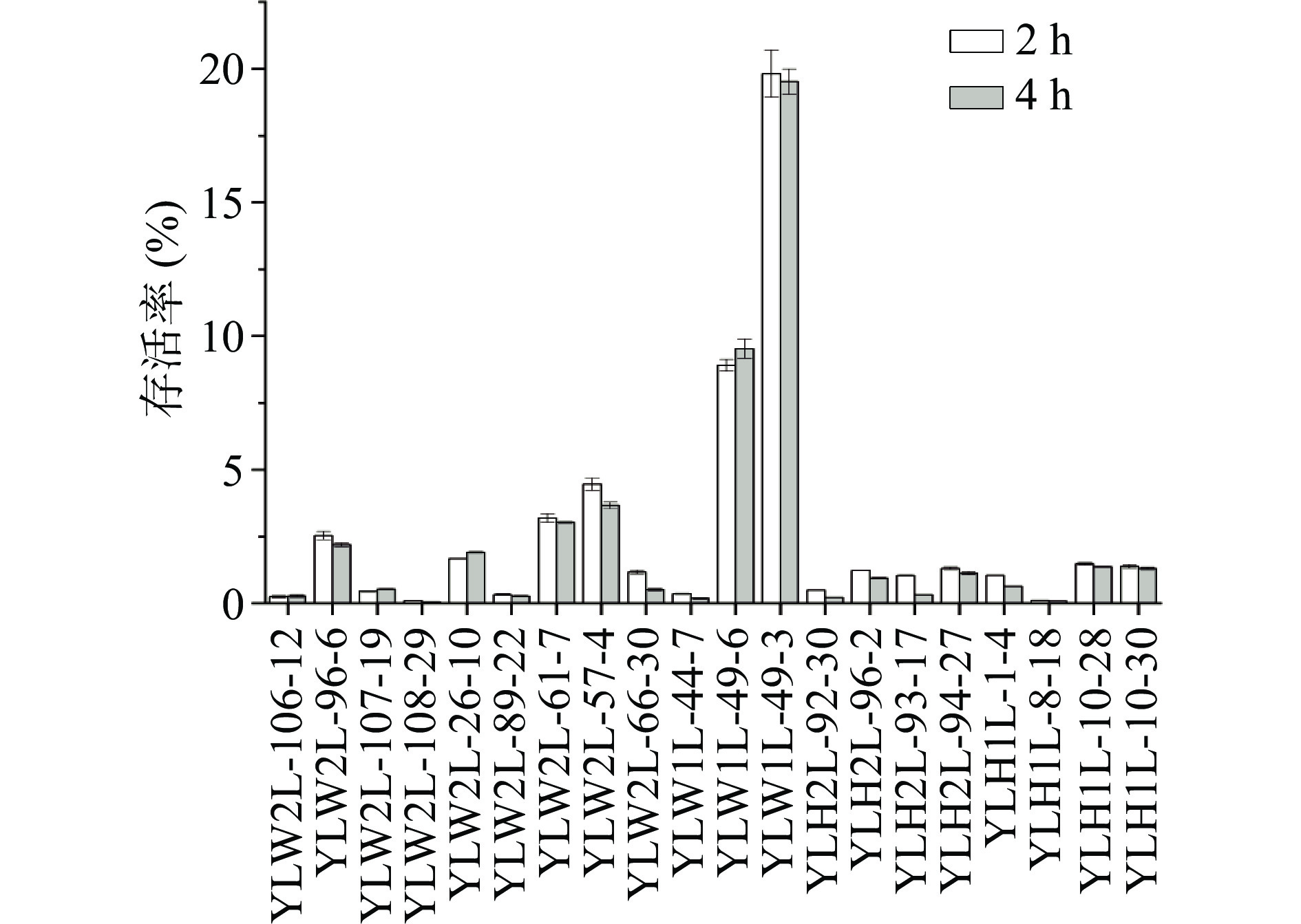
图3中菌株在pH2.5的改良MRS培养基中培养2 h后,存活率在4.42%~212.33%,4 h后存活率在4.85%~181.69%,说明某些菌株在pH2.5时仍可继续生长。YLW2L-96-6、YLW2L-108-29、YLW2L-61-7、YLW1L-44-7这4株菌株2 h后的存活率超过100%,4 h后YLW2L-108-29、YLW2L-61-7、YLW1L-44-7这3株菌株存活率超过100%。图4菌株在含有0.3%胆盐的改良MRS培养基中培养2 h后,存活率在0.10%~19.81%,4 h后存活率在0.05%~19.52%,存活率较低,平板计数结果显示菌落数在104~105 CFU/mL。2和4 h时存活率最高的菌株都是YLW1L-49-3,分别为19.81%、19.52%。
2.3 自聚集能力和疏水性分析
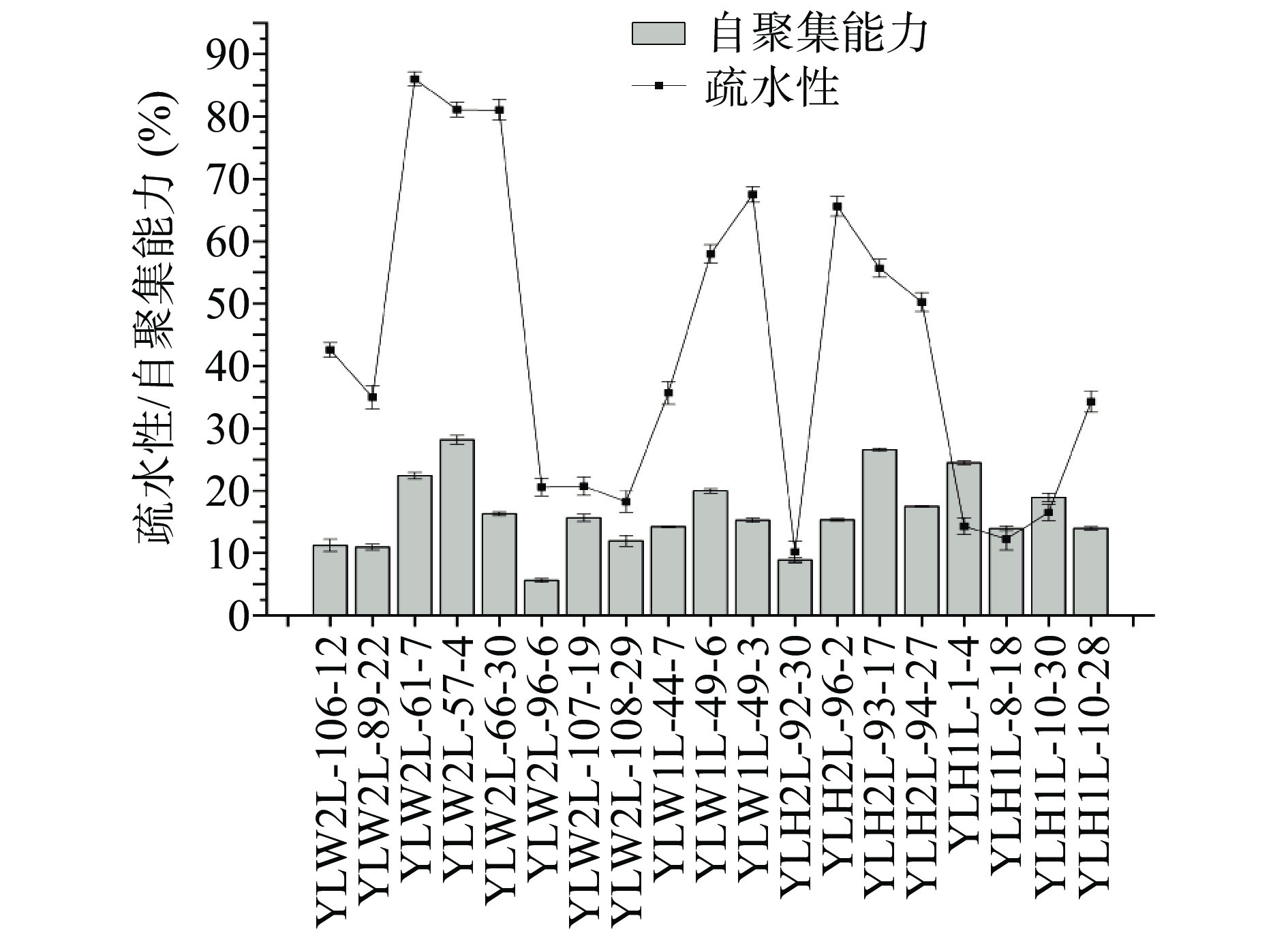
通过测定细菌自聚集和表面疏水性来间接反映其黏附能力,细菌表面疏水性越大,则黏附能力越强[24],但是黏附能力与自聚集能力的关系在菌株间存在差异性[25−26]。高黏附性有助于菌株定殖肠道,可以通过自聚集能力和表面疏水性作为高黏附能力植物乳植杆菌的参考指标。图5中植物乳植杆菌的疏水性在10.21%~86.01%,较高的是YLW2L-61-7、YLW2L-57-4、YLW2L-66-30这3株菌,疏水性都超过了80%。自聚集能力在5.61%~28.16%,最高的是YLW2L-57-4。
2.4 抑菌能力分析
15株菌株对6种致病菌都有抑菌效果,表4中所有菌株对Listeria monocytogenes CGMCC 1.9136都有抑菌效果,但是抑菌圈直径总体较小;总体来看,对Salmonella enterica subsp. enterica serovar Typhimwium、Listeria monocytogenes和Escherichia coli EPCC O127:K63的抑菌效果较差,对Escherichia coli EHEC O157:H7和Escherichia coli ETEC O78:K80的抑菌效果较好。除了YLW2L-108-29、YLW2L-26-10、YLW1L-49-3、YLW1L-44-7、YLH2L-93-17这5株菌株,其余植物乳植杆菌对6种致病菌都有抑菌圈。
表 4 20株植物乳植杆菌对6种致病菌的抑菌圈效果Table 4. Inhibition zone effect of 20 strains of L. plantarum on 6 pathogenic bacteria菌株编号 10411 10421 21530 10420 1.9136 1.10754 YLW2L-108-29 ++ − − ++ + − YLW2L-107-19 ++ ++ +++ +++ ++ ++ YLW2L-106-12 + + ++++ +++ + + YLW2L-96-6 ++ +++ ++++ ++ + + YLW2L-89-22 + + ++++ +++ ++ + YLW2L-66-30 ++ +++ ++++ +++ ++ ++ YLW2L-61-7 ++ ++++ ++ ++ ++ +++ YLW2L-57-4 ++ ++ ++++ + + + YLW2L-26-10 + +++ ++ ++ ++ − YLW1L-49-6 ++ ++ +++ ++ + + YLW1L-49-3 − + +++ +++ + + YLW1L-44-7 − ++ + − + − YLH2L-96-2 + ++ ++++ +++ + + YLH2L-94-27 ++ ++ +++ +++ + + YLH2L-93-17 ++ − − + + − YLH2L-92-30 ++ ++ ++++ +++ + + YLH1L-10-30 ++ +++ +++ +++ ++ ++ YLH1L-10-28 + ++ ++++ ++ + + YLH1L-8-18 ++ ++++ ++ ++ ++ +++ YLH1L-1-4 ++ +++ ++++ + ++ ++ 注:10411:Escherichia coli EPCC O127:K63 CICC;21530:Escherichia coli EHEC O157:H7 CICC;10421:Escherichia coli ETEC O78:K80 CICC;10420:Salmonella enterica subsp. enterica serovar Typhimwium CICC;1.9136:Listeria monocytogenes CGMCC 1.9136;1.10754:Salmonella enterica subsp. enterica CGMCC 1.10754;+抑菌圈直径≤15 mm,++15<抑菌圈直径≤20 mm,+++20<抑菌圈直径≤25 mm,++++抑菌圈直径>25 mm,−无抑菌圈。 2.5 抗生素耐药分析
表5中20株植物乳植杆菌对庆大霉素耐药,对米洛环素、氯霉素和氨苄西林敏感,YLW2L-96-6、YLH2L-92-30、YLH1L-8-18这3株菌对3种抗生素耐药,YLW2L-26-10、YLW2L-66-30、YLW2L-57-4、YLW1L-49-6这4株菌株对5种抗生素耐药,除上述7株菌外,其余菌株对4种抗生素耐药。
表 5 20株植物乳植杆菌对12种抗生素的敏感性Table 5. Sensitivity of 20 strains of L. plantarum to 12 kinds of antibiotics编号 RD TE MH CN P LEV St AMP CTX OX C FOX YLW2L-61-7 S S S R I R I S S R S R YLW2L-89-22 S S S R S R I S I R S R YLW2L-107-19 S I S R S R I S S R S R YLW2L-106-12 I S S R I R S S S R S R YLW2L-108-29 I I S R I R I S S R S R YLW2L-26-10 S S S R R R I S S R S R YLW2L-66-30 S I S R R R I S S R S R YLW2L-57-4 S I S R R R S S S R S R YLW2L-96-6 S I S R S R S S R S S I YLW1L-49-6 S S S R R R S S S R S R YLW1L-44-7 S S S R S R S S I R S R YLW1L-49-3 S I S R S R S S S R S R YLH2L-96-2 S I S R S R I S S R S R YLH2L-94-27 S I S R S R S S S R S R YLH2L-92-30 S S S R R I S S S I S R YLH2L-93-17 S S S R S R I S S R S R YLH1L-10-28 I I S R S R I S S R S R YLH1L-10-30 S I S R R R S S I I S R YLH1L-1-4 S I S R S R S S S I S R YLH1L-8-18 S I S R S R I S S S S R 注:P:青霉素;AMP;氨苄西林;OX:苯唑西林;CTX:头孢噻啶;RD:利福平;CN:庆大霉素;TE:四环素;MH:米洛环素;C:氯霉素;LEV:左氧氟沙星;St:链霉素;FOX:头孢西丁;R:耐药;I:中度敏感;S:敏感。 2.6 碳源利用能力分析
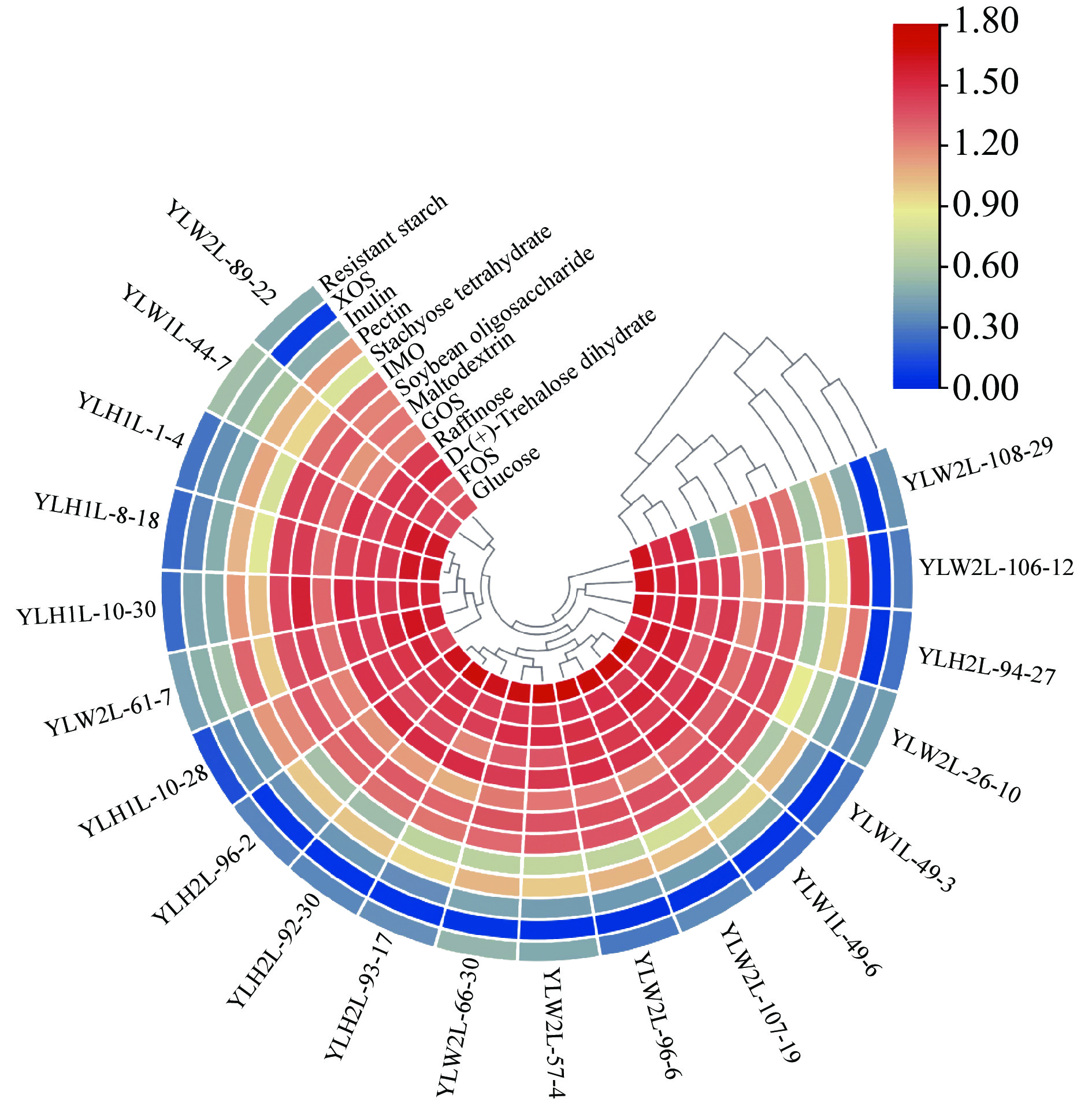
根据图6结果可知,植物乳植杆菌YLW1L-44-7、YLW2L-26-10、YLH1L-10-30、YLH1L-8-18、YLH1L-1-4、YLW2L-61-7、YLH1L-10-28这7株菌株在低聚木糖中生长24 h后的OD600高于0.100,其余菌株OD600在0.100以下;在抗性淀粉中生长较差,菌株YLW1L-44-7的OD600最高,为0.570;在菊糖中培养24 h后的OD600值在0.369~1.474,菌株YLW2L-106-12和YLH2L-94-27(OD600分别为1.474和1.245)生长最好,其余菌株OD600低于0.610;在水苏糖中培养24 h后的OD600值在0.559~1.199,YLH1L-10-30和YLH1L-10-28生长得最好,OD600值分别为1.025和1.199;在低聚果糖、低聚半乳糖、低聚异麦芽糖、麦芽糊精、棉子糖、D-海藻糖、果胶和大豆低聚糖中生长良好,其中在果胶中OD600值在0.900以上,其余碳源中OD600值均在1.000以上。
3. 讨论与结论
对于人类来说,益生菌已与人体健康紧密相连,许多商业食品都声称添加了对人体健康有益的益生菌,并且以此作为宣传卖点。益生菌(Probiotics)、益生元(Prebiotics)、合生元(Synbiotics)[27]和后生元(Postbioticis)[28]的概念已被广泛定义,为益生功能食品的开发带来标准。现在植物乳植杆菌与其它益生菌一起广泛用于工业发酵食品生产。
本文中相同民族来源的植物乳植杆菌在系统发育树上更倾向于聚集在同一分支,电泳图聚类结果中同一小分支上是相同来源的菌株,这说明同一生境中的植物乳植杆菌其遗传特征更为相似。即使是同种细菌,它们的表型特征也存在很大差异,研究不同来源的同种细菌有利于筛选出拥有符合不同条件的菌株,在开发益生菌产品上有更多的选择。
pH和高浓度胆盐是影响菌株生长的重要因素。因此,菌株必须有较强的耐酸耐胆盐能力才能在肠道中发挥其益生功能。本文中菌株的耐酸能力较强,耐胆盐能力则较差,菌株在4 h时存活率基本在10%以下,但在2和4 h时存活率相差不大,推测菌株可能会在该胆盐浓度下维持现有的存活率较长一段时间,后续实验可做进一步验证。Arena等[7]的研究中植物乳植杆菌对Listeria monocytogenes和Escherichia coli O157:H7表现出抑制作用,抑菌作用主要是产生的有机酸类物质造成;植物乳植杆菌YM-5-2产生的有机酸类物质对食源性致病菌埃希氏菌,肠沙门氏菌肠亚种鼠伤寒血清型、单核增生李斯特菌有抑制作用[29],与本文研究结果相似。植物乳植杆菌对氨基糖苷类、糖肽类和氟喹诺酮类抗生素耐药,对四环素类、利福霉类抗生素敏感[30],与本文结果相似。此外,植物乳植杆菌对绝大多数β-内酰胺类抗生素敏感[31],在本研究中对氨苄西林敏感,对苯唑西林则表现为耐药和中度敏感。乳杆菌对大多数核酸抑制剂,左氧氟沙星,氨基糖苷类抗生素,链霉素[32]、卡那霉素、庆大霉素等具有耐药性[33]。不同的是本文中植物乳植杆菌对链霉素表现出了不同程度的敏感性。这可能与地区,微生物所处环境有关。本文中的植物乳植杆菌对大多数碳源利用能力较强,在低聚糖上生长良好,也能在多糖菊粉和抗性淀粉上生长,但是几乎不能利用低聚木糖,有研究认为编码能降解低聚木糖的基因仅存在于乳酸菌特定的成员中[34],并不包括植物乳植杆菌。
综上,本研究是从新疆伊宁18份儿童粪便样品中分离出的分离株中,挑选出经groEL基因扩增测序鉴定为植物乳植杆菌的菌株,采用rep-PCR指纹图谱扩增选出代表菌株进行体外益生特性实验,通过对比耐酸、耐胆盐、自聚集、疏水性、抑菌、抗生素敏感性以及碳源利用的性能,菌株YLW2L-61-7可作为潜在益生菌菌株开展下一步的体内益生特性研究,为开发适合当地人群的益生菌产品奠定基础。在后续实验中,耐胆盐实验可将菌株培养时间延长,检测其是否能在0.3%胆盐浓度的MRS中维持现有存活率,本文中的自聚集与疏水性的测定是为了筛选出具有良好黏附能力的菌株,该方法简单快速,可用于初筛符合要求的菌株,同时也存在缺陷,后续黏附实验可做细胞黏附,还可增加抑菌物质的确定实验。
-
表 1 药敏片信息
Table 1 Information of drugs sensitive tablets
缩写 中文名称 含量(μg/片) RD 利福平 5 TE 四环素 30 MH 米诺环素 30 CN 庆大霉素 10 P 青霉素 10 LEV 左氧氟沙星 5 St 链霉素 300 AMP 氨苄西林 10 CTX 头孢噻肟 30 OX 苯唑西林 1 C 氯霉素 30 FOX 头孢西丁 30 表 2 菌株对抗生素敏感性标准
Table 2 Standard of antibiotic sensitivity of strains
抗生素 抑菌圈直径(mm) R(耐药) I(中度敏感) S(敏感) 利福平 <17 17~29 >19 四环素 <15 15~18 >18 米诺环素 <13 13~15 >15 庆大霉素 <13 13~14 >14 青霉素 <20 20~22 >22 左氧氟沙星 <13 13~15 >22 链霉素 <12 12~14 >14 氨苄西林 <14 14~26 >16 头孢噻肟 <15 15~22 >22 苯唑西林 <11 11~12 >22 氯霉素 <13 13~17 >17 头孢西丁 <14 15~17 >18 表 3 实验菌株信息
Table 3 Information of experimental strains
编号 民族来源 年龄段来源 YLW2L-61-7 维吾尔族 学龄 YLW2L-89-22 维吾尔族 学龄 YLW2L-107-19 维吾尔族 学龄 YLW2L-106-12 维吾尔族 学龄 YLW2L-108-29 维吾尔族 学龄 YLW2L-26-10 维吾尔族 学龄 YLW2L-66-30 维吾尔族 学龄 YLW2L-57-4 维吾尔族 学龄 YLW2L-96-6 维吾尔族 学龄 YLW1L-49-6 维吾尔族 学龄前 YLW1L-44-7 维吾尔族 学龄前 YLW1L-49-3 维吾尔族 学龄前 YLH2L-96-2 哈萨克族 学龄 YLH2L-94-27 哈萨克族 学龄 YLH2L-92-30 哈萨克族 学龄 YLH2L-93-17 哈萨克族 学龄 YLH1L-10-28 哈萨克族 学龄前 YLH1L-10-30 哈萨克族 学龄前 YLH1L-1-4 哈萨克族 学龄前 YLH1L-8-18 哈萨克族 学龄前 表 4 20株植物乳植杆菌对6种致病菌的抑菌圈效果
Table 4 Inhibition zone effect of 20 strains of L. plantarum on 6 pathogenic bacteria
菌株编号 10411 10421 21530 10420 1.9136 1.10754 YLW2L-108-29 ++ − − ++ + − YLW2L-107-19 ++ ++ +++ +++ ++ ++ YLW2L-106-12 + + ++++ +++ + + YLW2L-96-6 ++ +++ ++++ ++ + + YLW2L-89-22 + + ++++ +++ ++ + YLW2L-66-30 ++ +++ ++++ +++ ++ ++ YLW2L-61-7 ++ ++++ ++ ++ ++ +++ YLW2L-57-4 ++ ++ ++++ + + + YLW2L-26-10 + +++ ++ ++ ++ − YLW1L-49-6 ++ ++ +++ ++ + + YLW1L-49-3 − + +++ +++ + + YLW1L-44-7 − ++ + − + − YLH2L-96-2 + ++ ++++ +++ + + YLH2L-94-27 ++ ++ +++ +++ + + YLH2L-93-17 ++ − − + + − YLH2L-92-30 ++ ++ ++++ +++ + + YLH1L-10-30 ++ +++ +++ +++ ++ ++ YLH1L-10-28 + ++ ++++ ++ + + YLH1L-8-18 ++ ++++ ++ ++ ++ +++ YLH1L-1-4 ++ +++ ++++ + ++ ++ 注:10411:Escherichia coli EPCC O127:K63 CICC;21530:Escherichia coli EHEC O157:H7 CICC;10421:Escherichia coli ETEC O78:K80 CICC;10420:Salmonella enterica subsp. enterica serovar Typhimwium CICC;1.9136:Listeria monocytogenes CGMCC 1.9136;1.10754:Salmonella enterica subsp. enterica CGMCC 1.10754;+抑菌圈直径≤15 mm,++15<抑菌圈直径≤20 mm,+++20<抑菌圈直径≤25 mm,++++抑菌圈直径>25 mm,−无抑菌圈。 表 5 20株植物乳植杆菌对12种抗生素的敏感性
Table 5 Sensitivity of 20 strains of L. plantarum to 12 kinds of antibiotics
编号 RD TE MH CN P LEV St AMP CTX OX C FOX YLW2L-61-7 S S S R I R I S S R S R YLW2L-89-22 S S S R S R I S I R S R YLW2L-107-19 S I S R S R I S S R S R YLW2L-106-12 I S S R I R S S S R S R YLW2L-108-29 I I S R I R I S S R S R YLW2L-26-10 S S S R R R I S S R S R YLW2L-66-30 S I S R R R I S S R S R YLW2L-57-4 S I S R R R S S S R S R YLW2L-96-6 S I S R S R S S R S S I YLW1L-49-6 S S S R R R S S S R S R YLW1L-44-7 S S S R S R S S I R S R YLW1L-49-3 S I S R S R S S S R S R YLH2L-96-2 S I S R S R I S S R S R YLH2L-94-27 S I S R S R S S S R S R YLH2L-92-30 S S S R R I S S S I S R YLH2L-93-17 S S S R S R I S S R S R YLH1L-10-28 I I S R S R I S S R S R YLH1L-10-30 S I S R R R S S I I S R YLH1L-1-4 S I S R S R S S S I S R YLH1L-8-18 S I S R S R I S S S S R 注:P:青霉素;AMP;氨苄西林;OX:苯唑西林;CTX:头孢噻啶;RD:利福平;CN:庆大霉素;TE:四环素;MH:米洛环素;C:氯霉素;LEV:左氧氟沙星;St:链霉素;FOX:头孢西丁;R:耐药;I:中度敏感;S:敏感。 -
[1] RICCI A, ALLENDE A, BOLTON D, et al. Update of the list of qps-recommended biological agents intentionally added to food or feed as notified to efsa 5:Suitability of taxonomic units notified to efsa until september 2016[J]. Efsa Journal,2017,15(3):4663−4678.
[2] CEN S, YIN R, MAO B, et al. Comparative genomics shows niche-specific variations of Lactobacillus plantarum strains isolated from human, drosophila melanogaster, vegetable and dairy sources[J]. Food Bioscience,2020,35:100581−100597. doi: 10.1016/j.fbio.2020.100581
[3] FILANNINO P, DE ANGELIS M, DI CAGNO R, et al. How Lactobacillus plantarum shapes its transcriptome in response to contrasting habitats[J]. Environmental Microbiology,2018,20(10):3700−3716. doi: 10.1111/1462-2920.14372
[4] TEUSINK B, WIERSMA A, JACOBS L, et al. Understanding the adaptive growth strategy of Lactobacillus plantarum by in silico optimisation[J]. PLoS Computational Biology,2009,5(6):e1000410. doi: 10.1371/journal.pcbi.1000410
[5] SALVUCCI E, LEBLANC J G, PÉREZ G. Technological properties of lactic acid bacteria isolated from raw cereal material[J]. LWT,2016,70:185−191. doi: 10.1016/j.lwt.2016.02.043
[6] YILMAZ B, BANGAR S P, ECHEGARAY N, et al. The impacts of Lactiplantibacillus plantarum on the functional properties of fermented foods:A review of current knowledge[J]. Microorganisms,2022,10(4):826−843. doi: 10.3390/microorganisms10040826
[7] ARENA M P, SILVAIN A, NORMANNO G, et al. Use of Lactobacillus plantarum strains as a bio-control strategy against food-borne pathogenic microorganisms[J]. Frontiers in Microbiology,2016,7:464−481.
[8] LI X, XU W, YANG J, et al. Effects of applying lactic acid bacteria to the fermentation on a mixture of corn steep liquor and air-dried rice straw[J]. Animal Nutrition,2016,2(3):229−233. doi: 10.1016/j.aninu.2016.04.003
[9] MEADE E, SLATTERY M A, GARVEY M. Bacteriocins, potent antimicrobial peptides and the fight against multi drug resistant species:Resistance is futile?[J]. Antibiotics-Basel,2020,9(1):32−41. doi: 10.3390/antibiotics9010032
[10] YANG K M, JIANG Z Y, ZHENG C T, et al. Effect of Lactobacillus plantarum on diarrhea and intestinal barrier function of young piglets challenged with enterotoxigenic Escherichia Coli K881[J]. Journal of Animal Science,2014,92(4):1496−1503. doi: 10.2527/jas.2013-6619
[11] SAGGIORO A. Probiotics in the treatment of irritable bowel syndrome[J]. Journal of Clinical Gastroenterology, 2004, 38(6):104-106.
[12] VICARIOTTO F. Effectiveness of an association of a cranberry dry extract, d-mannose, and the two microorganisms Lactobacillus plantarum Lp01 and Lactobacillus paracasei Lpc09 in women affected by cystitis:A pilot study[J]. Journal of Clinical Gastroenterology,2014,48:96−101. doi: 10.1097/MCG.0b013e3182a02eff
[13] KAŹMIERCZAK-SIEDLECKA K, DACA A, FOLWARSKI M, et al. The role of Lactobacillus plantarum 299v in supporting treatment of selected diseases[J]. Central European Journal Of Immunology,2020,45(4):488−493. doi: 10.5114/ceji.2020.101515
[14] RUDZKI L, OSTROWSKA L, PAWLAK D, et al. Probiotic Lactobacillus plantarum 299v decreases kynurenine concentration and improves cognitive functions in patients with major depression:A double-blind, randomized, placebo controlled study[J]. Psychoneu Roendocrinology,2019,100:213−222. doi: 10.1016/j.psyneuen.2018.10.010
[15] ONBAS T, OSMANAGAOGLU O, KIRAN F. Potential properties of Lactobacillus plantarum F-10 as a bio-control strategy for wound infections[J]. Probiotics and Antimicrobial Proteins,2019,11(4):1110−1123. doi: 10.1007/s12602-018-9486-8
[16] DOUILLARD F P, DE VOS W M. Biotechnology of health-promoting bacteria[J]. Biotechnology Advances,2019,37(6):107369−107387. doi: 10.1016/j.biotechadv.2019.03.008
[17] MATSUKI T, WATANABE K, FUJIMOTO J, et al. Quantitative pcr with 16s rRAN-gene-targeted species-specific primers for analysis of human intestinal Bifidobacteria[J]. Applied and Environmental Microbiology 2004, 70(1):167-173.
[18] YANG B, CHEN Y, STANTON C, et al. Bifidobacterium and Lactobacillus composition at species level and gut microbiota diversity in infants before 6 weeks[J]. International Journal of Molecular Sciences,2019,20(13):3306. doi: 10.3390/ijms20133306
[19] KAUSHIK J K, KUMAR A, DUARY R K, et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum[J]. PLoS One,2009,4(12):e8099. doi: 10.1371/journal.pone.0008099
[20] SHEHATA M G, EL SOHAIMY S A, EL-SAHN M A, et al. Screening of isolated potential probiotic lactic acid bacteria for cholesterol lowering property and bile salt hydrolase activity[J]. Annals of Agricultural Sciences,2016,61(1):65−75. doi: 10.1016/j.aoas.2016.03.001
[21] TANG W, LI C, HE Z, et al. Probiotic properties and cellular antioxidant activity of Lactobacillus plantarum Ma2 isolated from tibetan kefir grains[J]. Probiotics Antimicrob Proteins,2018,10(3):523−533. doi: 10.1007/s12602-017-9349-8
[22] MUHAMMAD Z, RAMZAN R, ABDELAZEZ A, et al. Assessment of the antimicrobial potentiality and functionality of Lactobacillus plantarum strains isolated from the conventional inner mongolian fermented cheese against foodborne pathogens[J]. Pathogens,2019,8(2):71−87. doi: 10.3390/pathogens8020071
[23] 魏小晶, 周桓丞, 靳亚梅, 等. 新疆喀什地区维吾尔族婴幼儿肠道双歧杆菌遗传差异及益生特性分析[J]. 食品科学,2020,41(6):93−100. [WEI X J, ZHOU H C, JIN Y M, et al. Genetic difference and probiotic characteristics of intestinal Bifidobacterium in Uygur infants in Kashi area, Xinjiang[J]. Food Science,2020,41(6):93−100.] doi: 10.7506/spkx1002-6630-20190217-083 WEI X J, ZHOU H C, JIN Y M, et al . Genetic difference and probiotic characteristics of intestinal Bifidobacterium in Uygur infants in Kashi area, Xinjiang[J]. Food Science,2020 ,41 (6 ):93 −100 . doi: 10.7506/spkx1002-6630-20190217-083[24] MALDONADO N C, SILVA D R C, CLAUDIA O M, et al. Lactic acid bacteria isolated from young calves-characterization and potential as probiotics[J]. Research in Veterinary Science,2012,92(2):342−349. doi: 10.1016/j.rvsc.2011.03.017
[25] VLKOVA E, RADA V, SMEHILOVA M, et al. Auto-aggregation and co-aggregation ability in Bifidobacteria and Clostridia[J]. Folia Microbiologica,2008,53(3):263−269. doi: 10.1007/s12223-008-0040-z
[26] TUO Y, YU H, AI L, et al. Aggregation and adhesion properties of 22 Lactobacillus strains[J]. Journal of Dairy Science,2013,96(7):4252−4257. doi: 10.3168/jds.2013-6547
[27] SWANSON K S, GIBSON G R, HUTKINS R, et al. The international scientific association for probiotics and prebiotics consensus statement on the definition and scope of synbiotics[J]. Nature Reviews Gastroenterology & Hepatology,2020,17(11):687−701.
[28] SALMINEN S, COLLADO M C, ENDO A, et al. The international scientific association of probiotics and prebiotics consensus statement on the definition and scope of postbiotics[J]. Nature Reviews Gastroenterology & Hepatology,2021,18(9):649−667.
[29] 王志新, 韩烁培, 王雨, 等. 植物乳杆菌的筛选、鉴定及其抑菌物质研究[J]. 食品工业科技,2019,40(9):133−138. [WANG Z X, HAN S P, WANG Y, et al. Screening, identification and antibacterial substances of Lactiplantibacillus plantarum[J]. Science and Technology of Food Industry,2019,40(9):133−138.] WANG Z X, HAN S P, WANG Y, et al . Screening, identification and antibacterial substances of Lactiplantibacillus plantarum[J]. Science and Technology of Food Industry,2019 ,40 (9 ):133 −138 .[30] 韦珏, 刘金凤, 覃绍敏, 等. 发酵酸鱼中乳酸菌的鉴定及特性分析[J]. 中国酿造,2023,42(3):95−100. [WEI Y, LIU J F, QIN S M, et al. Identification and characteristic analysis of lactic acid bacteria in fermented fish[J]. China Brewing,2023,42(3):95−100.] WEI Y, LIU J F, QIN S M, et al . Identification and characteristic analysis of lactic acid bacteria in fermented fish[J]. China Brewing,2023 ,42 (3 ):95 −100 .[31] CHOPRA I. Tetracycline antibiotics:mode of action, applications, molecular biology, and epidemiology of bacterial resistance[J]. Microbiology & Molecular Biology Reviews,2001,65(2):232−260.
[32] 史梅莓, 伍亚龙, 杨恺, 等. 四川泡菜中潜在益生性植物乳杆菌的筛选及安全性评价[J]. 食品工业科技, 2022, 43(22):165-172. SHI M M, WU Y L, YANG K, et al. Screening and safety evaluation of potential beneficial Lactiplantibacillus plantarum in Sichuan pickles [J]. Science and Technology of Food Industry, 2022, 43(22):165−172. [33] JAIMEE G, HALAMI P M. Emerging resistance to aminoglycosides in lactic acid bacteria of food origin-an impending menace[J]. Applied Microbiology & Biotechnology,2016,100(3):1137−1151.
[34] MICHLMAYR H, SCHÜMANN C, KULBE KLAUS D, et al. Heterologously expressed family 51 Α-L-arabinofuranosidases from Oenococcus oeni and Lactobacillus brevis[J]. Applied and Environmental Microbiology,2011,77(4):1528−1531. doi: 10.1128/AEM.01385-10
-
期刊类型引用(4)
1. 任菲菲,张静,张艳红,郑艳青. UPLC-MS/MS测定僵蚕中多种兽药残留. 食品与药品. 2025(01): 46-51 .  百度学术
百度学术
2. 孙梅梅,吴银良. 固相萃取-液相色谱-串联质谱法快速测定猪肉中27种兽药及代谢物残留量. 食品安全质量检测学报. 2024(17): 30-38 .  百度学术
百度学术
3. 管益涛,陈明华,谷翠梅,马淑青. QuEChERS结合GC-MS/MS检测果蔬中13种农药残留. 食品安全导刊. 2024(27): 63-67 .  百度学术
百度学术
4. 罗登武,张帅,胡中海,胡惠茗,王飞,罗炽增. SinChERS净化结合UPLC-MS/MS法测定茶叶中农药多残留的基质效应研究. 食品安全导刊. 2023(32): 65-72 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



