Toxic Effects of Arecoline on Human Stomach Mucosal Epithelial Cells
-
摘要: 本文旨在探讨槟榔碱对人胃黏膜上皮细胞GES-1的毒性作用。用不同浓度(60、90、120、150 μg/mL)的槟榔碱处理GES-1细胞,并检测GES-1细胞活力、活性氧水平(Reactive Oxygen Species,ROS)和线粒体膜电位(Mitochondrial Membrane Potential,MMP),测定GES-1细胞还原型谷胱甘肽(Glutathione,GSH)水平、超氧化物歧化酶(Superoxide Dismutase,SOD)活力、乳酸脱氢酶(Lactate dehydrogenase,LDH)活力、三磷酸腺苷(ATP)酶活力。测定肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、白介素-6(Interleukin 6,IL-6)、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、转化生长因子-β(Transforming Growth Factor-β,TGF-β)水平。结果表明,与空白对照组相比,槟榔碱刺激后GES-1细胞形态发生改变,细胞活力最低降低至24%,活性氧水平最高升至12.5倍,线粒体膜电位最低下降至10.4%。在150 μg/mL槟榔碱刺激下,总ATP酶以及Na+K+-ATP酶活力分别下降至42.31%和39.84%,GSH和SOD分别下降了40.23%和34.1%,LDH上升了30.46%,TNF-α、IL-6、VEGF、TGF-β水平分别上升了4.67%、10.2%、23.14%和22.83%。结果表明槟榔碱能够产生氧化应激并诱发炎症因子,对GES-1细胞造成毒性损伤。
-
关键词:
- 槟榔碱 /
- 人胃黏膜上皮细胞GES-1 /
- 氧化应激 /
- 线粒体 /
- 细胞毒性
Abstract: The purpose of this study was to look into the toxicity of arecoline on human stomach mucosal epithelial cells GES-1. GES-1 cells were treated with different concentrations (60, 90, 120, 150 μg/mL) of arecoline, detection of GES-1 cell viability, reactive oxygen species levels (ROS) and mitochondrial membrane potential (MMP). The levels of glutathione (GSH), superoxide dismutase (SOD), lactate dehydrogenase (LDH), adenosine triphosphate (ATP) enzymes were measured in GES-1 cellls. And the leves of tumor necrosis factor-α (TNF-α), interleukin 6 (IL-6), vascular endothelial growth factor (VEGF), transforming growth factor-β (TGF-β) were measured in GES-1 cells. Compared with the control group, the shape of GES-1 cells was altered after arecoline stimulation, with the lowest cell viability rate reduced to 24%, the highest reactive oxygen species level increased to 12.5 fold, and the lowest mitochondrial membrane potential decreased to 10.4%. Under 150 μg/mL arecoline stimulation, T-ATPase and Na+K+-ATPase activity decreased to 42.31% and 39.84%, GSH and SOD decreased by 40.23% and 34.1%, respectively, LDH increased by 30.46%, TNF-α, IL-6, VEGF and TGF-β levels increased by 4.67%, 10.2%, 23.14% and 22.83%. The results indicate that arecoline can produce oxidative stress and induce inflammatory factors that cause toxic damage to GES-1 cells. -
槟榔及其制品中含有多种成分,包括碳水化合物、脂肪、蛋白质、粗纤维、生物碱、皂苷、酚类、氨基酸和微量元素等。其中,生物碱是槟榔及其制品中的主要活性物质,包括槟榔碱、槟榔次碱、去甲基槟榔碱、去甲基槟榔次碱、槟榔副碱和高槟榔碱等[1−2]。其中槟榔碱含量在2.98~745.0 μg/mL[3]。
槟榔碱(Methyl-1,2,5,6-tetrahydro-1-methyl-nicotinate)是从槟榔中分离出来的一种生物碱,被认为是槟榔中含量最多的有效成分。槟榔碱的毒性作用可归因于其对各种生物过程的广泛影响因素[4],例如抑制参与生物代谢、解毒、染色体结构稳定性和DNA修复系统的基因表达。研究表明,槟榔碱抑制多种细胞DNA和双链核酸的合成,进而影响细胞生长、迁移、增殖以及组织附着再生[5]。另外,氧化应激在细胞生长、细胞凋亡[6]、基因表达[7]和细胞信号传导[8]中起着关键作用,而槟榔碱会阻碍人体内抗氧化剂如SOD、过氧化氢酶和谷胱甘肽-S-转移酶(GST)和活性氧(ROS)的中和[9]。槟榔碱可调节实验动物的免疫功能[10]来调节炎症过程,例如槟榔碱可能通过引发前列腺素E2(PGE-2)和环氧合酶2(COX-2)的产生以及诱导白细胞介素6(IL-6)的表达来引发上皮炎症[11−12]。槟榔碱的细胞毒作用已在口腔上皮细胞中得到证实[13−14]。
有研究表明,咀嚼槟榔与胃癌以及食管癌之间存在一定的因果关系[15]。咀嚼槟榔时,带有槟榔活性成分的唾液可能会经过食道、胃部以及肠道等的消化系统器官,所以,咀嚼槟榔还可能会导致这些部位发生黏膜损伤、溃疡等病变,长期刺激可能引发胃癌。利用槟榔碱或者是槟榔提取物经过多种方式如灌胃[16]、混合到饲料中[17],发现食道和胃部都具有类似癌症的症状,导致胃黏膜上皮细胞的p53、Bax及p65的水平升高[15]。然而,槟榔碱体内外损伤模型的系统建立方法未有报道,槟榔或者是槟榔碱对消化器官,尤其是胃部的损害以及致癌途径研究依然不完善。因此本研究采用体外培养人胃黏膜上皮细胞GES-1的方法,探讨槟榔碱对GES-1细胞的毒性,以期建立槟榔碱对GES-1细胞的损伤模型,为进一步阐明槟榔碱的细胞毒性作用机制提供实验依据。
1. 材料与方法
1.1 材料与仪器
GES-1人胃黏膜上皮细胞 武汉普诺赛生命科技有限公司;RPMI-1640培养基、特级胎牛血清(Fetal Bovine Serum,FBS)、0.25%含EDTA胰酶(0.02%EDTA,Trypsin-EDTA)、0.25%无EDTA胰酶(Trypsin Solution without EDTA)、磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS)、青霉素-链霉素混合液(P/S) 美国Gibco公司;槟榔碱(分析标准品,HPLC≥98%,CAS:63-75-2) 上海源叶生物科技有限公司;LDH试剂盒、SOD试剂盒、GSH试剂盒、ROS检测试剂盒、YO-PRO-1/PI细胞凋亡与坏死检测试剂盒 碧云天生物技术公司;ATP酶试剂盒、Na+K+-ATP酶试剂盒 南京建成生物工程研究所;TNF-α试剂盒、IL-6试剂盒、VEGF试剂盒、TGF-β试剂盒 江苏酶免实业有限公司。
SH型CO2细胞培养箱 上海善志仪器设备有限公司;DGG-9070B型鼓风干燥箱 上海森信实验仪器有限公司;ANKE TDL-5-A型离心机 上海安亭分析仪器有限责任公司;Labserv K3型酶标仪、BD FACSCalibur流式细胞仪 赛默飞世尔科技(中国)有限公司;SW-CJ-I-1FD苏洁超净工作台 苏州安泰空气技术有限公司;ZEISS Lab.A1倒置生物学显微镜 德国蔡司公司。
1.2 实验方法
1.2.1 细胞培养
GES-1细胞培养在含10%(体积分数)FBS的RPMI-1640培养基中,在5%(体积分数)CO2、37 ℃的培养箱中培养,取对数生长期的细胞进行试验。
1.2.2 CCK-8法测定细胞活力
设置只含有新鲜培养液为空白孔,含有细胞且不含样品作为对照孔,含有不同质量浓度槟榔碱孔为实验孔(10、20、30、60、90、120、150 μg/mL),每组样品设置6个复孔。
取出生长状态良好细胞,用胰酶消化后制成细胞悬液,以1×104个/mL的密度将细胞接种在96孔细胞培养板中,每孔100 μL,培养12 h使细胞贴壁生长。
弃去细胞培养板的培养基,空白孔与对照孔加入新鲜的完全培养基,实验孔按分组加入含不同质量浓度槟榔碱(10、20、30、60、90、120、150 μg/mL)的培养基,每孔100 μL,放回培养箱内继续培养24 h/48 h后弃去培养基,用PBS清洗1次后每孔加入10 μL的CCK8试剂和90 μL的完全培养基,将孔板在培养箱内放置4 h,测定450 nm处吸光值(A值),计算细胞活力。
V(%)=A−A0A1−A0×100 式中,V指细胞活力;A指样品组的A值;A0指空白组的A值;A1指对照组的A值。
1.2.3 槟榔碱对GES-1细胞形态的影响
取生长状态良好GES-1细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h后,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h。培养完成后在倒置显微镜下观察细胞形态。
1.2.4 GES-1细胞活性氧检测
取生长状态良好GES-1细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h后,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h。培养完成后,参考冷彦等[18]的方法进行细胞活性氧检测。
1.2.5 GES-1细胞线粒体膜电位检测
收集处于对数生长期的细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h,培养完成后,参考冼健安等[19]的方法进行细胞线粒体膜电位的检测。
1.2.6 槟榔碱对GES-1细胞ATP酶的影响
取生长状态良好GES-1细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h,按照超微量ATP酶测试盒(Na+K+、T-ATP酶)的说明书进行测定。
1.2.7 槟榔碱对GES-1细胞GSH、SOD、LDH的影响
取生长状态良好GES-1细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h后,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h,按照乳酸脱氢酶(LDH)试剂盒、超氧化物歧化酶(T-SOD)试剂盒、还原型谷胱甘肽(GSH)试剂盒中的说明书进行测定。
1.2.8 槟榔碱对GES-1细胞炎症因子的影响
取生长状态良好GES-1细胞,以1×105个/mL的密度接种于6孔细胞培养板内,置于细胞培养箱内培养24 h,按分组加入含不同质量浓度槟榔碱(60、90、120、150 μg/mL)的培养基,每孔2 mL,放回培养箱内继续培养24 h,按照TNF-α、IL-6、TGF-β、VEGF试剂盒说明书检测。
1.3 数据处理
采用SPSS 24.0统计软件进行数据分析,以Graphpad 8.0进行图表处理,统计方法采用单因素方差分析(One-Way ANOVA),并做组间比较,不同组别样本数n=6,计量数据以平均数±标准差表示。
2. 结果与分析
2.1 槟榔碱对GES-1细胞的毒性作用
2.1.1 槟榔碱对人胃黏膜上皮细胞活力影响
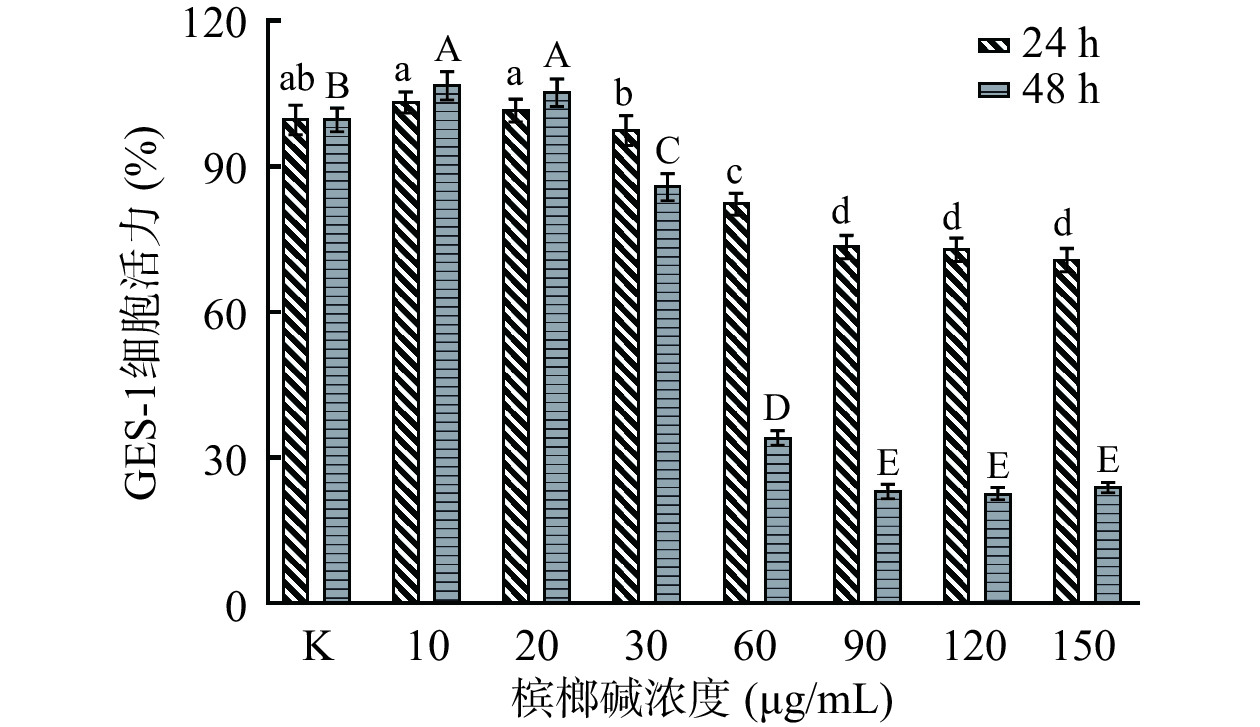
不同浓度槟榔碱对人胃黏膜上皮细胞活力的影响见图1。与对照组相比,GES-1细胞在经过60 μg/mL的槟榔碱刺激24 h后,细胞活力开始出现极显著降低(P<0.01),是对照组的82.6%。
而在48 h的刺激时间下,槟榔碱浓度为30 μg/mL时细胞活力开始出现极显著降低(P<0.01),是对照组的86.2%;随着槟榔碱浓度的升高,细胞活力过低,已普遍降至30%以下,因此后续实验中选择24 h作为刺激时间,并且选择60~150 μg/mL槟榔碱浓度作为后续实验的作用浓度范围。
2.1.2 槟榔碱刺激对GES-1细胞形态影响
不同浓度槟榔碱刺激对GES-1细胞形态影响见图2。可观察到正常生长的GES-1细胞排列有序,细胞边界清晰,胞质均匀。而随着槟榔碱浓度的提升,细胞的数量逐渐减少,排列出现紊乱;部分细胞回缩变圆;部分死亡细胞脱离底部,漂浮在培养液中,同时也可以观察到部分细胞碎片。说明槟榔碱对细胞具有一定损伤作用,会引起细胞损伤甚至死亡脱落。
2.2 槟榔碱对GES-1细胞内ROS水平影响
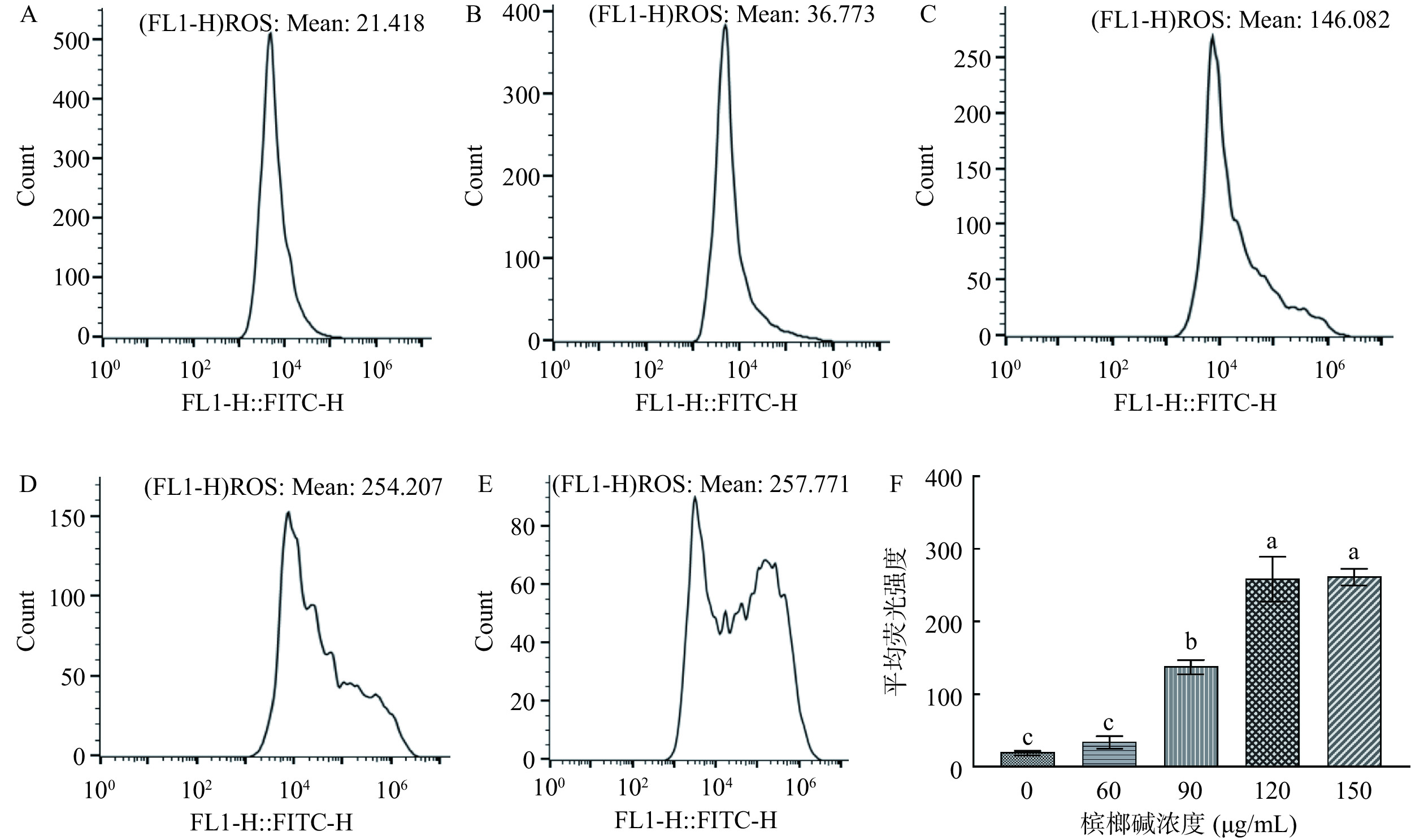
不同浓度槟榔碱对GES-1细胞内ROS水平影响见图3。随着槟榔碱的浓度的提升,GES-1细胞内的ROS水平也随之升高,具有一定的浓度依赖性。与空白组相比,90 μg/mL槟榔碱处理后,GES-1细胞的平均荧光强度开始出现极显著上升(P<0.01),约为对照组的7.4倍。120 μg/mL槟榔碱处理后平均荧光强度达到259.14,150 μg/mL槟榔碱处理后平均荧光强度达到262.27,与对照组相比均有极显著升高(P<0.01)。以上结果表明,槟榔碱刺激GES-1细胞可能会引起细胞内氧化应激,促使细胞内ROS的生成,造成细胞的氧化损伤。
![]() 图 3 不同槟榔碱浓度刺激对GES-1细胞内ROS水平影响注:A为对照组GES-1流式直方图;B为60 μg/mL槟榔碱刺激下GES-1流式直方图;C为90 μg/mL槟榔碱刺激下GES-1流式直方图;D为120 μg/mL槟榔碱刺激下GES-1流式直方图;E为150 μg/mL槟榔碱刺激下GES-1流式直方图;F为平均荧光强度统计柱状图;FL1-H::FITC-H表示检测到FITC荧光的信号强度;不同字母表示差异极显著(P<0.01),图4~图5、图7同。Figure 3. Effect of stimulation with different arecoline concentrations on intracellular ROS levels in GES-1 cells
图 3 不同槟榔碱浓度刺激对GES-1细胞内ROS水平影响注:A为对照组GES-1流式直方图;B为60 μg/mL槟榔碱刺激下GES-1流式直方图;C为90 μg/mL槟榔碱刺激下GES-1流式直方图;D为120 μg/mL槟榔碱刺激下GES-1流式直方图;E为150 μg/mL槟榔碱刺激下GES-1流式直方图;F为平均荧光强度统计柱状图;FL1-H::FITC-H表示检测到FITC荧光的信号强度;不同字母表示差异极显著(P<0.01),图4~图5、图7同。Figure 3. Effect of stimulation with different arecoline concentrations on intracellular ROS levels in GES-1 cells2.3 槟榔碱对GES-1细胞线粒体膜电位影响
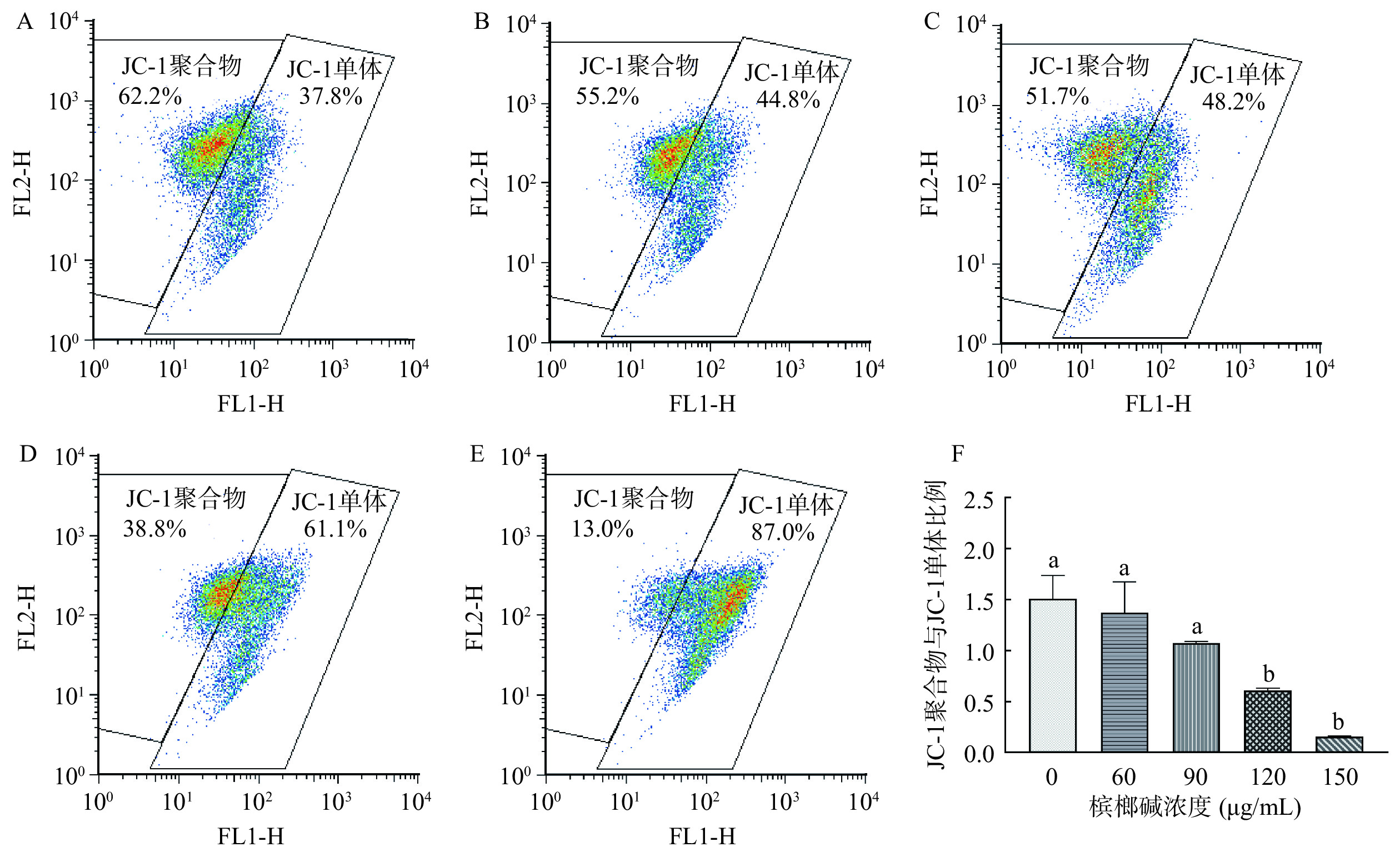
不同浓度槟榔碱对GES-1细胞线粒体膜电位影响见图4。随着槟榔碱浓度的提升,GES-1细胞的线粒体膜电位呈现下降的趋势,在120 μg/mL开始出现极显著下降(P<0.01),当槟榔碱浓度为150 μg/mL时,线粒体膜电位下降至对照组的10.4%(P<0.01)。以上结果提示,在槟榔碱的处理下,GES-1细胞的线粒体发生去极化导致膜电位失衡,呼吸链电子的传递过程出现障碍,进一步导致线粒体的功能出现障碍。
![]() 图 4 不同槟榔碱浓度刺激对GES-1细胞线粒体膜电位影响注:A,对照组GES-1流式散点图;B,60 μg/mL槟榔碱刺激下GES-1流式散点图;C,90 μg/mL槟榔碱刺激下GES-1流式散点图;D,120 μg/mL槟榔碱刺激下GES-1流式散点图;E,150 mg/mL槟榔碱刺激下GES-1流式散点图;F,线粒体膜电位水平统计柱状图。其中FL1-H表示检测到的绿色荧光信号强度,FL2-H表示检测到的红色荧光信号强度。Figure 4. Effect of stimulation with different arecoline concentrations on the mitochondrial membrane potential of GES-1 cells
图 4 不同槟榔碱浓度刺激对GES-1细胞线粒体膜电位影响注:A,对照组GES-1流式散点图;B,60 μg/mL槟榔碱刺激下GES-1流式散点图;C,90 μg/mL槟榔碱刺激下GES-1流式散点图;D,120 μg/mL槟榔碱刺激下GES-1流式散点图;E,150 mg/mL槟榔碱刺激下GES-1流式散点图;F,线粒体膜电位水平统计柱状图。其中FL1-H表示检测到的绿色荧光信号强度,FL2-H表示检测到的红色荧光信号强度。Figure 4. Effect of stimulation with different arecoline concentrations on the mitochondrial membrane potential of GES-1 cells2.4 槟榔碱对GES-1细胞ATP酶影响
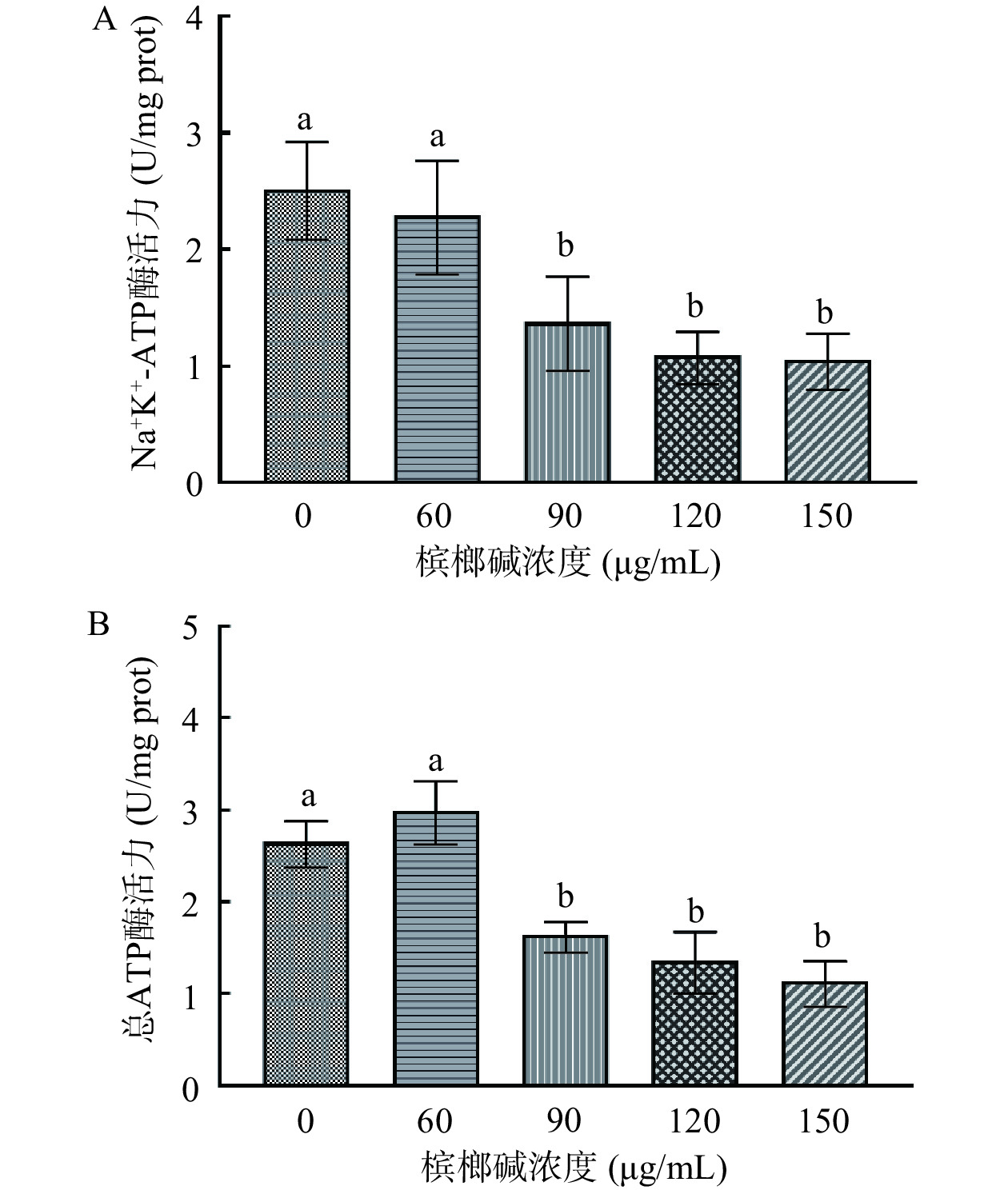
不同浓度槟榔碱对GES-1细胞ATP酶影响见图5。随着槟榔碱浓度的提升,总ATP酶活力呈现先上升后下降的趋势,其原因可能是因为槟榔碱存在双相剂量效应(Hormesis)[20],即在低浓度槟榔碱刺激下,促使细胞产生ATP酶;而Na+K+-ATP酶的活力则呈现出浓度剂量依赖式下降。在90 μg/mL浓度的槟榔碱处理下,细胞的总ATP酶以及Na+K+-ATP酶活力均出现了极显著性下降(P<0.01),分别下降为1.64、1.38 U/mg prot。在150 μg/mL浓度的槟榔碱刺激下,总ATP酶以及Na+K+-ATP酶活力进一步下降至1.13、1.05 U/mg prot。说明槟榔碱的刺激会降低GES-1细胞的ATP酶活力,可能进一步对线粒体造成损伤,导致能量代谢失衡与ATP的生成下降。
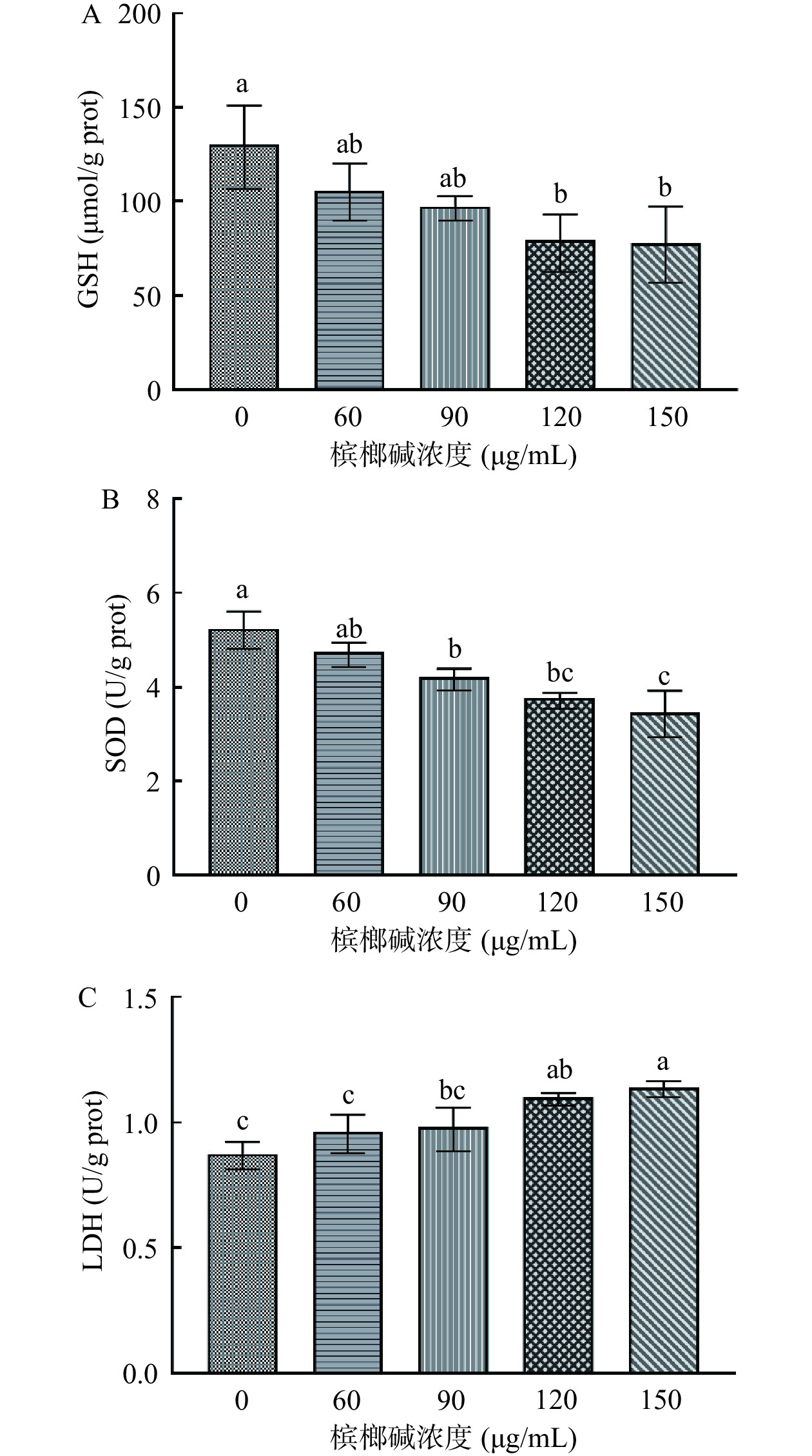
2.5 槟榔碱对GES-1细胞GSH、SOD、LDH的影响
不同浓度的槟榔碱对GES-1细胞内GSH、SOD、LDH的影响见图6。在120 μg/mL浓度的槟榔碱刺激下,GES-1细胞的GSH含量为79.6 μmol/g prot,与对照组相比出现显著性降低(P<0.05)。在90 μg/mL浓度的槟榔碱刺激下,SOD的酶活力开始出现极显著性降低(P<0.01),降低到了4.74 U/g prot。在120 μg/mL浓度的槟榔碱刺激下,LDH出现极显著性升高(P<0.01),说明槟榔碱的刺激对GES-1细胞具有毒性作用,GES-1细胞内的抗氧化酶系统遭到了破坏,导致细胞出现氧化损伤。
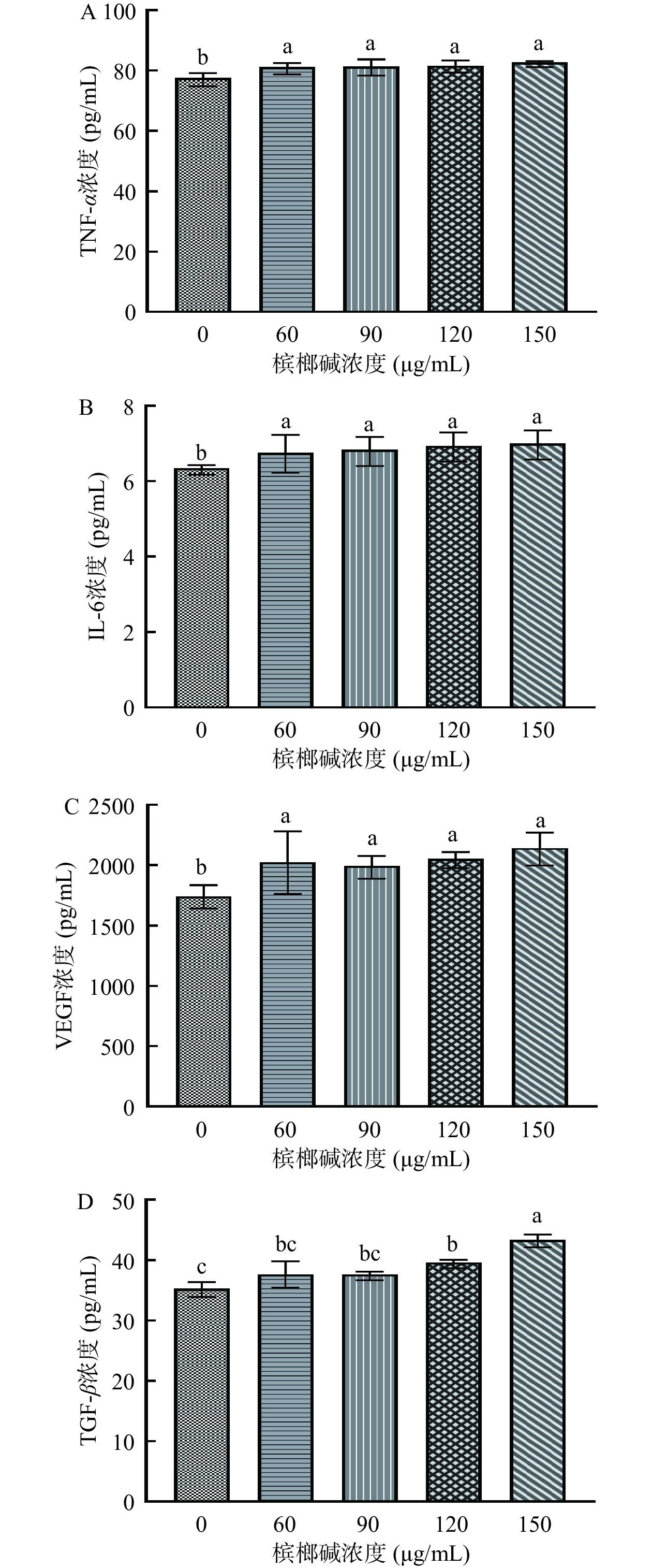
2.6 槟榔碱对GES-1细胞炎症因子的影响
不同浓度的槟榔碱对GES-1细胞内炎症因子的影响见图7。在不同浓度槟榔碱的刺激下,各炎症因子均出现上升趋势,在150 μg/mL槟榔碱的刺激下,与对照组相比TNF-α含量极显著上升至82.21 pg/mL(P<0.01),IL-6含量上升至6.95 pg/mL(P<0.01),VEGF含量上升至2145.41 pg/mL(P<0.01),TGF-β含量上升至43.02 pg/mL(P<0.01)。说明槟榔碱能够提高细胞内促炎因子与促纤维化因子水平,破坏胃黏膜正常的保护功能,进一步诱发胃黏膜的炎症反应,导致细胞损伤。
3. 讨论与结论
GES-1细胞是人胃黏膜中正常的胃黏膜上皮细胞,是研究胃黏膜损伤、胃溃疡、胃炎、幽门螺旋杆菌感染、胃癌等疾病的重要细胞模型系统[21]。有研究表明,槟榔碱在经过人体消化系统时会对消化系统造成损伤,其中包括胃部黏膜的损伤[15]。Kong等[22]的体外模拟消化研究表明,摄入121.22 μg/mL的槟榔碱1 h后,在胃部消化阶段仍能检测到72.41 μg/mL的槟榔碱残留,有可能对胃部造成损伤。因此本研究利用槟榔碱刺激GES-1细胞,探究槟榔碱对人胃黏膜的毒性作用,结果显示:60 μg/mL槟榔碱刺激GES-1细胞24 h后细胞活力开始出现极显著降低(P<0.01);30 μg/mL槟榔碱刺激GES-1细胞48 h后细胞活力开始出现极显著降低(P<0.01)。此外,不同浓度槟榔碱刺激后细胞形态发生改变,槟榔碱浓度越高,细胞形态变化程度越大。槟榔碱刺激降低了细胞内 SOD 与 GSH 的活力,促进 LDH 与 ROS 的含量升高,引发细胞的氧化应激反应;同时积蓄的ROS攻击线粒体,进一步导致线粒体膜电位失衡与功能障碍,ATP酶活力降低,细胞供能受损,促炎因子与促纤维化因子水平升高,最终对GES-1细胞产生毒性作用。
细胞在氧化胁迫中会诱导线粒体功能出现障碍,产生大量的自由基,破坏细胞内的平衡状态,最终导致细胞损伤甚至死亡。其中ROS是机体正常代谢的产物,能参与到多种信号通路中,激活细胞信号联级反应,抑制细胞增殖、诱导细胞发生凋亡、坏死等[8]。有研究表明槟榔碱可以提升细胞内ROS的水平,引发氧化应激,打破细胞内的平衡环境,诱导线粒体功能障碍,最终导致病变甚至癌变[23−24]。Hung等[25]证明了槟榔提取物诱导内皮细胞的ROS水平上升,并且进一步通过MAPK(JNK和p38)通路上调HO-1的表达,引发氧化应激。同样Ji等[26]研究表明槟榔碱能诱导口腔鳞状细胞中ROS上升,引起DNA损伤,导致DNA复制错误。本研究中,在90 μg/mL槟榔碱处理下ROS呈现出极显著性升高(P<0.01),表明槟榔碱刺激导致GES-1细胞产生大量活性氧,对细胞造成损害。
细胞内自由基的清除需要依靠抗氧化酶,其中GSH在机体内可以维护正常的免疫系统功能,可以帮助机体清除自由基,保护机体内多种酶不被氧化并且正常地发挥其生理功能,具有抗氧化、解毒的功效,可以作为细胞内衡量抗氧化能力的关键指标[27];SOD是一种抗氧化金属酶,能够清除细胞内超氧阴离子,参与细胞内的抗氧化进程并起关键作用,SOD活力可以反映组织内细胞的氧化受损情况[28];LDH稳定存在于细胞内部,当细胞受损伤后能迅速释放到细胞外,因此,细胞外液中的LDH活性是衡量细胞发生应激损伤的指标物[28]。有研究表明,小鼠胶质细胞中GSH的耗竭引起的过氧化导致细胞坏死[29];Run等[30]发现槟榔碱能够抑制细胞内SOD的酶活性,进一步破坏氧化应激抗氧化酶系统。在本研究中,随着槟榔碱浓度的升高,GSH、SOD活力出现下降,LDH含量升高,说明槟榔碱的刺激对GES-1细胞的抗氧化系统造成了破坏,导致细胞内产生的自由基积蓄,最终导致细胞损伤。
线粒体膜电位是由线粒体内膜两侧质子以及其他离子的浓度不对称分布而形成的,对稳定细胞的正常生理功能有重要作用[19]。ATP作为机体内重要的能量产物,能够维系生物功能的正常运转,ATP酶广泛分布在细胞的生物膜系统内,对保护细胞的正常生理功能具有重要意义。线粒体受到氧化剂的攻击后,线粒体膜电位的失衡会导致能量异常代谢,进而导致细胞周期的失调、细胞坏死[31]以及细胞凋亡[32]等。已有研究表明过氧化氢处理人脐静脉内皮细胞(HUVECs)会导致线粒体膜电位显著下降,诱导HUVECs发生程序性坏死[33];香烟烟雾提取物会导致人肺上皮细胞(BEAS-2B)ATP酶水平明显下降,进一步诱导BEAS-2B发生程序性坏死[34];H2S通过下调ATP酶的活性引起能量代谢紊乱,诱导鸡的脾脏细胞发生程序性坏死[35]。在本研究中,60~150 μg/mL的槟榔碱处理组线粒体膜电位以及ATP酶活力出现下降,能够说明氧化应激进一步导致线粒体功能破坏,正常的膜电位失衡引起能量代谢紊乱,最终导致细胞出现损伤。
TNF-α作为多肽类细胞因子具有多种生物功能,参与细胞的增殖与分化、侵袭与转移、细胞凋亡、机体免疫应答反应和炎症反应[36]。IL-6是典型的细胞炎症因子,在炎症与肿瘤的形成中有着重要作用[37]。TGF-β是一种具有多种生物学活性的细胞因子,与细胞的生长与转化密切相关,可以通过调节免疫来促进细胞的侵袭和转移[38−39]。有研究表明,槟榔碱能够促进炎症因子的表达与释放[40−41],Jeng等[42]发现槟榔提取物能够促进TNF-α和IL-6的产生,引发口腔癌。Li等[43]认为在成纤维细胞和角质形成细胞中,槟榔提取物或槟榔碱诱导肿瘤促进介质或致癌信号通路,包括IL-6、TGF-β[44]。此外,槟榔提取物能够引发口腔癌细胞中VEGF的表达,具有促进癌症转移的潜在作用[43]。槟榔碱可能通过多种分子调节因子促进细胞炎症,最终引发细胞死亡。这与本研究结果一致,随槟榔碱浓度的升高,促炎因子与促纤维化因子均出现上升趋势,导致细胞出现炎症反应,并促进损伤部位炎症的转移,最终导致GES-1细胞的毒性损伤。
细胞的死亡方式多种多样,大致可以分为程序性与非程序性死亡,程序性死亡的方式主要为程序性坏死、细胞凋亡、焦亡、铁死亡和自噬等。其中程序性坏死具有一些特征:细胞膜在外界的刺激下被破坏,产生氧化应激导致线粒体的膜电位丧失,发生线粒体功能障碍与能量失衡[45]。很多研究表明ROS的产生是引发程序性坏死的关键因子[46],此外线粒体膜电位在程序性坏死中起到关键作用,线粒体膜电位失衡导致能量供应失调,最终导致细胞产生程序性坏死[33−35]。目前对于槟榔碱导致细胞毒性的机制研究仍不明确,根据本研究结果显示,线粒体膜电位以及ATP酶活力随槟榔碱的浓度提升而降低,引发线粒体功能障碍,推测槟榔碱可能引发GES-1细胞程序性坏死发挥毒性作用。
综上所述,槟榔碱引发氧化应激失衡,导致细胞内的ROS积蓄,进而导致线粒体功能障碍,细胞供能受损,最终引发GES-1细胞死亡。对GES-1细胞毒性作用的潜在机制可能是氧化应激导致的线粒体功能障碍,诱发炎症因子的产生,最终导致GES-1程序性坏死,但有待进一步研究确定。本研究发现槟榔碱对人胃黏膜上皮细胞具有损伤作用,并为槟榔碱对GES-1细胞的损伤模型的建立提供了实验剂量的参考依据,研究结果提示食用槟榔可能会导致胃部损伤,因此建议人们应减少槟榔的食用以保护自身消化系统的健康。
-
图 3 不同槟榔碱浓度刺激对GES-1细胞内ROS水平影响
注:A为对照组GES-1流式直方图;B为60 μg/mL槟榔碱刺激下GES-1流式直方图;C为90 μg/mL槟榔碱刺激下GES-1流式直方图;D为120 μg/mL槟榔碱刺激下GES-1流式直方图;E为150 μg/mL槟榔碱刺激下GES-1流式直方图;F为平均荧光强度统计柱状图;FL1-H::FITC-H表示检测到FITC荧光的信号强度;不同字母表示差异极显著(P<0.01),图4~图5、图7同。
Figure 3. Effect of stimulation with different arecoline concentrations on intracellular ROS levels in GES-1 cells
图 4 不同槟榔碱浓度刺激对GES-1细胞线粒体膜电位影响
注:A,对照组GES-1流式散点图;B,60 μg/mL槟榔碱刺激下GES-1流式散点图;C,90 μg/mL槟榔碱刺激下GES-1流式散点图;D,120 μg/mL槟榔碱刺激下GES-1流式散点图;E,150 mg/mL槟榔碱刺激下GES-1流式散点图;F,线粒体膜电位水平统计柱状图。其中FL1-H表示检测到的绿色荧光信号强度,FL2-H表示检测到的红色荧光信号强度。
Figure 4. Effect of stimulation with different arecoline concentrations on the mitochondrial membrane potential of GES-1 cells
-
[1] LI L, LUO Z, LIU Y, et al. Screening and identification of the metabolites in rat plasma and urine after oral administration of Areca catechu L. nut extract by ultra-high-pressure liquid chromatography coupled with linear ion trap–orbitrap tandem mass spectrometry[J]. Molecules,2017,22(6):1026. doi: 10.3390/molecules22061026
[2] IARC W G O T. Betel-quid and areca-nut chewing and some areca-nut derived nitrosamines[J]. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans,2004,85:1−334.
[3] 侯倩煜, 符礼顺, 梁焕宴, 等. LC-PDA测定槟榔、焦槟榔、大腹皮中4种生物碱的含量[J]. 中国现代应用药学,2023,40(4):443−447. [HOU Q Y, FU L S, LIANG H Y, et al. Determination of four alkaloids components in arecae semen, arecae semen tostum and arecae pericarpium by LC-PDA[J]. Chinese Journal of Modern Applied Pharmacy,2023,40(4):443−447.] HOU Q Y, FU L S, LIANG H Y, et al. Determination of four alkaloids components in arecae semen, arecae semen tostum and arecae pericarpium by LC-PDA[J]. Chinese Journal of Modern Applied Pharmacy, 2023, 40(4): 443−447.
[4] JENG J, CHANG M C, HAHN L J. Role of areca nut in betel quid-associated chemical carcinogenesis:Current awareness and future perspectives[J]. Oral Oncology,2001,37(6):477−492. doi: 10.1016/S1368-8375(01)00003-3
[5] JENG J H, HAHN L J, LIN B R, et al. Effects of areca nut, inflorescence piper betle extracts and arecoline on cytotoxicity, total and unscheduled DNA synthesis in cultured gingival keratinocytes[J]. Journal of Oral Pathology & Medicine,1999,28(2):64−71.
[6] PEARCE A K, HUMPHREY T C. Integrating stress-response and cell-cycle checkpoint pathways[J]. Trends in Cell Biology,2001,11(10):426−433. doi: 10.1016/S0962-8924(01)02119-5
[7] WASSERMAN W W, FAHL W E. Functional antioxidant responsive elements[J]. Proceedings of the National Academy of Sciences,1997,94(10):5361−5366. doi: 10.1073/pnas.94.10.5361
[8] GENESTRA M. Oxyl radicals, redox-sensitive signalling cascades and antioxidant[J]. Cellular Signalling,2007,19(9):1807−1819. doi: 10.1016/j.cellsig.2007.04.009
[9] DASGUPTA R, SAHA I, PAL S, et al. Immunosuppression, hepatotoxicity and depression of antioxidant status by arecoline in albino mice[J]. Toxicology,2006,227(1-2):94−104. doi: 10.1016/j.tox.2006.07.016
[10] SAHA I, CHATTERJI U, CHAUDHURI S S, et al. Ultrastructural and hormonal changes in the pineal–testicular axis following arecoline administration in rats[J]. Journal of Experimental Zoology Part A:Ecological Genetics and Physiology,2007,307(4):187−198.
[11] CHANG M, WU H, LEE J, et al. The induction of prostaglandin E2 production, interleukin-6 production, cell cycle arrest, and cytotoxicity in primary oral keratinocytes and KB cancer cells by areca nut ingredients is differentially regulated by MEK/ERK activation[J]. Journal of Biological Chemistry,2004,279(49):50676−50683. doi: 10.1074/jbc.M404465200
[12] TSAI C H, CHOU M Y, CHANG Y C. The induction of prostaglandin E2 production, interleukin-6 production, cell cycle arrest, and cytotoxicity in primary oral keratinocytes and KB cancer cells by areca nut ingredients is differentially regulated by MEK/ERK activation[J]. Journal of Oral Pathology & Medicine,2003,32(3):146−153.
[13] JENG J, TSAI C L, HAHN L J, et al. Arecoline cytotoxicity on human oral mucosal fibroblasts related to cellular thiol and esterase activities[J]. Food and Chemical Toxicology,1999,37(7):751−756. doi: 10.1016/S0278-6915(99)00050-2
[14] SUNDQVIST K, LIU Y, NAIR J, et al. Cytotoxic and genotoxic effects of areca nut-related compounds in cultured human buccal epithelial cells[J]. Cancer Research,1989,49(19):5294−5298.
[15] KURKALANG S, BANERJEE A, GHOSHAL N, et al. Induction of chromosome instability and stomach cancer by altering the expression pattern of mitotic checkpoint genes in mice exposed to areca-nut[J]. BMC Cancer,2013,13(1):1−12. doi: 10.1186/1471-2407-13-1
[16] BHIDE S V, GOTHOSKAR S V, SHIVAPURKAR N M. Arecoline tumorigenicity in Swiss strain mice on normal and vitamin B deficient diet[J]. Journal of Cancer Research and Clinical Oncology,1984,107:169−171. doi: 10.1007/BF01032602
[17] DUNHAM L J, SNELL K C, STEWART H L. Brief communication:Argyrophilic carcinoids in two syrian hamsters (Mesocricetus auratus)[J]. Journal of the National Cancer Institute,1975,54(2):507−513.
[18] 冷彦, 王静, 吴文斗, 等. 高压脉冲电场预处理普洱熟茶对SD大鼠体内活性氧(ROS)水平的影响[J]. 西南农业学报,2021,34(6):1208−1214. [LENG Y, WANG J, WU W D, et al. Effect of pre-treatment of Pu'er tea by high voltage pulse eLectric field on reactive oxygen (ROS) levels in SD mice[J]. Southwest China Journal of Agricultural Sciences,2021,34(6):1208−1214.] LENG Y, WANG J, WU W D, et al. Effect of pre-treatment of Pu'er tea by high voltage pulse eLectric field on reactive oxygen (ROS) levels in SD mice[J]. Southwest China Journal of Agricultural Sciences, 2021, 34(6): 1208−1214.
[19] 冼健安, 李彬, 郭慧, 等. JC-1标记的流式细胞术测定虾类血细胞的线粒体膜电位[J]. 水产科学,2013,32(3):157−160. [XIAN J A, LI B, GUO H, et al. Measurement of mitochondrial membrane electronic potential in shrimp haemocytes by JC-1 staining and flow cytometry[J]. Fisheries Science,2013,32(3):157−160.] XIAN J A, LI B, GUO H, et al. Measurement of mitochondrial membrane electronic potential in shrimp haemocytes by JC-1 staining and flow cytometry[J]. Fisheries Science, 2013, 32(3): 157−160.
[20] 朱钦士. 低剂量的毒物对生物有益?——比较毒物的单相剂量效应理论和双相剂量效应理论(1)[J]. 生物学通报,2020,55(1):10−13. [ZHU Q S. Is a little bit of toxin good for you?-linear no-threshold model versus Hormesis model(1)[J]. Bulletin of Biology,2020,55(1):10−13.] ZHU Q S. Is a little bit of toxin good for you?-linear no-threshold model versus Hormesis model(1)[J]. Bulletin of Biology, 2020, 55(1): 10−13.
[21] WU J, LIU K, SHI X. The anti-inflammatory activity of several flavonoids isolated from Murraya paniculata on murine macrophage cell line and gastric epithelial cell (GES-1)[J]. Pharmaceutical Biology,2016,54(5):868−881. doi: 10.3109/13880209.2015.1089294
[22] KONG D, WANG G, TANG Y, et al. Potential health risk of areca nut consumption:Hazardous effect of toxic alkaloids and aflatoxins on human digestive system[J]. Food Research International, 2022, 162(Pt A):112012.
[23] RAY P D, HUANG B W, TSUJI Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cell Signal,2012,24(5):981−990. doi: 10.1016/j.cellsig.2012.01.008
[24] 许智, 吕逢源, 姜二辉, 等. 槟榔与细胞内活性氧及自噬的关系[J]. 华西口腔医学杂志,2020,38(1):80−85. [XU Z, LÜ F Y, JIANG E H, et al. Relationship among areca nut, intracellular reactive oxygen species, and autophagy[J]. West China Journal of Stomatology,2020,38(1):80−85.] XU Z, LÜ F Y, JIANG E H, et al. Relationship among areca nut, intracellular reactive oxygen species, and autophagy[J]. West China Journal of Stomatology, 2020, 38(1): 80−85.
[25] HUNG T C, HUANG L W, SU S J, et al. Hemeoxygenase-1 expression in response to arecoline-induced oxidative stress in human umbilical vein endothelial cells[J]. International Journal of Cardiology,2011,151(2):187−194. doi: 10.1016/j.ijcard.2010.05.015
[26] JI W T, YANG S R, CHEN J Y, et al. Arecoline downregulates levels of p21 and p27 through the reactive oxygen species/mTOR complex 1 pathway and may contribute to oral squamous cell carcinoma[J]. Cancer Science,2012,103(7):1221−1229. doi: 10.1111/j.1349-7006.2012.02294.x
[27] 王小巍, 张红艳, 刘锐, 等. 谷胱甘肽的研究进展[J]. 中国药剂学杂志(网络版),2019,17(4):141−148. [WANG X W, ZHANG H Y, LIU R, et al. Progress in research of glutathione[J]. Chinese Journal of Pharmaceutics (Online Edition),2019,17(4):141−148.] WANG X W, ZHANG H Y, LIU R, et al. Progress in research of glutathione[J]. Chinese Journal of Pharmaceutics (Online Edition), 2019, 17(4): 141−148.
[28] 覃焱, 许海钊, 徐境懋, 等. 亚硒酸钠和硒代蛋氨酸对人结肠腺癌细胞的毒性作用[J]. 现代食品科技,2021,37(1):1−6. [TAN Y, XU H Z, XU J M, et al. Cytotoxicity in human colon adenocarcinoma Caco-2 cell induced by celenite and selenomethionine[J]. Modern Food Science and Technology,2021,37(1):1−6.] TAN Y, XU H Z, XU J M, et al. Cytotoxicity in human colon adenocarcinoma Caco-2 cell induced by celenite and selenomethionine[J]. Modern Food Science and Technology, 2021, 37(1): 1−6.
[29] LARID M D, WAKADE C, ALLEYNE C J, et al. Hemin-induced necroptosis involves glutathione depletion in mouse astrocytes[J]. Free Radical Biology and Medicine,2008,45(8):1103−1114. doi: 10.1016/j.freeradbiomed.2008.07.003
[30] RUN M X, JUN J W, JING Y C, et al. Effects of arecoline on hepatic cytochrome P450 activity and oxidative stress[J]. Journal of Toxicological Sciences,2014,39(4):609−614. doi: 10.2131/jts.39.609
[31] CHANG M C, HO Y S, LEE P H, et al. Areca nut extract and arecoline induced the cell cycle arrest but not apoptosis of cultured oral KB epithelial cells:Association of glutathione, reactive oxygen species and mitochondrial membrane potential[J]. Carcinogenesis,2001,22(9):1527−1535.
[32] DING Y, YAO H, YAO Y, et al. Protection of dietary polyphenols against oral cancer[J]. Nutrients,2013,5(6):2173−2191.
[33] ZHAO W, FENG H, SUN W, et al. Tert-butyl hydroperoxide (t-BHP) induced apoptosis and necroptosis in endothelial cells:Roles of NOX4 and mitochondrion[J]. Redox Biology,2017,11:524−534. doi: 10.1016/j.redox.2016.12.036
[34] DERA A A, AL F M, OTIFI H, et al. Thymoquinone (Tq) protects necroptosis induced by autophagy/mitophagy-dependent oxidative stress in human bronchial epithelial cells exposed to cigarette smoke extract (CSE)[J]. Journal of Food Biochemistry,2020,44(9):e13366.
[35] CHI Q, WANG D, HU X, et al. Hydrogen sulfide gas exposure induces necroptosis and promotes inflammation through the MAPK/NF-kappaB pathway in broiler spleen[J]. Oxidative Medicine and Cellular Longevity,2019,2019:8061823.
[36] 高世勇, 李丹. 肿瘤坏死因子与癌症相关研究进展[J]. 中国药理学通报,2020,36(9):1209−1213. [GAO S Y, LI D. Research advances in tumor necrosis factor and cancer[J]. Chinese Pharmacological Bulletin,2020,36(9):1209−1213.] GAO S Y, LI D. Research advances in tumor necrosis factor and cancer[J]. Chinese Pharmacological Bulletin, 2020, 36(9): 1209−1213.
[37] HARUN O R M, ALI M B, JESMIN, et al. Statistical meta-analysis to investigate the association between the interleukin-6 (IL-6) gene polymorphisms and cancer risk[J]. PLoS One,2021,16(3):e247055.
[38] WEEKS B H, HE W, OLSON K L, et al. Inducible expression of transforming growth factor beta1 in papillomas causes rapid metastasis[J]. Cancer Research,2001,61(20):7435−7443.
[39] 刘晨, 隋红. TGF-β信号通路介导胃癌EMT的研究进展[J]. 现代肿瘤医学,2020,28(3):517−520. [LIU C, SUI H. Research progress on TGF-β signaling pathway in mediating EMT of gastric cancer[J]. Journal of Modern Oncology,2020,28(3):517−520.] LIU C, SUI H. Research progress on TGF-β signaling pathway in mediating EMT of gastric cancer[J]. Journal of Modern Oncology, 2020, 28(3): 517−520.
[40] CHANG L Y, WAN H C, LAI Y L, et al. Areca nut extracts increased the expression of cyclooxygenase-2, prostaglandin E2 and interleukin-1alpha in human immune cells via oxidative stress[J]. Archives of Oral Biology,2013,58(10):1523−1531. doi: 10.1016/j.archoralbio.2013.05.006
[41] FAOUZI M, NEUPANE R P, YANG J, et al. Areca nut extracts mobilize calcium and release pro-inflammatory cytokines from various immune cells[J]. Scientific Reports,2018,8(1):1075. doi: 10.1038/s41598-017-18996-2
[42] JENG J H, WANG Y J, CHIANG B L, et al. Roles of keratinocyte inflammation in oral cancer:Regulating the prostaglandin E2, Interleukin-6 and TNF-alpha production of oral epithelial cells by areca nut extract and arecoline[J]. Carcinogenesis,2003,24(8):1301−1315. doi: 10.1093/carcin/bgg083
[43] LI Y C, CHENG A J, LEE L Y, et al. Multifaceted mechanisms of areca nuts in oral carcinogenesis:The molecular pathology from precancerous condition to malignant transformation[J]. Journal of Cancer,2019,10(17):4054−4062. doi: 10.7150/jca.29765
[44] 杨博, 符梦凡, 唐瞻贵. 槟榔碱及机械刺激构建大鼠口腔黏膜下纤维化模型[J]. 华西口腔医学杂志,2019,37(3):260−264. [YANG B, FU M F, TANG Z G. Rat model with oral submucous fibrosis induced by arecoline and mechanical stimulation[J]. West China Journal of Stomatology,2019,37(3):260−264.] YANG B, FU M F, TANG Z G. Rat model with oral submucous fibrosis induced by arecoline and mechanical stimulation[J]. West China Journal of Stomatology, 2019, 37(3): 260−264.
[45] LI L, HE Z, ZHU Y, et al. Hydrogen sulfide suppresses skin fibroblast proliferation via oxidative stress alleviation and necroptosis inhibition[J]. Oxidative Medicine and Cellular Longevity,2022,2022:7434733.
[46] SHEN C, WANG C, HAN S, et al. Aldehyde dhydrogenase 2 deficiency negates chronic low-to-moderate alcohol consumption-induced cardioprotecion possibly via ROS-dependent apoptosis and RIP1/RIP3/MLKL-mediated necroptosis[J]. Biochimica Et Biophysica Acta-molecular Basis of Disease,2017,1863(8):1912−1918. doi: 10.1016/j.bbadis.2016.11.016





 下载:
下载:

 下载:
下载:



