Application of Magnetic Nanoseparation Technology in Rapid Detection of Foodborne Pathogens
-
摘要: 食源性致病菌是导致食源性疾病的重要因素,对食品安全和人类健康造成了严重危害,是全球卫生保健系统面临的一个巨大挑战。受污染的食品基质复杂且早期致病菌浓度低,干扰了现有检测手段的灵敏度。通常使用传统的增菌培养能提高致病菌的浓度以满足检测需求,但其过程耗时、费力,不能满足市场监管部门快速检测的需要。为了准确检测前期污染食品中的致病菌,保障食品安全,迫切需要食源性致病菌分离富集的有效手段。近年来磁性纳米粒子被广泛研究,通过在其表面修饰能特异性结合致病菌的识别元件,能够对复杂食品基质中的致病菌进行有效的分离富集,结合现有的高灵敏度检测手段,可快速对食源性致病菌进行早期检测。本文主要综述了磁性纳米分离技术、磁性纳米粒子与识别元件的偶联方式、识别元件的种类及结合检测手段的应用情况,以期为食源性致病菌快速检测方法的开发提供参考。Abstract: Foodborne pathogens are important factors that contribute to foodborne illnesses, posing significant threats to food safety and human health, and presenting a major challenge for global healthcare systems. Contaminated food matrices are complex and often have low concentrations of early-stage pathogens, which hinder the sensitivity of existing detection methods. Traditional microbial culture methods are typically used to increase the concentration of pathogens for detection purposes, but these methods are time-consuming and labor-intensive, making them inadequate for the rapid testing needs of regulatory authorities. Therefore, there is an urgent need for effective methods of isolating and enriching foodborne pathogens to accurately detect early-stage contamination in food and ensure food safety. In recent years, magnetic nanoparticles have been extensively studied. By modifying their surfaces with recognition elements that can specifically bind to pathogens, they can effectively isolate and enrich foodborne pathogens in complex food matrices. When combined with existing highly sensitive detection methods, these magnetic nanoparticles enable rapid early-stage detection of foodborne pathogens. This article provides an overview of Magnetic nanoseparation technology, the coupling methods of magnetic nanoparticles with recognition elements, the types of recognition elements, and the application of combined detection methods. The aim is to provide reference for the development of rapid detection methods for foodborne pathogens.
-
食源性疾病是世界上最重要的公共卫生问题之一[1],因其发病率高、经济损失严重而引起了社会的广泛关注。食源性致病菌可引起大多数食源性疾病[2],其以食物为媒介传播入人体会导致严重的疾病,如腹泻、呕吐、高烧、胃肠道感染甚至死亡[3]。根据世界卫生组织的一份报告,全球每年约有6亿例食源性疾病病例,导致42万人死亡[4],其中约70%的食源性疾病是由致病菌引起的[5],包含沙门氏菌、副溶血性弧菌、金黄色葡萄球菌、单增李斯特菌等。食源性致病菌污染十分广泛,食物和水源都易被其污染,包括肉类、海鲜、蔬菜、水果、鸡蛋、乳制品等[6]。这对人类健康和食品安全构成了严重威胁。因此,快速检测食品中的致病菌对控制食品质量和保证食品安全具有重要意义。
食源性致病菌传统的鉴定技术需要进行増菌培养[7],检测过程耗时、费力,已不能满足相关部门食品安全监管和快速检测的需求。目前,检测食源性致病菌的分析方法已被广泛报道[7−8],如聚合酶链式反应(Polymerase chain reaction,PCR)、侧流层析技术(Lateral flow technology,LFA)、酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)和表面增强拉曼散射(Surface-enhanced raman scattering,SERS)等,虽然这些技术较传统的培养鉴定技术更灵敏、更快速,但由于食品成分十分复杂,动物来源的食品含有脂肪和蛋白质等,植物来源食品含有色素、淀粉、糖类等其他成分[9],复杂的食品基质对分析方法的干扰较大,而低浓度的致病菌产生的检测信号也较弱,导致无法满足高灵敏度检测的要求。为了提高检测灵敏度、缩短检测时间,迫切需要一种快速、有效的致病菌分离策略,配合现有检测手段实现致病菌的早期快速检测。近年来磁性纳米材料被广泛研究,由于磁性纳米粒子(Magnetic nanoparticles,MNPs)易修饰、生物相容性好、操作简单、响应快的优点[10−11],磁性纳米分离技术目前已成为食源性致病菌分离富集方法的研究热点,该方法可有效减少样品的预处理时间,减弱复杂食品基质对检测方法的干扰,极大提高了检测的效率和灵敏度。近年来,识别元件的发展为食源性致病菌新型快速检测方法的设计提供了新的方向,MNPs表面修饰的识别元件赋予了其特异性结合致病菌的能力,其特异性直接决定了功能化MNPs的结合效率[12]。本文主要介绍了磁性纳米分离技术、磁性纳米粒子与识别元件的偶联方式、识别元件的种类及结合检测手段的应用情况,为该领域的研究人员对食源性致病菌快速检测方法的开发提供参考。
1. 磁性纳米粒子与磁性纳米分离技术
纳米材料是指在三维空间中至少有一维处于纳米尺寸(1~100 nm)或由它们作为基本单元构成的材料,基于量子尺寸、表面效应等基本物理效应,纳米材料具备了高结合能力、优秀的分散性、强光学吸收等性能[13]。按照材料物性可分为纳米超导材料、纳米半导体、纳米磁性材料等,其中磁性纳米粒子是由磁性材料制备而成的纳米粒子,多种MNPs已广泛应用于分子诊断、食品药品安全检测、环境检测、生物医学等领域[14],MNPs的合成方法包括共沉淀、微乳液法和水热法等,常见构成材料有γ-Fe2O3、Fe3O4、CoFe2O4、MnFe2O4和CoPt3等,其中Fe3O4由于其超顺磁性及便宜的价格是最常见的选择。MNPs拥有纳米粒子的基本性质,另外拥有独特的磁效应。由于其良好的生物相容性、高饱和磁化强度、快速磁响应性、高捕获容量和选择性[15],近年在生物分离中得到了广泛的应用。
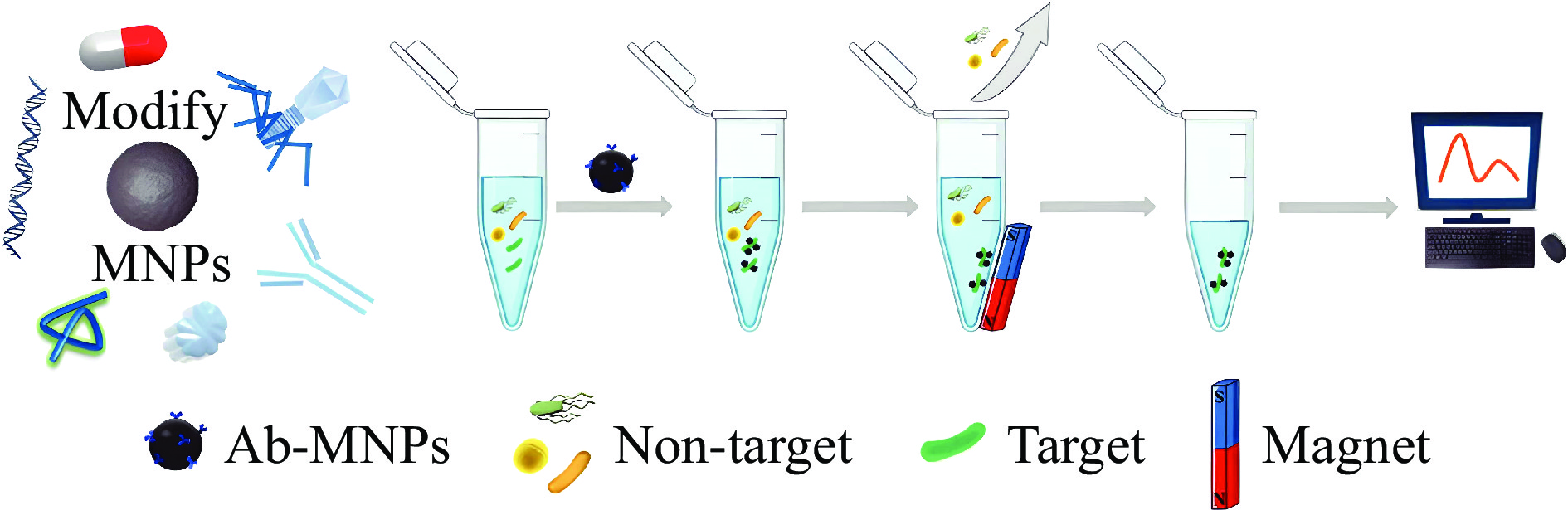
Guesdon等[16]在1977年第一次报道了磁性纳米分离技术,迄今为止已被广泛应用于各种生物分子的分离,包括核酸、蛋白等,在食源性致病菌分离领域已引起人们的关注。如图1所示,在经典静态磁分离过程中[17],将修饰有识别元件的MNPs添加到含有目标致病菌的样品溶液中,在共孵育过程中,对目标致病菌表现出高亲和力的识别因子与目标致病菌的表面结合,然后通过外部磁场将致病菌-MNPs磁性复合物于样品中分离出来,撤去磁场后将其重悬于小体积的溶液中,以达到分离富集的效果,捕获的目标致病菌可用于进一步的检测工作。
2. 磁性纳米粒子与识别元件的偶联方式
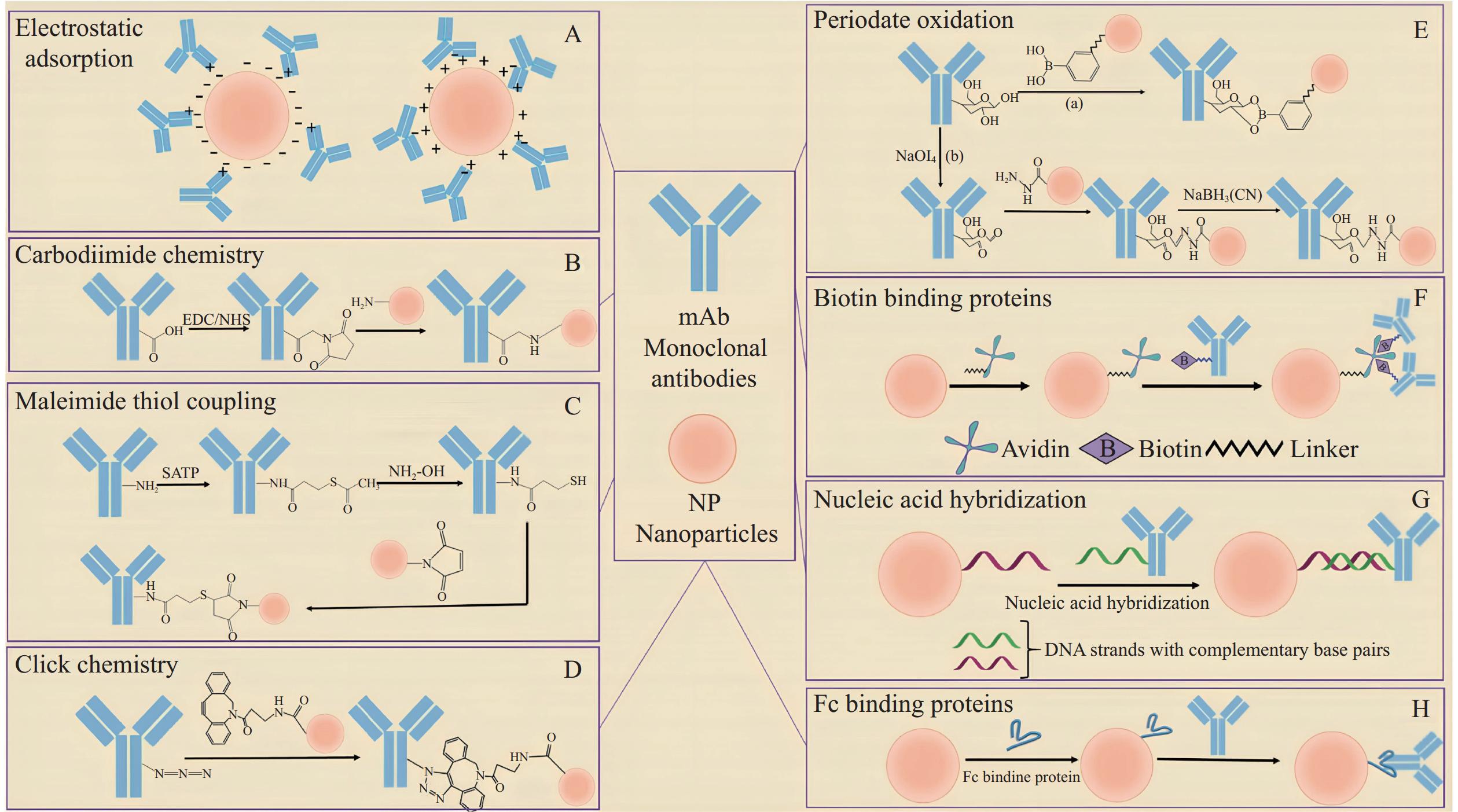
磁性纳米粒子与识别元件之间的偶联方式是影响识别元件固定及致病菌分离效率的关键因素之一。根据是否需要介导物,偶联方式可分为直接法和间接法[18],直接法指识别元件无需介导物直接与MNPs偶联,称为“刚性”连接,如物理吸附和化学共价偶联方式。间接法则指识别元件通过介导物与MNPs偶联,称为“柔性”连接,生物亲和作用是常见的介导方式。间接法较直接法提高了MNPs的负载量,减少了识别元件与靶标的空间位阻,更有利于两者的结合,但偶联步骤较为繁琐。抗体是应用最为广泛的一种识别元件,且偶联方式报道也较为全面,基本覆盖了其它类型识别元件的主要偶联方式,所以以抗体为例,介绍了其与MNPs之间常见的偶联方式,如图2所示。
2.1 物理吸附
物理吸附主要依靠疏水作用、静电作用等非共价作用力将识别元件偶联在MNPs上(图2A),这是一种直接偶联的方法,不涉及任何化学修饰,通过简单混合即可固定[19]。以往研究已有成功将物理吸附应用于抗体与MNPs的偶联中,如Chen等[20]将抗体加入MNPs溶液中,在室温下孵育,通过静电作用及疏水作用使抗体吸附在MNPs表面,开发了一款高灵敏度的免疫传感器。Huang等[21]利用静电作用将单克隆抗体与MNPs结合。物理吸附是最简便的偶联方法,但存在较多局限性,如MNPs表面的带电官能团会导致非特异性吸附,疏水作用可能会导致抗体三维结构改变而引起不可逆的变性,抗体与MNPs的偶联取向不固定且重复性较差等。
2.2 化学共价偶联
抗体和MNPs通过功能基团形成共价键进行偶联的方式称为化学共价偶联[22],常用的功能基团有羧基(-COOH)、氨基(-NH2)、巯基(-SH)等,大多数情况下,共价偶联直接利用抗体表面的基团,为了促进偶联效率,往往通过化学交联剂在MNPs表面引入特定基团或进行化学修饰。
氨基是抗体偶联的常用基团,其常用的偶联剂有戊二醛、N-羟基琥珀酰亚胺(N-Hydroxy succinimide, NHS)酯类等[23−24]。戊二醛的双醛基结构可作为氨基之间的交联剂,其优势在于成本低,但双醛中间体不稳定,偶联效率低,且易造成非特异性吸附。酰胺键偶联是较为稳定的方式,NHS酯类可在中性至弱碱条件下与氨基形成稳定的酰胺键,常配合碳二亚胺类化合物促进MNPs上的羧基与抗体上的氨基进行偶联[24]。碳二亚胺类化合物可活化羧基,促进酰胺键的生成,其中EDC使用较为广泛,EDC活化羧基的中间体O-酰基异脲不稳定,而NHS可将羧基转化为胺反应性NHS酯,达到稳定中间体,提高EDC偶联效率的作用[25](图2B)。目前酰胺键偶联中EDC-NHS的偶联方式较为普遍,然而局限在于EDC的残留可能会导致抗体自交联,且可能会导致抗体活性丧失,因为参与反应的氨基可能位于活性位点[26]。巯基可作为氨基的替代偶联基团。马来亚酰胺-巯基反应是经典通过巯基的偶联方式(图2C)。MNPs经马来亚酰胺修饰后,可与抗体上的巯基进行共价结合,其中抗体除自身的巯基基团外,还可通过试剂引入,如N-琥珀酰亚胺-S-乙酰巯基丙酸酯(N-Succinimidyl-S-acetylthiopropionate,SATP),这种方式对抗体的结构影响较小,能够最大限度保留抗体功能。虽然巯基较氨基在抗体中的位置相对固定,但偶联后抗体活性仍可能受到影响,定向修饰Fc区域可能是不影响抗体结合域的最佳偶联方式。抗体Fc区域存在的大量羰基化合物,MNPs可通过羰基与抗体进行偶联,如图2E是可能的两种方式,一种方法是用MNPs上连接的硼酸衍生物氧化抗体Fc区域内的糖基进行偶联[27]。另一种方法是用高碘酸钠氧化抗体的Fc区域,产生醛酮类羰基化合物,与酰肼类基团修饰的MNPs进行偶联[28]。除通过氧化Fc区域羰基实现定向偶联外,目前点击化学反应由于其高偶联效率,高程度的定向固定,已成为开发新型MNPs最有前途的定向偶联策略之一[29],叠氮-炔环加成是经典的点击化学反应,叠氮修饰的抗体可与炔环修饰的MNPs通过该反应进行偶联(图2D)。化学共价偶联较物理吸附先进,抗体取向一定程度上固定,且偶联更加牢固。但偶联步骤多,过程相对复杂,而且功能基团通常需要化学试剂活化,这可能会导致自交联或者非特异性吸附。
2.3 生物亲和作用
生物亲和作用是指蛋白或核酸等生物分子间特异结合的作用力。MNPs和抗体分别连接具有亲和作用的生物分子,通过介导可实现两者的间接连接。常见的介导方式有生物素-亲和素[30](Biotin-Avidin-System,BAS)、核酸杂交[31]和Fc结合蛋白[32]等。BAS是经典的间接偶联方式,特异性强、亲和力大,其中生物素可与大多数生物大分子结合,而每个亲和素表面的四个结合位点与生物素之间有极高的亲和力,且反应高度专一性[30](图2F),BAS的多结合位点使偶联不易受到空间阻碍的影响,所以对亲和素在MNPs表面的固定方向要求并不严格,而生物素化抗体的获得是影响BAS偶联的关键因素。在实际应用中,链霉亲和素(Streptavidin,SA)是良好的选择,因亲和素的等电点较高,有聚集和非特异性结合的趋势,可能导致偶联物的特异性降低[33]。核酸杂交技术具有高特异性的优势,可通过互补的碱基序列偶联MNPs和抗体[31](图2G)。Fc结合蛋白偶联的优点是Fab位点被释放,抗体结合活性得到较好保留,常见种类有蛋白A、蛋白G和Fc结合蛋白(FcγRs)等,它们对IgG的Fc区域具有不同程度的亲和力,可将其修饰在MNPs上用于IGg抗体的定向偶联[32](图2H)。生物偶联的优势在于特异性强、结合效率高,但存在步骤繁琐、制备难度高和成本高的问题。
3. 磁性纳米粒子的识别元件
磁性纳米粒子在致病菌分离应用中仅充当载体的作用,其表面偶联的识别元件是磁分离过程中的关键组分,在复杂的食品基质中,识别元件赋予了MNPs特异性识别目标致病菌而不结合其它组分的能力,通过识别元件的特异性结合,外加磁场对MNPs的回收,可分离富集目标致病菌并减少食品基质对检测的干扰,结合现有高灵敏度的检测技术,可实现对食源性致病菌早期的快速检测。目前已有广泛的研究将磁分离技术与高灵敏度检测技术结合,并对食源性致病菌达到了较好的检测效果,表1介绍了近年来识别元件的种类及结合检测技术应用的例子,并在表2中对各种识别元件的优势与劣势[17]进行了分析。
表 1 识别元件种类及结合检测技术在食源性致病菌检测中的应用Table 1. Application of recognition element types and combined detection techniques in the detection of foodborne pathogens识别
元件偶联
方式食物
基质致病菌 捕获率(%) 检测
技术检测
时间检出限
(CFU/mL)参考
文献抗体 EDC/NHS、BSA 生菜 单增李斯特菌 80 mPCR 7 h 10 [34] 抗体 MBP-SPG 牛奶 大肠杆菌O157:H7 90 PCR NR 10 [35] 抗体 EDC/NHS 鸭肉 沙门氏菌 95 LAMP 3 h 3 [36] 适配体 BSA 牛奶 鼠伤寒沙门氏菌 92 LFA 1.5 h 860 [37] 适配体 静电吸附 猪里脊肉 单增李斯特菌 91.1 LFA 3 h 100 [38] 适配体 EDC/NHS 牛奶/牛肉/生菜 沙门氏菌 88.6 比色法 1.5 h 8 [39] 噬菌体 BSA 肉汤 大肠杆菌 86.2 PCR 3 h 100 [40] 噬菌体 GSH-GST 牛奶/鸡汤 空肠弯曲杆菌 80 qPCR 3 h 100 [41] 噬菌体 EDC/NHS 牛奶/生菜/鸡肉 沙门氏菌 NR ELISA 1.5 h 10 [42] 氨苄西林 EDC/NHS 牛奶/猪肉/生菜 肠炎沙门氏菌 90 LFA 1 h 100 [43] 替考拉宁 EDC/NHS 果汁 金黄色葡萄球菌/蜡样芽胞杆菌 80 mPCR 4 h 10 [44] 万古霉素 BSA 果汁 金黄色葡萄球菌 NR RCA 5 h 330 [45] 刀豆凝集素 EDC/NHS 瓶装矿泉水 大肠杆菌O157:H7 NR FCM 4 h 6 [46] 胚芽凝集素 EDC/NHS 橙汁/包菜/河水 铜绿假单胞菌/鼠伤寒沙门氏菌 81.64 LFA 35 min 30 [47] 胚芽凝集素 EDC/NHS、BSA 橙汁/生菜 金黄色葡萄球菌/单增李斯特菌 94.39 SERS 15 min 3 [48] 注:NR未报道;麦芽糖结合蛋白-链球菌蛋白G(Maltose binding protein-Streptococcal protein G,MBP-SPG);谷胱甘肽-谷胱甘肽S转移酶(Glutathione-Glutathione S transferase,GSH-GST);多重PCR(Multiplex polymerase chain reaction,mPCR);环介导等温扩增(Loop-mediated isothermal amplification,LAMP);实时荧光定量PCR(Quantitative real-time PCR,qPCR);滚环扩增(Rolling circle amplification,RCA);流式细胞术(Flow cytometry,FCM)。 表 2 磁性纳米粒子识别元件的优势与劣势Table 2. Advantages and disadvantages of magnetic nanoparticle recognition elements3.1 抗体
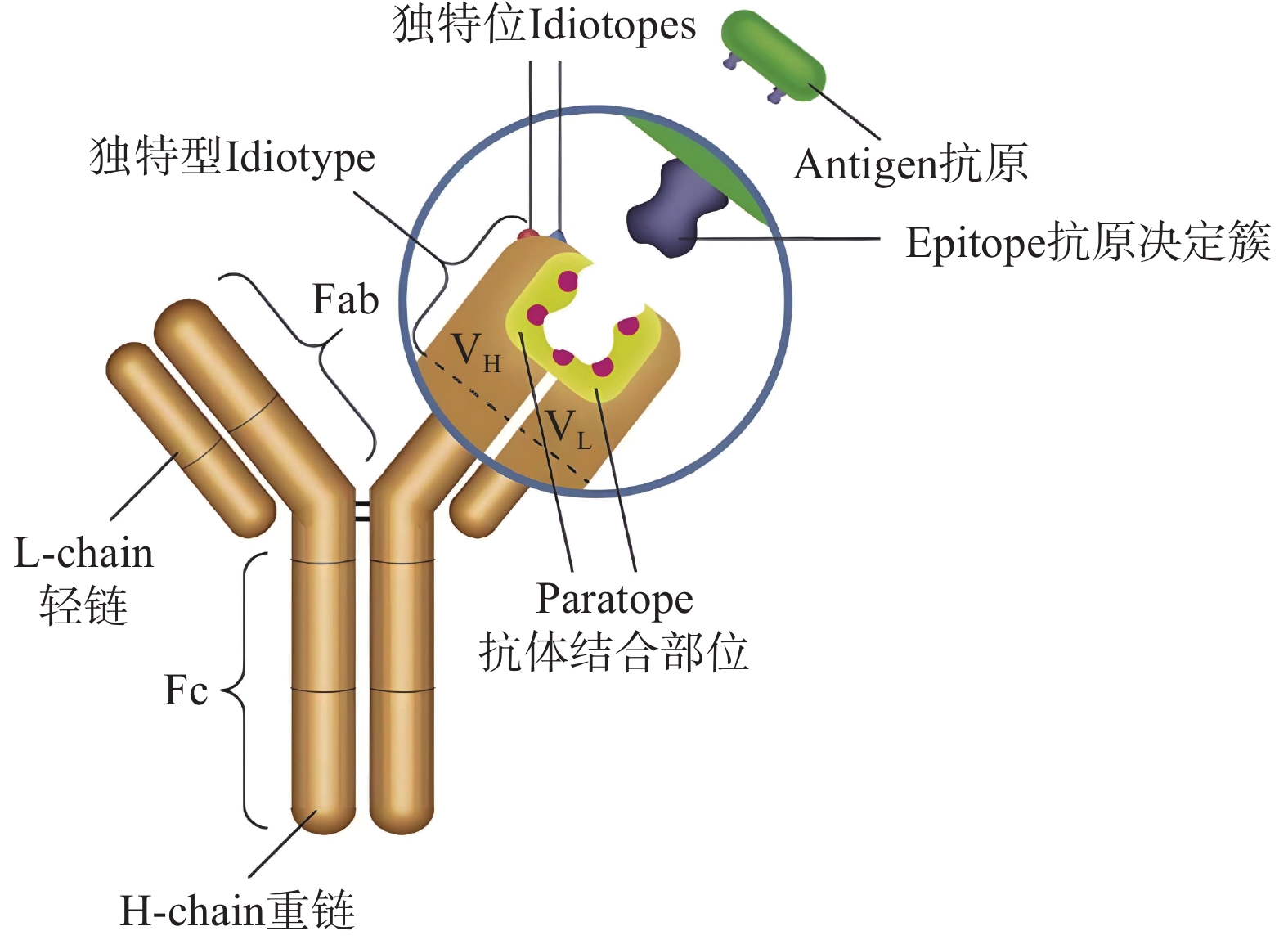
抗体是生物机体受到抗原刺激后,通过免疫应答产生的特殊蛋白质,在结构上能与抗原进行互补,具有与抗原特异结合的能力[54]。除单链抗体外,几乎所有的抗体都呈现“Y”形结构(图3),其顶部的Fab区域为可变区,是抗原结合片段,决定了抗体的特异性,底部的Fc区域为恒定区,序列较为保守[55]。将特异性抗体修饰在MNPs表面,基于抗原-抗体的特异性结合,外加磁场回收MNPs,达到分离富集样本中致病菌的目的,该技术称为免疫磁分离技术[56]。
物理吸附和化学共价偶联已被广泛应用于制备免疫MNPs,然而存在一些问题,如抗体的随机定向固定、化学物质残留导致的非特异性吸附和自交联等。其中抗体的随机定向可能导致识别活性的丧失,高度定向固定抗体的方法可以最大限度地保留抗体的结合能力。抗体理想的固定方式是通过Fc区域固定于MNPs表面,不影响Fab区域与抗原的结合。链球菌蛋白G(Streptococcus protein G,SPG)由于具有特异结合Fc区域的能力,在定向固定抗体方面有着巨大的潜力。Lim等[35]通过麦芽糖结合蛋白-链球菌蛋白G(MBP-SPG)将抗大肠杆菌O157的抗体定向固定在直链淀粉磁珠(AMBs)表面,无需任何物理或化学处理。其中MBP由于对AMBs中麦芽糖的固有亲和力而与其表面结合,与MBP融合的SPG对抗体的Fc区具有特异性亲和力,从而通过MBP-SPG融合蛋白实现了抗体在AMBs表面的定向固定。制备的免疫AMBs可有效地从市售牛奶样品中分离并浓缩目标细菌,对大肠杆菌O157的捕获率达到了90%,与PCR检测手段结合,检出限为10 CFU/mL。除抗体的高度定向化方式,还可通过改变分离策略来提高对致病菌的捕获率。IMS分离通常采用抗体修饰的MNPs直接投入样品进行致病菌的锚定,即“一步法”,如上述Lim等[35]所开发的方法。目前有研究发现采用“两步法”对致病菌的捕获率更高,即投入游离抗体锚定致病菌后,再通过MNPs回收抗体-致病菌复合物。如Li等[57]采用的“两步法”分离策略,该策略首先将生物素-抗单增李斯特菌的抗体复合物注射到含有单增李斯特菌的样本中,然后加入修饰有链霉亲和素的MNPs,通过生物素-亲和素之间的高亲和力来回收生物素-抗体-单增李斯特菌复合物,较将抗体直接固定在MNPs表面的“一步法”分离策略[58]相比,“两步法”分离策略的致病菌捕获效率更高,且相同捕获效率下该策略的抗体用量减少了10倍,这可能是由于游离抗体比固定抗体更容易结合抗原[59],同时也侧面反映了抗体的固定会影响其与抗原的结合效率。该“两步法”分离策略用于分离生菜样品中的单增李斯特菌,当菌体浓度为105 CFU/mL时捕获率达85%,结合核酸侧流(NALF)生物传感器,在PBS中的单增李斯特菌检出限为3.5×103 CFU/mL,生菜样本中的检出限为3.5×104 CFU/g,整个检测流程可在6 h内完成。免疫磁珠的粒径同样是影响食源性致病菌捕获效率的一个重要因素,小粒径磁珠的空间位阻更小,比表面积更大,分散性更好,容易大量结合在致病菌表面,从而提高捕获效率;Chen等[60]研究了不同粒径的免疫磁珠从PBS、鸡肉冲洗液以及蛋清液中捕获肠炎沙门氏菌,比较了捕获率和非特异性结合率,结果显示,纳米级MNPs的捕获率显著优于微米级MNPs,并且受食品基质的干扰程度更小。
基于抗体-抗原反应的高特异性,IMS已广泛应用于食源性致病菌的分离。但存在一些局限性,如抗体生产多为动物来源,成本高、制备繁琐,还可能存在抗原交叉反应性,造成非特异性吸附,而且抗体对pH、温度等环境条件敏感,稳定性差,这些限制了抗体作为识别元件在食源性致病菌分离领域的发展。
3.2 适配体
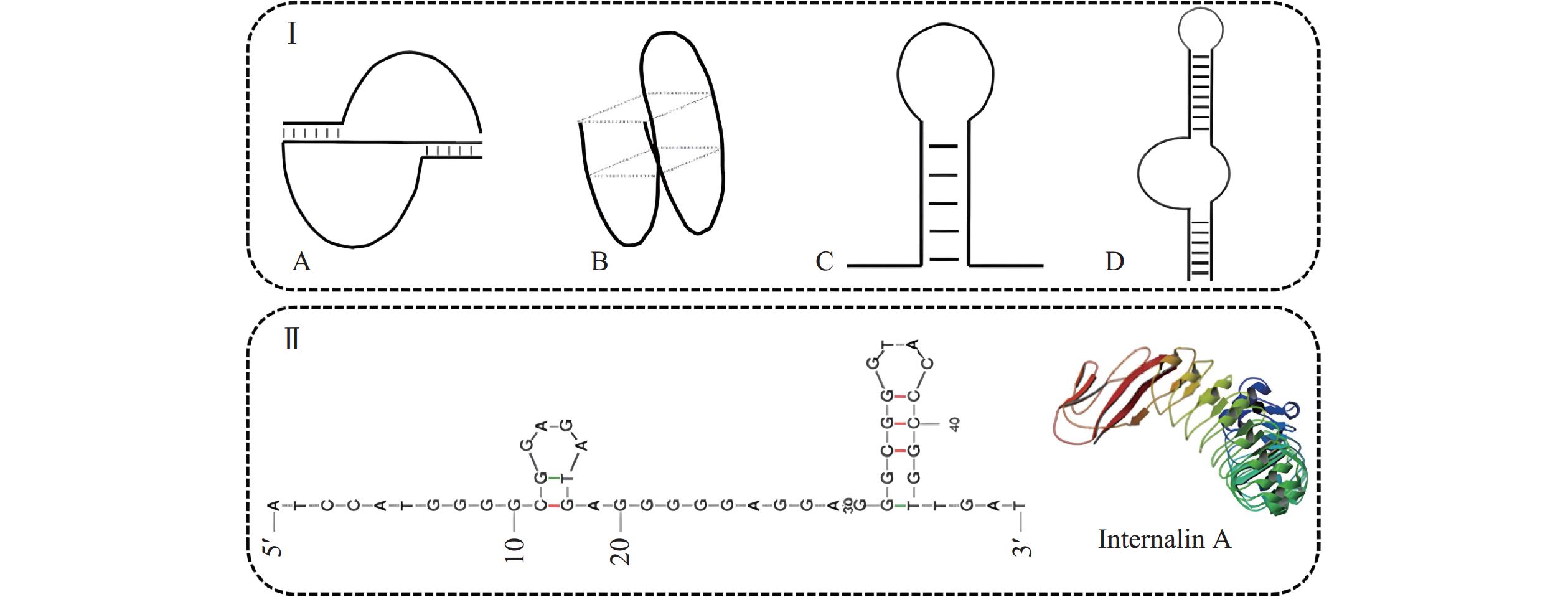
适配体是通过体外筛选程序-指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)从随机序列库中筛选出的对给定目标具有高亲和力的序列,这种序列通常是单链DNA/RNA,能够靶向与目标物高效、特异性结合[50],给定目标可以是一个或多个特定的细胞表面靶点,比如一种特定的抗原。适配体与靶标的特异性结合依赖于其独特的三维构型,通常用于DNA/RNA适配体的四个最显著构象包括假结、G-四链体、发夹和茎环凸起[61](图4),如Ohk等[62]设计的双发夹47-mer DNA适配体,能够用于特异性结合单增李斯特菌特有的毒力因子内化素A(Internalin A,InlA)。
基于适配体-MNPs的生物传感器易于使用、响应速度快、生物相容性好,使其成为个体化医疗、疾病标志物检测、食品安全等领域的理想选择。近年来,MNPs偶联适配体用于致病菌检测传感器的研究被广泛报道[63]。Du等[38]基于适配体开发了一种用于灵敏、特异性检测猪里脊肉中单增生李斯特菌的荧光试纸传感器,通过适配体功能化MNPs的分离富集作用,并在此基础上搭配PCR进行双重识别和信号放大,最终该荧光试纸传感器可在1.0×102~1.9×108 CFU/mL范围内获得良好的线性曲线,检测限为1.0×102 CFU/mL,可不通过増菌富集培养在3 h内完成检测,已成功应用于猪里脊肉中单增生李斯特菌的检测,回收率为91.1%~97.1%。Wang等[39]将适配体通过EDC/NHS共轭于双功能组氨酸修饰的磁性杂化纳米酶(His-Fe3O4@Cu)上用作捕获探针和信号放大器,开发了一种简单的用于鼠伤寒沙门氏菌检测的比色适配体传感器,与Fe3O4构成的MNPs相比,His-Fe3O4@Cu的类过氧化物酶活性提高了5倍,并表现出超顺磁性,在牛奶、牛肉、生菜中对鼠伤寒沙门氏菌的捕获率为88.6%~96.5%,检测限为8 CFU/mL,线性范围为1.2×101~1.2×106 CFU/mL,可在90 min内完成检测。
与传统的抗体相比,适配体作为识别元件稳定性更高,不易受到pH、温度等环境因素的干扰,制备工艺成熟,避免了动物实验的伦理问题,且高亲和力可与抗原-抗体反应相媲美[64],有望取代ELASA反应,成为有力的分子探测工具。但目前适配体仍存在一些局限性,首先SELEX体外筛选程序较为复杂,技术不成熟,导致适配体的筛选效率低,目前筛选出高亲和力和高特异性的适配体难度较大,同时存在合成需要昂贵的仪器,易被核酸酶降解的问题。与抗体相比,适配体的商业应用还有很长的路要走。
3.3 噬菌体
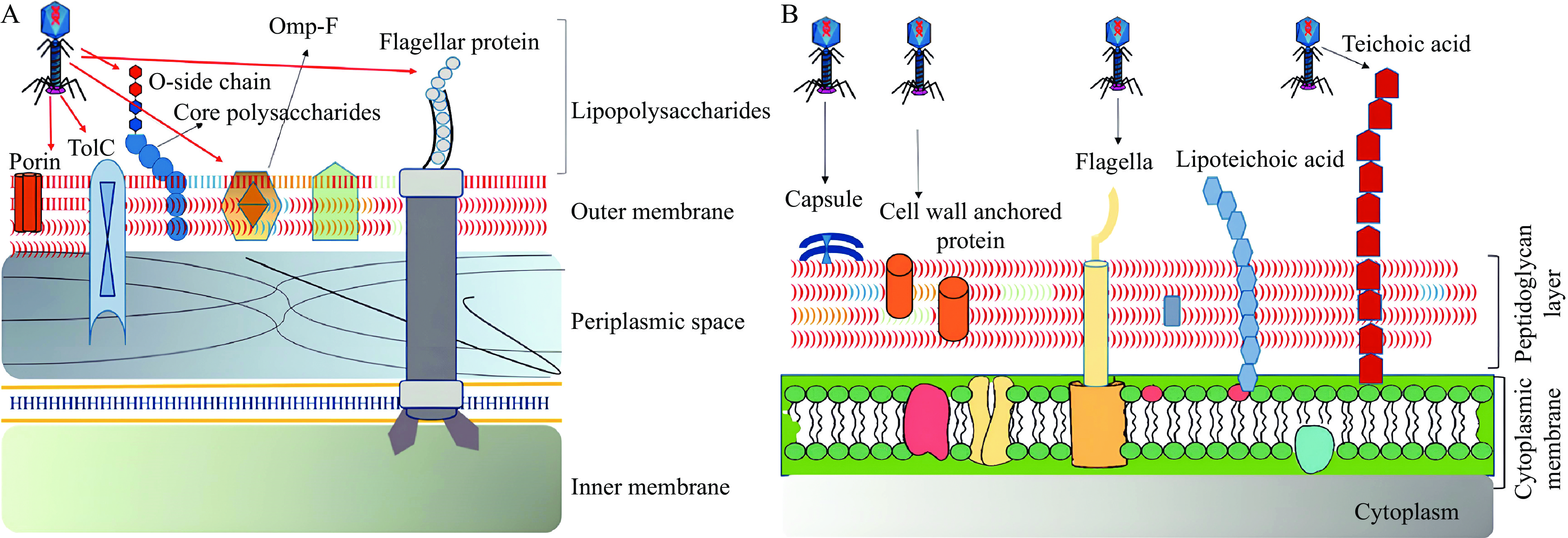
噬菌体是一种广泛存在的纳米结构病毒,它可以特异性地识别和感染宿主菌株,并利用宿主产生子代噬菌体颗粒,具有严格宿主特异性[65],如T2噬菌体的专一宿主为大肠杆菌。噬菌体通过其尾部刺突蛋白(RBPs)识别并结合宿主,RBPs对革兰氏阴性和革兰氏阳性细菌表面受体(脂多糖、外膜蛋白、磷壁酸)的识别表现出较强的特异性[66](图5)。因识别宿主作用的RBPs位于噬菌体尾部,所以在噬菌体与MNPs表面偶联时应注意使用噬菌体的头部进行固定,释放噬菌体尾部用于结合受体。
噬菌体与宿主识别具有高度特异性,因此噬菌体可修饰于MNPs表面用于特异性分离目标致病菌,并结合检测手段用于食源性致病菌的快速检测,目前已有研究取得了较好的检测效果。Janczuk等[67]将MNPs表面的羧基与T4噬菌体头部的氨基通过EDC介导形成酰胺键,实现了T4噬菌体在MNPs表面的头部定向固定,利用T4噬菌体对外膜蛋白(OmpC)和脂多糖(LPS)的自然亲和力,特异性分离大肠杆菌,改造的T4噬菌体-MNPs在3.3×104 CFU/mL的样本中对大肠杆菌捕获率超过90%,最佳捕获时间为15 min,并选择流式细胞术作为检测方法,检测限约为104 CFU/mL。Poshtiban等[41]将基于噬菌体受体结合蛋白(RBPs)的磁分离技术与实时荧光PCR结合,用于检测污染牛奶和鸡汤中的空肠弯曲菌,通过实时PCR荧光评估,在实际样本中最低检出限为102 CFU/mL,回收率大于80%,该方法无需通过培养进行费时的预富集步骤,样品制备和分析的总时间少于3 h。上述研究展示了噬菌体偶联MNPs在食源性致病菌检测中实际应用的广阔前景。
近年来,由于噬菌体对宿主识别的高度特异性,并克服了抗体的一些局限性,如稳定性提高、对蛋白酶不敏感、易于生产,这些优势使噬菌体有潜力成为食源性致病菌分离富集领域中能够替代抗体的识别元件,但是噬菌体作为识别元件的研究内容较少,技术不成熟,在食源性致病菌分离领域的应用有待进一步的研究。
3.4 抗生素
抗生素是生物分泌的一类能够抵抗病原体的次级代谢物,在医学上常被用于预防和治疗细菌感染,糖肽类、环脂肽类和β-内酰胺类的抗生素通过攻击病原体的细胞膜和细胞壁而表现出抗菌作用[59]。抗生素与细菌结合具有特异性,如β-内酰胺类抗生素(如氨苄西林、头孢菌素和头孢霉素)可以识别细菌表面的青霉素结合蛋白,并通过共价键结合[68]。此外,抗生素还含有丰富的基团,可通过碳二亚胺反应或生物素-亲和素系统稳定地修饰到MNPs的表面,因此作为识别因子在食源性致病菌靶向分离领域已被广泛研究。
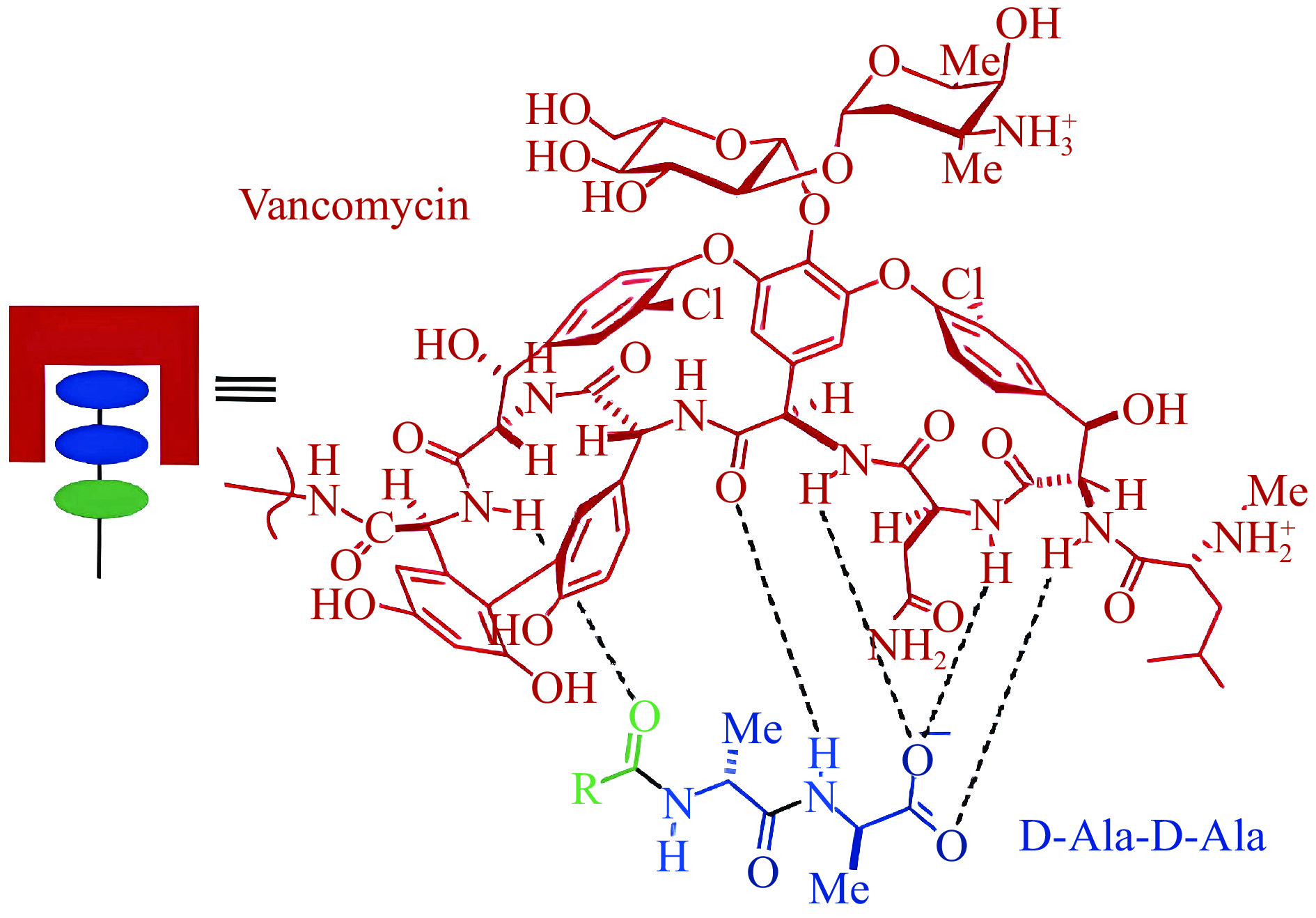
糖肽类抗生素(如万古霉素、替考拉宁等)可以识别革兰氏阳性菌细胞壁上的D-Ala-D-Ala分子(图6),并通过氢键结合来抑制细胞壁的合成,从而抑制细菌生长[69]。Wang等[45]利用生物素-亲和素系统(BAS)将万古霉素偶联于MNPs表面,结合磁分离技术和滚环扩增PCR技术实现了对金黄色葡萄球菌的富集和特异性检测,该方法对果汁中金黄色葡萄球菌的检出限为3.3×102 CFU/mL。抗生素可以识别一类细菌,因此基于抗生素的磁分离策略可能更适用于可疑样本的大规模筛查,并结合多特异性检测方法,实现短时间、多目标同时检测。Bai等[44]制备了替考拉宁修饰的MNPs,将其与多重PCR相结合,可高灵敏度和特异性检测果汁样品中的蜡状芽孢杆菌和金黄色葡萄球菌,这两种细菌在果汁中的捕获率大于80%,检出限低至10 CFU/mL,整个检测流程在4 h内完成。在Ca2+存在下,环脂肽类抗生素(如达托霉素)将其疏水尾部插入革兰氏阳性细菌的细胞膜中,导致K+外流,改变细胞膜的通透性,从而导致细菌死亡。基于其独特的机制,达托霉素可作为捕获革兰氏阳性菌的识别剂。Wang等[70]基于达托霉素作为识别剂功能化MNPs的策略,开发了一种生物发光方法,用于快速检测革兰氏阳性菌。达托霉素-MNPs捕获的细菌用十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium bromide,CTAB)溶液裂解,然后针对细胞裂解释放的三磷酸腺苷(Adenosine triphosphate,ATP)进行生物发光检测。该方法可检测四种革兰氏阳性菌,包括金黄色葡萄球菌、变形链球菌、枯草芽孢杆菌和金黄色葡萄球菌,可在1.0×102~3.0×106 CFU/mL的范围内取得良好的线性,检出限为33 CFU/mL,整个检测过程在20 min内完成,已成功应用于量化奶酪、牛奶中革兰氏阳性菌的数量。
抗生素具有性能稳定、易获得、易修饰等优点,与昂贵和不稳定的抗体和适配体等识别因子相比,抗生素更便宜,并具有更好的批间一致性,其作为一种广谱识别元件,在磁分离技术中得到了广泛的应用,但是抗生素滥用导致越来越多耐药细菌的出现给其应用带来了一些挑战。
3.5 凝集素
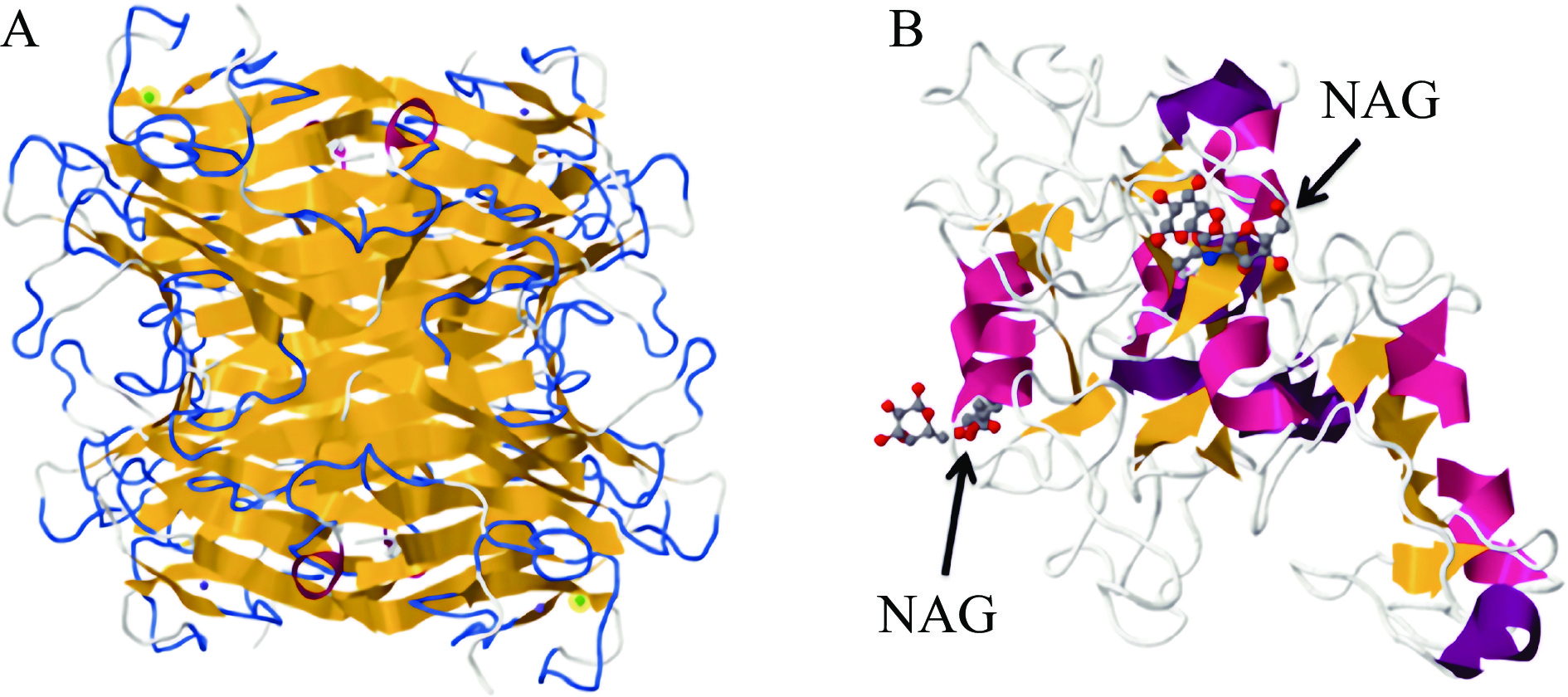
凝集素是一类各种动植物细胞分泌的特殊蛋白质,其表面含有糖类特异性识别位点,可通过氢键、静电相互作用、疏水相互作用等非共价键作用与细胞表面的糖类碳脂化合物决定簇特异性结合[72],在细胞增殖、吸附、识别和免疫中起着重要作用。凝集素包含一个或多个碳水化合物识别域(CRDs),而CRDs的结构决定了特异性,保证了其只能与特定的糖基结合,如刀豆蛋白A(Concanavalin A,Con A)和α-D-甘露聚糖和α-D-葡萄糖专一结合、小麦胚芽凝集素(Wheat germ agglutinin,WGA)和N-乙酰氨基葡萄糖(NAG)专一结合,图7展示了两种凝集素的晶体结构与相应的CRDs。
由于细菌表面富含糖类,如肽聚糖和脂多糖等,这使得凝集素可以作为细菌间的生物识别元件,另外,凝集素具有多价结合能力,能修饰于纳米粒子、胶体金、生物素等物质表面,用于分离或示踪等作用[73]。所以凝集素可作为识别元件修饰于MNPs表面用于特定食源性致病菌的分离。其中Con A和WGA是应用较为广泛的两种凝集素,He等[46]利用Con A修饰MNPs,结合基于荧光二氧化硅纳米颗粒的双色流式细胞术,开发了一种快速、灵敏的大肠杆菌O157:H7检测策略,首先菌体被Con A-MNPs捕获并回收富集,其次利用荧光二氧化硅纳米颗粒和核酸染料SYBR Green I进行双重标记并染色,最后使用双色流式细胞术分析测定富集的大肠杆菌O157:H7,磁分离的富集作用和双重标记的信号放大作用提高了检测灵敏度,该测定法在污染水源中的检出限低至6 CFU/mL,菌体富集及检测在内的总分析时间少于4 h。Yang等[74]开发了一种用于金黄色葡萄球菌分离的WGA两步磁分离方法,并设计了三种检测策略。该研究通过聚乙二醇介导将链霉亲和素修饰于MNPs表面,用于回收溶液中的亲和素-抗体-金黄色葡萄球菌复合物,检测采用了Baird-Parker培养、PCR测定及比色测定三种策略,Baird-Parker培养方法可在15 h内检测金黄色葡萄球菌,检测限为3×100 CFU/mL;PCR测定方法可在4 h内完成,检测限为3×102 CFU/mL;比色法的检测限为3×105 CFU/mL,检测时间为2 h。结合具体的检测方法,可以满足快速检测金黄色葡萄球菌的不同需求。
基于凝集素的磁分离策略是通过结合细菌上的特异性糖基,而这种糖基往往在多种细菌上同时存在,如α-D-甘露聚糖、N-乙酰氨基葡萄糖等。这意味着基于凝集素的磁分离策略是广谱的,可以识别多种细菌,这与抗生素一致,但较抗生素而言,凝集素避免了因药物滥用导致“超级细菌”产生的风险。虽然凝集素相较于抗体、适配体的特异性和亲和性较低,但凝集素修饰的MNPs具备了多种致病菌同时检测的潜力,可根据应用情况选择合适的识别元件。
4. 总结与展望
本文综述了磁性纳米分离技术、磁性纳米粒子与识别元件的偶联方式、识别元件的种类及结合检测手段的应用情况。磁性纳米分离技术可通过偶联在其表面的识别元件特异性吸附致病菌,对致病菌进行有效的分离富集,还能减少食品中其他杂质对后续检测的干扰。多种识别元件可修饰磁性纳米粒子并赋予其在食品基质中特异性吸附目标菌的能力,如抗体、适配体、抗生素、凝集素、噬菌体等,它们对食品基质中的致病菌表现出了较高的捕获率,并与高灵敏度检测手段结合达到了较低的检出限,识别元件修饰的磁性纳米粒子展现了其在未来食源性致病菌快速检测领域的潜力。但是各种识别元件在实际应用中仍存在较多局限,如抗体存在成本高、稳定性差等问题,适配体筛选程序复杂、存在被核酸酶降解的风险。抗生素、凝集素适合广谱筛选,但亲和力、特异性不足。噬菌体作为识别元件的研究内容较少,技术不成熟。食品种类繁多,成分差异大,存在碳水化合物干扰分离效率的问题。纳米磁分离技术近年来发展迅速,其未来可能的发展方向有:a.食品污染往往包含多种致病菌,发展广谱磁分离结合多靶点特异性检测的方式,在短时间内高灵敏度的同时分离和检测多种病原体是未来发展的重要方向。b.致病菌的捕获、分离、检测集中在小型便携式一体化装置中已逐渐发展,将有利于缩短分析时间,简化程序,更加适合产品监管部门现场分析食源性病原菌。c.在磁性纳米粒子分离食源性致病菌领域有望处理大体积的样本,可进一步降低检出限,避免因分离小体积样本导致菌体含量不足而漏检的情况。在食品安全事件频发的今天,快速检测食品中的早期致病菌已成为一种趋势,磁性纳米分离技术结合检测手段具有灵敏度高、检测时间短、操作简单等优点,在食品卫生、环境监测、临床诊断和药品安全等方面具有广阔的应用前景。
-
表 1 识别元件种类及结合检测技术在食源性致病菌检测中的应用
Table 1 Application of recognition element types and combined detection techniques in the detection of foodborne pathogens
识别
元件偶联
方式食物
基质致病菌 捕获率(%) 检测
技术检测
时间检出限
(CFU/mL)参考
文献抗体 EDC/NHS、BSA 生菜 单增李斯特菌 80 mPCR 7 h 10 [34] 抗体 MBP-SPG 牛奶 大肠杆菌O157:H7 90 PCR NR 10 [35] 抗体 EDC/NHS 鸭肉 沙门氏菌 95 LAMP 3 h 3 [36] 适配体 BSA 牛奶 鼠伤寒沙门氏菌 92 LFA 1.5 h 860 [37] 适配体 静电吸附 猪里脊肉 单增李斯特菌 91.1 LFA 3 h 100 [38] 适配体 EDC/NHS 牛奶/牛肉/生菜 沙门氏菌 88.6 比色法 1.5 h 8 [39] 噬菌体 BSA 肉汤 大肠杆菌 86.2 PCR 3 h 100 [40] 噬菌体 GSH-GST 牛奶/鸡汤 空肠弯曲杆菌 80 qPCR 3 h 100 [41] 噬菌体 EDC/NHS 牛奶/生菜/鸡肉 沙门氏菌 NR ELISA 1.5 h 10 [42] 氨苄西林 EDC/NHS 牛奶/猪肉/生菜 肠炎沙门氏菌 90 LFA 1 h 100 [43] 替考拉宁 EDC/NHS 果汁 金黄色葡萄球菌/蜡样芽胞杆菌 80 mPCR 4 h 10 [44] 万古霉素 BSA 果汁 金黄色葡萄球菌 NR RCA 5 h 330 [45] 刀豆凝集素 EDC/NHS 瓶装矿泉水 大肠杆菌O157:H7 NR FCM 4 h 6 [46] 胚芽凝集素 EDC/NHS 橙汁/包菜/河水 铜绿假单胞菌/鼠伤寒沙门氏菌 81.64 LFA 35 min 30 [47] 胚芽凝集素 EDC/NHS、BSA 橙汁/生菜 金黄色葡萄球菌/单增李斯特菌 94.39 SERS 15 min 3 [48] 注:NR未报道;麦芽糖结合蛋白-链球菌蛋白G(Maltose binding protein-Streptococcal protein G,MBP-SPG);谷胱甘肽-谷胱甘肽S转移酶(Glutathione-Glutathione S transferase,GSH-GST);多重PCR(Multiplex polymerase chain reaction,mPCR);环介导等温扩增(Loop-mediated isothermal amplification,LAMP);实时荧光定量PCR(Quantitative real-time PCR,qPCR);滚环扩增(Rolling circle amplification,RCA);流式细胞术(Flow cytometry,FCM)。 表 2 磁性纳米粒子识别元件的优势与劣势
Table 2 Advantages and disadvantages of magnetic nanoparticle recognition elements
-
[1] BLACKBURN C. Foodborne pathogens:Hazards, risk analysis and control[J]. Foodborne Pathogens Hazards Risk Analysis & Control,2009,85(1):131−133.
[2] SUN F, YAO M, SU H, et al. A magnetic fluorescent spirochetes micromotor:Dynamic monitoring and in situ sterilization of foodborne pathogens[J]. Sensors and Actuators B:Chemical,2023,385(15):133679.
[3] 刘耀, 魏元苗, 李玲, 等. 食源性致病菌溯源分型技术研究进展[J]. 食品工业科技,2022,43(12):427−437. [LIU Y, WEI Y M, LI L, et al. Advances in traceability and typing of foodborne pathogenic bacteria[J]. Science and Technology of Food Industry,2022,43(12):427−437.] LIU Y, WEI Y M, LI L, et al. Advances in traceability and typing of foodborne pathogenic bacteria[J]. Science and Technology of Food Industry, 2022, 43(12): 427−437.
[4] ORGANIZATION W H. WHO estimates of the global burden of foodborne diseases:Foodborne disease burden epidemiology reference group 2007–2015[J]. ISBN,2017,978(92):4.
[5] GE H, WANG Y, ZHAO X. Research on the drug resistance mechanism of foodborne pathogens[J]. Microbial Pathogenesis,2022,162:105306. doi: 10.1016/j.micpath.2021.105306
[6] GHATAK S. Strategies for elimination of foodborne pathogens, their influensive detection techniques and drawbacks[J]. Meat Quality Analysis,2020,15:267−286.
[7] 王俊韵, 沈静雯, 陆利霞, 等. 食源性病原菌的富集与检测复合技术研究进展[J]. 食品工业科技,2021,42(11):348−355. [WANG J Y, SHEN J W, LU L X, et al. Research progress in composite technologies for enrichment and detection of foodborne pathogens[J]. Science and Technology of Food Industry,2021,42(11):348−355.] WANG J Y, SHEN J W, LU L X, et al. Research progress in composite technologies for enrichment and detection of foodborne pathogens[J]. Science and Technology of Food Industry, 2021, 42(11): 348−355.
[8] 丁博群, 刘珊娜. 荧光定量PCR技术在食品快速检测中的应用[J]. 食品工业科技,2021,42(7):366−373. [DING B Q, LIU S N. Application of fluorescence quantitative PCR technology in rapid food detection[J]. Science and Technology of Food Industry,2021,42(7):366−373.] DING B Q, LIU S N. Application of fluorescence quantitative PCR technology in rapid food detection[J]. Science and Technology of Food Industry, 2021, 42(7): 366−373.
[9] ŠVARC P L, JENSEN M B, LANGWAGEN M, et al. Nutrient content in plant-based protein products intended for food composition databases[J]. Journal of Food Composition and Analysis,2022,106:104332. doi: 10.1016/j.jfca.2021.104332
[10] YILMAZ E, SARP G, UZCAN F, et al. Application of magnetic nanomaterials in bioanalysis[J]. Talanta,2021,229:122285. doi: 10.1016/j.talanta.2021.122285
[11] 吴鸿敏, 傅骏青, 王文特, 等. 纳米材料电化学传感器在食品检测中的应用[J]. 食品安全质量检测学报,2020,11(14):4708−4713. [WU H M, FU J Q, WANG W T, et al. Application of nanomaterial electrochemical sensors in food detection[J]. Journal of Food Safety and Quality Inspection,2020,11(14):4708−4713.] WU H M, FU J Q, WANG W T, et al. Application of nanomaterial electrochemical sensors in food detection[J]. Journal of Food Safety and Quality Inspection, 2020, 11(14): 4708−4713.
[12] 曹潇, 赵力超, 陈洵, 等. 免疫磁分离技术在食源性致病菌快速检测中的研究进展[J]. 食品科学,2019,40(15):338−345. [CAO X, ZHAO L C, CHEN X, et al. Research progress of immunomagnetic separation technology in rapid detection of foodborne pathogenic bacteria[J]. Food Science,2019,40(15):338−345.] CAO X, ZHAO L C, CHEN X, et al. Research progress of immunomagnetic separation technology in rapid detection of foodborne pathogenic bacteria[J]. Food Science, 2019, 40(15): 338−345.
[13] 左佳盛, 秦颖, 赵祖珍, 等. 医用纳米金属及其氧化物的制备、性能与抗菌应用研究进展[J]. 生物工程学报,2023,39(4):1462−1476. [ZUO J S, QIN Y, ZHAO Z Z, et al. Advances in the preparation, properties and antibacterial applications of medical nanometals and their oxides[J]. Journal of Biological Engineering,2023,39(4):1462−1476.] ZUO J S, QIN Y, ZHAO Z Z, et al. Advances in the preparation, properties and antibacterial applications of medical nanometals and their oxides[J]. Journal of Biological Engineering, 2023, 39(4): 1462−1476.
[14] MA Y, CHEN T, IQBAL M Z, et al. Applications of magnetic materials separation in biological nanomedicine[J]. Electrophoresis,2019,40(16-17):2011−2028. doi: 10.1002/elps.201800401
[15] YANG Q, DONG Y, QIU Y, et al. Design of functional magnetic nanocomposites for bioseparation[J]. Colloids and Surfaces B:Biointerfaces,2020,191:111014. doi: 10.1016/j.colsurfb.2020.111014
[16] GUESDON J L, AVRAMEAS S. Magnetic solid phase enzyme-immunoassay[J]. Immunochemistry,1977,14(6):443−447. doi: 10.1016/0019-2791(77)90170-7
[17] KANG Y, SHI S, SUN H, et al. Magnetic nanoseparation technology for efficient control of microorganisms and toxins in foods:A review[J]. Journal of Agricultural and Food Chemistry,2022,70(51):16050−16068. doi: 10.1021/acs.jafc.2c07132
[18] 王钰童, 李晖, 杨国泰, 等. 基于识别分子的磁分离技术在食源性致病菌分离中应用[J]. 化学通报,2019(1):27−31. [WANG Y T, LI H, YANG G T, et al. Application of magnetic separation technology based on recognition molecules in the separation of foodborne pathogens[J]. Chemical Bulletin,2019(1):27−31.] WANG Y T, LI H, YANG G T, et al. Application of magnetic separation technology based on recognition molecules in the separation of foodborne pathogens[J]. Chemical Bulletin, 2019(1): 27−31.
[19] OLIVEIRA J P, PRADO A R, KEIJOK W J, et al. Impact of conjugation strategies for targeting of antibodies in gold nanoparticles for ultrasensitive detection of 17β-estradiol[J]. Scientific reports,2019,9(1):13859. doi: 10.1038/s41598-019-50424-5
[20] CHEN Z P, PENG Z F, ZHANG P, et al. A sensitive immunosensor using colloidal gold as electrochemical label[J]. Talanta,2007,72(5):1800−1804. doi: 10.1016/j.talanta.2007.02.020
[21] HUANG X, EL-SAYED I H, QIAN W, et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J]. Journal of the American Chemical Society,2006,128(6):2115−2120. doi: 10.1021/ja057254a
[22] SIVARAM A J, WARDIANA A, HOWARD C B, et al. Recent advances in the generation of antibody–nanomaterial conjugates[J]. Advanced Healthcare Materials,2018,7(1):1700607. doi: 10.1002/adhm.201700607
[23] LIU D M, CHEN J, SHI Y P. Tyrosinase immobilization on aminated magnetic nanoparticles by physical adsorption combined with covalent crosslinking with improved catalytic activity, reusability and storage stability[J]. Analytica Chimica Acta,2018,1006:90−98. doi: 10.1016/j.aca.2017.12.022
[24] BARRE A, ŢÎNŢAŞ M L, LEVACHER V, et al. An overview of the synthesis of highly versatile N-hydroxysuccinimide esters[J]. Synthesis,2017,49(3):472−483.
[25] SAHA A, BEN H H, SAINI A, et al. Magnetic nanoparticles fishing for biomarkers in artificial saliva[J]. Molecules,2020,25(17):3968. doi: 10.3390/molecules25173968
[26] WANG P, ZHU X, YUAN J, et al. Grafting of tyrosine-containing peptide onto silk fibroin membrane for improving enzymatic reactivity[J]. Fibers and Polymers,2016,17:1323−1329. doi: 10.1007/s12221-016-6460-5
[27] LIN P C, CHEN S H, WANG K Y, et al. Fabrication of oriented antibody-conjugated magnetic nanoprobes and their immunoaffinity application[J]. Analytical Chemistry,2009,81(21):8774−8782. doi: 10.1021/ac9012122
[28] TAO L, ZHANG K, SUN Y, et al. Anti-epithelial cell adhesion molecule monoclonal antibody conjugated fluorescent nanoparticle biosensor for sensitive detection of colon cancer cells[J]. Biosensors and Bioelectronics,2012,35(1):186−192. doi: 10.1016/j.bios.2012.02.044
[29] KOTAGIRI N, LI Z, XU X, et al. Antibody quantum dot conjugates developed via copper-free click chemistry for rapid analysis of biological samples using a microfluidic microsphere array system[J]. Bioconjugate Chemistry,2014,25(7):1272−1281. doi: 10.1021/bc500139u
[30] KATZ E, WILLNER I. Integrated nanoparticle–biomolecule hybrid systems:Synthesis, properties, and applications[J]. Angewandte Chemie International Edition,2004,43(45):6042−6108. doi: 10.1002/anie.200400651
[31] ZHANG K, HAO L, HURST S J, et al. Antibody-linked spherical nucleic acids for cellular targeting[J]. Journal of the American Chemical Society,2012,134(40):16488−16491. doi: 10.1021/ja306854d
[32] GOLDMAN E R, ANDERSON G P, TRAN P T, et al. Conjugation of luminescent quantum dots with antibodies using an engineered adaptor protein to provide new reagents for fluoroimmunoassays[J]. Analytical Chemistry,2002,74(4):841−847. doi: 10.1021/ac010662m
[33] HIRSCH J D, ESLAMIZAR L, FILANOSKI B J, et al. Easily reversible desthiobiotin binding to streptavidin, avidin, and other biotin-binding proteins:Uses for protein labeling, detection, and isolation[J]. Analytical Biochemistry,2002,308(2):343−357. doi: 10.1016/S0003-2697(02)00201-4
[34] MAO Y, HUANG X, XIONG S, et al. Large-volume immunomagnetic separation combined with multiplex PCR assay for simultaneous detection of Listeria monocytogenes and Listeria ivanovii in lettuce[J]. Food Control,2016,59:601−608. doi: 10.1016/j.foodcont.2015.06.048
[35] LIM M C, LEE G H, HUYNH D T N, et al. Biological preparation of highly effective immunomagnetic beads for the separation, concentration, and detection of pathogenic bacteria in milk[J]. Colloids and Surfaces B:Biointerfaces,2016,145(1):854−861.
[36] BI Y, SHU M, ZHONG C, et al. A novel SDS rinse and immunomagnetic beads separation combined with real-time loop-mediated isothermal amplification for rapid and sensitive detection of Salmonella in ready-to-eat duck meat[J]. Food Analytical Methods,2020,13:1166−1175. doi: 10.1007/s12161-020-01735-1
[37] GAO P, WANG L, HE Y, et al. An enhanced lateral flow assay based on aptamer–magnetic separation and multifold AuNPs for ultrasensitive detection of Salmonella typhimurium in milk[J]. Foods,2021,10(7):1605. doi: 10.3390/foods10071605
[38] DU J, LIU J, LIU K, et al. Development of a fluorescent test strip sensor based on surface positively-charged magnetic bead separation for the detection of Listeria monocytogenes[J]. Analytical Methods,2022,14(22):2188−2194. doi: 10.1039/D2AY00384H
[39] WANG L, ZHOU H, HU H, et al. Constructing difunctional histidine-modified magnetic hybrid nanozymes as capture probes and signal amplifiers for the sensitive colorimetric detection of Salmonella typhimurium in food[J]. Microchemical Journal,2022,182:107917. doi: 10.1016/j.microc.2022.107917
[40] WANG Z, WANG D, CHEN J, et al. Development of a novel bacteriophage based biomagnetic separation method as an aid for sensitive detection of viable Escherichia coli[J]. Analyst,2016,141(3):1009−1016. doi: 10.1039/C5AN01769F
[41] POSHTIBAN S, JAVED M A, ARUTYUNOV D, et al. Phage receptor binding protein-based magnetic enrichment method as an aid for real time PCR detection of foodborne bacteria[J]. Analyst,2013,138(19):5619−5626. doi: 10.1039/c3an01100c
[42] DING Y, HUANG C, ZHANG Y, et al. Magnetic microbead enzyme-linked immunoassay based on phage encoded protein RBP 41-mediated for rapid and sensitive detection of Salmonella in food matrices[J]. Food Research International,2023,163:112212. doi: 10.1016/j.foodres.2022.112212
[43] BU T, YAO X, HUANG L, et al. Dual recognition strategy and magnetic enrichment based lateral flow assay toward Salmonella enteritidis detection[J]. Talanta,2020,206:120204. doi: 10.1016/j.talanta.2019.120204
[44] BAI X, CHEN G, WANG Z, et al. Simultaneous detection of Bacillus cereus and Staphylococcus aureus by teicoplanin functionalized magnetic beads combined with triplex PCR[J]. Food Control,2022,132:108531. doi: 10.1016/j.foodcont.2021.108531
[45] WANG Y, WANG Z, ZHAN Z, et al. Fluorescence detection of Staphylococcus aureus using vancomycin functionalized magnetic beads combined with rolling circle amplification in fruit juice[J]. Analytica Chimica Acta,2022,1189:339213. doi: 10.1016/j.aca.2021.339213
[46] HE X, ZHOU L, HE D, et al. Rapid and ultrasensitive E. coli O157:H7 quantitation by combination of ligandmagnetic nanoparticles enrichment with fluorescent nanoparticles based two-color flow cytometry[J]. Analyst,2011,136(20):4183−4191. doi: 10.1039/c1an15413c
[47] TU Z, YANG X, DONG H, et al. Ultrasensitive fluorescence lateral flow assay for simultaneous detection of Pseudomonas aeruginosa and Salmonella typhimurium via wheat germ agglutinin-functionalized magnetic quantum dot nanoprobe[J]. Biosensors,2022,12(11):942. doi: 10.3390/bios12110942
[48] CHENG S, TU Z, ZHENG S, et al. An efficient sers platform for the ultrasensitive detection of Staphylococcus aureus and Listeria monocytogenes via wheat germ agglutinin-modified magnetic sers substrate and streptavidin/aptamer co-functionalized sers tags[J]. Analytica Chimica Acta,2021,1187:339155. doi: 10.1016/j.aca.2021.339155
[49] PELTOMAA R, BARDERAS R, BENITO-PEÑA E, et al. Recombinant antibodies and their use for food immunoanalysis[J]. Analytical and Bioanalytical Chemistry,2022,414(1):193−217. doi: 10.1007/s00216-021-03619-7
[50] LIU R, ZHANG F, SANG Y, et al. Screening, identification, and application of nucleic acid aptamers applied in food safety biosensing[J]. Trends in Food Science & Technology,2022,123:355−375.
[51] WANG J, KANACH A, HAN R, et al. Application of bacteriophage in rapid detection of Escherichia coli in foods[J]. Current Opinion in Food Science,2021,39:43−50. doi: 10.1016/j.cofs.2020.12.015
[52] AQIB A I, ALSAYEQH A F. Vancomycin drug resistance, an emerging threat to animal and public health[J]. Frontiers in Veterinary Science,2022,9:1010728. doi: 10.3389/fvets.2022.1010728
[53] MI F, GUAN M, HU C, et al. Application of lectin-based biosensor technology in the detection of foodborne pathogenic bacteria:A review[J]. Analyst,2021,146(2):429−443. doi: 10.1039/D0AN01459A
[54] MUYLDERMANS S. Applications of nanobodies[J]. Annual Review of Animal Biosciences,2021,9:401−421. doi: 10.1146/annurev-animal-021419-083831
[55] KOTANI N, KUMARESAN R, KAWAMOTO-OZAKI Y, et al. Swinging arms of antibody IgG make the antigen binding docile[J]. Biophysical Journal,2016,110(3):497.
[56] 林吉恒, 黄朱梁, 彭志兰, 等. 免疫磁珠分离技术在食源性致病菌检测中的应用[J]. 食品安全质量检测学报,2019,10(18):5998−6005. [LIN J H, HUANG Z L, PENG Z L, et al. Application of immunomagnetic bead separation technology in the detection of foodborne pathogens[J]. Journal of Food Safety and Quality Inspection,2019,10(18):5998−6005.] LIN J H, HUANG Z L, PENG Z L, et al. Application of immunomagnetic bead separation technology in the detection of foodborne pathogens[J]. Journal of Food Safety and Quality Inspection, 2019, 10(18): 5998−6005.
[57] LI F L, LI F, LUO D, et al. Biotin-exposure-based immunomagnetic separation coupled with nucleic acid lateral flow biosensor for visibly detecting viable Listeria monocytogenes[J]. Analytica Chimica Acta,2018,1017:48−56. doi: 10.1016/j.aca.2018.02.009
[58] SHAN S, ZHONG Z, LAI W, et al. Immunomagnetic nanobeads based on a streptavidin-biotin system for the highly efficient and specific separation of Listeria monocytogenes[J]. Food Control,2014,45:138−142. doi: 10.1016/j.foodcont.2014.04.036
[59] XIAO F, LI W, XU H. Advances in magnetic nanoparticles for the separation of foodborne pathogens:recognition, separation strategy, and application[J]. Comprehensive Reviews in Food Science and Food Safety,2022,21(5):4478−4504. doi: 10.1111/1541-4337.13023
[60] CHEN J, PARK B. Effect of immunomagnetic bead size on recovery of foodborne pathogenic bacteria[J]. International Journal of Food Microbiology,2018,267:1−8. doi: 10.1016/j.ijfoodmicro.2017.11.022
[61] VANEGAS D C, GOMES C L, CAVALLARO N D, et al. Emerging biorecognition and transduction schemes for rapid detection of pathogenic bacteria in food[J]. Comprehensive Reviews in Food Science and Food Safety,2017,16(6):1188−1205. doi: 10.1111/1541-4337.12294
[62] OHK S H, KOO O K, SEN T, et al. Antibody–aptamer functionalized fibre-optic biosensor for specific detection of Listeria monocytogenes from food[J]. Journal of Applied Microbiology,2010,109(3):808−817. doi: 10.1111/j.1365-2672.2010.04709.x
[63] NOORANIAN S, MOHAMMADINEJAD A, MOHAJERI T, et al. Biosensors based on aptamer-conjugated gold nanoparticles:A review[J]. Biotechnology and Applied Biochemistry,2022,69(4):1517−1534. doi: 10.1002/bab.2224
[64] KALITA J J, SHARMA P, BORA U. Recent developments in application of nucleic acid aptamer in food safety[J]. Food Control,2022,145:109406.
[65] PELTOMAA R, BENITO-PEÑA E, BARDERAS R, et al. Phage display in the quest for new selective recognition elements for biosensors[J]. ACS omega,2019,4(7):11569−11580. doi: 10.1021/acsomega.9b01206
[66] HUSSAIN W, ULLAH M W, FAROOQ U, et al. Bacteriophage-based advanced bacterial detection:Concept, mechanisms, and applications[J]. Biosensors and Bioelectronics,2021,177:112973. doi: 10.1016/j.bios.2021.112973
[67] JANCZUK M, RICHTER Ł, HOSER G, et al. Bacteriophage-based bioconjugates as a flow cytometry probe for fast bacteria detection[J]. Bioconjugate Chemistry,2017,28(2):419−425. doi: 10.1021/acs.bioconjchem.6b00596
[68] DÍAZ N, SUÁREZ D, SORDO T L, et al. Acylation of class a β-lactamases by penicillins:A theoretical examination of the role of serine 130 and the β-lactam carboxylate group[J]. The Journal of Physical Chemistry B,2001,105(45):11302−11313. doi: 10.1021/jp012881h
[69] KELL A J, STEWART G, RYAN S, et al. Vancomycin-modified nanoparticles for efficient targeting and preconcentration of gram-positive and gram-negative bacteria[J]. Acs Nano,2008,2(9):1777−1788. doi: 10.1021/nn700183g
[70] WANG M, WU Y, HE Y, et al. Antibiotic-affinity strategy for bioluminescent detection of viable gram-positive bacteria using daptomycin as recognition agent[J]. Analytica Chimica Acta,2017,987(22):91−97.
[71] GU H, HO P L, TSANG K W T, et al. Using biofunctional magnetic nanoparticles to capture vancomycin-resistant enterococci and other gram-positive bacteria at ultralow concentration[J]. Journal of the American Chemical Society,2003,125(51):15702−15703. doi: 10.1021/ja0359310
[72] 杨国泰, 李鹏, 胡烈海, 等. 凝集素在食源致病菌快速检测中应用的研究进展[J]. 微生物学通报,2019,46(5):1136−1145. [YANG G T, LI P, HU L H, et al. Research progress on the application of lectins in rapid detection of foodborne pathogens[J]. Microbiology Bulletin,2019,46(5):1136−1145.] YANG G T, LI P, HU L H, et al. Research progress on the application of lectins in rapid detection of foodborne pathogens[J]. Microbiology Bulletin, 2019, 46(5): 1136−1145.
[73] VERMA M, SHUKLA A K, ACHARYA A. Lectin nanoconjugates for targeted therapeutic applications[J]. Nanomaterial-Based Biomedical Applications in Molecular Imaging, Diagnostics and Therapy, 2020:103−127.
[74] YANG G, HUANG M, WANG Y, et al. Streptavidin-exposed magnetic nanoparticles for lectin magnetic separation (lms) of Staphylococcus aureus prior to three quantification strategies[J]. Microchimica Acta,2019,186:1−8. doi: 10.1007/s00604-018-3127-5
-
期刊类型引用(4)
1. 任卫威,张宇航,郑玉成,陈文贤,林宏政,徐梦婷,陈谢勇,陈百文,叶乃兴. 不同香型安溪黄金桂风味品质解析. 食品科学. 2025(05): 263-271 .  百度学术
百度学术
2. 李元朝,黎勤吉,郭玉琼,郝志龙,金珊. 枸杞茶感官审评方法的建立及其主要呈香物质的探索. 食品工业科技. 2025(04): 30-41 .  本站查看
本站查看
3. 周晶晶,张雯萍,李光发,谢荣富,何吉杭,郝韵智,李秋明,余欣茹,林宏政,孙云. 九龙大白茶白茶风味品质的分析. 食品科学. 2025(06): 201-210 .  百度学术
百度学术
4. 刘学艳,杨文光,徐婷,罗正飞,王绍梅,龚正礼. 并堆工艺对云南白茶品质影响的研究. 中国茶叶. 2025(03): 25-33 .  百度学术
百度学术
其他类型引用(3)





 下载:
下载:
 下载:
下载:
