Effect of Soy Protein Isolate-Sucrose Ester on the Stability of Emulsion Prepared by Different Oil
-
摘要: 为探究复合乳化剂对不同油脂乳化效果的影响,以大豆分离蛋白(SPI)和蔗糖酯(SE)为复合乳化剂,猪油(LA)、大豆油(SO)、亚麻籽油(LO)、鱼油(FO)为油相制备乳液。通过测定乳液的乳化活性、结构特性、热特性、稳定性等指标,研究了不同油相制备的乳液之间稳定性的差异。结果表明,四种乳液中乳液LA有最高的乳化活性和乳液稳定性(27.374 m2/g,361.243 min),且其乳液液滴平均粒径(D)最小(8.411±0.670 μm)。微观结构结果显示,四种乳液颗粒的均匀性为乳液LA >乳液SO >乳液LO >乳液FO。DSC结果表明,乳液LA熔融时需要最多的能量(ΔH=−57.67±1.28 J/g),而乳液FO的焓值仅为−10.18±0.10 J/g。储藏及氧化稳定性的结果表明,乳液LA的稳定性最佳。油脂中不饱和脂肪酸的差异会影响SPI-SE对乳液的稳定效果,油相的不饱和脂肪酸比例越大、不饱和程度越高,乳液稳定性越差。该结果可丰富SPI-SE在油脂乳化上的研究,为油脂的乳化应用提供一定的参考依据。Abstract: In order to explore the effect of compound emulsifiers on the emulsification of different oils, soybean protein isolate (SPI) and sucrose ester (SE) were used as composite emulsifier, and lard (LA), soybean oil (SO), linseed oil (LO), fish oil (FO) as oil phase to prepare the emulsions (E). The stability differences of emulsions prepared with various oil phases were studied by measuring the emulsifying activity, structure properties, thermal characteristics and emulsifying stability. The results showed that the emulsifying activity index of ELA was the highest (27.374 m2/g, 361.243 min) among the four emulsions, and its average droplet size (D) was the smallest (8.411±0.670 μm). Microstructure images revealed that the particle uniformity was followed by ELA>ESO>ELO>EFO. DSC results showed that ELA took the most melting energy (ΔH=−57.67±1.28 J/g), while the enthalpy of EFO was only −10.18±0.10 J/g. The data of storage and oxidation stability displayed that ELA was the most stable. The difference of unsaturated fatty acid in oil affected the stability of emulsion, the larger the proportion of unsaturated fatty acid and the higher the degree of unsaturation in oil phase, accounting for the worse the stability of emulsion. These results could enrich the research of SPI-SE in oil emulsification, and will benefit development of application on oil emulsification.
-
Keywords:
- soybean protein isolate /
- sucrose ester /
- oil /
- structure property /
- stability
-
乳液广泛应用于多种食品,如冰淇淋、糖果以及肉制品。然而,乳液体系中的不稳定机制,如乳析、絮凝、奥斯特瓦尔德熟化等降低了乳液的稳定性[1]。因此,常在乳化过程中加入表面活性剂(乳化剂)以提高乳液的稳定性。相比于人工合成乳化剂,天然乳化剂特别是植物基乳化剂因具有生物降解性、可持续性和生物功能性等优点而备受关注[2]。其中大豆分离蛋白(SPI)已成为一种广泛使用的天然乳化剂。SPI具有两亲性结构,可降低油水两相间的界面张力,同时具有较高的营养价值和较低的成本。然而,SPI的分子量大、溶解度低、静电斥力弱等特点降低了SPI向油水界面的运动和吸附速度,需要较长的乳化时间才能形成稳定的乳液[3]。有研究通过在SPI中加入其他成分如低聚果糖、大豆磷脂、染料木黄酮等[4−6]来形成复合乳化剂,以此乳化得到更稳定的乳液。然而,乳液的稳定性还与乳化环境及油相脂肪酸组成等有关。杨凯麟等[7]研究了水相pH和Na+浓度对乳液稳定性的影响。Jiang等[8]和许笑男等[9]研究发现,超声对乳液的稳定性及消化性有明显影响。然而,关于油脂中脂肪酸组成对乳液稳定性的研究还很有限。
蔗糖酯(SE)是一种无毒、生物可降解的非离子型表面活性剂,大范围的亲水亲油平衡值(HLB 1-16),使其具有良好的乳化性,可显著降低溶液的表面张力和粘度[10]。有研究表明,SE可通过范德华力和疏水作用与蛋白质发生相互作用,结合到SPI分子上后可改变SPI的二级结构,从而提高SPI的乳化特性[11]。另外,Hu等[12]研究发现,蔗糖硬脂酸酯在临界聚集浓度(CAC)为2.0×10−4wt%以上时形成囊泡,可稳定十六烷或可食用油水乳状液(0.1wt%以上),其中囊泡分散在油滴周围的水片状中,提高乳状液的稳定性。Ariyaprakai等[13]发现相比吐温,使用蔗糖酯稳定的乳状液的冻融稳定性更好。
目前,关于SE与其他成分复合乳化的研究还很少。因此,本研究在前人研究基础上,以SPI-SE为复合乳化剂同时制备了四种乳液(乳液LA、乳液SO、乳液LO、乳液FO),通过对比乳液的乳化活性、粒径分布、微观结构、热特性、储藏稳定性、氧化稳定性等指标来探究四种乳液的稳定性差异,为SPI-SE复合乳化剂在乳化油脂上的应用提供一定的理论研究依据。
1. 材料与方法
1.1 材料与仪器
大豆分离蛋白 纯度>98%,滨州御馨生物科技有限公司;蔗糖酯 纯度100%,日本第一工业制药株式会社;精制猪油 一级,临沂新程金锣肉制品集团有限公司;大豆油 一级,浙江益海嘉里食品工业有限公司;亚麻籽油 一级,宁夏优优食用油有限公司;鱼油(鲱鱼油) 上海麦克林生化科技有限公司;10%十二烷基苯磺酸钠溶液(10%SDS) 分析级,上海阿拉丁生化科技有限公司;无水乙酸、碘化钾、硫代硫酸钠、异辛烷、异丙醇等 分析级,国药集团化学试剂有限公司;实验过程所用水均为超纯水。
T25型均质机 德国IKA集团;TQ8040型气相色谱质谱联用仪(GC-MS)、SALD-2300型激光衍射粒度仪、DSC-60plus型差示扫描量热仪(DSC) 日本岛津公司;UV-1800型紫外分光光度计 上海美谱达仪器有限公司;Nikon E-200型光学显微镜 日本尼康株式会社;JSM-IT100型扫描电镜(SEM) 日本电子株式会社;CR 22N型高速冷冻离心机 日本日立公司;800 Dosino型电位滴定计 瑞士Metrohm公司。
1.2 实验方法
1.2.1 油脂中脂肪酸组成
根据国标中食品脂肪酸的测定方法[14]对四种油脂进行甲酯化。GC-MS条件如下:色谱柱为SH-Rtx-Wax(30 m×0.25 mm, 0.25 μm),进样口温度为240 ℃,进样量1 μL,分流比为20:1;升温程序如下:100 ℃持续13 min,以10 ℃/min升至180 ℃,保持6 min,随后以1 ℃/min升至200 ℃,保持20 min,再以4 ℃/min升至240 ℃,保持10.5 min;载气为氮气。测试的结果定性分析根据Wiley7n.1 标准谱库检索,以各组分的色谱峰的相对峰面积计算各组分所占的比例。
1.2.2 乳液的制备
参照Tian等[15]和Cofrades等[16]的方法并作少量修改制备乳液。准确称取一定量的大豆分离蛋白(SPI,1.50wt%)和蔗糖酯(SE,0.28wt%),物理混合后分散在去离子水中,配成SPI-SE分散液,置于4 ℃环境下水化12 h。水化好的SPI-SE分散液待其恢复至室温后转移至50 ℃水浴加热20 min,再加入20wt% 50 ℃预热好猪油(LA)、大豆油(SO)、亚麻籽油(LO)、鱼油(FO)四种油相,用高速均质机在15000 r/min转速下乳化5 min得到乳液LA、乳液SO、乳液LO和乳液FO,随后立即转移至4 ℃环境下避光保存。
1.2.3 乳化活性及乳液稳定性
通过浊度法[17]测定乳液的乳化活性(EAI)及乳液稳定性(ESI)。乳液均质完成后立即从底部吸取50 μL样品,用质量分数为0.1%的SDS稀释至10 mL,以0.1%的SDS溶液为空白,摇匀后测定样品在500 nm处的吸光值,记为A0。待乳液液静置15 min后,再次从底部吸取50 μL样品,用质量分数为0.1%的SDS稀释至10 mL,测定其在500 nm处的吸光值,记为A1。样品的EAI和ESI根据下式计算:
EAI=(2×2.303×A0×N)/(c×ρ×10000) (1) ESI=[A0(A0−A1)]×15 (2) 式中:A0为第一次取样测定的吸光度;N为稀释倍数,200;c为蛋白质质量浓度,g/mL;ρ为乳液中油相体积分数,1/5;A1为15 min时取样测得的吸光度。
1.2.4 乳液粒径
采用激光粒度衍射仪测定各乳液的平均粒径和粒度分布,每个样品在常温下测量三次,结果取平均值。平均粒径结果以D(μm)表示。
1.2.5 乳液微观结构
取50 μL制备好的乳液用去离子水稀释至10 mL,摇匀后取20 μL稀释液于载玻片上,在100×物镜下观察乳液液滴的颗粒结构。
1.2.6 乳液扫描电镜(SEM)
参照Zheng等[18]方法并做部分修改制备乳液样品进行SEM观察。准确称量10 g乳液样品用40 g超纯水进行稀释后用液氮进行淬冷,随后立即进行冷冻干燥(48 h)。取适量干燥好的样品自然附着在导电胶带上,然后进行喷金处理。处理好的样品转移到SEM样品仓内,在工作电压15.0 kV,工作距离11 mm的真空条件下对样品进行观察。
1.2.7 乳液热力学特性
通过DSC测定油脂及其乳液的热力学特性。测试方法参考Wang等[19]的研究并作一些修改。DSC设备测试前用铟进行校准(熔点=156.63 ℃,焓值ΔH=28.45 J/g)。精确称取5.00 mg冷冻干燥好的乳液样品于铝制坩埚内,立即进行密封,以密封的空铝制坩埚为空白对样品进行热特性分析。样品先在−50 ℃下平衡5 min,随后以5 ℃/min的升温速率从−50 ℃升温至70 ℃,根据DSC曲线计算样品的熔点及ΔH,每个样品重复三次,结果以“平均值±标准偏差”表示。
1.2.8 储藏稳定性测定
乳层析指数(IC)可表示乳液的成乳稳定性,乳层析指数越小表明乳液相分离程度越小[20]。根据Taha等[21]的方法并作部分修改测定乳液的储藏稳定性,均质好的乳液分别分装在50 mL的圆柱形样品瓶中,通过吹氮气的方式排出上部空间空气后立即密封,在25 ℃下保存,根据乳液的乳层析指数(IC)来判断乳液的储藏稳定性。乳层析指数根据下式计算:
IC(%)=HtH0×100 (3) 式中:Ht为底层水层的高度;H0为乳液总高度。
1.2.9 氧化稳定性测定
通过加速氧化的方式测定乳液的氧化稳定性。将制备好的乳液分装在50 mL的圆柱形样品瓶中并提供充足的氧气,避光储藏在37 ℃的烘箱中,参照Shantha等[22]以及国标中食品中过氧化值的测定方法[23]并作一些修改,定期测定乳液的过氧化值(POV),以原油为空白对照,监测乳液的氧化稳定性。取10 mL乳液于离心管中,加入20 mL异辛烷异丙醇混合液(v/v=3:1),涡旋振荡5 min,然后进行离心(6000 r/min,10 min),取上层清液加入50 mL乙酸异辛烷混合液(v/v=3:2),随后加入0.5 mL饱和碘化钾溶液,搅拌1 min后立即加入100 mL去离子水进行电位滴定,记录EP1出现时硫代硫酸钠溶液消耗的体积(V,mL),同时进行空白试验,记录消耗的硫代硫酸钠溶液的体积为V0(mL),根据下式计算油脂的过氧化值:
X1=(V−V0)×cm×1000 (4) 式中:X1为过氧化值(meq/kg);V为试样消耗的硫代硫酸钠标准液的体积(mL);V0为空白试验消耗的硫代硫酸钠标准液的体积(mL);c为硫代硫酸钠标准溶液的浓度(0.01 mol/L);m为试验中油的质量(g,该试验乳液换算得到油的质量为2.00 g);1000为换算系数。
1.3 数据处理
所有实验结果重复3次,以“平均值±标准偏差”的方式表示。利用Origin8.5软件作图,使用SPSS 22.0对数据进行统计学差异分析(P<0.05)。
2. 结果与分析
2.1 油脂中各脂肪酸的组成分析
通过GC-MS对四种油脂的脂肪酸组成进行了分析,结果如表1所示。从表1中数据可以看出各油脂中的脂肪酸成本组成较为复杂,脂肪分布范围在C14(肉豆蔻酸)至C22(二十二碳烯酸)之间。另外,四种油脂原料之间的脂肪酸组成存在差异。猪油、大豆油、亚麻籽油、鱼油的饱和脂肪酸和不饱和脂肪酸比例分别为45.33:54.64、19.27:80.64、15.13:84.81、20.82:79.18,其中猪油中饱和脂肪酸含量最高,主要为棕榈酸和硬脂酸,亚麻籽油的不饱和脂肪酸比例最高,主要为亚油酸和亚麻酸。大豆油和鱼油的不饱和脂肪酸比例接近,且大豆油中的不饱和脂肪酸多为油酸和亚油酸,这与周纷[24]的研究结果相似,鱼油中的不饱和脂肪酸除油酸外,长链多不饱和脂肪酸占了16.09%(EPA+DHA)。油脂中脂肪酸的饱和程度和组成影响熔点、结晶行为以及油在室温下的粘度,在乳液体系中则会影响乳化剂如大豆分离蛋白的吸附行为,从而影响乳液的稳定性[19]。
表 1 猪油、大豆油、亚麻籽油、鱼油中的脂肪酸组成(%)Table 1. Compositions of fatty acid in lard, soybean oil, linseed oil and fish oil (%)脂肪酸 油脂 猪油 大豆油 亚麻籽油 鱼油 肉豆蔻酸 1.69±0.11 0.07±0.01 − 0.33±0.01 棕榈酸 25.34±0.71 13.00±0.06 8.32±0.17 15.62±0.06 棕榈油酸 2.64±0.14 0.09±0.02 0.07±0.01 0.43±0.03 十六碳三烯酸 − − − 0.09±0.00 十七烷酸 0.24±0.02 0.07±0.01 0.04±0.02 0.07±0.01 十七碳烯酸 0.18±0.03 0.06±0.01 硬脂酸 17.81±0.21 5.74±0.13 6.58±0.04 4.71±0.03 油酸 39.77±0.71 20.01±1.40 12.83±0.04 59.58±0.66 亚油酸 11.15±0.71 49.96±0.58 15.62±0.08 0.17±0.02 亚麻酸 0.04±0.00 9.87±0.98 56.14±0.22 − 十八碳四烯酸 − − − 2.15±0.01 十九烷酸 − − − 0.09±0.01 二十碳烷酸 0.25±0.03 0.39±0.00 0.19±0.01 − 二十碳烯酸 0.98±0.05 0.65±0.02 0.15±0.01 0.16±0.02 二十碳二烯酸 0.43±0.09 二十碳三烯酸 0.05±0.00 − − − 花生四烯酸 0.08±0.02 − − 0.12±0.00 二十碳五烯酸(EPA) − − − 4.65±0.06 二十一碳烯酸 − − − 0.34±0.01 二十二碳烯酸 − − − 0.05±0.01 二十二碳六烯酸(DHA) − − − 11.44±0.02 Δ饱和脂肪酸 45.33 19.27 15.13 20.82 Δ不饱和脂肪酸 54.32 80.64 84.81 79.18 注:所有数据均测量三次取平均值得出,结果以“平均值±标准偏差”的方式表示,表中“−”代表未检出。 2.2 乳化活性及乳液稳定性
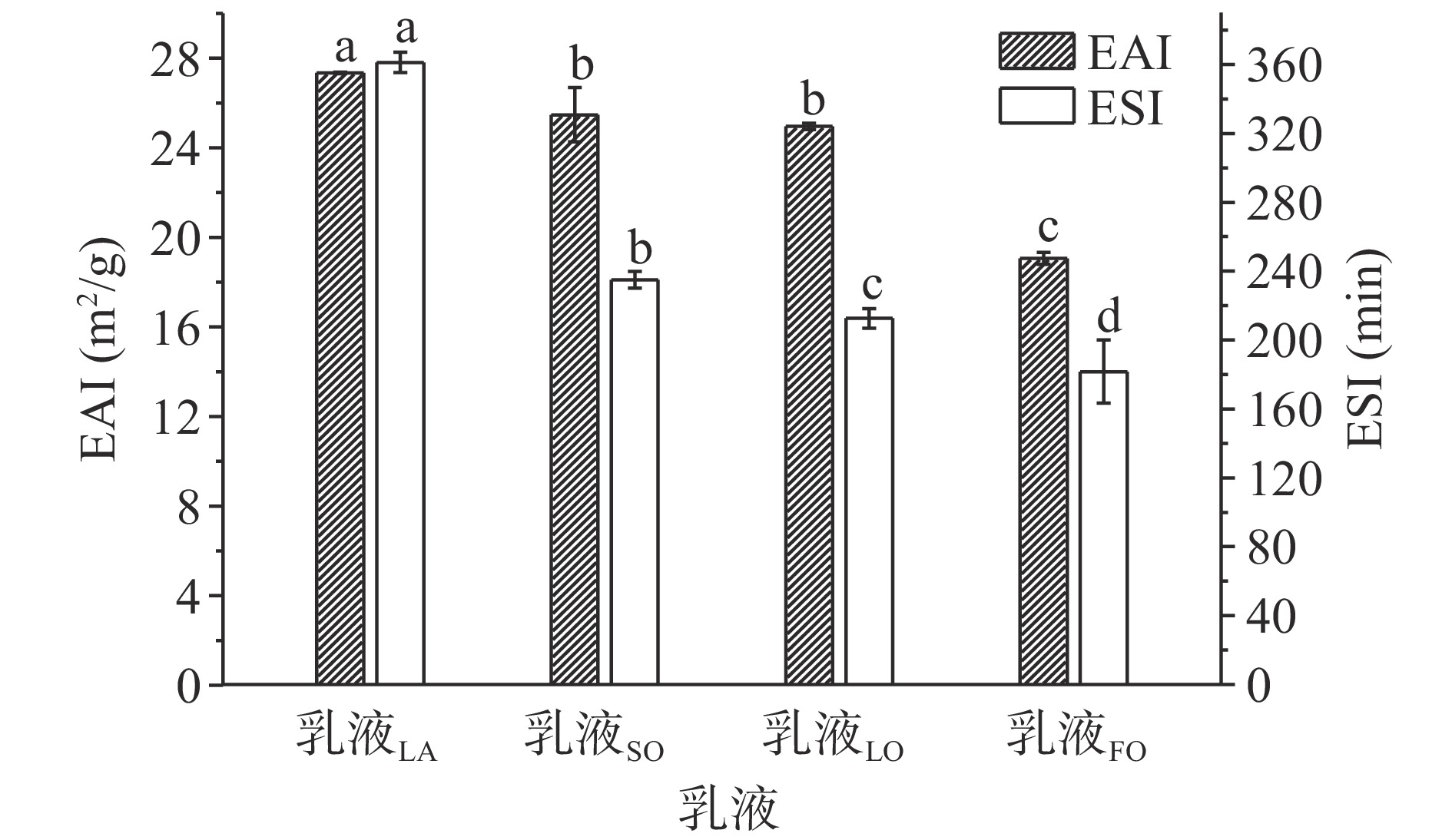
乳化活性可以反应乳化体系中的蛋白质对脂肪分子的吸附能力,乳化活性越高说明蛋白质对油脂的乳化效率越大。乳液稳定性则可以反应蛋白质维持乳液体系相稳定的能力,乳液稳定性越高,体系中的油水乳化效果越好[25]。SPI-SE对不同油脂的乳化活性和乳液稳定性如图1所示。从图1可以看出乳液LA的EAI达到27.374±0.029 m2/g,乳液SO、乳液LO和乳液FO的EAI分别为25.476±1.208、24.959±0.142、19.059±0.268 m2/g,这说明SPI-SE乳化剂对猪油的乳化效率最大。这归因于猪油中的饱和脂肪酸比例较高(45.33%),更容易被SPI-SE乳化剂形成的液膜所包裹[26]。相反,大豆油、亚麻籽油、鱼油中的不饱和脂肪酸比例较高(表1),影响了SPI-SE形成的乳液液膜对油脂的吸附。各乳液的ESI同样说明SPI-SE乳化剂对猪油的乳化效果最好,乳液LA的ESI达到361.243±11.875 min,而乳液SO、乳液LO和乳液FO的ESI分别为235.081±9.738、212.596±11.192、181.671±36.645 min,说明油脂的脂肪酸差异对SPI-SE稳定的乳液的稳定性有显著影响(P<0.05),油脂中饱和脂肪酸比例越大,形成的乳液稳定性越高。Zhang等[27]亦报道过,乳液体系中的不饱和脂肪酸会影响油脂与乳化剂的结合。大豆油、亚麻籽油、鱼油中的不饱和脂肪酸比例相近,然而鱼油中有C20以上不饱和脂肪酸比例较大,因此乳液FO的稳定性最差。
2.3 粒径分析
乳液液滴的颗粒大小与粒径分布影响乳液的稳定性。利用激光衍射式粒度仪测定了不同油脂制备的乳液的粒径分布,结果如表2所示。从数据中可以看出,乳液LA的平均粒径(8.411±0.670 μm)最小,乳液FO的平均粒径(14.919±1.363 μm)最大。乳液的双峰分布图如图2所示,四种乳液的主峰值呈现乳液LA(10.04 μm)<乳液SO(14.49 μm)<乳液LO(15.37 μm)<乳液FO(19.01 μm)的趋势。根据粒径分布图(图2)可以看出,随着油脂中不饱和脂肪酸比例的升高,乳液的粒径分布趋势逐渐靠右。乳液颗粒的粒径越小,颗粒的沉降速度越慢,乳液体系也越稳定。这表明乳液LA的稳定性最好,这与乳液的ESI结果相一致。它们大小之间的差异可能由于油脂中饱和脂肪酸与不饱和脂肪酸的比例以及各脂肪酸的结构差异[28]。相比饱和脂肪酸,不饱和脂肪酸的线性程度更低,所制备的乳液液滴尺寸更大。
表 2 不同油脂制备的乳液的平均粒径(μm)Table 2. Mean diameters of emulsion which prepared by different oils (μm)乳液类型 平均粒径(μm) 乳液LA 8.411±0.670a 乳液SO 9.954±0.006ab 乳液LO 11.469±0.456b 乳液FO 14.919±1.363c 注:表中数据右上小写字母代表显著性差异(P<0.05)。 2.4 微观结构分析
不同油脂制备的乳液的液滴显微结构图3所示。在相同显微视野下,乳液LA的液滴大小较为均匀,且数量较多(图3a),主要呈现较小的球形颗粒结构。随着油脂中不饱和脂肪酸比例的增加,视野中乳液液滴的数量逐渐减少,且液滴大小呈现逐渐增大的趋势,尤其在乳液FO中,出现较大乳液液滴。相比大豆油和亚麻籽油,鱼油中的不饱和脂肪酸的比例与两种油脂接近,然而鱼油中不饱和脂肪酸的不饱和程度更高,因此形成的乳液液滴尺寸更大。Dafna等[29]也报道过相似的结果,石榴籽油(富含共轭亚麻酸)与三油酸甘油酯形成的乳液液滴尺寸大于橄榄油(富含油酸)与三油酸甘油酯形成的乳液液滴。另外,各乳液中均包含部分小颗粒乳液液滴(图3b~图3d),归因于各油脂(大豆油、亚麻籽油、鱼油中)包含一定比例的饱和脂肪酸,可以在SPI-SE作用下形成较小的乳液液滴,这一现象与乳液粒径分布的结果相吻合。
2.5 SEM分析
SPI-SE制备的各乳液的扫描电镜结果如图4所示。从图中可以看出,各乳液经冷冻干燥后,乳液颗粒呈现近似球形,部分乳液颗粒表现出变形、及凹进的表面形态,这是蛋白质外壳形成的特征[30]。另外部分颗粒出现孔洞或裂纹特征(红色箭头处),这可能是由冰晶或冷冻过程中保留的气泡留下的空洞形成的。Mohammed等[31]以SPI-阿拉伯胶为乳化剂乳化花青素制备的乳液经冷冻干燥得到相似的结果。此外,与乳液SO、乳液LO和乳液FO相比(图4b~图4d),乳液LA的颗粒大小更为均匀且聚集的更为紧密,这与光学显微镜下观察到的液滴状态的结果相一致,说明冷冻干燥很好的保持了乳液的形态。油脂中不饱和脂肪酸比例的升高,制备的乳液的液滴间隙较大,且出现不规则粘连,部分颗粒表层可见蛋白膜(绿色箭头处),说明并非所有SPI参与包裹油脂[18]。在乳液LA中并未观察到相似的现象,说明SPI-SE对猪油的乳化效果较好。
2.6 DSC分析
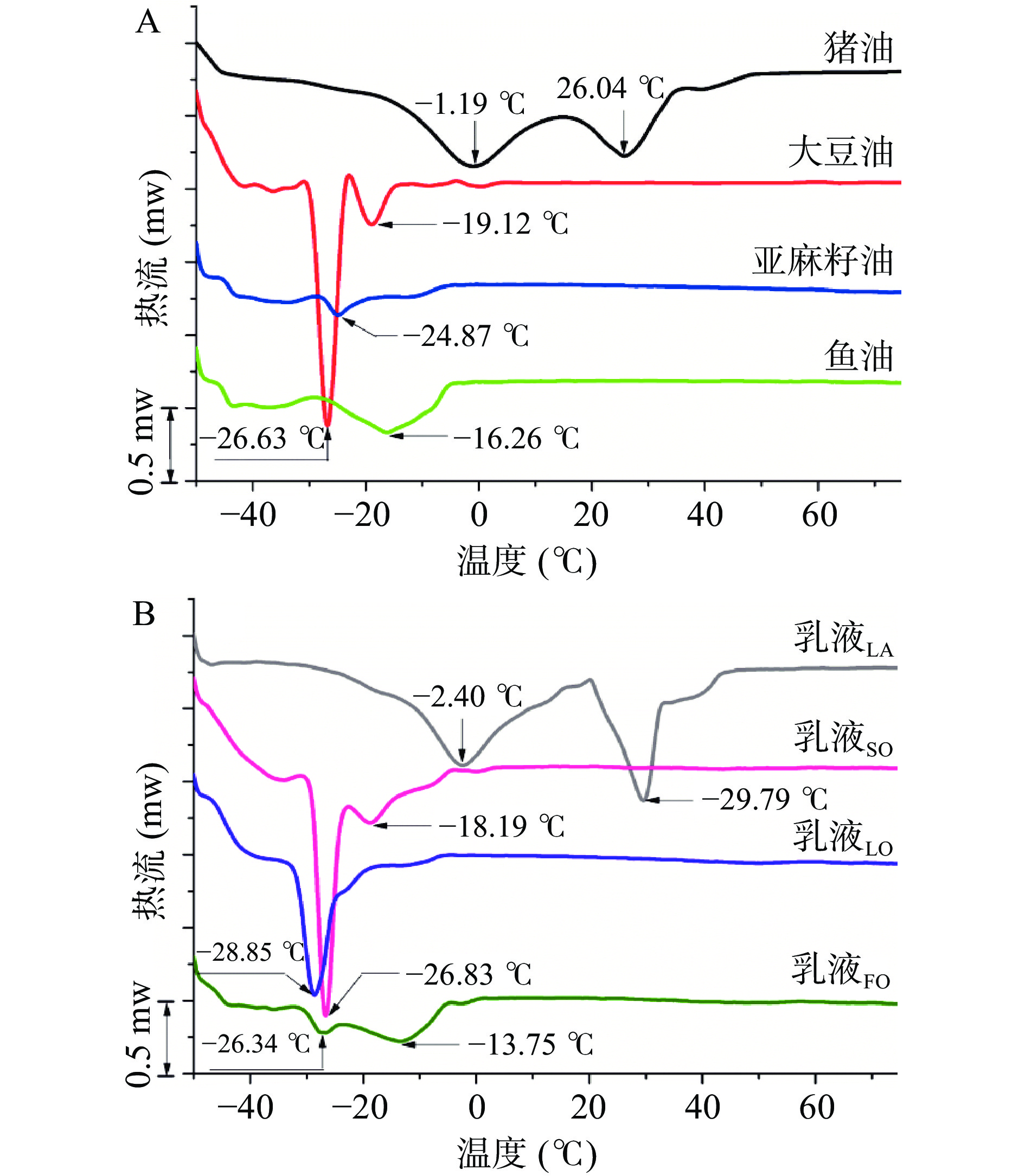
通过DSC对不同油脂制备的乳液的热特性进行了研究,各乳液的DSC热流曲线如图5所示。从图5中可以看出猪油在从-50~70 ℃的升温过程中出现两个明显的熔融峰,其熔融温度范围均较广(−19.32~11.78 ℃,17.96~35.86 ℃),分别对应于猪油中不饱和脂肪酸和饱和脂肪酸的融化温度。大豆油的熔融温度分别在−26.63±0.04 ℃和−19.12±0.36 ℃处,该结果与Ishibashi等[32]结果相近。亚麻籽油和鱼油在整个熔融过程中均只出现一个明显的熔融峰,然而,鱼油的熔融峰在−16.26±0.01 ℃处且熔融温度范围较宽,而亚麻籽油的熔融峰在−24.87±0.02 ℃处,峰较为尖锐。这可能是因为鱼油中不饱和脂肪酸的种类较多,且其饱和脂肪酸整体比例稍高于亚麻籽油,导致鱼油的熔融峰值温度高于亚麻籽油。当各油脂在SPI-SE作用下形成乳液后,其熔融温度发生明显变化。乳液LA的熔融峰变得更加尖锐,且其饱和脂肪酸的熔融温度偏移至29.79±0.30 ℃,说明猪油形成乳液后需要更多的热量才能融化。乳液SO的熔融温度点与空白大豆油相差不大。与空白亚麻籽油相比乳液LO的熔融温度点偏移至−28.85±0.27 ℃,说明乳液在冷却过程中出现了过冷效应[19],然而乳液LO的峰型更加尖锐,熔融温度范围更宽(包含−24.87±0.02 ℃),说明蛋白质外壳对内部油脂结晶有保护作用。乳液FO在整个熔融温度范围内出现两个吸收峰(−26.34±0.48 ℃,−13.75±0.39 ℃),这可能是因为乳液中的鱼油在降温过程中出现均相成核作用,鱼油中组分分开熔融。Wang等[19]研究乳清分离蛋白-卵磷脂乳化橄榄油得到相似研究结果。根据DSC热流曲线计算了各乳液的ΔH(表3)。从表3中可以看出乳液LA的总ΔH>乳液SO>乳液LA>乳液FO(−57.67±1.28>24.19±0.83>17.05±1.06>10.18±0.10 J/g),进一步表明乳液LA的热稳定性高于其他三种油脂。不饱和脂肪酸引起SPI结构的展开、构象重排和交联,降低了蛋白质外壳对油脂的保护作用,从而降低了不饱和脂肪酸含量高的乳液的稳定性[25]。
表 3 不同油脂制备的乳液的焓值Table 3. Enthalpy of lotion prepared with different oils样品 峰1 峰2 To(℃) Tp(℃) Tc(℃) ΔH(J/g) To(℃) Tp(℃) Tc(℃) ΔH(J/g) 猪油 −19.32±0.62e −1.19±0.02f 11.78±0.31d −26.35±0.90b 17.96±0.09b 26.04±0.11c 35.86±0.75c −16.65±0.76b 大豆油 −30.99±0.06bc −26.63±0.04b −22.51±0.30a −12.03±1.21e −22.82±0.02a −19.12±0.36a −13.91±0.13a −2.65±0.18d 亚麻籽油 −29.05±0.57d −24.87±0.02c −18.87±1.25b −1.11±0.08f 鱼油 −28.94±0.08d −16.26±0.01d −3.98±0.97c −9.84±0.04e SPI-SE/猪油 −18.16±0.08f −2.40±0.08e 15.90±0.15e −30.87±2.92a 20.36±0.08c 29.79±0.30d 43.36±0.20d −26.80±1.13a SPI-SE/大豆油 −30.32±0.30c −26.83±0.24b −22.77±0.33a −21.38±0.72c −22.78±0.33a −18.19±0.11a −13.31±0.37a −2.81±0.11d SPI-SE/亚麻籽油 −33.20±0.28a −28.85±0.27a −20.69±0.61ab −17.05±1.06d SPI-SE/鱼油 −31.18±0.25b −26.34±0.48b −23.18±0.25a −2.59±0.02f −23.68±0.46a −13.75±0.39b −5.09±0.13b −7.59±0.08c 注:同列数据右上角小写字母代表显著性差异(P<0.05)。 2.7 储藏稳定性分析
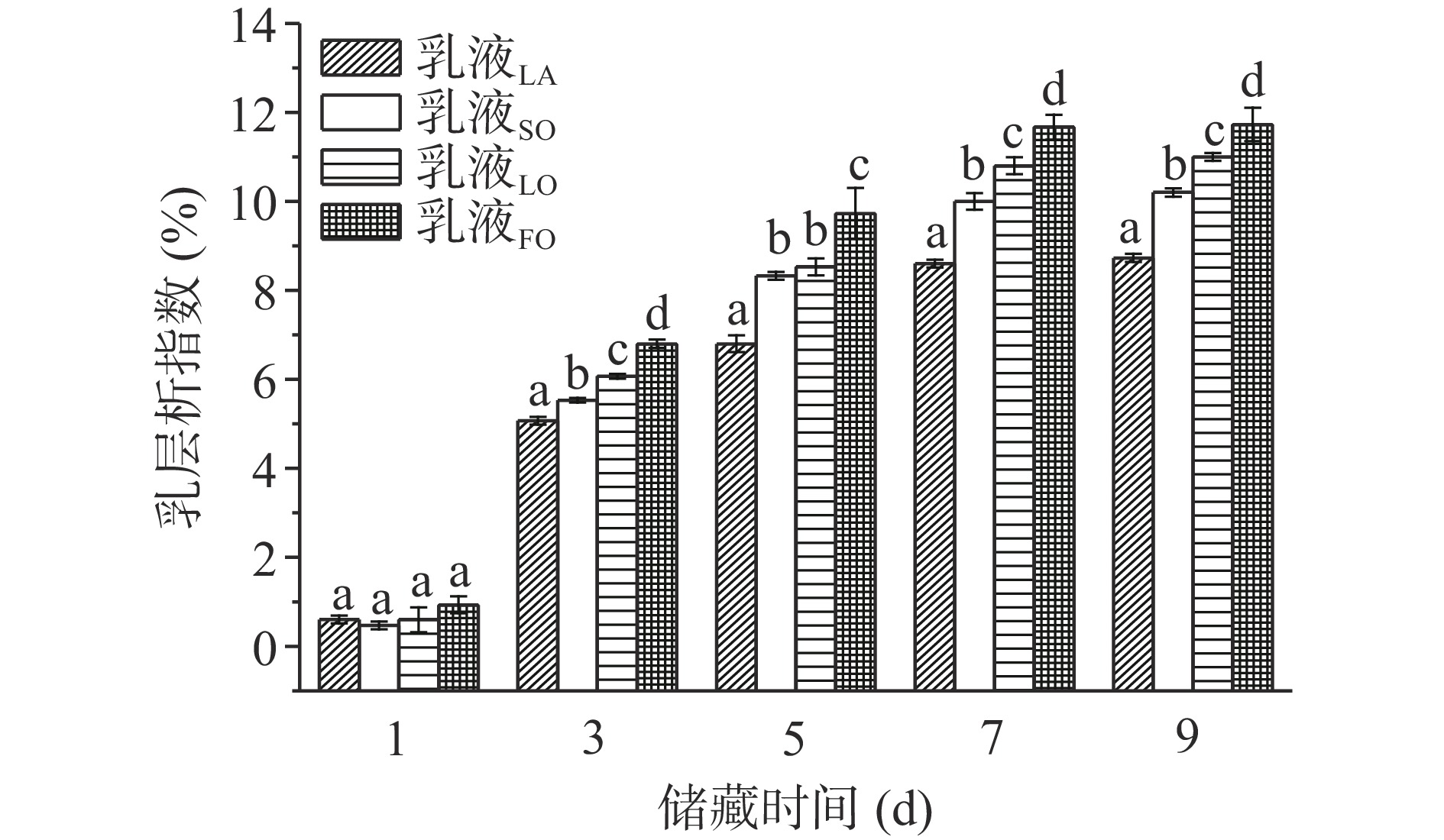
乳层析指数可以表示乳液中油相在水相中的稳定程度,乳层析指数越低说明乳液体系越稳定。不同储藏时间下各乳液的乳层析指数如图6所示。由图6可知,储藏1 d后的乳液均出现层析现象,这说明均质完的乳液并未立即达到稳定状态,乳液稳定性的结果亦证实这一点。随着储藏时间的延长,各乳液的乳层析指数逐渐增加,其中乳液FO的乳层析指数大于其他三种乳液,层析实际情况如图7所示。储藏7 d后乳液FO的乳层析指数达到11.67%,乳液LO、乳液SO、乳液LA的乳层析指数分别为10.80%、10.00%、8.60%,这表明乳液FO的稳定性最差,乳液LA的稳定性最好。储藏9 d后,各乳液逐渐趋于稳定,对应的乳层析指数相较于第7 d变化不大。通过表面乳化剂稳定的乳液体系仍会发生分层和聚集的现象[33],尽管SPI和SE共同作用下形成的界面蛋白膜有助于提高油相在水相中的稳定性,但对于不同油脂的稳定效果存在明显差异。
2.8 氧化稳定性
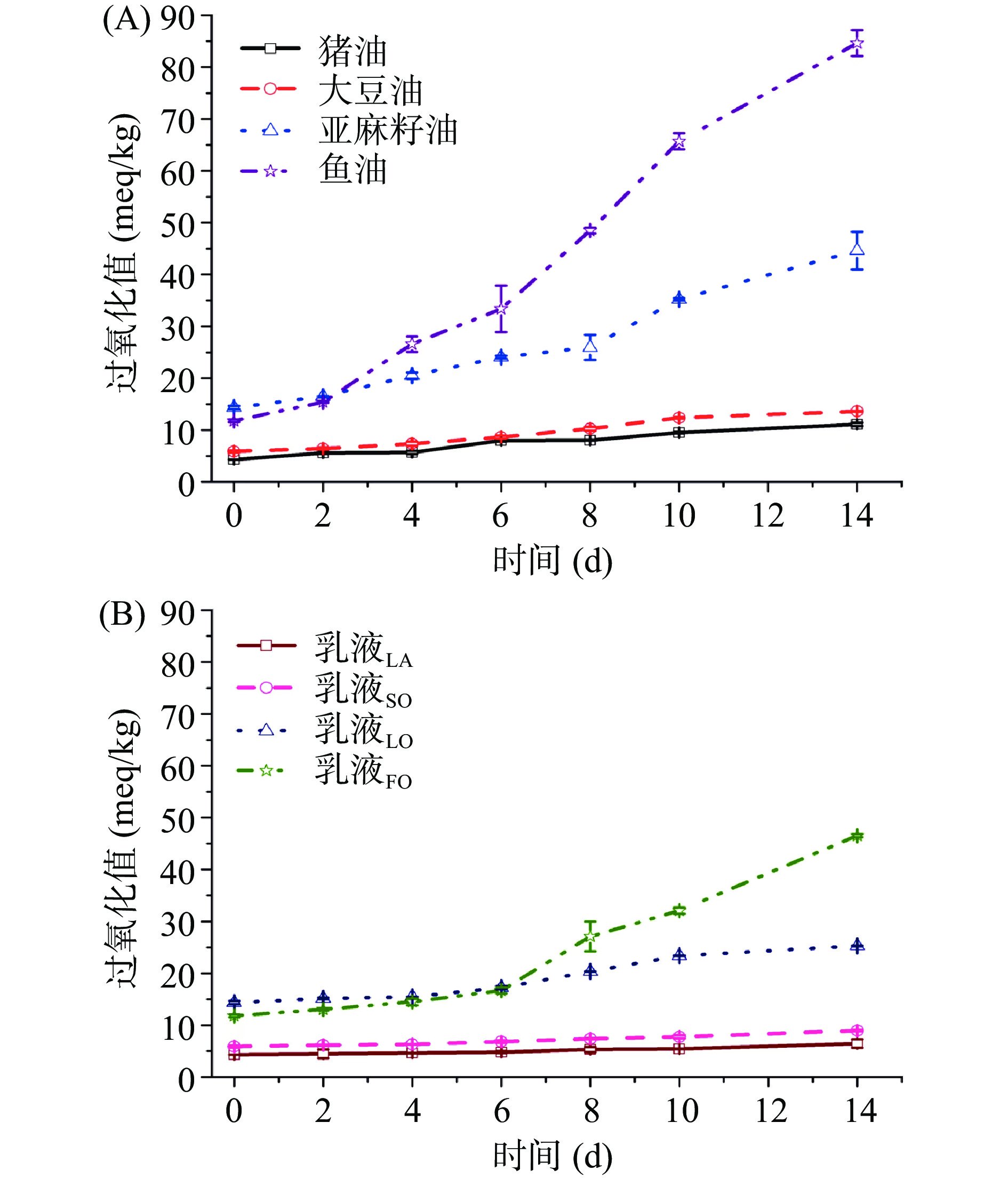
油脂中的由于不饱和脂肪酸的存在,因此暴露在空气环境中容易被氧化。已有相关研究报道通过形成乳液的形式可以提高油脂的氧化稳定性[34]。因此,本文研究了四种油脂制备成乳液后的氧化稳定性。从图8可以看出,四种油脂未被乳化时,在37 ℃加速氧化的环境下油脂的过氧化值逐渐上升,且随着储藏时间的延长,油脂的过氧化值增大的越明显。猪油氧化至第9 d时,其过氧化值达到8.05±0.08 meq/kg,超过了国家限量标准[35]。同样大豆油、亚麻籽油、鱼油的过氧化值也在不同时间段超出相应国家限定标准[36−37]。从中可以看出油脂中不饱和脂肪酸的含量越高、不饱和程度越大越容易被氧化。然而,当猪油、大豆油、亚麻籽油、鱼油四种油脂以乳液的形式存在时,油脂的氧化稳定性得到明显提升。随着储藏时间的延长,乳液中各油脂的过氧化值呈现缓慢上升的趋势。油脂以水包油的形式存在可有效降低油脂于外界环境的可及性[38]。朱波等[17]利用豌豆蛋白乳化亚麻籽油后其氧化稳定性亦得到明显提高。另外,相比于其它三种乳液,乳液LA的过氧化值变化趋势最缓,这也表明SPI-SE复合乳化剂对猪油的乳化效果最好。该结果与乳液的储藏稳定性结果相一致。
3. 结论
本文通过SPI-SE复合乳化剂同时乳化LA、SO、LO和FO四种油脂制备乳液,对比了四种乳液稳定性之间的差异。发现SPI-SE作用下的乳液LA稳定性最佳,相同条件乳液LA的粒径最小(8.411±0.670 μm),颗粒大小分布最均匀。相反,随着油脂中不饱和脂肪酸的比例增加,所制备的乳液的稳定性呈现降低的趋势(乳液SO>乳液LO>乳液FO)。另外,四种油脂经乳化后,其氧化稳定性均得到一定提高。油脂不饱和脂肪酸的比例以及不饱和程度对SPI-SE所制备乳液的稳定性有很大影响,这与Dafna等[29]的研究结果相似。该研究可为油脂的乳化研究及保存应用上提供理论参考。然而,关于油脂乳液的稳定性受多种因素的影响如在食品加工中存在的加热、冷冻等应用,因此温度条件对乳液稳定性的影响如冻融稳定性等还需做进一步的研究。
-
表 1 猪油、大豆油、亚麻籽油、鱼油中的脂肪酸组成(%)
Table 1 Compositions of fatty acid in lard, soybean oil, linseed oil and fish oil (%)
脂肪酸 油脂 猪油 大豆油 亚麻籽油 鱼油 肉豆蔻酸 1.69±0.11 0.07±0.01 − 0.33±0.01 棕榈酸 25.34±0.71 13.00±0.06 8.32±0.17 15.62±0.06 棕榈油酸 2.64±0.14 0.09±0.02 0.07±0.01 0.43±0.03 十六碳三烯酸 − − − 0.09±0.00 十七烷酸 0.24±0.02 0.07±0.01 0.04±0.02 0.07±0.01 十七碳烯酸 0.18±0.03 0.06±0.01 硬脂酸 17.81±0.21 5.74±0.13 6.58±0.04 4.71±0.03 油酸 39.77±0.71 20.01±1.40 12.83±0.04 59.58±0.66 亚油酸 11.15±0.71 49.96±0.58 15.62±0.08 0.17±0.02 亚麻酸 0.04±0.00 9.87±0.98 56.14±0.22 − 十八碳四烯酸 − − − 2.15±0.01 十九烷酸 − − − 0.09±0.01 二十碳烷酸 0.25±0.03 0.39±0.00 0.19±0.01 − 二十碳烯酸 0.98±0.05 0.65±0.02 0.15±0.01 0.16±0.02 二十碳二烯酸 0.43±0.09 二十碳三烯酸 0.05±0.00 − − − 花生四烯酸 0.08±0.02 − − 0.12±0.00 二十碳五烯酸(EPA) − − − 4.65±0.06 二十一碳烯酸 − − − 0.34±0.01 二十二碳烯酸 − − − 0.05±0.01 二十二碳六烯酸(DHA) − − − 11.44±0.02 Δ饱和脂肪酸 45.33 19.27 15.13 20.82 Δ不饱和脂肪酸 54.32 80.64 84.81 79.18 注:所有数据均测量三次取平均值得出,结果以“平均值±标准偏差”的方式表示,表中“−”代表未检出。 表 2 不同油脂制备的乳液的平均粒径(μm)
Table 2 Mean diameters of emulsion which prepared by different oils (μm)
乳液类型 平均粒径(μm) 乳液LA 8.411±0.670a 乳液SO 9.954±0.006ab 乳液LO 11.469±0.456b 乳液FO 14.919±1.363c 注:表中数据右上小写字母代表显著性差异(P<0.05)。 表 3 不同油脂制备的乳液的焓值
Table 3 Enthalpy of lotion prepared with different oils
样品 峰1 峰2 To(℃) Tp(℃) Tc(℃) ΔH(J/g) To(℃) Tp(℃) Tc(℃) ΔH(J/g) 猪油 −19.32±0.62e −1.19±0.02f 11.78±0.31d −26.35±0.90b 17.96±0.09b 26.04±0.11c 35.86±0.75c −16.65±0.76b 大豆油 −30.99±0.06bc −26.63±0.04b −22.51±0.30a −12.03±1.21e −22.82±0.02a −19.12±0.36a −13.91±0.13a −2.65±0.18d 亚麻籽油 −29.05±0.57d −24.87±0.02c −18.87±1.25b −1.11±0.08f 鱼油 −28.94±0.08d −16.26±0.01d −3.98±0.97c −9.84±0.04e SPI-SE/猪油 −18.16±0.08f −2.40±0.08e 15.90±0.15e −30.87±2.92a 20.36±0.08c 29.79±0.30d 43.36±0.20d −26.80±1.13a SPI-SE/大豆油 −30.32±0.30c −26.83±0.24b −22.77±0.33a −21.38±0.72c −22.78±0.33a −18.19±0.11a −13.31±0.37a −2.81±0.11d SPI-SE/亚麻籽油 −33.20±0.28a −28.85±0.27a −20.69±0.61ab −17.05±1.06d SPI-SE/鱼油 −31.18±0.25b −26.34±0.48b −23.18±0.25a −2.59±0.02f −23.68±0.46a −13.75±0.39b −5.09±0.13b −7.59±0.08c 注:同列数据右上角小写字母代表显著性差异(P<0.05)。 -
[1] TADROS, THARWAT F. Emulsion formation, stability, and rheology[M]. Wiley-VCH Verlag GmbH & Co. KGaA, 2013:175.
[2] OZTURK B, MCCLEMENTS D J. Progress in natural emulsifiers for utilization in food emulsions[J]. Current Opinion in Food Science,2016(7):1−6.
[3] NISHINARI K, FANG Y, GUO S, et al. Soy proteins:A review on composition, aggregation and emulsification[J]. Food Hydrocolloids,2014(39):301−318.
[4] LIN D R, XIAO L J, LI S Q, et al. Effects of fructooligosaccharide and soybean protein isolate in the microencapsulation of walnut oil[J]. Industrial Crops and Products,2022(177):114431.
[5] 刘聪慧, 王欣. 大豆分离蛋白与大豆磷脂比例对超声乳化亚麻籽油乳液特性的影响[J]. 中国油脂,2022,47(5):41−46,72. [LIU C H, WANG X. Effects of ratio of soybean protein isolate to soybean lecithin on the properties of flaxseed oil emulsion prepared by ultrasound[J]. China Oils and Fats,2022,47(5):41−46,72.] LIU C H, WANG X . Effects of ratio of soybean protein isolate to soybean lecithin on the properties of flaxseed oil emulsion prepared by ultrasound[J]. China Oils and Fats,2022 ,47 (5 ):41 −46,72 .[6] 朱登兆, 鲍云翔, 吕思瑶, 等. 大豆分离蛋白-染料木黄酮作为复合乳化剂制备O/W乳液及其性质研究[J]. 食品科技,2022,47(5):260−267. [ZHU D Z, BAO Y X, LÜ S Y, et al. Effect of soybean protein isolate-genistein as composite emulsifier on the functional properties of emulsion[J]. Food Science and Technology,2022,47(5):260−267.] doi: 10.3969/j.issn.1005-9989.2022.5.spkj202205039 ZHU D Z, BAO Y X, LÜ S Y, et al . Effect of soybean protein isolate-genistein as composite emulsifier on the functional properties of emulsion[J]. Food Science and Technology,2022 ,47 (5 ):260 −267 . doi: 10.3969/j.issn.1005-9989.2022.5.spkj202205039[7] 杨凯麟, 康梦瑶, 耿宏庆, 等. 水相pH和Na+对微晶纤维素与猪油的Pickering乳液稳定性的影响[J]. 食品工业科技,2022,43(20):87−96. [YANG K L, KANG M Y, GENG H Q, et al. Effect of aqueous phase pH and Na+ on the stability of microcrystalline cellulose-lard Pickering emulsion[J]. Science and Technology of Food Industry,2022,43(20):87−96.] YANG K L, KANG M Y, GENG H Q, et al . Effect of aqueous phase pH and Na+ on the stability of microcrystalline cellulose-lard Pickering emulsion[J]. Science and Technology of Food Industry,2022 ,43 (20 ):87 −96 .[8] JIANG J, SONG Z Y, WANG Q L, et al. Ultrasound-mediated interfacial protein adsorption and fat crystallization in cholesterol-reduced lard emulsion[J]. Ultrasonics Sonochemistry,2019(58):104641.
[9] 许笑男, 刘元法, 李进伟, 等. 超声和酶处理对乳化猪油体外消化特性的影响[J]. 食品科学,2018,39(1):111−117. [XU X N, LIU Y F, LI J W, et al. Effect of ultrasound and glutamine transaminase treatments on the in vitro digestibility of emulsified lard[J]. Food Science,2018,39(1):111−117.] doi: 10.7506/spkx1002-6630-201801017 XU X N, LIU Y F, LI J W, et al . Effect of ultrasound and glutamine transaminase treatments on the in vitro digestibility of emulsified lard[J]. Food Science,2018 ,39 (1 ):111 −117 . doi: 10.7506/spkx1002-6630-201801017[10] 胡靖, 刘政芳, 彭颖, 等. 酵母抽提物复合膏状调味料粘度与稳定性研究[J]. 中国调味品,2021,46(5):77−79. [HU J, LIU Z F, PENG Y, et al. Study on the viscosity and stability of yeast extract compound paste seasoning[J]. China Condiment,2021,46(5):77−79.] doi: 10.3969/j.issn.1000-9973.2021.05.015 HU J, LIU Z F, PENG Y, et al . Study on the viscosity and stability of yeast extract compound paste seasoning[J]. China Condiment,2021 ,46 (5 ):77 −79 . doi: 10.3969/j.issn.1000-9973.2021.05.015[11] 邓伶俐, 刘雨雨, 康雪帆, 等. 蔗糖酯对大豆分离蛋白乳化性的影响及作用机理[J]. 中国食品学报,2016,16(12):43−49. [DENG L L, LIU Y Y, KANG X F, et al. Effect of sucrose ester on the emulsifying properties of soy protein isolate[J]. Journal of Chinese Institute of Food Science and Technology,2016,16(12):43−49.] DENG L L, LIU Y Y, KANG X F, et al . Effect of sucrose ester on the emulsifying properties of soy protein isolate[J]. Journal of Chinese Institute of Food Science and Technology,2016 ,16 (12 ):43 −49 .[12] HU X, BINKS B P, CUI Z G. High internal phase emulsions stabilized by adsorbed sucrose stearate molecules and dispersed vesicles[J]. Food Hydrocolloids,2021(121):107002.
[13] ARIYAPRAKAI S, LIMPACHOTI T, PRADIPASENA P. Interfacial and emulsifying properties of sucrose ester in coconut milk emulsions in comparison with Tween[J]. Food Hydrocolloids,2013,30(1):358−367. doi: 10.1016/j.foodhyd.2012.06.003
[14] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 5009.168-2016 食品安全国家标准食品中脂肪酸的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission the People's Republic of China, China Food and Drug Administration. GB 5009.168-2016 National food safety standards determination of fatty acids in food[S]. Bei Jing:Standards Press of China, 2016.] National Health and Family Planning Commission the People's Republic of China, China Food and Drug Administration. GB 5009.168-2016 National food safety standards determination of fatty acids in food[S]. Bei Jing: Standards Press of China, 2016.
[15] TIAN X L, WANG D, LI Y H, et al. Preparation and characterization of emulsions of soy protein isolate-chitosan quaternary ammonium salt complexes and peppermint essential oil with extended release effect[J]. Food Hydrocolloids,2023(142):108779.
[16] COFRADES S, GARCIMARTÍN A, PÉREZ-MATEOS M, et al. Stabilized soy protein emulsion enriched with silicon and containing or not methylcellulose as novel technological alternatives to reduce animal fat digestion[J]. Food Research International,2023(170):112833.
[17] 朱波, 蒋将, 李进伟, 等. 三种不同脂肪酸组成的油脂乳化液的理化性质研究[J]. 食品工业科技,2013,34(14):103−107. [ZHU B, JIANG J, LI J W, et al. Physicochemical properties of three different oil in water emulsions[J]. Science and Technology of Food Industry,2013,34(14):103−107.] ZHU B, JIANG J, LI J W, et al . Physicochemical properties of three different oil in water emulsions[J]. Science and Technology of Food Industry,2013 ,34 (14 ):103 −107 .[18] ZHENG Y, OGUZLU H, BALDELLI A, et al. Sprayable cellulose nanofibrils stabilized phase change material Pickering emulsion for spray coating application[J]. Carbohydrate Polymers,2022(291):119583.
[19] WANG Y, LIN R H, SONG Z Y, et al. Freeze-thaw stability and oil crystallization behavior of phospholipids/whey protein-costabilized acidic emulsions with four oil types[J]. Food Hydrocolloids,2022(125):107385.
[20] SUI X N, BI S, QI B K, et al. Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin:Its emulsifying property and emulsion stability[J]. Food Hydrocolloids,2017,63:727−734. doi: 10.1016/j.foodhyd.2016.10.024
[21] TAHA A, HU T, ZHANG Z, et al. Effect of different oils and ultrasound emulsification conditions on the physicochemical properties of emulsions stabilized by soy protein isolate[J]. Ultrasonics Sonochemistry,2018,49:283−293. doi: 10.1016/j.ultsonch.2018.08.020
[22] SHANTHA N C, DECKER E A. Rapid, sensitive, iron-based spectrophotometric methods for determination of peroxide values of food lipids[J]. Journal of AOAC International,1994,77(2):421−424. doi: 10.1093/jaoac/77.2.421
[23] 中华人民共和国国家卫生和计划生育委员会. GB5009.227-2016 食品安全国家标准食品中过氧化值的测定[S]. 北京:中国标准出版社, 2016. [National Health and Family Planning Commission the People's Republic of China, GB5009.227-2016 National food safety standards determination of peroxide value in food[S]. Beijing:Standards Press of China, 2016.] National Health and Family Planning Commission the People's Republic of China, GB5009.227-2016 National food safety standards determination of peroxide value in food[S]. Beijing: Standards Press of China, 2016.
[24] 周纷. 脂肪类型和脂肪酸饱和程度对猪肉蛋白质乳化特性的影响[D]. 锦州:渤海大学, 2017. [ZHOU F. Effect of lipid types and fatty acid saturation degree on the pork meat proteins emulsifying properties[D]. Jinzhou:Bohai University, 2017.] ZHOU F. Effect of lipid types and fatty acid saturation degree on the pork meat proteins emulsifying properties[D]. Jinzhou: Bohai University, 2017.
[25] 李艳青, 陈洪生, 俞龙浩, 等. 氧化大豆分离蛋白对鲤鱼肌原纤维蛋白乳化性和凝胶性的影响[J]. 农产品加工,2018(5):7−9,12. [LI Y Q, CHEN H S, YU L H, et al. Influence of oxidized soy protein isolate on emulsifying and gel properties of common carp ( Cyprinus carpio) myofibrillar protein[J]. Farm Products Processing,2018(5):7−9,12.] LI Y Q, CHEN H S, YU L H, et al . Influence of oxidized soy protein isolate on emulsifying and gel properties of common carp (Cyprinus carpio) myofibrillar protein[J]. Farm Products Processing,2018 (5 ):7 −9,12 .[26] WANG X, WANG S T, YANG J Y, et al. Microemulsions based on peony ( Paeonia suffruticosa Andr.) seed oil and its fatty acids:Product development and stability enhancement[J]. Industrial Crops and Products,2022(183):114987.
[27] ZHANG L, WANG P, YANG Z Y, et al. Molecular dynamics simulation exploration of the interaction between curcumin and myosin combined with the results of spectroscopy techniques[J]. Food Hydrocolloids,2020(101):105455.
[28] WARAHO T, MCCLEMENTS D J, DECKER E A. Impact of free fatty acid concentration and structure on lipid oxidation in oil-in-water emulsions[J]. Food Chemistry,2011,129(3):854−859. doi: 10.1016/j.foodchem.2011.05.034
[29] DAFNA M P, NETA G, AYELET F, et al. Impact of fatty acids unsaturation on stability and intestinal lipolysis of bioactive lipid droplets[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects,2019(561):70−78.
[30] LIU F, CHEN Z, TANG C H. Microencapsulation properties of protein isolates from three selected phaseolus legumes in comparison with soy protein isolate[J]. LWT-Food Science and Technology,2014,55(1):74−82. doi: 10.1016/j.lwt.2013.09.008
[31] MOHAMMED M, MAHMOUD S, XU X Y. Effect of microencapsulation using soy protein isolate and gum arabic as wall material on red raspberry anthocyanin stability, characterization, and simulated gastrointestinal conditions[J]. Ultrasonics Sonochemistry,2020(63):104927.
[32] ISHIBASHI C, HONDOH H, UENO S. Influence of morphology and polymorphic transformation of fat crystals on the freeze-thaw stability of mayonnaise-type oil-in-water emulsions[J]. Food Research International,2016,89(1):604−613.
[33] FRELICHOWSKA J, BOLZINGER M A, VALOUR J P, et al. Pickering w/o emulsions:Drug release and topical delivery[J]. International Journal of Pharmaceutics,2009,368(1−2):7−15. doi: 10.1016/j.ijpharm.2008.09.057
[34] 史昫皓, 徐振波, 蒋将, 等. 两种不同芯材制备的乳化液稳定性研究[J]. 食品工业科技,2015,36(17):49−52,57. [SHI X H, XU Z B, JIANG J, et al. Study on the stability of emulsions prepared by different core oil[J]. Science and Technology of Food Industry,2015,36(17):49−52,57.] SHI X H, XU Z B, JIANG J, et al . Study on the stability of emulsions prepared by different core oil[J]. Science and Technology of Food Industry,2015 ,36 (17 ):49 −52,57 .[35] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 8937-2023 食用动物油脂 猪油[S]. 北京:中国标准出版社, 2023. [General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 8937-2023 Edible animal fats and oils–lard[S]. Beijing:Standards Press of China, 2023.] General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 8937-2023 Edible animal fats and oils–lard[S]. Beijing: Standards Press of China, 2023.
[36] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 1535-2017 大豆油[S]. 北京:中国标准出版社, 2017. [General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 1535-2017 Soybean oil[S]. Beijing:Standards Press of China, 2017.] General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 1535-2017 Soybean oil[S]. Beijing: Standards Press of China, 2017.
[37] 国家市场监督管理总局, 中国国家标准化管理委员会. GB/T 8235-2019 亚麻籽油[S]. 北京:中国标准出版社, 2019. [State Administration for Market Regulation, Standardization Administration of the People's Republic of China. GB/T 8235-2019 Linseed oil[S]. Beijing:Standards Press of China, 2019.] State Administration for Market Regulation, Standardization Administration of the People's Republic of China. GB/T 8235-2019 Linseed oil[S]. Beijing: Standards Press of China, 2019.
[38] 王中江, 常宗明, 张翠, 等. 超声波及高压均质制备大豆蛋白-磷脂酰胆碱纳米乳液的特性比较[J]. 中国食品学报,2019,19(8):157−165. [WANG Z J, CHANG Z M, ZHANG C, et al. Comparison of the characteristic of soybean protein-phosphatidylcholine nanoemulsion by ultrasound and high pressure homogenization[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(8):157−165.] WANG Z J, CHANG Z M, ZHANG C, et al . Comparison of the characteristic of soybean protein-phosphatidylcholine nanoemulsion by ultrasound and high pressure homogenization[J]. Journal of Chinese Institute of Food Science and Technology,2019 ,19 (8 ):157 −165 . -
期刊类型引用(2)
1. 蒋亚吉,丁雪梅,刘亚萍,孟金明. 风吹豆豉牛肉干加工工艺的研究. 粮食与油脂. 2023(12): 102-107 .  百度学术
百度学术
2. 罗秋霞,何江红,刘倩,夏龙,李杨,张惠,程利思,刘承慈,苏雨婷,曾义星. 不同大米对八宝粥食用品质的影响. 粮食与食品工业. 2022(04): 33-36 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:




 下载:
下载:



