Effects of Different Postharvest Treatments on Browning, Active Oxygen Metabolism and Saccharides of Gongcheng Persimmon
-
摘要: 本文分析了有氧、真空和真空+1-MCP三种采后处理方式对脱涩后柿子贮藏过程中果实褐变、活性氧代谢和糖类的影响,并对褐变与各指标的相关性进行分析。真空和真空+1-MCP组柿子贮藏过程中的褐变指数BI低于有氧组,其中真空+1-MCP组褐变程度最低;三种采后处理柿子贮藏过程中SOD、APX活性分别呈下降和上升的趋势,真空组柿子SOD活性最低,真空和真空+1-MCP条件下柿子APX活性高于有氧组;真空和真空+1-MCP抑制柿子CAT活性的增加,减少H2O2积累,同时抑制羟自由基的能力和抗坏血酸含量较低。真空和真空+1-MCP组柿子还原糖含量低于有氧组,其中真空+1-MCP组增加最慢,从贮藏开始时的14.10%增加至12 d时的14.87%;真空+1-MCP组柿子果胶含量下降缓慢。相关性分析可知,不同采后处理柿子贮藏过程中柿子褐变与各指标的相关性并不相同,但柿子褐变指数BI均与果胶呈负相关,与还原糖呈正相关。综合可知真空和真空+1-MCP条件更有利于抑制脱涩后月柿的褐变。Abstract: In this paper, the effects of three postharvest treatments (aerobic,vacuum,vacuum+1-MCP) on browning, active oxygen metabolism and saccharides during storage of deastringent persimmon were researched. Meanwhile, the correlations between browning and other indexes were analyzed. BI of vacuum and vacuum+1-MCP was lower than that in aerobic group, and the browning degree in vacuum+1-MCP group was the lowest. The SOD and APX activities of the three kinds of persimmon treated after harvest decreased and increased respectively, and the SOD activities of the vacuum group were the lowest, the APX activities under vacuum and vacuum+1-MCP conditions were higher than that in aerobic group. At vacuum and vacuum+1-MCP conditions, the increase of CAT activity of persimmon was inhibited, and the accumulation of H2O2 was reduced, with lower ability to inhibit hydroxyl radical and ascorbic acid content. The reducing sugar content of persimmon in vacuum and vacuum+1-MCP groups was lower than that in aerobic group, and the increase in vacuum+1-MCP group was the slowest, from 14.10% at the beginning of storage to 14.87% on 12 d. The pectin content of persimmon in vacuum+1-MCP group decreased slowly. Correlation analysis showed that the correlations between browning and various indexes under different postharharvest treatments were different. The persimmon BI was always negatively correlated with pectin, meanwhile positively correlated with reducing sugar. It can be concluded that vacuum and vacuum+1-MCP conditions are more conducive to inhibiting the browning of persimmon after deastringent.
-
柿子起源于中国,有悠久的栽培历史,在我国的栽培面积和产量长期稳居世界首位[1]。我国种植的柿子以涩柿品种为主,人工脱涩处理是销售前的必经环节。高浓度CO2脱涩以方便操作,处理量大的优势成为最常用的商业化脱涩方式,然而脱涩处理往往会破坏柿果实内部氧化还原的平衡状态,加速柿子软化、褐变等,曹坤[2]对不同品种的柿子脱涩研究发现,可溶性固形物含量越高、风味越香甜的涩柿品种(如‘恭城月柿’、‘磨盘柿’等),越容易发生褐变。
活性氧代谢和糖类变化与果蔬褐变密切相关。在易褐变果实荔枝、苹果、葡萄、莲藕均发现果实褐变与活性氧代谢有关[3−6],韩卫娟等[7]对‘平核无’柿子高CO2脱涩处理后发现氧化压力失衡使柿子过氧化物酶、超氧化物歧化酶、过氧化氢酶等活性氧清除酶活力显著上升,以维持氧化还原反应的平衡状态。研究还发现一些加工水果制品的褐变不仅受到多酚氧化的影响,还受到细胞壁多糖等的影响[8−9];荔枝、龙眼等加工过程中褐变与还原糖、果胶等糖含量有关[10−11]。‘恭城月柿’是完全涩柿品种,且在我国产量最大[12]。目前对该品种柿子的研究主要集中在脱涩保脆以及干制品加工技术方面,但有关CO2脱涩后柿子褐变发生的原因尚未见系统报道。
柿子从完成脱涩,再经包装、运输、零售直到消费者手中,一般需要1~2周的时间,这个过程也是柿子最容易发生褐变的过程。目前常用1-甲基环丙烯(1-methylcyclopropene,1-MCP)、真空、气调、冰温等一种或者多种联合的采后处理[12−15],生产上多采用真空结合1-MCP包装处理。李莹等[16]对CO2脱涩‘磨盘柿’研究发现脱涩过程中1-MCP加入能有效降低活性氧的积累,维持果实硬度。因此本文以‘恭城月柿’为原料,经高浓度CO2脱涩后,研究有氧、真空、真空结合1-MCP三种处理条件下柿子褐变、活性氧代谢和糖类物质变化规律,并进一步对各指标进行相关性分析,明确月柿脱涩后不同采后处理方式下柿子褐变与活性氧代谢和糖类物质的关系,为进一步指导柿子脱涩后包装、运输、销售过程中保鲜技术的研究提供一定的理论支撑。
1. 材料与方法
1.1 材料与仪器
恭城月柿 桂林恭城丰华园食品有限公司提供,采收时间2021年11月,成熟度八成;1-MCP保鲜剂 青岛丰邦农化有限公司;葡萄糖、氢氧化钠、咔唑 均为分析纯,天津博迪化工股份有限公司;超氧化物歧化酶(SOD)活性检测试剂盒、抗坏血酸过氧化物酶(APX)活性检测试剂盒、过氧化氢(H2O2)含量检测试剂盒、无水半乳糖醛酸 分析纯,北京索莱宝科技有限公司;羟自由基(·OH)测定试剂盒 分析纯,南京建成生物工程研究所;a-萘酚、抗坏血酸、H2O2 分析纯,天津市大茂化学试剂厂;4,7-二苯基-1,10-菲啰啉 分析纯,上海源叶生物科技有限公司;无水乙醇、硫酸、3,5-二硝基水杨酸、磷酸钠 分析纯,成都市科隆化学品有限公司;聚乙烯吡咯烷酮 分析纯,天津科密欧化学试剂有限公司;19丝聚酯包装袋 食品级,石家庄喜龙包装有限公司。
PAL-1便携式数显折射计 日本Atago爱拓;400A多功能粉碎机 永康市红太阳机电有限公司;CM-3600A分光测色计 柯尼卡美能达控股公司;UV-6100紫外可见分光光度计 上海元析仪器有限公司;SIGMA3-18KS高速冷冻离心机 德国Sigma公司;ATX124精密电子天平 日本Shimadzu公司;WJ-3A数显恒温三温水浴锅 常州市伟嘉仪器制造有限公司。
1.2 实验方法
1.2.1 样品处理
恭城月柿采收自桂林恭城丰华园食品有限公司月柿种植基地,采收时间2021年11月;单果重量(210±26) g,硬度为(22.15±1.05) N,色泽橙黄,无机械伤和病虫害,采摘当天运送至实验室。选取285个果实,参照覃慧[17]的方法,在室温CO2浓度大于95%密闭罐中脱涩48 h。脱涩后的柿子分成19份,每份15个果实。6份柿子分别使用19丝聚酯透明包装袋(下同)敞口存放,记为有氧组;6份柿子分别使用包装袋抽气至真空度0.08 MPa存放,记为真空组;6份柿子单层排列放入透明包装袋内,温水润湿的1-MCP保鲜剂包(0.5 g/包,有效成分0.03%)摆放在包装袋中央,然后抽气至真空度0.08 MPa存放,记为真空+1-MCP组;剩余1份直接取样为贮藏0 d样品。以上三组均在平均温度25 ℃室内环境下存放,空气湿度65%±5%。每组柿子每隔2 d取样一次,去皮后柿子每个果实均匀取样后打浆−18 ℃存放测定理化指标,酶活性样品液氮打粉后−80 ℃存放待用。
1.2.2 褐变指数测定
采用分光测色计测定去皮后柿子果肉表面的色泽(L* 、a* 、b*),柿子褐变程度以褐变指数BI表示,根据Feumba等[18]方法计算褐变指数,计算公式如下:
BI=(x−0.31)×100/0.172 式中,x=(a*+1.75×L*)/(5.645×L*+a*−3.012×b*)。
1.2.3 活性氧代谢相关酶活性测定
1.2.3.1 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照北京索莱宝生产的试剂盒测定,黄嘌呤氧化酶偶联反应体系抑制百分率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位。具体操作步骤和计算方法为:0.1 g液氮打粉的柿子加入1 mL提取液冰浴匀浆,8000×g、4 ℃离心10 min,取上清测定。按照说明添加各试剂和蒸馏水至对照管、空白管1、空白管2;37 ℃水浴30 min后,置于1 mL玻璃比色皿560 nm测定吸光度,分别记为A测定、A对照、A1空白、A2空白,计算ΔA测定=A测定−A对照,ΔA空白=A1空白−A2空白。
SOD活性(U/g)=[抑制百分率/(1−抑制百分率)×V反总]/(W×V样/V样总)×F=11.11×抑制百分率/(1−抑制百分率)/W×F 式中,抑制百分率(%)=(ΔA空白−ΔA测定)/ΔA空白×100;W:样本质量,g;F:样本稀释倍数。
1.2.3.2 抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性
参考北京索莱宝生产的试剂盒测定,以每毫克组织每分钟氧化1 μmol抗坏血酸为1个酶活单位。0.1 g液氮打粉的柿子加入1 mL提取液冰浴匀浆,13000×g、4 ℃离心20 min,取上清置冰上待测。空白管:依次在1 mL石英比色皿中加入100 μL蒸馏水、700 μL预热的试剂一、100 μL试剂二和100 μL试剂三,迅速混匀后在290 nm 测定10 s和130 s 光吸收A1和A2,ΔA空白管=A1−A2。测定管:依次在1 mL石英比色皿中加入100 μL上清液、700 μL预热的试剂一、100 μL试剂二和100 μL试剂三,迅速混匀后在290 nm测定10 s和130 s光吸收A3和A4,ΔA 测定管=A3−A4。
APX活性(U/g)=1.79×(ΔA测定管−ΔA空白管)/W 式中,W:样本质量,g。
1.2.3.3 过氧化氢酶(catalase,CAT)活性
参考曹建康等[19]方法,以每克果蔬样品(鲜重)每分钟吸光度变化值增加0.01时为1个过氧化物酶活性单位(U),表示为0.01△OD240/min·g。称取5.0 g样品加入5.0 mL 提取缓冲液在冰浴研磨成匀浆,于4 ℃、12000×g 离心30 min,收集上清液即为酶提取液。2.9 mL 20 mmol/L H2O2溶液和100 μL酶提取液混合,以蒸馏水为参比空白,在反应15 s时开始记录反应体系在波长240 nm处吸光度值,作为初始值,然后每隔30 s记录一次,连续测定。计算公式:
ΔOD240=ΔOD240F−ΔOD240I/(tF−tI) 式中,△OD240:每分钟反应混合物吸光度变化值;△OD240F:反应混合液吸光度终止值;△OD240I:反应混合液吸光度初始值;tF:反应终止时间,min; tI:反应初始时间,min。
U=ΔOD240×V/(0.01×VS×m) 式中,V:样品提取液总体积,mL;VS:测定时所取样品提取液体积,mL;m:样品质量,g。
1.2.4 过氧化氢含量测定
根据北京索莱宝生产的过氧化氢(H2O2)含量检测试剂盒说明书的操作步骤,采用可见分光光度法在415 nm测定吸光值并计算含量。称取约0.1 g 组织,加入1 mL试剂一进行冰浴匀浆;8000×g、4 ℃离心10 min,取全部上清液,置冰上待测。测定管、标准管、空白管按照说明加入样液、标准溶液、试剂一、试剂二、试剂三后,4000×g常温离心10 min,弃上清,留沉淀。加入试剂四溶解沉淀,室温静置5 min,倒入比色皿中,415 nm处,蒸馏水调零,记录测定管吸光度。计算∆A测定=A测定管−A空白管,∆A标准=A标准管−A空白管。
H2O2含量(μmol/g)=ΔA测定/(ΔA标准/C标液)×V样本/(V样本/V提取×W)=ΔA测定/ΔA标准/W 式中,V样本:加入的样本体积,mL;W:组织质量,g;V提取:提取过程中所用体积,mL。
1.2.5 抑制羟自由基能力测定
抑制羟自由基(·OH)能力采用南京建成生物工程研究所生产的羟自由基(·OH)试剂盒测定。规定每毫克组织在37 ℃下反应1 min,使反应体系中H2O2的浓度降低1 mmol/L为一个抑制羟自由基能力单位。具体方法为分别往空白管、标准管、对照管加入0.4、0.2、0.2 mL双蒸水,标准管加入0.2 mL 0.03% H2O2标准应用液,对照管和测定管加入0.2 mL底物应用液,测定管加入0.2 mL样本,四个管中分别加入0.4 mL试剂三应用液迅速混匀,37 ℃反应1 min,然后立即加入显色剂终止反应。混匀,室温放置20 min后,1 cm光径,550 nm,双蒸水调零,测各管吸光度值A空白、A标准、A对照、A测定。
抑制羟自由能力(U/mg)=(A对照−A测定)/(A标准−A空白)×C标准×N/(C样×V样) 式中,C标准:标准品浓度,8.824 mmol/L;N:样本测试前稀释倍数;V样:取样量,g; C样 :样液浓度,mg/mL。
1.2.6 抗坏血酸含量测定
采用GB 5009.86-2016《食品安全国家标准 食品中抗坏血酸的测定》中的2,6-二氯靛酚滴定法测定[20]。
1.2.7 还原糖和果胶含量测定
还原糖含量采用GB 5009.7-2016 《食品安全国家标准 食品中还原糖的测定》中的直接滴定法测定[21],果胶含量采用NY/T 2016-2011《水果及其制品中果胶含量的测定 分光光度法》中的咔唑比色法测定[22]。
1.3 数据处理
运用Excel 2007软件进行数据处理,采用Duncan对数据的差异性进行分析,P<0.05表示差异显著,P<0.01表示差异性极显著;使用Origin 2021对数据进行Pearson相关性分析并作图。
2. 结果与分析
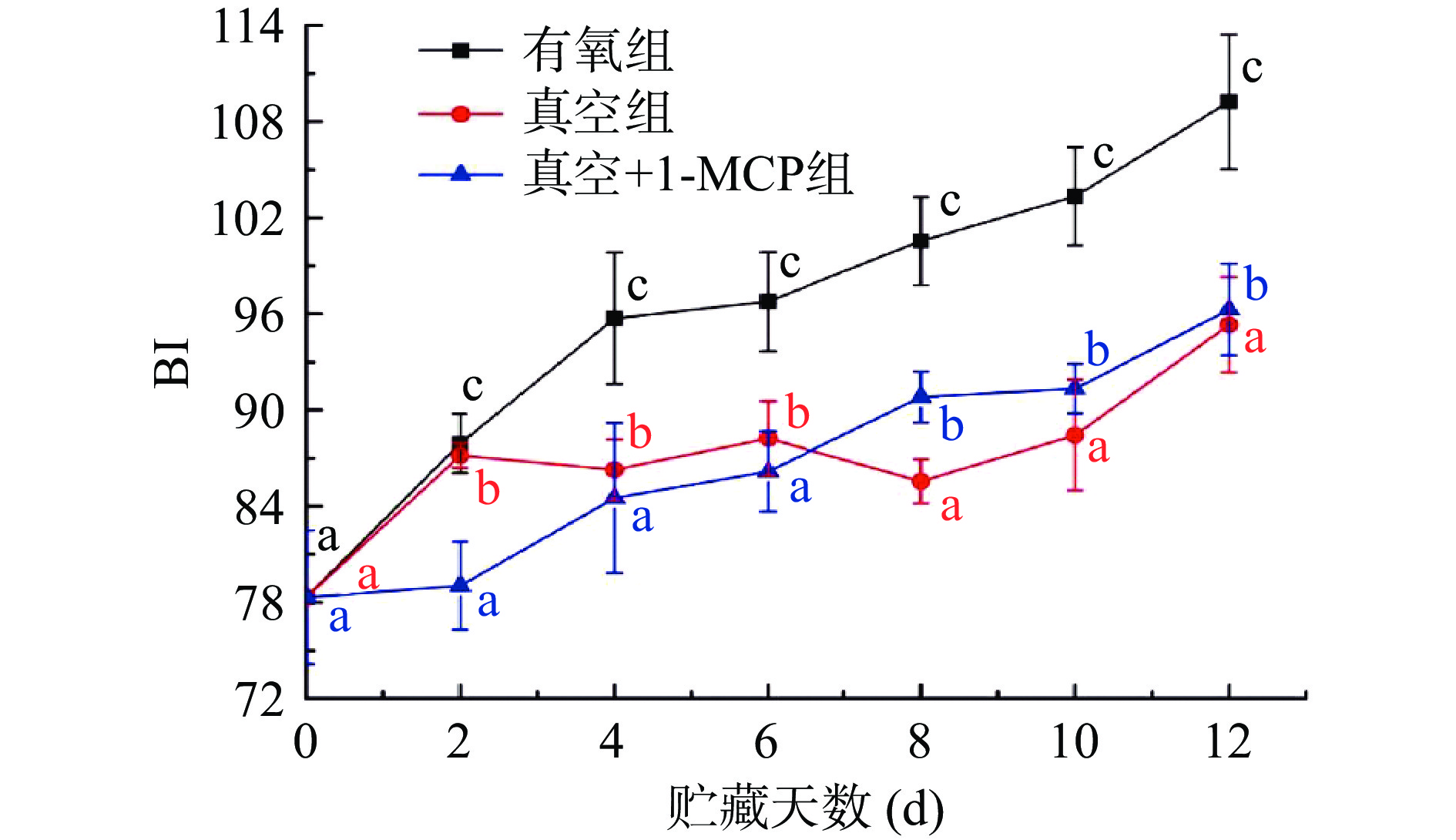
2.1 不同采后处理对柿子褐变指数BI的影响
褐变是反映柿子外观和品质最直观的指标,脱涩后的柿子比未脱涩的柿子更容易发生褐变[23]。脱涩处理往往会破坏柿果实内部氧化还原的平衡状态,CO2脱涩磨盘柿脱涩完成当天呼吸速率是未脱涩组的3.8倍[16]。曹坤[2]对极易褐变柿子品种‘中柿1号’脱涩后发现,该品种在CO2脱涩后即表现出明显的褐变现象,且果实个体褐变差异明显。从图1不同采后处理对柿子褐变指数BI影响结果可以看出,三种采后处理的柿子BI值随着贮藏时间的延长整体呈上升的趋势,这与覃慧[17]研究结果相似。其中有氧组在贮藏过程中BI值增加最快,真空组和真空+1-MCP组BI增加相对缓慢,在整个贮藏过程中有氧组柿子BI值均高于其他2组。在贮藏6 d时,有氧组柿子BI值为96.77,真空组和真空+1-MCP组BI值分别为88.24和86.17;贮藏12 d时,有氧组柿子BI值增加至109.24,真空组和真空+1-MCP组BI值分别为95.32、96.27,在整个贮藏过程中,各处理组柿子的BI均存在显著性差异(P<0.05),相比于有氧组,真空和真空+1-MCP两种方式的采后处理延缓了柿子在贮藏过程中的褐变进程。李丽萍等[24]对单果真空包装的‘大盖’柿研究也发现未抽真空柿子果实褐变率高于真空包装的柿子组。
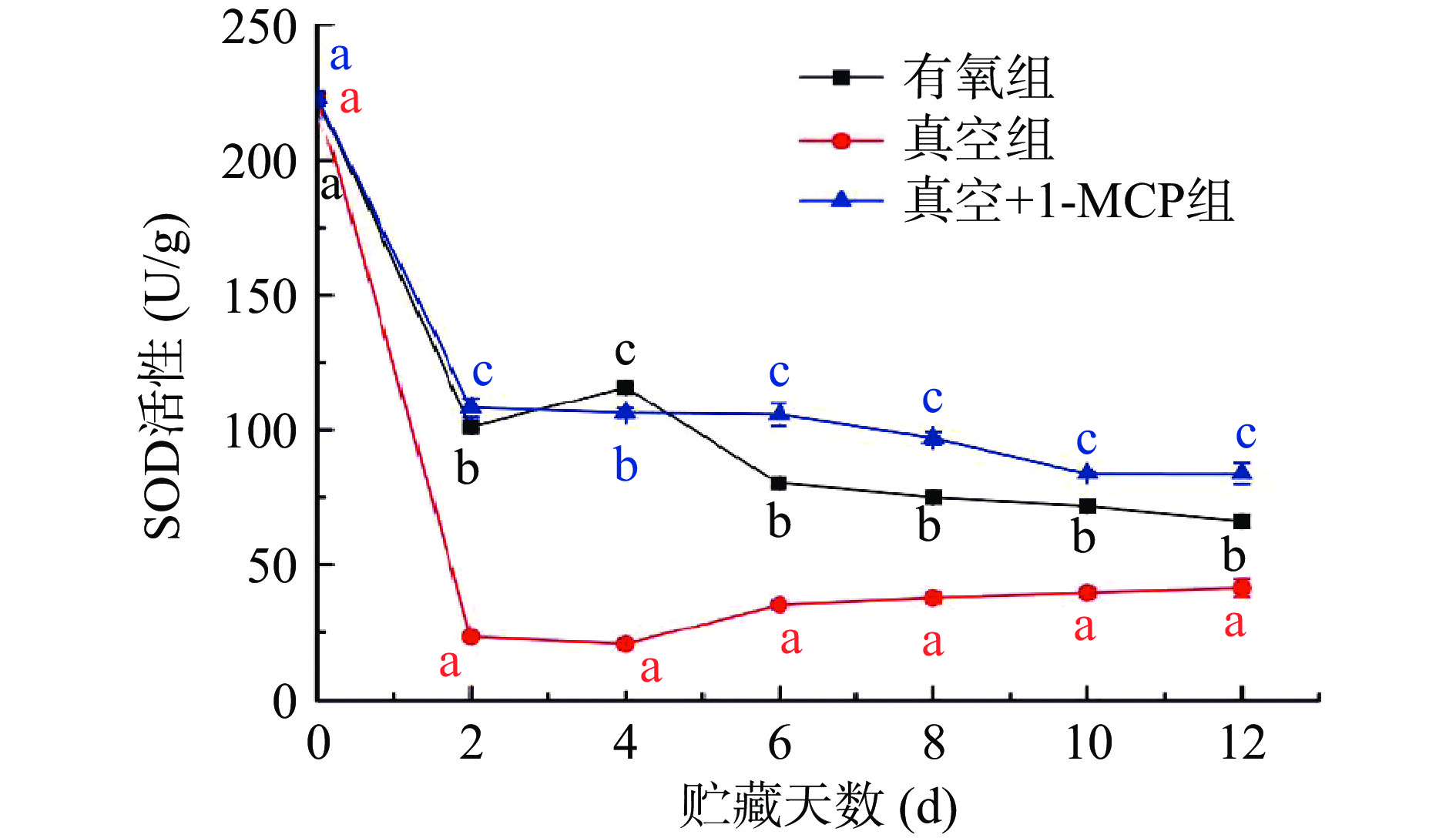
2.2 不同采后处理对柿子活性氧清除酶活性的影响
植物组织中含有清除活性氧的酶,SOD、CAT、APX都是植物体内活性氧清除酶系[25]。SOD在植物活性氧代谢中起抗氧化剂酶的作用,能够歧化O−2⋅生成H2O2和O2,APX降解以抗坏血酸为底物的过氧化物,CAT也降解H2O2并清除自由基,SOD、CAT和APX等抗氧化酶协同作用清除植物体内积累的过量活性氧,从而维持植物体内活性氧动态平衡[26−27]。从图2不同采后处理对柿子SOD活性影响结果可以看出,随着贮藏时间的增加,三种采后处理的柿子SOD活性呈现整体下降的趋势,其中真空组柿子SOD活性下降最快,贮藏2 d,活性从贮藏开始的222.84 U/g下降至23.38 U/g,贮藏2~12 d 活性略有升高并维持在一个比较稳定活性水平(23.38~39.76 U/g),显著低于其他两组(P<0.05);SODs是由核基因编码的蛋白,在植物体内SOD被认为易受环境胁迫影响,Gong等[28]发现‘布瑞班’苹果在低氧或缺氧环境下SOD活性降低,与本文柿子SOD活性结果相似。有氧组和真空+1-MCP在贮藏前2 d下降趋势相似,从222.84 U/g分别下降至101.11、108.26 U/g,然后在2~12 d 呈现缓慢下降的趋势,真空+1-MCP组柿子SOD活性在整个贮藏期整体高于有氧组和真空组(P<0.05),表明真空+1-MCP组柿子在贮藏的过程中歧化超氧阴离子能力更强。这可能是由于1-MCP作为乙烯受体抑制剂,降低了柿子呼吸代谢速率,进而减缓真空+1-MCP组柿子SOD活性的下降[16,29]。
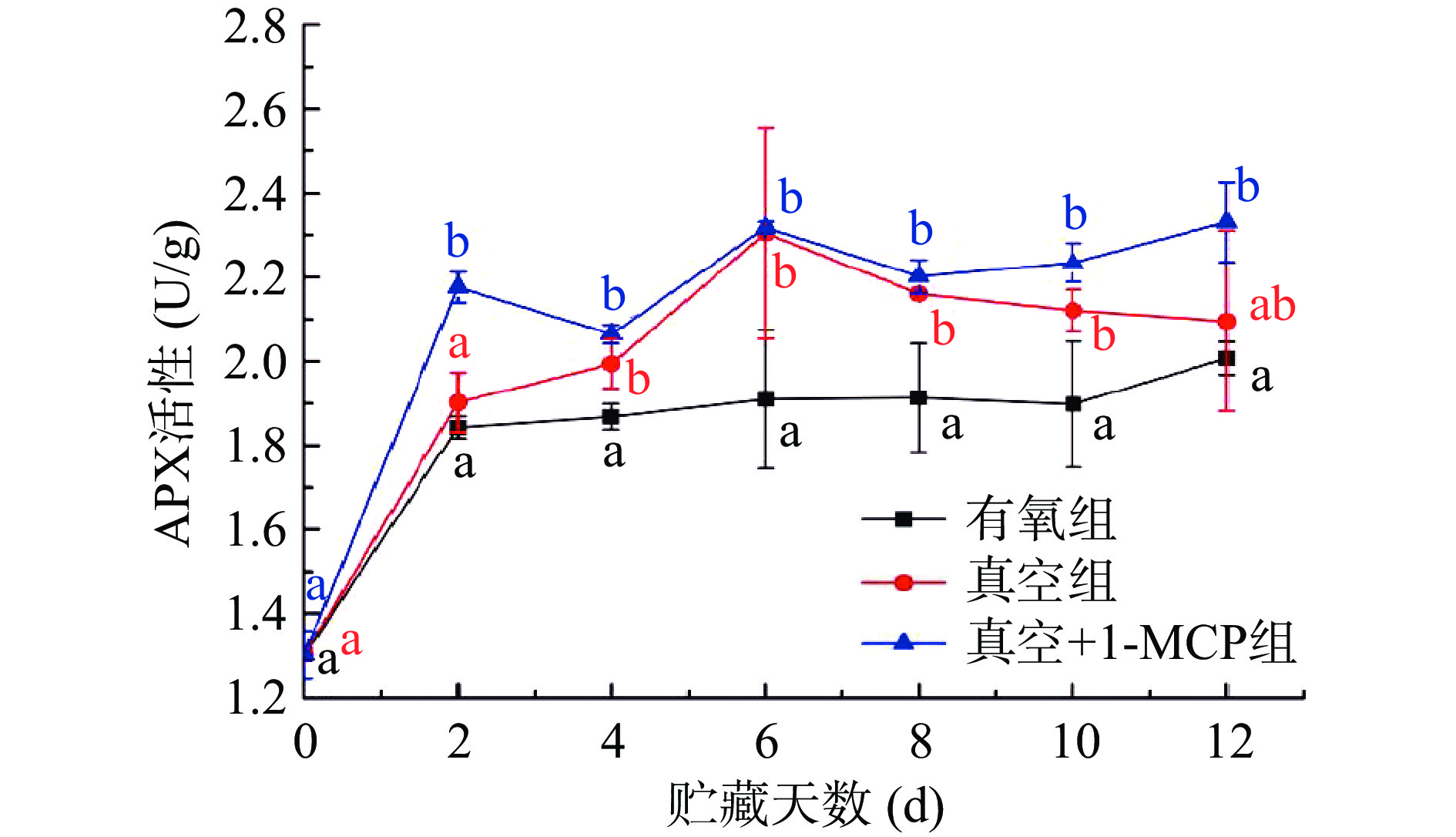
APX是一种非常特异的酶,与植物的胁迫表达有关。APX可以以抗坏血酸作为其反应电子供体,从而破坏果实中过氧化氢的途径[30]。从图3不同采后处理对柿子APX活性变化结果可知,CO2脱涩贮藏的柿子APX活性呈增加的趋势,这与李莹等[16]对磨盘柿的研究结果相似。其中APX活性在贮藏前2 d快速增加,贮藏开始(0 d)APX活性为1.30 U/g,当贮藏2 d时有氧组、真空组和真空+1-MCP组分别增加至1.84、1.90、2.17 U/g,贮藏2 d后,随着贮藏时间的增加,三组不同采后处理下柿子APX活性呈现整体上升的趋势,但比较缓慢,在贮藏12 d后有氧组、真空组和真空+1-MCP组APX活性分别增加至2.00、2.10、2.33 U/g。真空组和真空+1-MCP组APX活性在整个贮藏过程中均高于有氧组,说明真空和真空+1-MCP处理能明显提高柿子APX活性。同时从图中也可以看出,真空组和真空+1-MCP组APX活性在贮藏4~12 d时差异性不明显(P>0.05),说明真空环境对提高柿子果实APX活性作用更大,1-MCP作用对脱涩后贮藏柿子APX活性影响较小,Xu等[31]对皇冠梨贮藏研究发现单独1-MCP处理可以提高APX活性但与未使用组差异不明显,与本研究结果相似。
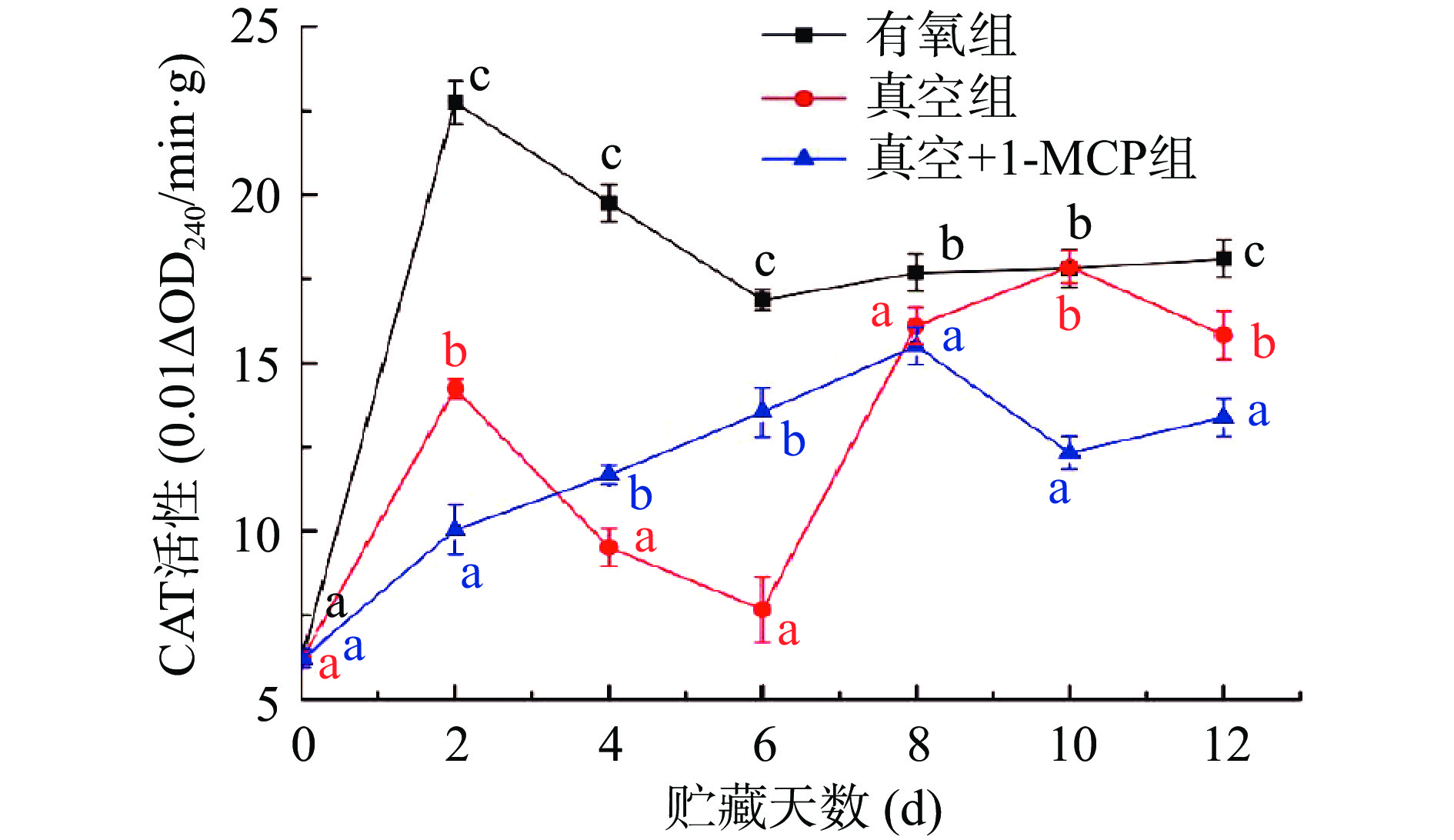
从图4不同采后处理对柿子CAT活性影响结果可知,有氧组和真空组柿子CAT活性在贮藏前2 d时呈现快速增加的趋势,有氧组CAT活性增加最快,贮藏2 d活性从开始的6.21 (0.01△OD240·min−1·g−1)增加至22.75(0.01△OD240·min−1·g−1),其次为真空组;在贮藏2~6 d期间,有氧组和真空组柿子CAT活性下降,贮藏6 d后两组CAT活性再次增加。而真空+1-MCP组贮藏的柿子CAT活性增加至8 d后才呈现下降的趋势,且贮藏前2 d CAT活性增加最慢。随着贮藏条件的改变,整个贮藏期间真空+1-MCP组CAT活性最大值低于其他两组贮藏期期CAT活性最大值。说明真空、1-MCP对脱涩柿子贮藏过程中CAT活性均有影响,同时也得出真空和真空+1-MCP条件能一定程度的抑制柿子CAT活性的增加。活性氧产生和清除是一个动态平衡过程,且是整个防御系统的协调作用,底物浓度水平、信号传导等都会对这个过程产生影响[32]。因此采后处理方式不同CAT活性差异显著可能与不同处理后活性氧含量密切相关。
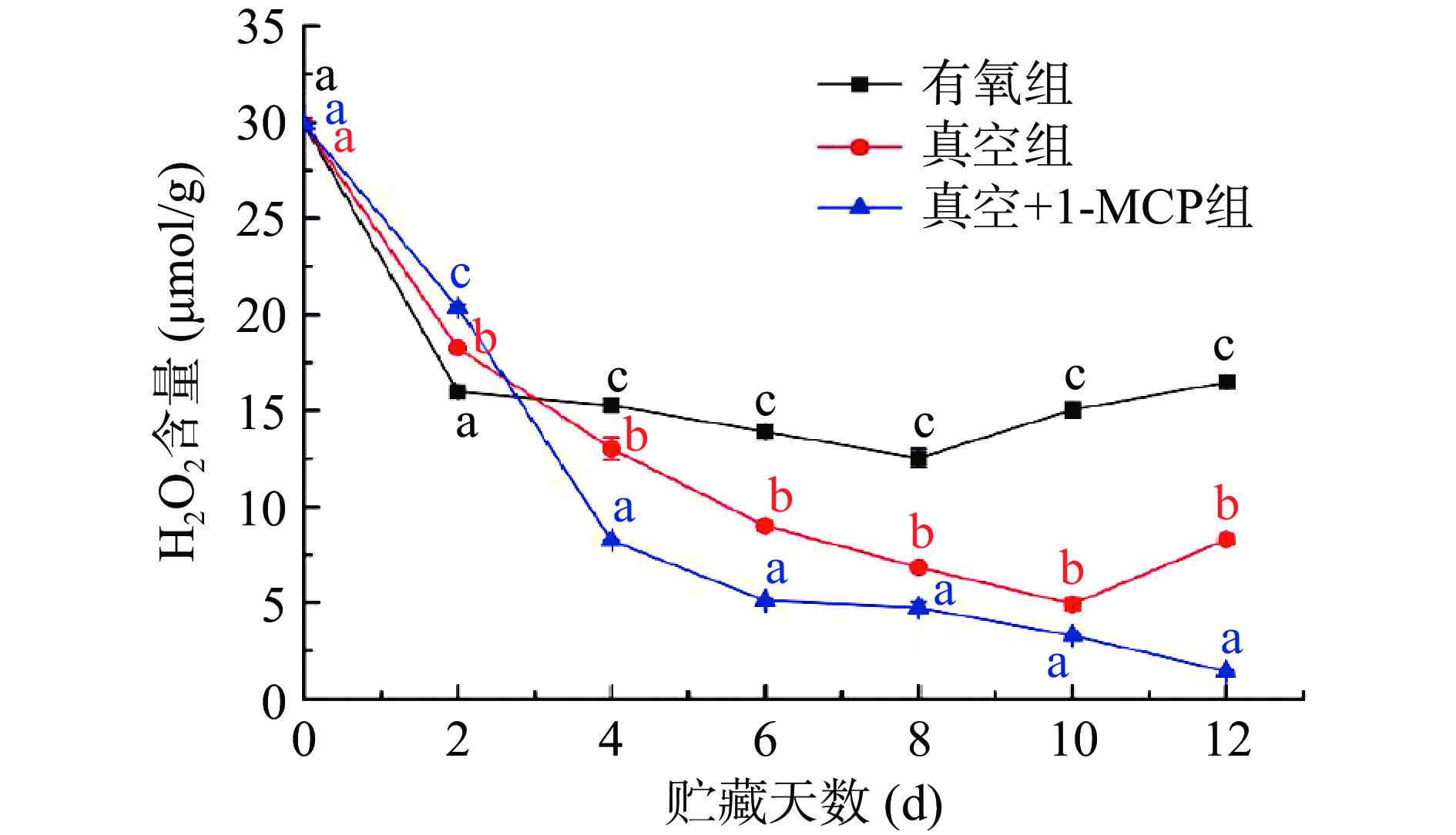
2.3 不同采后处理对柿子H2O2含量的影响
采后果蔬贮藏衰老是一种氧化现象,呼吸作用产生的活性氧O2-·、H2O2等过量积累会导致果蔬代谢过程紊乱,可引发细胞质膜上不饱和脂肪酸的脂质过氧化反应,产生活性氧自由基,导致果蔬品质下降[33]。柿子贮藏过程中H2O2含量变化如图5,从图中可看出,三种不同采后处理的柿子H2O2含量呈现整体下降的趋势,且不同采后处理的柿子H2O2含量在同样贮藏时间下均存在显著性差异(P<0.05)。贮藏2 d时,有氧组、真空组和真空+1-MCP组柿子H2O2含量从29.89 μmol/g分别下降至15.99、18.26、20.37 μmol/g。贮藏2 d后,相同贮藏时间下真空组和真空+1-MCP组柿子H2O2含量均低于有氧组柿子H2O2含量,且真空+1-MCP组H2O2最低,说明贮藏2 d后真空、真空+1-MCP两种条件均可以减少活性氧H2O2 积累,这与磨盘柿脱涩后贮藏结果相似[16]。活性氧产生和清除是一个动态平衡过程,SOD歧化O−2⋅生成H2O2和O2 ,同时POD、CAT和APX能够清除H2O2[34−35]。不同采后处理柿子H2O2含量实验结果可能是由于柿子在高浓度CO2脱涩期间,H2O2含量快速增加,从而诱导柿子APX和CAT活性增加,而在贮藏过程中由于APX和CAT的作用,使H2O2含量呈现逐渐降低的趋势。脱涩后的柿子贮藏过程中APX和CAT活性的增加对降低H2O2积累表现出更积极的作用。
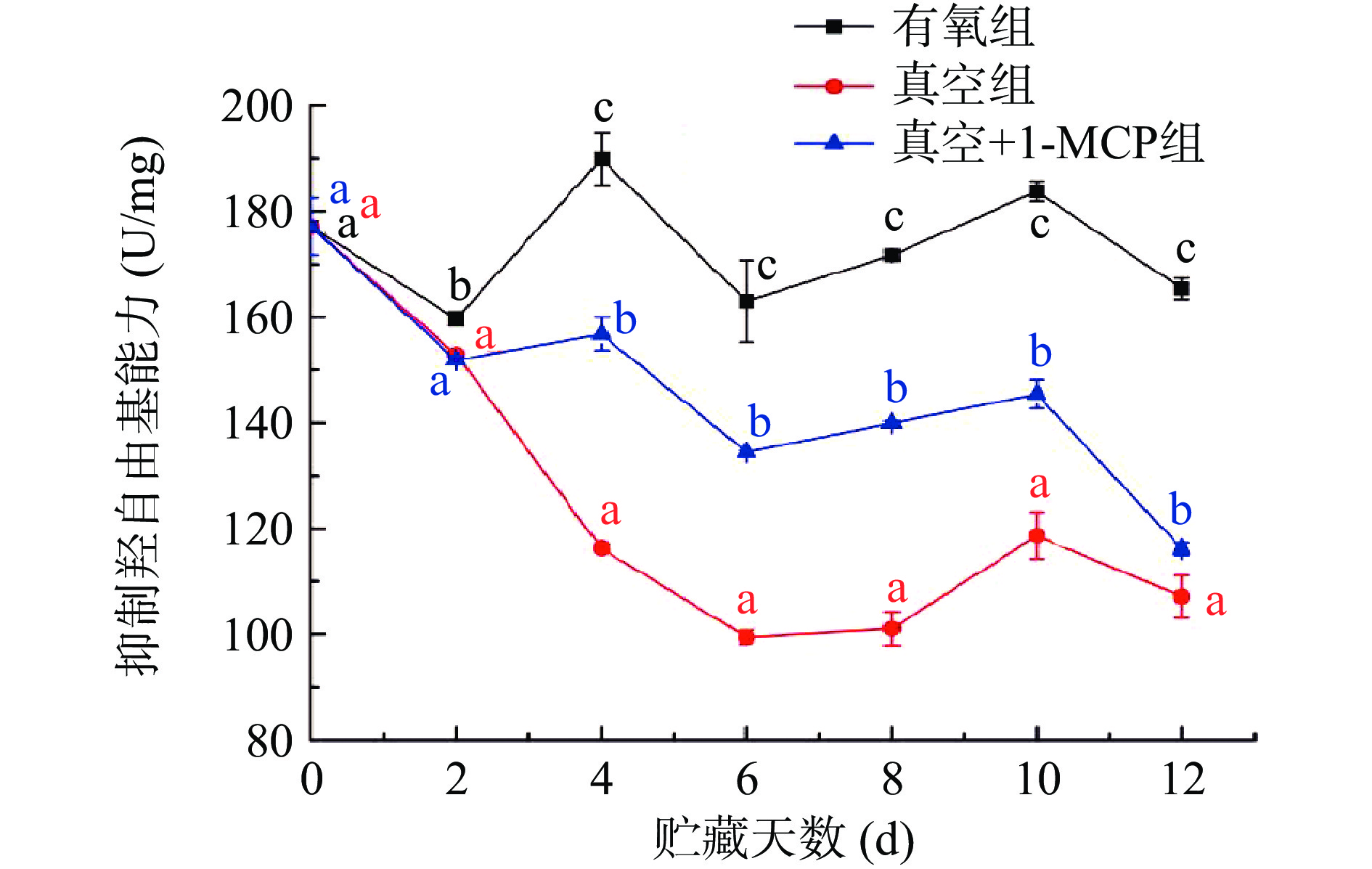
2.4 不同采后处理对柿子抑制羟自由基能力的影响
羟自由基具有极强的得电子能力即氧化能力,抑制羟自由基能力能反映样本的抗氧化性[36]。从图6不同采后处理对柿子抑制羟自由基能力影响结果可以看出,有氧组柿子在整个贮藏期间抑制羟自由基能力在159.73~189.94 U/mg之间波动;真空组和真空+1-MCP组柿子在贮藏过程中抑制羟自由基能力整体呈下降的趋势,且真空组和真空+1-MCP组柿子抑制羟自由基能力均低于有氧组;在相同的贮藏时间时,各组处理后的柿子抑制羟自由基能力存在显著性差异(P<0.05)。其中真空组柿子抑制羟自由基能力下降最快,在贮藏6 d时为99.42 U/mg,随后在贮藏第10 d上升至118.62 U/mg,第12 d下降至107.09 U/mg;真空+1-MCP组羟自由基抑制能力在贮藏第6 d从177.13 U/mg下降至134.46 U/mg,然后下降至贮藏12 d时的116.08 U/mg,以上结果表明真空组和真空+1-MCP组降低了柿子抑制羟自由基的能力。这可能是由于真空组和真空+1-MCP组条件下柿子在脱涩后仍然进行无氧呼吸,可溶性单宁、总酚、黄酮类物质含量进一步下降[37],导致柿子抑制羟自由基的能力减弱。
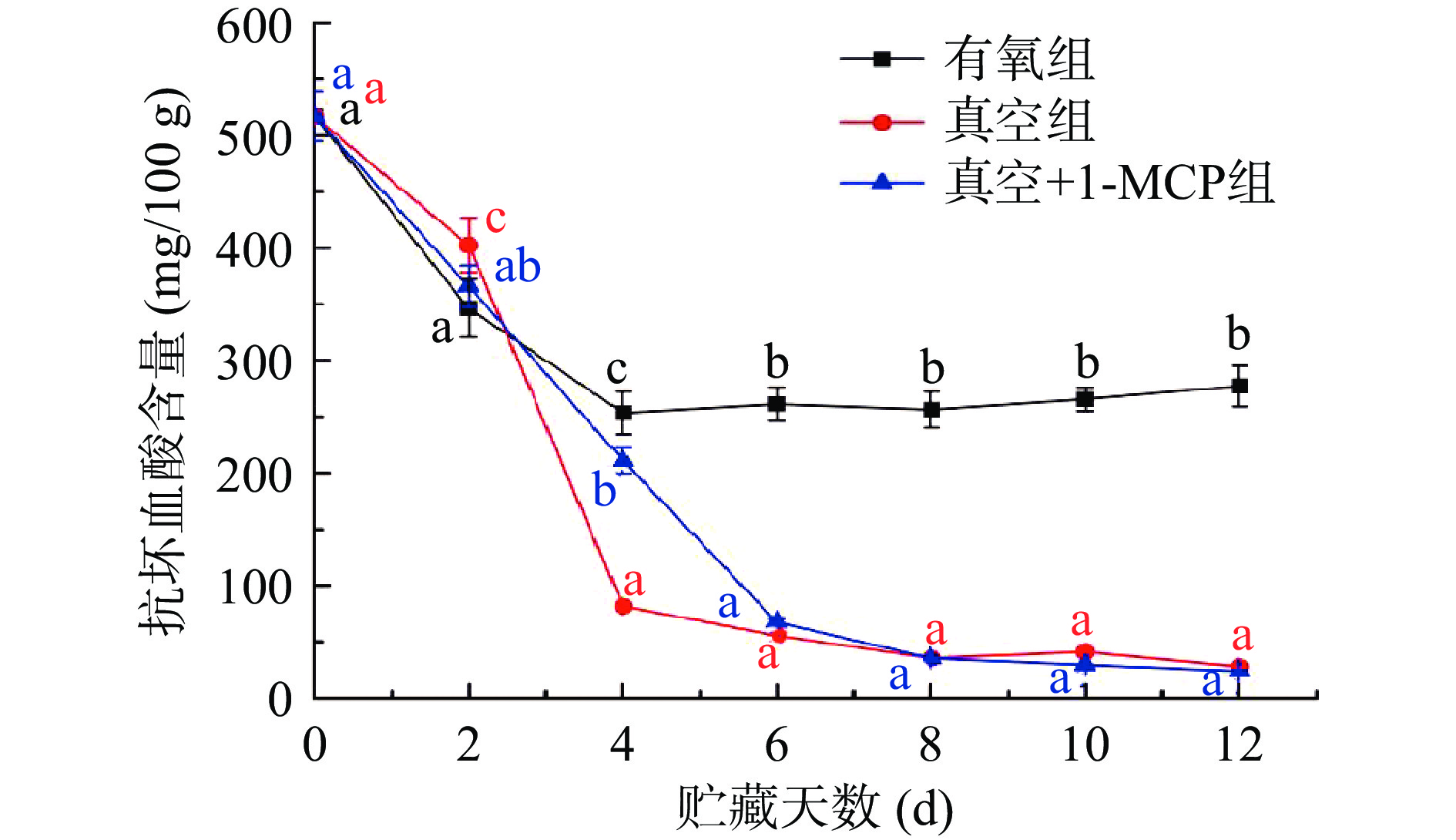
2.5 不同采后处理对柿子抗坏血酸含量的影响
抗坏血酸含量是评价果蔬贮藏品质非酶促抗氧化能力的重要指标[38]。图7为不同采后处理对柿子抗坏血酸含量影响结果,从图中可知,三组柿子在贮藏过程中抗坏血酸含量呈现整体下降的趋势,在贮藏前4 d有氧组的柿子从517.07 mg/100 g降至253.36 mg/100 g,贮藏4~12 d 柿子抗坏血酸含量相对稳定,含量在261.25~277.29 mg/100 g之间,且与其他两组存在显著性差异(P<0.05)。而真空组和真空+1-MCP组在贮藏前6 d 柿子抗坏血酸含量下降较快,从517.07 mg/100 g分别下降至55.32、67.47 mg/100 g,贮藏6 d后抗坏血酸含量下降缓慢,贮藏12 d 柿子抗坏血酸含量分别为27.82、23.92 mg/100 g,两组柿子贮藏6 d后抗坏血酸含量相近,不存在显著性差异(P>0.05)。寇文丽等[39]对脱涩后结合真空、1-MCP包装贮藏的磨盘柿的品质研究发现,真空包装柿子抗坏血酸含量快速下降,远低于未真空包装组,与本文研究结果相似。结合图3不同采后处理柿子APX活性变化结果,得出真空组和真空+1-MCP组抗坏血酸含量低于有氧组可能是真空组和真空+1-MCP组柿子APX需要较多的抗坏血酸作为电子供体破坏H2O2生成,从而使有氧组在贮藏4 d后抗坏血酸含量显著高于其他两组。
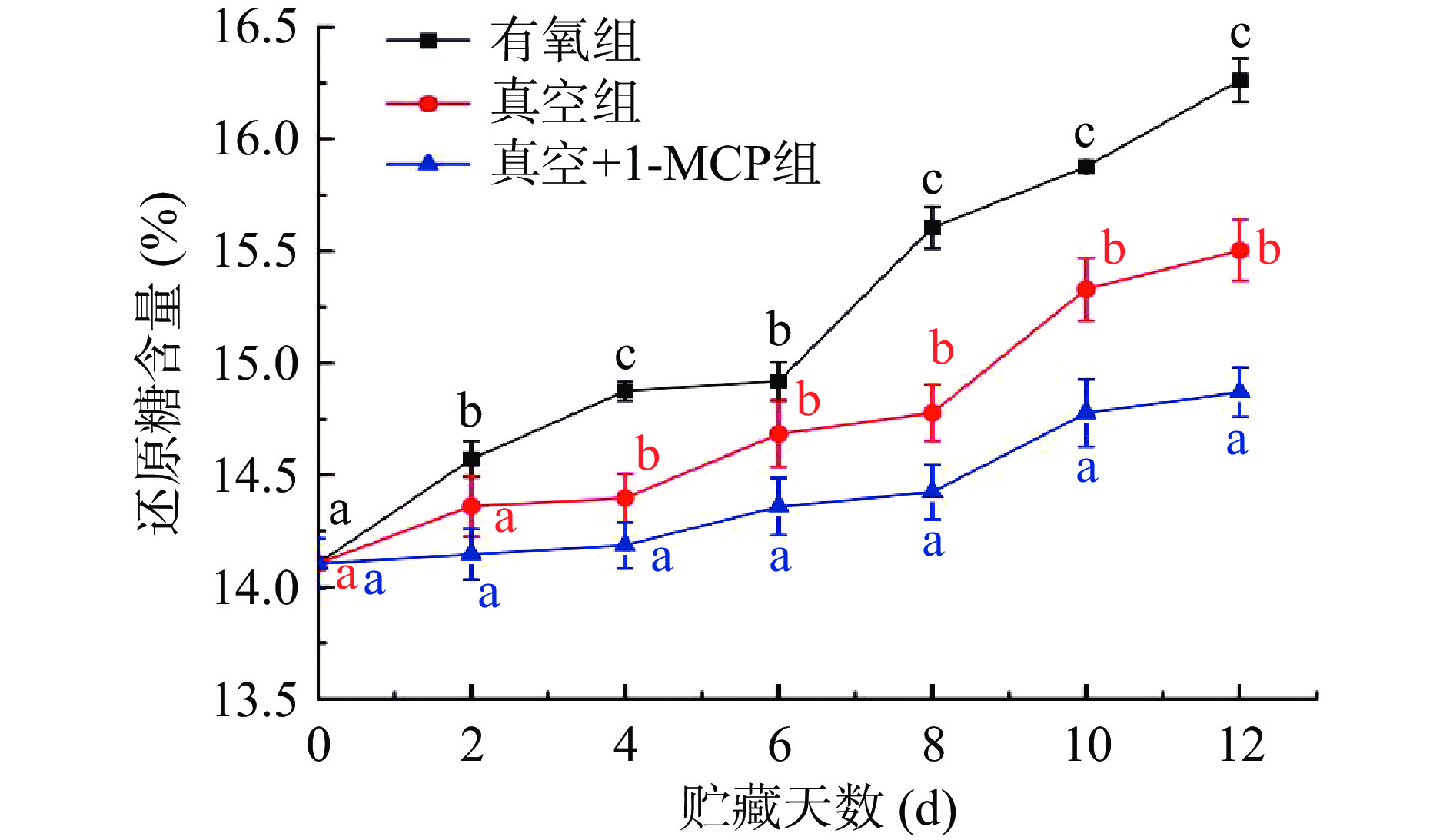
2.6 不同采后处理对柿子还原糖和果胶含量的影响
还原糖和果胶的变化可以侧面反映柿子在贮藏期间的成熟软化进程。从图8不同采后处理对柿子还原糖含量影响结果可知,三种不同采后处理的柿子在整个贮藏期间还原糖含量呈上升的趋势,而有氧组柿子还原糖含量增加最快,还原糖含量从贮藏开始的14.10%增加至贮藏12 d时16.26%;真空+1-MCP组柿子还原糖含量增加最慢,从贮藏开始时的14.10%增加至贮藏12 d时的14.87%,说明在有氧环境中贮藏的柿子成熟软化较快。而真空(低氧胁迫)和1-MCP环境下的柿子成熟软化缓慢。
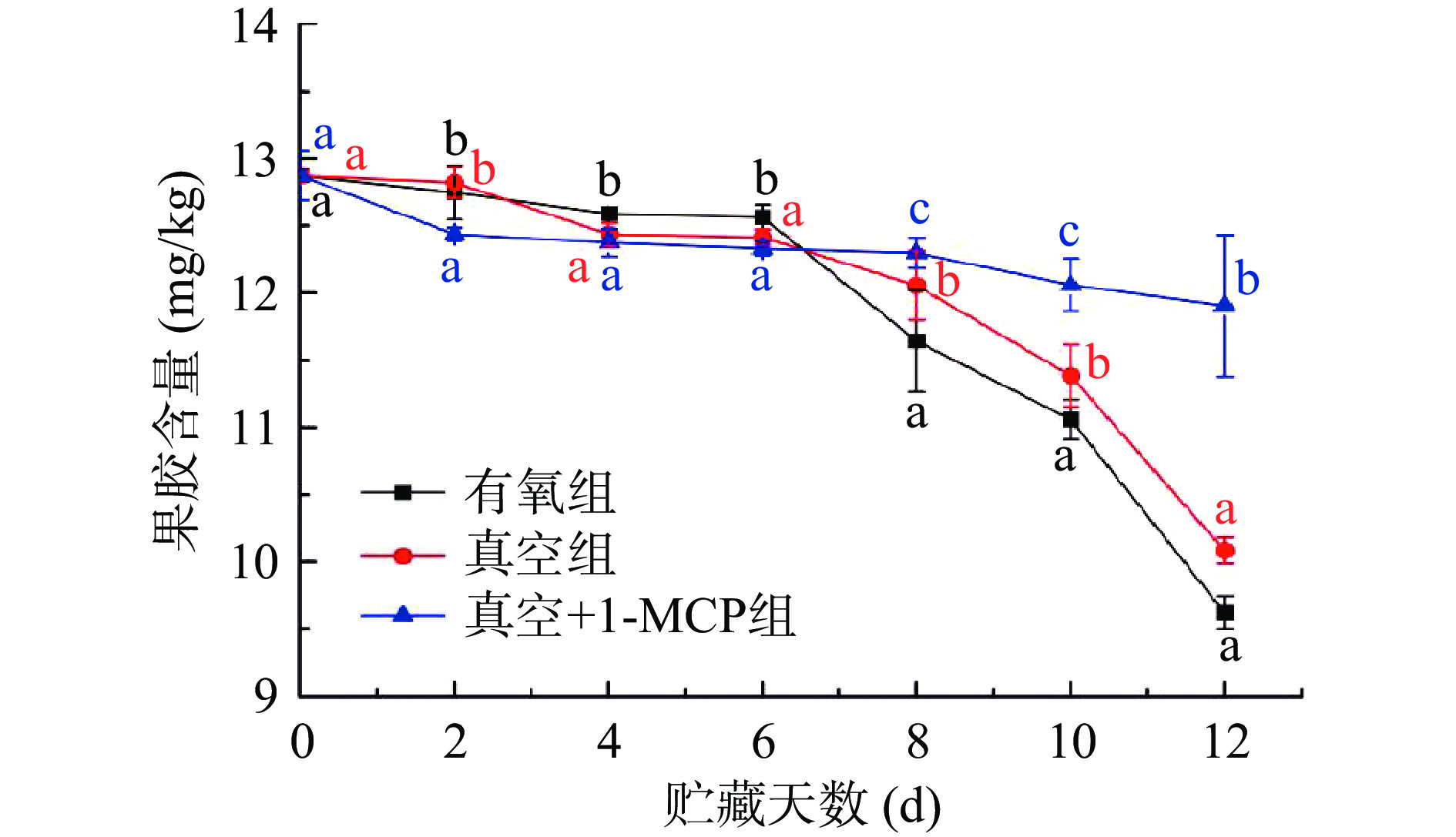
从图9不同采后处理对柿子果胶含量影响结果可以看出,三组不同采后处理的柿子随着贮藏时间的延长,果胶含量均呈下降的趋势,而真空+1-MCP组柿子果胶下降最为缓慢,贮藏12 d后,果胶含量从贮藏开始时12.87 mg/kg下降至11.90 mg/kg;有氧组和真空组的柿子果胶含量在贮藏6 d后开始快速下降,贮藏12 d果胶含量分别为9.62和10.08 mg/kg。由此表明真空+1-MCP能减缓脱涩柿子果胶的降解,延缓柿子的成熟软化。果胶降解可生成还原糖,这也解释了图8中有氧组、真空组柿子贮藏期间还原糖含量高于真空+1-MCP组,贮藏4 d后各组之间均存在显著性差异(P<0.05)。
2.7 不同采后处理下柿子各指标相关性分析
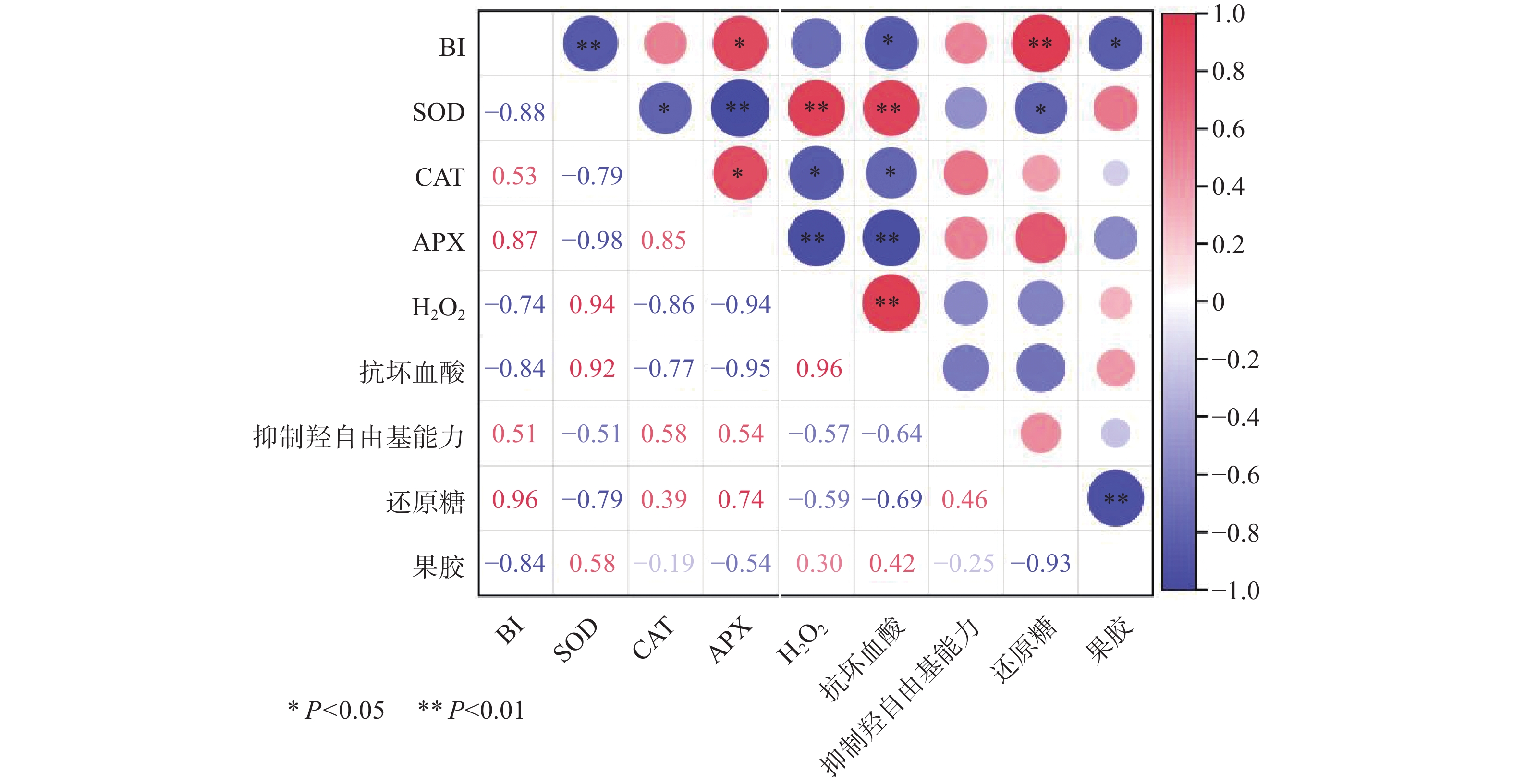
从图10有氧组的贮藏过程中各指标的相关性分析结果可知,BI与SOD(-0.88)、抗坏血酸(−0.84)、果胶(−0.84)呈负相关,其中与SOD呈极显著负相关(P<0.01),与抗坏血酸、果胶呈显著负相关(P<0.05);BI与APX(0.87)、还原糖(0.96)呈正相关,且BI与还原糖呈极显著正相关(P<0.01)、与APX呈显著正相关(P<0.05)。另外SOD和APX、APX和H2O2、APX和抗坏血酸以及还原糖和果胶之间呈极显著负相关(P<0.01); SOD和H2O2、SOD和抗坏血酸、H2O2和抗坏血酸存在极显著正相关(P<0.01)。APX和CAT之间呈显著正相关(P<0.05);SOD和还原糖、BI和抗坏血酸、CAT和H2O2、CAT和抗坏血酸呈显著负相关(P<0.05);其他各指标之间不存在显著相关性(P>0.05)。
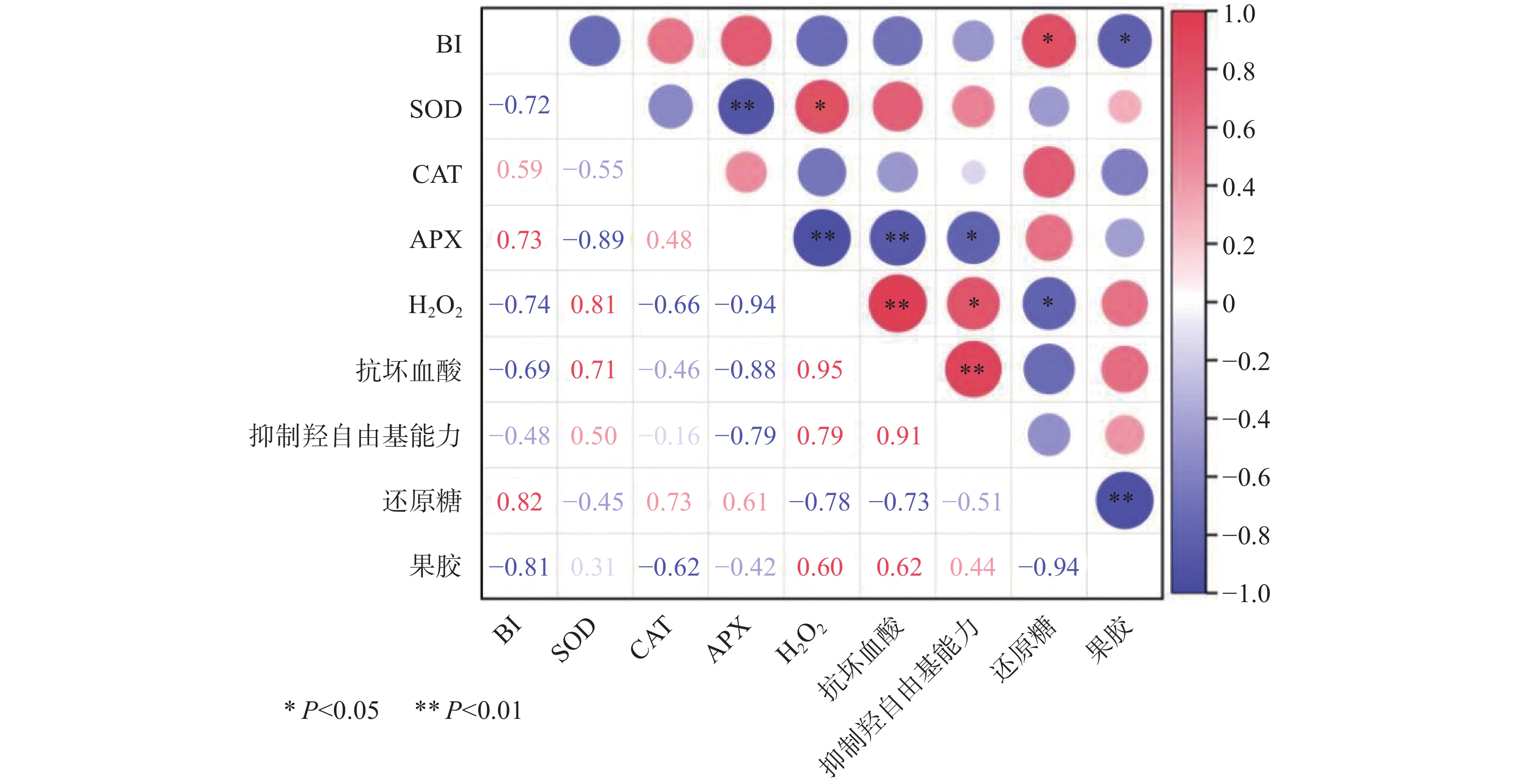
从图11真空贮藏柿子各指标的相关性分析结果可知,在真空条件下,柿子生理生化指标SOD和APX、APX和H2O2、APX和抗坏血酸之间呈极显著负相关(P<0.01),这些指标的相关性与柿子在有氧环境下的相关性一致;H2O2和抗坏血酸、抗坏血酸和抑制羟自由基能力之间呈极显著正相关(P<0.01);BI和果胶、APX和抑制羟自由基能力之间呈显著负相关(P<0.05);BI和还原糖、SOD和 H2O2、H2O2和抑制羟自由基能力之间呈显著正相关(P<0.05)。CAT与其他各指标均不存在显著性相关(P>0.05)。
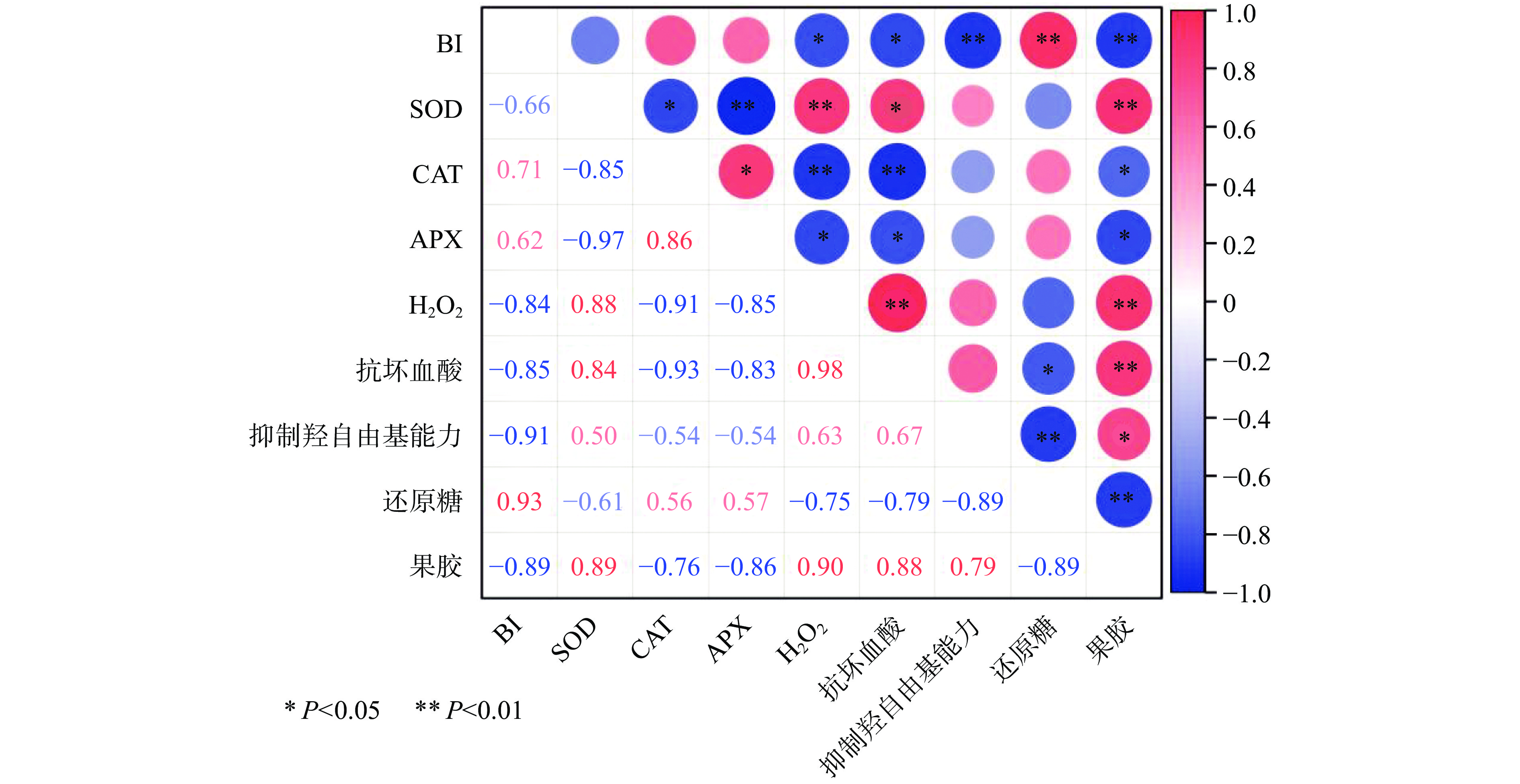
从图12真空+1-MCP组柿子各指标的相关性分析结果可知,BI和H2O2(−0.84)、抗坏血酸(−0.85)、抑制羟自由基能力(−0.91)、果胶(−0.89)之间呈负相关,BI和还原糖(0.93)之间呈正相关。另外SOD与APX、CAT与H2O2和抗坏血酸、还原糖与果胶和抑制羟自由基能力两两之间呈极显著负相关(P<0.01);SOD与H2O2和果胶、H2O2与抗坏血酸和果胶、抗坏血酸与果胶两两之间呈极显著正相关(P<0.01);SOD与CAT、CAT与果胶、抗坏血酸与还原糖之间呈显著性负相关(P<0.05),同时APX与H2O2、抗坏血酸、果胶之间也成显著性负相关(P<0.05);SOD与抗坏血酸、CAT与APX、果胶和抑制羟自由基能力之间存在显著性正相关(P<0.05)。其他各指标之间不存在显著性相关性(P>0.05)。
从图10~图12结果可知,柿子的褐变不仅与活性氧代谢有关,还与脱涩后果实还原糖增加、细胞壁果胶降解等糖类变化密切相关。但不同采后处理条件下,柿子的褐变与各指标的相关性并不完全一致。三种采后处理条件下柿子褐变指数BI仅同时与果胶呈负相关,与还原糖呈正相关。说明不同的采后处理方式对柿子代谢影响并不完全一致。后期可结合基因组学等手段,进一步解析不同采后处理条件下脱涩后柿子与褐变相关的代谢路径,明确脱涩后柿子褐变发生机理。
3. 结论
从有氧、真空、真空+1-MCP三种采后处理方式对脱涩后柿子褐变、活性氧代谢和糖类影响结果可知,相比于有氧组,真空和真空+1-MCP采后处理可降低柿子贮藏过程中的褐变;贮藏过程中SOD、APX活性分别呈下降和上升的趋势,真空+1-MCP组柿子SOD活性在贮藏期整体高于有氧组和真空组,有氧组柿子APX活性最低;真空和真空+1-MCP抑制柿子CAT活性的增加,减少H2O2积累,但同时抑制羟自由基的能力和抗坏血酸含量低于有氧组。有氧组柿子还原糖含量增加最快,真空和真空+1-MCP组柿子还原糖含量低于有氧组,其中真空+1-MCP组增加最慢;真空+1-MCP组柿子果胶含量下降缓慢,有氧组和真空组的柿子果胶含量在贮藏6 d后开始快速下降,贮藏12 d时果胶含量分别下降至9.62、10.08 mg/kg,说明1-MCP显著抑制了柿子果胶的降解。相关性分析可知,不同采后处理柿子贮藏过程中柿子褐变与各指标的相关性并不相同,三种采后处理柿子褐变指数BI均与果胶呈负相关,与还原糖呈正相关。说明不同采后处理影响了柿子的代谢过程,进一步影响了柿子的褐变。综合可知真空和真空+1-MCP条件更有利于抑制脱涩后月柿的褐变。本研究明确脱涩月柿不同采后处理条件下褐变与活性氧代谢的相关性,为进一步指导柿子脱涩后果实在包装、运输、销售过程中保鲜技术开发以及新型褐变抑制剂的研制提供一定的理论基础和思路。
-
-
[1] Food and Agriculture Organization of the United Nations. FAO STAT:Crops and livestock products[R]. Geneva:FAO, 2022.
[2] 曹坤. CO2脱涩过程中柿果褐变的生理生化效应[D]. 呼和浩特:内蒙古农业大学, 2019. [CAO K. Physiological and biochemical effects of browning in the process of CO2 de-astringent among astringent persimmon [D]. Hohhot:Inner Mongolia Agricultural University, 2019.] CAO K. Physiological and biochemical effects of browning in the process of CO2 de-astringent among astringent persimmon [D]. Hohhot: Inner Mongolia Agricultural University, 2019.
[3] DUAN X W, LIU T, ZHANG D, et al. Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J]. Food Research International,2011,44(7):1905−1911. doi: 10.1016/j.foodres.2010.10.027
[4] 张琼琼. 鲜食葡萄采后活性氧及乙烯代谢对果梗褐变的影响[D]. 乌鲁木齐:新疆农业大学, 2021. [ZHANG Q Q. Effects of postharvest active oxygen and ethylene metabolism of table grapes on browning of fruit rachis[D]. Urumqi:Xinjiang Agricultural University, 2021.] ZHANG Q Q. Effects of postharvest active oxygen and ethylene metabolism of table grapes on browning of fruit rachis[D]. Urumqi: Xinjiang Agricultural University, 2021.
[5] 徐雨晗, 包垠秋, 易阳, 等. 乙醇熏蒸处理对鲜切莲藕片褐变和活性氧代谢的影响[J]. 中国食品学报,2023,23(1):259−266. [XU Y H, BAO Y Q, YI Y, et al. Effects of ethanol vapor treatment on browning and reactive oxygen species metabolism of fresh-cut Lotus root slices[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(1):259−266.] XU Y H, BAO Y Q, YI Y, et al. Effects of ethanol vapor treatment on browning and reactive oxygen species metabolism of fresh-cut Lotus root slices[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(1): 259−266.
[6] 周琪, 陈晨, 周福慧, 等. 短波紫外线控制鲜切苹果褐变与其活性氧代谢的相关性[J]. 食品科学,2019,40(5):102−109. [ZHOU Q, CHEN C, ZHOU F H, et al. Correlation between enzymatic browning inhibition by UV-C treatment and reactive oxygen species metabolism of fresh-cut apples[J]. Food Science,2019,40(5):102−109.] ZHOU Q, CHEN C, ZHOU F H, et al. Correlation between enzymatic browning inhibition by UV-C treatment and reactive oxygen species metabolism of fresh-cut apples[J]. Food Science, 2019, 40(5): 102−109.
[7] 韩卫娟, 曹坤, 索玉静, 等. CO2脱涩处理对‘平核无’柿果实生理品质的影响[J]. 食品科学,2021,42(17):43−53. [HAN W J, CAO K, SUO Y J, et al. Effect of deastringency treatment with CO2 on physiological quality of ‘Hiratanenashi’ persimmon fruit[J]. Food Science,2021,42(17):43−53.] HAN W J, CAO K, SUO Y J, et al. Effect of deastringency treatment with CO2 on physiological quality of ‘Hiratanenashi’ persimmon fruit[J]. Food Science, 2021, 42(17): 43−53.
[8] HU J X, BI J F, LI X, et al. Understanding the impact of pectin on browning of polyphenol oxidation system in thermal and storage processing[J]. Carbohydrate Polymers,2023,307:120641. doi: 10.1016/j.carbpol.2023.120641
[9] LIN D, XIAO L, WEN, Y, et al. Comparison of apple polyphenol-gelatin binary complex and apple polyphenol-gelatin-pectin ternary complex:Antioxidant and structural characterization[J]. LWT-Food Science and Technology,2021,148:111740. doi: 10.1016/j.lwt.2021.111740
[10] 蔡长河, 郭际, 曾庆孝. 荔枝干加工过程果肉糖分的变化与褐变[J]. 食品科学,2006(9):87−90. [CAI C H, GUO J, ZENG Q X. Changes of saccharides and browning effects during dried litchi processing[J]. Food Science,2006(9):87−90.] CAI C H, GUO J, ZENG Q X. Changes of saccharides and browning effects during dried litchi processing[J]. Food Science, 2006(9): 87−90.
[11] 黄榕辉, 吴光亮, 黄春梅, 等. 龙眼干制过程中糖含量变化对果肉褐变度的影响[J]. 亚热带农业研究,2014,10(3):145−150. [HUANG R H, WU G L, HUANG C M, et al. Effect of sugar content on browning degree of longan aril in drying processing[J]. Subtropical Agriculture Research,2014,10(3):145−150.] HUANG R H, WU G L, HUANG C M, et al. Effect of sugar content on browning degree of longan aril in drying processing[J]. Subtropical Agriculture Research, 2014, 10(3): 145−150.
[12] 陆曼婵. 月柿贮藏期间环境因素对果实采后品质影响的研究[D]. 南宁:广西大学, 2017. [LU M C. Effects of environmental factors during storage of persimmon on the fruit quality after harvest [D]. Nanning:Guangxi University, 2017.] LU M C. Effects of environmental factors during storage of persimmon on the fruit quality after harvest [D]. Nanning: Guangxi University, 2017.
[13] 王慧, 陈燕华, 林河通, 等. 纸片型1-MCP处理对安溪油柿果实采后生理和贮藏品质的影响[J]. 食品科学,2018,39(21):253−259. [WANG H, CHEN Y H, LIN H T, et al. Effect of 1-methylcyclopropene treatment on postharvest physiology and storage quality of Anxi persimmon fruit[J]. Food Science,2018,39(21):253−259.] WANG H, CHEN Y H, LIN H T, et al. Effect of 1-methylcyclopropene treatment on postharvest physiology and storage quality of Anxi persimmon fruit[J]. Food Science, 2018, 39(21): 253−259.
[14] LUO Z. Effect of 1-methylcyclopropene on ripening of postharvest persimmon (Diospyros kaki L.) fruit[J]. LWT-Food Science and Technology,2007,40(2):285−291. doi: 10.1016/j.lwt.2005.10.010
[15] SALADOR A, CUQUERELLA J, MARTÍNEZ-JÁVEGA J M, et al. 1-MCP preserves the firmness of stored persimmon‘Rojo Brillante’[J]. Journal of Food Science,2004,69(2):69−73.
[16] 李莹, 程青, 李冉, 等. 1-MCP对CO2处理‘磨盘柿’果实活性氧含量及清除酶活性的影响[J]. 果树学报,2015,32(3):494−501. [LI Y, CHENG Q, LI R, et al. Influence of 1-MCP on reactive oxygen species content and scavenger enzyme activity in persimmon fruit treated with CO2[J]. Journal of Fruit Science,2015,32(3):494−501.] LI Y, CHENG Q, LI R, et al. Influence of 1-MCP on reactive oxygen species content and scavenger enzyme activity in persimmon fruit treated with CO2[J]. Journal of Fruit Science, 2015, 32(3): 494−501.
[17] 覃慧. ‘恭城月柿’CO2脱涩及保鲜剂1-MCP应用技术研究[D]. 南宁:广西大学, 2017. [QIN H. Study on application technique of CO2 de-astringency and preservative 1-MCP to ‘Gongcheng’ persimmon [D]. Nanning:Guangxi university, 2017.] QIN H. Study on application technique of CO2 de-astringency and preservative 1-MCP to ‘Gongcheng’ persimmon [D]. Nanning: Guangxi university, 2017.
[18] FEUMBA D R, PANYOO A E, RANI P, et al. Effect of microwave blanching on antioxidant activity, phenolic compounds and browning behaviour of some fruit peelings[J]. Food Chemistry,2020,302:125308. doi: 10.1016/j.foodchem.2019.125308
[19] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007. [CAO J K, JIANG W B, ZHAO Y M. Guide of fruit and vegetable postharvest physiological and biochemical experiments[M]. Beijing:China Light Industry Press, 2007.] CAO J K, JIANG W B, ZHAO Y M. Guide of fruit and vegetable postharvest physiological and biochemical experiments[M]. Beijing: China Light Industry Press, 2007.
[20] 中华人民共和国国家卫生计划生育委员会. GB 5009.86-2016 食品安全国家标准 食品中抗坏血酸的测定[S]. 北京:中国标准出版社, 2016:1−9. [National Health and Family Planning Commission of the People's Republic of China. GB/T 5009.86-2016 State criteria for food safety-determination of ascorbic acid in foods[S]. Beijing:Standards Press of China, 2016:1–9.] National Health and Family Planning Commission of the People's Republic of China. GB/T 5009.86-2016 State criteria for food safety-determination of ascorbic acid in foods[S]. Beijing: Standards Press of China, 2016: 1–9.
[21] 中华人民共和国国家卫生计划生育委员会. GB 5009.7-2016 食品安全国家标准 食品中还原糖的测定[S]. 北京:中国标准出版社, 2016:1−9. [National Health and Family Planning Commission of the People's Republic of China. GB/T 5009.86-2016 State criteria for food safety-determination of reducing sugar in foods[S]. Beijing:Standards Press of China, 2016:1–9.] National Health and Family Planning Commission of the People's Republic of China. GB/T 5009.86-2016 State criteria for food safety-determination of reducing sugar in foods[S]. Beijing: Standards Press of China, 2016: 1–9.
[22] 中华人民共和国农业部. NY/T 2016-2011水果及其制品中果胶含量的测定 分光光度法[S]. 北京:中国标准出版社, 2011:1−3. [Ministry of Agriculture of the People's Republic of China. NY/T 2016-2011 Determination of pectin content in fruits and products-spectrophotometric method[S]. Beijing:Standards Press of China, 2011:1−3.] Ministry of Agriculture of the People's Republic of China. NY/T 2016-2011 Determination of pectin content in fruits and products-spectrophotometric method[S]. Beijing: Standards Press of China, 2011: 1−3.
[23] PARK Y M, LEE Y J. Induction of modified atmosphere browning disorders in ‘Fuyu’ persimmon fruit[J]. Postharvest Biology and Technology,2008,47(3):346−352. doi: 10.1016/j.postharvbio.2007.08.006
[24] 李丽萍, 韩涛, 刘佳阳, 等. 单果真空包装对冷藏涩柿品质和有关生化变化的影响[J]. 农业工程学报,1998(1):238−242. [LI L P, HAN T, LIU J Y, et al. Changes of quality and related enzymes activity of individual air-evacuated packaging astringency persimmon during cold storage[J]. Transactions of the Chinese Society of Agricultural Engineering,1998(1):238−242.] LI L P, HAN T, LIU J Y, et al. Changes of quality and related enzymes activity of individual air-evacuated packaging astringency persimmon during cold storage[J]. Transactions of the Chinese Society of Agricultural Engineering, 1998(1): 238−242.
[25] CHAPMAN J M, MUHLEMANN J K, GAYOMBA S R, et al. RBOH-dependent ROS synthesis and ROS scavenging by plant specialized metabolites to modulate plant development and stress responses[J]. Chemical Research in Toxicology,2019,32(3):370−396. doi: 10.1021/acs.chemrestox.9b00028
[26] ABDELAAL K A, EL-MAGHRABY L M, ELANSARY H, et al. Treatment of sweet pepper with stress tolerance-inducing compounds alleviates salinity stress oxidative damage by mediating the physio- biochemical activities and antioxidant systems[J]. Agronomy,2019,10(1):26. doi: 10.3390/agronomy10010026
[27] ZHU L J, HU W F, AYESHA M, et al. Eugenol treatment delays the flesh browning of fresh-cut water chestnut (Eleocharis tuberosa) through regulating the metabolisms of phenolics and reactive oxygen species[J]. Food Chemistry:X,2022,14:100307. doi: 10.1016/j.fochx.2022.100307
[28] GONG Y, MATTHEIS J P. Effects of low oxygen on active oxygen metabolism and internal browning in‘Braeburn’apple fruit[J]. Acta Horticuttural,2003,628:533−539.
[29] 李自芹, 赵志永, 潘艳芳, 等. 乙烯脱除剂结合1-MCP处理对吊干杏贮藏期间冷害及活性氧代谢的调控作用[J]. 现代食品科技,2023,39(9):1−7. [LI Z Q, ZHAO Z Y, PAN Y F, et al. Regulation effects of ethylene removers combined with 1-MCP treatment on chilling injury and active oxygen metabolism of hanging dried apricot during storage[J]. Modern Food Science and Technology,2023,39(9):1−7.] LI Z Q, ZHAO Z Y, PAN Y F, et al. Regulation effects of ethylene removers combined with 1-MCP treatment on chilling injury and active oxygen metabolism of hanging dried apricot during storage[J]. Modern Food Science and Technology, 2023, 39(9): 1−7.
[30] ZHOU Q, MA C, CHENG S C, et al. Changes in antioxidative metabolism accompanying pitting development in stored blueberry fruit[J]. Postharvest Biology & Technology,2014,88:88−95.
[31] XU F X, ZHANG K X, LIU S Y. Evaluation of 1-methylcyclopropene (1-MCP) and low temperature conditioning (LTC) to control brown of Huangguan pears[J]. Scientia Horticulturae,2020,259:108738. doi: 10.1016/j.scienta.2019.108738
[32] 金光, 廖汝玉, 郭瑞, 等. 早红柿果实CO2脱涩过程若干活性氧代谢研究[J]. 西南大学学报:自然科学版,2012,34(6):25−28. [JIN G, LIAO R Y, GUO R, et al. Research of active oxygen metabolism during CO2 deastringency treatment for fruit of persimmon cv. Zaohong[J]. Journal of Southwest University:Natural Science Edition,2012,34(6):25−28.] JIN G, LIAO R Y, GUO R, et al. Research of active oxygen metabolism during CO2 deastringency treatment for fruit of persimmon cv. Zaohong[J]. Journal of Southwest University:Natural Science Edition, 2012, 34(6): 25−28.
[33] 唐建新, 王佳莉, 英丽美, 等. 果蔬采后生理代谢变化及调控机制研究进展[J]. 包装工程,2022,43(5):91−99. [TANG J X, WANG J L, YING L M, et al. Advances in physiological metabolism changes and regulation mechanism of harvested fruits and vegetables[J]. Packaging Engineering,2022,43(5):91−99.] TANG J X, WANG J L, YING L M, et al. Advances in physiological metabolism changes and regulation mechanism of harvested fruits and vegetables[J]. Packaging Engineering, 2022, 43(5): 91−99.
[34] ALI S, KHAN A S, NAWAZ A, et al. Glutathione application delays surface browning of fresh-cut lotus (Nelumbo nucifera Gaertn.) root slices during low temperature storage[J]. Postharvest Biology and Technology,2023,200:112311. doi: 10.1016/j.postharvbio.2023.112311
[35] MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science,2002,7:405−410. doi: 10.1016/S1360-1385(02)02312-9
[36] HIDENORI W, YOHEI T, YUKINORI Y, et al. Histidine-rich glycoprotein possesses anti-oxidant activity through self-oxidation and inhibition of hydroxyl radical production via chelating divalent metal ions in Fenton's reaction[J]. Free Radical Research,2020,54(8):649−661.
[37] 陈佳歆, 周沫, 毕金峰, 等. CO2脱涩对柿果理化特性、酚类成分及抗氧化能力的影响[J]. 食品科学,2019,40(13):28−35. [CHEN J X, ZHOU M, BI J F, et al. Impact of CO2 de-astringency on physicochemical properties, phenolic compounds and antioxidant capacities of persimmon fruit[J]. Food Science,2019,40(13):28−35.] CHEN J X, ZHOU M, BI J F, et al. Impact of CO2 de-astringency on physicochemical properties, phenolic compounds and antioxidant capacities of persimmon fruit[J]. Food Science, 2019, 40(13): 28−35.
[38] 冯晓汀. 鲜切西兰花保鲜及机理研究[D]. 武汉:华中农业大学, 2016. [FENG X D. Studies on preservation and mechanism of fresh-cut broccoli[D]. Wuhan:Huazhong Agricultural University, 2016.] FENG X D. Studies on preservation and mechanism of fresh-cut broccoli[D]. Wuhan: Huazhong Agricultural University, 2016.
[39] 寇文丽, 李江阔, 张鹏, 等. 1-MCP和真空包装对半脱涩磨盘柿常温保脆效果的影响[J]. 食品与发酵工业,2011,37(8):213−217. [KOU W L, LI J K, ZHANG P, et al. Effect of 1-methylcyclopropene and vacuum packaging on crispiness-keeping in room temperature of incomplete de-astringency Mopan persimmon[J]. Food and Fermentation Industries,2011,37(8):213−217.] KOU W L, LI J K, ZHANG P, et al. Effect of 1-methylcyclopropene and vacuum packaging on crispiness-keeping in room temperature of incomplete de-astringency Mopan persimmon[J]. Food and Fermentation Industries, 2011, 37(8): 213−217.
-
期刊类型引用(0)
其他类型引用(1)





 下载:
下载:
 下载:
下载:



