Progress on the Anti-inflammatory, Anti-cancer Activities and Mechanism of Action of Fucoxanthin
-
摘要: 岩藻黄素(Fucoxanthin)是一种类胡萝卜素,呈红褐色,主要来源于褐藻和硅藻等海洋生物,因其独特的化学结构和丰富的生物活性而引起了广泛的科研兴趣。研究表明,岩藻黄素具有显著的抗炎和抗癌活性,其抗炎作用机制主要包括抑制氧化应激、调控炎症因子、诱导细胞自噬和抵抗细胞凋亡等,抗癌作用机制主要包括诱导细胞自噬与凋亡机制、调控细胞周期、抑制细胞迁移和细胞侵袭等多个方面。本文对岩藻黄素的抗炎、抗癌活性及相关作用机制的研究进展进行简要概述,为进一步深入研究及开发岩藻黄素提供理论基础和借鉴。Abstract: Fucoxanthin is a carotenoid, reddish-brown in color, which is mainly derived from marine organisms such as brown algae and diatoms, and has aroused extensive scientific interest due to its unique chemical structure and abundant biological activities. Studies have shown that fucoxanthin processes significant anti-inflammatory and anti-cancer activities. Its anti-inflammatory mechanisms primarily include inhibiting oxidative stress, regulating inflammatory factors, inducting cell autophagy, and resisting cell apoptosis, etc. The main mechanism of anti-cancer activity includes inducing cell autophagy and apoptosis mechanisms, regulating the cell cycle, inhibiting cell migration, and suppressing cell invasion, among other aspects. In this paper, the research progress of anti-inflammatory and anti-cancer activities and related mechanisms of action of fucoxanthin is briefly summarized, which provides the theoretical basis and reference for further research and development of fucoxanthin.
-
Keywords:
- fucoxanthin /
- anti-inflammatory /
- anti-cancer /
- action mechanism
-
炎性刺激可引发机体产生氧化应激,导致大量氧化物的生成[1]。这可诱导大量炎性介质的产生,继而引发炎性反应[2]。炎性反应可导致组织功能短时下降,增加疾病发生的风险[3]。如果炎症反应未被及时抑制,将继续损害机体健康,并提高癌症的发生概率[4]。一旦机体患癌,组织功能遭到破坏,生命健康将面临严重威胁[5]。
为抑制炎症和癌症的影响及病情进一步的恶化,目前主要采用药物治疗和化疗等方式。然而,这些治疗方法常伴有肝肾毒性、胃肠道损伤、血液及神经系统损伤等毒副作用,同时可能导致患者产生药物耐药性[6−7]。相比之下,来源广泛的天然产物由于副作用较小,在治疗中备受关注。特别是源自微藻的岩藻黄素,其显著的抗炎和抗癌活性已引起了广泛的关注。
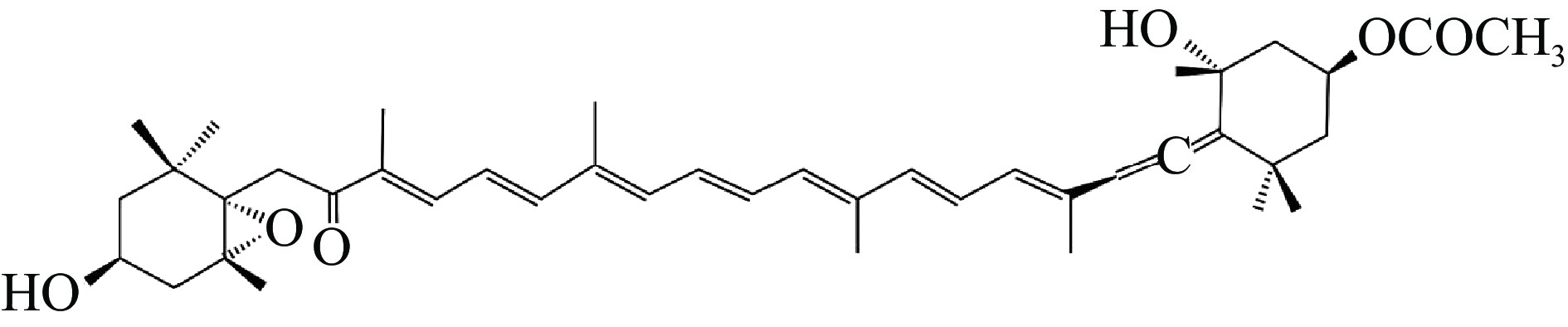
岩藻黄素(Fucoxanthin,FX)属于叶黄素类类胡萝卜素,约占天然类胡萝卜素含量的10%[8]。其独特的环氧及丙二烯结构(图1)赋予了岩藻黄素多种生物活性,包括抗氧化、抗炎、抗癌、调节脂质代谢、神经保护等,且在多种疾病治疗方面具有潜在作用。有研究将岩藻黄素与各种药物联合应用后的效果与原效果进行比较,发现岩藻黄素能够增强药物的效力并减轻药物对身体的毒性[9],此外,研究还发现岩藻黄素的代谢产物和前体物质表现出与岩藻黄素相似甚至在某些方面更加有效的活性[10]。有研究表明岩藻黄素可以在化疗中用作增敏剂,并抑制癌细胞的耐药性[11]。重要的是,岩藻黄素对皮肤细胞、肝脏、肾脏、脾脏和腺体组织等没有明显的毒性影响[12]。本文就岩藻黄素的抗炎、抗癌活性及相关机制进行概述。
1. 岩藻黄素抗炎及抗癌活性
1.1 岩藻黄素抗炎活性
岩藻黄素表现出显著的抗炎活性。在研究岩藻黄素对溃疡性肠炎(UC)的抗炎效应时,研究人员观察到在右旋糖酐硫酸钠(DSS)诱导的溃疡性结肠炎小鼠模型中,岩藻黄素能够明显改善结肠组织的受损情况,包括恢复体重、结肠长度以及固体粪便重量[13]。此外,Slautin 等[14]将不同浓度的岩藻黄素(100 μg/kg体重、200 μg/kg 体重、600 μg/kg体重)200 μL蒸馏水稀释后施用于四氯化碳(CCl4)诱导的肝纤维化小鼠模型,发现岩藻黄素能够减少促纤维化标志物和炎症浸润水平,且这种效应呈现出明显的剂量依赖性。另外,Wu等[15]研究了岩藻黄素对炎症性人气管上皮(BEAS-2B)细胞和对哮喘小鼠的影响,结果表明,岩藻黄素可以抑制哮喘小鼠肺部杯状细胞增生、气道炎症,并显著降低哮喘小鼠气道高反应(AHR),从而减轻小鼠对刺激源的过度病理性反应。在研究岩藻黄素对非酒精脂肪肝的修复作用时,研究者通过高脂饮食喂养小鼠,并将其分为处理组(分别施加高、低两种浓度岩藻黄素)和对照组,结果显示,岩藻黄素处理后的小鼠肝脏体积减小,颜色与正常相近,且胞内脂滴减少,表明肝组织得到了良好的修复[16]。这些研究表明,岩藻黄素不仅对炎症损伤具有改善和修复作用,还能够减轻机体对刺激源的过度反应。Zheng等[17]通过研究高糖诱导的糖尿病心肌病大鼠模型发现,岩藻黄素可以改善链脲佐菌素(STZ)诱导的糖尿病大鼠心肌组织中的脂质代谢、心肌损伤、心肌纤维化和肥大。且在Hu等[18]的研究中发现,在探索岩藻黄素对肾缺血再灌注(I/R)损伤的作用时,岩藻黄素能够显著改善肾功能不全和组织结构损伤。此外,有研究者在家兔痤疮模型中发现,不同剂量的岩藻黄素均对实验性痤疮具有缓解作用[19]。当炎症持续存在,出现炎症浸润现象,对细胞[20]、组织[21]、器官[22]以及整个机体造成伤害,从而促进炎症恶化[23]。岩藻黄素具有降低炎性细胞浸润的潜力,可以减缓慢性疾病的进展。有研究者利用嘧啶甲烷和1,2-二甲基肼二盐酸盐(DMH)诱导的小鼠,发现岩藻黄素抑制了异常隐窝病灶(ACF,结肠癌的肿瘤前标志物)形成,从而抑制结肠炎症向结肠癌的进一步转变[24−25]。综合而言,岩藻黄素表现出显著的抗炎活性,对炎症引起的损伤具有修复作用,可以剂量依赖性地缓解炎症,抑制其进一步发展。
1.2 岩藻黄素抗癌活性
研究显示,岩藻黄素具备显著的抗癌活性,并能提高癌细胞对抗癌药物的敏感性[26−27]。在犬乳肿瘤大鼠模型中,岩藻黄素成功地减少了25%的微血管萌芽数量。此外,使用20 μmol/L岩藻黄素处理犬乳肿瘤细胞(CMT-U27)24 h后,迁移细胞数量减少了66.27%,证实了岩藻黄素具有抗癌细胞转移的能力[28]。在胞同种异体和原位移植的小鼠模型中,岩藻黄素成功地阻止了腺癌(ADC)在胰腺和壁层腹膜组织中的发展,这为其作为化学预防胰腺癌的候选药物提供了有力支持[29]。此外,研究者还发现,在结肠癌模型中添加岩藻黄素后癌细胞的数量减少。岩藻黄素还显著降低了氧化偶氮甲烷/葡聚糖硫酸钠(AOM/DSS)小鼠模型中结肠病变的发生率和/或多发性程度[30]。另外,通过研究7,12-二甲基苯并[a]蒽(DMBA)诱导的仓鼠口腔癌模型,研究者发现给予岩藻黄素(9 mg/kg体重)的小鼠仅出现了轻度或中度的癌前病变,如增生或异性增生,而未接受岩藻黄素的小鼠则出现严重的过度角化、增生及发育异常,均进展为口腔肿瘤[31]。此外,将岩藻黄素与虾青素对照施加给小鼠表皮(JB6P+)细胞,显著降低了JB6P+转化细胞集落的数量。体内和体外实验都说明岩藻黄素对癌症具有化学预防作用[32]。
两位研究者在相同的MDA-MB-231细胞系上进行了研究,但却得到了不同的信号通路[21]。此外,他们还将健康乳腺细胞与MDA-MB-231细胞系进行了对照实验,结果发现岩藻黄素对非肿瘤细胞的活力、迁移速率以及细胞周期等没有显著影响,这表明岩藻黄素对癌细胞具有特异性作用[33−34]。同样地,岩藻黄素与阿霉素联用时,也未对非癌细胞产生不良影响[34]。此外,Qu等[35]对子宫内膜癌HEC-1A施加不同剂量的岩藻黄素(1.2~5 μmol/L)后发现癌细胞活力降低,证明了岩藻黄素对癌细胞具备细胞毒性。癌症组织通常伴随着炎性细胞的存在[36],这些炎性细胞可以促使炎症过程的激活[37],从而加速了癌症的进展。岩藻黄素的作用机制包括抑制癌症引发的炎症,从而有效抑 制了癌症的发展。此外,研究还表明,加入岩藻黄素的饼干显示出明显地抑制结直肠癌发生的潜力[38]。综上所述,岩藻黄素不仅有望预防癌症的发生和抑制其发展,还能够有选择性地干预癌细胞的生长和活动。
2. 岩藻黄素抗炎及抗癌活性机制
2.1 抗炎机制
岩藻黄素有显著的抗炎作用,相关抗炎机制包括抑制氧化应激、调控炎症因子、诱导细胞自噬和抵抗细胞凋亡等(表1)。
表 1 岩藻黄素抗炎作用机制及相关通路Table 1. Anti-inflammatory mechanism and related pathways of fucoxanthin相关炎症 模型类别 作用机制 通路 文献 结肠炎 小鼠模型 炎症相关分子过表达显着降低 NF-κB [14] 肝纤维化 小鼠模型 降低肝纤维化、促纤维化标志物、炎症浸润和促炎细胞因子,促炎细胞因子合成和白细胞迁移 TGF-β/SMAD [15] 哮喘 小鼠模型 降低活性氧,提高抗氧化酶活性;降低炎性细胞因子标志物,降低单核细胞粘附 TGF-β [16] 糖尿病心肌病 大鼠模型 降低活性氧,改善线粒体功能,促进线粒体自噬 Nrf2/Bnip3/Nix [17] 肾缺血/再灌注损伤 小鼠模型 减弱氧化应激诱导的细胞凋亡 Sirt1/Nrf2/HO-1 [18] 痤疮 兔子模型 抑制IL-8分泌量 TLR/NF-κB [19] 氧化损伤 细胞模型 还原型谷胱甘肽增加,ROS含量降低 PI3K/Nrf2 [20] 急性肺损伤 细胞模型 有效地降低促炎因子的mRNA表达,改善炎症反应 NF-κB/TLR4/MyD88 [45] 氧化应激 细胞模型 降低活性氧,抑制促炎基因表达 NF-κB/Nrf2 [46] 脑缺血/再灌注(I/R)损伤 细胞模型 抑制细胞凋亡和培养神经元中的ROS积累 Nrf2/HO-1 [47] 慢性阻塞性肺病 细胞模型 增强细胞活力,并减弱细胞炎症和氧化损伤 PPAR/NF-κB [53] 创伤性脑损伤 小鼠模型 自噬激活,提供神经保护作用 Nrf2-ARE/Nrf2 [54] 高氧化应激 细胞模型 降低细胞活性损伤;对抗细胞凋亡;减少炎症 AKT/ERK [56] 视网膜损伤 细胞模型 缓解氧化应激、炎症,吞噬作用改善 Nrf2 [59] 骨质疏松 细胞模型 抑制破骨细胞分化、骨吸收能力和破骨细胞特异性标志物表达 MAPK/Nrf2 [60] 非酒精性脂肪性肝 细胞模型 超氧化物歧化酶含量上升,促炎细胞因子降低 AMPK/Nrf2/TLR4 [61] 葡萄膜炎 大鼠模型 抑制氧化应激 Nrf2 [62] 糖尿病肾病 细胞模型 通过降低ROS来减弱氧化应激 Sirt1/Nrf2 [63] 脓毒症 小鼠模型 降低促炎因子产生 IκB-α/NF-κB [64] 肾纤维化 大鼠模型 增加抗氧化酶表达,减少ROS的产生,减轻氧化应激 Akt/Sirt1/FoxO3α [65] 阿尔茨海默病 大鼠模型 改善认知功能和神经递质浓度,降低炎症标志物 Tau [66] 糖尿病 小鼠模型 显著改善葡萄糖/脂质代谢和胰岛素抵抗 IRS-1/PI3K/AKT/AMPK [67] 代谢综合征 小鼠模型 减少肝脏脂肪沉积、炎症反应和氧化应激来改善肝损伤 AMPK [68] 2.1.1 抑制氧化应激
岩藻黄素表现出抑制氧化应激的能力,当机体受到刺激时,通常会引发大量氧化物的产生,从而激发氧化应激反应[1]。研究发现,岩藻黄素能够通过促进抗氧化基因的表达,显著增加还原性谷胱甘肽、超氧化物歧化酶和过氧化氢酶等蛋白的表达[39],从而有效缓解氧化应激。实验结果显示,岩藻黄素对DPPH和ABTS+自由基的IC50值分别为0.14 mg/mL和0.05 mg/mL[40]。此外,在抗氧化过程中,岩藻黄素还能够增加还原和氧化谷胱甘肽的比率,将其提高了3.3倍,从而显著增强了机体内源性抗氧化防御机制[41]。岩藻黄素还能够通过靶向清除细胞或线粒体膜上的活性氧(ROS),减少细胞的脂质过氧化程度[42]。这一作用可以缓解由胆碱缺乏高脂肪饮食引发的非酒精性脂肪性肝炎(NASH)模型小鼠的肝损伤,同时也减轻了炎症和炎症浸润相关基因的mRNA表达水平,抑制了肝脏的氧化应激和炎症[43]。当体内自由基持续过量时,会损害DNA并对其他生物大分子产生损害,导致其功能受损,形成恶性氧化应激循环[44]。岩藻黄素能够阻止饮食诱导的NASH模型小鼠肝炎向纤维化的早期阶段转化,从而有效预防了肝炎的进一步发展[43],这表明岩藻黄素可以通过调节自由基水平和提高抗氧化能力,发挥对炎症的拮抗作用。另外,岩藻黄素在抑制核因子κB(NF-κB)的同时激活Nrf2蛋白,从而有助于缓解炎症和氧化应激[44]。Nrf2是抗氧化应激反应的主要调节因子之一,参与防御多种氧化应激/炎症介导的疾病[45]。岩藻黄素可以通过促进Nrf2与其靶基因NQO2的结合,提高NQO1等抗氧化酶的表达,从而增强了抗氧化能力和抗氧化酶活性,发挥了抗炎活性[46]。此外,在神经保护方面,岩藻黄素能够通过间接激活上游的Akt途径,并直接促进Keap1-Nrf2复合物的解离[47]。岩藻黄素通过调节Nrf2蛋白相关通路来增强抗氧化能力,从而发挥抗炎活性。另外,岩藻黄素还通过激活PI3K/Akt途径和抑制ERK靶点蛋白(细胞外信号调节激酶),有效降低活性氧水平,阻止神经元的丧失和死亡,缓解了阿尔兹海默症的神经炎症[48]。岩藻黄素通过降低自由基水平、增加抗氧化物质的表达以及调整氧化应激反应,对于炎症的发展具有抑制作用,从而发挥抗炎作用。
2.1.2 调控炎症因子
正常细胞一旦转变为炎性细胞,就会释放炎症因子,引发炎症反应。岩藻黄素表现出了抑制炎性细胞因子标志物(如IL-1β、TNF-α、iNOS和COX-2等)的能力,从而减轻了细胞的氧化损伤,有助于缓解哮喘炎症反应[49]。在一项关于肺炎支原体(MP)小鼠模型的研究中,岩藻黄素表现出了保护作用,通过降低促炎因子(如IL-6、TNF-α和IL-1β等)浓度,有效减轻了MP感染引发的炎症[50]。此外,在研究岩藻黄素对食物过敏的保护机制时,发现岩藻黄素能够通过调节细胞分泌抗炎因子,如白细胞介素-10(IL-10)和转化生长因子-β(TGF-β),降低促炎因子(如IL-4、肿瘤坏死因子-α(TNF-α)、IL-17和IL-1β等)的水平,从而改善肠道炎症[51]。
岩藻黄素通过抑制NF-κB蛋白的活性,有效降低炎症因子的产生。在炎症反应中,NF-κB蛋白发挥着重要的作用,而IκB-α的活化促进了炎症的发展。研究发现,在败血症小鼠模型[52]和Kligman兔耳痤疮模型中[19],岩藻黄素通过抑制IκB-α的降解和NF-κB蛋白的磷酸化,减少了NF-κB的核转位,进而抑制了细胞中炎症因子的生成,从而进一步预防和缓解了炎症反应。由于NF-κB蛋白在多种免疫通路的交汇处发挥着作用,它与其他多种蛋白质的协同作用形成了更为复杂的信号通路。岩藻黄素能够通过针对TLR4抑制TLR4/MyD88信号通路,降低NF-κB的激活程度[45],这一作用有效地减少了促炎因子(包括IL-10、IL-6、iNOS和COX-2)的mRNA表达。此外,岩藻黄素还能提高PPARγ的表达,抑制NF-κB的激活,增强细胞的抗炎活性,减弱促炎因子的效应,显著缓解了炎症风暴的程度[53]。岩藻黄素对NF-κB蛋白的显著抑制作用使其在免疫调节方面具备了更为有前景的潜力。
2.1.3 诱导细胞自噬
岩藻黄素能够诱导自噬机制,以发挥其抗炎作用。Zheng等[17]利用大鼠模型研究发现,岩藻黄素通过上调Bnip3/Nix蛋白,促进线粒体自噬,抑制了STZ诱导的炎性反应中的线粒体损伤及积累,从而抑制糖尿病心肌病的发展。此外,有研究表明,在创伤性脑损伤模型中,岩藻黄素在体内和体外均能激活细胞自噬过程,抑制炎性反应,提高神经元存活率[54],其相关信号通路与Nrf2蛋白有关。炎症是骨骼肌萎缩的发病机制之一。在地塞米松诱导的C2C12肌管萎缩细胞模型中,岩藻黄素通过激活SIRT1促进PGC-1α的表达,抑制FoxO3作用,减少蛋白质降解,并增强降解蛋白质的清除率,诱导细胞自噬,增强线粒体功能,抑制骨骼肌萎缩的相关炎症,从而发挥缓解骨骼肌萎缩的潜力[55]。
2.1.4 抵抗细胞凋亡
在抗炎过程中,岩藻黄素表现出对炎症细胞凋亡的抵抗作用。一项研究发现,在细胞高氧化应激模型中,岩藻黄素通过降低Akt/ERK相关蛋白以及细胞凋亡相关蛋白的表达,抑制细胞凋亡从而成功抑制了氧化应激引发的炎性反应[56]。此外,在小鼠肾脏缺血/再灌注(I/R)损伤模型中,预先使用岩藻黄素的小鼠显示肾功能障碍得到了改善,炎症反应被抑制,相关信号通路蛋白Sirt1、Nrf2和HO-1的表达得以上调,同时细胞凋亡被有效抑制[18]。另外在脑I/R损伤模型中,岩藻黄素也成功抑制了脑I/R损伤中的炎性反应,抑制细胞凋亡,其作用涉及到Nrf2/HO-1信号通路[47]。
2.1.5 其他
除上述几种机制外,岩藻黄素还能够通过抑制细胞焦亡和诱导炎症小体来发挥抗炎作用。在研究岩藻黄素对动脉粥样硬化的影响时,发现岩藻黄素可以显著降低内皮细胞焦亡相关蛋白的表达,并通过过表达相关蛋白,揭示了岩藻黄素的抗焦亡作用是通过PI3K/AKT和TLR4/NFκB信号传导通路的调控来介导的[57]。Hyeon等[58]为进一步了解岩藻黄素在炎性疾病和神经退行性疾病中的生理功能,在LPS和ATP联合诱导的多细胞模型中,观察到岩藻黄素可以降低NOD样受体热蛋白结构域蛋白(NLRP3)、凋亡相关斑点样蛋白(ASC)和cleaved caspase-1蛋白的表达,从而靶向负调控炎症小体的自组装能力,从而发挥抗炎活性。此外,岩藻黄素还能通过抑制白细胞向炎症组织的迁移进行抗炎[15]。研究发现,在视网膜细胞氧化损伤模型中,施加岩藻黄素后,Nrf2信号通路被激活,细胞的吞噬能力显著提高,炎症反应受到抑制[46,59]。综上所述,岩藻黄素通过增加抗炎因子的产生、降低促炎因子的浓度以及抑制促炎因子的产生等多种途径来调节炎症反应,从而发挥抗炎作用。
2.2 抗癌机制
岩藻黄素可以通过调节细胞周期及状态、诱导细胞凋亡与自噬,抑制细胞迁移和侵袭,诱导细胞铁死亡等机制对癌症发挥化学防护作用[47](表2)。
表 2 岩藻黄素抗肿瘤作用机制及信号通路Table 2. Anti-tumor mechanism and signal pathways of fucoxanthin肿瘤类型 模型 作用机制 通路 文献 三阴性乳腺癌 细胞模型 诱导细胞凋亡和干扰细胞周期S期阻滞 JNK [21] 犬乳腺肿瘤细胞 细胞模型 细胞凋亡,抑制内皮细胞发芽,抑制血管形成和迁移,诱导肿瘤细胞
死亡并抑制血管生成Ang2 [28] 皮肤癌 细胞模型 阻断细胞转化 Nrf2 [32] 肝癌 细胞模型 引起细胞周期G0/G1期停滞,诱导细胞凋亡,增强间隙连接细胞间连接 Cx32/Cx1 [33] 三阴性乳腺癌 细胞模型 减少细胞增殖,诱导细胞凋亡,抑制细胞迁移和侵袭 VEGF-A和VEGF-C [34] 子宫内膜癌 细胞模型 诱导细胞凋亡 PI3K/Akt/mTOR [35] 人胶质瘤 细胞模型 诱导细胞凋亡 MAPKs/PI3K/Akt [69] 胃腺癌 细胞模型 诱导细胞的G2/M期细胞周期阻滞和凋亡 JAK/STAT [71] 黑色素瘤 细胞模型 诱导细胞周期阻滞于G0/G1期和细胞凋亡 NF-κB [72] 宫颈癌 细胞模型 细胞被阻滞在G0/G1细胞周期阶段,显著增加凋亡 p53 [73] 乳腺癌 细胞模型 细胞凋亡增加 NF-κB [76] 鼻咽癌 细胞模型 降低自噬连接蛋白的表达,从而导致细胞凋亡 LC3-I/ATG4B/LC3-II [79] 胶质母细胞瘤 细胞模型 抑制细胞增殖及迁移侵袭,诱导细胞凋亡 Akt/mTOR/p38 [80] 胃癌 细胞模型 抑制体内外肿瘤淋巴管生成和淋巴结转移 importinβ/NF-κB/VEGF-C [83] 乳腺癌 细胞模型 抑制炎症因子诱导的细胞粘附分子(CAM)的表达以及由此产生的癌细胞与内皮细胞之间的粘附 PI7K/AKT 和 FAK/Paxillin
IKK-α/β,IкB-α和NF-кB[84] 卵巢癌 细胞模型 可增强细胞凋亡,减少细胞增殖、迁移和侵袭 PI3K/Akt/mTOR [88] 结直肠癌 小鼠模型 下调癌症相关蛋白,对结直肠癌有化学预防 MAPK/PI3K/Akt
p53/RAS/STAT/TGF-β/Wnt[89] 前列腺癌 细胞模型 诱导癌细胞凋亡 Caspase 9/Caspase 3/7 [90] 宫颈癌 细胞模型 靶向增加细胞凋亡 PI3K/Akt/NF-κB [91] 人膀胱癌 细胞模型 抑制细胞增殖,细胞周期G0/G1期生长停滞 p21/CDK-2/p53 [92] 肺腺癌 细胞模型 抑制细胞细胞增殖及细胞迁移 Wnt/β-catenin [93] 非细小细胞癌 细胞模型 抑制增殖、迁移和侵袭,阻断细胞周期,诱导癌细胞凋亡 PI3K/Akt/mTOR [94] 2.2.1 调节细胞周期及状态
岩藻黄素能够通过调节癌细胞状态和癌细胞生长周期发挥抗癌活性。实验结果显示,在20 μmol/L岩藻黄素处理72 h后,人神经胶质瘤细胞(U87细胞)的生存率明显下降,且这种效应呈现出剂量依赖性[69]。另外,3.8 μmol/L的岩藻黄素与曲格列酮(Troglitazone)的联合治疗显著减弱了人结直肠癌(Caco-2)细胞的存活能力[70]。对于BGC-823细胞,50 μmol/L或75 μmol/L的岩藻黄素通过JAK/STAT信号通路降低了细胞周期蛋白B1的表达,并诱导了在G2/M期的细胞周期停滞。相似浓度下,岩藻黄素还能够诱导SGC-7901细胞在S期循环停滞,这一效应显示出剂量依赖性[71]。除此之外,黑色素瘤细胞[72]、胃腺癌细胞[73]在施加岩藻黄素后,均出现细胞周期停滞现象,但三种癌症细胞分别停滞于G0/G1期和G2/M期。这些结果表明,岩藻黄素能够对不同细胞的生长周期产生阻滞作用,但停滞的细胞周期阶段可能存在差异。另外,岩藻黄素诱导了黑色素瘤细胞系(B16F10细胞)在G0/G1期的周期停滞,研究进一步表明,这一效应是通过降低视网膜母细胞瘤蛋白的磷酸化、细胞周期蛋白D(1和2)以及细胞周期蛋白依赖性激酶(CDK)4的表达,并上调细胞周期蛋白依赖性激酶抑制因子水平实现的[74]。最后,在人肝癌SK-Hep-24细胞中,添加岩藻黄素(1~20 μmol/L)孵育48 h后,细胞周期停滞在G0/G1期,且呈现出浓度依赖性[34]。这些研究结果表明,岩藻黄素通过调节不同的信号通路,对不同的细胞系产生细胞周期阻滞作用。PI3K信号通路的过度激活通常被认为是癌症的标志,而它涉及的PI3K/Akt途径,则被认为是致癌的关键驱动因子,能够促进癌细胞增殖和转移[35]。
2.2.2 诱导细胞凋亡
岩藻黄素诱导细胞凋亡时会显著提高细胞凋亡蛋白Caspase-3和Bax的表达水平。在人前列腺癌细胞(PC-3)模型的实验中,发现岩藻黄素能够引发线粒体功能障碍,并诱导PC-3细胞发生凋亡[69]。NF-κB是岩藻黄素抑制癌细胞增殖、促进细胞凋亡和抑制血管生成的靶点[75]。在MDA-MB-231乳腺癌细胞中,岩藻黄素显著降低了NF-κB中p65、p52和RelB在细胞核中的水平,从而促使细胞凋亡,并且在乳腺癌预防方面表现出明显的效果[76]。岩藻黄素能够以时间依赖性和浓度依赖性诱导细胞凋亡[77]。此外,岩藻黄素还能够激活MAPK信号通路的其他分支,包括JNK、p38/MAPK和ERK5,从而调节神经相关疾病的信号通路[69,78]。研究还表明,岩藻黄素通过降低自噬连接蛋白的表达水平,诱导细胞发生凋亡[79]。
2.2.3 诱导细胞自噬
岩藻黄素能够显著增加与自噬相关的蛋白LC3和Beclin 1的表达,从而抑制癌症。研究表明,岩藻黄素可以诱导人神经胶质瘤细胞(U87细胞)中的细胞自噬机制[80]。此外,自噬还能够防止细胞的过度生长,在早期癌症抑制中发挥着重要作用[14]。Zhu等[81]研究者使用人胃癌(SGC7901)细胞模型发现,岩藻黄素能够诱导细胞内自噬泡的生成,而且这种诱导呈现出浓度依赖性。随着时间和岩藻黄素浓度的增加,细胞中自噬的关键因子Beclin1和LC3的表达也呈上调趋势。此外,岩藻黄素在SGC-7901细胞中上调自噬相关蛋白(beclin-1、LC3)和凋亡相关蛋白(cleaved caspase-3)的表达,同时下调了凋亡相关蛋白Bcl-2的表达,有效诱导自噬和细胞凋亡。
Nrf2不仅能够诱导自噬途径,还参与了岩藻黄素引起的抗癌作用。岩藻黄素能够激活Nrf2信号通路,阻断了TPA诱导的JB6 P+细胞的转化,从而对皮肤癌产生预防作用[32]。Nrf2还能与其他蛋白如Sirt1、HO-1等形成复杂的信号通路,进一步诱导自噬机制,对神经元产生有益作用[82]。
2.2.4 抑制细胞迁移和侵袭
岩藻黄素通过多种机制对癌症发挥防护和抑制作用,其中包括对血管和淋巴管生成的抑制。淋巴结转移在胃癌(GC)的转移过程中起着主要作用,Wang等[83]通过体内外模型研究发现,岩藻黄素通过调控细胞核质转运受体(importinβ)/NF-κB/VEGF-C核转运信号通路来降调Ras相关核蛋白(Ran)的表达,从而有效地抑制了GC诱导的淋巴管生成和转移。此外,岩藻黄素还通过减少MCF-3细胞中IKK-α/β、IкB-α和NF-кB p65的磷酸化水平来抑制NF-кB信号通路,降低了癌细胞与内皮细胞的黏附[84]。此外,岩藻黄素通过下调前列腺癌细胞和内皮细胞中血管生成素2(Ang2)、趋化因子(CXCL5)、TGFβ、IL6、信号转导和转录激活因子(STAT3)、基质金属蛋白酶1(MMP1)、基质金属蛋白酶抑制剂1和2(TIMP1和TIMP2)的表达来抑制前列腺癌细胞的生长,并阻碍内皮细胞的血管网络形成[85]。血管生成与慢性炎症和癌症密切相关[86]。研究表明,上皮-间充质转化(EMT)在肿瘤侵袭和转移中起重要作用,岩藻黄素可以通过抑制上皮到间充质转化(EMT)、PI3K/AKT和FAK/Paxillin信号通路来抑制癌细胞的迁移,从而预防癌症的转移[86]。岩藻黄素(6.25 μmol/L)下调TNF-α刺激MDA-MB-231细胞中的血管内皮生长因子-A(VEGF-A)和VEGF-C表达,减少细胞增殖[34]。并且岩藻黄素能通过显著提高人肝癌细胞(SK-Hep-1细胞)中连接蛋白43(Cx43)和连接蛋白32(Cx32)的蛋白,增加癌细胞间的连接从而抑制癌细胞的迁移与侵袭。
2.2.5 其他
研究表明,岩藻黄素能够通过触发铁死亡对胶质母细胞瘤(GBM)产生抑制作用,其具体机制是靶向转铁蛋白受体(TFRC)并抑制TFRC的降解,帮助将更多的铁离子运输到细胞中,导致GBM细胞铁死亡[87]。
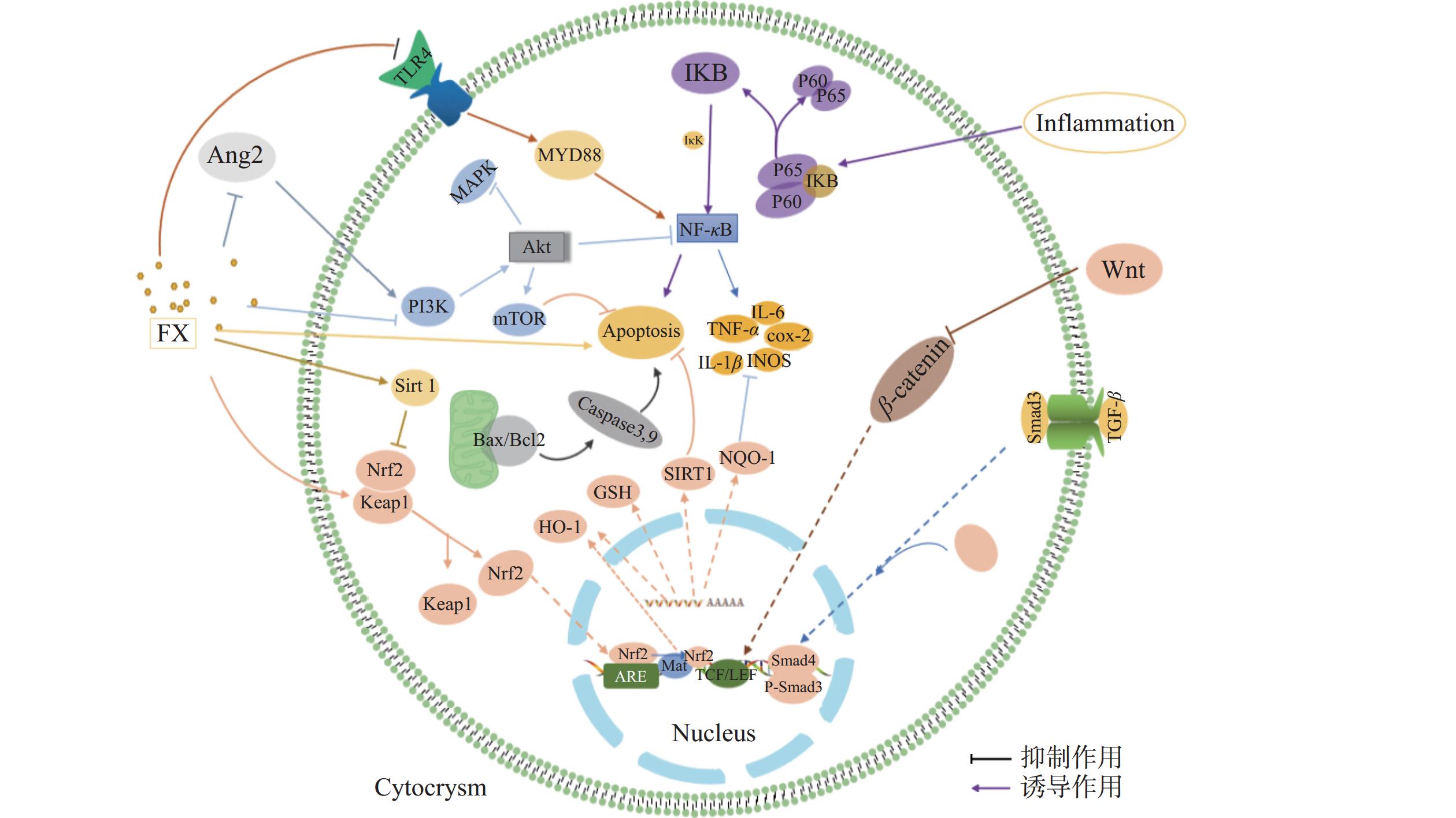
岩藻黄素发挥抗炎、抗癌作用机制的相关靶点蛋白质共同形成了与疾病相适应的信号通路,从而发挥了抗炎和抗癌的作用。由于炎症和癌症之间存在紧密联系,因此岩藻黄素所激活的炎症通路和癌症通路具有相似的特点和作用靶点(图2)。
3. 结论
岩藻黄素作为一种具有多种生理活性的天然产物,在抗炎和抗癌领域具有广泛的应用前景。其具有的抗炎机制(抑制氧化应激、调节炎症因子、调控细胞自噬和抵抗细胞凋亡等)和抗癌机制(诱导细胞凋亡和自噬、调节细胞周期、抑制细胞转移侵袭等),为癌症治疗和炎症性疾病管理提供了新的可能性。岩藻黄素通过干预关键信号通路的靶点蛋白调节多种细胞生物学过程,有望成为未来治疗策略中的重要组成部分。然而,尽管已经取得了显著的研究进展,但仍需更加深入了解岩藻黄素的作用机制以及其与其他药物和治疗方法的潜在协同效应及相关作用机制。同时,岩藻黄素的肠道代谢物岩藻黄质醇、岩藻黄嘌呤和褐藻黄质A,以及合成前体新黄质等物质的生物活性及应用也值得探索,此外,临床研究和临床试验将有助于验证其在实际临床中的疗效和安全性。随着科学研究的不断深入,期待岩藻黄素在未来在功能性食品领域中能进一步应用。
-
表 1 岩藻黄素抗炎作用机制及相关通路
Table 1 Anti-inflammatory mechanism and related pathways of fucoxanthin
相关炎症 模型类别 作用机制 通路 文献 结肠炎 小鼠模型 炎症相关分子过表达显着降低 NF-κB [14] 肝纤维化 小鼠模型 降低肝纤维化、促纤维化标志物、炎症浸润和促炎细胞因子,促炎细胞因子合成和白细胞迁移 TGF-β/SMAD [15] 哮喘 小鼠模型 降低活性氧,提高抗氧化酶活性;降低炎性细胞因子标志物,降低单核细胞粘附 TGF-β [16] 糖尿病心肌病 大鼠模型 降低活性氧,改善线粒体功能,促进线粒体自噬 Nrf2/Bnip3/Nix [17] 肾缺血/再灌注损伤 小鼠模型 减弱氧化应激诱导的细胞凋亡 Sirt1/Nrf2/HO-1 [18] 痤疮 兔子模型 抑制IL-8分泌量 TLR/NF-κB [19] 氧化损伤 细胞模型 还原型谷胱甘肽增加,ROS含量降低 PI3K/Nrf2 [20] 急性肺损伤 细胞模型 有效地降低促炎因子的mRNA表达,改善炎症反应 NF-κB/TLR4/MyD88 [45] 氧化应激 细胞模型 降低活性氧,抑制促炎基因表达 NF-κB/Nrf2 [46] 脑缺血/再灌注(I/R)损伤 细胞模型 抑制细胞凋亡和培养神经元中的ROS积累 Nrf2/HO-1 [47] 慢性阻塞性肺病 细胞模型 增强细胞活力,并减弱细胞炎症和氧化损伤 PPAR/NF-κB [53] 创伤性脑损伤 小鼠模型 自噬激活,提供神经保护作用 Nrf2-ARE/Nrf2 [54] 高氧化应激 细胞模型 降低细胞活性损伤;对抗细胞凋亡;减少炎症 AKT/ERK [56] 视网膜损伤 细胞模型 缓解氧化应激、炎症,吞噬作用改善 Nrf2 [59] 骨质疏松 细胞模型 抑制破骨细胞分化、骨吸收能力和破骨细胞特异性标志物表达 MAPK/Nrf2 [60] 非酒精性脂肪性肝 细胞模型 超氧化物歧化酶含量上升,促炎细胞因子降低 AMPK/Nrf2/TLR4 [61] 葡萄膜炎 大鼠模型 抑制氧化应激 Nrf2 [62] 糖尿病肾病 细胞模型 通过降低ROS来减弱氧化应激 Sirt1/Nrf2 [63] 脓毒症 小鼠模型 降低促炎因子产生 IκB-α/NF-κB [64] 肾纤维化 大鼠模型 增加抗氧化酶表达,减少ROS的产生,减轻氧化应激 Akt/Sirt1/FoxO3α [65] 阿尔茨海默病 大鼠模型 改善认知功能和神经递质浓度,降低炎症标志物 Tau [66] 糖尿病 小鼠模型 显著改善葡萄糖/脂质代谢和胰岛素抵抗 IRS-1/PI3K/AKT/AMPK [67] 代谢综合征 小鼠模型 减少肝脏脂肪沉积、炎症反应和氧化应激来改善肝损伤 AMPK [68] 表 2 岩藻黄素抗肿瘤作用机制及信号通路
Table 2 Anti-tumor mechanism and signal pathways of fucoxanthin
肿瘤类型 模型 作用机制 通路 文献 三阴性乳腺癌 细胞模型 诱导细胞凋亡和干扰细胞周期S期阻滞 JNK [21] 犬乳腺肿瘤细胞 细胞模型 细胞凋亡,抑制内皮细胞发芽,抑制血管形成和迁移,诱导肿瘤细胞
死亡并抑制血管生成Ang2 [28] 皮肤癌 细胞模型 阻断细胞转化 Nrf2 [32] 肝癌 细胞模型 引起细胞周期G0/G1期停滞,诱导细胞凋亡,增强间隙连接细胞间连接 Cx32/Cx1 [33] 三阴性乳腺癌 细胞模型 减少细胞增殖,诱导细胞凋亡,抑制细胞迁移和侵袭 VEGF-A和VEGF-C [34] 子宫内膜癌 细胞模型 诱导细胞凋亡 PI3K/Akt/mTOR [35] 人胶质瘤 细胞模型 诱导细胞凋亡 MAPKs/PI3K/Akt [69] 胃腺癌 细胞模型 诱导细胞的G2/M期细胞周期阻滞和凋亡 JAK/STAT [71] 黑色素瘤 细胞模型 诱导细胞周期阻滞于G0/G1期和细胞凋亡 NF-κB [72] 宫颈癌 细胞模型 细胞被阻滞在G0/G1细胞周期阶段,显著增加凋亡 p53 [73] 乳腺癌 细胞模型 细胞凋亡增加 NF-κB [76] 鼻咽癌 细胞模型 降低自噬连接蛋白的表达,从而导致细胞凋亡 LC3-I/ATG4B/LC3-II [79] 胶质母细胞瘤 细胞模型 抑制细胞增殖及迁移侵袭,诱导细胞凋亡 Akt/mTOR/p38 [80] 胃癌 细胞模型 抑制体内外肿瘤淋巴管生成和淋巴结转移 importinβ/NF-κB/VEGF-C [83] 乳腺癌 细胞模型 抑制炎症因子诱导的细胞粘附分子(CAM)的表达以及由此产生的癌细胞与内皮细胞之间的粘附 PI7K/AKT 和 FAK/Paxillin
IKK-α/β,IкB-α和NF-кB[84] 卵巢癌 细胞模型 可增强细胞凋亡,减少细胞增殖、迁移和侵袭 PI3K/Akt/mTOR [88] 结直肠癌 小鼠模型 下调癌症相关蛋白,对结直肠癌有化学预防 MAPK/PI3K/Akt
p53/RAS/STAT/TGF-β/Wnt[89] 前列腺癌 细胞模型 诱导癌细胞凋亡 Caspase 9/Caspase 3/7 [90] 宫颈癌 细胞模型 靶向增加细胞凋亡 PI3K/Akt/NF-κB [91] 人膀胱癌 细胞模型 抑制细胞增殖,细胞周期G0/G1期生长停滞 p21/CDK-2/p53 [92] 肺腺癌 细胞模型 抑制细胞细胞增殖及细胞迁移 Wnt/β-catenin [93] 非细小细胞癌 细胞模型 抑制增殖、迁移和侵袭,阻断细胞周期,诱导癌细胞凋亡 PI3K/Akt/mTOR [94] -
[1] GÖKHAN S H. Inflammation, metaflammation and immunometabolic disorders[J]. Nature,2017,542(7640):177−185. doi: 10.1038/nature21363
[2] KORNILUK A, KOPER O, KEMONA H, et al. From inflammation to cancer[J]. Irish Journal of Medical Science,2017,186(1):57−62. doi: 10.1007/s11845-016-1464-0
[3] JAVIER Á, SARA G, AZAHARA R, et al. Anti-inflammatory and anticancer effects of microalgal carotenoids[J]. Marine Drugs,2021,19(10):531. doi: 10.3390/md19100531
[4] GIUSEPPE R, ESTER C, CLAUDIA P, et al. Sinonasal side effects of chemotherapy and/or radiation therapy for head and neck cancer:A literature review[J]. Cancers,2022,14(9):2324. doi: 10.3390/cancers14092324
[5] 林双兰, 周建荣. 癌症症状群的发展历程[J]. 中国老年学杂志,2013,33(10):2470−2474. [LIN S L, ZHOU J R. The development of cancer symptom clusters[J]. Chinese Journal of Gerontology,2013,33(10):2470−2474.] doi: 10.3969/j.issn.1005-9202.2013.10.132 LIN S L, ZHOU J R. The development of cancer symptom clusters[J]. Chinese Journal of Gerontology, 2013, 33(10): 2470−2474. doi: 10.3969/j.issn.1005-9202.2013.10.132
[6] 彭庆颖, 张远起. 乳腺癌化疗相关骨髓抑制的研究进展[J]. 临床医学研究与实践,2023,8(7):182−185. [PENG Q Y, ZHANG Y Q. Research progress of myelosuppression related to chemotherapy for breast cancer[J]. Clinical Research and Practice,2023,8(7):182−185.] PENG Q Y, ZHANG Y Q. Research progress of myelosuppression related to chemotherapy for breast cancer[J]. Clinical Research and Practice, 2023, 8(7): 182−185.
[7] 刘逸煊, 刘家伶, 郭凯, 等. 岩藻黄素通过NF-κB信号通路抑制LPS诱导的细胞炎症反应的研究[J]. 福建师范大学学报(自然科学版),2019,35(2):89−96. [LIU Y X, LIU J L, GUO K, et al. Fucoxanthin inhibits LPS-induced cellular inflammatory response through NF-κB signaling pathway[J]. Journal of Fujian Normal University(Natural Science Edition),2019,35(2):89−96.] doi: 10.12046/j.issn.1000-5277.2019.02.013 LIU Y X, LIU J L, GUO K, et al. Fucoxanthin inhibits LPS-induced cellular inflammatory response through NF-κB signaling pathway[J]. Journal of Fujian Normal University(Natural Science Edition), 2019, 35(2): 89−96. doi: 10.12046/j.issn.1000-5277.2019.02.013
[8] 方学红, 李晓丹, 蒋代顺, 等. 岩藻黄质及其活性[J]. 临床与病理杂志,2022,42(5):1210−1218. [FANG X H, LI X D, JIANG D S, et al. Flavoprotein and its activity[J]. Journal of Clinical and Pathological Sciences,2022,42(5):1210−1218.] doi: 10.3978/j.issn.2095-6959.2022.05.031 FANG X H, LI X D, JIANG D S, et al. Flavoprotein and its activity[J]. Journal of Clinical and Pathological Sciences, 2022, 42(5): 1210−1218. doi: 10.3978/j.issn.2095-6959.2022.05.031
[9] 张桂林, 张亚亭, 姜宏, 等. 岩藻黄质关键前体新黄质的代谢工程合成[J]. 南方水产科学,2022,18(2):57−65. [ZHANG G L, ZHANG Y T, JIANG H, et al. Metabolic engineering synthesis of neoxanthin, a key precursor of fucoxanthin[J]. South China Fisheries Science,2022,18(2):57−65.] doi: 10.12131/20210316 ZHANG G L, ZHANG Y T, JIANG H, et al. Metabolic engineering synthesis of neoxanthin, a key precursor of fucoxanthin[J]. South China Fisheries Science, 2022, 18(2): 57−65. doi: 10.12131/20210316
[10] AHMED S A, MENDONCA P, ELHAG R, et al. Anticancer effects of fucoxanthin through cell cycle arrest, apoptosis induction, angiogenesis inhibition, and autophagy modulation[J]. International Journal of Molecular Sciences,2022,23(24):16091. doi: 10.3390/ijms232416091
[11] EID S Y, EL-READI M. Z, WINK M, et al. Carotenoids reverse multidrug resistance in cancer cells by interfering with ABC-transporters[J]. Phytomedicine,2012,19(11):977−987. doi: 10.1016/j.phymed.2012.05.010
[12] ZHAO Y Q, ZHANG L, ZHAO G X, et al. Fucoxanthin attenuates doxorubicin-induced cardiotoxicity via anti-oxidant and anti-apoptotic mechanisms associated with p38, JNK and p53 pathways[J]. Journal of Functional Foods,2019,62:103542. doi: 10.1016/j.jff.2019.103542
[13] YANG Y P, TONG Q Y, ZHENG S H, et al. Anti-inflammatory effect of fucoxanthin on dextran sulfate sodium-induced colitis in mice[J]. Natural Product Research,2020,34(12):1791−1795. doi: 10.1080/14786419.2018.1528593
[14] SLAUTIN V, GREBNEV D, MAKLAKOVA I, et al. Fucoxanthin exert dose-dependent antifibrotic and anti-inflammatory effects on CCl-induced liver fibrosis[J]. Journal of Natural Medicines,2023,77(4):953−963. doi: 10.1007/s11418-023-01723-9
[15] WU S J, LIOU C J, CHEN Y L, et al. Fucoxanthin ameliorates oxidative stress and airway inflammation in tracheal epithelial cells and asthmatic mice[J]. Cells,2021,10(6):1311. doi: 10.3390/cells10061311
[16] 任祥雨, 郑佳文, 田笑笑, 等. 岩藻黄素对小鼠非酒精性脂肪性肝病的修复作用[J]. 食品科学,2024,45(3):42−52. [REN X Y, ZHENG J W, TIAN X X, et al. Repair effect of fucoxanthin on non-alcoholic fatty liver disease in mice[J]. Food Science,2024,45(3):42−52.] doi: 10.7506/spkx1002-6630-20230404-034 REN X Y, ZHENG J W, TIAN X X, et al. Repair effect of fucoxanthin on non-alcoholic fatty liver disease in mice[J]. Food Science, 2024, 45(3): 42−52. doi: 10.7506/spkx1002-6630-20230404-034
[17] ZHENG D X, CHEN L, LI G, et al. Fucoxanthin ameliorated myocardial fibrosis in STZ-induced diabetic rats and cell hypertrophy in HG-induced H9c2 cells by alleviating oxidative stress and restoring mitophagy[J]. Food & Function,2022,13(18):9559−9575.
[18] HU M, LEI W, YUFENG X, et al. Fucoxanthin attenuates oxidative damage by activating the Sirt1/Nrf2/HO-1 signaling pathway to protect the kidney from ischemia-reperfusion injury[J]. Oxidative Medicine and Cellular Longevity,2022,2022:7444430.
[19] 卢旭. 复方褐藻素软膏抗实验性痤疮及THP-1细胞炎症机制的研究[D]. 福州:福建中医药大学, 2017. [LU X. Study on the anti-experimental acne and THP-1 cell inflammatory mechanism of compound fucoidan ointment[D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2017.] LU X. Study on the anti-experimental acne and THP-1 cell inflammatory mechanism of compound fucoidan ointment[D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2017.
[20] WANG X, CUI Y J, JIA Q, et al. Fucoxanthin exerts cytoprotective effects against hydrogen peroxide-induced oxidative damage in LO2 cells[J]. Biomed Research International,2018,2018:1085073.
[21] ANTUNES A, CARMO F, PINTO S, et al. The anti-proliferative effect of β-carotene against a triple-negative breast cancer cell line is cancer cell-specific and JNK-dependent[J]. Pharmanutrition,2022,22:100320. doi: 10.1016/j.phanu.2022.100320
[22] RASIKA R H, DAVIT S, WENJI L, et al. Epigenomic, transcriptomic, and protective effect of carotenoid fucoxanthin in high glucose-induced oxidative stress in Mes13 kidney mesangial cells[J]. Chemical Research in Toxicology,2021,34(3):713−722. doi: 10.1021/acs.chemrestox.0c00235
[23] WANG R X, ZHOU M, MA H L, et al. The role of chronic inflammation in various diseases and anti-inflammatory therapies containing natural products he role of chronic[J]. Chem Med Chem,2021,16(10):1576−1592. doi: 10.1002/cmdc.202000996
[24] KIM J M, ARAKI S, KIM D J, et al. Chemopreventive effects of carotenoids and curcumins on mouse colon carcinogenesis after 1, 2-dimethylhydrazine initiation[J]. Carcinogenesis,1998,19(1):81−85. doi: 10.1093/carcin/19.1.81
[25] DAS S K, HASHIMOTO T, BABA M, et al. Japanese kelp (kombu) extract suppressed the formation of aberrant crypt foci in azoxymethane challenged mouse colon[J]. Journal of Clinical Biochemistry and Nutrition,2006,38(2):119−125. doi: 10.3164/jcbn.38.119
[26] LIU C L, LIM Y P, HU M L. Fucoxanthin enhances cisplatin-induced cytotoxicity via NF kappa B-mediated pathway and downregulates DNA repair gene expression in human hepatoma HepG2 cells[J]. Marine Drugs,2013,11(1):50−66.
[27] RETNO N A D, LIA K, MICHAEL W. Bixin and fucoxanthin sensitize human lung cancer and cervical cancer cell to cisplatin in vitro[J]. BMC Research Notes,2021,14(1):454−454. doi: 10.1186/s13104-021-05866-4
[28] HYUK J, JAWUN C, JEONGKI P, et al. Fucoxanthin exerts anti-tumor activity on canine mammary tumor cells via tumor cell apoptosis induction and angiogenesis inhibition[J]. Animals,2021,11(6):1512. doi: 10.3390/ani11061512
[29] MURASE W, KAMAKURA Y, KAWAKAMI S, et al. Fucoxanthin prevents pancreatic tumorigenesis in C57BL/6J mice that received allogenic and orthotopic transplants of cancer cells[J]. International Journal of Molecular Sciences,2021,22(24):13620. doi: 10.3390/ijms222413620
[30] TERASAKI M, KIMURA R, KUBOTA A, et al. Continuity of tumor microenvironmental suppression in AOM/DSS mice by fucoxanthin may be able to track with salivary glycine[J]. In Vivo (Athens, Greece), 34(6), 3205-3215.
[31] ZHUANG Z Z, WANG J X, YANG Y S, et al. Antioral cancer effect of fucoxanthin on 7, 12-dimethylbenz[a] anthracene-induced experimental cancer model hamster through changes of apoptosis and cell proliferation[J]. Pharmacognosy Magazine,2021,17(75):578−586.
[32] YANG Y, YANG I, CAO M, et al. Fucoxanthin elicits epigenetic modifications, Nrf2 activation and blocking transformation in mouse skin JB6 P+cells[J]. The AAPS Journal,2018,20(2):32. doi: 10.1208/s12248-018-0197-6
[33] LIU C L, HUANG Y S, HOSOKAWA M, et al. Inhibition of proliferation of a hepatoma cell line by fucoxanthin in relation to cell cycle arrest and enhanced gap junctional intercellular communication[J]. Chem-biol Interact,2009,182(2-3):165−172. doi: 10.1016/j.cbi.2009.08.017
[34] AHMED S, MENDONCAP P, MESSEHA S, et al. Fucoxanthin anti-tumor effects on the proliferation, angiogenesis, apoptosis, and migration of triple-negative breast cancer cells[J]. Cancer Epidem Biomar,2023,32(1):236−237.
[35] QU J F, SUN Y P, YANG L K, et al. Fucoxanthin prevents cell growth and induces apoptosis in endometrial cancer HEC-1A cells by the inhibition of the PI3K/Akt/mTOR pathway[J]. Journal of Biochemical and Molecular Toxicology,2022,36(6):e23027. doi: 10.1002/jbt.23027
[36] QIAO Y Y, FU E Q. Advances in the study of tumor-associated macrophages in lung cancer[J]. Chinese Journal of Lung Cancer,2022,25(1):34−39.
[37] SCHEEN A J, NOËL A, DELVENNE P, et al. Inflammation and cancer:A complex two-way relationship[J]. Revue Médicale de Liège,2022,77(5-6):354−360.
[38] MASARU T, WANG J X, YANG Y S, et al. A biscuit containing fucoxanthin prevents colorectal carcinogenesis in mice[J]. Nutrition and Cancer,2022,74(10):11.
[39] ZHENG J, PIAO M J, KIM K C, et al. Fucoxanthin enhances the level of reduced glutathione via the Nrf2-mediated pathway in human keratinocytes[J]. Marine Drugs,2014,12(7):4214−4230. doi: 10.3390/md12074214
[40] ZHAO X J, GAO L W, ZHAO X Z. Rapid purification of fucoxanthin from Phaeodactylum tricornutum[J]. Molecules,2022,27(10):3189. doi: 10.3390/molecules27103189
[41] JIN X, ZHAO T T, SHI D, et al. Protective role of fucoxanthin in diethylnitrosamine-induced hepatocarcinogenesis in experimental adult rats[J]. Drug Development Research,2019,80(2):209−217. doi: 10.1002/ddr.21451
[42] CHIANG Y F, CHEN H Y, CHANG Y J, et al. Protective effects of fucoxanthin on high glucose and 4-hydroxynonenal (4-HNE)-induced injury in human retinal pigment epithelial cells[J]. Antioxidants (Basel),2020,9(12):1176. doi: 10.3390/antiox9121176
[43] TAKATANI N, KONO Y, BEPPU F, et al. Fucoxanthin inhibits hepatic oxidative stress, inflammation, and fibrosis in diet-induced nonalcoholic steatohepatitis model mice[J]. Biochemical and Biophysical Research Communications,2020,528(2):305−310. doi: 10.1016/j.bbrc.2020.05.050
[44] ZHENG J W, T X X, ZHANG W, et al. Protective effects of fucoxanthin against alcoholic liver injury by activation of Nrf2-mediated antioxidant defense and inhibition of TLR4-mediated inflammation[J]. Marine Drugs,2019,17(10):552. doi: 10.3390/md17100552
[45] LI X L, HUANG R M, LIU K F, et al. Fucoxanthin attenuates LPS-induced acute lung injury via inhibition of the TLR4/MYD88 signaling axis[J]. Aging,2020,12:2655−2667.
[46] LI Y J, GUO Z X, WANG S N, et al. Fucoxanthin pretreatment ameliorates visible light-induced phagocytosis disruption of RPE cells under a lipid-rich environment via the Nrf2 pathway[J]. Marine Drugs,2021,20(1):15. doi: 10.3390/md20010015
[47] HU L X, CHEN W M, FENG T, et al. Neuroprotective role of fucoxanthin against cerebral ischemic/reperfusion injury through activation of Nrf2/HO-1 signaling[J]. Biomed Pharmacother,2018,106:1484−1489. doi: 10.1016/j.biopha.2018.07.088
[48] OLIYAEI N, MOOSAVI-NASAB M, TANIDEH N, et al. Multiple roles of fucoxanthin and astaxanthin against Alzheimer's disease:Their pharmacological potential and therapeutic insights[J]. Brain Research Bulletin,2023,193:11−21. doi: 10.1016/j.brainresbull.2022.11.018
[49] TANG C P, HOU Y H. First evidence for the anti-inflammatory activity of fucoxanthin in high-fat-diet-induced obesity in mice and the antioxidant functions in PC12 cells[J]. Inflammation,2014,37(2):443−450. doi: 10.1007/s10753-013-9757-1
[50] WU H B, LI S, WANG L L, et al. Fucoxanthin, a marine carotenoid, suppresses mycoplasma pneumoniae-triggered inflammatory cytokine production and promotes bacterial clearance in a murine model[J]. Evidence-Based Complementary and Alternative Medicine,2022,2022:6238162.
[51] HAN B, MA Y, LIU Y X. Fucoxanthin prevents the ovalbumin-induced food allergic response by enhancing the intestinal epithelial barrier and regulating the intestinal flora[J]. Journal of Agricultural and Food Chemistry,2022,70(33):10229−10238. doi: 10.1021/acs.jafc.2c04685
[52] XIAO Y, YANG C, DONG M, et al. Fucoxanthin attenuates the lipopolysaccharide-induced sepsis and acute lung injury through the inactivation of nuclear factor-kappa B signaling pathway[J]. Pharmacognosy Magazine,2020,16(69):235−241.
[53] CHEN S L, LIN Z, LI J. Fucoxanthin ameliorates oxidative injury and inflammation of human bronchial epithelial cells induced by cigarette smoke extract via the PPARγ/NF-κB signaling pathway[J]. Experimental and Therapeutic Medicine,2023,25(1):11768.
[54] ZHANG L, WANG H D, FAN Y W, et al. Fucoxanthin provides neuroprotection in models of traumatic brain injury via the Nrf2-ARE and Nrf2-autophagy pathways[J]. Scientific Reports,2017,7:46763. doi: 10.1038/srep46763
[55] LIAO Z Y, CHEN J L, CHEN Q N, et al. Fucoxanthin rescues dexamethasone induced C2C12 myotubes atrophy[J]. Biomedicine & Pharmacotherapy 2021, 139:111590.
[56] CHIANG Y F, TSAI C T, CHEN H Y, et al. Protective effects of fucoxanthin on hydrogen peroxide-induced calcification of heart valve interstitial cells[J]. Marine Drugs,2021,19(6):307. doi: 10.3390/md19060307
[57] CUI S Y, WU H L, HE Q, et al. Fucoxanthin alleviated atherosclerosis by regulating PI3K/AKT and TLR4/NFκB mediated pyroptosis in endothelial cells[J]. International Immunopharmacologyl,2023,120:110370. doi: 10.1016/j.intimp.2023.110370
[58] HYEON A L, YOON H S, HWI J P, et al. Fucoxanthin from microalgae Phaeodactylum tricornutum inhibits pro-inflammatory cytokines by regulating both NF-κB and NLRP3 inflammasome activation[J]. Scientific Reports,2021,11(1):543−543. doi: 10.1038/s41598-020-80748-6
[59] 郭紫欣, 刘芸君, 刘翼翔, 等. 岩藻黄素改善视网膜色素上皮细胞吞噬功能的非抗氧化途径[J]. 食品科学,2022,43(23):168−173. [GUO Z X, LIU Y J, LIU Y X, et al. Non-antioxidant pathway of fucoxanthin to improve phagocytosis function of retinal pigment epithelial cells[J]. Food Science,2022,43(23):168−173.] doi: 10.7506/spkx1002-6630-20211231-358 GUO Z X, LIU Y J, LIU Y X, et al. Non-antioxidant pathway of fucoxanthin to improve phagocytosis function of retinal pigment epithelial cells[J]. Food Science, 2022, 43(23): 168−173. doi: 10.7506/spkx1002-6630-20211231-358
[60] YOUJUNG H, SEOK C Y, RIM O Y, et al. Fucoxanthin suppresses osteoclastogenesis via modulation of MAP kinase and Nrf2 signaling[J]. Marine Drugs,2021,19(3):132. doi: 10.3390/md19030132
[61] YE J N, ZHENG J W, TIAN X X, et al. Fucoxanthin attenuates free fatty acid-induced nonalcoholic fatty liver disease by regulating lipid metabolism/oxidative stress/inflammation via the AMPK/Nrf2/TLR4 signaling pathway[J]. Marine Drugs,2022,20(4):225. doi: 10.3390/md20040225
[62] CHEN S J, LIN Z B, PENG X Y, et al. Protective effects of fucoxanthin dampen pathogen-associated molecular pattern (PAMP) lipopolysaccharide-induced inflammatory action and elevated intraocular pressure by activating Nrf2 signaling and generating reactive oxygen species[J]. Antioxidants,2021,10(7):1092−1092. doi: 10.3390/antiox10071092
[63] GUANYU Y, QINGDE L, JING P, et al. Fucoxanthin regulates Nrf2 signaling to decrease oxidative stress and improves renal fibrosis depending on Sirt1 in HG-induced GMCs and STZ-induced diabetic rats[J]. European Journal of Pharmacology,2021,913:174629. doi: 10.1016/j.ejphar.2021.174629
[64] 郭凯. 岩藻黄素抗炎及调控先天免疫机制的研究[D]. 福州:福建师范大学, 2019. [GUO K. Study on anti-inflammatory and innate immune mechanism of fucoxanthin[D]. Fuzhou:Fujian Normal University, 2019.] GUO K. Study on anti-inflammatory and innate immune mechanism of fucoxanthin[D]. Fuzhou: Fujian Normal University, 2019.
[65] YANG G Y, LIN J, ZHENG D X, et al. Fucoxanthin alleviates oxidative stress through Akt/Sirt1/FoxO3α signaling to inhibit HG-induced renal fibrosis in GMCs[J]. Marine Drugs,2019,17(12):702. doi: 10.3390/md17120702
[66] DHAMI M, RAJ K, SINGH S. Neuroprotective effect of fucoxanthin against intracerebroventricular streptozotocin (ICV-STZ) induced cognitive impairment in experimental rats[J]. Current Alzheimer Research,2021,18(8):623−637. doi: 10.2174/1567205018666211118144602
[67] ZHANG Y P, XU W, HUANG X Q, et al. Fucoxanthin ameliorates hyperglycemia, hyperlipidemia and insulin resistance in diabetic mice partially through IRS-1/PI3K/Akt and AMPK pathways[J]. Journal of Functional Foods,2018,48:515−524. doi: 10.1016/j.jff.2018.07.048
[68] DENG Z, WANG J, WU N, et al. Co-activating the AMPK signaling axis by low molecular weight fucoidan LF2 and fucoxanthin improves the HFD-induced metabolic syndrome in mice[J]. Journal of Functional Foods,2022,94:105119. doi: 10.1016/j.jff.2022.105119
[69] WU H L, FU X Y, CAO W G, et al. Induction of apoptosis in human glioma cells by fucoxanthin via triggering of ROS-mediated oxidative damage and regulation of MAPKs and PI3K-AKT pathways[J]. Journal of Agricultural and Food Chemistry,2019,67(8):2212−2219. doi: 10.1021/acs.jafc.8b07126
[70] HOSOKAWA M, KUDO M, MAEDA H, et al. Fucoxanthin induces apoptosis and enhances the antiproliferative effect of the PPARgamma ligand, troglitazone, on colon cancer cells[J]. Biochimica et Biophysica Acta,2004,1675(1-3):113−119. doi: 10.1016/j.bbagen.2004.08.012
[71] YU R X, HU X M, XU S Q, et al. Effects of fucoxanthin on proliferation and apoptosis in human gastric adenocarcinoma MGC-803 cells via JAK/STAT signal pathway[J]. European Journal of Pharmacology,2011,657(1-3):10−19. doi: 10.1016/j.ejphar.2010.12.006
[72] CHUNG T W, CHOI H J, LEE J Y, et al. Marine algal fucoxanthin inhibits the metastatic potential of cancer cells[J]. Biochemical and Biophysical Research Communications,2013,439(4):580−585. doi: 10.1016/j.bbrc.2013.09.019
[73] YE G L, WANG L L, YANG K, et al. Fucoxanthin may inhibit cervical cancer cell proliferation via downregulation of HIST1H3D[J]. Journal of International Medical Research,2020,48(10):1.
[74] KIM K, AHN G, HEO S, et al. Inhibition of tumor growth in vitro and in vivo by fucoxanthin against melanoma B16F10 cells[J]. Environ Toxicol Pharmacol,2013,35(1):39−46. doi: 10.1016/j.etap.2012.10.002
[75] LIU J, LU Y J, TANG M, et al. Fucoxanthin prevents long-term administration l-DOPA-induced neurotoxicity through the ERK/JNK-c-jun system in 6-OHDA-lesioned mice and PC12 cells[J]. Marine Drugs,2022,20(4):245. doi: 10.3390/md20040245
[76] RWIGEMERA A, MAMELONA J, MARTIN L J. Comparative effects between fucoxanthinol and its precursor fucoxanthin on viability and apoptosis of breast cancer cell lines MCF-7 and MDA-MB-231[J]. Anticancer Research,2015,35(1):207−219.
[77] LIU Y G, ZHENG J, ZHANG Y, et al. Fucoxanthin activates apoptosis via inhibition of PI3K/Akt/mTOR pathway and suppresses invasion and migration by restriction of p38-MMP-2/9 pathway in human glioblastoma cells[J]. Neurochem Res,2016,41(10):2728−2751. doi: 10.1007/s11064-016-1989-7
[78] SALVATO I, RICCIARDI L, NUCERA F, et al. Rna-binding proteins as a molecular link between COPD and lung cancer[J]. Int J Chron Obstruct Pulmon Dis,2023,20(1):18−30. doi: 10.1080/15412555.2022.2107500
[79] LONG Y, CAO X B, ZHAO R Q, et al. Fucoxanthin treatment inhibits nasopharyngeal carcinoma cell proliferation through induction of autophagy mechanism[J]. Environ Toxicol,2020,35(10):1082−1090. doi: 10.1002/tox.22944
[80] 刘钰罡, 孙移坤, 戴宜武. 岩藻黄素对脑胶质瘤细胞U87增殖及自噬的影响[J]. 山东医药,2016,56(15):4−7. [LIU Y G, SUN Y K, DAI Y W. Effects of fucoidan on proliferation and autophagy of glioma cell U87[J]. Shandong Medicine,2016,56(15):4−7.] doi: 10.3969/j.issn.1002-266X.2016.15.002 LIU Y G, SUN Y K, DAI Y W. Effects of fucoidan on proliferation and autophagy of glioma cell U87[J]. Shandong Medicine, 2016, 56(15): 4−7. doi: 10.3969/j.issn.1002-266X.2016.15.002
[81] ZHU Y, CHENG J, MIN Z L, et al. Effects of fucoxanthin on autophagy and apoptosis in SGC-7901cells and the mechanism[J]. Journal of Cellular Biochemistry,2018,119(9):7274−7284. doi: 10.1002/jcb.27022
[82] SU J Q, GUO K, HUANG M, et al. Fucoxanthin, a marine xanthophyll isolated from Conticribra weissflogii ND-8:Preventive anti-inflammatory effect in a mouse model of sepsis[J]. Frontiers in Pharmacology,2019,10:906. doi: 10.3389/fphar.2019.00906
[83] WANG J, DONG X, LI D D, et al. Fucoxanthin inhibits gastric cancer lymphangiogenesis and metastasis by regulating Ran expression[J]. Phytomedicine,2023,118:154926. doi: 10.1016/j.phymed.2023.154926
[84] WANG W Y, FU C B, LIN M T, et al. Fucoxanthin prevents breast cancer metastasis by interrupting circulating tumor cells adhesion and transendothelial migration[J]. Frontiers in Pharmacology,2022,13:960375. doi: 10.3389/fphar.2022.960375
[85] CALABRONE L, CARLINI V, NOONAN D M, et al. Skeletonema marinoi extracts and associated carotenoid fucoxanthin downregulate pro-angiogenic mediators on prostate cancer and endothelial cells[J]. Cells,2023,12(7):1053. doi: 10.3390/cells12071053
[86] KOBAYASHI H, LIN P C. Angiogenesis links chronic inflammation with cancer[J]. Methods Mol Biol,2009,511:185−191.
[87] ZHU Q, ZHOU Y Q, WANG H X, et al. Fucoxanthin triggers ferroptosis in glioblastoma cells by stabilizing the transferrin receptor[J]. Medical Oncology (Northwood, London, England),2023,40(8):230. doi: 10.1007/s12032-023-02095-6
[88] LI Y, TAO L S, BAO L, et al. Fucoxanthin inhibits cell proliferation and stimulates apoptosis through downregulation of PI3K/AKT/mTOR signaling pathway in human ovarian cancer cells[J]. Pharmacognosy Magazine,2020,16(69):311−316.
[89] TAMURA S, NARITA T, FUJII G, et al. Inhibition of NF-kappaB transcriptional activity enhances fucoxanthinol-induced apoptosis in colorectal cancer cells[J]. Genes and Environment,2019,41:1. doi: 10.1186/s41021-018-0116-1
[90] 李国平, 常秀亭, 罗小菊, 等. 褐藻素通过线粒体通路和氧化应激诱导前列腺癌细胞凋亡[J]. 南方医科大学学报,2021,41(6):953−959. [LI G P, CHANG X T, LUO S J, et al. Fucoxanthin induces apoptosis in prostate cancer cells via mitochondrial pathway and oxidative stress[J]. Journal of Southern Medical University,2021,41(6):953−959.] doi: 10.12122/j.issn.1673-4254.2021.06.21 LI G P, CHANG X T, LUO S J, et al. Fucoxanthin induces apoptosis in prostate cancer cells via mitochondrial pathway and oxidative stress[J]. Journal of Southern Medical University, 2021, 41(6): 953−959. doi: 10.12122/j.issn.1673-4254.2021.06.21
[91] YE J, SHUANG Q, NA S, et al. Fucoxanthin and tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) synergistically promotes apoptosis of human cervical cancer cells by targeting PI3K/Akt/NF-κB signaling pathway[J]. Med Sci Monit,2018,24:11−18. doi: 10.12659/MSM.905360
[92] WANG L B, ZENG Y, LIU Y, et al. Fucoxanthin induces growth arrest and apoptosis in human bladder cancer T24 cells by up-regulation of P21 and down-regulation of mortalin[J]. Acta Biochimica et Biophysica Sinica,2014,46(10):877−884. doi: 10.1093/abbs/gmu080
[93] 栾贺琪. 岩藻黄素对肺腺癌细胞上皮间质转化的影响及其机制研究[D]. 大连:大连医科大学, 2019. [LUAN H Q. Effect of fucoxanthin on epithelial-mesenchymal transformation of lung adenocarcinoma cells and its mechanism[D]. Dalian:Dalian Medical University, 2019.] LUAN H Q. Effect of fucoxanthin on epithelial-mesenchymal transformation of lung adenocarcinoma cells and its mechanism[D]. Dalian: Dalian Medical University, 2019.
[94] FANG X H, ZHU Y Z, ZHANG T M, et al. Fucoxanthin inactivates the PI3K/Akt signaling pathway to mediate malignant biological behaviors of non-small cell lung cancer[J]. Nutrition and Cancer,2022,74(10):3747−3760. doi: 10.1080/01635581.2022.2091149





 下载:
下载:
 下载:
下载:



