Effect of Hydrolysis on Structure and Properties of Duck Myofibrillar Protein in Low-salt Condition
-
摘要: 为研究水解时间(0、20、40、60、80 min)对低盐溶液中鸭肉肌原纤维蛋白的结构和功能特性的影响,本文用胰蛋白酶水解鸭肉肌原纤维蛋白(Myofibrillar protein,MP),通过分析水解处理后的水解度、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)、溶解度、表面疏水性、二级结构、荧光光谱、Zeta电位和乳化性,对水解物的结构和功能特性进行评估。结果表明:在低盐溶液中,随着水解时间的延长,溶解度显著升高(P<0.05),表面疏水性先降低后升高,乳化性先升高后降低;当水解时间为40 min时,水解度为4.15%,鸭肉MP的溶解度和乳化性达到最高,分别达到60.57%和21.2 m2/g;表面疏水性最低(40.85 BPB/μg)。此外,蛋白结构变化显著,α-螺旋含量减少,内源性色氨酸荧光强度明显高于未水解组,且Zeta电位绝对值升高。综上所述,在低盐溶液中,水解40 min可以有效改善鸭肉MP的结构和功能特性。Abstract: To investigate the effects of hydrolysis time (0, 20, 40, 60, 80 min) on the structure and functional properties of duck myofibrillar protein in low-salt solution, the duck myofibrillar protein was hydrolyzed by trypsin, the structure and functional properties of hydrolysate was assessed by analyzing the degree of hydrolysis, sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), solubility, surface hydrophobicity, secondary structure, fluorescence spectrum, Zeta potential and emulsification after hydrolysis treatment. The results showed that in low-salt condition, with the prolongation of hydrolysis time, the solubility increased significantly (P<0.05), the surface hydrophobicity first decreased and then increased, while the emulsification first increased and then decreased. When the hydrolysis time was 40 min, the hydrolysis degree was 4.15%, the solubility and emulsification of duck MP were the highest, reaching 60.57% and 21.2 m2/g respectively, and the surface hydrophobicity was lowest (40.85 BPB/μg). In addition, the protein structure was changed significantly, the α-helix content decreased, the endogenous tryptophan fluorescence intensity was obviously higher than that in the unhydrolyzed group, and the absolute value of Zeta potential increased. In summary, in low-salt condition, hydrolysis for 40 min could effectively improve the structural and functional properties of duck MP.
-
鸭肉蛋白中富含人体必需的氨基酸和各种营养物质,完全符合人们对健康、营养的需求。我国鸭肉年产量巨大,但是对鸭肉的利用率非常低,利用方式仍停留在传统加工水平,如板鸭、烤鸭等,限制其在食品工业化生产中的应用。肉类中的蛋白质,根据其溶解特性可以分为三大类,即肌浆蛋白(sarcoplasmic protein)、肌原纤维蛋白(myofibrillar protein,MP)和基质蛋白(stromal protein)[1],其中,MP是肉制品形成良好的质构和品质的重要成分。但是,MP在低离子强度溶液中的溶解性极差,在离子强度大于0.3 mol/L盐溶液中的溶解度较好[2],然而,离子强度过高可能会导致盐摄入量超标,导致一系列的健康危害,例如心血管和高血压[3−4]等,限制MP在食品加工中的应用。因此,需要在符合健康安全的前提下,提高MP在低盐溶液中的溶解性,从而提高鸭肉在食品生产中的应用。
通常来说,MP的溶解度与其在溶液中的自组装行为有关[5]。在低盐介质中,MP分子通过静电相互作用,有规律地自组装成不溶性的丝状聚合物,导致其溶解性较差[6]。为抑制MP的这种自组装行为,许多方法包括物理(超声、高压均质、高静水压、研磨等)、化学(糖基化、酰基化、酸碱处理等)、酶处理和添加各种物质(多糖、多酚、氨基酸等)已被应用[7−8]。然而,超声虽然效果好,但对超声强度要求特别高,且在处理过程中会伴随热效应的产生[9];糖基化的工艺复杂,耗时长,还会导致赖氨酸/精氨酸的丢失[10]。因此,需要选择适当的方法来改善鸭肉MP在低盐溶液中的溶解度。水解处理通过切割蛋白质内部的肽键,将大分子蛋白分解成小分子的片段[11−12],同时暴露出更多的亲水性侧链基团,提高蛋白在溶液体系中的溶解度[8]。该处理方式效率高,条件温和,效果明显,且不会导致蛋白品质劣化。
目前关于水解处理MP主要应用于猪肉、牛肉和鸡肉中,水解处理对低盐鸭肉MP结构和功能特性的影响效果不明确。因此,本文以鸭肉MP为原料,探究水解技术对其结构和功能特性的影响,通过溶解度、表面疏水性和乳化性分析其性质变化,SDS-PAGE、二级结构、内源性色氨酸荧光和Zeta电位分析其结构变化,以期提高鸭肉MP在低盐溶液中的溶解度,为鸭肉在食品生产中的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
新鲜鸭肉 购买于浙江省宁波市北仑区春晓街道农贸市场;胰蛋白酶(牛胰)(2500 U/g) 上海源叶公司;三(羟甲基)氨基甲烷(Tris(hydroxymethyl)aminomethane,Tris)、乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(Ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、KCl、K2HPO4、KH2PO4、MgCl2、NaCl、TritonX-100、溴酚蓝(Bromophenol blue,BPB)、十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、邻苯二甲醛、四硼酸钠、甲醇、二硫苏糖醇、甘氨酸标品 麦克林公司;双缩脲试剂盒(BC3185) 索莱宝公司。
电子分析天平 北京赛多利斯仪器系统有限公司;SGJ-2A磁力搅拌恒温水浴锅 上海硕光电子科技有限公司;XHF-D高速分散器 宁波新芝生物科技股份有限公司;GL-20B飞鸽冷冻离心机 上海安亭科学仪器厂;Bio-Rad Mini-Protein电泳仪、XR+凝胶成像仪 美国Bio-Rad Laboratories公司;Zeta sizer Nano ZS90粒子分析仪 英国Malvern Instruments公司;J-1500圆二色光谱 日本JASCO公司;varioskan lux多功能酶标仪 赛默飞公司。
1.2 实验方法
1.2.1 鸭肉肌原纤维蛋白的提取
鸭肉肌原纤维蛋白的提取方法参考Li等[13]的方法,并进行适当修改。新鲜的鸭肉剔除筋膜,在绞肉机中搅碎,加入4倍体积的缓冲溶液(0.1 mol/L Tris、10 mmol/L EDTA,pH8.3),匀浆60 s(10000 r/min,30 s/次,每次间隔5 s),结束后将样品离心(10000×g,20 min,4 ℃),收集沉淀。接着,将沉淀分别与以下四种溶液按照(A,B,A,C,D)的顺序混合,均质(10000 r/min,30 s)并离心(10000×g,4 ℃,10 min),重复3次(A:20 mmol/L K2HPO4/KH2PO4、1 mmol/L EGTA、2 mmol/L MgCl2、0.1 mol/L KCl,pH7.0;B:A含有1% Triton X-100;C:0.1 mol/L KCl;D:0.1 mol/L NaCl)。最后将沉淀与4倍体积的纯水混合均质,通过三层纱布过滤,然后离心(10000×g,4 ℃,10 min),所得沉淀即为鸭肉肌原纤维蛋白。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)溶解所得沉淀,并用双缩脲试剂盒和酶标仪测定蛋白浓度。
1.2.2 胰蛋白酶水解处理
根据Nawaz等[14]的方法进行水解处理,并稍加修改。首先,用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)稀释蛋白,磁力搅拌2 h使其分布均匀,将浓度调节到25 mg/mL,调节pH7.0,按照酶:蛋白=1:100(w/w)的比例加入胰蛋白酶,搅拌均匀,于37 ℃的恒温磁力搅拌水浴锅中反应0,20,40,60和80 min,结束后取出于4 ℃冰浴冷却灭酶,备用。
1.2.3 水解度的测定
采用邻苯二甲醛(Ortho-phthalaldehyde,OPA)进行测定,参考Church等[15]的方法,并略作修改。在96孔板中加入200 μL OPA试剂(97.5 mL 100 mmol/L的四硼酸钠(pH9.9),0.5 mL 20%的SDS,1 mL 5 mg/mL溶解于甲醇的邻苯二甲醛,1 mL 5 mg/mL溶解在水中的二硫苏糖醇)和5 μL的样品(甘氨酸标品),在密封状态下,25 ℃震荡5 min,然后在37 ℃下恒温反应20 min。在激发波长340 nm,发射波长450 nm条件下,用酶标仪测量其荧光值,并根据式(1)计算其水解度。
水解度(%)=Cs×DF1×DF2×100m×Htot (1) 式中,Cs代表样品的荧光值,根据线性回归方程计算而得出的浓度(mmol/L);DF1描述样品在OPA之前的稀释系数1;DF2描述样品在OPA时的稀释系数2;m是每升蛋白质的质量(g);Htot是蛋白质底物总肽键(视为7.8 mmol/g)。
1.2.4 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考林伟伟[16]的方法,电泳条件如下:分离胶体积分数为12%,浓缩胶体积分数为5%,上样体积为5 μL,上样浓度为5 mg/mL,浓缩胶电压为80 V,分离胶电压为120 V。进行凝胶电泳,待指示剂达到底部边缘时停止电泳。然后用考马斯亮蓝染色30 min并脱色,待底色脱尽,用凝胶成像系统扫描,并对图像进行分析。
1.2.5 溶解度的测定
参考李少博[1]的方法,并略作修改。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)将蛋白浓度调节为10 mg/mL。取1 mL待测蛋白溶液于2 mL离心管内,离心(10000×g,4 ℃,15 min)。离心完成后,取上清液测定蛋白浓度。溶解度用样品离心后的上清液蛋白浓度和离心前蛋白总浓度的比值来表示,计算如式(2):
溶解度(%)=离心后上清液蛋白浓度离心前蛋白总浓度×100 (2) 1.2.6 表面疏水性的测定
参考Li等[13]的方法测定表面疏水性,并稍做修改。取1 mL MP溶液(5 mg/mL),加入0.2 mL溴酚蓝溶液(BPB,1 mg/mL),混匀。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)作为空白对照组。所有样品在25 ℃振荡10 min后离心(6000×g,15 min,4 ℃)。取上清,稀释10倍,并于595 nm处测定吸光值。表面疏水性的计算如式(3):
BPB(μg)=200×(Ac−As)Ac (3) 式中,Ac为对照吸光度;As为样品吸光度。
1.2.7 二级结构的测定
根据陈故等[17]的方法测量MP的二级结构,并略作修改。用纯水将MP样品稀释到0.5 mg/mL,取300 μL样品置于0.1 cm的石英皿中,用圆二色光谱仪进行测量。仪器参数设置如下:扫描波长范围为200~250 nm,波长宽度为1 nm,扫描速度为200 nm/min,扫描次数为3次。使用仪器自带软件对蛋白质二级结构含量进行分析。
1.2.8 内源性色氨酸荧光的测定
内源荧光光谱的测量参考Jia等[18]的方法,并稍加修改。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)将蛋白稀释到0.5 mg/mL,用荧光分光光度计记录300~450 nm处的荧光光谱。激发波长为290 nm,扫描速度为300 nm/min。用0.02 mol/L K2HPO4/KH2PO4的磷酸缓冲液(含0.1 mol/L NaCl)作为空白对照。
1.2.9 Zeta电位的测定
Zeta电位的测定参考陈姑等[17]的方法,并稍做修改。用纯水将蛋白稀释到0.5 mg/mL,以马尔文激光粒度分析仪的SOP模式测定MP溶液的Zeta电位。
1.2.10 乳液的制备
将10 mg/mL鸭肉MP溶液与大豆油按8:2(v/v)的比例混合,然后于冰浴下使用高速分散器以12000 r/min的速度均质2 min(每次30 s,共4次),即得到乳液。将制备的乳液贮存于4 ℃条件备用。
1.2.11 乳化活性、乳化稳定性和乳析指数的测定
乳化活性(emulsion activity index,EAI)和乳化稳定性(emulsion stability index,ESI)的测定参考Zhou等[19]的方法,并略作修改。待制备的乳液放置0和10 min后,移取50 μL底部样品,并用十二烷基磺酸钠(SDS,0.1% w/v)稀释100倍,测定样品在500 nm处的吸光度,分别记为A0和A10。EAI和ESI分别由式(4)和(5)计算:
EAI(m2/g)=2×2.303×N×A0C×φ×L×10000 (4) ESI(\%)=A10A0×100 (5) 式中,N为稀释倍数;C为初始蛋白质浓度;φ为油相比例,0.2;L为光程长度,1 cm。
乳析指数(creaming index,CI)的测定参考Zhou等[19]的方法。将制备的乳液移入30 mL的玻璃瓶中,每隔24 h测定乳液的总高度和底层清相的高度,分别记作H0和Ht,CI根据式(6)计算:
CI(%)=HtH0×100 (6) 1.3 数据处理
本试验数据用平均值±标准偏差表示。用IBM SPSS Statistics v.26.0软件进行统计分析,采用Duncan多重比较进行差异显著性分析,不同处理组之间显著性差异水平设置为P<0.05。数据结果用Origin Pro 2023绘图。每组实验做三次,每次做三次重复。
2. 结果与分析
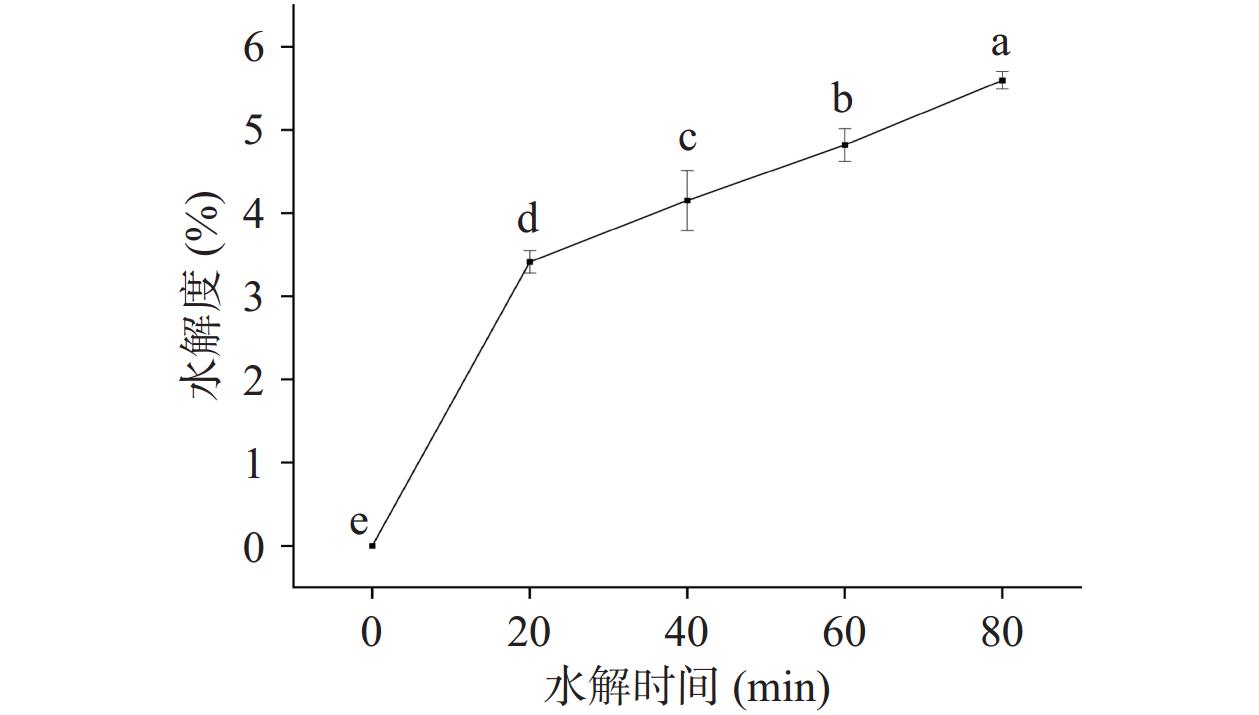
2.1 水解时间对低盐鸭肉MP水解度的影响
水解度反映蛋白质的水解程度,其大小影响蛋白质水解过程中的功能性质。OPA试剂可以与肽键切割释放出来的游离氨基(α-NH2)结合[20],被用来测定蛋白水解程度。如图1所示,水解度随着水解时间的延长不断升高,胰蛋白酶在水解过程中切割肽键,从而导致鸭肉MP的重组和游离氨基的暴露。同时,肽链结构的断裂,可能引起蛋白质空间结构的变化以及肽段侧链基团的暴露,会使蛋白的性质发生变化,如蛋白质的溶解度、乳化性等[21]。如图1所示,随着水解时间的延长,水解度显著提高(P<0.05),但整体水解度较低,最高为5.60%。有研究表明蛋白质在水解度达5%以下,其乳化性、持油性达到最大,之后随着水解时间的延长,逐渐变小[11]。
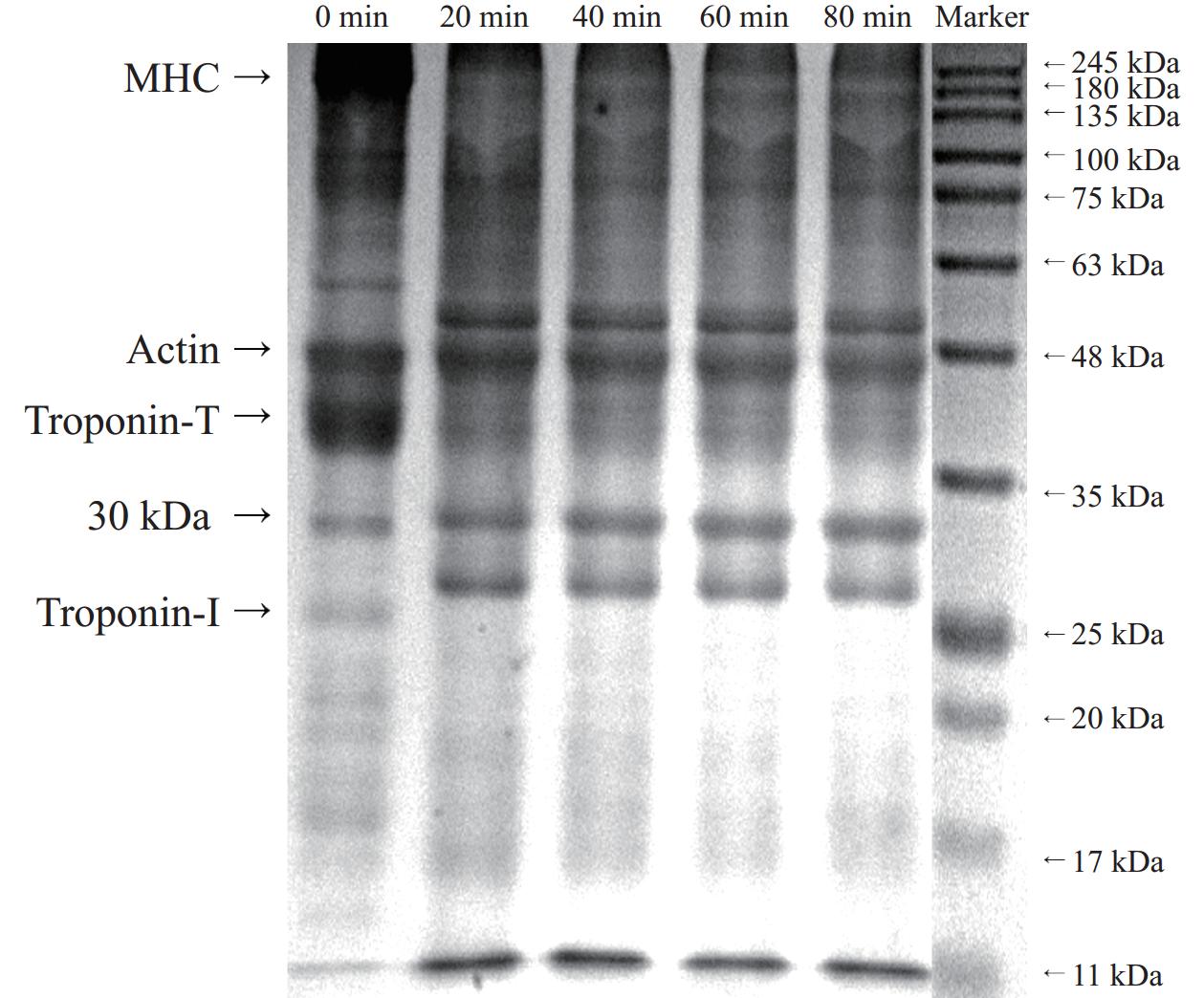
2.2 水解时间对蛋白质分子量分布的影响
通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析水解时间对蛋白质分子量分布的影响,结果如图2所示。未进行水解处理的鸭肉MP,具有明显的特征条带,如肌球蛋白重链(约220 kDa),肌动蛋白(Actin,约43 kDa),以及肌钙蛋白T(Troponin T,约40 kDa)[22];但是,不同水解时间后的SDS-PAGE相对于空白处理组而言,部分特征条带发生明显变化,首先是肌球蛋白重链含量明显减少,被分解成小分子肽段,主要在48~63 kDa附近;肌动蛋白含量没有明显变化,这是因为水解主要降解肌球蛋白重链,而不会导致肌动蛋白的降解[23−24]。但是肌钙蛋白T在水解后条带颜色变浅,且在25~35 KDa间出现两条明显的条带;此外,肌钙蛋白I在水解后几乎没有明显条带出现,而在约11 KDa处观察到明显的条带。但水解组内随着水解程度的增高,蛋白条带变化不大,这可能与水解度较低有关,水解20、40、60、80 min时的水解度分别为3.41%、4.15%、4.82%和5.60%,虽然水解度变化显著(P<0.05),但是整体水解度较小,这就导致在SDS-PAGE结果中难以观察到明显的条带变化。总的来说,水解后鸭肉MP发生部分降解,产生更多的小分子肽段。
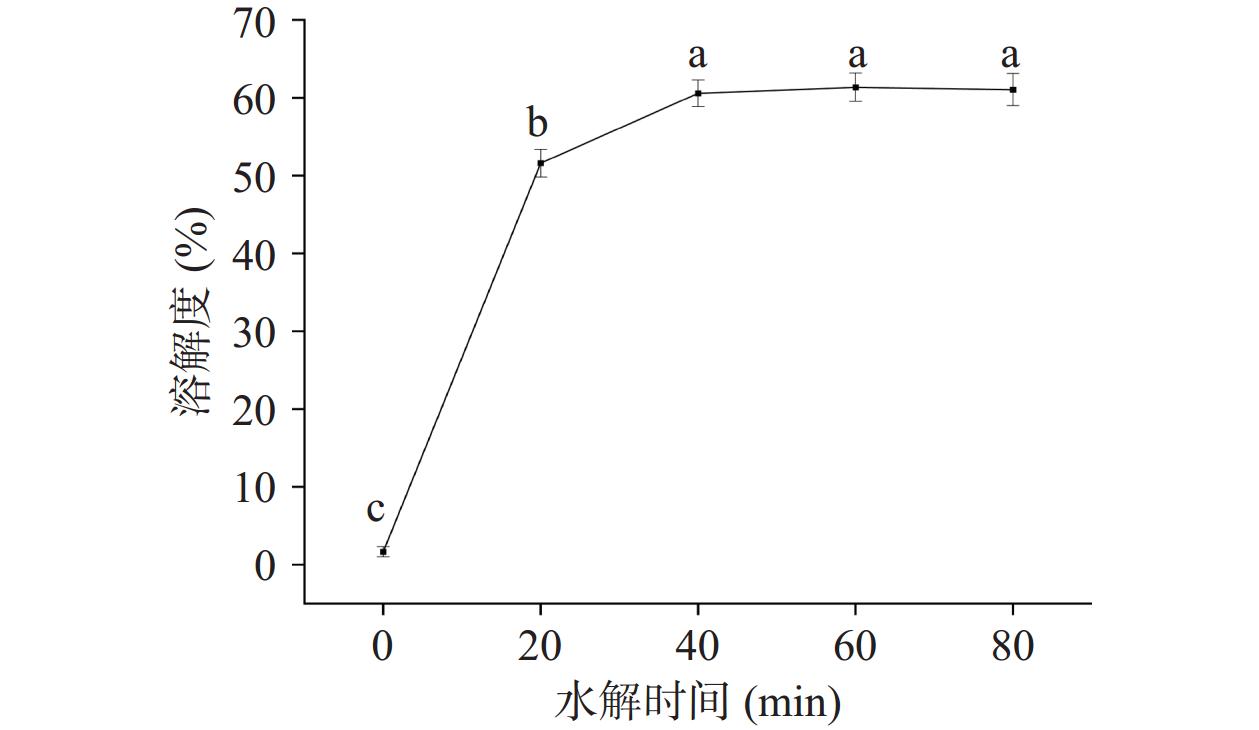
2.3 水解时间对低盐鸭肉MP溶解度的影响
如图3所示,MP的溶解度随着水解的进行,呈现出先升高后趋于平缓的现象。在40 min时,鸭肉MP在低盐溶液中的溶解度达到60.57%,显著高于空白组(1.67%)(P<0.05);但在40 min之后鸭肉MP的溶解度无显著变化。在0~40 min内,胰蛋白酶切割肽链,蛋白质被分解成小分子短肽,暴露出亲水区域,促进蛋白质-水相互作用[25],提高溶解度。此外,由于肽链解离,蛋白分子间的静电斥力增强,从而提高蛋白水解产物的溶解度[26]。但是在40 min之后无显著变化,说明就溶解度而言,水解处理40 min即可。
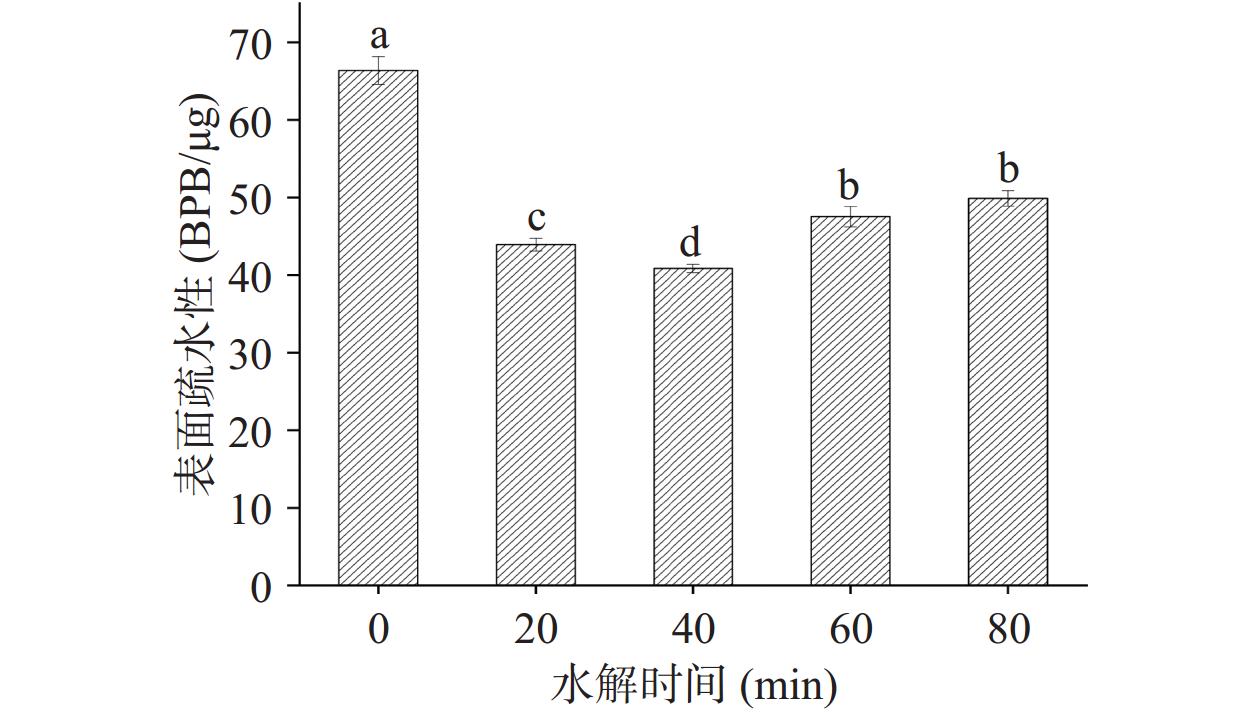
2.4 水解时间对低盐鸭肉MP表面疏水性的影响
水解时间对MP表面疏水性的影响如图4所示。水解后的MP的表面疏水性显著(P<0.05)降低,且随着水解时间的延长,表面疏水性先降低后升高。鸭肉MP由于在低盐溶液中的溶解度极低,会引发蛋白聚集/团聚形成大分子聚集物,导致蛋白质空间结构发生变化,使得亲水侧链被埋藏在内部,而大量疏水侧链基团暴露在表面,因此未进行水解处理时其表面疏水性较大(66.36 BPB/μg)。而水解后蛋白质结构被打开,肽链解离,埋藏在内部的亲水基团暴露,溶解度显著(P<0.05)升高,同时表面疏水性降低,在40 min时表面疏水性最低(40.85 BPB/μg)。在40 min之后表面疏水性升高,这可能和蛋白的结构展开有关[27],导致隐藏在蛋白结构内部的疏水性残基暴露在表面。总的来说,在低盐条件下,水解40 min时鸭肉MP的表面疏水性最低。
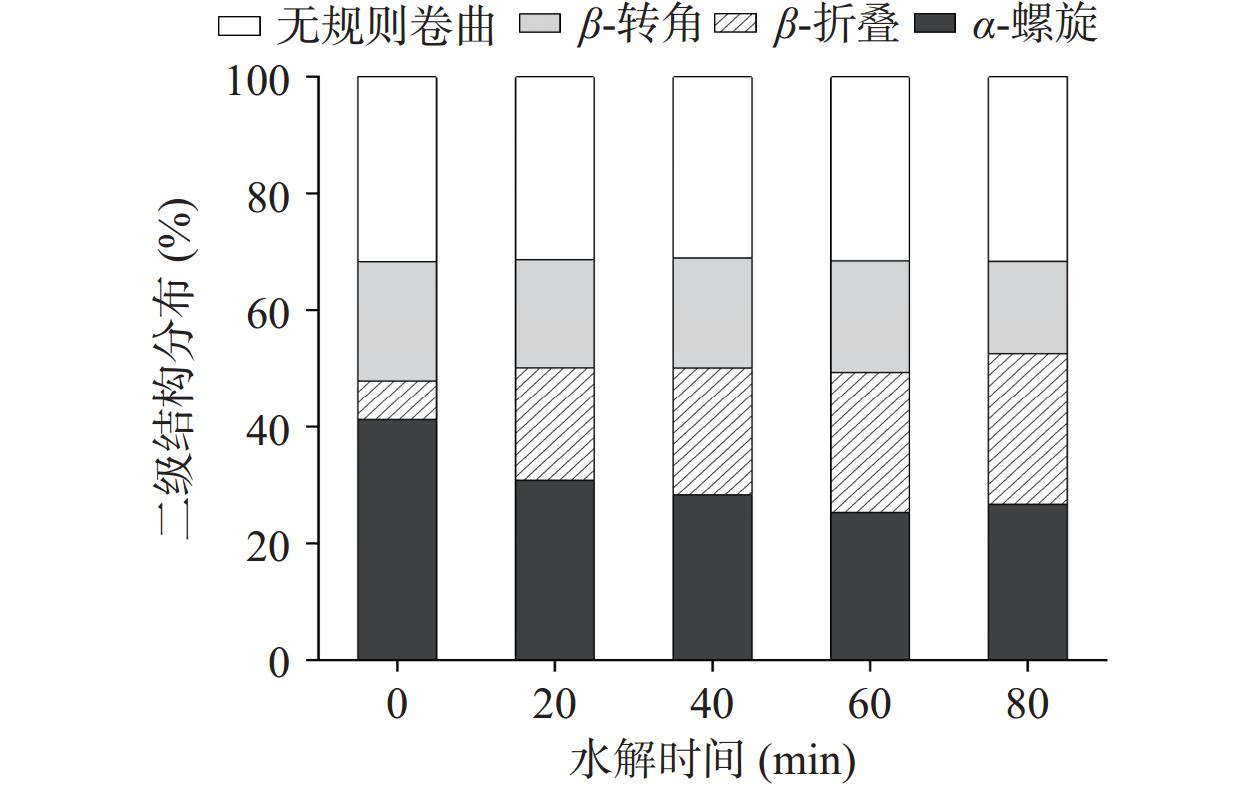
2.5 水解时间对低盐鸭肉MP二级结构分布的影响
利用圆二色谱分析水解时间对MP二级结构的影响。从图5中可以看出,与未水解的MP相比,二级结构含量发生明显变化。其中,水解后β-折叠的含量从6.7%增加到25.9%,而α-螺旋和β-转角的含量分别从41.2%和20.4%下降到26.7%和15.8%,说明水解处理影响蛋白的二级结构的分布。α-螺旋和β-折叠都是有序的蛋白质二级结构,β-折叠比α-螺旋更稳定[28]。α-螺旋是由肽链的羰基氧(C=O)和氨基氢(−NH2)通过分子内氢键维持,而β-折叠的稳定性取决于蛋白质分子肽链之间的氢键[29]。因此,鸭肉MP水解后α-螺旋含量降低,这表明酶水解破坏蛋白质内部的肽链结构,蛋白质的展开,导致肽链上的分子内氢键也被破坏;同时,暴露出更多的氢键结合位点,促进分子间氢键的形成,促进α-螺旋解聚并向β-折叠转化;而β-折叠的增加意味着蛋白质之间相互作用的增强。Bai等[30]研究表明,β-折叠对于MP的聚集至关重要,其稳定结构可以提高蛋白凝胶特性。因此,水解处理后鸭肉MP的二级结构改变,α-螺旋含量降低而β-折叠含量升高,分子间氢键的形成能够提高鸭肉MP在低盐溶液中的溶解度。
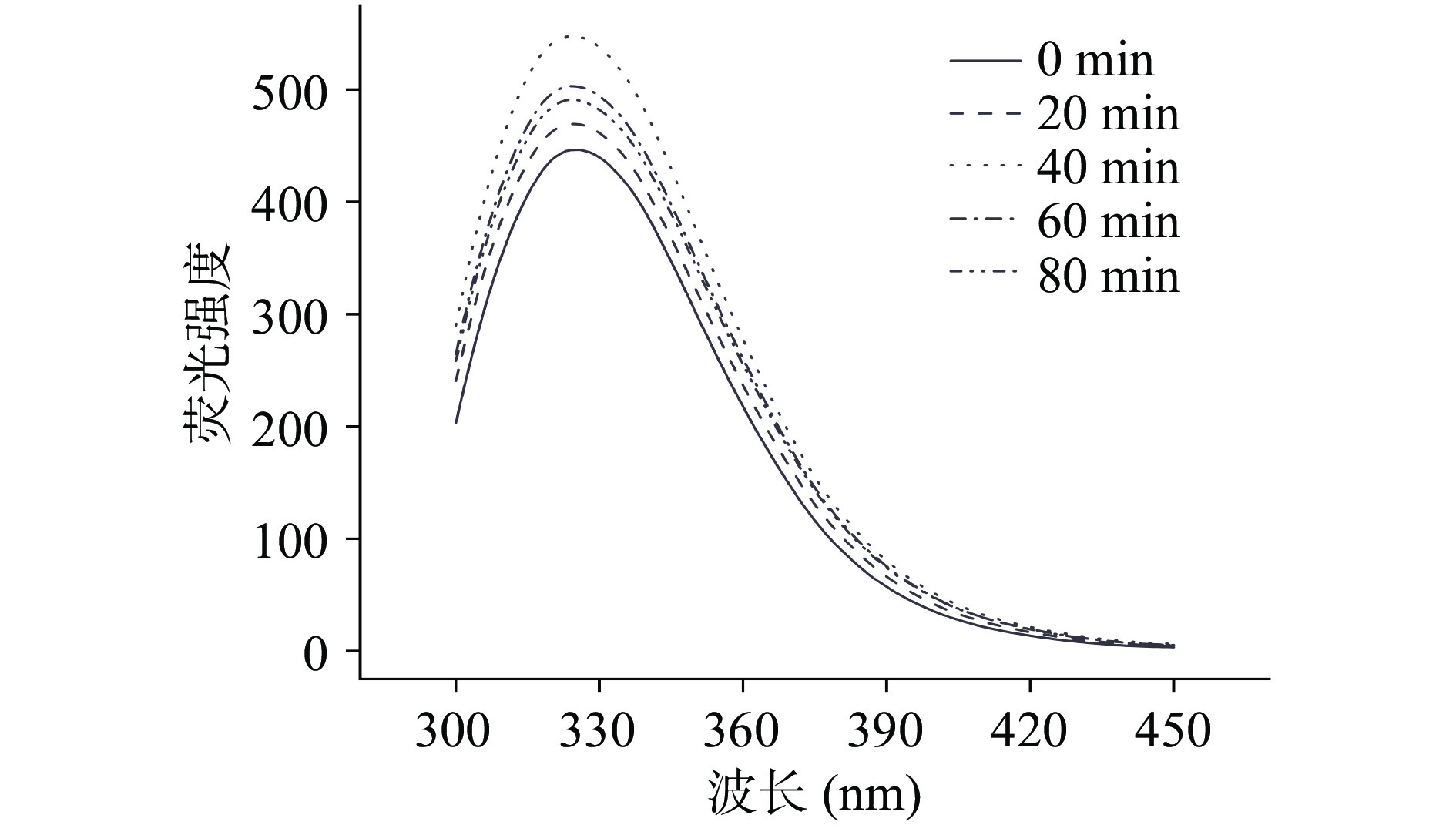
2.6 水解时间对低盐鸭肉MP内源性色氨酸荧光的影响
样品的内源性色氨酸荧光强度会受到色氨酸在蛋白质内部的位置的影响,因此可以通过测定样品的内源性色氨酸荧光强度来反映蛋白的三级结构的变化。埋藏在蛋白质内部位点的色氨酸残基具有较高的荧光强度,而当其暴露在溶剂中时,由于荧光的淬灭会导致荧光强度的降低[31]。即色氨酸残基埋藏在蛋白质内部,样品中荧光强度越强,反之亦然[32]。色氨酸在蛋白中有三种存在形式:第一种是色氨酸在蛋白质核心的封闭结构内,密闭的结构引发静态屏蔽,导致此时的色氨酸荧光无法被检测到(静态淬灭)[33];第二种它在蛋白质核心区域,但是这个结构不封闭,通过正常的手段可以检测到;第三种色氨酸暴露到溶剂中,此时会发生正常的荧光淬灭,导致荧光强度降低。
如图6所示,水解后的荧光强度增加,说明水解诱导蛋白质MP三级结构发生变化;而在0~40 min的过程中,荧光强度不断升高,在40~80 min时荧光强度又有所降低,结合图3和图4分析,可能有如下原因:首先,在初始状态(0 min),鸭肉MP在低盐溶液中溶解度极低,主要表现出疏水性,在溶液中由于疏水相互作用聚集,形成不溶性聚合物,而此时在蛋白质内部的核心区域,色氨酸主要以第一种形式存在,由于静态屏蔽的存在而不能被完全检测到[34];而在0~40 min,由于酶水解的作用,鸭肉MP的肽链被切割,蛋白质内部封闭的核心区域结构展开[35],静态屏蔽被解除,能够被检测到的色氨酸荧光增强;而在40~80 min,随着水解的继续,大分子蛋白质被分解成小分子肽段,蛋白结构可能过度展开,部分核心区域暴露到溶液环境中,发生荧光淬灭,导致荧光强度降低。同时,由于色氨酸是疏水性氨基酸,当其暴露到表面,虽然荧光发生淬灭,仍可表现出疏水性。因此,在低盐条件下,水解40 min时的蛋白三级结构的展开程度最为适宜,再继续水解则有可能导致空间结构被破坏。
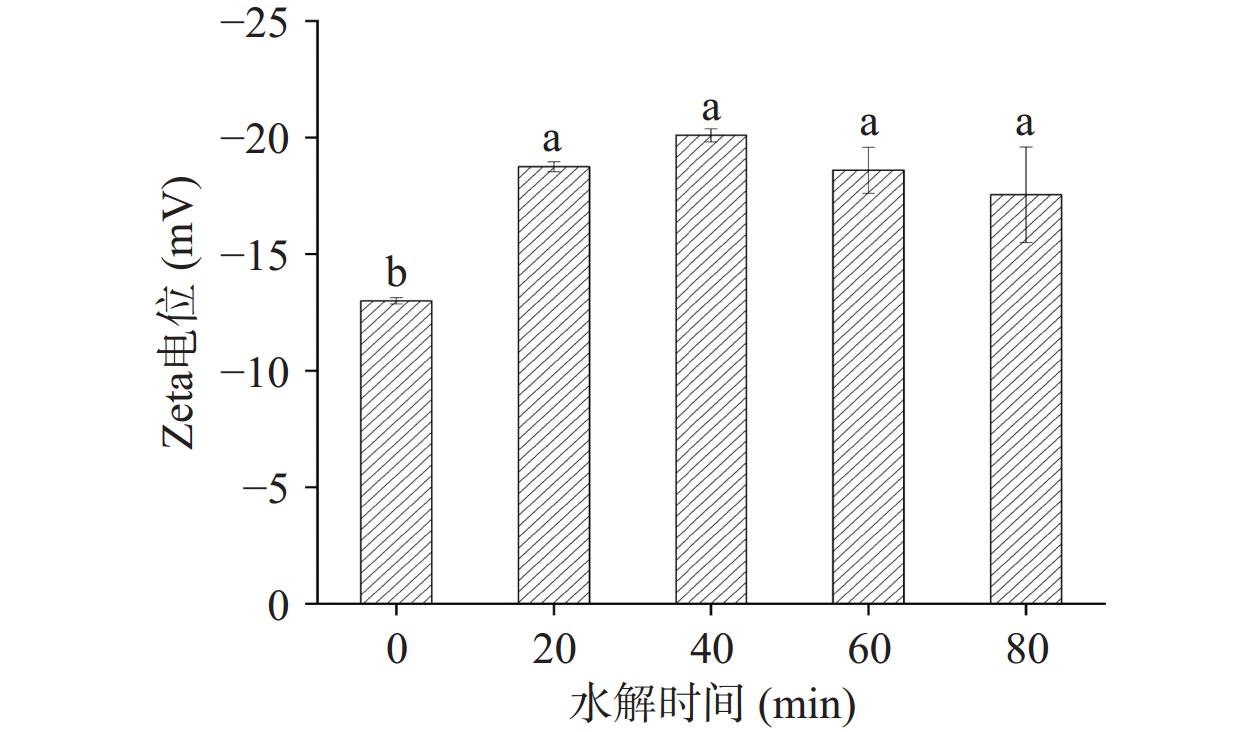
2.7 水解时间对低盐鸭肉MP Zeta电位的影响
Zeta电位能够反映带电生物聚合物之间的静电相互作用[36]。Zeta电位绝对值减小,蛋白分子表面的同种电荷数量减少,蛋白分子之间的电荷斥力减弱,蛋白质容易聚集并形成不稳定的聚合物;反之,Zeta电位绝对值增加,蛋白质分子表面同种电荷之间通过静电排斥作用,使其均匀分散在溶液中,表现出更稳定的状态[37]。如图7所示,水解后鸭肉MP的Zeta电位绝对值显著增加,虽然水解后各组之间的Zeta电位绝对值无显著差异,但40 min时明显略高于其他处理时间,这可能是因为在0~40 min胰蛋白酶水解肽链,使得蛋白分子中的肽键断裂,暴露出更多的COO-基团,MP表面负电荷数量增加,分子相互间的排斥力增强,能够更稳定的均匀分散在低盐溶液中;而COO-基团在增加蛋白质表面负电荷的同时,还具有良好的亲水性,能够提高MP在低盐水溶液体系中的溶解度(图3)。然而,蛋白分子表面的电荷与其聚集/分散状态有关[38],在40 min之后略有降低,而图6表明水解40 min后的结构过度展开,可能导致部分聚集,从而使Zeta电位绝对值略有降低。总的来说,水解40 min后的Zeta电位绝对值最高。
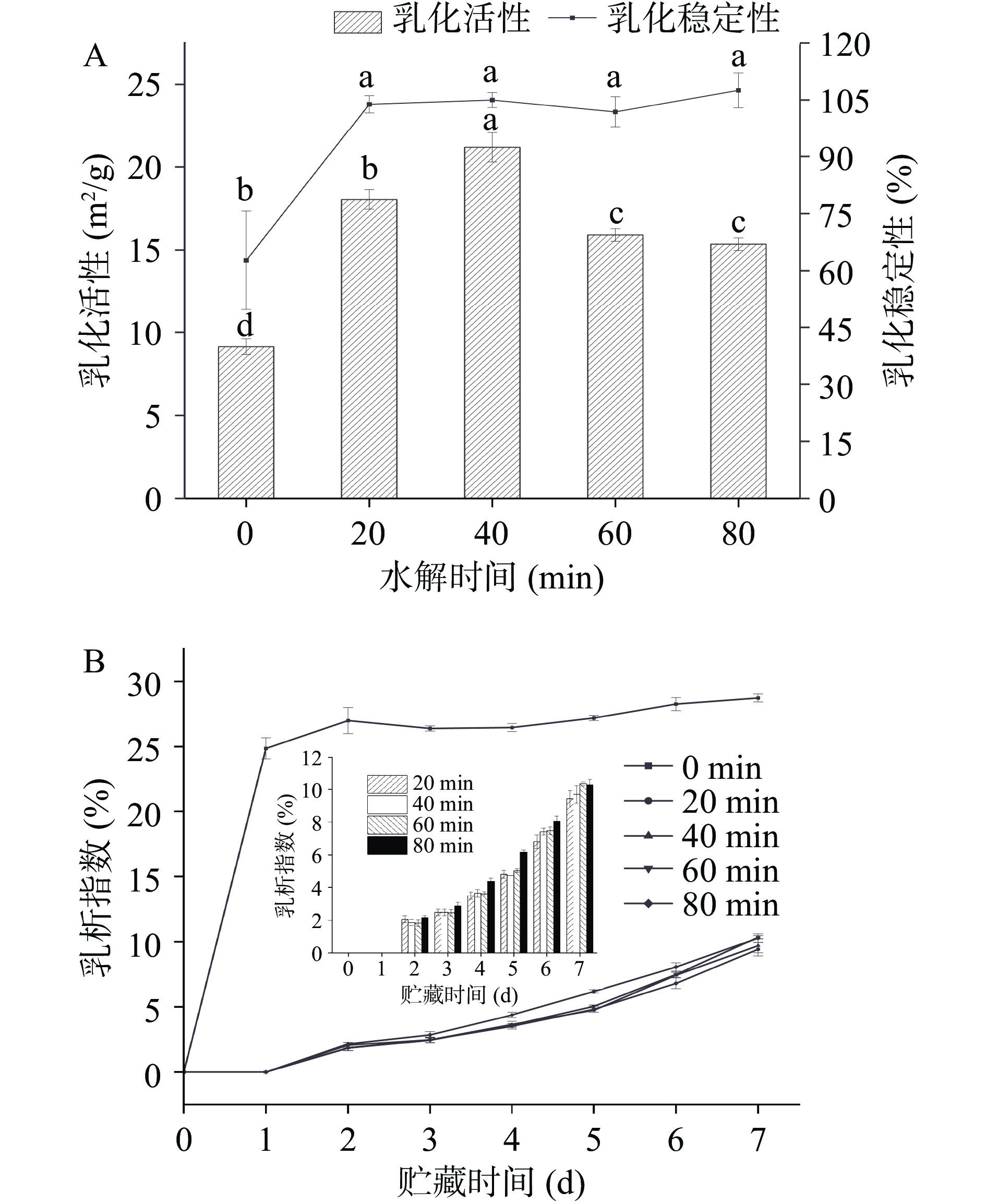
2.8 乳化活性、乳化稳定性和乳析指数
乳化过程主要是蛋白油滴表面的吸附行为[39]。乳化活性(emulsion activity index,EAI)、乳化稳定性(emulsion stability index,ESI)和乳析指数(creaming index,CI)可以评估蛋白与油相结合的能力。
如图8A所示,在低盐溶液中,水解后鸭肉MP的EAI和ESI显著提高;其中EAI随着水解时间的增加呈现出先升高后降低的趋势,在40 min时达到最高值(21.2 m2/g);结合图3分析,溶解度的提高能够使鸭肉MP更好的溶解在低盐溶液中,并提高其在溶液环境中的迁移速率[40−41],使其能够更快地迁移到油水界面上,提高其乳化活性。此外,水解使鸭肉MP的分子量分布和结构明显变化(如图2,图5和图6),大分子蛋白质解聚,肽键断裂并释放出更多的肽链,增强分子的灵活性和柔韧性[42],提高其在油水界面的吸附能力;然而,水解40 min之后EAI开始降低,可能是因为与大分子蛋白质相比,分子量合适的肽段具有更好的乳化性[43];而随着水解时间的延长,具有合适分子量的小肽段被分解,过小的分子量导致其乳化能力降低。因此,水解处理能够有效提高鸭肉MP在低盐溶液中的EAI,在本实验中水解40 min时的效果最好。
此外,图8A中的ESI表明,水解后的鸭肉MP乳液稳定性显著提高,这可能是因为在低盐条件下,水解后的鸭肉MP具有更好的溶解度和更高的Zeta电位绝对值,溶液体系更稳定,不易出现乳析的现象[44]。图8B是乳液贮藏0~7天内CI的变化,水解后乳液在贮藏期间的稳定性显著优于未水解组。总的来说,水解处理后低盐溶液中的鸭肉MP乳化性得到改善,在40 min时效果最好。
3. 结论
在低盐条件下,水解处理后鸭肉MP的分子量分布发生明显变化;溶解度和乳化性得到改善,均在40 min时达到最高(分别为60.57%和21.2 m2/g),此时的水解度为4.15%;表明水解有助于改善鸭肉MP在低盐溶液中的功能特性。此外,水解后α-螺旋含量降低,在40 min时内源性色氨酸荧光强度最高,Zeta电位绝对值从13.0 mV升高到20.1 mV,表明水解后鸭肉MP构象发生显著变化,结构展开,且在40 min时的结构稳定性最好。本实验初步研究水解对低盐鸭肉MP结构和功能特性的影响,为鸭肉在食品生产中的应用提供理论基础。但未将水解产物应用到实际食品生产中,水解产物对食品品质的影响还需进一步深入研究。
-
-
[1] 李少博. 兔肉蛋白质组成及其低盐溶糖基化肌原纤维蛋白理化特性研究[D]. 重庆:西南大学, 2020. [LI S B. Protein profile of rabbit meat and physicochemical properties of rabbit glycated myofibrillar protein with high solubility in low ionic strength medium[D]. Chongqing:Southwest University, 2020. LI S B. Protein profile of rabbit meat and physicochemical properties of rabbit glycated myofibrillar protein with high solubility in low ionic strength medium[D]. Chongqing: Southwest University, 2020.
[2] VILAR E G, OUYANG H, O'SULLIVAN M G, et al. Effect of salt reduction and inclusion of 1% edible seaweeds on the chemical, sensory and volatile component profile of reformulated frankfurters[J]. Meat Science,2020,161:108001. doi: 10.1016/j.meatsci.2019.108001
[3] CITTERIO L, DELLI CARPINI S, LUPOLI S, et al. Klotho gene in human salt-sensitive hypertension[J]. Clinical Journal of the American Society of Nephrology,2020,15(3):375−383. doi: 10.2215/CJN.08620719
[4] ZHU N, ZANG M, WANG S, et al. Modulating the structure of lamb myofibrillar protein gel influenced by psyllium husk powder at different NaCl concentrations:Effect of intermolecular interactions[J]. Food Chemistry,2022,397:133852. doi: 10.1016/j.foodchem.2022.133852
[5] CHEN X, TUME R K, XU X, et al. Solubilization of myofibrillar proteins in water or low ionic strength media:Classical techniques, basic principles, and novel functionalities[J]. Critical Reviews in Food Science and Nutrition,2017,57(15):3260−3280. doi: 10.1080/10408398.2015.1110111
[6] LIU H, ZHANG H, LIU Q, et al. Solubilization and stable dispersion of myofibrillar proteins in water through the destruction and inhibition of the assembly of filaments using high-intensity ultrasound[J]. Ultrasonic Sonochemistry,2020,67:105160. doi: 10.1016/j.ultsonch.2020.105160
[7] 薛山, 罗娟. 多糖添加对兔肌原纤维蛋白Pickering乳液稳定性及凝胶特性的影响[J/OL]. 食品工业科技:1−21[2023-04-16]. https://doi.org/10.13386/j.issn1002-0306.2022110340. [XUE S, LUO J. Effect of polysaccharide addition on the stability of rabbit myofibrillar Pickering emulsion as well as the characterization of its Pickering emulsion gel[J/OL]. Science and Technology of Food Industry:1−21[2023-04-16]. https://doi.org/10.13386/j.issn1002-0306.2022110340. XUE S, LUO J. Effect of polysaccharide addition on the stability of rabbit myofibrillar Pickering emulsion as well as the characterization of its Pickering emulsion gel[J/OL]. Science and Technology of Food Industry: 1−21[2023-04-16]. https://doi.org/10.13386/j.issn1002-0306.2022110340.
[8] WANG K, LI Y, ZHANG Y, et al. Improving myofibrillar proteins solubility and thermostability in low-ionic strength solution:A review[J]. Meat Science,2022,189:108822. doi: 10.1016/j.meatsci.2022.108822
[9] WANG Y, ZHAO J, ZHANG S, et al. Structural and rheological properties of mung bean protein emulsion as a liquid egg substitute:The effect of pH shifting and calcium[J]. Food Hydrocolloids,2022,126:107485. doi: 10.1016/j.foodhyd.2022.107485
[10] CANDRANINGRUM R G S, SETIOWATI A D, HIDAYAT C. Electrostatic-Maillard formation of coconut protein concentrate-pectin conjugate for oil-in-water emulsion:Effects of ratio, temperature, and pH[J]. Journal of the Saudi Society of Agricultural Sciences,2023,22(1):18−24. doi: 10.1016/j.jssas.2022.05.004
[11] 周欢. 水解改性技术在鲢鱼肌原纤维蛋白改性中的应用研究[D]. 杭州:浙江工业大学, 2016. [ZHOU H. Functional modification of silver carp myofibril protein by enzymatic hydrolysis and membrance separation[D]. Hangzhou:Zhejiang University of Technology, 2016. ZHOU H. Functional modification of silver carp myofibril protein by enzymatic hydrolysis and membrance separation[D]. Hangzhou: Zhejiang University of Technology, 2016.
[12] 丛海花, 常珂欣, 朱嘉雯, 等. 水解褐藻寡糖对扇贝肌原纤维蛋白体外消化特性的影响[J]. 肉类研究,2022,36(12):7−14. [CONG H H, CHANG K X, ZHU J W, et al. Effects of enzymatic hydrolysate of alginate oligosaccharides on in vitro digestion characteristics of scallop myofibrillar protein[J]. Meat Research,2022,36(12):7−14. CONG H H, CHANG K X, ZHU J W, et al . Effects of enzymatic hydrolysate of alginate oligosaccharides on in vitro digestion characteristics of scallop myofibrillar protein[J]. Meat Research,2022 ,36 (12 ):7 −14 .[13] LI M, HE S, SUN Y, et al. Effectiveness of l-arginine/l-lysine in retarding deterioration of structural and gelling properties of duck meat myofibrillar protein during freeze-thaw cycles[J]. Food Bioscience,2023,51:102302. doi: 10.1016/j.fbio.2022.102302
[14] NAWAZ M A, BUCKOW R, JEGASOTHY H, et al. Enzymatic hydrolysis improves the stability of UHT treated faba bean protein emulsions[J]. Food and Bioproducts Processing,2022,132:200−210. doi: 10.1016/j.fbp.2022.01.008
[15] CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins1[J]. Journal of Dairy Science,1983,66(6):1219−1227. doi: 10.3168/jds.S0022-0302(83)81926-2
[16] 林伟伟. pH和盐浓度对秘鲁鱿鱼肌原纤维蛋白聚集过程的影响[D]. 杭州:浙江工商大学, 2015. [LIN W W. Effects of pH and salt concentration on myofibrillar protein (dosidicus gigas) aggregation process[D]. Hangzhou:Zhejiang Gongshang University, 2015. LIN W W. Effects of pH and salt concentration on myofibrillar protein (dosidicus gigas) aggregation process[D]. Hangzhou: Zhejiang Gongshang University, 2015.
[17] 陈姑, 姜竹茂, 位正鹏, 等. 低温等离子体处理加速罗非鱼肌原纤维蛋白的氧化及结构改变[J]. 食品工业科技,2023,44(4):88−95. [CHEN G, JIANG Z M, WEI Z P, et al. Cold plasma treatment accelerated the oxidation and structural changes of myofibrillar in tilapia[J]. Science and Technology of Food Industry,2023,44(4):88−95. CHEN G, JIANG Z M, WEI Z P, et al . Cold plasma treatment accelerated the oxidation and structural changes of myofibrillar in tilapia[J]. Science and Technology of Food Industry,2023 ,44 (4 ):88 −95 .[18] JIA N, ZHANG F, LIU Q, et al. The beneficial effects of rutin on myofibrillar protein gel properties and related changes in protein conformation[J]. Food Chemistry,2019,301:125206. doi: 10.1016/j.foodchem.2019.125206
[19] ZHOU L, FENG X, YANG Y, et al. Effects of high-speed shear homogenization on the emulsifying and structural properties of myofibrillar protein under low-fat conditions[J]. Journal of the Science of Food and Agriculture,2019,99(14):6500−6508. doi: 10.1002/jsfa.9929
[20] SHAHBAL N, JING X, BHANDARI B, et al. Effect of enzymatic hydrolysis on solubility and surface properties of pea, rice, hemp, and oat proteins:Implication on high protein concentrations[J]. Food Bioscience,2023,53:102515. doi: 10.1016/j.fbio.2023.102515
[21] WASSWA J, TANG J, GU X, et al. Influence of the extent of enzymatic hydrolysis on the functional properties of protein hydrolysate from grass carp ( Ctenopharyngodon idella) skin[J]. Food Chemistry,2007,104(4):1698−1704. doi: 10.1016/j.foodchem.2007.03.044
[22] 王海帆, 熊哲民, 王玉洁, 等. 氯化钠对猪肉肌原纤维蛋白构像及其与辣椒素相互作用的影响[J]. 食品安全质量检测学报,2023,14(5):101−107. [WANG H F, XIONG Z M, WANG Y J, et al. Effects of sodium chloride on the configuration of porcine myofibrillar protein and its interaction with capsaicin[J]. Journal of Food Safety and Quality,2023,14(5):101−107. WANG H F, XIONG Z M, WANG Y J, et al . Effects of sodium chloride on the configuration of porcine myofibrillar protein and its interaction with capsaicin[J]. Journal of Food Safety and Quality,2023 ,14 (5 ):101 −107 .[23] SONG C, SHI Y, MENG X, et al. Identification of a novel alkaline serine protease from gazami crab ( Portunus trituberculatus) hepatopancreas and its hydrolysis of myofibrillar protein[J]. International Journal of Biological Macromolecules,2020,155:403−410. doi: 10.1016/j.ijbiomac.2020.03.179
[24] CAO M J, OSATOMI K, HARA K, et al. Identification of a myofibril-bound serine proteinase (MBSP) in the skeletal muscle of lizard fish Saurida wanieso which specifically cleaves the arginine site[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,2000,125(2):255−264. doi: 10.1016/S0305-0491(99)00176-5
[25] MOKNI GHRIBI A, MAKLOUF GAFSI I, SILA A, et al. Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J]. Food Chemistry,2015,187:322−330. doi: 10.1016/j.foodchem.2015.04.109
[26] SCHWENKE K D. Reflections about the functional potential of legume proteins. A review[J]. Nahrung,2001,45(6):377−381. doi: 10.1002/1521-3803(20011001)45:6<377::AID-FOOD377>3.0.CO;2-G
[27] AVRAMENKO N A, LOW N H, NICKERSON M T. The effects of limited enzymatic hydrolysis on the physicochemical and emulsifying properties of a lentil protein isolate[J]. Food Research International,2013,51(1):162−169. doi: 10.1016/j.foodres.2012.11.020
[28] BAO P, CHEN L, HU Y, et al. l-Arginine and l-lysine retard aggregation and polar residue modifications of myofibrillar proteins:Their roles in solubility of myofibrillar proteins in frozen porcine Longissimus lumborum[J]. Food Chemistry,2022,393:133347. doi: 10.1016/j.foodchem.2022.133347
[29] ZHANG M, BIAN H, LI J, et al. Comparison of biochemical characteristics and gel properties of chicken myofibrillar protein affected by heme-iron and nonheme-iron oxidizing systems[J]. Food Research International,2023,165:112538. doi: 10.1016/j.foodres.2023.112538
[30] BAI X, SHI S, KONG B, et al. Analysis of the influencing mechanism of the freeze-thawing cycles on in vitro chicken meat digestion based on protein structural changes[J]. Food Chemistry,2023,399:134020. doi: 10.1016/j.foodchem.2022.134020
[31] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry,2015,180:235−243. doi: 10.1016/j.foodchem.2015.02.036
[32] ZHANG C, LI Y, XIA X, et al. Changes in protein oxidation, structure, and thermal stability of chicken breast subjected to ultrasound-assisted immersion freezing during frozen storage[J]. Food Chemistry,2023,398:133874. doi: 10.1016/j.foodchem.2022.133874
[33] DU J, CAO J, ZHOU C, et al. Insight into the mechanism of myosin-fibrin gelation induced by non-disulfide covalent cross-linking[J]. Food Research International,2022,156:111168. doi: 10.1016/j.foodres.2022.111168
[34] ZHANG M, LI F, DIAO X, et al. Moisture migration, microstructure damage and protein structure changes in porcine longissimus muscle as influenced by multiple freeze-thaw cycles[J]. Meat Science,2017,133:10−18. doi: 10.1016/j.meatsci.2017.05.019
[35] LIU N, LIN P, ZHANG K, et al. Combined effects of limited enzymatic hydrolysis and high hydrostatic pressure on the structural and emulsifying properties of rice proteins[J]. Innovative Food Science & Emerging Technologies,2022,77:102975.
[36] LI F, DU X, REN Y, et al. Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J]. International Journal of Biological Macromolecules,2021,178:136−142. doi: 10.1016/j.ijbiomac.2021.02.158
[37] HUANG X, SUN L, LIU L, et al. Study on the mechanism of mulberry polyphenols inhibiting oxidation of beef myofibrillar protein[J]. Food Chemistry,2022,372:131241. doi: 10.1016/j.foodchem.2021.131241
[38] 王静宇, 杨玉玲, 周磊, 等. 超声波对肌原纤维蛋白理化和质构特性的影响[J]. 食品工业科技,2018,39(11):12−16,21. [WANG J Y, YANG Y L, ZHOU L, et al. Effects of ultrasound on physicochemical and texture property in myofibrillar protein[J]. Science and Technology of Food Industry,2018,39(11):12−16,21. doi: 10.13386/j.issn1002-0306.2018.11.003 WANG J Y, YANG Y L, ZHOU L, et al . Effects of ultrasound on physicochemical and texture property in myofibrillar protein[J]. Science and Technology of Food Industry,2018 ,39 (11 ):12 −16,21 . doi: 10.13386/j.issn1002-0306.2018.11.003[39] 郭浩楠, 杨荣华, 袁晓晴, 等. 鲢鱼蛋白的水解及其水解物功能性质的研究[J]. 中国食品学报,2010,10(4):106−112. [GUO H L, YANG R H, YUAN X Q, et al. Study on enzymatic hydrolysis of silver carp protein and functional properties of its hydrolysate[J]. Journal of Chinese Institute of Food Science and Technology,2010,10(4):106−112. GUO H L, YANG R H, YUAN X Q, et al . Study on enzymatic hydrolysis of silver carp protein and functional properties of its hydrolysate[J]. Journal of Chinese Institute of Food Science and Technology,2010 ,10 (4 ):106 −112 .[40] HAN Z, YUE X, SHAO J-H. The adsorption characteristics of 2D fibril and 3D hydrogel aggregates at the O/W interface combining molecular dynamics simulation[J]. Food Hydrocolloids,2022,128:107537. doi: 10.1016/j.foodhyd.2022.107537
[41] HAN Z, XU S, SUN J, et al. Effects of fatty acid saturation degree on salt-soluble pork protein conformation and interfacial adsorption characteristics at the oil/water interface[J]. Food Hydrocolloids,2021,113:106472. doi: 10.1016/j.foodhyd.2020.106472
[42] LIU Y Q, HUANG Y Y, DENG X Q , et al. Effect of enzymatic hydrolysis followed after extrusion pretreatment on the structure and emulsibility of soybean protein[J]. Process Biochemistry,2022,116:173−184. doi: 10.1016/j.procbio.2022.03.012
[43] JEON Y J, BYUN H G, KIM S K. Improvement of functional properties of cod frame protein hydrolysates using ultrafiltration membranes[J]. Process Biochemistry,1999,35(5):471−478. doi: 10.1016/S0032-9592(99)00098-9
[44] REN Z, LI X, MA F, et al. Oil-in-water emulsions prepared using high-pressure homogenisation with Dioscorea opposita mucilage and food-grade polysaccharides:guar gum, xanthan gum, and pectin[J]. LWT-Food Science and Technology,2022,162:113468. doi: 10.1016/j.lwt.2022.113468
-
期刊类型引用(2)
1. 徐瑞,杨文琳,贺林芝. 二氢杨梅素对滩羊肌原纤维蛋白抗氧化性和乳化性的影响. 食品安全导刊. 2024(17): 91-95+99 .  百度学术
百度学术
2. 郝林英,骆建林,随坤宇,王明波,黄青青,华雪,叶婷,王开卓,商文聪,孟永禄,李灿. 大鲵肝脏金属硫蛋白提取工艺优化及生物活性分析. 食品工业科技. 2024(22): 188-199 .  本站查看
本站查看
其他类型引用(1)





 下载:
下载:
 下载:
下载:



