Study on Fabrication and Stability of Starch-Lycium barbarum Complex
-
摘要: 为了探讨淀粉(CS)与枸杞(LB)在高速剪切过程中形成淀粉-枸杞复合物(CS-LB)的可能性及客体分子的稳定性,本文考察了高速剪切时间、转速及LB/CS质量比对CS-LB中枸杞色素(LP)质量分数及稳定性的影响,通过扫描电子显微镜(SEM)、X-射线衍射(XRD)、红外光谱(FT-IR)及热重分析(TGA)对所形成的复合物进行表征。结果表明,当高速剪切时间为1.5 h,转速为12000 r/min,LB与CS的质量比为3:1时,每克产物中LP的含量为0.99±0.03 mg。SEM结果显示产物呈现团聚状;XRD结果显示高速剪切处理破坏了淀粉颗粒的结晶域,转为无定形结构,CS与LB各组分间相互作用使得CS-LP的晶型转变为V型;FT-IR结果显示3421 cm−1处的吸收峰发生变化,可知CS和LB中的活性物质通过氢键结合;TGA结果显示该产物具有较好的热稳定性,600 ℃时复合物的质量保留率为36%,由此说明高速剪切处理能够较好地制备CS-LB,通过对复合物的稳定性研究发现该复合物可有效降低温度,氧气和光照对客体分子稳定性的影响,延长客体分子的保存期限,使其更好地发挥相关功能。Abstract: In this investigation, the starch-Lycium barbarum complex (CS-LB) was fabricated using corn starch (CS) and Lycium barbarum (LB) through a high-speed shear method. The stability of the guest molecules was also explored. The influence of shear time, rotational speed, and LB to CS mass ratio on Lycium barbarum pigment (LP) content and its stability were investigated. The CS-LB was characterized by scanning electron microscopy (SEM), X-ray diffraction (XRD), infrared spectroscopy (FT-IR), and thermogravimetric analysis (TGA). It was found that the content of LP in the product was 0.99±0.03 mg per gram when the shear time was 1.5 hours, the rotational speed was 12000 r/min, and the mass ratio of LB to CS was 3:1. The SEM results illustrated that the products had an agglomerated morphology. The XRD results showed that the crystal domain of starch particles was destroyed and transformed into amorphous structures due to the high-speed shear treatment, but the CS-LP crystalline structure changed into a V-type, which was promoted by the interaction between CS and active components of LB. The FT-IR results showed that the absorption peak at 3421 cm−1 shifted, indicating that CS and LB were bound through hydrogen bonds. The TGA results showed that the thermal stability of the product was also enhanced, with a mass retention rate of 36% at 600 ℃ for the composite. Thus, the CS-LB could be effectively fabricated by high-speed shear treatment. Additionally, it was found that the composite could effectively reduce the effects of temperature, oxygen, and light on the stability of guest molecules in stability experiments. The shelf-life of guest molecules was also extended, enabling them to perform their related functions better.
-
Keywords:
- Lycium barbarum /
- corn starch /
- high-speed shear treatment
-
枸杞(Lycium barbarum,LB),作为一种传统的药食同源类食品,在我国已有2000多年的食用历史[1]。现有的研究表明,枸杞的生物活性物质主要有枸杞色素(Lycium barbarum pigment,LP)、枸杞多糖、氨基酸和微量元素等[2],在调节机体新陈代谢、保护视觉、血糖调节、免疫调节、抗肿瘤活性和细胞保护等方面有着积极的效果[3]。
LP是一种由类胡萝卜素和黄酮组成的活性物质,对枸杞生物活性的发挥起着关键作用[4]。然而,相较于枸杞中其它活性成分,LP存在着稳定性差,不易保藏等问题。氧气、光照和高温是主要的诱导因素,容易使其发生褐变,导致其生物活性减弱,从而降低了LP的生物活性和生物利用度[5]。目前,提高LP稳定性的研究已逐渐受到关注,张春兰等[6]制备了LP微乳液,通过添加抗氧化剂和EDTA-2Na提高了LP的稳定性;刘永等[7]通过海藻酸钠和壳聚糖作为LP的载体,显著降低了高温、光照和氧气等诱导因素对LP的破坏,延长其储藏期。但是这些方法存在着生产成本高、加工流程复杂等问题,因此不适于LP包含体复合物的实际生产加工。
近年来,通过以淀粉作为载体制备复合物增加客体分子稳定性的研究已较为广泛。淀粉是一种由直链淀粉和支链淀粉以特定交错排列方式形成的晶体颗粒[8]。当存在疏水性客体分子时,直链淀粉可自发形成“内部疏水,外部亲水”的单螺旋空腔体结构[9]。疏水性客体分子可通过氢键、疏水相互作用和范德华力等非共价作用进入淀粉单螺旋空腔或镶嵌在两个螺旋空腔之间,从而形成复合物[10]。ANDREA等[11]制备了高直链淀粉-脂肪酸复合物,该复合物可显著降低氧气和温度对脂肪酸的影响,提高了脂肪酸的稳定性。WANG等[12]所制备的直链淀粉-儿茶素复合物和HOYOS等[13]制备的淀粉-杏仁油复合物也有相似的效果,所装载的客体分子的稳定性均显著提升。因此,本研究拟选择淀粉为载体,以LP含量为指标,探索一种新型的有效保护枸杞活性物质的CS-LB制备方法,通过考察其理化性质来揭示该复合物的形成方式,并进一步对该类复合物的稳定性进行考察,为LB的高效利用提供新的技术支撑。
1. 材料与方法
1.1 材料与仪器
玉米淀粉(直链淀粉含量为27.5%,水分含量为12.7%) 天津中英保健食品有限公司;枸杞(水分含量为10.2%) 宁夏宁馨儿生物科技有限公司;β-胡萝卜素标准品(CAS:7235-40-7,HPLC≥98%) 北京索莱宝科技有限公司;其余试剂均为分析纯。
PB12 Power311型高速破壁机 广东美的电器有限公司;Alpha 2-4 LD plus型真空冷冻干燥机 德国奇尔斯特公司;TU-1810PC型紫外-可见分光光度计 北京普析通用仪器有限公司;Philips XL-30型扫描电子显微镜 荷兰飞利浦公司;Rigaku D/max 2500X射线衍射仪 日本理学株式会社;Pyris/Diamond型热重分析仪 美国Perkin-Elmer公司;Vector-22型傅里叶红外光谱仪 德国布鲁克仪器公司。
1.2 实验方法
1.2.1 CS-LB制备方法
CS-LB的制备参照张黎明等[14]的方法并稍作修改。将8%的淀粉匀浆于90 ℃加热处理2 min使淀粉预糊化,并按照一定质量比加入枸杞进行高速剪切处理,然后对样品进行真空冷冻干燥、研磨过筛处理。再利用无水乙醇洗涤3次,于−80 ℃,0.35 atm的条件下冷冻干燥24 h并过100目筛即得CS-LB。然后对其LP的含量和包埋率进行测定。
1.2.2 制备条件的优化
利用复合物中LP的含量和包埋率筛选复合物的较佳制备条件。首先在剪切速率8000 r/min、 枸杞与淀粉质量比(干重)为3:1的条件下,将混合匀浆分别剪切不同时间(0.5~3 h,以30 min为间隔)以确定制备复合物的较优剪切时间。在确定较优剪切时间后,固定枸杞与淀粉质量比(干重)为3:1,设置破壁机不同剪切速率(8000~28000 r/min,以4000 r/min为间隔)高速剪切1.5 h以确定制备复合物的较优剪切速率。确定较优剪切速率和剪切时间后,在预糊化淀粉冷却过程中加入不同质量的枸杞,使枸杞:淀粉的质量比(干重)分别为1:3,1:2,1:1,2:1,3:1,对枸杞与淀粉的质量比(干重)进行优化,以确定制备复合物的较优质量比。
1.2.3 对照样品的制备
枸杞粉的制备:称取一定质量的枸杞置于90 ℃的热水中加热处理2 min,然后在冷却至室温后,以32000 r/min高速剪切混合2 min,之后12000 r/min剪切1.5 h,然后真空冷冻干燥、研磨过100目筛处理即得。预糊化淀粉的制备方法采用上述CS-LP的制备方法,制备过程中不添加枸杞。物理混合物按照枸杞粉与预糊化淀粉的设定质量比称重,置于EP管中并充分混合即得。
1.2.4 LP含量和包埋率的测定
LP中的主要成分为类胡萝卜素,本实验对LP含量的测定以β-胡萝卜素为测定指标,测定方法参考Yazdani等[15]并稍作修改。简言之,于波长λ=450 nm处测定不同浓度β-胡萝卜素(0~100 μg/mL)的吸光值,以β-胡萝卜素浓度为X轴,吸光值为Y轴绘制的标准曲线为y=0.2366x−0.0032,R²=0.9993。LP含量测定参考李小玉等[16]的方法,分别称取0.2 g LB和CS-LB溶于9 mL蒸馏水中,静置15 min后于6000 r/min条件下离心5 min,弃上清液,后向沉淀中加入提取溶剂(石油醚:丙酮=1:1),充分振荡后超声提取15 min,反复3次,收集上清液并用提取溶剂定容至50 mL,于450 nm处测定吸光值,并按式(1)计算LP的含量,按式(2)计算CS-LB中LP的包埋率。
X(mg/g)=C×VM×103 (1) R(%)=X1X2×100 (2) 式中:X,β-胡萝卜素含量,mg/g;C,β-胡萝卜素浓度,µg/mL;V,定容体积,mL;M,CS-LB质量,g;R,LP的包埋率,%;X1,CS-LB中β-胡萝卜素含量,mg/g;X2,所添加LB中的β-胡萝卜素总含量,mg/g。
1.2.5 CS-LB的理化性质表征
1.2.5.1 扫描电子显微镜分析(SEM)
将微量样品用导电胶固定在样品板上镀金膜,加速电压设为6 kV[17],放大1000倍观察样品的微观形貌。
1.2.5.2 X-射线衍射分析(XRD)
取样品粉末放置铝片孔中,选用波长为541 nm的单色Cu-Kα射线,设置电压为40 kV、电流为40 mA、起始角为3°、终止角为60°进行扫描[18]。
1.2.5.3 红外光谱分析(FT-IR)
精确称取1.0 mg样品与100.0 mg溴化钾混合,压片后进行光谱采集,空气背景做空白对照。
1.2.5.4 热重分析(TGA)
精确称取10.0 mg样品于坩埚中,起始、结束温度分别设置为25 ℃、600 ℃,升温速率为10 ℃/min进行热重分析。
1.2.6 CS-LB稳定性实验
CS-LB稳定性实验参照李素云等[19]的方法,并稍作修改,LP保留率按式(3)计算:
保留率(%)=X3X4×100 (3) 式中:X3为测定时CS-LP中LP的含量,mg/g;X4为CS-LP中LP的初始含量,mg/g。
1.2.6.1 温度对CS-LB稳定性的影响
称取1.0 g样品,用透明袋真空包装,分别置于冷藏条件(4 ℃)、常温条件(25 ℃)、高温条件(50 ℃)下避光保存,于第0、2、4、8、12 d取出部分测定LP的含量。
1.2.6.2 氧气对CS-LB稳定性的影响
称取1.0 g样品,常温条件下分别置于密封和敞口棕色瓶中保存,隔天取样测定LP含量,分析两种条件下的LP保留率。
1.2.6.3 光照对CS-LB稳定性的影响
称取1.0 g样品,常温条件下分别置于黑暗和光照环境中保存,隔天取样测定LP含量,分析两种条件下的LP保留率。
1.3 数据处理
结果以平均值±标准差(¯X±SD)的形式表示,实验均重复测定3次,采用SPSS 13.0统计软件对测量结果进行统计学分析,Origin 2022作图。显著性分析采用邓肯氏多重比较,P<0.05为差异显著。
2. 结果与分析
2.1 制备条件对CS-LB中LP含量及其包埋率的影响
2.1.1 高速剪切时间对CS-LB中LP含量及其包埋率的影响
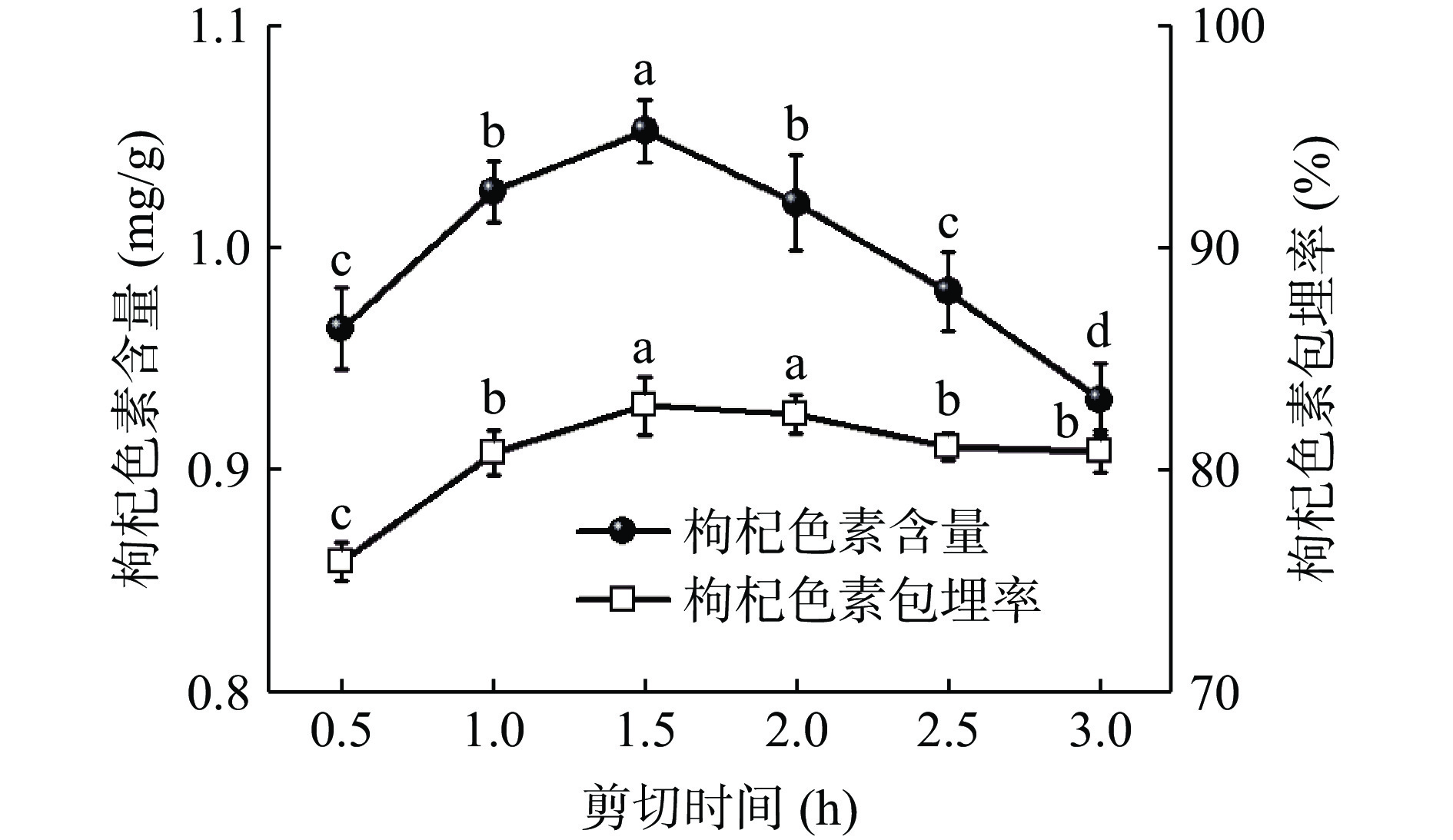
图1为高速剪切时间对CS-LB中LP含量及包埋率的影响。由图1可知,当剪切时间由0.5 h延长至1.5 h时,CS-LB中LP含量与包埋率均呈现平稳上升的趋势,在1.5 h达到峰值,此时LP含量和包埋率分别为1.060±0.004 mg/g、83.10%±0.33%;当剪切时间延长至3 h时,LP含量和包埋率均呈现下降的趋势。这可能是由于在剪切力的作用下,淀粉双螺旋结构被进一步破坏,单螺旋空腔的比例上升。同时,高速剪切处理使得枸杞细胞中的生物活性物质充分释放出来。枸杞中的疏水性物质可通过非共价作用进入直链淀粉的螺旋空腔中形成复合物[20]。然而,随着高速剪切的持续进行,可能是由于CS-LB的结构发生破坏,导致复合物的包埋率降低,因此选择制备CS-LB的较优剪切时间为1.5 h。
2.1.2 高速剪切速率对CS-LB中LP含量及其包埋率的影响
图2为高速剪切速率对CS-LB中LP含量及其包埋率的影响。由图2可知,LP的含量与包埋率的变化呈现类似的趋势,均先增后减。当剪切速率开始由8000 r/min升高时,CS-LB中LP的含量及包埋率迅速上升,并在12000 r/min时达到峰值,此时LP含量和包埋率分别为1.02±0.01 mg/g,80.44%±0.92%。当剪切速率继续升高时,LP含量和包埋率呈显著下降的趋势(P<0.05)。因此,当剪切速率为12000 r/min时,可较好地制备CS-LB。
2.1.3 枸杞/淀粉质量比对LP含量及包埋率的影响
图3为LB/CS质量比(g/g)对LP含量及包埋率的影响。由图3可知,当LB和CS质量比在1:3到3:1范围内,LP的含量随CS和LB质量比的增加呈递增趋势,在LB与CS质量比为3:1时,复合物中LP含量最高0.99±0.03 mg/g,因此选择LB和CS质量比3:1作为较优的制备比例。
2.2 CS-LB的理化性质表征
2.2.1 扫描电镜分析(SEM)
图4为玉米淀粉、预糊化淀粉、枸杞粉、物理混合物和淀粉-枸杞复合物的扫描电镜照片。从图4可以观察到,CS的构型呈多面体结构,大小不一,表面光滑,平均粒径约7 μm(图4A)。预糊化淀粉整体呈不规则片状,与王娜等[21]制备的预糊化淀粉形态类似,这可能是由于加热糊化破坏了CS的结晶区域,直链淀粉扩展并形成了密集的网状结构(图4B)。枸杞粉呈团聚状,表面凹凸不平,大小不均,形态各异(图4C)。物理混合物可见枸杞粉和预糊化淀粉两种物质形态的存在,说明二者仅通过物理作用聚集(图4D)。CS-LB(图4E)表面分布小孔,颗粒大小近似,相较于预糊化淀粉体积变大,并伴有团聚现象的发生。另外,与物理混合物相比,包合物的表面平整度降低,其形态也发生了明显变化,由此可知LB中的疏水性活性物质在高速剪切过程中与淀粉发生了包合络结作用[22]。
2.2.2 X射线衍射(XRD)分析结果
图5为玉米淀粉、预糊化淀粉、枸杞粉、物理混合物和CS-LB复合物的X射线衍射图。由图5可知,CS在2θ为15.0°,17.0°,18.0°,23.5°处出现尖峰衍射,这是典型的A型淀粉结晶的特征(图5a)。预糊化淀粉(图5b)相较于CS衍射峰减弱或消失。当2θ为20.1°有较弱的衍射峰存在,这是由于CS在加热作用下不断吸水溶胀导致其有序分子崩解并溶解,从而破坏了CS的晶体结构[23]。枸杞粉呈无定型结构(图5c),物理混合物(图5d)未出现衍射峰,属于非结晶结构。而CS-LB(图5e)在2θ为18°、20°处出现V型淀粉的特征衍射峰[24],这说明CS与枸杞粉高速剪切后促使淀粉晶型发生了由A型向V型的转变,且相对结晶度有所下降。这可能与直链淀粉的单螺旋空腔与LB中的活性物质有关,Lee等[25]报道称β-胡萝卜素可通过范德华力,疏水相互作用与CS作用形成复合物;Zhao等[26]通过使用多糖可与淀粉通过氢键,范德华力等非共价作用结合并形成V型复合物;同时,多酚也具有类似的效果[27]。因此,直链淀粉和LB中的活性物质结合形成CS-LB。
2.2.3 FT-IR分析结果
图6为CS、预糊化淀粉、枸杞粉、物理混合物和CS-LB复合物的FT-IR图谱。由图6可知,LB在包合前后代表各基团的吸收峰并未增加或减少,表明高速剪切处理不会对LP的分子基团造成破坏(图6c和图6e)。CS在3421 cm−1处为羟基O-H伸缩振动吸收峰,2925 cm−1处为饱和的C-H伸缩振动吸收峰,1647 cm−1处为结合水的伸缩振动吸收峰[28](图6a)。CS与LB粉的物理混合物在3421 cm−1处的O-H吸收峰,以及1647 cm−1处的结合水吸收峰均变宽,且峰强变大,这是由于CS与LB活性物质中O-H吸收峰的缔合叠加造成的[29](图6d)。与物理混合物相比,CS-LB的3421 cm−1处吸收峰变强,且向高频处发生偏移。同时,1647 cm−1处的吸收峰变强。这可能是由于CS与客体分子包结络合后,主客体通过氢键结合(图6e)。这表明形成的CS-LB是以非共价键偶联结合的形式存在[30]。
2.2.4 热重分析结果(TGA)
图7为CS、预糊化淀粉、枸杞粉、物理混合物和CS-LP复合物的热重分析图。由图7可知,CS(图7a)的热损失分为两个阶段,第一阶段(50~100 ℃)主要与CS中水分挥发有关,第二阶段(254~340 ℃)主要是CS的分解,在此阶段CS分子键发生断裂和碳化[31]。LB粉(图7c)热损失也表现为两个阶段,第一阶段(50~100 ℃)是由于自由水的挥发,第二阶段的热损失主要是在高温条件下LB活性物质发生分解(304~314 ℃)。CS-LB(图7e)热损失分为三个阶段:第一阶段为水分的散失(50~100 ℃),第二阶段为外部CS的部分碳化与所包含的LB活性物质的部分分解(138~209 ℃),第三阶段为CS的碳化与LP的完全分解(221~372 ℃),CS-LB的质量保留率为36%,高于物理混合物(图7d),这可能是由于CS-LB中螺旋空腔与LB活性物质通过非共价键缔合形成的结构更为稳定,在一定程度上提高了LB活性物质的热稳定性[32]。
2.3 CS-LB的稳定性分析
2.3.1 温度对CS-LB中LP稳定性的影响
图8A为不同温度下包合前后的LP保留率随保存时间的变化趋势图。由图8A可知,环境温度越高,保存时间越长,LP的保留率越低,而在同一温度下,CS-LB中的LP保留率均高于LB粉。其中,第12 d时50 ℃条件下LB粉的保留率仅为26.64%,而CS-LB中LP的保留率为85.62%。原因在于高温会对LP造成不可逆损伤,且当温度升高,时间延长,损伤越严重。CS-LB中的LP由于CS的保护作用,降解速率减缓,且受高温影响作用降低,热稳定性明显提高。刘树兴等[33]研究的淀粉-姜黄色素复合物也可改善姜黄色素的热稳定性,本实验结果与之相似。
2.3.2 氧气对CS-LB中LP稳定性的影响
图8B为氧气对LP稳定性的影响。由图8B可知,在有氧或无氧条件下,CS-LB中LP的保留率均高于LB粉,而在有氧条件下LP保留率均低于无氧条件。第12 d时,有氧条件下枸杞粉的LP保留率为62.38%,而CS-LB中LP的保留率为91.22%,原因在于有氧条件下产生的氧自由基会掠夺化学键中的电子,使化学键失去稳定,导致LP逐渐氧化分解[34]。而CS-LB可降低氧自由基对客体分子的破坏,保护LP,并提高其稳定性。鲍杰[35]曾探究氧气对玫瑰花渣复合物稳定性的影响,其结果也证明复合物化可显著提高色素的稳定性。
2.3.3 光照对CS-LB中LP稳定性的影响
图8C为光照对LP稳定性的影响。由图8C可知,光照下LP的保留率相比于避光条件均较低,但无论光照与否,CS-LB中LP保留率均远高于LB粉。第12 d时,光照条件下LB粉的LP保留率为54.81%,而CS-LB中LP的保留率为91.38%,原因在于紫外光线会破坏化学键,降低LP稳定性,使其活性逐渐分解[36]。而CS-LB使紫外光线无法穿过螺旋空腔,包埋其中的LP无法被分解,稳定性明显提高。
3. 结论
本研究采用高速剪切法制备了CS-LB,并以LP含量和包埋率为指标,确定了较好的制备条件,当LB和CS质量比为3:1(g/g),剪切速率为12000 r/min,剪切时间为1.5 h,在此条件下得到CS-LB中LP的含量为0.99±0.03 mg/g。SEM分析结果表明,所形成的CS-LP与物理混合物相比,体积增大,表面粗糙程度增加;X射线衍射分析表明,形成了V型复合物,证明LB中的疏水性活性物质被成功地结合在直链淀粉包合物的螺旋内腔中;FT-IR分析结果表明,CS与LB活性成分通过非共价的形式结合形成复合物;与混合物相比,CS-LP的热稳定性明显增强,可知预糊化淀粉与LB活性成分发生了缔合作用。通过稳定性实验发现,CS-LP在不同的温度、氧气以及光照条件下LP的保留率均高于LB粉。由此说明CS-LB对LP有较强的保护效果,能够有效提高LP的稳定性,使其更好的发挥生物活性。
-
-
[1] GAO Y J, WEI Y F, WANG Y Q, et al. Lycium barbarum:A taditional Chinese herb and a promising anti-aging agent[J]. Aging Dis,2017,8(6):778−791. doi: 10.14336/AD.2017.0725
[2] LIU H, CUI B, ZHANG Z. Mechanism of glycometabolism regulation by bioactive compounds from the fruits of Lycium barbarum[J]. Food Research International,2022,159:111408. doi: 10.1016/j.foodres.2022.111408
[3] DONNO D, BECCARO G L, MELLANO M G, et al. Goji berry fruit ( Lycium spp.):Antioxidant compound fingerprint and bioactivity evaluation[J]. Functional Foods,2015,10(18):1070−1085.
[4] 刘倩, 余意, 梁琰, 等. 枸杞子活性成分及分析方法研究进展[J]. 辽宁中医药大学学报,2018,20(11):56−59. [LIU Qian, YU Yi, LIANG Yan, et al. Research progress on active components and analytical methods of Lycium barbarum[J]. Journal of Liaoning University of Traditional Chinese Medicine,2018,20(11):56−59.] LIU Qian, YU Yi, LIANG Yan, et al . Research progress on active components and analytical methods of Lycium barbarum[J]. Journal of Liaoning University of Traditional Chinese Medicine,2018 ,20 (11 ):56 −59 .[5] RUTZ J K, BORGES C D, ZAMBIAZI R C, et al. Elaboration of microparticles of carotenoids from natural and synthetic sources for applications in food[J]. Food Chemistry,2016,202:324−333. doi: 10.1016/j.foodchem.2016.01.140
[6] 张春兰, 李斌. 枸杞色素微乳液的理化稳定性[J]. 食品工业科技,2019,40(23):72−76. [ZHANG Chunlan, LI Bin. Physicochemical stability of Lycium barbarum pigment microemulsion[J]. Food Industry Science and Technology,2019,40(23):72−76.] ZHANG Chunlan, LI Bin . Physicochemical stability of Lycium barbarum pigment microemulsion[J]. Food Industry Science and Technology,2019 ,40 (23 ):72 −76 .[7] 刘永, 张林. 枸杞色素微胶囊的制备[J]. 食品科技,2015,40(9):101−104. [LIU Yong, ZHANG Lin. Preparation of Lycium barbarum pigment microcapsules[J]. Food Science and Technology,2015,40(9):101−104.] LIU Yong, ZHANG Lin . Preparation of Lycium barbarum pigment microcapsules[J]. Food Science and Technology,2015 ,40 (9 ):101 −104 .[8] BERTOFT E. Understanding starch structure:Recent progress[J]. Agronomy,2017,7(3):56−84. doi: 10.3390/agronomy7030056
[9] LI L, ZHANG W H, PENG J, et al. A novel shell material-highland barley starch for microencapsulation of cinnamon essential oil with different preparation methods[J]. Materials,2020,13(5):1192−1208. doi: 10.3390/ma13051192
[10] ZHANG Y Q, GLADDEN I, GUO G Y, et al. Enzymatic digestion of amylose and high amylose maize starch inclusion complexes with alkyl gallates[J]. Food Hydrocolloids,2020,108(4):106009−106015.
[11] ANDREA E, VANESA Y, MABEL C. Inclusion complexes of high amylose corn starch with essential fatty acids from chia seed oil as potential delivery systems in food[J]. Food Hydrocolloids,2020,108(1):106030−106038.
[12] WANG Y Z, ZHANG Y Q, GUAN L, et al. Lipophilization and amylose inclusion complexation enhance the stability and release of catechin[J]. Carbohydrate Polymer,2021,269:118251. doi: 10.1016/j.carbpol.2021.118251
[13] HOYOS-LEYVA J D, BELLO-PEREZ L A, AGAMA-ACEVEDO J E, et al. Characterization of spray drying microencapsulation of almond oil into taro starch spherical ggregates[J]. LWT,2019,101:526−533. doi: 10.1016/j.lwt.2018.11.079
[14] 张黎明, 彭巧玲, 金雪芹, 等. 3种淀粉与大蒜中大蒜素所形成包合物的特征及其抑菌活性研究[J]. 食品工业科技,2020,41(11):92−97,124. [ZHANG Liming, PENG Qiaoling, JIN Xueqin, et al. Study on the characteristics and antibacterial activity of the inclusion compound formed by three kinds of starch and allicin in garlic[J]. Food Industry Science and Technology,2020,41(11):92−97,124.] ZHANG Liming, PENG Qiaoling, JIN Xueqin, et al . Study on the characteristics and antibacterial activity of the inclusion compound formed by three kinds of starch and allicin in garlic[J]. Food Industry Science and Technology,2020 ,41 (11 ):92 −97,124 .[15] YAZDANI M, TAVAKOLI O, KHOOBI M. et al. Beta-carotene/cyclodextrin-based inclusion complex:Improved loading, solubility, stability, and cytotoxicity[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry,2022,102:55−64. doi: 10.1007/s10847-021-01100-7
[16] 李小玉, 肖丽凤, 杨懋勋. 超声萃取-超高效液相色谱法快速测定烤烟中的类胡萝卜素[J]. 化工时刊,2019,33(12):10−13. [LI Xiaoyu, XIAO Lifeng, YANG Maoxun. Rapid determination of carotenoids in flue-cured tobacco by ultrasonic extraction-ultra-high performance liquid chromatography[J]. Journal of Chemical Engineering,2019,33(12):10−13.] LI Xiaoyu, XIAO Lifeng, YANG Maoxun . Rapid determination of carotenoids in flue-cured tobacco by ultrasonic extraction-ultra-high performance liquid chromatography[J]. Journal of Chemical Engineering,2019 ,33 (12 ):10 −13 .[17] KIM J Y, HUBER K C. Preparation and characterization of corn starch- β-carotene composites[J]. Carbohydrate Polymer,2016,136:394−401. doi: 10.1016/j.carbpol.2015.08.069
[18] 郭晋彪, 曲迎辉, 何希宏, 等. 淀粉/石榴皮多酚自组装体形成及消化性分析[J]. 食品科学, 2023:1−12[2024-01-23]. http://kns.cnki.net/kcms/detail/11.2206.TS.20221229.1911.009.html. [GUO Jinbiao, QU Yinghui, HE Xihong, et al. Formation and digestibility analysis of starch/pomegranate peel polyphenol self-assembly[J]. Food Science, 2023:1−12[2024-01-23]. http://kns.cnki.net/kcms/detail/11.2206.TS.20221229.1911.009.html.] GUO Jinbiao, QU Yinghui, HE Xihong, et al. Formation and digestibility analysis of starch/pomegranate peel polyphenol self-assembly[J]. Food Science, 2023: 1−12[2024-01-23]. http://kns.cnki.net/kcms/detail/11.2206.TS.20221229.1911.009.html.
[19] 李素云, 李星科, 张华. 大蒜油微胶囊的制备及其储藏稳定性研究[J]. 中国调味品,2015,40(2):40−43. [LI Suyun, LI Xingke, ZHANG Hua. Preparation and storage stability of garlic oil microcapsules[J]. China Condiment,2015,40(2):40−43.] LI Suyun, LI Xingke, ZHANG Hua . Preparation and storage stability of garlic oil microcapsules[J]. China Condiment,2015 ,40 (2 ):40 −43 .[20] 张黎明, 彭巧玲, 金雪芹, 等. 玉米淀粉对大蒜中大蒜素的包合及其复合物的抑菌活性[J]. 现代食品科技,2020,36(3):180−188. [ZHANG Liming, PENG Qiaoling, JIN Xueqin, et al. Inclusion effect of corn starch on allicin in garlic and antibacterial activity of its complex[J]. Modern Food Science and Technology,2020,36(3):180−188.] ZHANG Liming, PENG Qiaoling, JIN Xueqin, et al . Inclusion effect of corn starch on allicin in garlic and antibacterial activity of its complex[J]. Modern Food Science and Technology,2020 ,36 (3 ):180 −188 .[21] 王娜, 肖云峰, 钱新宇, 等. 丁香酚/淀粉包合物冻干粉的制备及表征[J]. 现代食品科技,2020,36(12):180−187. [WANG Na, XIAO Yunfeng, QIAN Xinyu, et al. Preparation and characterization of eugenol/starch inclusion complex freeze-dried powder[J]. Modern Food Science and Technology,2020,36(12):180−187.] WANG Na, XIAO Yunfeng, QIAN Xinyu, et al . Preparation and characterization of eugenol/starch inclusion complex freeze-dried powder[J]. Modern Food Science and Technology,2020 ,36 (12 ):180 −187 .[22] 郑成娟, 李珊珊, 陈青. 金樱子果渣中脂肪酸与玉米淀粉包合物的制备及性能[J]. 精细化工,2020,37(12):2482−2489. [ZHENG Chengjuan, LI Shanshan, CHEN Qing. Preparation and properties of the inclusion compound of fatty acids and corn starch in the fruit residue of Rosa laevigata[J]. Fine Chemical Industry,2020,37(12):2482−2489.] ZHENG Chengjuan, LI Shanshan, CHEN Qing . Preparation and properties of the inclusion compound of fatty acids and corn starch in the fruit residue of Rosa laevigata[J]. Fine Chemical Industry,2020 ,37 (12 ):2482 −2489 .[23] 徐芬, 刘伟, 刘倩楠, 等. 不同糊化度马铃薯淀粉的黏度及凝胶特性分析[J]. 现代食品科技,2020,36(5):42−50. [XU Fen, LIU Wei, LIU Qiannan, et al. Analysis of viscosity and gel properties of potato starch with different gelatinization degrees[J]. Modern Food Science and Technology,2020,36(5):42−50.] XU Fen, LIU Wei, LIU Qiannan, et al . Analysis of viscosity and gel properties of potato starch with different gelatinization degrees[J]. Modern Food Science and Technology,2020 ,36 (5 ):42 −50 .[24] GUTIÉRREZ T J, BELLO-PÉREZ L A. Self-assembled and assembled starch V-type complexes for the development of functional foodstuffs[J]. Food Hydrocolloids,2022,12:107453.
[25] LEE D H, KWON K S, JEONG D, et al. Structural and physicochemical properties of composites between starch nanoparticles and β-carotene prepared via nanoprecipitation[J]. Int J Biol Macromol,2022,214:100−110. doi: 10.1016/j.ijbiomac.2022.06.062
[26] ZHAO Qizhu, TIAN Hao, CHEN Long, et al. Interactions between soluble soybean polysaccharide and starch during the gelatinization and retrogradation:Effects of selected starch varieties[J]. Food Hydrocolloids,2020,118:106765.
[27] NAG S, MAJUMDER S. Starch, gallic acid, their inclusion complex and their effects in diabetes and other diseases-A review[J]. Food Sci Nutr,2022,11(4):1612−1621.
[28] 张黎明, 时文佳, 张丽, 等. 球磨法制备淀粉-芹菜素复合物及其消化性分析[J]. 食品科学,2020,41(11):64−70. [ZHANG Liming, SHI Wenjia, ZHANG Li, et al. Preparation of starch-apigenin complex by ball milling and its digestibility analysis[J]. Food Science,2020,41(11):64−70.] ZHANG Liming, SHI Wenjia, ZHANG Li, et al . Preparation of starch-apigenin complex by ball milling and its digestibility analysis[J]. Food Science,2020 ,41 (11 ):64 −70 .[29] 刘华玲, 史苗苗, 周亚萍, 等. 茶多酚/直链淀粉复合物的制备及表征[J]. 食品工业科技,2019,40(2):113−118. [LIU Hualing, SHI Miaomiao, ZHOU Yaping, et al. Preparation and characterization of tea polyphenols/amylose complex[J]. Food Industry Science and Technology,2019,40(2):113−118.] LIU Hualing, SHI Miaomiao, ZHOU Yaping, et al . Preparation and characterization of tea polyphenols/amylose complex[J]. Food Industry Science and Technology,2019 ,40 (2 ):113 −118 .[30] 肖遥, 曹悦, 任顺成, 等. 多酚与玉米淀粉相互作用研究[J]. 河南工业大学学报(自然科学版),2020,41(1):45−51. [XIAO Yao, CAO Yue, REN Shuncheng, et al. Study on the Interaction between polyphenols and corn starch[J]. Journal of Henan University of Technology (Natural Science Edition),2020,41(1):45−51.] XIAO Yao, CAO Yue, REN Shuncheng, et al . Study on the Interaction between polyphenols and corn starch[J]. Journal of Henan University of Technology (Natural Science Edition),2020 ,41 (1 ):45 −51 .[31] KANG Xueming, JIA Siqing, GUO Wei, et al. The formation of starch-lipid complexes by microwave heating[J]. Food Chemistry,2022,382:132319. doi: 10.1016/j.foodchem.2022.132319
[32] 赵德厚, 郝帅, 朱智杰, 等. 大豆蛋白肽-玉米淀粉复合物的制备及其性质研究[J]. 安徽农业大学学报,2021,48(6):989−996. [ZHAO Dehou, HAO Shuai, ZHU Zhijie, et al. Preparation and properties of soybean protein peptide-corn starch complex[J]. Journal of Anhui Agricultural University,2021,48(6):989−996.] ZHAO Dehou, HAO Shuai, ZHU Zhijie, et al . Preparation and properties of soybean protein peptide-corn starch complex[J]. Journal of Anhui Agricultural University,2021 ,48 (6 ):989 −996 .[33] 刘树兴, 胡小军, 杨大庆, 等. 微胶囊化姜黄色素的制备与性质研究[J]. 食品科学,2004(11):164−167. [LIU Shuxing, HU Xiaojun, YANG Daqing, et al. Preparation and properties of microencapsulated curcumin[J]. Food Science,2004(11):164−167.] LIU Shuxing, HU Xiaojun, YANG Daqing, et al . Preparation and properties of microencapsulated curcumin[J]. Food Science,2004 (11 ):164 −167 .[34] LAVELLI V, SEREIKAITE J. Kinetic study of encapsulated β-carotene degradation in dried systems a review[J]. Foods,2022,11(3):437. doi: 10.3390/foods11030437
[35] 鲍杰. 微胶囊化对玫瑰花渣色素理化性质及稳定性的影响研究[D]. 北京:北京林业大学, 2019. [BAO Jie. Study on the effect of microencapsulation on the physicochemical properties and stability of rose pomace pigment[D]. Beijing:Beijing Forestry University, 2019.] BAO Jie. Study on the effect of microencapsulation on the physicochemical properties and stability of rose pomace pigment[D]. Beijing: Beijing Forestry University, 2019.
[36] JAFARI S M, ASSADPOOR E, HE Y, et al. Encapsulation efficiency of food flavours and oils during spray drying[J]. Drying Technology,2008,26(7):816−835. doi: 10.1080/07373930802135972
-
期刊类型引用(2)
1. 彭婷,江丹,陈阳,王玉,赖富丽,陈志元,黄林恋. 响应面法优化桑叶提取液脱色工艺及其对α-葡萄糖苷酶抑制活性. 食品与发酵科技. 2024(06): 62-69 .  百度学术
百度学术
2. 郑霖华,吴启赐,陈巧玲,林佳燕,廖苑萍. 细梗香草皂苷活性炭脱色工艺及抑菌活性研究. 中国食品添加剂. 2021(11): 67-72 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:







 下载:
下载:



