Astaxanthin Reduces Retinal Damage in Diabetes Mice by Inhibiting Iron Death through Regulating Nrf2/Gpx4 Signaling Pathway
-
摘要: 目的:探究虾青素改善糖尿病小鼠视网膜损伤的作用及作用机制。方法:将小鼠随机分为四组:分别为正常组、模型组、虾青素低剂量组和虾青素高剂量组。采用腹腔注射链脲佐菌素(STZ)联合高脂饲料诱导糖尿病小鼠视网膜损伤模型。通过血糖仪测定小鼠的空腹血糖及胰岛素抵抗情况;采用分光光度法测定小鼠视网膜组织中丙二醛(malondialdehyde,MDA)和Fe2+水平,谷胱甘肽过氧化物酶(glutataione peroxidase,GSH-PX)及超氧化物歧化酶(superoxide dismutase,SOD)的活性;通过免疫印记法测定小鼠视网膜中谷胱甘肽过氧化酶4(Glutathione Peroxidase 4,GPX4)、核因子E2相关因子2(nuclearfactor erythroid-2 related factor 2,Nrf2)、转铁蛋白受体1(transferrin1,TFR1)和铁蛋白重链1(Ferritin Heavy Chain 1,FTH1)的表达水平;HE染色法观察各组小鼠视网膜病理学变化。结果:检测结果显示,虾青素可显著降低糖尿病小鼠的空腹血糖水平(P<0.05,P<0.01)。高剂量虾青素可极显著(P<0.01)改善糖尿病小鼠的胰岛素抵抗情况;虾青素可显著降低糖尿病小鼠视网膜组织中MDA和Fe2+的含量,升高GSH-PX和SOD的活性(P<0.05,P<0.01);此外,蛋白质免疫印迹结果显示,虾青素可以显著升高糖尿病小鼠视网膜中GPX4,Nrf2,FTH1蛋白的表达,降低TFR1蛋白的表达(P<0.05,P<0.01);病理切片结果显示,给予虾青素干预后,小鼠视网膜内核层细胞、外核层细胞以及小鼠视网膜神经节细胞层损伤明显减轻。结论:虾青素可以通过抗氧化并上调Nrf2/Gpx4信号通路抑制铁死亡,减轻糖尿病视网膜损伤。Abstract: Objective: To investigate the effect and mechanism of astaxanthin on retinal damage in diabetes mice. Methods: The mice were randomly divided into four groups: Normal group, model group, low-dose astaxanthin group and high-dose astaxanthin group. Retinal injury model of diabetes mice induced by intraperitoneal injection of streptozotocin (STZ) combined with high-fat diet. The fasting blood glucose and insulin resistance were measured by blood glucose meter. The levels of malondialdehyde (MDA) and Fe2+, the activities of glutathione peroxidase (GSH-PX) and superoxide dismutase (SOD) in mouse retina were measured by spectrophotometry. The expression levels of glutathione peroxidase 4 (GPX4), nuclear factor E2 related factor 2 (Nrf2), transferrin receptor 1 (TFR1), and ferritin heavy chain 1 (FTH1) in mouse retina were determined by immunoblotting. Observating the pathological changes of mice retina in each group using HE staining method. Results: The astaxanthin could reduce the level of fasting blood glucose in diabetic mice (P<0.05, P<0.01) and high dose of astaxanthin could ameliorate the insulin resistance of diabetic mice (P<0.01). Astaxanthin could reduce the contents of MDA and Fe2+ in the retina of diabetes mice, and increased the activities of GSH-PX and SOD (P<0.05, P<0.01). In addition, the results of Western blotting showed that astaxanthin could significantly increase the expression of GPX4, Nrf2, FTH1 protein in the retina of diabetes mice, and reduced the expression of TFR1 protein (P<0.05, P<0.01). The pathological section results showed that, after the intervention of astaxanthin, the damage of mouse retinal inner nuclear layer cells, outer nuclear layer cells and mouse retinal ganglion cell layer were significantly reduced. Conclusion: Astaxanthin could inhibit ferroptosis through antioxidation and up-regulation of Nrf2/GPX4 signaling pathway, and alleviate retinal damage in diabetes.
-
Keywords:
- astaxanthin /
- ferroptosis /
- diabetes mellitus /
- retina
-
据报道,到2035年,全球患有糖尿病的人数将突破5.92亿[1],而糖尿病引发的视网膜病变患者人数也会明显增加,因而寻找有效的治疗糖尿病视网膜病变的药物迫在眉睫。糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的并发症之一,主要以视网膜血管失调为特征,如不进行及时治疗,极易引起视网膜损伤,甚至失明,严重降低了患者的生活质量。
大量研究显示,氧化应激是导致糖尿病视网膜损伤的主要因素[2−3]。当机体长期处于高糖状态下,体内的氧自由基增加,造成脂质过氧化,体内的抗氧化系统发生紊乱,最终导致细胞DNA损伤。近年来,越来越多的科研人员发现眼科疾病的发生发展与铁死亡有着密切的联系,为探究眼科疾病的发病机制及治疗手段提供了新的途径[4−5]。铁死亡是一种以细胞内亚铁离子过度堆积导致脂质过氧化为特征的程序性细胞死亡方式,其细胞死亡特征与凋亡细胞明显不同,多呈现线粒体皱缩,膜密度增大等特点[6−7]。有研究发现,当细胞内铁代谢紊乱时,谷胱甘肽(GSH)循环出现明显异常,导致细胞能量代谢紊乱,进一步加剧铁死亡,形成恶行循环。近年来,研究发现核转录因子(Nrf2)蛋白的上调,可以明显提升细胞的抗氧化能力,在介导细胞铁死亡过程中发挥着关键作用[8]。介于氧化应激与铁死亡之间的密切联系,抗氧化剂作为一种潜在的治疗视网膜损伤的药物成为研究的热点。如有研究发现矢车菊素-3-葡萄糖苷、槲皮素、姜黄素等都可以通过抗氧化作用改善多种原因引起的视网膜损伤[9−10]。虾青素广泛存在于自然界当中,结构中富含多个不饱和键和酚羟基,具有优越的抗氧化能力,而且虾青素具有优秀的脂溶性,可顺利的通过血脑屏障[11−14]。已有研究发现,虾青素不仅可通过有效清除细胞内氧自由基,改善心血管疾病及糖尿病的症状[15],还可通过上调Nrf2通路,调控氧化应激,控制炎症从而发挥其保护作用[16]。有文献报道,虾青素对链脲佐菌素诱导的糖尿病大鼠具有较好的降糖作用,而且近期研究发现虾青素对于高糖诱导的晶状体上皮细胞损伤具有较好的改善作用[17−18],其是否可以通过调控铁死亡信号通路改善糖尿病导致的小鼠视网膜损伤,尚未有文献报道。
因此,本研究以注射链脲佐菌素联合使用高脂饲料,构建2型糖尿病小鼠视网膜损伤模型,并基于Nrf2介导的铁死亡信号通路,探究虾青素改善糖尿病视网膜损伤的作用,研究结果为虾青素的应用提供理论基础。
1. 材料与方法
1.1 材料与仪器
SPF级C57BL/6J雄性小鼠 4周龄,40只,体重18~22 g,江苏集萃药康生物科技有限公司,实验动物使用许可证SYXK(苏)2020-0001;普通饲料、高脂饲料(88%普通饲料,2%的胆固醇,10%的猪油) 江苏协同医药生物公司;链脲佐菌素 金克隆生物技术有限公司;虾青素 (CAS:472-61-7,含量≥98%) 陕西康盛生物技术有限公司;橄榄油 化学纯,CAS:8001-25-0 上海国药集团;MDA测定试剂盒(批号20210804)、GSH-PX测定试剂盒(批号20210826)、SOD测定试剂盒(批号20210613) 南京建成生物工程研究所;Fe2+比色法测定试剂盒 (批号E-BC-K772-M) Elabscience公司;兔抗小鼠GPX-4(批号DF6701)、兔抗小鼠NRF-2(批号AF0639)、兔抗小鼠FTH1(批号DF6278) 美国Affinity公司;兔抗小鼠TR1抗体(批号17435-1-AP) Proteintech中国公司。
HT-300型小型垂直蛋白电泳系统 美国Bio-Rad公司;CM3050S冰冻切片机 德国Leica公司;CV5030-ST5020染色封片工作站 德国Leica公司;BX53型生物显微镜 日本Olympus公司;Rt-6100酶标仪 美国Rayto公司。
1.2 实验方法
1.2.1 实验动物及分组处理
本实验的开展通过了江苏卫生健康职业学院动物福利伦理审查(批号:JHVC-IACUC-2022-B004),将小鼠随机分为正常组、模型组、虾青素低剂量组和虾青素高剂量组,除正常组之外,其余各组均以高脂饲料进行喂养,每组10只,模型组和给药组小鼠按照体重(60 mg/kg)剂量腹腔注射链脲佐菌素,连续注射5 d,第7 d时,剪尾取血检测血糖,血糖值≥11.1 mol/L时,表示模型构建成功。正常组注射相同体积的柠檬酸缓冲液,连续注射5 d。模型构建成功后,虾青素低、高剂量组每日灌胃给药剂量分别为100、200 mg/kg[19],正常组和模型组给予相同体积的溶媒对照,连续灌胃14周。
1.2.2 小鼠日常状态及空腹血糖检测
在实验过程中,每周分别观察并记录小鼠运动状态、摄食量、毛发变化,垫料潮湿程度,每周进行一次体重称量,每两周进行一次空腹血糖测定,血糖测定时,用消毒后的剪刀剪去小鼠的部分尾巴,挤出部分血液,采用血糖仪和血糖试纸检测空腹血糖尾浓度并记录,观察各组小鼠体重及血糖变化。
1.2.3 各组小鼠胰岛素抵抗情况检测
胰岛素抵抗实验开始前,所有小鼠进行禁食12 h,中途不禁水,禁食完成后腹腔注射1 U/kg的胰岛素,并在注射胰岛素后的0、0.5、1.0、1.5、2.0 h对小鼠进行剪尾取血,使用血糖仪和血糖试纸进行血糖测定。
1.2.4 分光光度法检测小鼠血清中氧化应激相关指标及Fe2+含量
给药结束后,采用弯镊摘除眼球,收集血液,静止1.5 h,在4 ℃和3500 r/min的条件下离心10 min分离血清,每组取10只。根据试剂盒测定说明书分别测定小鼠视网膜中MDA和Fe2+含量以及GSH-PX和SOD的活性。
1.2.5 HE染色观察各组小鼠视网膜病理学变化
给药结束后,每组取3只小鼠,取出眼球后放入40 g·L−1多聚甲醛中固定,固定后进行石蜡包埋,切片。石蜡切片后采用HE染色观察小鼠视网膜病理学变化,步骤如下,二甲苯脱蜡20 min×2次;依次采用100%、95%、80%、75%的乙醇进行水化,其中100%和95%的乙醇水化2次,80%和75%的乙醇水化1次,每次10 min;苏木素染色10 min;采用5%的乙酸分化1 min,流水冲洗,用吸管滴加乙酸,布满玻片上的组织即可,分化后颜色变浅,成为蓝色;返蓝;伊红染色1 min;采用70%、80%、90%、100%乙醇各10 s,二甲苯1 min进行脱水,自然晾干,采用中性树脂封片,倒置显微镜观察拍照。
1.2.6 Western blot检测
称量视网膜组织重量,按照裂解液(RIPA):蛋白酶抑制剂(PMSF):磷酸酯酶抑制剂:氟化钠体积比为100:1:1:2配制匀浆液,按照匀浆液(mL)体积:组织重量(g)为7.5:1进行混合,操作过程在冰浴中进行,制备好的匀浆液于4 ℃和12000 r/min的条件下离心10 min,移液枪吸取上清,采用BCA试剂盒确定蛋白浓度。
采用8%的梯度分离胶进行上样,用梯度胶配套的电泳液进行电泳,条件为恒压160 V,45 min;转膜:采用湿转法转膜,转膜过程中使用冰盒和碎冰降温,恒流转膜350 mA,40 min,抗体稀释均按照抗体体积:一抗稀释液进行配制,比例如下[Nrf2(1:1000)、GPX4(1:1000)、FTH1(1:1000)、TFR1(1:1000)],转膜后封闭,一抗过夜孵育、二抗孵育、显色,扫描,分析目的条带灰度值。
1.3 数据处理
采用SPSS 18.0软件分析数据。根据数据特征采用不同的数据分析方法,方差齐采用最小显著差数(least significant difference,LSD)法,方差不齐采用新复极差法检验(Duncan’s new multiple range test,Dunnett T3)法。检验水准:α=0.05。
2. 结果与分析
2.1 虾青素对小鼠一般状态的影响
实验过程中,观察并记录小鼠一般状态变化,结果如表1所示。与对照组相比,模型组小鼠摄食量增加、毛发不顺滑、状态不活跃,垫料极潮湿,表现出典型的糖尿病特征。与模型组相比,虾青素低高剂量组小鼠摄食量减少、毛发较顺滑、状态相对活跃,垫料潮湿程度较小,说明虾青素具有一定的改善糖尿病的效果。
表 1 虾青素对小鼠一般状态的影响(n=10)Table 1. Effect of astaxanthin on general state of mice (n=10)组别 摄食情况 毛发情况 运动情况 垫料 正常组 正常 毛发顺滑 活跃 干燥 模型组 多 毛发不顺滑,粗糙 不活跃 非常潮湿 虾青素低剂量组 较少 毛发较顺滑 较活跃 较干燥 虾青素高剂量组 较少 毛发较顺滑 较活跃 较干燥 注:模型组均与正常组相比,给药组均与模型组相比。 2.2 虾青素对小鼠体重和血糖浓度的影响
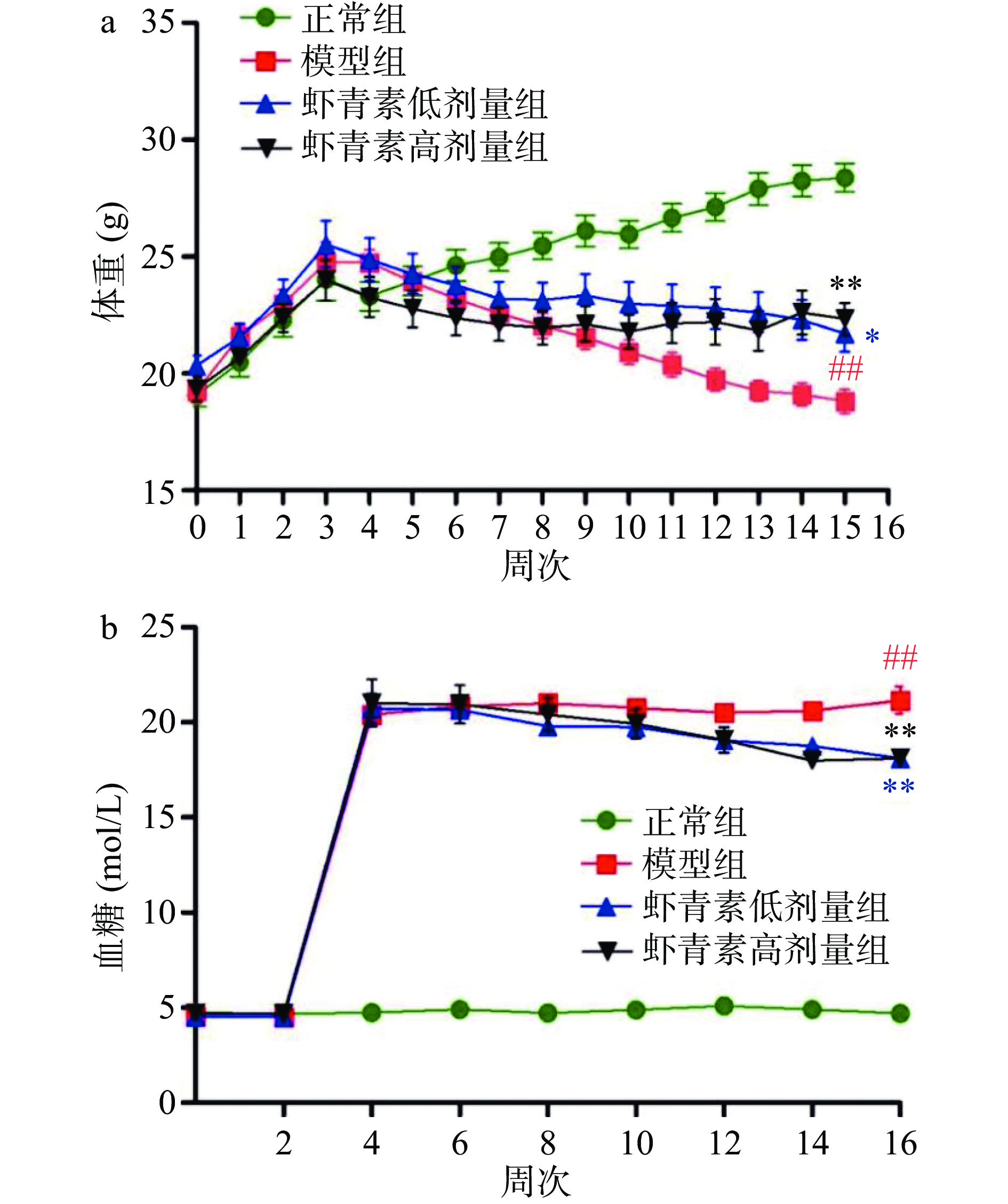
如图1a所示,实验开始时,各组小鼠体重无差异,实验结束时,与正常组相比,模型组小鼠体重极显著下降(P<0.01);与模型组相比,虾青素低剂量组小鼠显著体重升高(P<0.05),高剂量组小鼠体重极显著升高(P<0.01)。实验开始时,各组小鼠空腹血糖无明显差异(图1b),实验结束时,与正常组相比,模型组小鼠空腹血糖极显著升高(P<0.01);与模型组相比,虾青素低高剂量组小鼠空腹血糖均极显著降低(P<0.01)。
![]() 图 1 虾青素对小鼠体重和血糖浓度的影响(n=10)注:与正常组相比,##表示极显著差异,P<0.01;与模型组相比,*表示显著性差异,P<0.05,**表示极显著差异,P<0.01;图2、图4同。Figure 1. Effects of astaxanthin on body weight and blood glucose concentration in mice (n=10)
图 1 虾青素对小鼠体重和血糖浓度的影响(n=10)注:与正常组相比,##表示极显著差异,P<0.01;与模型组相比,*表示显著性差异,P<0.05,**表示极显著差异,P<0.01;图2、图4同。Figure 1. Effects of astaxanthin on body weight and blood glucose concentration in mice (n=10)2.3 虾青素对糖尿病小鼠视网膜氧化应激能力及Fe2+含量的影响
各组小鼠视网膜组织中氧化应激能力变化如表2所示,与正常组相比,模型组小鼠视网膜中MDA水平极显著升高(P<0.01),GSH-PX活性,SOD活性极显著降低(P<0.01),Fe2+含量极显著升高(P<0.01);与模型组相比,虾青素低高剂量组小鼠视网膜中GSH-PX活性和SOD活性显著升高(P<0.05,P<0.01),MDA水平和Fe2+含量显著降低(P<0.05,P<0.01)。
表 2 虾青素对小鼠视网膜中GSH-PX活性、SOD活性及MDA、Fe2+含量的影响($\overline{\mathrm{x}} $±s,n=6)Table 2. Effects of astaxanthin on GSH-PX activity, SOD activity, MDA, Fe2+content in mouse retina ($\overline{\mathrm{x}} $±s, n=6)组别 SOD活性
(U/mgprot)GSH-PX活性
(U/mgprot)MDA含量
(μmol/gprot)Fe2+含量
(μmol/gprot)正常组 129±11.98 66.22±9.54 49.05±10.23 9.81±1.02 模型组 59.09±12.66## 36.91±7.18## 84.09±10.19## 21.25±2.82## 虾青素低剂量组 83.21±12.33* 55.88±10.45* 61.69±11.07* 17.09±2.29* 虾青素高剂量组 93.71±16.59** 61.52±10.49** 53.92±11.82** 16.67±2.35** 注:与正常组相比,##表示数据差异极显著,P<0.01;与模型组相比,*表示数据差异显著P<0.05,**表示数据差异极显著,P<0.01。 2.4 虾青素对小鼠胰岛素抵抗情况的影响
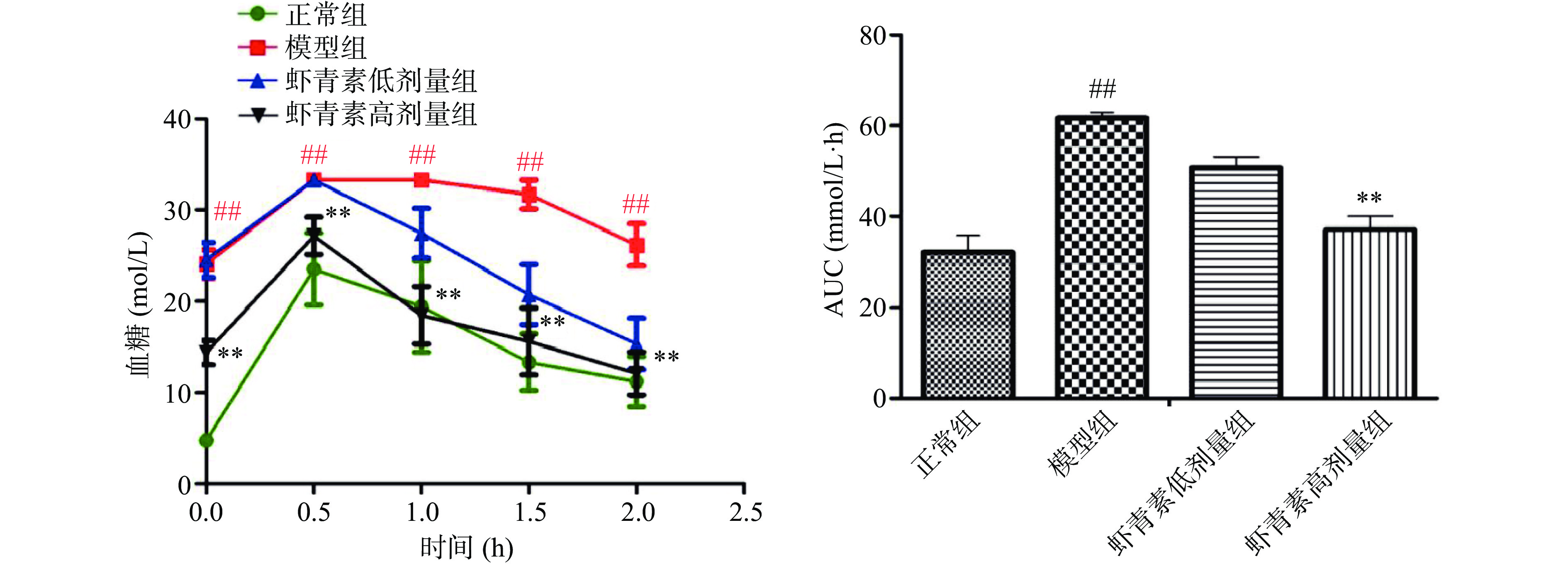
各组小鼠胰岛素抵抗情况如图2所示,与正常组相比,模型组小鼠出现明显的胰岛素抵抗现象(P<0.01);与模型组相比,虾青素低剂量组胰岛素抵抗现象没有明显改善,虾青素高剂量组胰岛素抵抗现象得到显著改善(P<0.01)。
2.5 虾青素对糖尿病小鼠视网膜病理学变化的影响
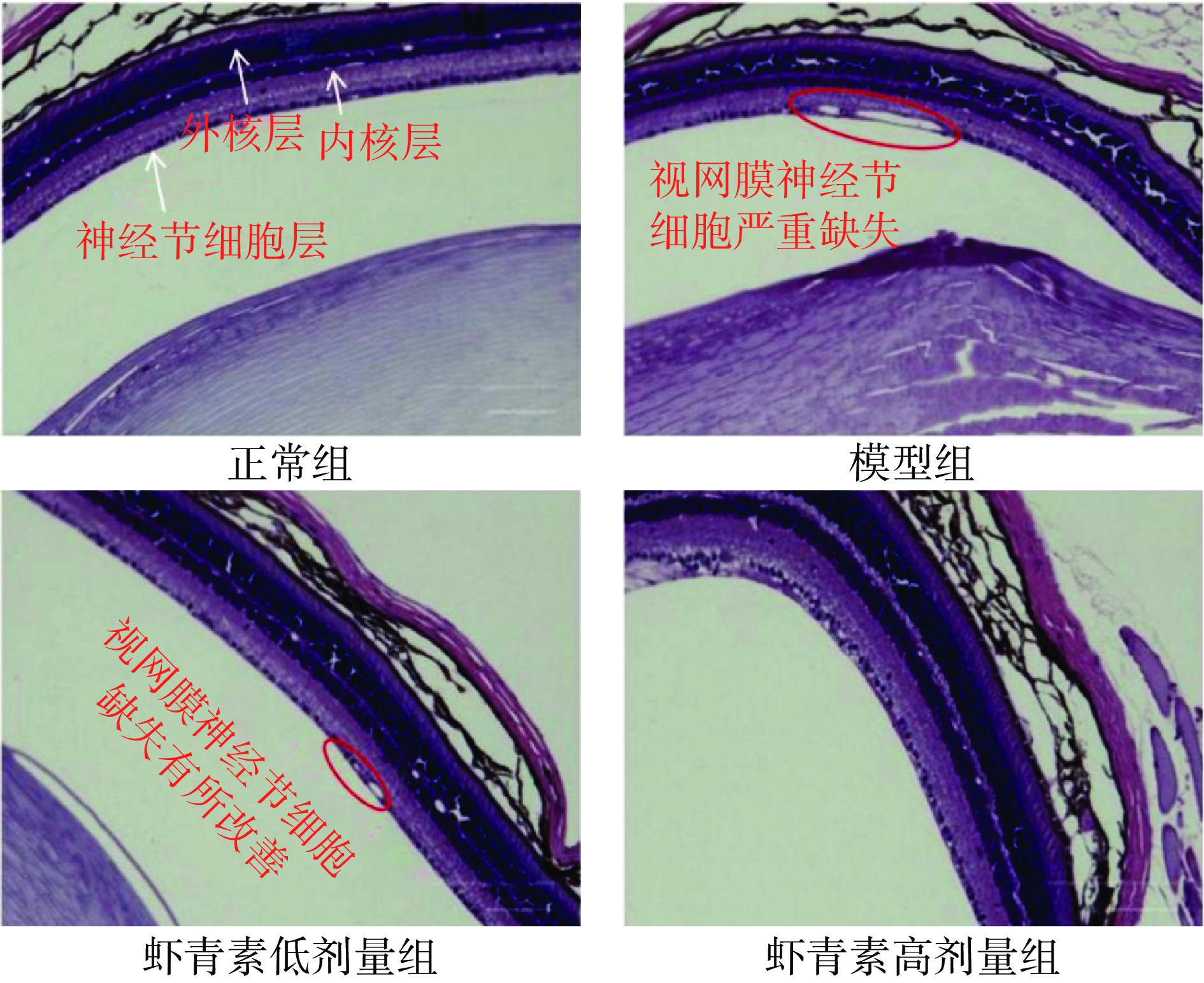
各组小鼠视网膜病理学变化如图3所示,正常组小鼠神经节细胞层,内外核层细胞排列紧密、整齐、规则;模型组小鼠神经节细胞层出现了较大面积的缺失,外核层细胞数量明显减少,排列松散;与模型组相比,虾青素低剂量组小鼠视网膜神经节细胞层有所改善,缺失面积明显减少,细胞排列良好,内外核层轻度紊乱;高剂量组,小鼠视网膜组织结构进一步得到改善。
2.6 虾青素对糖尿病小鼠视网膜中Nrf2和GPX4蛋白及铁死亡相关蛋白的影响
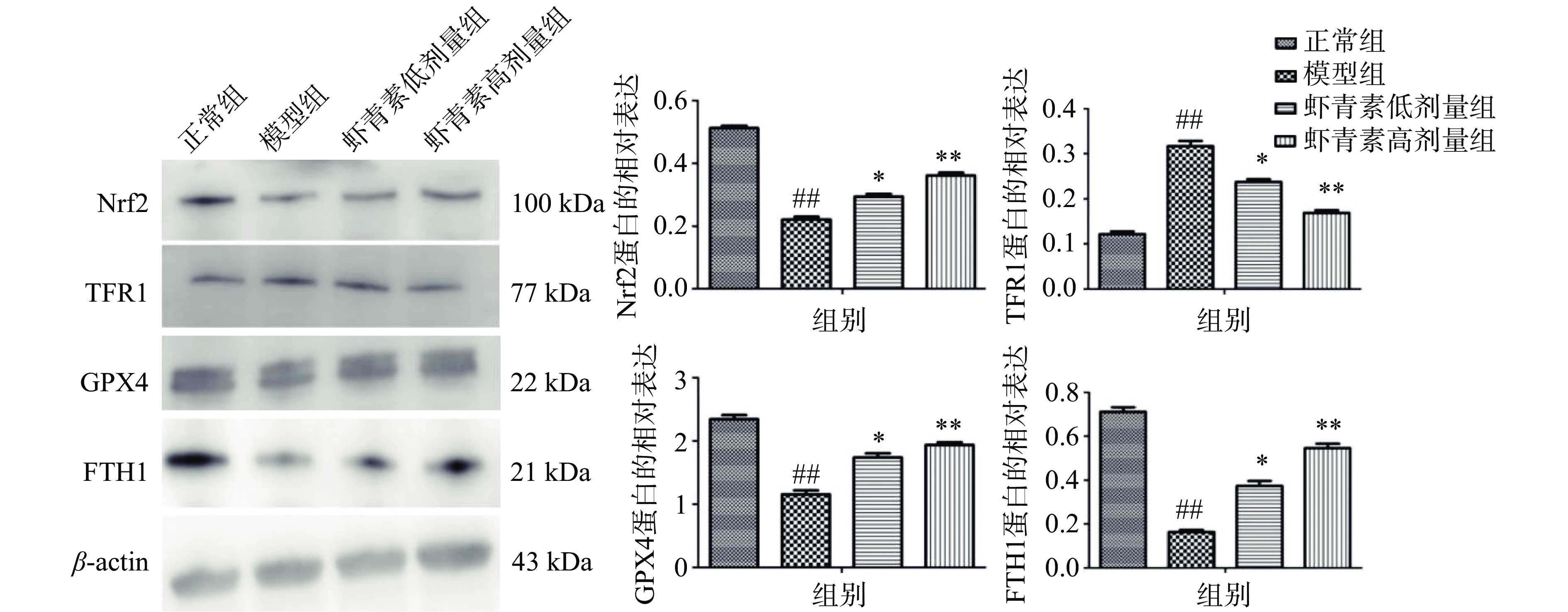
如图4所示,与正常组相比,模型组小鼠视网膜组织中Nrf2、GPX4、FTH1蛋白表达极显著降低(P<0.01),TFR1蛋白表达极显著升高(P<0.01);给予虾青素进行干预后,与模型组相比,虾青素低高剂量组小鼠视网膜组织中Nrf2、GPX4、FTH1蛋白表达显著升高(P<0.05,P<0.01),虾青素低高剂量组小鼠视网膜组织中TFR1蛋白表达显著降低(P<0.05,P<0.01)。
3. 讨论与结论
本研究通过注射链脲佐菌素联合使用高脂饲料,构建2型糖尿病小鼠视网膜损伤模型,并采用虾青素对糖尿病引起的视网膜损伤进行有效的干预,结果发现虾青素可以通过调控Nrf2/Gpx4信号通路抑制铁死亡减轻糖尿病小鼠视网膜损伤。
结果显示,长期高糖状态可以明显降低小鼠视网膜中SOD和GSH-PX活性,升高MDA含量,造成小鼠视网膜组织中氧化应激失衡,而虾青素可以有效提升视网膜中抗氧化酶的活性,增加脂质过氧化产物的清除率,发挥改善作用,与杨倩等[19]的研究结果一致。另外,本实验研究还发现,糖尿病小鼠视网膜中的亚铁离子含量明显高于正常组小鼠,并且近年来有研究显示,铁死亡的重要特征之一也是脂质过氧化堆积和氧化系统失衡,进一步印证了糖尿病导致的视网膜损伤与细胞内铁代谢紊乱密切相关[20]。此外,胰岛素抵抗是糖尿病代谢紊乱的重要原因,而过量的铁离子可以催化脂质氧化,增加糖异生,进一步促进胰岛素抵抗的发生。
Nrf2是调控氧化应激系统参与免疫应答的重要转录因子,在铁死亡发生过程中,扮演着重要的角色,可靶向调控一系列氧化还原相关基因,对铁死亡起到调控作用。GPX4是清除脂质过氧化物的关键酶,并且有研究发现,GPX4是Nrf2调控的重要靶标[21],Nrf2的抑制均可降低GPX4的表达[22−23]。TFR1作为一种跨膜运输蛋白,可以与Fe3+结合,增加细胞内铁的摄取[24]。当细胞内出现铁超载时,大量的Fe2+堆积,引发芬顿反应,活性氧和脂质过氧化物被大量释放,最终导致细胞死亡[25]。多项研究表明,铁死亡参与的多种疾病模型中均出现TFR1表达升高的结果,因此其过量表达被认为是铁死亡的重要标志之一[26−30]。铁蛋白是机体最主要的铁储存仓库,主要由2种多肽链(FTL和FTH)组成,其作用主要是通过储存细胞内游离的铁离子,从而维持细胞铁稳态。本研究结果发现,长期高糖状态可以明显降低铁死亡标志物GPX4和FTH蛋白的表达,升高TFR1的表达,说明糖尿病导致的视网膜损伤确实与Nrf2介导的铁死亡密切相关。给予虾青素干预后,与模型组相比,小鼠视网膜组织中铁死亡标志物GPX4和FTH蛋白的表达显著升高(P<0.05,P<0.01),TFR1的表达显著降低(P<0.05,P<0.01),而在虾青素干预过程中Nrf2蛋白的表达明显升高,并且已有文献报道,虾青素可以通过上调Nrf2蛋白的表达,抑制氧化应激反应,改善糖尿病引发的肾损伤[31−32]。因此,本实验结果说明,虾青素可以通过上调Nrf2/GPX4信号通路抑制铁死亡发挥改善糖尿病视网膜损伤的作用。
综上所述,虾青素可以通过激活Nrf2/GPX4信号通路,抑制铁死亡改善糖尿病导致的视网膜损伤,但是调控铁死亡的信号通路多种多样,虾青素是否还通过其它信号通路发挥改善作用,需要进行进一步的研究。
-
图 1 虾青素对小鼠体重和血糖浓度的影响(n=10)
注:与正常组相比,##表示极显著差异,P<0.01;与模型组相比,*表示显著性差异,P<0.05,**表示极显著差异,P<0.01;图2、图4同。
Figure 1. Effects of astaxanthin on body weight and blood glucose concentration in mice (n=10)
表 1 虾青素对小鼠一般状态的影响(n=10)
Table 1 Effect of astaxanthin on general state of mice (n=10)
组别 摄食情况 毛发情况 运动情况 垫料 正常组 正常 毛发顺滑 活跃 干燥 模型组 多 毛发不顺滑,粗糙 不活跃 非常潮湿 虾青素低剂量组 较少 毛发较顺滑 较活跃 较干燥 虾青素高剂量组 较少 毛发较顺滑 较活跃 较干燥 注:模型组均与正常组相比,给药组均与模型组相比。 表 2 虾青素对小鼠视网膜中GSH-PX活性、SOD活性及MDA、Fe2+含量的影响(¯x±s,n=6)
Table 2 Effects of astaxanthin on GSH-PX activity, SOD activity, MDA, Fe2+content in mouse retina (¯x±s, n=6)
组别 SOD活性
(U/mgprot)GSH-PX活性
(U/mgprot)MDA含量
(μmol/gprot)Fe2+含量
(μmol/gprot)正常组 129±11.98 66.22±9.54 49.05±10.23 9.81±1.02 模型组 59.09±12.66## 36.91±7.18## 84.09±10.19## 21.25±2.82## 虾青素低剂量组 83.21±12.33* 55.88±10.45* 61.69±11.07* 17.09±2.29* 虾青素高剂量组 93.71±16.59** 61.52±10.49** 53.92±11.82** 16.67±2.35** 注:与正常组相比,##表示数据差异极显著,P<0.01;与模型组相比,*表示数据差异显著P<0.05,**表示数据差异极显著,P<0.01。 -
[1] 彭清华. 糖尿病视网膜病变中西医结合研究现状[J]. 中国中西医结合杂志,2021,41(6):660−662. [PENG Q H. Research status of integrated traditional and western medicine in diabetes retinopathy[J]. Chinese Journal of Integrated Traditional and Western Medicine,2021,41(6):660−662.] PENG Q H . Research status of integrated traditional and western medicine in diabetes retinopathy[J]. Chinese Journal of Integrated Traditional and Western Medicine,2021 ,41 (6 ):660 −662 .[2] ANDRES B I, GALLEGO M A, MACHADO X, et al. Oxidative stress, inflammatory, angiogenic, and apoptotic molecules in proliferative diabetic retinopathy and diabetic macular edema patients[J]. Int J Mol Sci,2023,24(9):822−836.
[3] YANG X L, LI D L. Tricin attenuates diabetic retinopathy by inhibiting oxidative stress and angiogenesis through regulating Sestrin2/Nrf2 signaling[J]. Hum Exp Toxicol,2023,42(6):1228−1244.
[4] BONET A, PAMPALONA J, JOSE C E, et al. Ferritin but not iron increases in retina upon systemic iron overload in diabetic and iron-dextran injected mice[J]. Invest Ophthalmol Vis Sci,2023,64(3):1022−1044.
[5] 董欣. 铁死亡与视网膜疾病的相关性研究进展[J]. 眼科新进展,2022,42(12):984−988. [DONG X. Research progress on the correlation between ferroptosis and retinal diseases[J]. New Advances in Ophthalmology,2022,42(12):984−988.] DONG X . Research progress on the correlation between ferroptosis and retinal diseases[J]. New Advances in Ophthalmology,2022 ,42 (12 ):984 −988 .[6] 刘泽鑫, 曹赛, 陈清, 等. MicroRNA-132通过诱导线粒体氧化应激障碍-铁死亡进程促进动脉粥样硬化[J]. 南方医科大学学报,2022,42(1):143−149. [LIU Z X, CAO S, CHEN Q, et al. MicroRNA-132 promotes atherosclerosis by inducing mitochondrial oxidative stress disorder iron death process[J]. Journal of Southern Medical University,2022,42(1):143−149.] LIU Z X, CAO S, CHEN Q, et al . MicroRNA-132 promotes atherosclerosis by inducing mitochondrial oxidative stress disorder iron death process[J]. Journal of Southern Medical University,2022 ,42 (1 ):143 −149 .[7] 吴娜, 万治平, 曾娟, 等. 黄芩汤对溃疡性结肠炎小鼠氧化应激及铁死亡相关指标GSH-Px4, P53, SLC7A11的影响[J]. 中国实验方剂学杂志,2021,27(8):17−24. [WU N, WAN Z P, ZENG J, et al. Huangqin Tang on oxidative stress and iron death related indicators GSH-Px4 in mice with ulcerative colitis, The impact of P53 and SLC7A11[J]. Chinese Journal of Experimental Prescriptions,2021,27(8):17−24.] WU N, WAN Z P, ZENG J, et al . Huangqin Tang on oxidative stress and iron death related indicators GSH-Px4 in mice with ulcerative colitis, The impact of P53 and SLC7A11[J]. Chinese Journal of Experimental Prescriptions,2021 ,27 (8 ):17 −24 .[8] 王艳, 孙照阳, 任欣会, 等. 姜黄素通过Nrf2/HO-1通路抑制高糖诱导的Neuro-2a细胞铁死亡的作用[J]. 福建医科大学学报,2023,57(2):79−88. [WANG Y, SUN Z Y, REN X H, et al. Curcumin inhibits high glucose-induced iron death in Neuro-2a cells through Nrf2/HO-1 pathway[J]. Acta Fujian Medical University,2023,57(2):79−88.] doi: 10.3969/j.issn.1672-4194.2023.02.002 WANG Y, SUN Z Y, REN X H, et al . Curcumin inhibits high glucose-induced iron death in Neuro-2a cells through Nrf2/HO-1 pathway[J]. Acta Fujian Medical University,2023 ,57 (2 ):79 −88 . doi: 10.3969/j.issn.1672-4194.2023.02.002[9] 裴涌, 郝旭红, 孙晓楠. 姜黄素在缺氧致视网膜神经节细胞氧化应激损伤中的作用及机制[J]. 中国医科大学学报,2016,45(3):227−229. [PEI Y, HAO X H, SUN X N. The role and mechanism of curcumin in oxidative stress injury of retinal ganglion cell induced by hypoxia[J]. Journal of China Medical University,2016,45(3):227−229.] doi: 10.12007/j.issn.0258-4646.2016.03.009 PEI Y, HAO X H, SUN X N . The role and mechanism of curcumin in oxidative stress injury of retinal ganglion cell induced by hypoxia[J]. Journal of China Medical University,2016 ,45 (3 ):227 −229 . doi: 10.12007/j.issn.0258-4646.2016.03.009[10] 朱素华, 张曼, 徐圣秋. 槲皮素对糖尿病视网膜病变小鼠氧化应激损伤和炎症反应的影响[J]. 药学与临床研究,2023,31(1):48−52. [ZHU S H, ZHANG M, XU S Q. Effects of quercetin on oxidative stress injury and inflammatory response in mice with diabetes retinopathy[J]. Pharmaceutical and Clinical Research,2023,31(1):48−52.] doi: 10.13664/j.cnki.pcr.2023.01.003 ZHU S H, ZHANG M, XU S Q . Effects of quercetin on oxidative stress injury and inflammatory response in mice with diabetes retinopathy[J]. Pharmaceutical and Clinical Research,2023 ,31 (1 ):48 −52 . doi: 10.13664/j.cnki.pcr.2023.01.003[11] SHI H Y, DENG X J, JI X Y, et al. Sources, dynamics in vivo, and application of astaxanthin and lutein in laying hens:A review[J]. Anim Nutr,2023,2(13):324−333.
[12] LIN X J, BO H J, GU J, et al. Astaxanthin, a carotenoid antioxidant, pretreatment alleviates cognitive deficits in aircraft noised mice by attenuating inflammatory and oxidative damage to the gut, heart and hippocampus[J]. Biomed Pharmacother,2022,64(2):148−156.
[13] QIANG J, TAO Y F, LU S Q, et al. Role of astaxanthin as a stimulator of ovarian development in Nile tilapia (Oreochromis niloticus) and its potential regulatory mechanism:ameliorating oxidative stress and apoptosis[J]. Aquac Nutr, 2022, 2022:1245151.
[14] 张景正, 许晨新, 陈娴. 虾青素对D-半乳糖致衰老小鼠认知功能障碍的改善作用及机制研究[J]. 食品安全质量检测学报,2022,13(22):7461−7468. [ZHANG J Z, XU C X, CHEN X. Study on the improvement effect and mechanism of astaxanthin on cognitive dysfunction of aging mice induced by D-nenenebb galactose[J]. Journal of Food Safety and Quality Inspection,2022,13(22):7461−7468.] ZHANG J Z, XU C X, CHEN X . Study on the improvement effect and mechanism of astaxanthin on cognitive dysfunction of aging mice induced by D-nenenebb galactose[J]. Journal of Food Safety and Quality Inspection,2022 ,13 (22 ):7461 −7468 .[15] 赵英源, 刘俊霞, 陈姝彤, 等. 虾青素生理活性的研究进展[J]. 中国海洋药物, 2020, 39(3):80-88. [ZHAO Y Y, LIU J X , CHEN S T, et al. Research progress on the physiological activity of astaxanthin [J]. China Marine Medicine, 2020, 39 (3):80-88.] ZHAO Y Y, LIU J X , CHEN S T, et al. Research progress on the physiological activity of astaxanthin [J]. China Marine Medicine, 2020, 39 (3): 80-88.
[16] 陆婵君, 郭艺, 胡可, 等. 虾青素通过调控Nrf2通路在心血管疾病中发挥保护作用的研究进展[J]. 中国新药与临床杂志:2023, 23(6):1-9. [LU C J, GUO Y, HU K, et al. Research progress on astaxanthin's protective role in cardiovascular disease by regulating Nrf2 pathway [J]. Chinese Journal of New Drugs and Clinical Sciences:2023, 23(6):1-9.] LU C J, GUO Y, HU K, et al. Research progress on astaxanthin's protective role in cardiovascular disease by regulating Nrf2 pathway [J]. Chinese Journal of New Drugs and Clinical Sciences: 2023, 23(6): 1-9.
[17] 吕亭亭, 桂定坤, 葛声. 虾青素对db/db小鼠糖尿病肾病的保护作用[J]. 中国食物与营养,2021,27(9):69−73. [LÜ T T, GUI D K, GE S. Protective effect of astaxanthin on diabetic nephropathy in db/db mice[J]. Chinese Food and Nutrition,2021,27(9):69−73.] LÜ T T, GUI D K, GE S . Protective effect of astaxanthin on diabetic nephropathy in db/db mice[J]. Chinese Food and Nutrition,2021 ,27 (9 ):69 −73 .[18] 张露, 赵芳, 杨万举, 等. 虾青素预处理抑制高糖作用下晶状体上皮细胞损伤的机制[J]. 中国老年学杂志,2022,42(17):4321−4325. [ZHANG L, ZHAO F, YANG W J, et al. Mechanism of astaxanthin pretreatment inhibiting lens epithelial cell injury under high glucose[J]. Chinese Journal of Gerontology,2022,42(17):4321−4325.] doi: 10.3969/j.issn.1005-9202.2022.17.048 ZHANG L, ZHAO F, YANG W J, et al . Mechanism of astaxanthin pretreatment inhibiting lens epithelial cell injury under high glucose[J]. Chinese Journal of Gerontology,2022 ,42 (17 ):4321 −4325 . doi: 10.3969/j.issn.1005-9202.2022.17.048[19] 杨倩, 刘媛, 李威威. 虾青素对2型糖尿病大鼠视网膜病变的干预作用及机制研究[J]. 中南医学科学杂志,2020,48(5):505−508. [YANG Q, LIU Y, LI W W. Study on the intervention effect and mechanism of astaxanthin on retinopathy in type 2 diabetes rats[J]. Zhongnan Journal of Medical Sciences,2020,48(5):505−508.] YANG Q, LIU Y, LI W W . Study on the intervention effect and mechanism of astaxanthin on retinopathy in type 2 diabetes rats[J]. Zhongnan Journal of Medical Sciences,2020 ,48 (5 ):505 −508 .[20] FERNANDEZ M, LOKAN J, LEUNG C, et al. A critical evaluation of the role of iron overload in fatty liver disease[J]. J Gastroenterol Hepatol,2022,37(10):1873−1883. doi: 10.1111/jgh.15971
[21] OSBURN W O, WAKABAYASHI N, MISRA V, et al. Nrf2 regulates an adaptive response protecting against oxidative damage following diquat-mediated formation of superoxide anion[J]. Arch Biochem Biophys,2006,454(1):7−15. doi: 10.1016/j.abb.2006.08.005
[22] LU H Y, XIAO H, DAI M Y, et al. Britanin relieves ferroptosis-mediated myocardial ischaemia/reperfusion damage by upregulating GPX4 through activation of AMPK/GSK3beta/Nrf2 signalling[J]. Pharm Biol,2022,60(1):38−45. doi: 10.1080/13880209.2021.2007269
[23] YANG W C, WANG Y X, ZHANG C G, et al. Maresin1 protect against ferroptosis-induced liver injury through ROS inhibition and Nrf2/HO-1/GPX4 activation[J]. Front in Pharmacol,2022,13:865−876.
[24] PARK E, CHUNG S W. ROS-mediated autophagy increases intracellular iron levels and ferroptosis by ferritin and transferrin receptor regulation[J]. Cell Death Dis,2019,10:822−834. doi: 10.1038/s41419-019-2064-5
[25] ILLES E, PATRA S G, MARKS V, et al. The Fe (citrate) fenton reaction under physiological conditions[J]. J Inorg Biochem,2020,206:111−118.
[26] FENG H, SCHORPP K, JIN J, et al. Transferrin receptor is a specific ferroptosis marker[J]. Cell Rep,2020,30:341−354.
[27] GAO G, XIE Z S, LI E W, et al. Dehydroabietic acid improves nonalcoholic fatty liver disease through activating the Keap1/Nrf2- ARE signaling pathway to reduce ferroptosis[J]. J Nat Med,2021,75(3):540−552. doi: 10.1007/s11418-021-01491-4
[28] YANG C J, WU A M, TAN L Q, et al. Epigallocatechin-3-gallate alleviates liver oxidative damage caused by iron overload in mice through inhibiting ferroptosis[J]. Nutrients,2023,15(8):1993−2015. doi: 10.3390/nu15081993
[29] DENG L, MO M Q, ZHONG J et al. Iron overload induces islet β cell ferroptosis by activating ASK1/P-P38/CHOP signaling pathway[J]. Peer J,2023,18(6):152−168.
[30] GUO T L, YU Y, YAN W H, et al. Erythropoietin ameliorates cognitive dysfunction in mice with type 2 diabetes mellitus via inhibiting iron overload and ferroptosis[J]. Exp Neurol,2023,16(9):365−386.
[31] ZHU X Y, CHEN Y J, CHEN Q, et al. Astaxanthin promotes Nrf2/ARE signaling to alleviate renal fibronectin and collagen IV accumulation in diabetic rats[J]. J Diabetes Res,2018,21(9):673−688.
[32] ASHRAFIZADEH M, AHMADI Z, YARIBEYGI H, et al. Astaxanthin and Nrf2 signaling pathway:A novel target for new therapeutic approaches[J]. Mini Rev Med Chem,2022,22(2):312−321. doi: 10.2174/1389557521666210505112834





 下载:
下载:
 下载:
下载:



