Optimization of Extraction Process by Response Surface Method and Analysis of Antioxidant Activity in Vitro of Total Flavonoids from Abrus precatorius Linn
-
摘要: 为优化相思藤黄酮的提取工艺,探讨其抗氧化活性,以乙醇浓度、料液比、超声能量、超声时间为影响因素,以黄酮得率为考核指标,采用单因素和Box-Behnken法优化相思藤黄酮提取工艺,并通过检测相思藤黄酮对DPPH、ABTS+自由基的清除能力和对亚铁离子的还原力探讨其抗氧化能力。结果表明,在料液比(W/V)为1:50时,相思藤黄酮的最佳提取工艺为乙醇浓度82%、超声能量507 J、超声时间42 min,此时相思藤黄酮得率为0.696%。相思藤黄酮能有效清除DPPH、ABTS+自由基,清除半数有效浓度EC50分别为0.028、0.009 mg/mL,清除能力优于水溶性维生素E(Trolox),且在一定浓度范围内清除能力随着质量浓度的增加而增强;相思藤黄酮浓度为5 mg/mL时对铁离子的还原力为2.42 mmol/L,弱于Trolox。综上,应用超声提取技术可有效提取相思藤黄酮,提取的黄酮具有良好的抗氧化活性。Abstract: The objective of this study was to optimize the extraction process of flavonoids from Abrus precatorius Linn, and explored its antioxidant activity. Ethanol volume fraction, solid-liquid ratio, ultrasonic energy and ultrasonic extracting time as variables, the yield of flavonoids as evaluation index, single factor tests and Box-Behnken method were used to optimize the extraction process. The scavenging ability on DPPH, ABTS+ free radicals, and the reducing power of flavonoids from Abrus precatorius Linn were also detected to estimate the antioxidant activities. Results showed that, when solid-liquid ratio reached 1:50, the optimum extraction process (0.696%, highest yield) could be achieved under condition of ethanol volume fraction 82%, ultrasonic energy 507 J and ultrasonic extracting time 42 min. Half effective concentration being EC50 0.028 and 0.009 mg/mL respectively. Abrus precatorius Linn flavonoids were able to scavenge DPPH and ABTS+ free radicals effectively, and its ability risen as mass concentration increases, meaning it is superior to Trolox. When flavonoid concentration was set at 5 mg/mL, the reducing power on iron ion reached 2.42 mmol/L, which was weaker than Trolox. To sum up, ultrasonic extraction technology can be effectively employed to the extraction of Abrus precatorius Linn flavonoids, resulting in better antioxidant activity.
-
Keywords:
- Abrus precatorius Linn /
- flavonoids /
- extraction technology /
- antioxidant activity
-
相思藤,中药大辞典记载其为豆科相思子属植物相思子(Abrus precatorius Linn.)[1],以根藤入药,有清热解毒、消炎利尿、润肺护肝功效。相思藤主要分布于广西、广东、福建、云南和台湾等地山地疏林中[2],在广西钦州、南宁、玉林等地已有大规模人工种植并将枝叶开发为相思藤茶,相思藤茶茶汤纯净金黄、清甜回甘、淡香清爽、风味独特,深受消费者欢迎。文献报道从相思藤根茎叶果等分离得到100多个化学成分,主要为黄酮、生物碱、甾体和三萜皂苷等[3−5],具有保护肝损伤[6]、抗肿瘤[7−8]、抗菌[9]和降血糖[10]等作用,主要活性物质为黄酮类、脂溶成分和蛋白质等。相思藤能够成为消费者欢迎的类茶饮料,与其清甜回甘特性有很大关系,甜味成分来源于环烷型皂苷[11],与罗汉果甜苷具有类似苷元结构。陈红霞等[6]认为相思藤总黄酮对CCl4、对乙酰氨基酚(AP)和D-半乳糖胺(D-GalN)所致小鼠急性化学性肝损伤有保护作用,显著降低ALT、AST活性,抑制MDA的生成,明显提高肝组织GSH 水平和GSH-PX活性(P<0.05),作用机制可能与清除自由基、抑制脂质过氧化有关。其他研究发现相思藤叶、果实、果实壳成分都具有较好的抗氧化效果[12−13]。自由基在调节宿主防御、衰老和凋亡等生理过程发挥重要作用,在疾病的发生和发展中扮演重要角色[14],而目前相思藤抗氧化物质基础和机制并不清楚。黄酮类物质具有多种生理活性,可以通过乙醇浸泡,超声波、微波、高压脉冲电场辅助方法提取,也可以通过超临界流体萃取。微波、高压脉冲电场辅助和超临界流体萃取因设备要求高、价格贵导致目前应用难以普及,超声波辅助提取法因操作方便、设备简单、可在室温进行等优点得到广泛应用[15]。本文探索超声波辅助乙醇提取相思藤黄酮的工艺及其体外抗氧化作用,期望能够为相思藤的深入开发提供理论基础。
1. 材料与方法
1.1 材料与仪器
相思藤(Abrus precatorius Linn.) 购自广西钦州市城东市场;2,4,6-三吡啶基三嗪(TPTZ)、2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 阿拉丁试剂(上海)有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、芦丁标准品 上海如吉生物科技发展有限公司;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox) 上海西宝生物科技有限公司;其他试剂均为分析纯试剂。
VC505超声波破碎仪 美国SONICS公司产品;EVOLUTION 201紫外分光光度计 美国Thermo公司产品;EU-C 4002 RS D型高精度电子分析天平 德国GIBERTINI公司产品;DZF-6030A真空干燥箱 上海龙跃仪器设备有限公司产品。
1.2 实验方法
1.2.1 相思藤黄酮提取及纯化
将相思藤和500 mL石油醚置于索氏回流装置中,进行回流萃取叶绿素2 h后晾干。分别称取1.0 g去除叶绿素样品,在不同乙醇浓度、料液比、超声能量和超声时间等条件下进行黄酮提取工艺研究。
取去除叶绿素的相思藤粉碎,按上述单因素研究所确定的最优工艺进行总黄酮提取,以旋转蒸发仪浓缩除去乙醇至粘稠状,加入10倍量水稀释浓缩液并抽滤除去不溶物。处理好的D-101大孔吸附树脂填充于1.5 cm×34 cm层析柱并平衡,将过滤液以4 mL/min速度上样,上样体积50 mL,先以9倍量柱体积水洗脱除杂,用70%乙醇以1 mL/min速度洗脱,收集12倍量柱体积乙醇洗脱液,浓缩、冷冻干燥得粗黄酮[16],检测得粗黄酮中总黄酮含量为65.86%。
1.2.2 芦丁标准曲线的绘制及样品黄酮得率测定
参照夏雨弘等[17]方法并加以改进,分别量取浓度为2.0 mg/mL的芦丁标准溶液0、0.5、1.0、1.5、2.0 mL于10 mL刻度管中,加入5%的NaNO2溶液0.3 mL,静置6 min,然后加入10%的Al(NO3)3溶液0.3 mL,静置6 min,再加入4% NaOH溶液4.0 mL,静置15 min,最后加入50%乙醇定容至10 mL,暗处静置30 min,于波长510 nm处测定吸光值,以芦丁浓度为横坐标、吸光值为纵坐标绘制芦丁浓度-吸光度标准曲线。吸光度与浓度的回归方程为y=0.0011x−0.0067,R2=0.9991,芦丁对照品浓度范围为0~400 μg/mL时,吸光度和浓度呈现比较好的线性关系。
黄酮提取液进行抽滤,滤液定容至60 mL,分别吸取各样品1.0 mL,按照上述操作测量样品吸光度,计算样液中总黄酮含量和得率[18]。
(1) 1.2.3 单因素实验条件
1.2.3.1 乙醇浓度对相思藤黄酮得率的影响
准确称取相思藤样品1.0 g,固定超声时间40 min、料液比(W/V)1:30和超声能量450 J,乙醇浓度分别选用50%、60%、70%、80%、90%等5个水平提取相思藤黄酮,计算黄酮得率。
1.2.3.2 料液比对相思藤黄酮得率的影响
准确称取相思藤样品1.0 g,固定超声能量450 J、乙醇浓度80%、超声时间40 min,料液比(W/V)分别选用1:20、1:30、1:40、1:50、1:60等5个水平提取相思藤黄酮,计算黄酮得率。
1.2.3.3 超声时间对相思藤黄酮得率的影响
准确称取相思藤样品1.0 g,固定超声能量450 J、乙醇浓度80%和料液比(W/V)1:50,超声时间分别选用20、30、40、50、60 min等5个水平提取相思藤黄酮,计算黄酮得率。
1.2.3.4 超声能量对相思藤黄酮得率的影响
准确称取相思藤样品1.0 g,固定超声时间40 min、乙醇浓度80%和料液比(W/V)1:50,超声能量分别选用350、400、450、500、550 J这5个水平提取相思藤黄酮,计算黄酮得率。
1.2.4 响应面试验设计
以黄酮得率为考察指标,对黄酮得率最高水平与相邻水平进行组间比较,根据影响显著性设计三因素三水平的响应面试验(表1)。
表 1 响应面试验设计因素与水平Table 1. Design factors and levels of response surface experiment水平 因素 A:乙醇浓度(%) B:超声时间(min) C:超声能量(J) −1 70 30 450 0 80 40 500 1 90 50 550 1.2.5 抗氧化能力的测定
1.2.5.1 DPPH自由基清除能力测定
用无水乙醇配制0.1、0.2、0.3、0.4、0.5 mg/mL的黄酮溶液及0.03、0.06、0.09、0.12、0.15、0.18 mg/mL的Trolox标准液,各取5 mL置于刻度管中,配制浓度为0.2 mmol/L的DPPH溶液,向黄酮样品和Trolox刻度管中加入现配的DPPH溶液5.0 mL,将刻度管置于暗处反应30 min后,在517 nm处测定吸光值,计算黄酮和Trolox对DPPH自由基的清除率、EC50[19]。
(2) 式中C—DPPH自由基清除率,A1—空白溶液的吸光度,A2—样品溶液的吸光度。
1.2.5.2 ABTS+自由基清除能力测定
吸取7.4 mmol/L的ABTS原液25.0 mL与2.45 mmol/L的过硫酸钾溶液25.0 mL混合,在暗处反应16 h。吸取浓度为0.05、0.10、0.15、0.20、0.25 mg/mL的黄酮溶液各1 mL,加入配置好的ABTS+工作液5.0 mL,混匀后静置5 min,在734 nm处测其吸光度,用无水乙醇作为空白对照,采用相同方法吸取0.005、0.010、0.015、0.020、0.025、0.030 mg/mL的Trolox标准液进行反应测定。计算黄酮和Trolox对ABTS+自由基的清除率、EC50[17]。
(3) 式中,A1为空白溶液的吸光度,A2为样品溶液的吸光度。
1.2.5.3 FRAP的测定
分别吸取浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的黄酮溶液60 μL于刻度管中,在每个刻度管中加入5 mL的FRAP试剂,混和均匀后置于37 ℃水浴20 min,在595 nm处测其吸光度,以Trolox为对照进行对比分析[20]。
1.3 数据处理
单因素实验和抗氧化实验数据采用Origin 9.1进行整理和绘图;响应面试验数据利用Design-Expert 10软件中的Box-Behnken进行回归模型方程的建立及方差分析,实验均重复三次;使用SPSS 20.0软件进行组间方差分析及显著性检验,P<0.05为差异显著。
2. 结果与分析
2.1 单因素对相思藤黄酮得率的影响
2.1.1 乙醇浓度对相思藤黄酮得率的影响
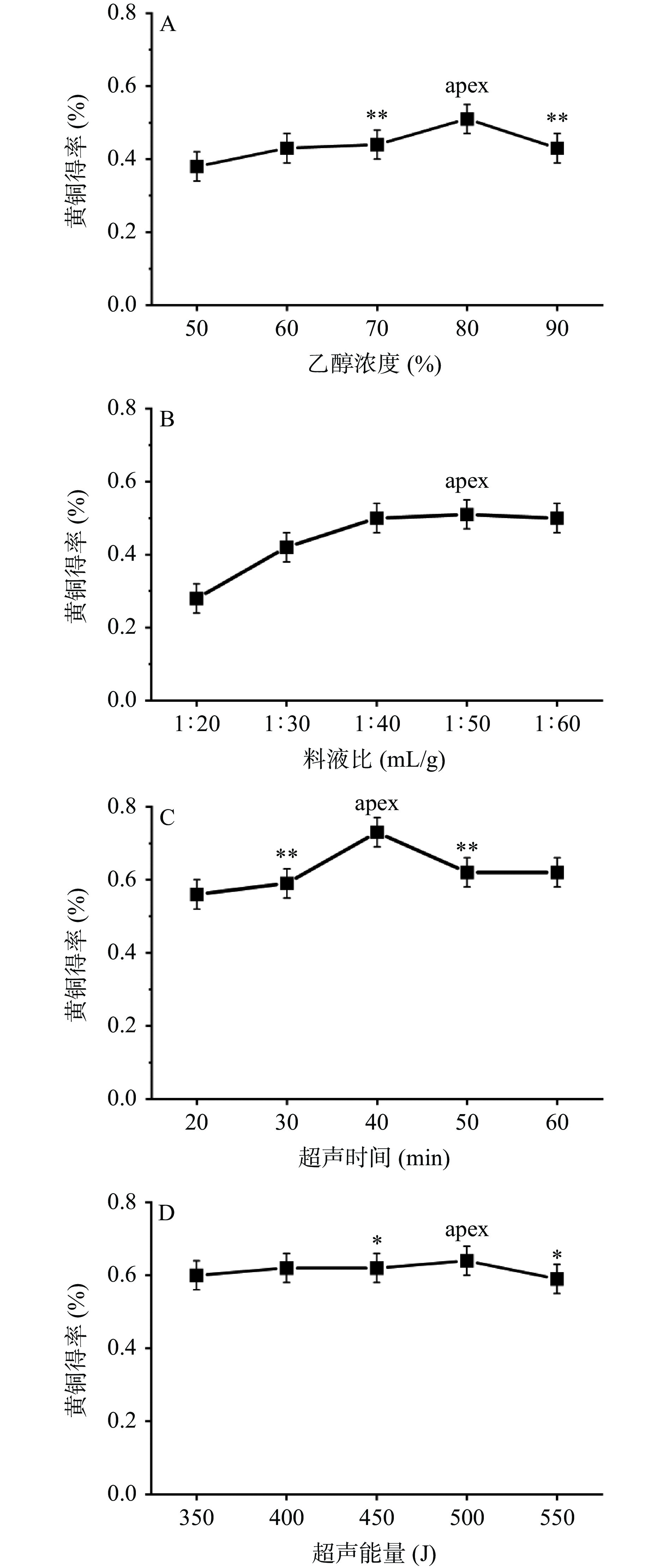
在固定的工艺组合条件下,改变乙醇浓度,考察乙醇浓度对相思藤黄酮提取得率的影响。当乙醇浓度在50%至80%时,随着乙醇浓度增加,相思藤黄酮得率慢慢增加。当乙醇浓度达到80%时,相思藤黄酮得率接近最高值。乙醇浓度超过80%,相思藤黄酮得率减小,80%乙醇提取得率与70%、90%比较具有显著性差异(P<0.001),如图1A所示。不同材料使用乙醇提取时,获得最高提取率的乙醇浓度存在差异,小二仙草在75%时提取率最高[17],黄花菜于90%~95%乙醇浓度时提取率最高[13],野葛在50%的乙醇中提取率最高[11],而本实验用80%乙醇提取相思藤黄酮得率最高,造成这些差异的原因尚不清楚,猜测可能与材料结构细胞致密度相关。本实验根据单因素结果对70%~90%的乙醇进行超声提取相思藤黄酮响应面研究。
![]() 图 1 乙醇浓度、料液比、超声时间和超声能量对黄酮得率的影响注:与黄酮得率最高水平比较,*P<0.05,**P<0.001;A:乙醇浓度对黄酮得率的影响;B:料液比对黄酮得率的影响;C:超声时间对黄酮得率的影响;D:超声能量对黄酮得率的影响;apex代表最高值。Figure 1. Effects of ethanol volume fraction, solid-liquid ratio, ultrasonic extracting time and ultrasonic energy on the extraction rate of flavonoids from Abrus precatorius Linn
图 1 乙醇浓度、料液比、超声时间和超声能量对黄酮得率的影响注:与黄酮得率最高水平比较,*P<0.05,**P<0.001;A:乙醇浓度对黄酮得率的影响;B:料液比对黄酮得率的影响;C:超声时间对黄酮得率的影响;D:超声能量对黄酮得率的影响;apex代表最高值。Figure 1. Effects of ethanol volume fraction, solid-liquid ratio, ultrasonic extracting time and ultrasonic energy on the extraction rate of flavonoids from Abrus precatorius Linn2.1.2 料液比对相思藤黄酮得率的影响
改变料液比考察其对提取相思藤黄酮得率的影响,当料液比(W/V)在1:20至1:40时,随着料液比改变,相思藤黄酮得率快速增加。当料液比(W/V)超过1:40时候,相思藤黄酮得率趋于平衡,见图1B,有学者认为当料液比达到一定值后,黄酮能充分溶出,其他成分溶出相对较少,提取液比例增加后,杂质溶出增加,与黄酮结合沉淀,黄酮得率反而降低[21]。本试验中得率最高水平与相邻水平1:40、1:50、1:60三个水平实验中,最高值和最低值相差2.0%,没有显著性差异。野葛在1:15~1:20的料液比区间提取黄酮得率最高[11],小二仙草在1:40时得率最高[17]。本实验中1:40~1:60的料液比对相思藤黄酮得率的影响差别不大,所以在响应面试验中直接选用料液比(W/V)为1:50进行后续研究。
2.1.3 超声时间对相思藤黄酮得率的影响
超声时间在40 min时相思藤黄酮得率最高,在20~40 min时,相思藤黄酮得率随超声时间增加而增加。在40~60 min时,相思藤黄酮得率随超声时间增加而减少,如图1C所示。超声外场的引入,使细胞壁更易出现裂缝,更易破碎,提高孔隙率,增大溶剂与固体基质的接触面积,并且随着超声处理时间的延长,细胞破壁受损情况也更加明显,从而有效成分的溶解也就更加完全,提取效率更高[22]。但黄酮能通过氢键、疏水吸引和其他相互作用与蛋白质结合,超声使蛋白分子结构发生改变,疏水基团外露[23−24],增加两者结合[25],反而导致黄酮得率下降。所以超声时间确定为30、40、50 min,进行响应面优化试验研究。
2.1.4 超声能量对相思藤黄酮得率的影响
黄酮得率不但与超声时间相关,而且也与超声能量相关。当超声能量小不足以破坏细胞壁时,细胞内有效成分仅通过细胞壁及细胞膜依靠浓度差进行渗透释放,当超声能量足够大,除了加速细胞壁裂缝产生和发展,而且促使细胞膨胀至破裂,细胞内成分直接暴露进入溶剂中,大大提高溶出率及溶出速率[22]。本研究中超声能量在350~500 J时,随超声能量增加相思藤黄酮得率增加,在500 J时相思藤黄酮得率趋向最大值。超声能量超过500 J,相思藤黄酮得率减小,如图1D所示。故选用超声能量为450、500、550 J作为研究相思藤黄酮超声提取的响应面分析比较合适。
在各单因素研究中,黄酮得率分别出现了最大值,与得率最大值水平比较,70%和90%乙醇浓度的黄酮得率、30和50 min的黄酮得率有显著性差异(P<0.001),450和550 J的黄酮得率有显著性差异(P<0.05),而1:40和1:60料液比的黄酮得率与1:50水平比较没有显著差异(P>0.05)。
2.2 响应面优化试验
2.2.1 响应面试验设计与结果
单因素的实验结果比较分析表明,对相思藤黄酮得率影响显著的因素是乙醇浓度、超声时间、超声能量,以上述三个因素为自变量,相思藤黄酮得率为响应值,采用Design-Expert 8.0.6 Trial软件的Box-Behnken模型设计三水平三因素的响应面分析试验,响应面分析方案及结果如表2所示。
表 2 响应面分析方案及结果Table 2. Design and results of response surface experimental实验号 A:乙醇浓度
(%)B:超声时间
(min)C:超声能量
(J)黄酮得率
(%)1 1 0 1 0.61 2 0 0 0 0.69 3 −1 0 −1 0.55 4 0 0 0 0.69 5 −1 −1 0 0.56 6 1 0 −1 0.62 7 0 1 1 0.66 8 0 −1 −1 0.59 9 −1 1 0 0.61 10 0 0 0 0.68 11 −1 0 1 0.59 12 0 0 0 0.70 13 0 0 0 0.70 14 0 1 −1 0.60 15 1 1 0 0.64 16 −1 −1 1 0.62 17 −1 −1 0 0.64 对黄酮得率的结果进行拟合,得到相思藤黄酮得率对乙醇浓度(A)、超声时间(B)和超声能量(C)的二次多项式回归方程模型:
Y=0.49+0.025A+0.012B+0.015C−0.012AB−0.013AC+0.0075BC−0.052A2−0.027B2−0.047C2
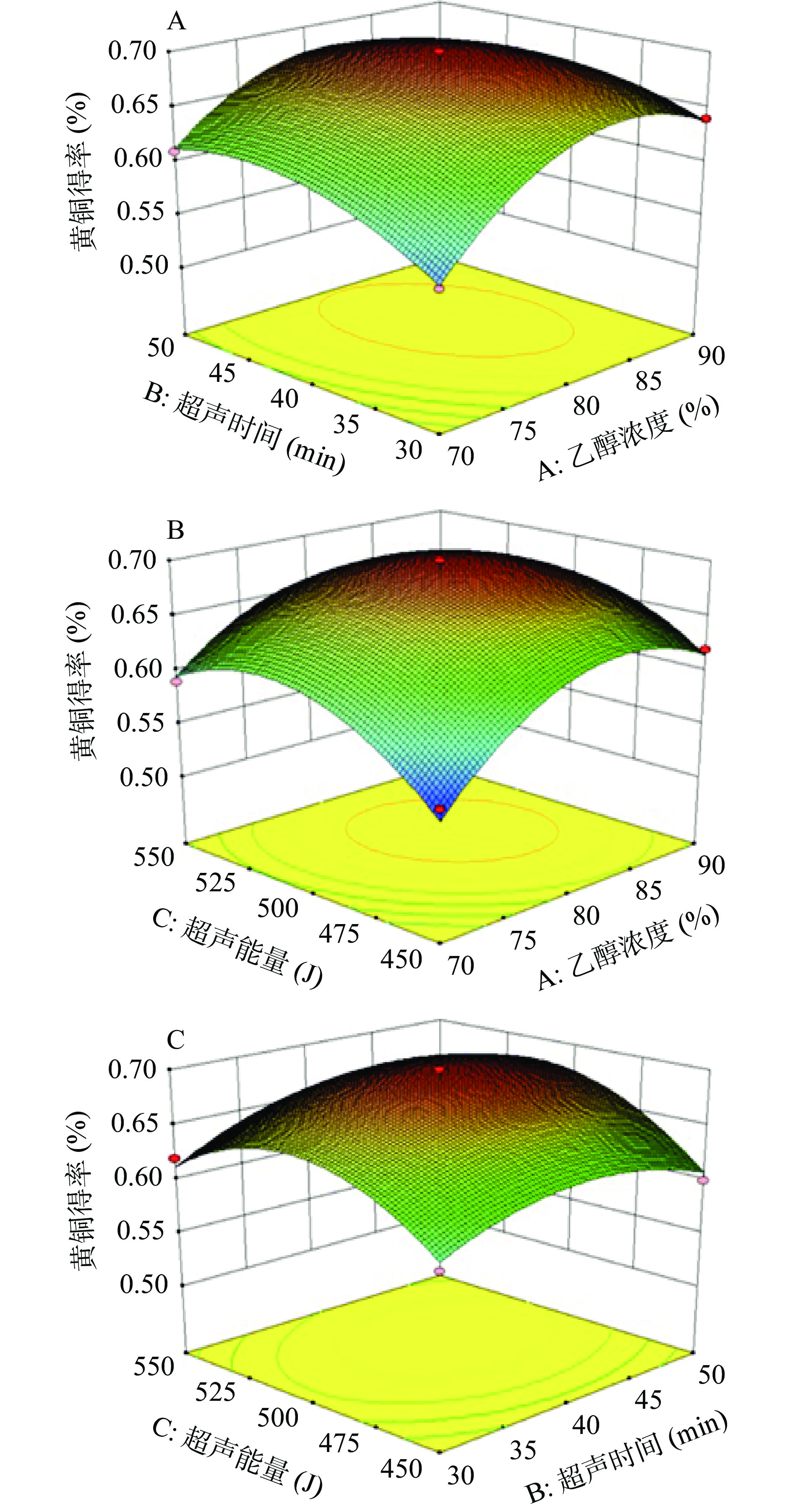
对回归模型进行方差分析,模型的F值为36.02,P<0.0001,故该模型极显著,即对相思藤黄酮得率的影响较为显著,具有统计学意义。失拟误差的P=0.2104>0.05,可以看出该模型与实际试验拟合良好,误差小,模型的R2=0.9789,R2Adj=0.9517,说明该模型可以解释97.89%的黄酮得率变化,大概有2.1%的变化不能得到合理解释,表明预测结果与实际结果的一致性较好。由表计算各因素的P值,PA=0.0003,PB=0.0123,PC=0.0051。P值越小,影响越明显,所以各因素对相思藤黄酮得率的影响程度为乙醇浓度(A)>超声能量(C)>超声时间(B)。乙醇浓度的二次项和超声能量的二次项的P值都小于0.0001,达到了极显著水平。乙醇浓度与超声时间、乙醇浓度与超声能量的交互作用的PAB、PAC均小于0.05,交互作用显著,超声时间与超声能量交互作用PBC=0.1983,大于0.05,交互作用不显著,见表3。
表 3 响应面试验的方差分析Table 3. Analysis of variance for regression simulation方差来源 平方和 自由度 均方 F值 P值 模型 0.036 9 0.004014 36.02 <0.0001 A 0.005 1 0.005 44.87 0.0003 B 0.00125 1 0.00125 11.22 0.0123 C 0.0018 1 0.0018 16.15 0.0051 AB 0.000625 1 0.000625 5.61 0.0497 AC 0.000625 1 0.000625 5.61 0.0497 BC 0.000225 1 0.000225 2.02 0.1983 A2 0.011 1 0.011 103.16 <0.0001 B2 0.003127 1 0.003127 28.06 0.0011 C2 0.0094 1 0.0094 84.36 <0.0001 残差 0.00078 7 0.0001114 − − 失拟误差 0.0005 3 0.0001667 2.38 0.2104 纯误差 0.00028 4 0.00007 − − 总和 0.037 16 − − − 2.2.2 各因素间交互作用的响应面分析
利用Design-Expert 8.0.6 Trial自身所带软件对各因素之间的交互作用做响应面分析,得到响应面曲线如图2。观察响应面坡度,如果响应面的坡度是陡峭的,说明两个因素交互作用对相思藤黄酮得率的影响显著,坡度平缓,则影响非显著。坡度最陡的是乙醇浓度和超声能量响应面图2B,乙醇浓度和超声时间的响应面坡度比较陡如图2A,超声时间和超声能量响应面的坡度较平缓图2C,说明乙醇浓度和超声时间、乙醇浓度和超声能量交互作用对相思藤黄酮提取的影响显著,而超声时间和超声能量交互作用对相思藤黄酮提取的影响不显著,这与方差分析结果一致。
2.2.3 验证试验
为了确定各因素的最优值,采用Design-Expert 8.0.6 Trial软件中的Optimization的Numerical功能,在模型因素的取值范围内,选取最大的响应值。提取相思藤黄酮得率最优条件为:乙醇浓度为82.0%,超声时间为42.1 min,超声能量为507.4 J,此时黄酮得率为0.70%。根据实际的操作条件,将最优条件参数进行修正,选择提取相思藤黄酮得率最优的条件为:乙醇浓度为82%,超声时间为42 min,超声能量为507 J。为了验证响应面法优化结果的可靠性,选用修正的最优提取条件,进行三次验证试验,黄酮得率的平均值为0.696%,相对标准偏差为0.605%,说明试验值与理论值没有显著差别。
2.3 相思藤黄酮的抗氧化能力
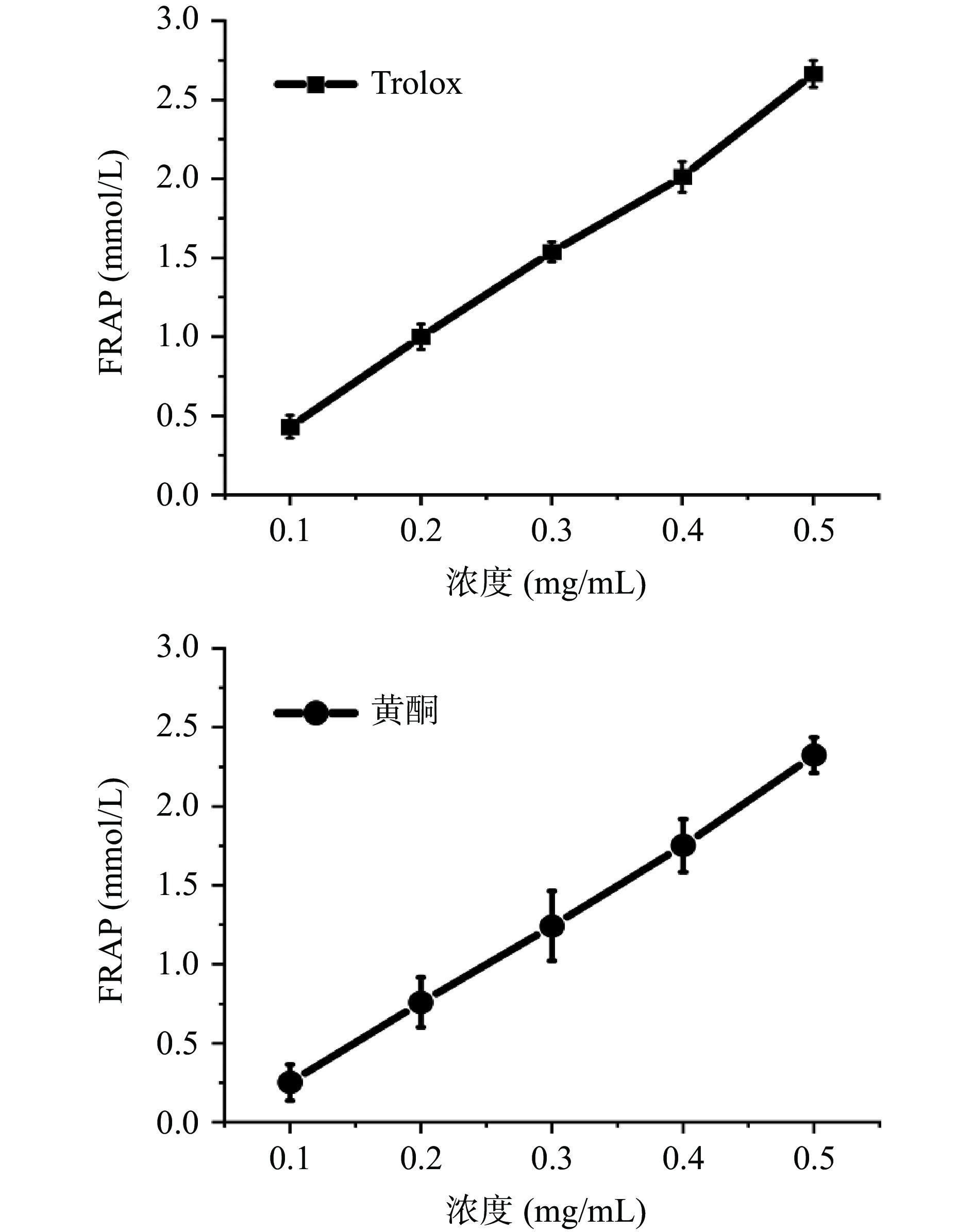
随着相思藤黄酮和Trolox浓度增加,FRAP值增加,亚铁离子还原能力与黄酮、Trolox含量呈现良好的线性关系。相思藤黄酮浓度为0.5 mg/mL时对铁离子的还原力为2.42 mmol/L,Trolox浓度为0.5 mg/mL时对铁离子的还原力为2.76 mmol/L,Trolox在较低浓度时的FRAP响应值和较高浓度的相思藤黄酮的FRAP值相当,见图3。可见相思藤黄酮的铁离子还原能力要弱于Trolox,但与苦笋黄酮还原能力相当[26],优于化橘红[27],远优于黄花菜、百香果皮和牛大力[28−30],综合来看相思藤黄酮对亚铁离子的还原能力较好。
相思藤黄酮具有较好的清除DPPH自由基能力,浓度在0.1~0.5 mg/mL范围内与DPPH自由基清除率有良好的线性关系,清除DPPH自由基EC50为0.028 mg/mL,见表4。Trolox是水溶性维生素E,具有强效抗氧化作用,常用作食品、饮料和补充剂的抗氧化能力阳性对照,其EC50值0.094 mg/mL。相思藤黄酮的EC50小于Trolox,清除DPPH自由基能力优于Trolox。相思藤黄酮清除DPPH EC50值与小二仙草相当[17],清除DPPH自由基能力优于陈艾和野葛总黄酮[31−32],远优于山茱萸、黄花菜、百香果皮、黄晶果果皮和罗汉参皮等黄酮 [28−29,33−35],但比三叶木通黄酮效果差[36]。
表 4 Trolox和相思藤黄酮抗氧化能力Table 4. Antioxidant activity of Trolox and flavonoids from Abrus precatorius Linn项目 对DPPH·的清除能力 对ABTS+·的清除能力 Trolox 线性方程 y=465.9x+5.9827 y=3219.1x−0.5633 EC50(mg/mL) 0.094 0.015 黄酮 线性方程 y=103.52x−2.24 y=330.2x+2.426 EC50(mg/mL) 0.028 0.009 相思藤黄酮在0.05~0.25 mg/mL范围内与ABTS+自由基清除率有良好的线性关系,具有优秀的清除ABTS+自由基能力,半数清除有效浓度EC50为0.009 mg/mL,而Trolox对ABTS+的EC50为0.015 mg/mL,见表4,显然相思茶黄酮对ABTS+的清除效果明显优于Trolox。与其他植物类黄酮相比,相思藤黄酮清除ABTS+自由基能力优于新疆圆柏[37],远优于罗汉参皮、黄晶果果皮、黄花菜和百香果皮[28−29,33−34]等黄酮,与牛大力[30]黄酮能力相当。
相思藤果油(EC分别为DPPH 5.03 mg/mL、ABTS+ 2.95 mg/mL)和果壳油(EC分别为DPPH 3.03 mg/mL、ABTS+ 3.07 mg/mL)[13]有一定的清除自由基效果,但比相思藤黄酮差。总体上相思藤黄酮具有较好的抗氧化能力。
3. 结论
相思藤中总黄酮含量较高,利用响应面设计法优化相思藤黄酮提取条件切实可行,在乙醇浓度82%,超声时间42 min,超声能量为507 J,黄酮得率为0.696%。
以Trolox作为抗氧化研究对照,体外测定Trolox和相思藤黄酮清除DPPH自由基的EC50分别为0.094、0.028 mg/mL,清除ABTS+自由基的EC50分别为0.015、0.009 mg/mL;相思藤黄酮浓度为5 mg/mL时对铁离子的还原力为2.42 mmol/L,弱于Trolox。本研究证实相思藤黄酮具有较好的清除自由基能力和还原能力,是潜在的植物源抗氧化剂,研究结果为相思藤黄酮的开发利用提供了理论依据。
-
图 1 乙醇浓度、料液比、超声时间和超声能量对黄酮得率的影响
注:与黄酮得率最高水平比较,*P<0.05,**P<0.001;A:乙醇浓度对黄酮得率的影响;B:料液比对黄酮得率的影响;C:超声时间对黄酮得率的影响;D:超声能量对黄酮得率的影响;apex代表最高值。
Figure 1. Effects of ethanol volume fraction, solid-liquid ratio, ultrasonic extracting time and ultrasonic energy on the extraction rate of flavonoids from Abrus precatorius Linn
表 1 响应面试验设计因素与水平
Table 1 Design factors and levels of response surface experiment
水平 因素 A:乙醇浓度(%) B:超声时间(min) C:超声能量(J) −1 70 30 450 0 80 40 500 1 90 50 550 表 2 响应面分析方案及结果
Table 2 Design and results of response surface experimental
实验号 A:乙醇浓度
(%)B:超声时间
(min)C:超声能量
(J)黄酮得率
(%)1 1 0 1 0.61 2 0 0 0 0.69 3 −1 0 −1 0.55 4 0 0 0 0.69 5 −1 −1 0 0.56 6 1 0 −1 0.62 7 0 1 1 0.66 8 0 −1 −1 0.59 9 −1 1 0 0.61 10 0 0 0 0.68 11 −1 0 1 0.59 12 0 0 0 0.70 13 0 0 0 0.70 14 0 1 −1 0.60 15 1 1 0 0.64 16 −1 −1 1 0.62 17 −1 −1 0 0.64 表 3 响应面试验的方差分析
Table 3 Analysis of variance for regression simulation
方差来源 平方和 自由度 均方 F值 P值 模型 0.036 9 0.004014 36.02 <0.0001 A 0.005 1 0.005 44.87 0.0003 B 0.00125 1 0.00125 11.22 0.0123 C 0.0018 1 0.0018 16.15 0.0051 AB 0.000625 1 0.000625 5.61 0.0497 AC 0.000625 1 0.000625 5.61 0.0497 BC 0.000225 1 0.000225 2.02 0.1983 A2 0.011 1 0.011 103.16 <0.0001 B2 0.003127 1 0.003127 28.06 0.0011 C2 0.0094 1 0.0094 84.36 <0.0001 残差 0.00078 7 0.0001114 − − 失拟误差 0.0005 3 0.0001667 2.38 0.2104 纯误差 0.00028 4 0.00007 − − 总和 0.037 16 − − − 表 4 Trolox和相思藤黄酮抗氧化能力
Table 4 Antioxidant activity of Trolox and flavonoids from Abrus precatorius Linn
项目 对DPPH·的清除能力 对ABTS+·的清除能力 Trolox 线性方程 y=465.9x+5.9827 y=3219.1x−0.5633 EC50(mg/mL) 0.094 0.015 黄酮 线性方程 y=103.52x−2.24 y=330.2x+2.426 EC50(mg/mL) 0.028 0.009 -
[1] 南京中医药大学. 中药大辞典[M]. 第2版 上, 上海:上海科学技术出版社, 2014. [Nanjing University of Chinese Medicine. The Dictionary of Chinese Herbal Medicine[M]. Second Edition, Volume 1, Shanghai:Shanghai Science and Technology Press, 2014.] Nanjing University of Chinese Medicine. The Dictionary of Chinese Herbal Medicine[M]. Second Edition, Volume 1, Shanghai: Shanghai Science and Technology Press, 2014.
[2] 张春花, 郭宏伟, 黄仁彬, 等. 相思藤生药学研究[J]. 中成药,2019,41(7):1639−1643. [ZHANG C H, GUO H W, HUANG R B, et al. Pharmacognosy study on Abrus precatorius[J]. Chinese Traditional Patent Medicine,2019,41(7):1639−1643.] ZHANG C H, GUO H W, HUANG R B, et al . Pharmacognosy study on Abrus precatorius[J]. Chinese Traditional Patent Medicine,2019 ,41 (7 ):1639 −1643 .[3] 薛显妹, 梁智科, 何翠敏, 等. 基于一测多评法测定相思子叶总黄酮部位中5种成分含量[J]. 中药新药与临床药理,2023,34(2):249−255. [XUE X M, LIANG Z K, HE C M, et al. Simultaneous determination of 5 components in total flavonoids fraction of Abrus precatorious leaves based on quantitative analysis of multi-components by single marker[J]. Traditional Chinese Drug Research & Clinical Pharmacology,2023,34(2):249−255.] XUE X M, LIANG Z K, HE C M, et al . Simultaneous determination of 5 components in total flavonoids fraction of Abrus precatorious leaves based on quantitative analysis of multi-components by single marker[J]. Traditional Chinese Drug Research & Clinical Pharmacology,2023 ,34 (2 ):249 −255 .[4] 李良波, 温秀萍, 何翊, 等. 相思子化学成分研究[J]. 天然产物研究与开发,2012,24(10):1371−1373. [LI L B, WEN X Q, HE Y, et al. Chemical constituents of Abrus precatorius L J]. Natural Product Research and Development,2012,24(10):1371−1373.]
[5] 李春阳, 张平, 袁旭江. 相思子叶化学成分研究[J]. 广东药学院学报,2014,30(1):24−27. [LI C Y, ZHANG P, YUAN X J. Study on chemical constituents from the leaves of Abrus precatorius L J]. Journal of Guangdong Pharmaceutical University,2014,30(1):24−27.]
[6] 陈红霞, 吴咖, 黄仁彬, 等. 相思藤总黄酮对小鼠急性化学性肝损伤的保护作用及机制[J]. 广西医学,2012,34(2):138−140. [CHEN H X, WU K, HUANG R B, et al. Protective effect and mechanism of xiangsiteng flavonoid against acute chemical liver injuries in mice[J]. Guangxi Medical Journal,2012,34(2):138−140.] CHEN H X, WU K, HUANG R B, et al . Protective effect and mechanism of xiangsiteng flavonoid against acute chemical liver injuries in mice[J]. Guangxi Medical Journal,2012 ,34 (2 ):138 −140 .[7] SHAFI S M, SATEESH M K, BASHIR M, et al. Cytotoxic and pro-apoptotic effects of Abrus precatorius L. on human metastatic breast cancer cell line, MDA-MB-231[J]. Cytotechnology,2013,65(3):407−417. doi: 10.1007/s10616-012-9494-6
[8] SOFI M S, SATEESH M K, BASHIR M, et al. Chemopreventive and anti-breast cancer activity of compounds isolated from leaves of Abrus precatorius L.[J]. 3 Biotech,2018,8(8):371. doi: 10.1007/s13205-018-1395-8
[9] ROY S, ACHARYA R, MANDAL N C, et al. A comparative antibacterial evaluation of raw and processed Guñjā ( Abrus precatorius Linn.) seeds[J]. Ancient Science of Life,2012,32(1):20−23. doi: 10.4103/0257-7941.113794
[10] ALEX B, DESMOND O A, ERIC O G, et al. Glucose lowering and pancreato-protective effects of Abrus Precatorius (L.) leaf extract in normoglycemic and STZ/Nicotinamide–Induced diabetic rats[J]. Journal of Ethnopharmacology,2020,258:112918. doi: 10.1016/j.jep.2020.112918
[11] STAVRIANIDI A, STEKOLSHCHIKOVA E, RODIN I, et al. Structure elucidation of sweet-tasting cycloartane-type saponins from ginseng oolong tea and Abrus precatorius L. leaves[J]. Natural Product Research,2017,32(20):2490−2493.
[12] Z G M, FARHAN A, K K A, et al. Antioxidant and antiproliferative activities of Abrus precatorius leaf extracts-an in vitro study[J]. BMC Complementary and Alternative Medicine,2013,13(1):53. doi: 10.1186/1472-6882-13-53
[13] SUNDAY O O, OLAYINKA T A, OLUWOLE B F, et al. Antioxidant and free radical scavenging capacity of seed and shell essential oils extracted from Abrus precatorius (L.)[J]. Antioxidants,2014,3(2):278−287. doi: 10.3390/antiox3020278
[14] PHILIP, NEWSHOLME, VINICIUS, et al. Molecular mechanisms of ROS production and oxidative stress in diabetes[J]. Biochemical Journal,2016,473:4527−4550. doi: 10.1042/BCJ20160503C
[15] 李路亚, 冯雪, 李圣豪, 等. 药食同源中黄酮类化合物提取工艺的研究进展[J]. 安徽农学通报,2023,29(7):33−36. [LI L Y, FENG X, LI S H, et al. Research progress on extraction technology of flavonoids from medicine and food homology[J]. Anhui Agricultural Science Bulletin,2023,29(7):33−36.] LI L Y, FENG X, LI S H, et al . Research progress on extraction technology of flavonoids from medicine and food homology[J]. Anhui Agricultural Science Bulletin,2023 ,29 (7 ):33 −36 .[16] 孙开芬, 陈胤睿, 徐文芬, 等. 大孔吸附树脂分离纯化红禾麻总黄酮工艺的优化[J]. 中成药,2022,44(8):2619−2623. [SUN K F, CHEN Y R, XU W F, et al. Optimization of the separation and purification process of total flavonoids from red hemp with macroporous adsorption resin[J]. Chinese Traditional Patent Medicine,2022,44(8):2619−2623.] SUN K F, CHEN Y R, XU W F, et al . Optimization of the separation and purification process of total flavonoids from red hemp with macroporous adsorption resin[J]. Chinese Traditional Patent Medicine,2022 ,44 (8 ):2619 −2623 .[17] 夏雨弘, 刘颖, 周茗, 等. 小二仙草总黄酮提取工艺的优化及其抗氧化活性分析[J]. 食品工业科技, 2023:1−14. [XIA Y H, LIU Y, ZHOU M, et al. Extraction process optimization and antioxidant activity of total flavonoids from Haloragis micrantha (Thunb.) R. Brown[J]. Science and Technology of Food Industry, 2023:1−14.] XIA Y H, LIU Y, ZHOU M, et al. Extraction process optimization and antioxidant activity of total flavonoids from Haloragis micrantha (Thunb.) R. Brown[J]. Science and Technology of Food Industry, 2023: 1−14.
[18] 罗蓉, 蔡旭, 薛宏坤, 等. 响应面法优化超声辅助低共熔溶剂提取山楂总黄酮工艺[J]. 食品工业科技, 2022, 43(22):229−237. [LUO R, CAI X, XUE H K, et al. Optimization of ultrasonic-assisted deep eutectic solvent extraction of flavonoids from Crataegus pinnatifida using response surface methodology[J]. Science and Technology of Food Industry, 2022, 43(22):229−237.] LUO R, CAI X, XUE H K, et al. Optimization of ultrasonic-assisted deep eutectic solvent extraction of flavonoids from Crataegus pinnatifida using response surface methodology[J]. Science and Technology of Food Industry, 2022, 43(22): 229−237.
[19] 张志毅, 白若熙, 宗爱珍, 等. 菊芋中抗氧化成分的在线鉴定和构效关系分析[J]. 食品工业科技, 2023:1−14[2024-01-22]. https://doi.org/10.13386/j.issn1002-0306.2022080031. [ZHANG Z Y, BAI R X, ZONG A Z, et al. Online identification and constitutive relationship analysis of antioxidant components in Jerusalem artichoke[J]. Science and Technology of Food Industry, 2023:1−14[2024-01-22]. https://doi.org/10.13386/j.issn1002-0306.2022080031.] ZHANG Z Y, BAI R X, ZONG A Z, et al. Online identification and constitutive relationship analysis of antioxidant components in Jerusalem artichoke[J]. Science and Technology of Food Industry, 2023: 1−14[2024-01-22]. https://doi.org/10.13386/j.issn1002-0306.2022080031.
[20] 陈智玲, 马剑, 文博, 等. 超高压提取蓝莓渣花色苷的工艺优化及其抗氧化活性[J]. 食品工业科技,2022,43(21):185−194. [CHEN Z L, MA J, WEN B, et al. Optimization of ultra-high pressure extraction and the antioxidant activity of anthocyanins from blueberry pomace[J]. Science and Technology of Food Industry,2022,43(21):185−194.] CHEN Z L, MA J, WEN B, et al . Optimization of ultra-high pressure extraction and the antioxidant activity of anthocyanins from blueberry pomace[J]. Science and Technology of Food Industry,2022 ,43 (21 ):185 −194 .[21] 秦晶晶, 钱慧琴, 赵媛, 等. 柿叶总黄酮提取工艺优化及其抗氧化活性[J]. 食品工业科技,2020,41(13):32−38. [QIN J J, QIAN H Q, ZHAO Y, et al. Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from persimmon leaves[J]. Science and Technology of Food Industry,2020,41(13):32−38.] QIN J J, QIAN H Q, ZHAO Y, et al . Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from persimmon leaves[J]. Science and Technology of Food Industry,2020 ,41 (13 ):32 −38 .[22] 欧阳娜娜. 银杏黄酮提取的外场强化机理及分离方法对抗氧化活性影响的研究[D]. 长沙:中南林业科技大学, 2008. [OUYANG N N. Mechanism of outfields enhancing extraction flavonoids from Ginkgo Biloba and the effect of separation methods on antioxidant activity[D]. Changsha:Central South University of Forestry and Technology, 2008.] OUYANG N N. Mechanism of outfields enhancing extraction flavonoids from Ginkgo Biloba and the effect of separation methods on antioxidant activity[D]. Changsha: Central South University of Forestry and Technology, 2008.
[23] 戴泽川, 毛相朝, 郝亚楠, 等. 高强度超声对凡纳滨对虾蛋白结构和功能特性的影响[J]. 食品科学,2022,43(19):80−87. [DAI Z C, MAO X Z, HAO Y N, et al. Effect of high intensity ultrasound on structural and functional properties of proteins in Litopenaeus vannamei[J]. Food Science,2022,43(19):80−87.] DAI Z C, MAO X Z, HAO Y N, et al . Effect of high intensity ultrasound on structural and functional properties of proteins in Litopenaeus vannamei[J]. Food Science,2022 ,43 (19 ):80 −87 .[24] 李根, 任国艳, 李倩, 等. 超声辅助提取鲵皮胶原蛋白工艺优化及结构特征分析[J]. 食品工业科技,2021,42(22):160−168. [LI G, REN G Y, LI Q, et al. Optimization of ultrasound-assisted extraction and structural characteristics analysis of collagen from chinese giant salamander ( Andrias davidianus) skin[J]. Science and Technology of Food Industry,2021,42(22):160−168.] LI G, REN G Y, LI Q, et al . Optimization of ultrasound-assisted extraction and structural characteristics analysis of collagen from chinese giant salamander (Andrias davidianus) skin[J]. Science and Technology of Food Industry,2021 ,42 (22 ):160 −168 .[25] CHEN D, ZHU X, ILAVSKY J, et al. Polyphenols weaken pea protein gel by formation of large aggregates with diminished noncovalent interactions[J]. Biomacromolecules,2021,22(2):1001−1014. doi: 10.1021/acs.biomac.0c01753
[26] 晏俊玲, 樊扬, 秦川, 等. 苦笋总黄酮提取工艺优化及其体外抗炎抗氧化活性研究[J]. 四川农业大学学报,2022,40(2):276−285. [YAN J L, FAN Y, QIN C, et al. Optimization of the extraction process of total flavonoids from the shoots of Pleioblastus amarus and evaluation of its anti-inflammatory and antioxidant activities in vitro[J]. Journal of Sichuan Agricultural University,2022,40(2):276−285.] YAN J L, FAN Y, QIN C, et al . Optimization of the extraction process of total flavonoids from the shoots of Pleioblastus amarus and evaluation of its anti-inflammatory and antioxidant activities in vitro[J]. Journal of Sichuan Agricultural University,2022 ,40 (2 ):276 −285 .[27] 陈亦璐, 徐梦兰, 邓健善, 等. 化橘红黄酮的高压脉冲电场提取及抗氧化活性检测[J]. 湖南农业大学学报(自然科学版),2021,47(3):305−311. [CHEN Y L, XU M L, DENG J S, et al. Pulsed electric field extraction of flavonoids from Exocarpium Citri grandis and its antioxidant activity detection[J]. Journal of Hunan Agricultural University (Natural Sciences),2021,47(3):305−311.] CHEN Y L, XU M L, DENG J S, et al . Pulsed electric field extraction of flavonoids from Exocarpium Citri grandis and its antioxidant activity detection[J]. Journal of Hunan Agricultural University (Natural Sciences),2021 ,47 (3 ):305 −311 .[28] 米智, 刘荔贞, 李慧. 响应面法优化黄花菜黄酮提取工艺及抗氧化活性的研究[J]. 中国调味品,2022,47(7):53−57. [MI Z, LIU L Z, LI H. Optimization of extraction process of flavonoids from Hemerocallis citrina baroni by response surface methodology and study on antioxidant activity[J]. China Condiment,2022,47(7):53−57.] MI Z, LIU L Z, LI H . Optimization of extraction process of flavonoids from Hemerocallis citrina baroni by response surface methodology and study on antioxidant activity[J]. China Condiment,2022 ,47 (7 ):53 −57 .[29] 景继月, 许梦圆, 田永涛, 等. 百香果皮总黄酮提取工艺优化及其抗氧化活性研究[J]. 中国调味品,2022,47(7):43−48. [JING J Y, XU M Y, TIAN Y T, et al. Optimization of extraction technology of total flavonoids from Passiflora edulis sims peel and study on the antioxidant activity[J]. China Condiment,2022,47(7):43−48.] JING J Y, XU M Y, TIAN Y T, et al . Optimization of extraction technology of total flavonoids from Passiflora edulis sims peel and study on the antioxidant activity[J]. China Condiment,2022 ,47 (7 ):43 −48 .[30] 王立抗, 陈鸿庚, 黄智霖, 等. 牛大力不同部位总黄酮、多酚含量及其抗氧化活性研究[J]. 中华中医药学刊,2022,40(3):139−142. [WANG L K, CHEN H G, HUANG Z L, et al. Antioxidant activities and contents of total flavonoids and polyphenols from different parts of niudali ( Millettia speciose Champ)[J]. Chinese Archives of Traditional Chinese,2022,40(3):139−142.] WANG L K, CHEN H G, HUANG Z L, et al . Antioxidant activities and contents of total flavonoids and polyphenols from different parts of niudali (Millettia speciose Champ)[J]. Chinese Archives of Traditional Chinese,2022 ,40 (3 ):139 −142 .[31] 朱静, 杨玲玲, 陈亚蓝, 等. 响应面优化酶辅助半仿生法提取野生陈艾总黄酮及其体外抗氧化性研究[J]. 粮食与油脂,2022,35(7):104−109. [ZHU J, YANG L L, CHEN Y L, et al. Response surface optimization enzyme-assisted semi-bionic extraction of total flavonoids from aged Artemisia argyi in wild and its antioxidant activity in vitro[J]. Cereals & Oils,2022,35(7):104−109.] ZHU J, YANG L L, CHEN Y L, et al . Response surface optimization enzyme-assisted semi-bionic extraction of total flavonoids from aged Artemisia argyi in wild and its antioxidant activity in vitro[J]. Cereals & Oils,2022 ,35 (7 ):104 −109 .[32] 龚频, 翟鹏涛, 张梦璇, 等. 野葛总黄酮的提取工艺优化及抗氧化活性研究[J]. 中国酿造,2022,41(10):172−176. [GONG P, ZHAI P T, ZHANG M X, et al. Optimization of extraction process of total flavonoids from Pueraria lobata and its antioxidant activity[J]. China Brewing,2022,41(10):172−176.] GONG P, ZHAI P T, ZHANG M X, et al . Optimization of extraction process of total flavonoids from Pueraria lobata and its antioxidant activity[J]. China Brewing,2022 ,41 (10 ):172 −176 .[33] 李杰, 马艳莉, 刘尚军, 等. 超声波辅助溶剂法提取山茱萸黄酮工艺及体外抗氧化活性研究[J]. 中国食品添加剂,2022,33(12):81−88. [LI J, MA Y L, LIU S J, et al. Study on ultrasonic-assisted solvent extraction technology of Cornus officinalis flavonoids and its anti-oxidation activity in vitro[J]. China Food Additives,2022,33(12):81−88.] LI J, MA Y L, LIU S J, et al . Study on ultrasonic-assisted solvent extraction technology of Cornus officinalis flavonoids and its anti-oxidation activity in vitro[J]. China Food Additives,2022 ,33 (12 ):81 −88 .[34] 李颖, 侯诗, 廖婉婷, 等. 响应面法优化黄晶果果皮总黄酮提取工艺及抗氧化活性[J]. 食品科技,2022,47(7):175−181. [LI Y, HOU S, LIAO W T, et al. Optimization of extraction process by response surface methodology and antioxidant activity of total flavonoids from Abiu. peels[J]. Food Science and Technology,2022,47(7):175−181.] LI Y, HOU S, LIAO W T, et al . Optimization of extraction process by response surface methodology and antioxidant activity of total flavonoids from Abiu. peels[J]. Food Science and Technology,2022 ,47 (7 ):175 −181 .[35] 宋代荣, 刘昌衡, 贾爱荣, 等. 罗汉参皮总黄酮的提取工艺优化及其抗氧化活性研究[J]. 食品工业, 2022, 43(8):69−74. [SONG D R, LIU C H, JIA A R, Optimization of the extraction process of total flavonoids from the peel of Apios americana medic. and study on its antioxidant activity[J]. The Food Industry, 2022, 43(8):69−74.] SONG D R, LIU C H, JIA A R, Optimization of the extraction process of total flavonoids from the peel of Apios americana medic. and study on its antioxidant activity[J]. The Food Industry, 2022, 43(8): 69−74.
[36] 苏慧慧, 许菲, 吴定坤, 等. 响应面优化三叶木通总黄酮的提取工艺及其抗氧化活性[J]. 北方园艺,2022(21):100−105. [SU H H, XU F, WU D K, et al. Optimization of extraction conditions of flavonoids from Akebia trifoliata by response surface methodology and its antioxidant activity[J]. Northern Horticulture,2022(21):100−105.] SU H H, XU F, WU D K, et al . Optimization of extraction conditions of flavonoids from Akebia trifoliata by response surface methodology and its antioxidant activity[J]. Northern Horticulture,2022 (21 ):100 −105 .[37] 王为兰, 刘晓颖, 陈伟, 等. 新疆圆柏总黄酮的抗氧化活性及在食品保鲜中的应用[J]. 新疆大学学报(自然科学版)(中英文),2020,37(2):197−203. [WANG W L, LIU X Y, CHEN W, et al. Antioxidant activity of flavonoids from Sabina vulgalis Ant. and its application in food preservation[J]. Journal of Xinjiang University (Natural Science Edition in Chinese and English),2020,37(2):197−203.] WANG W L, LIU X Y, CHEN W, et al . Antioxidant activity of flavonoids from Sabina vulgalis Ant. and its application in food preservation[J]. Journal of Xinjiang University (Natural Science Edition in Chinese and English),2020 ,37 (2 ):197 −203 . -
期刊类型引用(6)
1. 段敬重,霍瑞丽,吴姗姗,杨雨欣,孙薇,王艳. 低共熔溶剂在天然产物提取中的应用. 特产研究. 2024(01): 168-175 .  百度学术
百度学术
2. 孟蒙,巫明惠,周海洋,吕世豪,高振忠,孙瑾. 低共熔溶剂提取油茶果壳木质素及其结构特性研究. 木材科学与技术. 2024(03): 64-71 .  百度学术
百度学术
3. 陈作义,陈考昌,李华辉,柯永霞,柳晓俊,赵丹华. CA/COSBC复合凝胶微球的制备及其对Pb(Ⅱ)的吸附性能. 精细化工. 2024(11): 2423-2432 .  百度学术
百度学术
4. 牛一米,杜鑫宇,于孟言,洪伟淇,高珊. 纳米SiO_2@TiO_2增强竹塑复合材料制备及托盘应用性能仿真分析. 农业工程学报. 2024(20): 278-287 .  百度学术
百度学术
5. 胡钰迪,江南. 油茶果壳氧化纳米纤维素-海藻酸钠复合薄膜的制备及性能. 包装学报. 2023(03): 1-8 .  百度学术
百度学术
6. 邹佳利,于云鹏,闫雨晴,宋永明,房轶群,王清文. 木质素增强可自修复聚脲弹性体的制备与性能. 复合材料学报. 2023(10): 5666-5677 .  百度学术
百度学术
其他类型引用(5)





 下载:
下载:
 下载:
下载:



