Effect of Sciadonic Acid on Hepatic Lipid Metabolism in Obese Mice Induced by A High-fat Diet
-
摘要: 目的:本研究旨在探究金松酸(sciadonic acid,SA)对高脂饮食诱导小鼠肥胖的改善作用。方法:将48只C57BL/6雄鼠适应性喂养一周后随机分为正常组(C)、阳性对照组(S)、模型组(M)、金松酸低剂量组(LSA)、金松酸中剂量组(MSA)和金松酸高剂量组(HSA)。造模和给药同时进行,持续16周,低、高剂量组每日固定时间灌胃不同剂量的金松酸溶液。实验结束后从血脂代谢、肝脏脂肪代谢、肝脏氧化应激、肝脏脂质合成和代谢相关基因的表达等几个方面探讨金松酸调节肥胖小鼠脂质代谢的潜在机制。结果表明,高剂量金松酸干预肥胖小鼠能显著降低血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)含量,增加高密度脂蛋白胆固醇(HDL-C)(P<0.05),抑制体重增长,减少附睾脂肪积累,对肝组织损伤具有改善作用。此外,金松酸能明显提高小鼠体内超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)等抗氧化酶的活性(P<0.05),并显著降低氧化终产物MDA的生成(P<0.05),缓解体内氧化应激反应,并通过调节脂质代谢相关基因的表达,抑制脂质合成,改善脂质代谢。综上,金松酸可通过抑制脂肪积累,缓解氧化应激,调控脂质合成和代谢改善肥胖小鼠脂质代谢紊乱。Abstract: Objective: To investigate the potential beneficial effects of sciadonic acid (SA) on improving obesity induced by a high-fat diet in mice. Methods: Forty-eight male C57BL/6 mice were adaptively fed for one week and then randomly divided into the following groups: Control group (C), positive control group (S), model group (M), low-dose sciadonic acid group (LSA), medium-dose sciadonic acid group (MSA), and high-dose sciadonic acid group (HSA). The modeling process lasted for 16 weeks, and the low and high-dose groups were orally administered different doses of SA solution at a fixed time each day. After the modeling period, potential mechanisms of SA in regulating lipid metabolism in obese mice were explored, including aspects such as blood lipid metabolism, hepatic fat metabolism, hepatic oxidative stress, hepatic lipid synthesis, and expression of metabolism-related genes. Results: The high-dose SA intervention in obese mice significantly decreased the levels of total cholesterol (TC), triglycerides (TG), and low-density lipoprotein cholesterol (LDL-C) in serum, while increasing high-density lipoprotein cholesterol (HDL-C) (P<0.05). It inhibited weight gain, reduced epididymal fat accumulation, and improved liver tissue damage. Additionally, SA significantly increased the activities of antioxidant enzymes such as superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) in mice (P<0.05), and significantly reduced the production of oxidative end products MDA (P<0.05), alleviated oxidative stress in vivo, and inhibited lipid synthesis by regulating the expression of genes related to lipid metabolism to improve lipid metabolism. Conclusion: SA could improve lipid metabolism disorders in obese mice by suppressing fat accumulation, alleviate oxidative stress, regulate lipid synthesis and metabolism.
-
Keywords:
- sciadonic acid /
- mice /
- high-fat diet /
- lipid metabolism /
- obesity
-
肥胖是人类目前最紧迫的公共健康问题之一[1],主要是由能量摄入、消耗以及储存之间的不平衡所造成[2]。据报道,截止到2019年,青少年肥胖率和成人肥胖率分别增长至11.5%和16.4%[3],在全球范围内肥胖和超重作为导致人类死亡的危险因素位居第五,肥胖每年导致的成人死亡人数超过340万[4]。同时,肥胖是造成一系列慢性疾病的因素之一,包括心血管疾病[5]、糖尿病[6]、慢性肾病[7]、非酒精性脂肪肝[8]、代谢综合征[9]和许多癌症[10],以及其他并发症。改善肥胖途径主要包括节食、服药和外科手术等,然而每种方法都存在一定的弊端,如节食难以长期坚持,且可能会对大脑造成不良影响。而药物的副作用较为明显,手术的风险也更大[11]。因此寻求安全高效预防肥胖的活性物质非常必要。
香榧(Torreya grandis),是我国的药食同源食物[12],具有一定的降脂功效[13]。香榧起源于中国,是一种常绿树种,主要分布于中国亚热带丘陵地区,以其可食用且营养价值丰富的种子而闻名[14]。香榧籽油脂含量丰富,约为40%~65%[15],且富含角鲨烯、生育酚、甾醇等天然生物活性物质[16],具有抗炎[17]、抗肿瘤[18]、降脂[13]等诸多生理作用。
香榧仁油是多不饱和脂肪酸的良好来源[19],其含量约为52.58%~56.50%[20],其中以非亚甲基间断多不饱和脂肪酸和具有顺-5乙烯键的多不饱和脂肪酸为主。非亚甲基间断多不饱和脂肪酸包含一种特殊脂肪酸—顺5,11,14-二十碳三烯酸,即金松酸(sciadonic acid,SA),含量为6.68%~11.20%[21−22]。有研究表明,SA能通过减少体内自由基的产生达到减轻氧化应激的效果,并可抑制肝脏和血清中涉及脂肪酸合成酶的活性、提高肉毒碱棕榈酰基转移酶和酰基辅酶A氧化酶的活性,进而调节小鼠的血脂水平,改善肥胖[1]。碳水化合物引起的高甘油三酯血症与肥胖密切相关[23],研究表明SA作为肝脏Δ9-不饱和酶SCD1的抑制剂,能够降低血浆中甘油三酯含量,调节高甘油三酯血症[24],进而改善肥胖。虽然当前研究已证明SA具有一定的减肥作用,但对香榧籽油中SA改善肥胖的降脂机制研究甚少。
本文在已有研究的基础上,以高脂高糖饲料饲喂C57BL/6J小鼠,建立肥胖模型,并在造模的同时使用低、中、高三种剂量的SA进行干预,16周后检测小鼠与肥胖和脂质代谢相关的生理生化指标,旨在更加深入地揭示SA调节高脂饮食诱导的肥胖小鼠肝脏脂质代谢紊乱的作用机制,以期为金松酸降脂减重功能食品的开发提供理论依据。
1. 材料与方法
1.1 材料与仪器
香榧(细榧) 于2022年购自浙江省诸暨市浙江旭璟健康科技有限公司,在干燥阴凉处堆沤至假种皮柔软,剥离假种皮后晾晒种子,蒸馏水冲洗后再次晾晒,得到香榧籽;雄性C57BL/6小鼠 (质量合格证编号20170005070777) 四周龄,体重18~22 g,杭州杭斯生物科技有限公司;小鼠高脂粮(45%)、小鼠普通粮、小鼠垫料 苏州双狮实验动物饲料科技有限公司;总胆固醇(TC)、甘油三酯(TG)、游离脂肪酸(NEFA)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷丙氨酸转氨酶(ALT)、门冬氨酸氨基转移酶(AST)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化酶(GSH-Px)试剂盒 南京建成生物工程研究所;白介素6(IL-6)、白介素1β(IL-1β)试剂盒 武汉博士德有限公司;总RNA提取试剂盒 翌圣生物科技股份有限公司;反转录试剂盒、实时荧光定量 PCR试剂盒 北京天根有限公司。
LDO-101-5型电热恒温鼓风干燥箱 上海龙跃仪器设备有限公司;ZYJ-9028型榨油机 德国Bestday有限公司;FA1004N型分析天平 上海民桥精密科学仪器有限公司;5425R型低温高速冷冻离心机 德国Eppendorf有限公司;JX-24型样品快速研磨仪 上海净信公司;Multiskan SkyHigh多功能酶标仪 赛默飞世尔科技公司;TC-EA-B-48DA型PCR扩增仪 杭州博日科技有限公司;StepOne实时荧光定量PCR仪 美国Applied Biosystems公司。
1.2 实验方法
1.2.1 香榧籽油的制备
将香榧籽样品放置于45 ℃烘箱中干燥一段时间,控制其水分含量在5%以下,然后剥离种壳、种衣,将种仁切碎,采用螺旋压榨得到香榧籽原油,静置分层后,过滤,于10000 r/min离心15 min,取上清,即得香榧籽油。
1.2.2 SA的提取
参照温思思等[25]制备SA的方法,并在其基础上对实验条件加以优化。即将制备脂肪酸乙酯的搅拌时间延长至6 h,并调整包埋时间为20 h。
1.2.3 模型制备及分组
将48只四周龄C57BL/6雄性小鼠在动物房内适应性喂养1周,在此期间内观察每只小鼠的外观、精神状态、自主活动、进食饮水和排泄情况,一周后将小鼠随机分为6组,分别为正常对照组(C组)、肥胖造模组(M组)、奥利司他阳性对照组(S,60 mg/kg)、低剂量SA干预组(LSA,250 mg/kg/d)、中剂量SA干预组(MSA,500 mg/kg/d)和高剂量SA干预组(HAS,750 mg/kg/d),每组8只,实验周期为16周。C组小鼠饲喂基础饲料,其余5组均饲喂高脂饲料(饲料配方见表1),同时对SA干预组小鼠每日上午9时按0.1 mL/10 g/d的剂量灌胃SA溶液,C组和M组小鼠灌胃相同剂量生理盐水。
表 1 高脂饲料配方Table 1. Formula of high-fat feed配方 配比(g) 能量(kcal) 酪蛋白 200 800 胱氨酸 3 12 麦芽糊精 100 400 蔗糖 172.8 691 纤维素 50 0 豆油 25 225 猪油 177.5 1598 矿物质 10 0 磷酸氢钙 13 0 碳酸钙 5.5 0 柠檬酸钠 16.5 0 维生素复合物 10 40 酒石酸胆碱 2 0 合计 858.1 4057 所有实验大鼠均饲养于浙江省农业科学院实验动物中心SPF级动物房内,环境温度22±2 ℃、相对湿度60%±5%、明暗交替12 h/12 h,每周记录小鼠体重及各组小鼠总摄食量,并定期更换小鼠笼具内的垫料及饮水,整个实验过程小鼠皆可自由饮水、饮食,遵循“3R”原则给予实验动物人道主义关怀,动物福利伦理审查批文号2022ZAASLA86。16周后,确定肥胖造模组相对于正常对照组是否肥胖模型造模成功,以及SA干预组是否有减肥的功效。
1.2.4 血清和组织样本的收集
造模给药结束后,小鼠均在不禁止饮水的情况下禁食12 h(9:30 pm至9:30 am),并在处死小鼠前对其体重进行记录,后腹腔注射10%体重的水合氯醛将其麻醉,进行腹腔静脉采血,并将血样置于无菌离心管,于提前预冷至4 ℃的离心机中12000 r/min 离心15 min,分离出血清并保存在−80 ℃冰箱,用于血清生化指标检测。
血取净后,将小鼠脱颈处死,用75%酒精进行全身消毒后进行解剖,分离肝脏等主要脏器,剥离附睾周围脂肪组织垫,经无菌PBS漂洗后用滤纸吸干残留溶液,并依次称重,记录。另因需制作肝脏切片,称重后对肝脏进行切割,分装,制片部分置于盛有4%多聚甲醛溶液的离心管中固定。将所有实验样本置于液氮冷却,储存于−80 ℃冰箱备用。
1.2.5 脂肪及肝脏指数测定
根据1.2.4中称量得到的肝脏和附睾脂肪重量计算肝脏系数与附睾脂肪系数。
肝脏系数(%)=肝脏重量/小鼠体重×100 附睾脂肪系数(%)=附睾脂肪重量/小鼠体重×100 1.2.6 血清生化指标测定
使用相应的检测试剂盒,并根据生产厂家说明书推荐的操作方法及计算公式测定小鼠血清中TC、TG、HDL-C、LDL-C的含量。
1.2.7 肝脏病理组织切片观察
对固定状态良好的肝脏进行剪切,经梯度浓度无水乙醇脱水后,采用二甲苯进行透明处理,浸没石蜡进行包埋,后组织切片4 μm,切片经二甲苯脱蜡、分级酒精脱色脱蜡后,进行HE染色(具体方法参照林宁等[26]肝脏病理组织检测过程),然后再经脱水、透明处理,即可在光学显微镜下观测组织形态并拍照。
1.2.8 肝脏生化指标测定
分别称取1 g小鼠肝脏,于组织匀浆器中匀浆,加入9倍体积生理盐水,制成10%(m/V)肝组织匀浆,并于4 ℃预冷的离心机中,12000 r/min离心10 min,收集上清液,按照试剂盒说明书测定肝脏TC、TG、NEFA、SOD、MDA和GSH-Px水平。
1.2.9 肝脏相关因子 mRNA 表达水平测定
切取100 mg肝脏组织于无酶管中,加入1 mL组织裂解液研磨,将制备的匀浆液按照试剂盒说明书提取RNA。通过TGem Plus全波长分光光度计计算RNA样本的浓度。根据反转录试剂盒的说明将RNA反转录成cDNA,再进行PCR扩增。肝脏组织扩增腺苷酸激活蛋白激酶-α(AMPK-α)、乙酰辅酶A羧化酶1(ACC-1)、脂肪酸合成酶(FAS),固醇元件调节结合蛋白-1c(SREBP-1c)、过氧化物增殖激活受体-α(PPAR-α)、羟甲基戊二酸单酰辅酶还原酶(HMGCR)的基因表达,引物由上海生物工程公司合成,引物序列详见表2。扩增反应条件为:95 ℃预变性30 s,95 ℃变性5 s,不同退火温度34 s,65 ℃延伸1 min,反应循环40次,65℃延伸10 min。数据处理采用2−ΔΔCt法对目的基因(β-actin)进行相对定量分析。
表 2 目的基因引物序列Table 2. Primer sequence of target gene基因 引物序列 正向引物 反向引物 ampk-α1 5’-CGAGTGTTCGGAGGAGGAGGTC-3’ 5’-GTGGGCTGGTTGCTAGGTAGAAATC-3’ acc-1 5’-CCCAGAGATGTTTCGGCAGTCAC-3’ 5’-GTCAGGATGTCGGAAGGCAAAGG-3’ fas 5’-GGATATTGTCGCTCTGAGGCTGTTG-3’ 5’-TGCTCCTTGCTGCCATCTGTATTG-3’ srebp-1c 5’-TGCTGGCTTGGTGATGCTATGTTG-3’ 5’-GAGGGCTGGAAGGCAAAGGAAC-3’ ppar-α 5’-CCTCCTCCCTGTCTTCTGTCCTTC-3’ 5’-GATGACTTGCTCTGCCCTCTGATTC-3’ hmgcr 5’-GACCAACCTTCTACCTCAGCAAGC-3’ 5’-CCAGCCATCACAGTGCCACATAC-3’ β-actin 5’-AGTGTGACGTTGACATCCGT-3’ 5’-GCAGCTCAGTAACAGTCCGC-3’ 1.3 数据处理
采用SPSS 23.0软件对本章数据进行单因素方差分析和t检验,结果以平均值±标准差表示,P<0.05表示差异具有统计学意义。另使用GraphPad Prism 8.0.2软件进行绘图。
2. 结果与分析
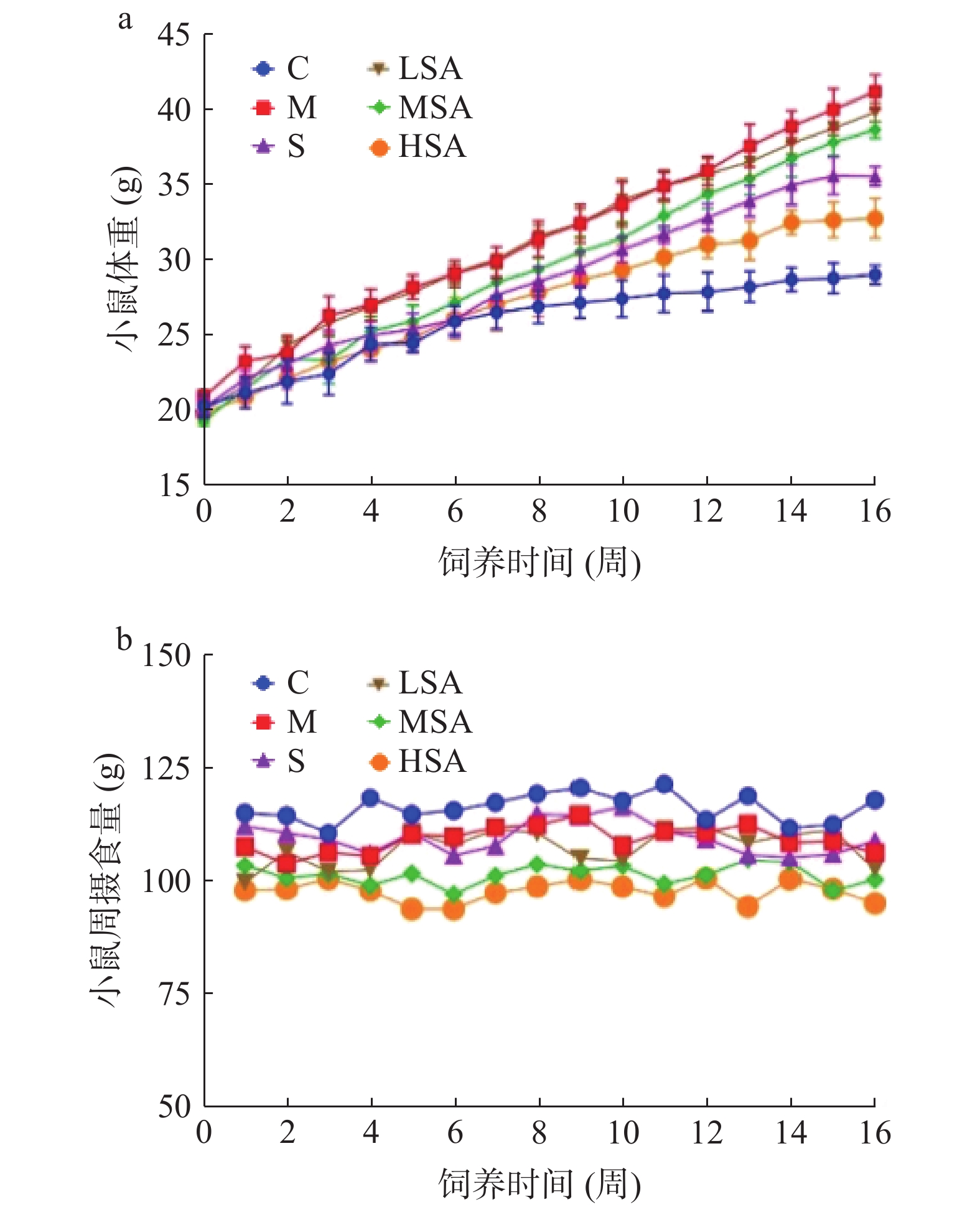
2.1 SA对小鼠体重和摄食量的影响
小鼠的体重可直观的反映出它是否处于肥胖状态[27],进而判断SA对高脂饮食小鼠肥胖的干预效果。如图1a所示,在灌胃实验之前,6组小鼠的初始体重之间无明显差别,这说明分组是合理的。经过 16周的灌胃,各组小鼠体重均呈上升趋势,灌胃期间健康状况良好,毛发有光泽,证实了小鼠饮食结构的合理性。
对16周以来小鼠的体重变化进行比较发现,M组小鼠体重(41.20±1.15) g始终显著高于C组(29.07±0.62) g(P<0.05),且两组间体重差异随饲喂时间的增加而增加,说明该肥胖模型建立成功[28]。灌胃低、中、高三个剂量SA对小鼠体重的增加均有一定的抑制作用(体重分别为39.86±0.63、38.67±0.55、32.80±1.33 g),且作用效果呈现较为明显的剂量依赖性,同时S组小鼠体重(35.6±0.62) g与造模组相比也有明显的降低,证明药物治疗和SA干预可抑制高脂饮食小鼠体重的增加,具有预防肥胖的效果。
同时,通过比较各组小鼠每周的饮食摄入量(图1b)发现,实验初期,各组小鼠摄食量的增加和降低交替出现,分析原因可能是初期的灌胃操作使小鼠产生了应急反应[29]。但在整个实验过程中C组小鼠的饮食摄入量(118.15 g)高于其他各组,LSA组、MSA组和HSA组小鼠相较于C组周均饮食量分别降低了7.68%、12.79%和15.83%,说明SA对小鼠的饮食摄入量有较为明显的抑制作用,且作用效果呈现剂量依赖性。以上结果表明SA酸可能通过抑制小鼠食欲减少其饮食摄入量,从而减少了高脂饮食引起的体重增加,这可能是SA抑制小鼠肥胖的重要原因之一。
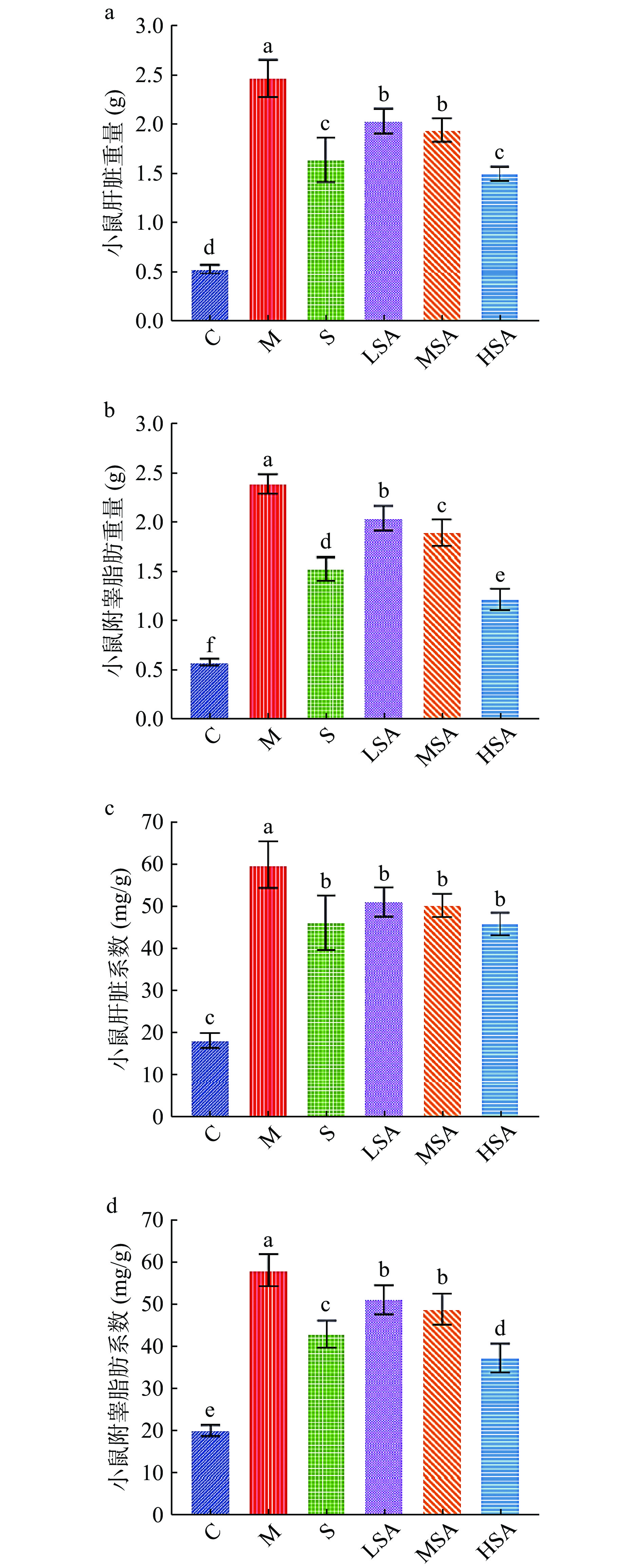
2.2 SA对小鼠附睾脂肪及肝脏指数的影响
小鼠体内肝脏和附睾脂肪质量,肝脏和附睾脂肪系数也是体现其肥胖程度的重要指标[30]。经奥利司他和低、中、高三种剂量SA溶液灌胃治疗16周后,肝脏和附睾脂肪的重量变化如图2a和图2b所示,与C组相比M组小鼠肝脏重量和附睾脂肪重量均显著升高(P<0.05),约为C组的4.64倍和4.10倍,这与高脂高糖食物的摄入有密不可分的联系。而与M组相比,奥利司他治疗和SA干预显著降低了高脂饮食小鼠肝脏和附睾脂肪组织重量(P<0.05),其中HSA组效果最为显著(P<0.05),分别降低了39.11%和48.86%。LSA组和MSA组小鼠肝脏和附睾脂肪重量与S组相比有显著差异(P<0.05),而HSA组肝脏重量与S组相比无显著差异(P>0.05),推测原因可能是SA与辛伐他调节脂质代谢,减缓体重增加的机制相似,且高剂量SA作用效果与辛伐他汀更相近。
肝脏系数和附睾脂肪系数的变化趋势和质量变化趋势相同如图2c和图2d所示,M组小鼠的肝脏和附睾脂肪系数显著高于C组(P<0.05),且分别比正常组增加了69.45%和65.43%。与M组相比,S组、SA处理组小鼠肝脏和附睾脂肪系数均显著下降(P<0.05),且干预效果呈现剂量依赖性,但LSA组、MSA组和HSA组对肝脏系数的影响差异不显著(P>0.05)。图2c中,S组与HSA组肝脏系数无明显差异(P>0.05)。图2d显示,S组与HSA组小鼠附睾脂肪系数虽差异显著(P<0.05)但均向C组靠近(P<0.05),说明在实验剂量范围内SA对动物肝脏和脂肪无损伤作用。综上所述,SA能够显著减少高脂饮食小鼠体内脂肪蓄积,缓解肝脏重量的增加,有效改善小鼠因高脂饮食引起的机体肥胖,且剂量越高,效果越好。
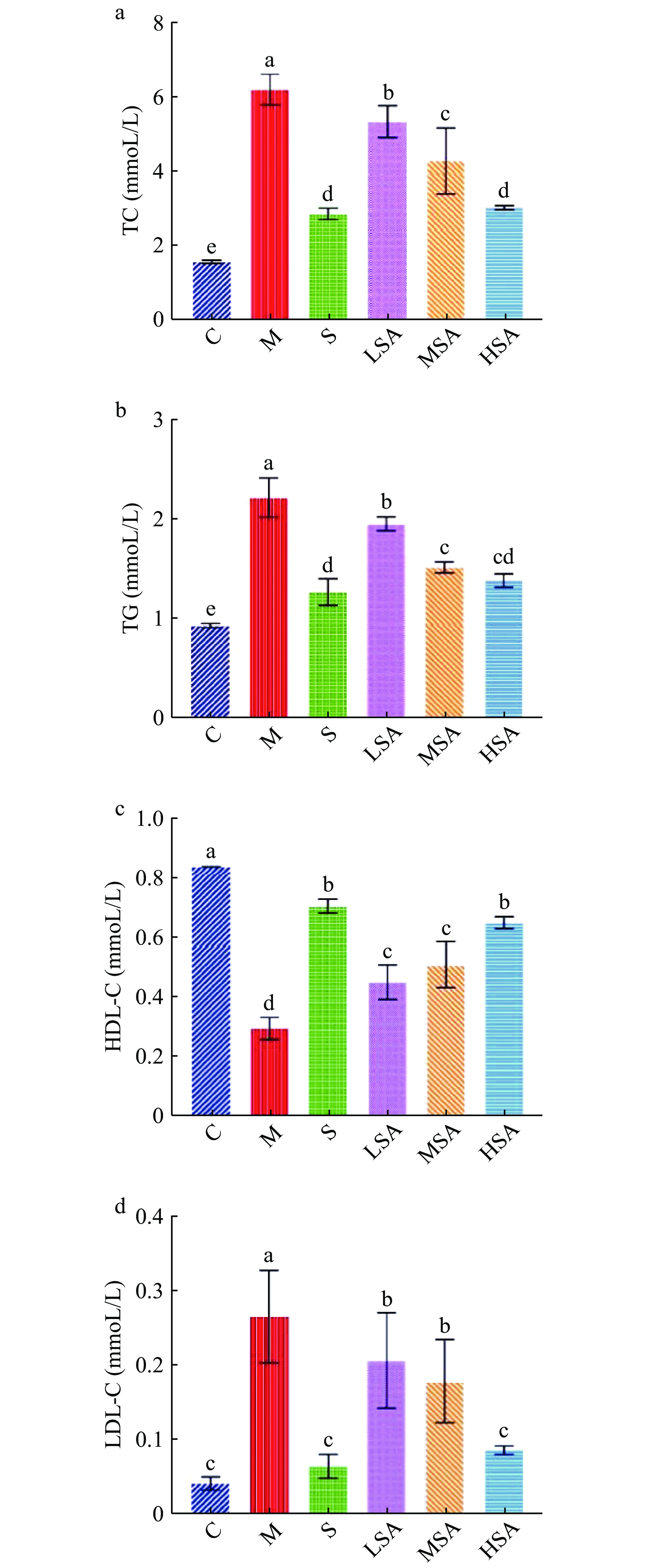
2.3 SA对小鼠血清生化指标的影响
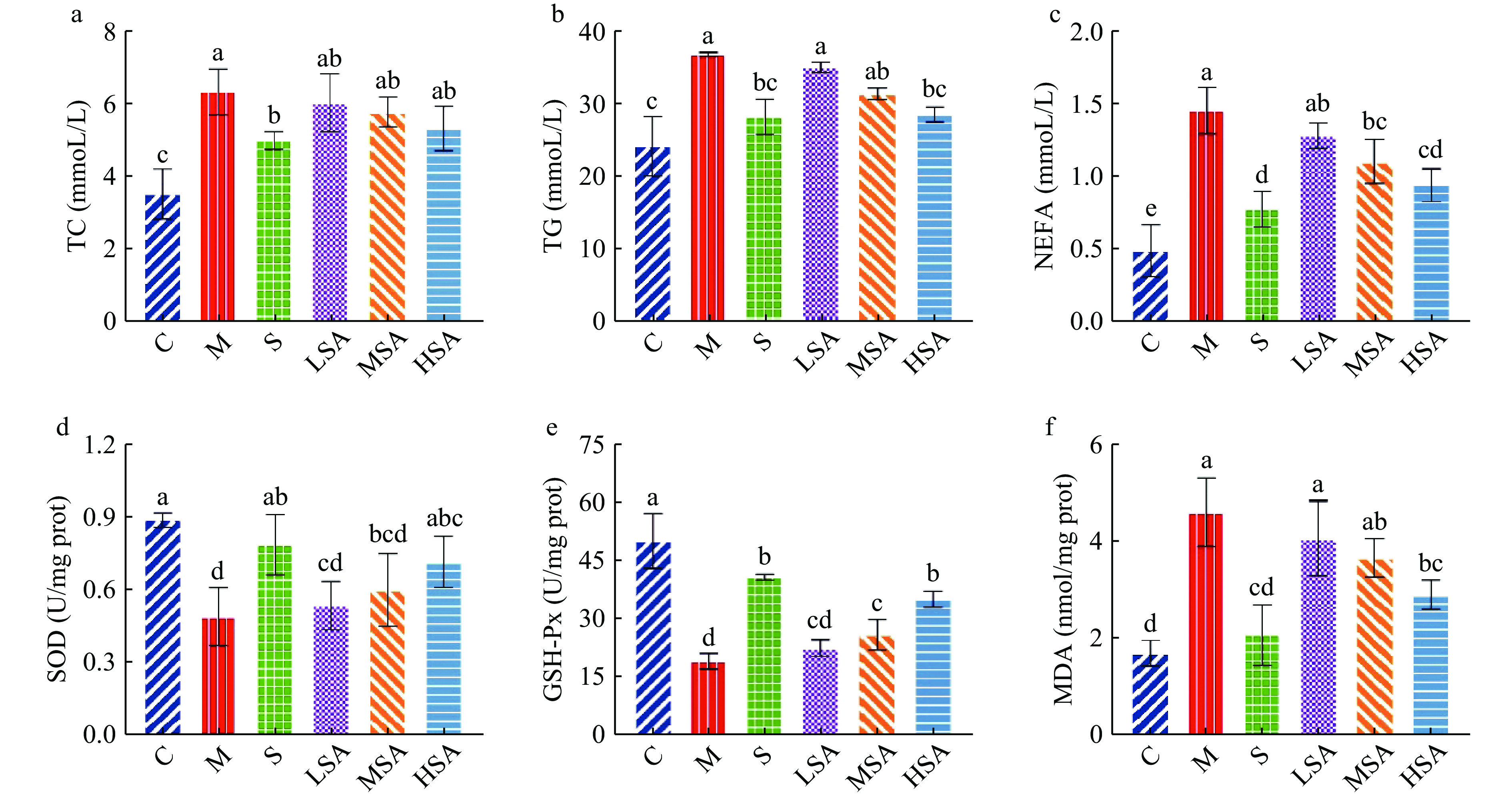
长期高脂饮食可能会引起小鼠血脂代谢紊乱。研究表明,临床上通过对血脂血清学指标进行检测有助于肥胖、高脂血症等疾病的诊断,对早筛早诊早治具有良好的促进作用,血脂指标TC、TG、HDL-C、LDL-C等与肥胖等脂代谢疾病的相关性已得到证实[31]。由图3可知,与C组相比,M组的TC、TG和LDL-C水平显著(P<0.05)升高,而HDL-C水平显著下降(P<0.05),表明小鼠脂质代谢紊乱引起高血脂症。SA干预后,小鼠血脂水平均有不同程度的改善。与M组相比,SA处理组在四项指标中表现出与S组相似的趋势,其中,HSA组效果最为显著(P<0.05),与S组无明显差异(P>0.05)。血清中TC的含量随SA浓度的增加而显著降低(P<0.05),呈现剂量依赖性;而经SA干预后血清中TG和LDL-C含量较M组显著降低(P<0.05),HDL-C含量显著升高(P<0.05),但MSA组TG含量与HSA组无显著差异(P>0.05),LSA组LDL-C和HDL-C的含量与MSA组无显著差异(P>0.05),而LSA组与HSA组始终有显著差异(P<0.05)。综上所述,辛伐他汀和SA都能够降低高脂饮食诱导的肥胖小鼠血清中的TC、TG和LDL-C水平,升高HDL-C水平,对脂质代谢紊乱起到一定程度的改善作用。
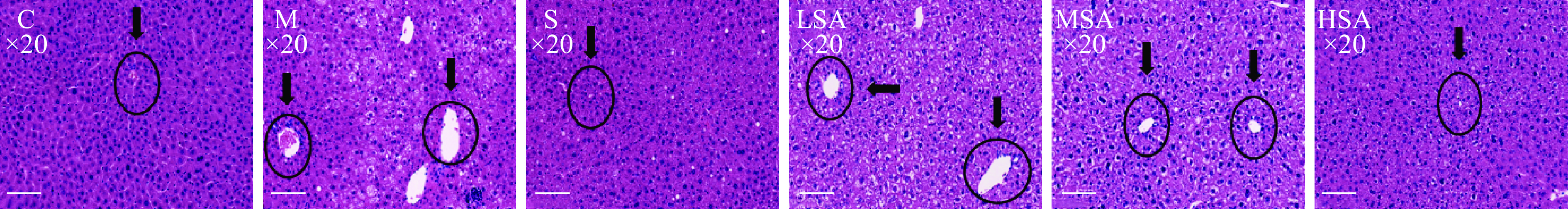
2.4 SA对小鼠肝脏组织病理变化的影响
肝脏是脂肪合成的主要场所,长期高脂高糖的饮食会影响肝脏代谢功能,损伤肝脏形态结构[32]。组织形态学检查是了解脏器受损的程度最直观清晰的手段,各组小鼠肝脏病理切片见图4。C组肝细胞分界清晰,大小较均一,从中心静脉放射出来,肝细胞核圆而清晰,位于细胞中央,胞质丰富,排列规律有序,肝细胞形态正常。而在长期喂食高脂饲料后,M组小鼠出现明显的肝脏病理损伤,少数肝细胞呈气球状,细胞质间有许多白色中性脂质,形成大小不一的脂肪空泡,肝小叶结构模糊,呈现明显的脂肪变性,存在炎性细胞浸润。S组小鼠肝小叶结构清晰,肝细胞脂肪变性明显减少,肝细胞排列较规则,接近正常的状态。SA各剂量组由HFD引起的肝脏病变得到了明显改善,肝组织内小叶结构排列较整齐,脂肪空泡明显减少,炎症浸润得到缓解,肝细胞排列较整齐,细胞质保存良好,细胞核突出,形态正常,其中以HSA组改变最为明显,且与S组效果较为接近。
2.5 SA对小鼠肝脏生化指标的影响
高脂饮食会导致小鼠的肝脏生化指标异常,造成小鼠的代谢紊乱,从而引起小鼠肥胖[33]。如图5a~图5c所示,M组小鼠的肝脏TG、TC和NEFA水平与C组小鼠相比,显著地(P<0.05)增加了1.80、1.52和2.99倍,说明高脂饮食可能诱导肝脏脂质的积累。经奥利司他和SA干预后,相比M组,LSA、MSA、HSA和S组小鼠肝脏TC、TG和NEFA水平均有不同程度的降低,其中S组与M组差异显著(P<0.05),且HSA组TC、TG和NEFA小鼠含量与S组小鼠无显著差异(P>0.05),说明SA干预可以改善高脂饮食诱导的小鼠肝脏脂质积累,进而预防小鼠肥胖,从改善程度上看,高剂量SA效果优于其他剂量。
活性氧自由基(ROS)的过量产生以及抗氧化能力的下降是肥胖氧化应激产生的可能机制之一。机体的防御系统通常可以平衡体内氧自由基的产生和消除,但长期的高脂饮食会导致氧化应激使其失衡,从而导致体内ROS的积累,而大量研究表明机体内自由基水平与肥胖呈显著的正相关性[34]。SOD 是体内主要的氧自由基清除酶,对于缓解体内氧化应激起到重要作用;MDA是体内多不饱和脂肪酸过氧化物的降解产物,具有一定的细胞毒性,可以反应机体内氧化损伤程度的高低[35];GSH-Px是体内抗氧化防御系统的重要组成部分,具有清除和中和体内自由基和过氧化物的作用[36]。如图5d~图5f所示,M组小鼠肝脏SOD和GSH-Px水平显著低于C组小鼠(P<0.05),而其MDA水平则显著高于C组(P<0.05)。经奥利司他干预后,S组小鼠SOD、GSH-Px和MDA水平得到明显改善(P<0.05)。LSA、MSA和HSA组对三个指标的影响与S组趋势相同,且呈现剂量依赖性,其中HSA组与S组差异不显著(P>0.05)。综上,SA能够增加小鼠肝脏SOD和GSH-Px酶活力,同时显著降低MDA水平,从而清除体内自由基,改善氧化应激状态,缓解小鼠肥胖。
2.6 SA对小鼠肝脏相关因子 mRNA 表达水平的影响
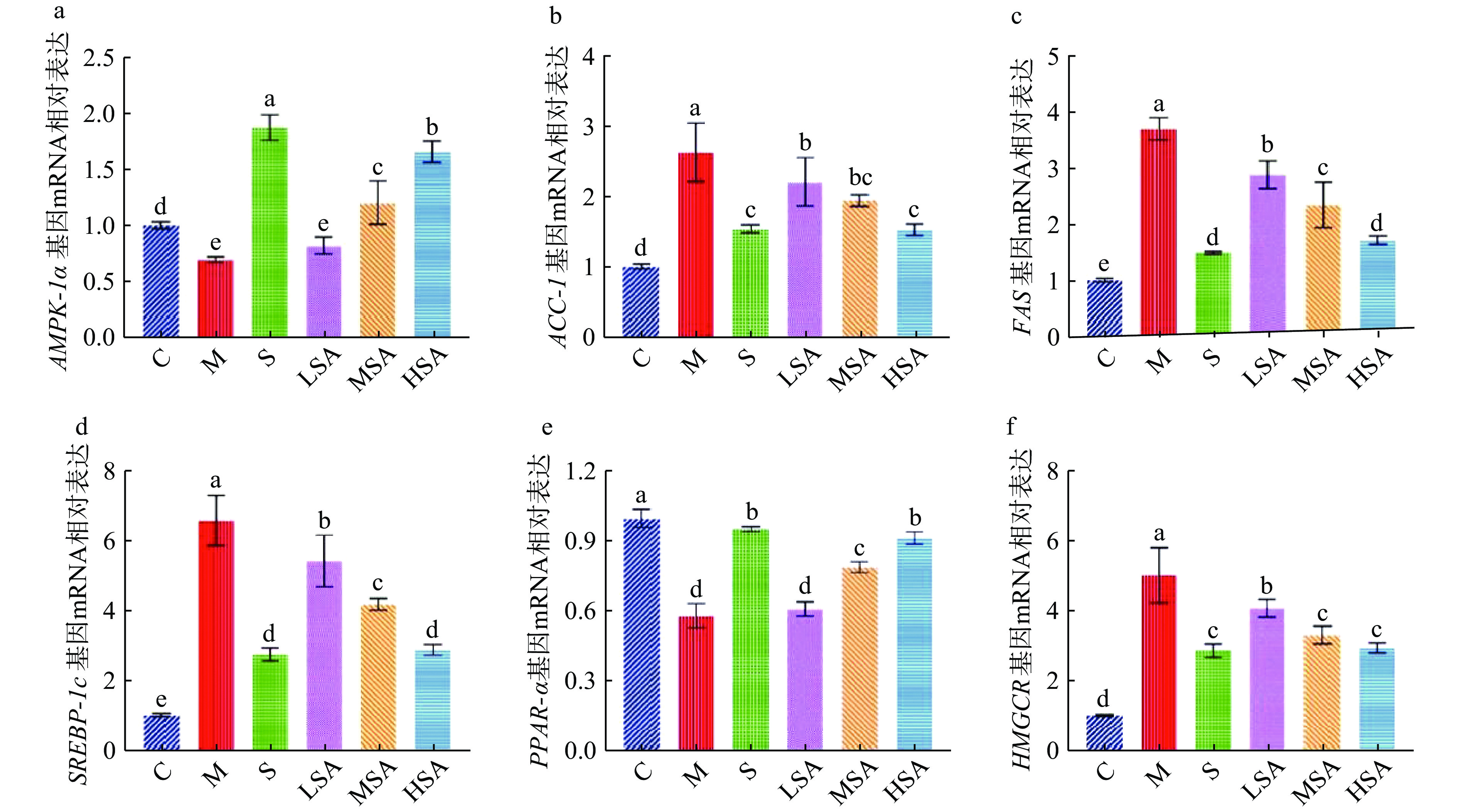
机体脂质合成和代谢通路中,ACC-1、FAS、SREBP-1c、PPAR-α、HMGCR是调控脂类物质合成和代谢的关键基因[37]。SREBP-1c可调控FAS、ACC-1、HGMCR表达上调,增加脂肪酸生物合成,触发肝脏脂肪变性[38];PPAR-α在肝脏组织中高表达,其不但参与肝脏中脂肪酸氧化代谢系统的调节,并且在脂质代谢疾病的发生和发展过程中具有重要作用。而 AMPK-1α能抑制脂肪酸代谢途径,使FAS、ACC-1、SREBP-1c表达下调,PPAR-α表达上调,促进脂质分解代谢[39]。
本实验采用RT-PCR检测影响肝脏脂质积累的重要调节因子mRNA的表达情况,由图6a、图6e可以看出,与C组相比,M组小鼠的肝脏组织中AMPK-1α和脂质代谢相关基因PPAR-α的mRNA表达水平显著降低(P<0.05)。MSA、HSA组显著(P<0.05)改善了AMPK-1α和PPAR-α基因的mRNA表达水平,相对于M组其表达分别增加了41.85%、57.67%和26.57%、36.60%,改善效果呈现明显的剂量依赖性,其中HSA组对PPAR-α mRNA表达水平的影响与S组无显著差异(P>0.05)。而由图6b~图6d、图6f可知,M组小鼠肝脏中脂质合成相关基因ACC-1、FAS、SREBP-1c、HMGCR mRNA的表达水平较C组显著升高(P<0.05)。而SA干预可不同程度的降低此类基因的mRNA表达水平,其中以HSA组效果最为显著(P<0.05),且与阳性药物S组无显著差异(P>0.05)。结果显示,SA可通过抑制脂肪从头合成,增强能量代谢等来改善长期高脂饮食引起的小鼠糖脂代谢异常现象,进而发挥其抗肥胖的作用。
3. 讨论与结论
诸多研究报道香榧籽油中的SA具有调节脂质沉积,促进脂质代谢的作用,进而缓解脂代谢引起的肥胖[1,40],但是其作用机制尚不清楚。本研究证实低、中、高剂量SA干预16周后均能减缓由HFD诱导的小鼠体质量增加、脏器的扩增,并降低血清中脂代谢相关指标TG、TC和LDL-C水平,同时增加HDL-C水平,其中高剂量组效果最佳。
HFD同样会引起肝脏脂代谢紊乱,而肝脏脂质代谢紊乱是引发高血糖、脂肪肝和肥胖等代谢综合征的关键原因[41]。因此,本研究探索了SA影响肝脏脂质代谢的作用机制,结果表明经HFD诱导的小鼠肝脏中脂质大量积累,其组织形态也发生了明显的病变。SA处理可显著降低小鼠肝脏脂质水平,改善肝脏脂肪变性的程度,同时增强小鼠肝脏组织中脂质代谢基因AMPK-1α、PPAR-α的mRNA表达,降低脂质合成基因ACC-1、FAS、SREBP-1c、HMGCR的mRNA表达,改善机体脂质代谢紊乱,从而达到预防或减轻肥胖的目的。
除体重增加、脂质代谢紊乱外,肥胖通常还伴随着氧化应激反应,其中以肝脏的氧化应激最为显著,SOD、GSH-Px和MDA是衡量体内氧化应激水平的重要指标[42]。研究表明,SA干预能显著增加小鼠肝脏中SOD和GSH-Px含量,同时降低氧化应激产物MDA的水平,进而减轻肥胖食小鼠氧化应激反应,保护肝脏组织。
综上所述,SA对高脂饮食诱导的小鼠肥胖有一定的改善作用,该作用可能与抑制脂质合成、促进脂质代谢、降低氧化应激反应等机制有关。
-
表 1 高脂饲料配方
Table 1 Formula of high-fat feed
配方 配比(g) 能量(kcal) 酪蛋白 200 800 胱氨酸 3 12 麦芽糊精 100 400 蔗糖 172.8 691 纤维素 50 0 豆油 25 225 猪油 177.5 1598 矿物质 10 0 磷酸氢钙 13 0 碳酸钙 5.5 0 柠檬酸钠 16.5 0 维生素复合物 10 40 酒石酸胆碱 2 0 合计 858.1 4057 表 2 目的基因引物序列
Table 2 Primer sequence of target gene
基因 引物序列 正向引物 反向引物 ampk-α1 5’-CGAGTGTTCGGAGGAGGAGGTC-3’ 5’-GTGGGCTGGTTGCTAGGTAGAAATC-3’ acc-1 5’-CCCAGAGATGTTTCGGCAGTCAC-3’ 5’-GTCAGGATGTCGGAAGGCAAAGG-3’ fas 5’-GGATATTGTCGCTCTGAGGCTGTTG-3’ 5’-TGCTCCTTGCTGCCATCTGTATTG-3’ srebp-1c 5’-TGCTGGCTTGGTGATGCTATGTTG-3’ 5’-GAGGGCTGGAAGGCAAAGGAAC-3’ ppar-α 5’-CCTCCTCCCTGTCTTCTGTCCTTC-3’ 5’-GATGACTTGCTCTGCCCTCTGATTC-3’ hmgcr 5’-GACCAACCTTCTACCTCAGCAAGC-3’ 5’-CCAGCCATCACAGTGCCACATAC-3’ β-actin 5’-AGTGTGACGTTGACATCCGT-3’ 5’-GCAGCTCAGTAACAGTCCGC-3’ -
[1] WANG H, LI Y, WANG R, et al. Chinese Torreya grandis cv. Merrillii seed oil affects obesity through accumulation of sciadonic acid and altering the composition of gut microbiota[J]. Food Science and Human Wellness,2022,11(1):58−67. doi: 10.1016/j.fshw.2021.07.007
[2] KIM S, HENNEICKE H, L. CAVANAGH L, et al. Osteoblastic glucocorticoid signaling exacerbates high-fat-diet induced bone loss and obesity[J]. Bone Research,2021,9(4):537−548.
[3] PAN X F, WANG L M, PAN A. Epidemiology and determinants of obesity in China[J]. The Lancet Diabetes & Endocrinology,2021,9(6):373−392.
[4] 卜军, 陈章炜, 崔晓通, 等. 中国成人代谢异常与心血管疾病防治[J]. 上海医学,2020,43(3):129−164. [BU J, CHEN Z W, CUI X T, et al. Current status ot metabolic abnormality & treatment of cardiovascular diseases in Chinese adults[J]. Shanghai Medical & Pharmaceutical Journal,2020,43(3):129−164.] BU J, CHEN Z W, CUI X T, et al . Current status ot metabolic abnormality & treatment of cardiovascular diseases in Chinese adults[J]. Shanghai Medical & Pharmaceutical Journal,2020 ,43 (3 ):129 −164 .[5] JOHN G K, WANG L, NANAVATI J, et al. Dietary alteration of the gut microbiome and its impact on weight and fat mass:A systematic review and meta-analysis[J]. Genes,2018,9(3):167. doi: 10.3390/genes9030167
[6] LI S, ZHAO J H, LUAN J, et al. Genetic predisposition to obesity leads to increased risk of type 2 diabetes[J]. Diabetologia,2011,54(4):776−782. doi: 10.1007/s00125-011-2044-5
[7] FUJII R, PATTARO C. Genetically-instrumented public health:Facing obesity to prevent chronic kidney disease[J]. Cardiovascular research, 2022, 18(5): 3013−3015.
[8] ANCA T, ADRIAN R, REMUS S, et al. Clinical and laboratory characteristics of normal weight and obese individuals with non-alcoholic fatty liver disease[J]. Diagnostics,2022,12(4):801. doi: 10.3390/diagnostics12040801
[9] CONNOLLY K, BATACAN R J, JACKSON D, et al. Perindopril prevents development of obesity and hypertension in middle aged diet-induced obese rat models of metabolic syndrome[J]. Life Sciences,2022,314:121291.
[10] TIM B, REBECCA L S. Body fatness as a cause of cancer:Epidemiologic clues to biologic mechanisms[J]. Endocrine-related cancer, 2015, 22(3): R125-R134.
[11] MOPURI R, ISLAM M S. Medicinal plants and phytochemicals with anti-obesogenic potentials:A review[J]. Biomedicine & Pharmacotherapy,2017,89:1442−1452.
[12] LIU M, VERYSER C, LU J G, et al. Bioassay-guided isolation of active substances from Semen Torreyae identifies two new anthelmintic compounds with novel mechanism of action[J]. Journal of Ethnopharmacology,2018,224:421−428. doi: 10.1016/j.jep.2018.06.026
[13] 肖铭慧, 黄敏婕, 董捷, 等. 香榧籽油对高脂膳食SD大鼠脂质代谢的影响及机理[J]. 中国油脂,2022,47(3):71−77. [XIAO M H, HUANG M J, DONG J, et al. Effect of Torreya grandis cv. Merrilli seed oil on lipid metabolism in SD rats fed with high fat diet[J]. China Oils and Fats,2022,47(3):71−77.] XIAO M H, HUANG M J, DONG J, et al . Effect of Torreya grandis cv. Merrilli seed oil on lipid metabolism in SD rats fed with high fat diet[J]. China Oils and Fats,2022 ,47 (3 ):71 −77 .[14] 朱杰丽, 柴振林, 吴翠蓉, 等. 浙江省香榧及其油脂综合性状研究[J]. 中国粮油学报,2019,34(3):67−73. [ZHU J L, CHAI Z L, WU C R, et al. Comprehensive research on the quality of torreya grandis and its oil in Zhejiang Province[J]. Journal of the Chinese Cereals and Oils Association,2019,34(3):67−73.] ZHU J L, CHAI Z L, WU C R, et al . Comprehensive research on the quality of torreya grandis and its oil in Zhejiang Province[J]. Journal of the Chinese Cereals and Oils Association,2019 ,34 (3 ):67 −73 .[15] SHI L K, MAO J H, ZHENG L, et al. Chemical characterization and free radical scavenging capacity of oils obtained from Torreya grandis Fort. ex. Lindl. and Torreya grandis Fort. var. Merrillii:A comparative study using chemometrics[J]. Industrial Crops and Products,2018,115:250−260. doi: 10.1016/j.indcrop.2018.02.037
[16] 李哲斌. 香榧仁油的营养特性研究进展[J]. 中国油料作物学报,2022,44(6):1166−1172. [LI Z B. Progress in nutritional property of Torreya grandis kernel oil[J]. Oil Crop Science,2022,44(6):1166−1172.] LI Z B . Progress in nutritional property of Torreya grandis kernel oil[J]. Oil Crop Science,2022 ,44 (6 ):1166 −1172 .[17] CHEN B Q, CUI X Y, ZHAO X, et al. Antioxidative and acute antiinflammatory effects of Torreya grandis[J]. Fitoterapia,2006,77(4):262−267. doi: 10.1016/j.fitote.2006.03.019
[18] YOU J S, HE S C, CHEN L, et al. Analysis of pharmacological activities and mechanisms of essential oil in leaves of C. grandis 'Tomentosa' by GC-MS/MS and network pharmacology[J]. Combinatorial Chemistry & High Throughput Screening, 2023, 26(9):1689−1700.
[19] 王衍彬, 刘本同, 秦玉川, 等. 不同品种香榧种子油脂肪酸及香味物质组成分析[J]. 中国油脂,2016,41(2):101−105. [WANG Y B, LIU B T, QIN Y C, et al. Comparison of fruit characteristics and fatty acid composition of different Torreya grandis varieties[J]. China Oils and Fats,2016,41(2):101−105.] WANG Y B, LIU B T, QIN Y C, et al . Comparison of fruit characteristics and fatty acid composition of different Torreya grandis varieties[J]. China Oils and Fats,2016 ,41 (2 ):101 −105 .[20] 毛家辉. 品种、产地和制油工艺对榧籽油成分的影响[D]. 无锡:江南大学, 2017. [MAO J H. Effect of varieties, regions and production process on the component of Torreya grandis seed oil[J]. Wuxi:Jiangnan University, 2017.] MAO J H. Effect of varieties, regions and production process on the component of Torreya grandis seed oil[J]. Wuxi: Jiangnan University, 2017.
[21] ENDO Y, TSUNOKAKE K, IKEDA I. Effects of non-methylene-interrupted polyunsaturated fatty acid, sciadonic (all-cis-5, 11, 14-eicosatrienoic acid) on lipid metabolism in rats[J]. Bioscience, Biotechnology, and Biochemistry,2009,73(3):577−581. doi: 10.1271/bbb.80646
[22] WOLFF R L, PÉDRONO F, PASQUIER E, et al. General characteristics of Pinus spp. seed fatty acid compositions, and importance of δ5-olefinic acids in the taxonomy and phylogeny of the genus[J]. Lipids,2000,35(1):1−22. doi: 10.1007/s11745-000-0489-y
[23] ECKEL R H. The complex metabolic mechanisms relating obesity to hypertriglyceridemia[Z]. Am Heart Assoc,2011:1946−8.
[24] PÉDRONO F, BOULIER-MONTHÉAN N, BOISSEL F, et al. Sciadonic acid derived from pine nuts as a food component to reduce plasma triglycerides by inhibiting the rat hepatic Δ9-desaturase[J]. Scientific Reports,2020,10(1):6223. doi: 10.1038/s41598-020-63301-3
[25] 温思思, 陆元超, 丁珏, 等. 金松酸对HepG2细胞中甘油三酯蓄积的影响[J]. 中国粮油学报,2022,37(11):191−198. [WEN S S, LU Y C, DING J, et al. Effects of sciadonic acid on triglyceride accumulation in HepG2 cells[J]. Journal of the Chinese Cereals and Oils Association,2022,37(11):191−198.] WEN S S, LU Y C, DING J, et al . Effects of sciadonic acid on triglyceride accumulation in HepG2 cells[J]. Journal of the Chinese Cereals and Oils Association,2022 ,37 (11 ):191 −198 .[26] 林宁. 人参皂甙Rb1对高脂饮食诱导C57/BL6小鼠肥胖的预防作用及机制探讨[D]. 上海:第二军医大学, 2010. [LIN N. The preventive effect of paranoxsides Rb1 on diet-induced obese C57/BL6 mice and its mechanism[D]. Shanghai:The Second Military Medical University, 2010.] LIN N. The preventive effect of paranoxsides Rb1 on diet-induced obese C57/BL6 mice and its mechanism[D]. Shanghai: The Second Military Medical University, 2010.
[27] 郭彩霞, 韩丽, 乔进平, 等. 翅果油对高脂饮食小鼠的降脂减肥作用[J]. 食品工业科技,2020,41(5):293−298. [GUO C X, HAN L, QIAO J P, et al. The prevention effect of elaeagnus mollis oil on high-fat diet induced obesity in mice[J]. Science and Technology of Food Industry,2020,41(5):293−298.] GUO C X, HAN L, QIAO J P, et al . The prevention effect of elaeagnus mollis oil on high-fat diet induced obesity in mice[J]. Science and Technology of Food Industry,2020 ,41 (5 ):293 −298 .[28] 许阳, 胡新中, 张恒, 等. 燕麦米对肥胖小鼠减肥降脂作用的研究[J]. 中国粮油学报,2013,28(2):15−21. [XU Y, HU X Z, ZHANG H, et al. The function of oat-rice in reducing obesity and blood lipids of obese mice[J]. Journal of the Chinese Cereals and Oils Association,2013,28(2):15−21.] XU Y, HU X Z, ZHANG H, et al . The function of oat-rice in reducing obesity and blood lipids of obese mice[J]. Journal of the Chinese Cereals and Oils Association,2013 ,28 (2 ):15 −21 .[29] 于智慧, 周丽媛, 朱迎春. 全蛋及去蛋黄替代物摄入对代谢综合征小鼠脂代谢调控作用的比较分析[J]. 现代食品科技,2022,38(6):37−45,83. [YU Z H, ZHOU L Y, ZHU Y C. Comparative analysis of effects of whole egg and substitute of egg yolk consumption on lipid metabolism in mice with metabolic syndrome[J]. Modern Food Science & Technology,2022,38(6):37−45,83.] YU Z H, ZHOU L Y, ZHU Y C . Comparative analysis of effects of whole egg and substitute of egg yolk consumption on lipid metabolism in mice with metabolic syndrome[J]. Modern Food Science & Technology,2022 ,38 (6 ):37 −45,83 .[30] 孔欠文, 卫克昭, 张世瑜, 等. 花生油、橄榄油和猪油对小鼠血脂水平、肥胖及糖尿病易感性的影响研究[J]. 中国油脂,2019,44(8):96−101. [KONG Q W, WEI K Z, ZHANG S Y, et al. Effects of peanut oil, olive oil and lard on serum lipid level, obesity and diabetes susceptibility in mice[J]. China Oils and Fats,2019,44(8):96−101.] KONG Q W, WEI K Z, ZHANG S Y, et al . Effects of peanut oil, olive oil and lard on serum lipid level, obesity and diabetes susceptibility in mice[J]. China Oils and Fats,2019 ,44 (8 ):96 −101 .[31] WANG D X, QING S L, MIAO Z W, et al. Hepatic nampt deficiency aggravates dyslipidemia and fatty liver in high fat diet fed mice[J]. Cells, 2023, 12:568.
[32] 陈敏, 尹明雨, 赵一梦, 等. 甜叶菊提取物对高糖脂饮食鼠血脂及其肠道菌群的影响[J]. 食品与发酵工业,2023,49(14):242−249. [CHEN M, YIN M Y, ZHAO Y M, et al. Effects of stevia extract on blood lipids and intestinal flora in mice fed with high sugar and fat diet[J]. Food and Fermentation Industries,2023,49(14):242−249.] CHEN M, YIN M Y, ZHAO Y M, et al . Effects of stevia extract on blood lipids and intestinal flora in mice fed with high sugar and fat diet[J]. Food and Fermentation Industries,2023 ,49 (14 ):242 −249 .[33] PANCHAL S K, POUDYAL H, IYER A, et al. High-carbohydrate, high-fat diet–induced metabolic syndrome and cardiovascular remodeling in rats[J]. Journal of Cardiovascular Pharmacology,2011,57(5):51−64.
[34] CLARA L, MALOU F P, ROBERTO P R, et al. Mitochondrial oxidative stress in obesity:Role of the mineralocorticoid receptor[J]. The Journal of Endocrinology,2018,238(3):R143−R159. doi: 10.1530/JOE-18-0163
[35] 张佳丽, 张爱霞, 赵巍, 等. 发芽粟米对高血脂症小鼠血脂调节和抗氧化作用的研究[J]. 中国粮油学报,2020,35(3):37−44. [ZHANG J L, ZHANG A X, ZHAO W, et al. Effects of germinated millet on blood lipid and antioxidation in hyperlipidemia mice[J]. Journal of the Chinese Cereals and Oils Association,2020,35(3):37−44.] ZHANG J L, ZHANG A X, ZHAO W, et al . Effects of germinated millet on blood lipid and antioxidation in hyperlipidemia mice[J]. Journal of the Chinese Cereals and Oils Association,2020 ,35 (3 ):37 −44 .[36] WANG J, YANG R W, LIU J B, et al. Effects of soybean antioxidant peptides (SAP) on SOD, GSH-Px, CAT activity and MDA level in vivo [J]. Advanced Materials Research, 2014, 3482(1025−1026).
[37] 刘小微, 李娟娥, 姜小帆, 等. 丹蒌片对载脂蛋白E基因敲除小鼠血脂及AMPK/SREBP通路的影响[J]. 陕西中医, 2021, 42(11):1531−5. [LI X W, LI J E, JIANG X F, et al. Effects of piper betel tablets on blood lipids and AMPK/SREBP pathway in ApoE knockout mice [J]. Shaanxi Journal of Traditional Chinese Medicine, 2021, 42(11):1531−1535.] LI X W, LI J E, JIANG X F, et al. Effects of piper betel tablets on blood lipids and AMPK/SREBP pathway in ApoE knockout mice [J]. Shaanxi Journal of Traditional Chinese Medicine, 2021, 42(11): 1531−1535.
[38] LI X J, XU Z M, WANG S J, et al. Emodin ameliorates hepatic steatosis through endoplasmic reticulum-stress sterol regulatory element-binding protein 1c pathway in liquid fructose-feeding rats[J]. Hepatology Research:The official journal of the Japan Society of Hepatology,2016,46(3):12538.
[39] 曾丽荣. 膳食单宁酸抑制高脂饮食诱导的小鼠肥胖的调控机制[D]. 武汉:武汉科技大学, 2020. [ZENG L R. The mechanism of dietary tannic acid prevents high-fat-diet induced obesity in mice [D]. Wuhan:Wuhan University of Technology, 2020.] ZENG L R. The mechanism of dietary tannic acid prevents high-fat-diet induced obesity in mice [D]. Wuhan: Wuhan University of Technology, 2020.
[40] CHEN L, JIANG Q H, JIANG C K, et al. Sciadonic acid attenuates high-fat diet-induced obesity in mice with alterations in the gut microbiota[J]. Food & Function,2023,14(6):2870−2880.
[41] XU M X, GE C X, QIN Y T, et al. Activated TNF- α/RIPK3 signaling is involved in prolonged high fat diet-stimulated hepatic inflammation and lipid accumulation:Inhibition by dietary fisetin intervention[J]. Food & Function,2019,10(3):1302−1316.
[42] GAO Q Y, LUO Z, MA S, et al. Microbe-derived antioxidants alleviate liver and adipose tissue lipid disorders and metabolic inflammation induced by high fat diet in mice[J]. International Journal of Molecular Sciences,2023,24(4):3269. doi: 10.3390/ijms24043269
-
期刊类型引用(2)
1. 解鹏,高岳,吴晨奇,崔保威,王芳,王慧,范娜. 不同种类原料肉对发酵香肠理化品质及风味特性的影响. 肉类研究. 2025(03): 29-34 .  百度学术
百度学术
2. 左敏,纪慧卓,苏礼君,张玉玉,颜文婧,张青川,孔建磊. 人工智能在食品安全中的最新应用及进展. 中国食品学报. 2024(10): 1-13 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



