Determination of Polyphenol Content and Antioxidant Activity of Houttuynia cordata Leaves Using HPLC-ECD
-
摘要: 目的:建立高效液相色谱-电化学检测法(High performance liquid chromatography-electrochemical detection,HPLC-ECD)测定鱼腥草叶中多酚类化合物,并采用相关性分析方法明确不同多酚单体化合物对于抗氧化活性的贡献。方法:鱼腥草叶经80%(v/v)甲醇超声提取,基于建立的HPLC-ECD检测方法测定12种多酚化合物含量。采用福林酚法测定鱼腥草叶总酚含量,以自由基清除能力和铁离子还原能力进行抗氧化活性评价,采用聚类热图和灰色关联分析法进行多元统计分析。结果:建立的HPLC-ECD方法线性、精密度、重复性、稳定性均良好,平均加样回收率为93.25%~103.97%,RSD为1.99%~4.47%。不同来源的鱼腥草叶的总酚含量为5.98~52.86 mg GAE/g,其含量与ABTS+、DPPH自由基清除能力和铁离子还原能力显著性相关(P<0.05)。鱼腥草中含量较高的多酚类化合物为咖啡酸和槲皮素的衍生物,12种酚类化合物均与抗氧化活性有较高的关联度,其中异槲皮苷、槲皮苷、异绿原酸A、金丝桃苷、芦丁的相关性最高。本研究明确了鱼腥草叶抗氧化的主要活性成分,可以为鱼腥草质量评价和资源开发提供参考。Abstract: Objective: To establish a high performance liquid chromatography-electrochemical detection (HPLC-ECD) method for the determination of polyphenolic compounds in the leaves of Houttuynia cordata and investigate the contribution of different compounds to the antioxidant activity by the correlation analysis. Methods: The leaves of Houttuynia cordata were extracted by ultrasonic extraction with 80% (v/v) methanol, and the content of 12 polyphenolic compounds was determined by the established HPLC-ECD method. The total phenolics content of Houttuynia cordata leaves was determined by the Folin-ciocalteu method. The antioxidant activities were evaluated by radical scavenging ability and ferric reducing antioxidant power (FRAP). Cluster heat map and gray correlation analysis were used for multivariate statistical analysis. Results: The established HPLC-ECD method showed good linearity, precision, repeatability and stability, with an average recovery of 93.25%~103.97% and RSD value of 1.99%~4.47%. The total phenolic content of Houttuynia cordata leaves from different sources ranged from 5.98~52.86 mg GAE/g, which was significantly correlated with ABTS+, DPPH radical scavenging ability and ferric ion reduction ability (P<0.05). The polyphenolic compounds with high content in Houttuynia cordata were derivatives of caffeic acid and quercetin. All of the 12 phenolic compounds had a high degree of correlation with antioxidant activity, among which isoquercitrin, quercetin, isochlorogenic acid A, hyperoside and rutin were the highest. The present study elucidated the primary antioxidant components in Houttuynia cordata leaves, which would provide reference for the quality evaluation and resource development of Houttuynia cordata.
-
鱼腥草为三白草科植物蕺菜(Houttuynia cordata Thunb.)的全草,产于长江以南,在云南、贵州、四川等地栽培较多,资源极丰富[1−2]。鱼腥草味辛,性微寒,具有清热解毒、消肿排脓、利尿通淋之功效。自古以来,鱼腥草都是人们喜爱的特色蔬菜之一,也是国家卫生部正式确定的药食两用植物资源之一,其根茎叶均可食用。鱼腥草富含多酚、黄酮类、醛酮类化合物[3],具有清除体内活性氧自由基,防止生物膜脂质被超氧自由基和羟自由基氧化的功能[4−5]。研究表明鱼腥草中槲皮苷、金丝桃苷、芦丁、绿原酸等多酚类成分为其中重要的活性成分,也是抗氧化活性的主要来源[6−7]。
植物多酚为含有多个酚羟基的一类化合物,常见的有酚酸、黄酮、木质素等[8],这些多酚类次生代谢产物能清除自由基而具有抗氧化活性,继而产生抗炎、抗病毒、利尿、治肺炎、肺脓疡等作用[9−10]。高效液相色谱法(High performance liquid chromatography,HPLC)是植物多酚研究最常用方法,结合紫外-可见、串联质谱等检测器,可以对单体化合物准确鉴别并进行定量分析,目前已经广泛用于食用油[11]、蔬菜[12]、水果[13]中的多酚分析。
在HPLC常用的检测方法中,电化学检测法(Electrochemical detection,ECD)可以特异性检测还原性化合物,避免生物碱、多糖等化学成分的干扰,在筛查天然产物抗氧化活性成分中有独特的优势[14]。ECD灵敏度极高,且同时具有选择性好、响应快等特点,在制药、化学、食品质量控制以及其它方面发挥着不可替代的作用[15−17]。此外,ECD的色谱峰反映了电荷转移,可以作为抗氧化成分筛选以及抗氧化能力评价的手段,其色谱峰面积可以反映化合物的还原能力,并且同自由基清除能力存在一定的相关性[18−19]。尤其对于酚类[20]、硫醇类[21]化合物具有极高的选择性和灵敏度,常用于筛查和检测植物中的酚类抗氧化活性成分。例如,吴其妹等[22]通过HPLC-ECD对牡荆叶的酚类化合物及其含量进行分析,并结合谱效关系建立了多指标成分的定量测定及指纹图谱控制方法;何婷等[23]利用HPLC-ECD指纹图谱结合体外抗氧化法对夏枯草进行质量评价。这些研究都证实了HPLC-ECD研究植物多酚类化合物的抗氧化活性的可靠性。
多酚类次生代谢产物是评价鱼腥草质量的重要指标,目前,已经从鱼腥草中鉴定出几十种多酚类成分[1,24],然而,现有的质量评价方法多针对其中的少数几种化合物进行测定,如槲皮苷、绿原酸以及金丝桃苷等几种含量较高的化合物[25−27]。少数几种化合物的含量测定不仅无法全面评价鱼腥草质量,而且无法明确不同的多酚化合物对于抗氧化的贡献,将成分和活性的研究独立开来[6,28−30]。为了解决此问题,本研究拟采用HPLC-ECD建立一种简便、快速的方法测定不同来源鱼腥草叶中的多酚类化合物,进而采用相关性分析的方法明确不同化合物同抗氧化活性的贡献。从而建立基于抗氧化活性的鱼腥草叶质量评价方法,为其功能性利用和产品的开发提供参考。
1. 材料与方法
1.1 材料与仪器
25份鱼腥草叶样本 采自贵州、湖南、江西等地,其详细信息见表1。新鲜鱼腥草叶于45 ℃进行烘干,粉碎后过60目筛,于4 ℃条件下保存备用;乙腈 色谱级,北京伊诺凯科技有限公司;原儿茶酸、儿茶素、异槲皮苷 Ark Pharm公司;新绿原酸、隐绿原酸 上海安谱实验科技股份有限公司;芦丁、异绿原酸A 成都普菲德生物技术有限公司;咖啡酸、槲皮苷、金丝桃苷、绿原酸、表儿茶素 上海阿拉丁生化科技股份有限公司;所有对照品纯度≧98%,其余试剂为分析纯;实验用水 均为实验室自制超纯水。
表 1 鱼腥草叶的来源Table 1. Sources of Houttuynia cordata leaves样品
编号采样时间 产地 样品编号 采样时间 产地 样品编号 采样时间 产地 S1 2021年6月 贵州凯里 S10 2021年6月 贵州遵义 S19 2021年7月 贵州毕节 S2 2021年6月 贵州毕节 S11 2021年6月 贵州遵义 S20 2021年6月 江西宜春 S3 2021年6月 陕西汉中 S12 2021年7月 贵州遵义 S21 2021年6月 贵州毕节 S4 2021年6月 安徽亳州 S13 2021年7月 贵州遵义 S22 2021年7月 贵州黔西南 S5 2021年7月 贵州遵义 S14 2021年6月 贵州遵义 S23 2021年6月 贵州遵义 S6 2021年6月 贵州遵义 S15 2021年7月 贵州毕节 S24 2021年6月 贵州铜仁 S7 2021年6月 贵州遵义 S16 2021年6月 贵州遵义 S25 2021年7月 贵州毕节 S8 2021年7月 安徽六安 S17 2021年6月 贵州遵义 S9 2021年6月 贵州毕节 S18 2021年6月 湖南益阳 Ultimate 3000 bio-RS高效液相色谱仪 赛默飞世尔科技;Purelab Chorus 2纯水及超纯水系统 英国埃尔格公司;ME104E/02电子天平 美国梅特勒-托利公司;Microfuge 20型台式离心机 贝克曼库尔特公司。
1.2 实验方法
1.2.1 色谱分析条件
以XBridge BEH shield RP18(3.0 mm×150 mm,填料粒径2.5 μm)色谱柱分离,柱温为45 ℃,进样量为1 μL,流速为0.6 mL/min,进样器温度为10 ℃,以乙腈(A)-0.2%柠檬酸缓冲溶液(氨水调节pH=2.70,B)为流动相,电化学检测器的电压设置为650 mV。洗脱梯度为0~18 min,5%~8% A;18~38 min,8%~25% A;38~40 min,25%~80% A;42~44 min,80% A。
1.2.2 供试品溶液的制备
称取1.0 g鱼腥草叶样品粉末,在40 ℃条件下加40 mL 80%(v/v)甲醇,超声30 min。提取液离心5 min(10000 r/min)取上清液,经0.22 μm滤膜过滤后,用于抗氧化活性研究和HPLC测定。
1.2.3 标准品溶液的配制
依次精密称取“1.1”项下试剂中的12种标准品加入80%(v/v)甲醇溶解分别制成2.0 mg/mL的储备液−20 ℃下备用。使用时根据实验需要取用,用80%(v/v)甲醇配制成所需浓度的混合标准工作液。
1.2.4 总酚含量测定
采用Folin-Ciocalteus法,参考文献[23],取提取液稀释100倍之后取250 μL加入0.25 mol/L Folin酚试剂250 μL混合均匀,静置3 min后加入15%的Na2CO3溶液500 μL,混合均匀,常温放置30 min后取上清液于波长760 nm处测定吸光值。样品中的总酚含量以每克干重含没食子酸当量表示(mg GAE /g)。
1.2.5 抗氧化活性测定
1.2.5.1 ABTS+自由基清除能力
参考文献[31−32],吸取0.2 mL 6.83 mmol/L ABTS试剂和0.2 mL 2.47 mmol/L K2S2O8储备液混合,暗反应12 h后稀释至734 nm处吸光度0.7±0.2。取400 μL ABTS工作液和200 μL样品(稀释120倍)混合,于暗处反应30 min,以80%(v/v)甲醇为对照,分别测定波长734 nm处的吸光值,计算清除率。
1.2.5.2 DPPH自由基清除能力
参考文献[31−32],用80%(v/v)甲醇配制成0.14 mmol/L DPPH溶液。取200 μL样品(稀释50倍)加入400 μL的DPPH混合,混匀后于室温下避光静置30 min,测定其在波长517 nm处的吸光值,计算清除率。
1.2.5.3 FRAP法
参考文献[31−32],将20 mmol/L FeCl3溶液:10 mmol/L TPTZ溶液:300 mmol/L醋酸钠=1:1:10混合配制TPTZ工作液。吸取400 μL样品,加入300 μL TPTZ工作液在37 ℃下反应10 min后波长593 nm处测其吸光度。以Trolox当量评价其铁离子还原能力(mg TE /g)。
1.3 数据处理
总酚含量和体外抗氧化测定的最终结果以均值±SD表示;采用Origin 2018版软件对检测电压的优化、样品和对照品色谱图以及聚类分析结果进行绘图。
2. 结果与分析
2.1 HPLC-ECD检测方法的建立
2.1.1 HPLC-ECD检测电压的选择
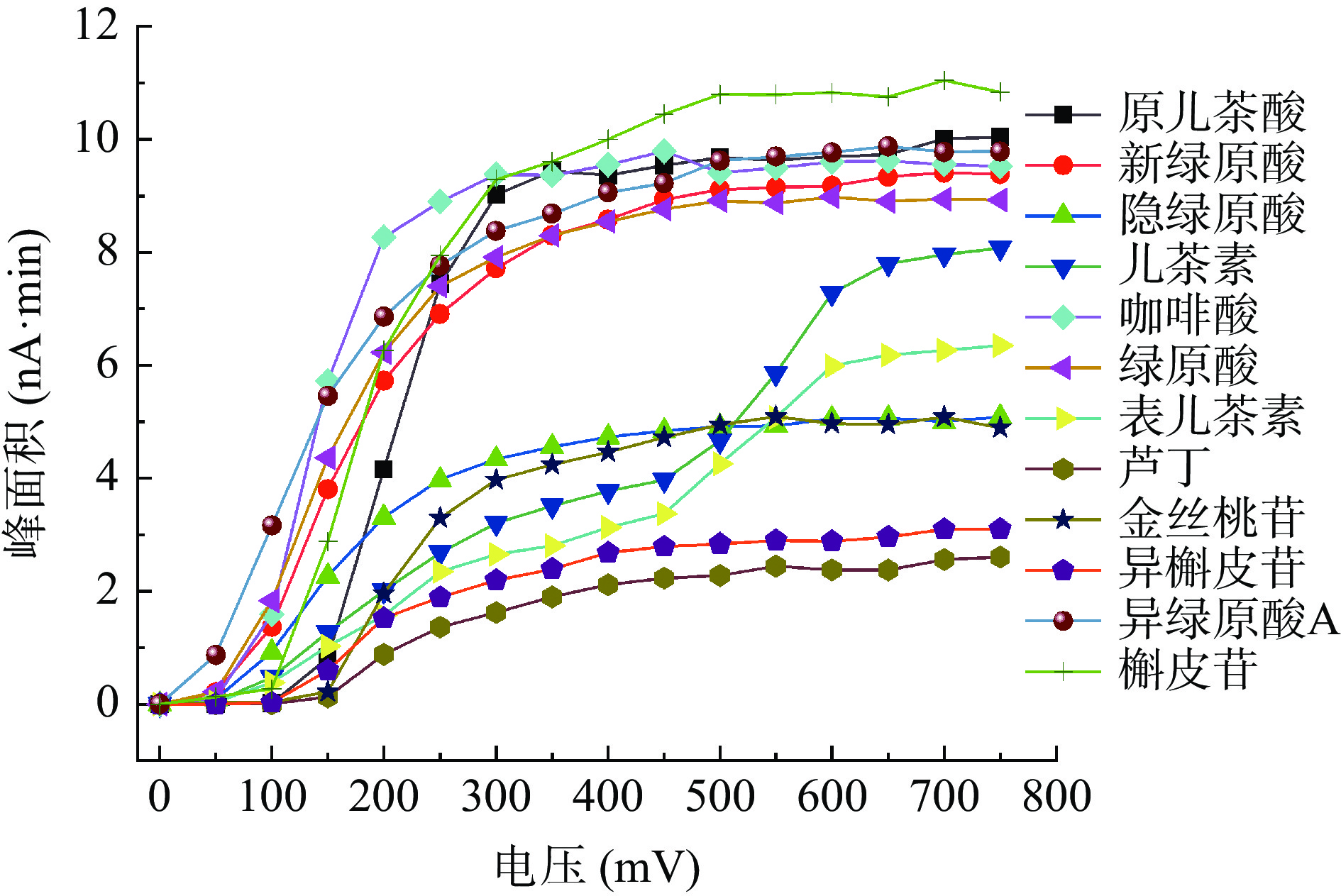
配制混合对照品溶液适量,在HPLC中将电化学检测器的检测池电压由50 mV逐渐升至750 mV,每隔50 mV进样一次,考察原儿茶酸等12种多酚类成分在电极上的响应情况。结果如图1所示,随着电压的升高,色谱面积增大;当升到650 mV时,峰面积保持稳定,故最后确定650 mV作为鱼腥草叶的检测电压。
2.1.2 方法学验证
2.1.2.1 线性关系
取“1.2.3”项下系列混合对照品溶液,按“1.2.1”项下的色谱条件进行分析,以对照品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线进行线性回归,计算相关系数均大于0.999,表明该供试品溶液浓度与峰面积有较好的线性相关,以信噪比等于3计算检测限,不同化合物的检测限在0.53~5.91 μg/L(表2)。
表 2 12个组分的线性、精密度、稳定性和重复性Table 2. Linearity, precision, stability and repeatability of 12 components序号 组分 线性范围
(mg/L)线性方程 R2 LOD
(μg/L)精密度 稳定性 重复性 RSD(%) 1 原儿茶酸 0.1~10.0 y=29.810x+0.044 0.9992 0.53 1.01 3.85 4.31 2 新绿原酸 2.5~250.0 y=9.250x+3.318 0.9991 2.44 0.61 2.02 1.95 3 儿茶素 0.1~20.0 y=14.914x+3.588 0.9995 0.76 0.85 2.02 2.58 4 隐绿原酸 0.5~50.0 y=9.223x+8.388 0.9992 1.59 0.64 1.75 1.83 5 咖啡酸 0.1~20.0 y=19.217x+5.944 0.9996 5.91 1.25 3.19 3.99 6 绿原酸 0.5~100. 0 y=8.895x-3.315 0.9993 1.64 0.91 1.67 2.56 7 表儿茶素 0.05~5.0 y=25.995x+0.290 0.9991 1.02 1.78 2.31 2.79 8 芦丁 0.5~50.0 y=2.559x+2.895 0.9996 3.96 1.22 3.14 3.46 9 金丝桃苷 2.5~250.0 y=5.028x+2.274 0.9991 1.75 0.92 2.30 2.70 10 异槲皮苷 0.5~50.0 y=3.074x+1.445 0.9999 1.59 1.33 3.09 3.31 11 异绿原酸A 0.15~15.0 y=9.723x+2.219 0.9995 1.63 1.09 4.01 4.30 12 槲皮苷 3.50~350.0 y=5.457x+1.160 0.9996 1.92 1.43 2.66 3.55 2.1.2.2 精密度
取同一标准品溶液,在“1.2.1”项色谱条件下连续进样六次,测定供试品溶液中12种化合物的峰面积值,计算相对标准偏差RSD在0.61%~1.78%之间(表2),仪器精密度良好。
2.1.2.3 重复性
取同一批鱼腥草13号样品粉末约1 g,精密称定,以建立的提取方法平行提取6份供试品溶液,按“1.2.1”项色谱条件下测定鱼腥草中12种化合物的峰面积,计算峰面积RSD在1.83%~4.31%之间(表2),表明该方法的重复性良好。
2.1.2.4 稳定性
取同一鱼腥草13号样品供试品溶液,在“1.2.1”项色谱条件下,分别在0、2、4、8、12、16、24 h进样,测定供试品溶液中12种化合物的峰面积值,计算相对标准偏差RSD在1.67%~4.01%之间(表2),表明24 h内供试品溶液的稳定性较好。
2.1.2.5 回收率
取已知含量的3号鱼腥草叶,平行称取6份,精密称定1.0 g,加入一定量混合对照品,按上述方法制备供试品溶液,色谱条件进样测定峰面积。计算平均回收率,结果见表3。12种多酚类化合物平均回收率在93.25%~103.56%之间,RSD为1.99%~4.47%,表示该方法准确度良好。
表 3 12种化合物的加标回收率及相对标准偏差(n=6)Table 3. Recoveries and relative standard deviations of 12 compounds (n=6)组分 样品含量(μg/g) 加入量(μg/g) 测得量(μg/g) 平均回收率(%) RSD(%) 原儿茶酸 140.78±4.64 150 279.41±8.28 96.09 4.47 新绿原酸 4654.7±158.20 4500 9269.13±316.67 101.25 2.11 儿茶素 342.1±10.73 350 650.79±20.54 94.02 2.74 隐绿原酸 417.0±15.45 400 790.27±31.67 96.72 1.99 咖啡酸 352.8±14.55 350 659.54±23.30 93.84 4.15 绿原酸 491.1±18.51 500 988.61±41.67 99.75 2.72 表儿茶素 39.30±1.32 40 82.12±2.54 103.56 2.95 芦丁 984.6±33.46 1000 1962.51±60.28 98.88 3.62 金丝桃苷 4941.1±167.99 5000 10147.33±344.36 102.08 2.86 异槲皮苷 1023.8±31.71 1000 2019.33±50.47 99.77 3.47 异绿原酸A 187.21±4.49 200 361.08±8.67 93.25 4.46 槲皮苷 6993.9±195.80 7000 14549.26±378.27 103.97 3.71 2.2 12种多酚单体化合物含量
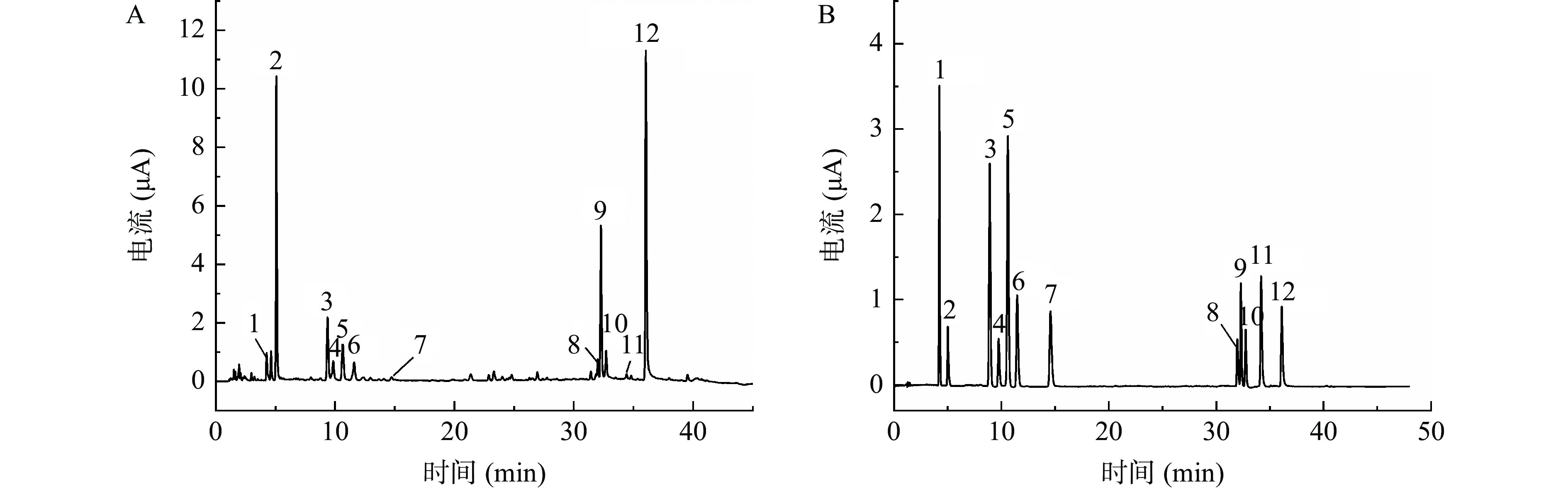
按“1.2.1”项色谱条件下进行检测,应用所建立测定方法测定不同产地鱼腥草叶中12种化合物的含量,样品和混合对照品溶液色谱图见图2。取不同产地鱼腥草叶,按“1.2.2”项下条件制备供试品溶液并进样,测定得鱼腥草叶中12种酚类化合物含量,结果见表4。12种成分的平均含量从高到低依次为槲皮苷>新绿原酸>金丝桃苷>异槲皮苷>绿原酸>芦丁>隐绿原酸>儿茶素>咖啡酸>异绿原酸A>原儿茶酸>表儿茶素。其中槲皮苷、新绿原酸、金丝桃苷、异槲皮苷含量相对较高。
表 4 25批样品中12种酚类化合物的含量测定结果(µg/g)Table 4. Results of content determination of 12 phenolic compounds in 25 batches of samples (µg/g)编号 原儿
茶酸新绿原酸 儿茶素 隐绿原酸 咖啡酸 绿原酸 表儿茶素 芦丁 金丝桃苷 异槲皮苷 异绿
原酸A槲皮苷 S1 48.1±2.20 1748.6±28,10 95.1±4.20 395.1±14.60 112.1±5.20 721.9±23.80 23.8±0.40 574.7±22.10 5278.8±69.20 1340.3±19.60 134.2±3.20 5576.1±66.50 S2 61.9±2.00 2977.1±29.40 31.2±0.80 90.8±2.40 27.8±0.90 1786.9±41.10 107.9±2.30 383.2±14.10 1288.7±18.60 520.2±13.60 70.5±3.00 3835.9±50.70 S3 142.7±6.10 4682.9±98.30 352.2±9.80 428.8±13.10 368.7±11.40 510.8±8.20 36.6±0.80 958.6±23.90 4909.1±118.30 997.5±18.70 179.0±6.90 6947.8±37.50 S4 18.7±0.90 267.5±1.50 7.3±0.20 41.2±1.20 8.1±0.20 38.2±1.20 2.9±0.10 109.4±3.90 454.2±10.40 204.1±2.90 12.0±0.30 1038.0±6.10 S5 157.7±5.20 3686.3±50.70 200.5±4.10 532.7±16.20 210.8±4.10 582.8±16.10 11.4±0.30 456.8±5.70 3677.9±45.20 1261.7±17.50 140.7±4.60 5231.9±100.30 S6 106.7±2.90 4212.7±76.60 248.5±5.00 819.9±27.40 245.6±6.20 1194.9±28.50 101.5±3.80 824.7±16.60 3284.2±68.60 1320.0±38.10 129.7±4.70 4463.9±84.90 S7 82.3±3.50 2101.8±72.30 143.1±2.90 621.5±22.90 104.1±2.30 884.7±13.10 22.5±0.70 86.4±3.30 4106.5±85.40 1305.5±16.40 119.6±3.00 4314.4±25.10 S8 62.2±1.90 1796.4±36.00 48.9±1.80 415.3±15.30 51.6±1.40 586.7±5.00 30.6±0.90 448.3±14.20 1830.1±31.30 674.8±19.50 53.2±1.50 3034.5±32.00 S9 80.2±3.90 2822.3±20.20 186.3±7.60 600.2±10.20 187.1±8.60 805.6±13.50 22.1±0.40 1218.2±20.50 3921.6±58.60 1479.2±16.40 136.4±4.60 6375.2±75.20 S10 22.3±0.70 186.7±1.50 16.7±0.80 75.3±2.40 12.9±0.60 83.9±1.50 12.3±0.50 100.1±2.30 1161.4±31.50 461.9±5.60 29.8±1.00 1564.3±22.10 S11 48.1±0.80 1801.8±47.50 74.0±3.40 468.5±12.50 55.6±1.60 555.2±13.20 34.4±1.00 245.1±4.50 1629.9±25.80 497.5±5.00 42.2±1.50 2066.5±24.00 S12 64.0±1.20 1971.8±31.20 77.1±3.20 450.7±12.30 90.2±3.60 452.9±11.60 18.8±0.40 411.7±11.10 1625.9±88.20 693.7±8.60 86.3±2.60 3752.5±34.70 S13 121.7±5.90 3291.2±24.50 294.3±7.10 1271.0±16.80 319.4±6.50 1112.8±36.50 72.2±2.40 873.2±20.10 3628.0±4.20 1544.1±27.30 120.5±3.50 4894.6±67.70 S14 45.7±1.30 1916.6±34.20 53.5±1.50 228.4±4.80 41.5±1.00 367.3±8.80 53.3±1.50 225.2±4.30 580.1±32.20 295.9±6.70 25.4±0.60 1537.4±11.00 S15 107.0±3.60 3006.5±27.80 152.7±2.80 262.3±5.60 122.7±3.60 244.6±6.00 32.5±1.00 471.3±11.40 2830.3±38.70 721.2±17.20 79.2±2.70 3906.7±69.40 S16 51.2±2.20 2678.7±12.60 150.5±2.60 660.9±8.40 147.9±7.30 691.4±9.30 23.7±1.00 355.1±8.00 2067.2±47.30 592.7±8.30 61.8±2.10 2701.3±51.50 S17 59.3±2.10 3230.3±115.30 231.9±4.20 591.7±16.80 175.6±7.90 825.2±26.00 22.7±1.00 567.5±21.20 4087.9±23.10 1251.0±31.00 100.0±3.70 5314.8±41.50 S18 58.8±2.90 966.7±29.80 15.0±0.50 92.3±3.00 16.5±0.70 116.7±1.00 9.8±0.30 382.9±10.20 1462.3±19.90 622.6±10.90 36.0±1.10 932.2±13.00 S19 143.7±3.00 3651.9±126.60 174.7±4.80 644.7±24.30 124.2±4.20 1486.8±48.50 65.1±2.30 657.3±10.10 1644.8±11.70 739.9±13.40 58.9±1.80 3320.5±17.20 S20 53.0±1.70 579.8±7.60 12.7±0.30 390.8±5.00 5.3±0.10 550.5±13.10 3.1±0.10 248.1±9.50 553.4±15.90 216.1±5.70 19.0±0.80 832.2±10.80 S21 144.9±4.50 3952.3±78.30 54.8±1.10 120.0±1.70 30.0±1.00 2015.5±16.10 52.8±2.00 867.2±18.80 2508.0±15.90 1353.5±13.70 168.5±6.40 6697.8±91.80 S22 144.2±6.70 4094.0±65.10 206.2±5.30 253.8±5.90 107.4±3.40 1168.0±25.40 36.3±0.80 666.7±21.30 2962.3±65.50 895.0±19.80 91.3±2.40 4845.7±57.60 S23 135.3±5.40 3552.8±83.20 149.9±4.40 599.3±14.30 93.4±4.10 580.6±16.60 14.3±0.40 381.8±12.70 2511.6±64.80 820.2±12.00 109.1±3.30 4389.9±48.60 S24 68.4±1.50 2672.5±93.50 320.2±7.80 948.6±27.20 243.2±9.40 1183.7±32.60 128.3±5.60 446.7±13.80 2287.9±69.60 960.7±24.70 86.1±3.50 3436.5±31.50 S25 69.1±2.60 2962.9±77.60 157.9±3.00 67.0±1.80 146.0±5.10 1568.4±14.20 143.0±4.50 1054.4±32.10 4241.0±112.60 1911.0±48.60 186.0±6.10 3580.0±50.90 大量研究表明,酚类化合物是植物抗氧化活性的主要来源,尤其是具有两个或更多酚羟基的多酚类化合物,其往往具有更强的还原能力和自由基清除能力,如酚酸类、黄酮类、单宁类、花色素类等[33]。其中前两者的分布最为广泛。鱼腥草叶多酚含量测定的结果表明,鱼腥草中的黄酮类化合物主要为槲皮素及其衍生物,如金丝桃苷、槲皮苷、异槲皮苷;而酚酸类化合物则主要为咖啡酸及其衍生物,如新绿原酸、绿原酸、隐绿原酸、异绿原酸A等。本研究所测定的12种多酚类化合物峰面积之和占色谱图总峰面积的90%以上,因此,咖啡酸和槲皮素的衍生物是鱼腥草叶抗氧化的主要物质基础。
2.3 总酚含量和体外抗氧化活性
分别取25份鱼腥草叶提取液,测定总酚含量及体外抗氧化活性,结果见表5。不同样品的总酚含量为5.98~52.86 mg GAE/g,DPPH自由基清除率为1.81%~81.42%,ABTS+自由基清除率为11.57%~88.92%,FRAP值为6.50~85.06 mg TE/g之间。
表 5 总酚含量和体外抗氧化测定结果Table 5. Results of total phenolics content and antioxidant activity in vitro样品
编号总酚含量
(mg GAE/g)DPPH自由基
清除率
(%)ABTS+自由基
清除率
(%)FRAP值
(mg TE/g)S1 39.68±0.70 32.34±0.33 66.00±0.43 62.13±0.26 S2 27.13±0.27 25.07±0.12 41.75±1.27 41.49±0.13 S3 49.24±0.90 51.23±0.15 83.75±1.34 81.62±0.46 S4 5.98±0.35 1.81±0.34 11.57±0.63 6.50±0.57 S5 41.28±1.20 49.92±0.25 74.42±0.46 76.65±1.04 S6 44.84±1.34 58.28±0.77 74.85±1.17 77.26±0.34 S7 37.16±0.32 38.79±0.69 66.54±0.94 59.96±0.06 S8 20.78±0.60 21.93±0.80 42.50±0.67 32.89±0.97 S9 50.92±1.01 61.37±0.38 88.92±1.02 85.06±1.09 S10 10.96±0.32 14.10±0.67 21.78±0.50 15.64±0.80 S11 19.59±0.51 20.13±0.54 31.24±0.40 30.13±0.41 S12 26.56±0.57 29.83±0.22 49.97±0.64 39.19±0.52 S13 52.86±0.42 81.42±1.73 88.57±0.22 82.45±0.72 S14 12.86±0.46 17.96±0.70 23.39±1.01 17.77±0.19 S15 26.84±0.78 43.45±0.55 58.3±0.90 43.76±0.43 S16 27.26±0.69 34.51±0.15 49.12±0.82 56.93±0.78 S17 39.46±0.48 62.28±0.39 81.66±0.65 64.25±0.08 S18 12.38±0.53 13.84±0.42 24.74±0.66 13.44±0.67 S19 29.27±0.34 45.47±0.41 78.91±0.73 45.76±0.60 S20 9.80±1.20 9.77±0.91 27.57±0.61 12.79±0.80 S21 33.72±0.58 64.30±0.16 68.08±0.32 63.44±0.27 S22 32.70±0.55 43.17±0.58 62.44±0.14 53.50±0.82 S23 27.09±0.49 29.56±0.15 51.97±0.44 41.27±0.90 S24 31.44±0.60 49.69±0.32 68.40±0.30 56.05±1.60 S25 48.42±0.83 57.55±0.94 84.68±0.48 74.07±1.03 酚类化合物是植物抗氧化活性的主要来源,将总酚与不同抗氧化活性评价指标间进行相关性分析,结果见表6。鱼腥草叶的总酚含量与ABTS+、DPPH自由基清除能力和FRAP值的相关系数为0.902~0.984,各组分之间呈显著的正相关(P<0.05),且不同类型的抗氧化活性间也有显著的相关性,可见酚类化合物为抗氧化主要活性成分。结合“2.2”部分的色谱分析结果可知,本研究所测定的12种多酚类化合物是鱼腥草抗氧化作用的重要单体成分。
表 6 鱼腥草叶中总酚与FRAP值、ABTS+、DPPH自由基清除能力之间的相关性Table 6. Correlation between total phenolics, FRAP values, ABTS+ and DPPH radical scavenging ability ofHouttuynia cordata leaves指标 总酚含量 DPPH自由基
清除率FRAP值 ABTS+自由基
清除率总酚含量 1.000 0.902 0.984 0.953 DPPH自由基清除率 1.000 0.908 0.933 FRAP值 1.000 0.944 ABTS+自由基清除率 1.000 2.4 多元统计分析
2.4.1 聚类分析
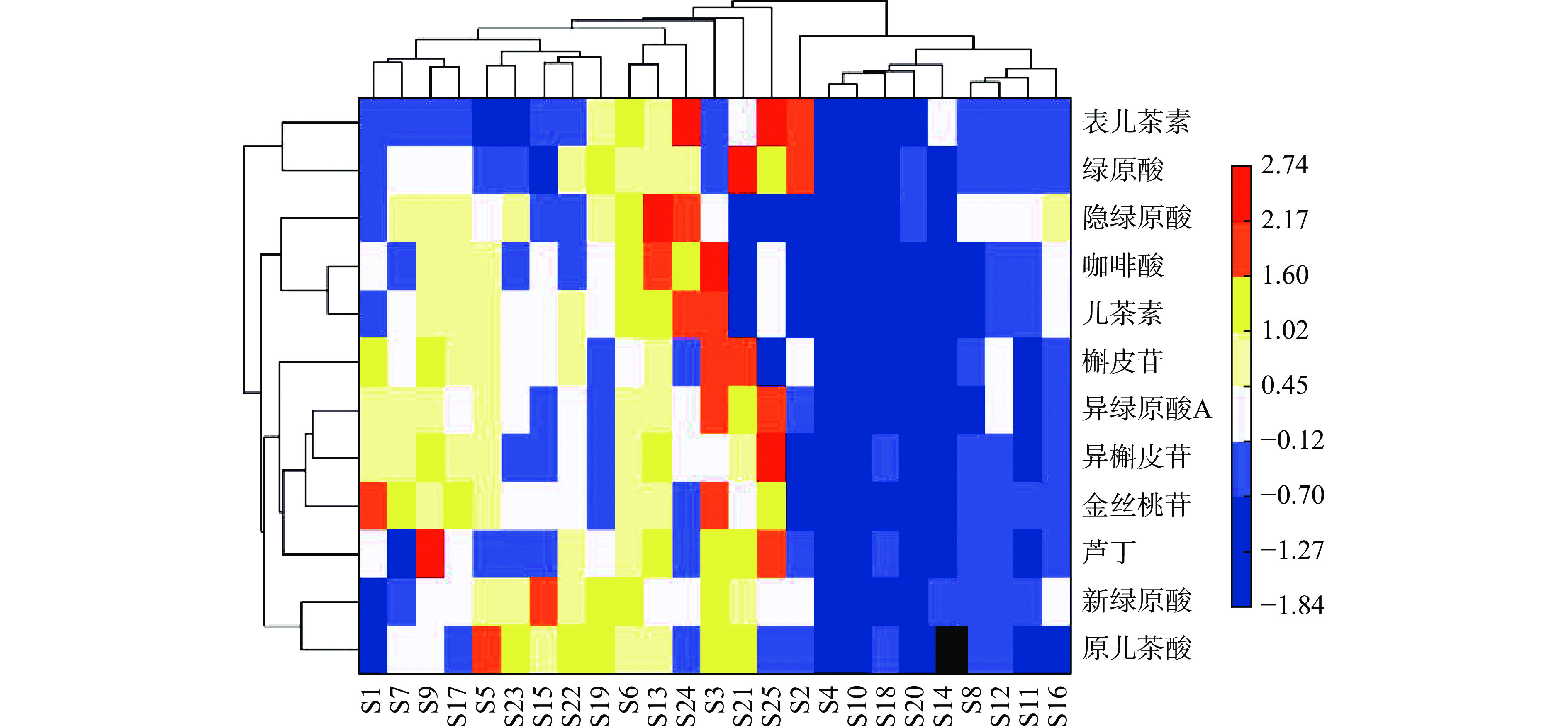
使用Origin(2018版)软件,数据归一化,选择聚类热图对25批鱼腥草叶样品进行归类分析,按照样品中各成分的含量,可将25个样品分为四大类,热图颜色深浅反应各成分含量的高低(见图3),可见不同的样品间不同化合物的含量存在较大差异。由于样品的来源较为分散,不同产地的样品在聚类中有所交叉,这是因为品种、光照、气温、土壤等因素均可能影响其次级代谢产物的生成。芦丁、金丝桃苷、异槲皮苷和槲皮苷在聚类中较为集中,这可能是因为这四种化合物均为槲皮素的衍生物,在植物体内有着类似的合成和代谢途径。
2.4.2 灰色关联分析
通过灰色关联分析鱼腥草叶中不同酚类化合物与抗氧化活性之间的相关性(见表7),采用均值法计算不同化合物同抗氧化活性的关联度,通常关联度在0.6以上即认为存在相关性,关联度越大,表示相关性越强[34]。结果表明12种酚类化合物与抗氧化活性的关联度均大于0.6,其中异槲皮苷、槲皮苷、异绿原酸A、金丝桃苷、芦丁与抗氧化活性的关联最强,在3种抗氧化活性中关联度均大于0.8。
表 7 12种酚类化合物与抗氧化活性的灰色关联分析结果Table 7. Results of grey correlation analysis of 12 phenolic compounds and antioxidant activities组分 DPPH自由基
清除率ABTS+自由基
清除率FRAP值 平均GRD 排名 异槲皮苷 0.823 0.854 0.846 0.841 1 槲皮苷 0.806 0.837 0.842 0.829 2 异绿原酸A 0.798 0.843 0.817 0.819 3 金丝桃苷 0.801 0.818 0.837 0.819 4 芦丁 0.794 0.804 0.811 0.803 5 新绿原酸 0.802 0.805 0.791 0.799 6 儿茶素 0.802 0.753 0.747 0.767 7 咖啡酸 0.781 0.774 0.744 0.766 8 原儿茶酸 0.756 0.744 0.779 0.759 9 绿原酸 0.748 0.726 0.742 0.739 10 隐绿原酸 0.707 0.700 0.713 0.707 11 表儿茶素 0.659 0.671 0.663 0.664 12 灰色关联分析目前作为相关性分析的主要手段,本研究发现通过HPLC-ECD筛查出的多酚类化合物均具有较强的关联度,这充分验证了HPLC-ECD筛查并定量酚类抗氧化活性成分的可靠性。由于ECD的检测原理是电荷转移,其色谱峰一定程度上体现出化合物的还原能力,灰色关联分析的结果也证实了这一点,峰面积较大的几种化合物同时具有较强的关联度。相对于咖啡酸衍生物来说,槲皮素及其衍生物的相关性更强。王亚茹等[35]的研究表明,槲皮素类对于因氧化应激导致的疾病有很好的预防和治疗作用,并且在体内可以减缓机体氧化应激过程,发挥较强的抗氧化能力。因此,这类黄酮化合物是鱼腥草叶生物活性的重要物质基础。
3. 结论
本研究建立了HPLC-ECD测定不同产地鱼腥草叶多酚含量的方法,对12种单体化合物的含量进行测定,并评价了其体外抗氧化活性。建立的HPLC-ECD方法线性、精密度、重复性、稳定性均良好,平均加样回收率为93.25%~103.97%,RSD为1.99%~4.47%。不同来源的鱼腥草叶的总酚含量为5.98~52.86 mg GAE/g,其含量与ABTS+、DPPH自由基清除能力和铁离子还原能力显著性相关。鱼腥草中含量较高的多酚类化合物为咖啡酸和槲皮素的衍生物,其中咖啡酸衍生物包括新绿原酸、隐绿原酸、绿原酸、异绿原酸A等,槲皮素衍生物包括槲皮苷、异槲皮苷、金丝桃苷、芦丁等。聚类热图分析表明样品含量对分类有一定影响,灰色关联分析结果表明鱼腥草叶的抗氧化活性是多种成分协同作用产生的结果,12种酚类化合物均有较高的关联度,其中异槲皮苷、槲皮苷、异绿原酸A、金丝桃苷、芦丁与抗氧化活性的相关性最高。综上所述,本研究明确了多酚类化合物与抗氧化活性的相关性,为鱼腥草叶功能性利用提供更加详尽的理论依据,也为质量控制和资源开发提供参考。
-
表 1 鱼腥草叶的来源
Table 1 Sources of Houttuynia cordata leaves
样品
编号采样时间 产地 样品编号 采样时间 产地 样品编号 采样时间 产地 S1 2021年6月 贵州凯里 S10 2021年6月 贵州遵义 S19 2021年7月 贵州毕节 S2 2021年6月 贵州毕节 S11 2021年6月 贵州遵义 S20 2021年6月 江西宜春 S3 2021年6月 陕西汉中 S12 2021年7月 贵州遵义 S21 2021年6月 贵州毕节 S4 2021年6月 安徽亳州 S13 2021年7月 贵州遵义 S22 2021年7月 贵州黔西南 S5 2021年7月 贵州遵义 S14 2021年6月 贵州遵义 S23 2021年6月 贵州遵义 S6 2021年6月 贵州遵义 S15 2021年7月 贵州毕节 S24 2021年6月 贵州铜仁 S7 2021年6月 贵州遵义 S16 2021年6月 贵州遵义 S25 2021年7月 贵州毕节 S8 2021年7月 安徽六安 S17 2021年6月 贵州遵义 S9 2021年6月 贵州毕节 S18 2021年6月 湖南益阳 表 2 12个组分的线性、精密度、稳定性和重复性
Table 2 Linearity, precision, stability and repeatability of 12 components
序号 组分 线性范围
(mg/L)线性方程 R2 LOD
(μg/L)精密度 稳定性 重复性 RSD(%) 1 原儿茶酸 0.1~10.0 y=29.810x+0.044 0.9992 0.53 1.01 3.85 4.31 2 新绿原酸 2.5~250.0 y=9.250x+3.318 0.9991 2.44 0.61 2.02 1.95 3 儿茶素 0.1~20.0 y=14.914x+3.588 0.9995 0.76 0.85 2.02 2.58 4 隐绿原酸 0.5~50.0 y=9.223x+8.388 0.9992 1.59 0.64 1.75 1.83 5 咖啡酸 0.1~20.0 y=19.217x+5.944 0.9996 5.91 1.25 3.19 3.99 6 绿原酸 0.5~100. 0 y=8.895x-3.315 0.9993 1.64 0.91 1.67 2.56 7 表儿茶素 0.05~5.0 y=25.995x+0.290 0.9991 1.02 1.78 2.31 2.79 8 芦丁 0.5~50.0 y=2.559x+2.895 0.9996 3.96 1.22 3.14 3.46 9 金丝桃苷 2.5~250.0 y=5.028x+2.274 0.9991 1.75 0.92 2.30 2.70 10 异槲皮苷 0.5~50.0 y=3.074x+1.445 0.9999 1.59 1.33 3.09 3.31 11 异绿原酸A 0.15~15.0 y=9.723x+2.219 0.9995 1.63 1.09 4.01 4.30 12 槲皮苷 3.50~350.0 y=5.457x+1.160 0.9996 1.92 1.43 2.66 3.55 表 3 12种化合物的加标回收率及相对标准偏差(n=6)
Table 3 Recoveries and relative standard deviations of 12 compounds (n=6)
组分 样品含量(μg/g) 加入量(μg/g) 测得量(μg/g) 平均回收率(%) RSD(%) 原儿茶酸 140.78±4.64 150 279.41±8.28 96.09 4.47 新绿原酸 4654.7±158.20 4500 9269.13±316.67 101.25 2.11 儿茶素 342.1±10.73 350 650.79±20.54 94.02 2.74 隐绿原酸 417.0±15.45 400 790.27±31.67 96.72 1.99 咖啡酸 352.8±14.55 350 659.54±23.30 93.84 4.15 绿原酸 491.1±18.51 500 988.61±41.67 99.75 2.72 表儿茶素 39.30±1.32 40 82.12±2.54 103.56 2.95 芦丁 984.6±33.46 1000 1962.51±60.28 98.88 3.62 金丝桃苷 4941.1±167.99 5000 10147.33±344.36 102.08 2.86 异槲皮苷 1023.8±31.71 1000 2019.33±50.47 99.77 3.47 异绿原酸A 187.21±4.49 200 361.08±8.67 93.25 4.46 槲皮苷 6993.9±195.80 7000 14549.26±378.27 103.97 3.71 表 4 25批样品中12种酚类化合物的含量测定结果(µg/g)
Table 4 Results of content determination of 12 phenolic compounds in 25 batches of samples (µg/g)
编号 原儿
茶酸新绿原酸 儿茶素 隐绿原酸 咖啡酸 绿原酸 表儿茶素 芦丁 金丝桃苷 异槲皮苷 异绿
原酸A槲皮苷 S1 48.1±2.20 1748.6±28,10 95.1±4.20 395.1±14.60 112.1±5.20 721.9±23.80 23.8±0.40 574.7±22.10 5278.8±69.20 1340.3±19.60 134.2±3.20 5576.1±66.50 S2 61.9±2.00 2977.1±29.40 31.2±0.80 90.8±2.40 27.8±0.90 1786.9±41.10 107.9±2.30 383.2±14.10 1288.7±18.60 520.2±13.60 70.5±3.00 3835.9±50.70 S3 142.7±6.10 4682.9±98.30 352.2±9.80 428.8±13.10 368.7±11.40 510.8±8.20 36.6±0.80 958.6±23.90 4909.1±118.30 997.5±18.70 179.0±6.90 6947.8±37.50 S4 18.7±0.90 267.5±1.50 7.3±0.20 41.2±1.20 8.1±0.20 38.2±1.20 2.9±0.10 109.4±3.90 454.2±10.40 204.1±2.90 12.0±0.30 1038.0±6.10 S5 157.7±5.20 3686.3±50.70 200.5±4.10 532.7±16.20 210.8±4.10 582.8±16.10 11.4±0.30 456.8±5.70 3677.9±45.20 1261.7±17.50 140.7±4.60 5231.9±100.30 S6 106.7±2.90 4212.7±76.60 248.5±5.00 819.9±27.40 245.6±6.20 1194.9±28.50 101.5±3.80 824.7±16.60 3284.2±68.60 1320.0±38.10 129.7±4.70 4463.9±84.90 S7 82.3±3.50 2101.8±72.30 143.1±2.90 621.5±22.90 104.1±2.30 884.7±13.10 22.5±0.70 86.4±3.30 4106.5±85.40 1305.5±16.40 119.6±3.00 4314.4±25.10 S8 62.2±1.90 1796.4±36.00 48.9±1.80 415.3±15.30 51.6±1.40 586.7±5.00 30.6±0.90 448.3±14.20 1830.1±31.30 674.8±19.50 53.2±1.50 3034.5±32.00 S9 80.2±3.90 2822.3±20.20 186.3±7.60 600.2±10.20 187.1±8.60 805.6±13.50 22.1±0.40 1218.2±20.50 3921.6±58.60 1479.2±16.40 136.4±4.60 6375.2±75.20 S10 22.3±0.70 186.7±1.50 16.7±0.80 75.3±2.40 12.9±0.60 83.9±1.50 12.3±0.50 100.1±2.30 1161.4±31.50 461.9±5.60 29.8±1.00 1564.3±22.10 S11 48.1±0.80 1801.8±47.50 74.0±3.40 468.5±12.50 55.6±1.60 555.2±13.20 34.4±1.00 245.1±4.50 1629.9±25.80 497.5±5.00 42.2±1.50 2066.5±24.00 S12 64.0±1.20 1971.8±31.20 77.1±3.20 450.7±12.30 90.2±3.60 452.9±11.60 18.8±0.40 411.7±11.10 1625.9±88.20 693.7±8.60 86.3±2.60 3752.5±34.70 S13 121.7±5.90 3291.2±24.50 294.3±7.10 1271.0±16.80 319.4±6.50 1112.8±36.50 72.2±2.40 873.2±20.10 3628.0±4.20 1544.1±27.30 120.5±3.50 4894.6±67.70 S14 45.7±1.30 1916.6±34.20 53.5±1.50 228.4±4.80 41.5±1.00 367.3±8.80 53.3±1.50 225.2±4.30 580.1±32.20 295.9±6.70 25.4±0.60 1537.4±11.00 S15 107.0±3.60 3006.5±27.80 152.7±2.80 262.3±5.60 122.7±3.60 244.6±6.00 32.5±1.00 471.3±11.40 2830.3±38.70 721.2±17.20 79.2±2.70 3906.7±69.40 S16 51.2±2.20 2678.7±12.60 150.5±2.60 660.9±8.40 147.9±7.30 691.4±9.30 23.7±1.00 355.1±8.00 2067.2±47.30 592.7±8.30 61.8±2.10 2701.3±51.50 S17 59.3±2.10 3230.3±115.30 231.9±4.20 591.7±16.80 175.6±7.90 825.2±26.00 22.7±1.00 567.5±21.20 4087.9±23.10 1251.0±31.00 100.0±3.70 5314.8±41.50 S18 58.8±2.90 966.7±29.80 15.0±0.50 92.3±3.00 16.5±0.70 116.7±1.00 9.8±0.30 382.9±10.20 1462.3±19.90 622.6±10.90 36.0±1.10 932.2±13.00 S19 143.7±3.00 3651.9±126.60 174.7±4.80 644.7±24.30 124.2±4.20 1486.8±48.50 65.1±2.30 657.3±10.10 1644.8±11.70 739.9±13.40 58.9±1.80 3320.5±17.20 S20 53.0±1.70 579.8±7.60 12.7±0.30 390.8±5.00 5.3±0.10 550.5±13.10 3.1±0.10 248.1±9.50 553.4±15.90 216.1±5.70 19.0±0.80 832.2±10.80 S21 144.9±4.50 3952.3±78.30 54.8±1.10 120.0±1.70 30.0±1.00 2015.5±16.10 52.8±2.00 867.2±18.80 2508.0±15.90 1353.5±13.70 168.5±6.40 6697.8±91.80 S22 144.2±6.70 4094.0±65.10 206.2±5.30 253.8±5.90 107.4±3.40 1168.0±25.40 36.3±0.80 666.7±21.30 2962.3±65.50 895.0±19.80 91.3±2.40 4845.7±57.60 S23 135.3±5.40 3552.8±83.20 149.9±4.40 599.3±14.30 93.4±4.10 580.6±16.60 14.3±0.40 381.8±12.70 2511.6±64.80 820.2±12.00 109.1±3.30 4389.9±48.60 S24 68.4±1.50 2672.5±93.50 320.2±7.80 948.6±27.20 243.2±9.40 1183.7±32.60 128.3±5.60 446.7±13.80 2287.9±69.60 960.7±24.70 86.1±3.50 3436.5±31.50 S25 69.1±2.60 2962.9±77.60 157.9±3.00 67.0±1.80 146.0±5.10 1568.4±14.20 143.0±4.50 1054.4±32.10 4241.0±112.60 1911.0±48.60 186.0±6.10 3580.0±50.90 表 5 总酚含量和体外抗氧化测定结果
Table 5 Results of total phenolics content and antioxidant activity in vitro
样品
编号总酚含量
(mg GAE/g)DPPH自由基
清除率
(%)ABTS+自由基
清除率
(%)FRAP值
(mg TE/g)S1 39.68±0.70 32.34±0.33 66.00±0.43 62.13±0.26 S2 27.13±0.27 25.07±0.12 41.75±1.27 41.49±0.13 S3 49.24±0.90 51.23±0.15 83.75±1.34 81.62±0.46 S4 5.98±0.35 1.81±0.34 11.57±0.63 6.50±0.57 S5 41.28±1.20 49.92±0.25 74.42±0.46 76.65±1.04 S6 44.84±1.34 58.28±0.77 74.85±1.17 77.26±0.34 S7 37.16±0.32 38.79±0.69 66.54±0.94 59.96±0.06 S8 20.78±0.60 21.93±0.80 42.50±0.67 32.89±0.97 S9 50.92±1.01 61.37±0.38 88.92±1.02 85.06±1.09 S10 10.96±0.32 14.10±0.67 21.78±0.50 15.64±0.80 S11 19.59±0.51 20.13±0.54 31.24±0.40 30.13±0.41 S12 26.56±0.57 29.83±0.22 49.97±0.64 39.19±0.52 S13 52.86±0.42 81.42±1.73 88.57±0.22 82.45±0.72 S14 12.86±0.46 17.96±0.70 23.39±1.01 17.77±0.19 S15 26.84±0.78 43.45±0.55 58.3±0.90 43.76±0.43 S16 27.26±0.69 34.51±0.15 49.12±0.82 56.93±0.78 S17 39.46±0.48 62.28±0.39 81.66±0.65 64.25±0.08 S18 12.38±0.53 13.84±0.42 24.74±0.66 13.44±0.67 S19 29.27±0.34 45.47±0.41 78.91±0.73 45.76±0.60 S20 9.80±1.20 9.77±0.91 27.57±0.61 12.79±0.80 S21 33.72±0.58 64.30±0.16 68.08±0.32 63.44±0.27 S22 32.70±0.55 43.17±0.58 62.44±0.14 53.50±0.82 S23 27.09±0.49 29.56±0.15 51.97±0.44 41.27±0.90 S24 31.44±0.60 49.69±0.32 68.40±0.30 56.05±1.60 S25 48.42±0.83 57.55±0.94 84.68±0.48 74.07±1.03 表 6 鱼腥草叶中总酚与FRAP值、ABTS+、DPPH自由基清除能力之间的相关性
Table 6 Correlation between total phenolics, FRAP values, ABTS+ and DPPH radical scavenging ability ofHouttuynia cordata leaves
指标 总酚含量 DPPH自由基
清除率FRAP值 ABTS+自由基
清除率总酚含量 1.000 0.902 0.984 0.953 DPPH自由基清除率 1.000 0.908 0.933 FRAP值 1.000 0.944 ABTS+自由基清除率 1.000 表 7 12种酚类化合物与抗氧化活性的灰色关联分析结果
Table 7 Results of grey correlation analysis of 12 phenolic compounds and antioxidant activities
组分 DPPH自由基
清除率ABTS+自由基
清除率FRAP值 平均GRD 排名 异槲皮苷 0.823 0.854 0.846 0.841 1 槲皮苷 0.806 0.837 0.842 0.829 2 异绿原酸A 0.798 0.843 0.817 0.819 3 金丝桃苷 0.801 0.818 0.837 0.819 4 芦丁 0.794 0.804 0.811 0.803 5 新绿原酸 0.802 0.805 0.791 0.799 6 儿茶素 0.802 0.753 0.747 0.767 7 咖啡酸 0.781 0.774 0.744 0.766 8 原儿茶酸 0.756 0.744 0.779 0.759 9 绿原酸 0.748 0.726 0.742 0.739 10 隐绿原酸 0.707 0.700 0.713 0.707 11 表儿茶素 0.659 0.671 0.663 0.664 12 -
[1] LUO Q, MENG P H, JIANG D W, et al. Comprehensive assessment of Houttuynia cordata Thunb., an important medicinal plant and vegetable[J]. Agronomy-Basel, 2022, 12(10):18.
[2] RAFIQ S, HAO H H, IJAZ M, et al. Pharmacological effects of Houttuynia cordata Thunb ( H. cordata):A comprehensive review[J]. Pharmaceuticals,2022,15(9):19.
[3] SHINGNAISUI K, DEY T, MANNA P, et al. Therapeutic potentials of Houttuynia cordata Thunb. against inflammation and oxidative stress:A review[J]. Journal of Ethnopharmacology,2018,220:35−43. doi: 10.1016/j.jep.2018.03.038
[4] LING L J, LU Y, ZHANG Y Y, et al. Flavonoids from Houttuynia cordata attenuate H1N1-induced acute lung injury in mice via inhibition of influenza virus and Toll-like receptor signalling[J]. Phytomedicine,2020,67:12.
[5] 孙谦, 胡中海, 孙志高, 等. 鱼腥草的生物活性及其机理研究进展[J]. 食品科学,2014,35(23):354−358. [SUN Q, HU Z H, SUN Z G, et al. Advances in biological activities and mechanisms of Houttuynia cordata[J]. Food Science,2014,35(23):354−358.] SUN Q, HU Z H, SUN Z G, et al . Advances in biological activities and mechanisms of Houttuynia cordata[J]. Food Science,2014 ,35 (23 ):354 −358 .[6] YANG Z N, SUN Y M, LUO S Q, et al. Quality evaluation of Houttuynia cordata Thunb. by high performance liquid chromatography with photodiode-array detection (HPLC-DAD)[J]. Pakistan Journal of Pharmaceutical Sciences,2014,27(2):223−231.
[7] ZHANG R, WANG L, LIU S J, et al. Separation and detection of electrochemical active compounds in Houttuynia Cordata Thunb. by reversed-phase high-performance liquid chromatography with electrochemical detection[J]. Journal of Liquid Chromatography & Related Technologies,2015,38(6):733−739.
[8] 田富林, 黄文晶, 王展, 等. 植物多酚提取研究进展[J]. 食品与机械,2020,36(9):211−216. [TIAN F L, HUANG W J, WANG Z, et al. Research progress on the extraction of plant polyphenols[J]. Food & Machinery,2020,36(9):211−216.] doi: 10.13652/j.issn.1003-5788.2020.09.038 TIAN F L, HUANG W J, WANG Z, et al . Research progress on the extraction of plant polyphenols[J]. Food & Machinery,2020 ,36 (9 ):211 −216 . doi: 10.13652/j.issn.1003-5788.2020.09.038[9] DI LORENZO C, COLOMBO F, BIELLA S, et al. Polyphenols and human health:The role of bioavailability[J]. Nutrients,2021,13(1):30.
[10] OLSZOWY M. What is responsible for antioxidant properties of polyphenolic compounds from plants?[J]. Plant Physiology and Biochemistry,2019,144:135−143. doi: 10.1016/j.plaphy.2019.09.039
[11] 卢姗, 伍志航, 刘海卿. 高效液相色谱法测定食用油中7种抗氧化剂的含量[J]. 现代食品,2022,28(19):190−194. [LU S, WU Z H, LIU H Q. Determination of seven antioxidants in edible oil by high performance liquid chromatography[J]. Modern Food,2022,28(19):190−194.] LU S, WU Z H, LIU H Q . Determination of seven antioxidants in edible oil by high performance liquid chromatography[J]. Modern Food,2022 ,28 (19 ):190 −194 .[12] 范卓妍, 班尹, 黄威, 等. 朝鲜蓟副产物超微粉强化茶饮料的功能性成分研究[J]. 中国食品学报,2022,22(1):332−341. [FAN Z Y, BAN Y, HUANG W, et al. Studies on functional components of milky green tea added with ultrafine powder of artichoke by-products[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(1):332−341.] FAN Z Y, BAN Y, HUANG W, et al . Studies on functional components of milky green tea added with ultrafine powder of artichoke by-products[J]. Journal of Chinese Institute of Food Science and Technology,2022 ,22 (1 ):332 −341 .[13] 孙莉琼, 郝雯菁, 唐晓清, 等. UPLC-MS/MS研究36个梨品种成熟果实中的特征性多酚和三萜酸类物质[J]. 食品科学,2020,41(22):206−214. [SUN L Q, HAO W J, TANG X Q, et al. Analysis of characteristic polyphenols and triterpenic acids in ripe pears of 36 cultivars by UPLC-MS/MS[J]. Food Science,2020,41(22):206−214.] SUN L Q, HAO W J, TANG X Q, et al . Analysis of characteristic polyphenols and triterpenic acids in ripe pears of 36 cultivars by UPLC-MS/MS[J]. Food Science,2020 ,41 (22 ):206 −214 .[14] 淳泽利, 朱娅, 陈荣祥. UPLC-ECD法同时测定不同产地女贞子中9种成分的含量[J]. 食品工业科技,2022,43(8):305−311. [CHUN Z L, ZHU Y, CHEN R X. Simultaneous determination of nine components in Ligustri lucidi Fructus from different habitats by UPLC-ECD[J]. Science and Technology of Food Industry,2022,43(8):305−311.] CHUN Z L, ZHU Y, CHEN R X . Simultaneous determination of nine components in Ligustri lucidi Fructus from different habitats by UPLC-ECD[J]. Science and Technology of Food Industry,2022 ,43 (8 ):305 −311 .[15] KOTANI A, WATANABE R, HAYASHI Y, et al. Chemometric evaluations of repeatability and detection limit in high-performance liquid chromatography with electrochemical detection[J]. Journal of Chromatography A,2022,1673:9.
[16] WANG L H, CHENG P T. Electrochemical detector for liquid chromatography:Determining minoxidil in hair-growth pharmaceuticals[J]. Current Analytical Chemistry,2019,15(5):575−582. doi: 10.2174/1573411014666180731120746
[17] 淳泽利, 谷莹莹, 陈荣祥. 超高效液相色谱-电化学检测法测定饮料中爱德万甜和5种二氢查耳酮类甜味剂的含量[J]. 理化检验-化学分册,2022,58(6):670−676. [CHUN Z L, GU Y Y, CHEN R X. Determination of advantame and 5 sweeteners of dihydrochalcones in drink by ultra-high performance liquid chromatography with electrochemical detection[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2022,58(6):670−676.] CHUN Z L, GU Y Y, CHEN R X . Determination of advantame and 5 sweeteners of dihydrochalcones in drink by ultra-high performance liquid chromatography with electrochemical detection[J]. Physical Testing and Chemical Analysis (Part B:Chemical Analysis),2022 ,58 (6 ):670 −676 .[18] WANG M Y, ZHANG P, ZHANG Y Z, et al. Chemical fingerprinting, quantification, and antioxidant activity evaluation of Osmanthus fragrans (Thunb.) Lour. flowers by UPLC-ECD[J]. International Journal of Food Properties,2022,25(1):648−660. doi: 10.1080/10942912.2022.2057530
[19] ZHANG P, CHUN Z, SHAO Q J, et al. Evaluation of the phytochemicals and antioxidant activity of Lophatherum gracile Brongn based on chemical fingerprinting by HPLC with electrochemical detection[J]. Journal of Separation Science,2021,44(20):3777−3788. doi: 10.1002/jssc.202100318
[20] 张萍, 胡克特, 陈荣祥, 等. 超高效液相色谱-电化学检测法测定不同产地盐肤木中的酚类化合物[J]. 西南林业大学学报(自然科学),2021,41(1):167−173. [ZHANG P, HU K T, CHEN R X, et al. Determination of phenolic compounds in Rhus chinensis from different habitats by UPLC−ECD[J]. Journal of Southwest Forestry University (Natural Sciences),2021,41(1):167−173.] ZHANG P, HU K T, CHEN R X, et al . Determination of phenolic compounds in Rhus chinensis from different habitats by UPLC−ECD[J]. Journal of Southwest Forestry University (Natural Sciences),2021 ,41 (1 ):167 −173 .[21] 陈荣祥, 刘涛涛, 王莉, 等. 高效液相色谱-电化学检测器同时测定脑组织中的硫醇和鸟嘌呤类物质[J]. 兰州大学学报(自然科学版),2016,52(4):552−556. [CHEN R X, LIU T T, WANG L, et al. Determination of thiols and guanine metabolites in rat brain by high performance liquid chromatography with electrochemical detector[J]. Journal of Lanzhou University (Natural Sciences),2016,52(4):552−556.] CHEN R X, LIU T T, WANG L, et al . Determination of thiols and guanine metabolites in rat brain by high performance liquid chromatography with electrochemical detector[J]. Journal of Lanzhou University (Natural Sciences),2016 ,52 (4 ):552 −556 .[22] 吴其妹, 李影, 李志荣, 等. 基于HPLC-ECD研究牡荆叶抗氧化的谱-效关系[J]. 广西植物,2023,43(6):1124-1134. [WU Q M, LI Y, LI Z R, et al. Spectrum-effect relationship of antioxidant activity in Vitex negundo var. cannabifolia based on HPLC-ECD[J]. Guihaia,2023,43(6):1124-1134.] WU Q M, LI Y, LI Z R, et al. Spectrum-effect relationship of antioxidant activity in Vitex negundo var. cannabifolia based on HPLC-ECD[J]. Guihaia,2023,43(6):1124-1134.
[23] 何婷, 罗敏, 王艳, 等. 夏枯草HPLC-ECD指纹图谱建立及抗氧化谱效关系研究[J]. 中国现代应用药学,2023,40(8):1021−1028. [HE T, LUO M, WANG Y, et al. Establishment of HPLC-ECD fingerprinting of Prunella vulgaris L. and study on its antioxidant spectrum-effect relationship[J]. Chinese Journal of Modern Applied Pharmacy,2023,40(8):1021−1028.] HE T, LUO M, WANG Y, et al . Establishment of HPLC-ECD fingerprinting of Prunella vulgaris L. and study on its antioxidant spectrum-effect relationship[J]. Chinese Journal of Modern Applied Pharmacy,2023 ,40 (8 ):1021 −1028 .[24] WU Z, DENG X Y, HU Q C, et al. Houttuynia cordata Thunb:An ethnopharmacological review[J]. Frontiers in Pharmacology, 2021, 12:714694.
[25] 何兵, 刘艳, 田吉, 等. 指纹图谱结合一测多评模式在中药鱼腥草质量评价中的应用研究[J]. 中国中药杂志,2013,38(16):2682−2689. [HE B, LIU Y, TIAN J, et al. Study on quality control of Houttuynia cordata, a traditional Chinese medicineby fingerprint combined with quantitative analysis of multi-components by single marker[J]. China Journal of Chinese Materia Medica,2013,38(16):2682−2689.] HE B, LIU Y, TIAN J, et al . Study on quality control of Houttuynia cordata, a traditional Chinese medicineby fingerprint combined with quantitative analysis of multi-components by single marker[J]. China Journal of Chinese Materia Medica,2013 ,38 (16 ):2682 −2689 .[26] 李永伟, 何兵, 周德兵, 等. 高效液相色谱法同时测定鱼腥草中绿原酸和金丝桃苷含量[J]. 中国药业,2015,24(7):49−51. [LI Y W, HE B, ZHOU D B, et al. Simultaneous determination of chlorogenic acid in Herba Houttuynia and hyperin HPLC[J]. China Pharmaceuticals,2015,24(7):49−51.] LI Y W, HE B, ZHOU D B, et al . Simultaneous determination of chlorogenic acid in Herba Houttuynia and hyperin HPLC[J]. China Pharmaceuticals,2015 ,24 (7 ):49 −51 .[27] 王静, 朱广飞, 梁思予, 等. 干鱼腥草药材及饮片的指纹图谱建立、化学计量学分析及含量测定[J]. 中国药房,2022,33(8):923−929. [WANG J, ZHU G F, LIANG S Y, et al. Study on the fingerprint establishment, chemometrics analysis and contentdetermination of dried Houttuynia cordata and its decoction pieces[J]. China Pharmacy,2022,33(8):923−929.] WANG J, ZHU G F, LIANG S Y, et al . Study on the fingerprint establishment, chemometrics analysis and contentdetermination of dried Houttuynia cordata and its decoction pieces[J]. China Pharmacy,2022 ,33 (8 ):923 −929 .[28] KIM H S, LEE A Y, JO J E, et al. Optimization of ultrasound-assisted extraction of quercitrin from Houttuynia cordata Thunb. using response surface methodology and UPLC analysis[J]. Food Science and Biotechnology,2014,23(1):1−7. doi: 10.1007/s10068-014-0001-z
[29] 李瑞玲, 崔运启, 刘奇森. HPLC法测定不同产地鱼腥草中不同部位芦丁的含量[J]. 天然产物研究与开发,2013,25(6):799−801. [LI R L, CUI Y Q, LIU Q S. Determination of rutin in different parts of Houttuynia cordata Thunb. collected in various areas by HPLC[J]. Natural Product Research and Development,2013,25(6):799−801.] LI R L, CUI Y Q, LIU Q S . Determination of rutin in different parts of Houttuynia cordata Thunb. collected in various areas by HPLC[J]. Natural Product Research and Development,2013 ,25 (6 ):799 −801 .[30] 徐杰, 曾昭君, 邓李红, 等. 鲜鱼腥草UPLC特征图谱及5种指标成分含量测定研究[J]. 天然产物研究与开发,2020,32(6):968−979. [XU J, ZENG Z J, DENG LH, et al. Study on the determination of five index components and characteristic chromatogram of fresh Houttuynia cordata by UPLC[J]. Natural Product Research and Development,2020,32(6):968−979.] XU J, ZENG Z J, DENG LH, et al . Study on the determination of five index components and characteristic chromatogram of fresh Houttuynia cordata by UPLC[J]. Natural Product Research and Development,2020 ,32 (6 ):968 −979 .[31] 胡倩, 李静, 刘大会, 等. 艾叶总黄酮提取物体内外抗氧化活性研究[J]. 食品工业科技,2021,42(6):304−309. [HU Q, LI J, LIU D H, et al. Antioxidant activity of total flavonoids extracts from folium of Artemisiae argyi in vitro and in vivo[J]. Science and Technology of Food Industry,2021,42(6):304−309.] HU Q, LI J, LIU D H, et al . Antioxidant activity of total flavonoids extracts from folium of Artemisiae argyi in vitro and in vivo[J]. Science and Technology of Food Industry,2021 ,42 (6 ):304 −309 .[32] 杨锡金, 王艳, 陈梓瀚, 等. 基于HPLC-ECD研究景天三七抗氧化活性的谱效关系[J]. 食品工业科技,2023,44(16):15−24. [YANG X J, WANG Y, CHEN Z H, et al. Study on the spectrum effect relationship of antioxidant activity of Sedum aizoon L based on HPLC-ECD[J]. Science and Technology of Food Industry,2023,44(16):15−24.] YANG X J, WANG Y, CHEN Z H, et al . Study on the spectrum effect relationship of antioxidant activity of Sedum aizoon L based on HPLC-ECD[J]. Science and Technology of Food Industry,2023 ,44 (16 ):15 −24 .[33] 裴河欢, 张美凤, 覃洋琛, 等. 多酚类化合物药理作用研究进展[J]. 中国药业,2022,31(23):124−127. [PEI H H, ZHANG M F, QIN Y C, et al. Research progress on pharmacological effects of polyphenolic compounds[J]. China Pharmaceuticals,2022,31(23):124−127.] PEI H H, ZHANG M F, QIN Y C, et al . Research progress on pharmacological effects of polyphenolic compounds[J]. China Pharmaceuticals,2022 ,31 (23 ):124 −127 .[34] 罗敏, 何婷, 龚磊, 等. 夏枯草中16种酚类化合物含量的测定及其与抗氧化活性的相关性分析[J]. 食品工业科技,2023,44(1):299−306. [LUO M, HE T, GONG L, et al. Determination of 16 phenolic compounds in Prunella vulgaris and analysis their correlation with antioxidant activity[J]. Science and Technology of Food Industry,2023,44(1):299−306.] LUO M, HE T, GONG L, et al . Determination of 16 phenolic compounds in Prunella vulgaris and analysis their correlation with antioxidant activity[J]. Science and Technology of Food Industry,2023 ,44 (1 ):299 −306 .[35] 王亚茹, 袁满, 张丽, 等. 槲皮素抗氧化作用及相关机制研究进展[J]. 营养学报,2022,44(2):204−208. [WANG Y R, YUAN M, ZHANG L, et al. Research progress on antioxidant actions and related mechanisms of quercetin[J]. Acta Nutrimenta Sinica,2022,44(2):204−208.] WANG Y R, YUAN M, ZHANG L, et al . Research progress on antioxidant actions and related mechanisms of quercetin[J]. Acta Nutrimenta Sinica,2022 ,44 (2 ):204 −208 .





 下载:
下载:
 下载:
下载:
