Analysis on the Influence of Meat Mincing Times on the Flavor Characteristics of Surimi Based on GC-IMS
-
摘要: 为阐明采肉次数对鱼糜风味特征的影响,本研究采用GC-IMS测定不同采肉次数下(1、2、3、4和5)制备的白鲢鱼糜的挥发性物质,同时测定TBARS值,并对它们进行相关性分析。结果显示:5组鱼糜中检测出的挥发性物质均为58种,其中壬醛、乙酸乙酯、2-丙酮、乙醇、2-甲基丁醛的含量相对较高;醛(39.13%~40.91%)、酮(15.52%~21.74%)、醇(19.28%~26.59%)是主要的挥发性物质种类。随着采肉次数的增加,醛类占比先下降后升高,酮类占比逐渐上升,醇类占比波动变化。挥发性物质的PCA和欧式距离结果表明,采肉次数为1制备的鱼糜样品和其它样品的风味特征差异明显。增加采肉次数,鱼糜的TBARS值先显著(P<0.05)增加后显著(P<0.05)降低。鱼糜中己醛、戊醛、E-2-戊烯醛、E-2-辛烯醛、3-辛醇,2,3-戊二酮等与TBARS值正相关(0.8>r>0.5),苯酚、苯乙醛负相关(−0.8<r<−0.5)。采肉次数影响鱼糜风味特征,其主要原因可能是与脂肪氧化有关。
-
关键词:
- 鱼糜 /
- 风味 /
- 加工 /
- 气相色谱离子迁移光谱 /
- 脂质氧化
Abstract: Volatile substances of silver carp surimi prepared under different meat mincing times (1, 2, 3, 4, and 5) were determined by GC-IMS, and their TBARS values were also measured. Additionally, correlation analysis between the flavor substances and the TBARS values were conducted to elucidate the effect of meat mincing times on the flavor characteristics of surimi. According to the GC-IMS result, a total of 58 volatile substances were detected in all the 5 surimi samples, with relatively high levels of nonanal, ethyl acetate, 2-acetone, ethanol, and 2-methylbutanal. Aldehydes (39.13%~40.91%), ketones (15.52%~21.74%), and alcohols (19.28%~26.59%) were the main types of volatile substances. As the number of meat mincing times increased, the proportion of aldehydes first decreased and then increased, the ketones gradually increased, while the alcohols fluctuated. The PCA and Euclidean distance results of volatile substances indicated that there was a significant difference in flavor characteristics between surimi sample prepared with one time of meat mincing and other samples. The TBARS value of surimi significantly (P<0.05) increased up to 3 mincing times and then decreased (P<0.05). Hexanal, glutaraldehyde, 3-octanol, 2,3-pentanedione, E-2-pentenal, and E-2-octenal in surimi were positively correlated with TBARS values (0.8>r>0.5), while phenol and phenylacetaldehyde were negatively correlated (−0.8<r<−0.5). The meat mincing times affected the flavor characteristics of surimi, which would be mainly due to fat oxidation.-
Keywords:
- surimi /
- flavor /
- processing /
- gas chromatography ion migration spectroscopy /
- lipid oxidation
-
鱼糜是一类重要的水产制品,其加工工序包括鱼体分割、采肉、漂洗、精滤、脱水、添加抗冻剂和速冻等[1]。采肉是鱼糜加工过程中重要的一步,其作用是将鱼体的皮、骨等去除,从而把鱼肉分离出来。目前在采肉过程中一般采用多台采肉设备串联的方式实现连续化生产,采肉次数影响鱼糜的得率和经济成本。前期研究发现采肉次数影响鱼糜的凝胶性能、结构及组成,随着采肉次数的增加,肌纤维细胞结构和超微结构逐渐被破坏,脂肪、组织蛋白酶、谷胺酰转氨酶(TGase)和血红素蛋白含量先升高后降低,凝胶强度逐渐下降,白度值先降低后增加[2]。除了凝胶强度和白度值,风味特征也是反映鱼糜品质的特征之一,影响消费者的可接受程度。
近年来,国内外学者采用GC-MS、GC-IMS和电子鼻等技术手段研究了原料鱼种、漂洗次数和方式、分割方式和添加物等对鱼糜风味特征的影响[3−5]。不同分割方式下,鱼糜的风味特征可通过线性判断方法(LDA)区分[4]。Qiu等[6]采用GC-IMS分析添加纳米豆渣对鱼糜风味特征的影响,发现纳米豆渣降低了鱼糜中己醛、壬醛、(E,E)-2,4-庚二烯醛和1-辛烯-3-醇等鱼腥味化合物,增加了2-甲基丁醛、3-甲基丁醛、苯甲醛和苯乙醛等具有支链或苯环的挥发性有机物的浓度。采肉次数影响鱼糜组成(特别是脂肪含量[2]),其可能进一步影响鱼糜风味特征。然而,目前关于采肉次数对鱼糜风味特性影响的相关研究还未见报道。
气相-离子迁移谱法(GC-IMS)结合了气相色谱的高分离性能以及离子迁移谱的高灵敏度,可以准确快速地分析出样品中的挥发性化合物[4]。因此,本研究利用GC-IMS技术对不同采肉次数制备的鲢鱼鱼糜的挥发性风味物质进行测定,通过构建指纹图谱以及统计学分析,探究采肉次数对鱼糜挥发性特征的影响,并通过脂肪氧化程度和风味成分之间的相关性分析,初步揭示采肉次数对鱼糜风味特征的影响机制,旨在为鱼糜及鱼糜制品的高值化加工利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
鲜活鲢鱼 购于白沙洲农贸市场(中国武汉);蔗糖 购自太古糖业中国有限公司(中国上海);三氯乙酸、丙二醛、硫代巴比妥酸、三聚磷酸钠 购自国药化学试剂有限公司(中国上海);其他化学试剂均为分析纯。
YBYM-6004-B采肉机(4 mm孔径) 中国厦门英博食品机械有限公司;UV2600A紫外可见分光光度仪 上海舜宇恒平科技仪器有限责任公司;SS-300三足离心机 润鑫机械厂(中国张家港);FP3013食品调理机 德国博朗公司;FlavourSpec1H1-00053型顶空气相-离子迁移谱仪 德国G.A.S.公司;CTC CombiPAL顶空自动进样器 瑞士CTC Analytics AG公司;MXT-5毛细管柱(15 mL×0.53 mm×1 μm,Restek Corp) 美国宾夕法尼亚州贝尔丰特公司。
1.2 实验方法
1.2.1 样品制备
根据He等[7]的方法进行鱼糜制备,并在此基础上做了一些改进。先将白鲢去头、去内脏,冲洗除去血液和其他杂质,再使用滚筒式鱼肉分离器分离鱼肉、鱼骨和鱼皮。采肉过程模拟工业操作步骤。分离过程中,鱼肉在皮带的挤压作用下,通过不锈钢滚筒的圆孔进入滚筒内部,与其它部分分离。原料鱼只经过分离器1次便进入下一道工序,制备的样品记作C1;将与C1鱼肉分离的其它部分收集,送入分离器,再将分离的鱼肉与C1鱼肉混合,制备的样品记为C2。在工业上为实现连续化生产,制备C2样品需要将2台分离器串联,一批原料需要经2台分离器采肉,即采肉2次。将分离C2鱼肉后的剩余部分收集,送入分离器,再将分离的鱼肉与C2混合,制备的样品记为C3。以此类推,再制备C4和C5样品。将经不同采肉次数后获得的鱼肉(C1、C2、C3、C4和C5),分别进行三次重复漂洗去除脂肪和水溶性蛋白质。将鱼肉与冰水混合(大约4:1)并搅拌10 min。漂洗后,将鱼糜放入滤袋(80目)中,以15000 r/min转速离心5 min去除多余的水分。完成脱水后的鱼糜与冷冻保护剂(6%蔗糖和0.3%三聚磷酸钠)混合,将样品分别置于乙烯塑料中并压平,使其厚度约为1 cm,然后真空包装并在−18 ℃下冷冻。
1.2.2 GC-IMS 分析
1.2.2.1 样品前处理
参考Nie等[8]的方法,并作一定修改。将每组样品切2 g用磁性盖密封在带有20 mL顶空小瓶的小瓶中,在60 ℃下孵育15 min后进样,进行数据分析。每个样品取3次作为平行。
1.2.2.2 分析条件
自动进样顶空单元:进样体积500 μL;孵育时间20 min;孵育温度60 ℃;进样针温度65 ℃;孵育转速500 r/min
气相-离子迁移谱单元:分析时间20 min;色谱柱类型为MXT-5:0.53 mm;柱温60 ℃;载气/漂移气为N2;IMS温度45 ℃;离子迁移管漂移器中以150 mL/min流速吹气20 min。
色谱条件:以N2为载气E1 20 min内保持150 mL/min,E2初始2.0 mL/min,保持2 min后在10 min内线性增至10 mL/min,之后在20min内线性增至100 mL/min。
1.2.3 硫代巴比妥酸值测定
1.2.3.1 标曲的制作
参照Kowalska等[9]的方法。精确称取约5 g样品,添加45 mL三氯乙酸(质量分数15%)-硫代巴比妥酸(TBARS,质量分数0.1%)溶液,60 ℃加热反应1 h,5000×g离心5 min,取上清液在波长532 nm处测定吸光度。通过样品中丙二醛(MDA)的浓度(μmol/L)表示,以丙二醛为标准品制备标准曲线(y=1.241x+0.0156,R2=0.9988),结果表示为mg/kg鱼糜,实验重复3次。
1.2.3.2 硫代巴比妥酸值(丙二醛含量)的计算
x=c×v×1000m×1000 (1) 式中:x表示鱼糜样品中丙二醛的含量,mg/kg;c表示根据吸光度值计算出的溶液中丙二醛质量浓度,μg /mL;V表示试样溶液定容体积,mL;m表示鱼糜量,g;1000为换算系数。
1.3 数据处理
用仪器配套的分析软件VOCal和三款插件以及GC×IMS Library Search,从不同角度对样品进行分析。应用软件内置的NIST数据库和IMS数据库可对物质进行定性分析。VOCal软件用于查看分析谱图,图中每一个点代表一种挥发性有机物,对其建立标准曲线后可以定量分析,如定量分析检测6种酮的混标,挥发物用正构酮:2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮和2-壬酮(均为分析纯)定量,建立保留时间和保留指数的校准曲线,随后通过目标物的保留时间计算出该物质的保留指数。
保留指数(RI)=100×[log10Xi−log10Xnlog10Xn+1−log10Xn+n] (2) 式中:Xi为目标代谢物的保留时间;Xn和Xn+1为前后相邻的两个正烷烃对应的保留时间;n表示碳原子数。
运用Reporter插件进行样品之间的谱图差异分析(二维俯视图、三维谱图和差异谱图);运用Gallery Plot插件构建指纹图谱,直观且定量地比较不同样品之间的挥发性有机物差异;运用Dynamic PCA插件动态主成分分析和相似度分析图,用于将样品聚类分析和相似度分析,以及快速确定未知样品的种类;用Excel 2010处理数据,用软件Origin 7.0绘图,SPSS 26显著性统计分析。
2. 结果与分析
2.1 GC-IMS分析
2.1.1 挥发性有机化合物的识别
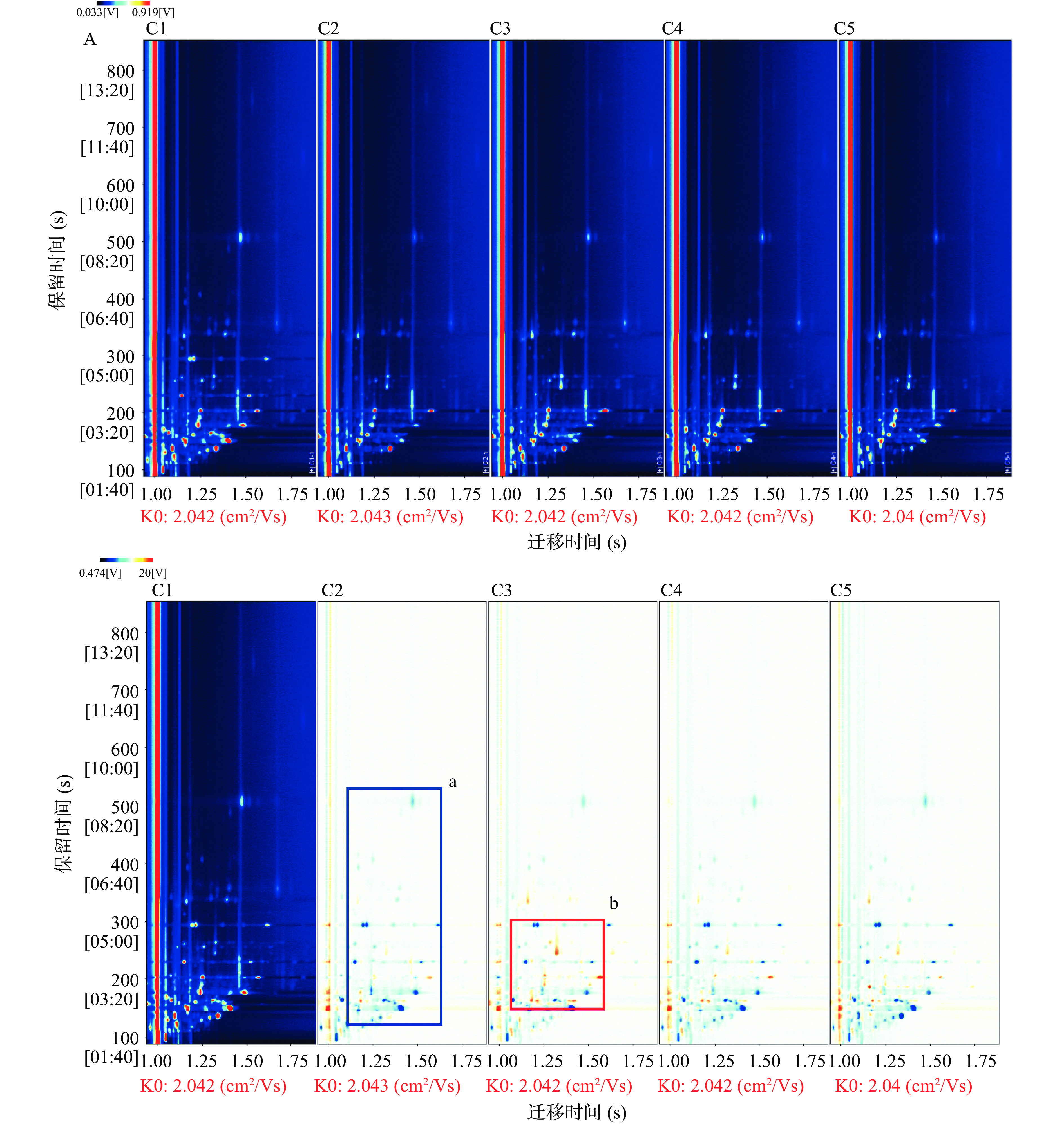
图1为不同采肉次数制备的鱼糜样品3D地形图投影获得的2D图,可较容易比较五种样品挥发性成分的差异性。图1A中迁移时间1.0 ms处红色竖线表示反应离子峰(reactive ion peak,RIP),每个样品的迁移时间约为2.08 ms,各种风味物质的保留时间集在100~380 s之间。RIP峰两侧的每一个带有编号的点代表一种挥发性有机物,其颜色代表物质的浓度,即蓝色表示浓度较低,红色表示浓度较高[10]。不同样品图中红点数量和位置在图谱中的差异较大,说明它们的风味物质组成存在差异[11]。本研究的2D图中鱼糜反应离子峰和各种风味物质的保留时间范围与Qiu等[6]报道的一致。
图1B以C1(采肉为1次的鱼糜样品)为参比,其余谱图扣除C1中的信号峰,得到二者的差异谱图(图1B)。图1B(C2、C3、C4和C5)中可见点的颜色为蓝色(以a区域为例),表示其对应物质的含量较C1样品的低;可见点的颜色为红色(以b区域为例),表示其对应物质的含量较C1样品的高。蓝或者红色越深,说明差异越大。从图1B中可以清楚地观察到,采肉次数为2、3、4、5的鱼糜样品的图谱中蓝色点比较多,说明它们总的挥发性物质含量较采肉次数为1的鱼糜样品低。鱼肉主要成分一般由水溶性的肌浆蛋白、盐溶性的肌原纤维蛋白和不溶性的基质蛋白组成[12]。随着采肉次数的增加,鱼肉肌纤维的细胞结构逐渐被破坏[2],鱼肉持水性降低,使得风味物质的流失增多[13]。
为了进一步分析不同采肉次数的鱼糜样品挥发性风味物质的变化,采用GC×IMS Library Search软件内置的NIST数据库和IMS数据库对图1A中带有编号的点进行有机化合物的定性分析。5种鱼糜样品中可以明确定性的挥发性物质均为58种(表1),包括提高待分析物浓度时,出现2个分子时共用一个质子或电子,形成二聚体的现象[14]。鉴定出的挥发性物质碳链普遍集中在C3~C10之间,醛类有23种,酮类11种,醇类10种,酸类2种,酯类3种,酚类3种和含硫化合物6种,其中醛类物质的含量最高,其次是酮类和醇类物质。阮秋凤[15]在冷冻鲢鱼糜中检测到挥发性气味物质45种,其中醛类18种、醇类5种、酸类1种、酮类6种、酯类4种及未知物质11种;而本研究中鉴定出58种气味物质,这可能是由于采用的鉴定方法有差别,也说明GC-IMS较高的灵敏度。但整体趋势一致,醛类物质偏多,其次是酮类物质,再次是醇类物质。不同采肉次数鱼糜样品的挥发性物质组成见图2。
表 1 鱼糜样品中挥发性化合物种类Table 1. Volatile compounds in surimi samples编号 化合物中(英)文名称 CAS# 分子式 分子量 保留指数 保留时间(s) 相对迁移
时间(ms)物质型态 1 癸醛(Decanal) C112312 C10H20O 156.3 1269.3 732.921 1.54651 2 壬醛(Nonanal) C124196 C9H18O 142.2 1110.8 505.027 1.48934 单体 3 壬醛(Nonanal) C124196 C9H18O 142.2 1110.8 505.027 1.94676 二聚体 4 (E)-2-辛烯醛((E)-2-Octenal) C2548870 C8H14O 126.2 1058.0 429.178 1.33379 5 辛醛(Octanal) C124130 C8H16O 128.2 1006.8 355.507 1.41505 6 1-辛烯-3-醇(1-Octen-3-ol) C3391864 C8H16O 128.2 986.2 332.104 1.15814 单体 7 1-辛烯-3-醇(1-Octen-3-ol ) C3391864 C8H16O 128.2 986.7 332.563 1.5979 二聚体 8 3-辛酮(3-Octanone) C106683 C8H16O 128.2 993.4 338.07 1.30775 9 6-甲基-5-庚烯-2-酮(6-Methyl-5-hepten-2-one) C110930 C8H14O 126.2 992.8 337.611 1.18686 10 安息香醛(Benzaldehyde) C100527 C7H6O 106.1 960.2 310.537 1.15059 11 环己酮(Cyclohexanone) C108941 C6H10O 98.1 899.3 260.06 1.14605 12 庚醛(Heptanal) C111717 C7H14O 114.2 903.2 263.272 1.33495 单体 13 庚醛(Heptanal) C111717 C7H14O 114.2 902.6 262.813 1.6931 二聚体 14 2-庚酮(2-Heptanone) C110430 C7H14O 114.2 893.8 255.471 1.25788 单体 15 2-庚酮(2-Heptanone) C110430 C7H14O 114.2 893.2 255.012 1.62963 二聚体 16 1-己醇(1-Hexanol) C111273 C6H14O 102.2 871.4 243.747 1.3267 17 (E)-2-己烯醛((E)-2-Hexenal) C6728263 C6H10O 98.1 847.1 231.564 1.17778 18 己醛(Hexanal) C66251 C6H12O 100.2 789.0 202.43 1.26255 单体 19 己醛(Hexanal) C66251 C6H12O 100.2 789.0 202.43 1.56268 二聚体 20 1-戊醇(1-Pentanol) C71410 C5H12O 88.1 761.5 191.307 1.2511 单体 21 1-戊醇(1-Pentanol) C71410 C5H12O 88.1 760.2 190.777 1.51343 二聚体 22 2-己酮(2-Hexanone) C591786 C6H12O 100.2 776.0 196.868 1.19153 23 (E)-2-戊烯醛((E)-2-Pentenal) C1576870 C5H8O 84.1 739.1 182.706 1.10303 24 戊醛(Pentanal) C110623 C5H10O 86.1 688.0 163.148 1.1921 单体 25 戊醛(Pentanal) C110623 C5H10O 86.1 684.3 162.333 1.42329 二聚体 26 1-丁醇(1-Butanol) C71363 C4H10O 74.1 661.3 157.118 1.37402 27 2-甲基丁醛(2-Methyl-butanal) C96173 C5H10O 86.1 640.6 152.458 1.16254 单体 28 2-甲基丁醛(2-Methyl-butanal) C96173 C5H10O 86.1 637.7 151.803 1.39957 二聚体 29 3-甲基丁醛(3-Methylbutanal) C590863 C5H10O 86.1 610.8 145.726 1.17873 单体 30 3-甲基丁醛(3-Methylbutanal) C590863 C5H10O 86.1 616.1 146.908 1.40571 二聚体 31 乙酸乙酯(Ethyl acetate) C141786 C4H8O2 88.1 572.0 136.948 1.09531 单体 32 乙酸乙酯(Ethyl acetate) C141786 C4H8O2 88.1 572.0 136.948 1.33455 二聚体 33 丁醛(Butanal) C123728 C4H8O 72.1 545.0 130.871 1.28302 34 2-丙酮(2-Propanone) C67641 C3H6O 58.1 511.4 123.283 1.11038 35 丙醛(Propanal) C123386 C3H6O 58.1 465.5 112.907 1.06617 36 乙醇(Ethanol) C64175 C2H6O 46.1 430.9 105.097 1.04407 37 2-戊基呋喃(2-Pentylfuran) C3777693 C9H14O 138.2 997.6 342.28 1.25447 38 2-丁酮(2-Butanone) C78933 C4H8O 72.1 543.9 130.609 1.24086 39 2-壬酮(2-Nonanone) C821556 C9H18O 142.2 1093.6 480.364 1.41241 40 苯乙醛(Benzeneacetaldehyde) C122781 C8H8O 120.2 1041.9 406.013 1.25564 41 2-甲基吡嗪(2-Methylpyrazine) C109080 C5H6N2 94.1 797.3 206.601 1.07746 42 2-甲基丙酸(2-Methylpropanoic acid) C79312 C4H8O2 88.1 773.3 195.832 1.16895 43 3-甲基-1-丁醇(3-Methyl-1-butanol) C123513 C5H12O 88.1 722.5 176.332 1.2437 单体 44 3-甲基-1-丁醇(3-Methyl-1-butanol) C123513 C5H12O 88.1 721.0 175.75 1.49028 二聚体 45 3-羟基-2-丁酮(Acetoin) C513860 C4H8O2 88.1 706.6 170.22 1.05737 单体 46 3-羟基-2-丁酮(Acetoin) C513860 C4H8O2 88.1 708.1 170.803 1.32961 二聚体 47 苯酚(Phenol) C108952 C6H6O 94.1 997.7 342.375 1.0791 48 3-辛醇(3-Octanol) C589980 C8H18O 130.2 993.9 338.478 1.39133 49 2,5-二甲基吡嗪(2,5-Dimethylpyrazine) C123320 C6H8N2 108.1 894.8 256.347 1.11503 50 3-甲基丁酸乙酯(Ethyl 3-methylbutanoate) C108645 C7H14O2 130.2 849.1 232.573 1.2523 51 二甲基硫醚(Dimethyl sulfide) C75183 C2H6S 62.1 497.0 120.009 0.96041 52 2-乙基呋喃(2-Ethylfuran) C3208160 C6H8O 96.1 692.1 164.634 1.07502 单体 53 2-乙基呋喃(2-Ethylfuran) C3208160 C6H8O 96.1 691.5 164.423 1.31004 二聚体 54 3-戊酮(3-Pentanone) C96220 C5H10O 86.1 689.3 163.577 1.10859 55 2,3-丁二酮(2,3-Butanedione) C431038 C4H6O2 86.1 594.4 142.02 1.16948 56 2,3-戊二酮(2,3-Pentanedione) C600146 C5H8O2 100.1 680.9 161.549 1.21549 57 (Z)-2-己烯醛((Z)-2-Hexenal) R218138 C6H10O 98.1 843.7 229.829 1.15277 单体 58 (Z)-2-己烯醛((Z)-2-Hexenal) R218138 C6H10O 98.1 845.4 230.676 1.52137 二聚体 2.1.2 指纹图谱分析
利用GC-IMS分析采肉次数不同的鲢鱼鱼糜挥发性风味物质的变化,得到的风味指纹图谱(图2)。图中每一行代表一个鱼糜样品中选取的全部信号峰,每一组样品做3个平行,每一列代表同一挥发性有机物在不同样品中的信号峰,重复性好。图中亮点颜色越深表示峰强度越大,含量越高,部分物质后面有_M、_D,表示同一个物质的单体(Monomer)与二聚体(Dimer),数字编号的是未鉴定出的峰。图谱中代表挥发性物质的点亮度发生明显变化,说明不同采肉次数制备的鱼糜中挥发性风味物质的种类和浓度存在明显差异。目前已有研究表明鱼肉的主要气味物质是己醛、壬醛、辛醛、1-辛烯-3-醇和烯醛等[3],在本实验中均检出。图2中a区域显示2-甲基丁醛、3-甲基丁醛、(Z)-2-己烯醛、丁醛、1-丁醇、6-甲基-5-庚烯-2-酮、2-乙基呋喃、二甲基硫醚、3-甲基丁酸乙酯、2-甲基丙酸、2,5-二甲基吡嗪、2-甲基吡嗪、3-辛醇、3-甲基-1-丁醇、乙醇、2-丙酮、2-丁酮、2-己酮、2-壬酮、2-庚酮、环己酮随着采肉次数的增多而减少;图2中b区域可知C3中(E)-2-辛烯醛、庚醛、(E)-2-己烯醛、壬醛、己醛、(E)-2-戊烯醛、戊醛、1-辛烯-3-醇、1-己醇、1-戊醇、3-辛酮、2,3-戊二酮、2-戊基呋喃等物质的含量随着采肉次数的增加先增加后减少;己醛普遍存在于淡水鱼中,具有清香或青草气味,常会与八碳或九碳挥发性物质混合在一起共同产生香味[16]。醇类化合物中,1-辛烯-3-醇是一种亚油酸的氢过氧化物的降解物,具有类似蘑菇的气味[17];1-辛烯-3-醇和己醛、壬醛和各类烯醛在较高浓度时还表现出腥味[5]。1-己醇在新鲜淡水鱼肉中呈现青草味[18],其在C3组的相对含量较高;图2中c区域可知,3-羟基丁酮、3-戊酮、2,3-丁二酮等物质的含量随着采肉次数的增加而增加,采肉5次时,这几种挥发性风味化合物的相对含量最高。随着采肉次数的增加,各挥发性物质的含量发生变化,说明采肉次数对鱼糜的风味成分影响较大。根据文献[3,6,15]报道,推断己醛、壬醛和1-辛烯-3-醇和烯醛(如(E)-2-己烯醛)等是采肉1~5次鱼糜中主要挥发性物质,它们贡献鱼肉特征风味。己醛、壬醛、1-辛烯-3-醇和(E)-2-己烯醛等的含量随着采肉次数先增加后降低,说明样品的鱼肉特征风味强度可能先增加后降低。
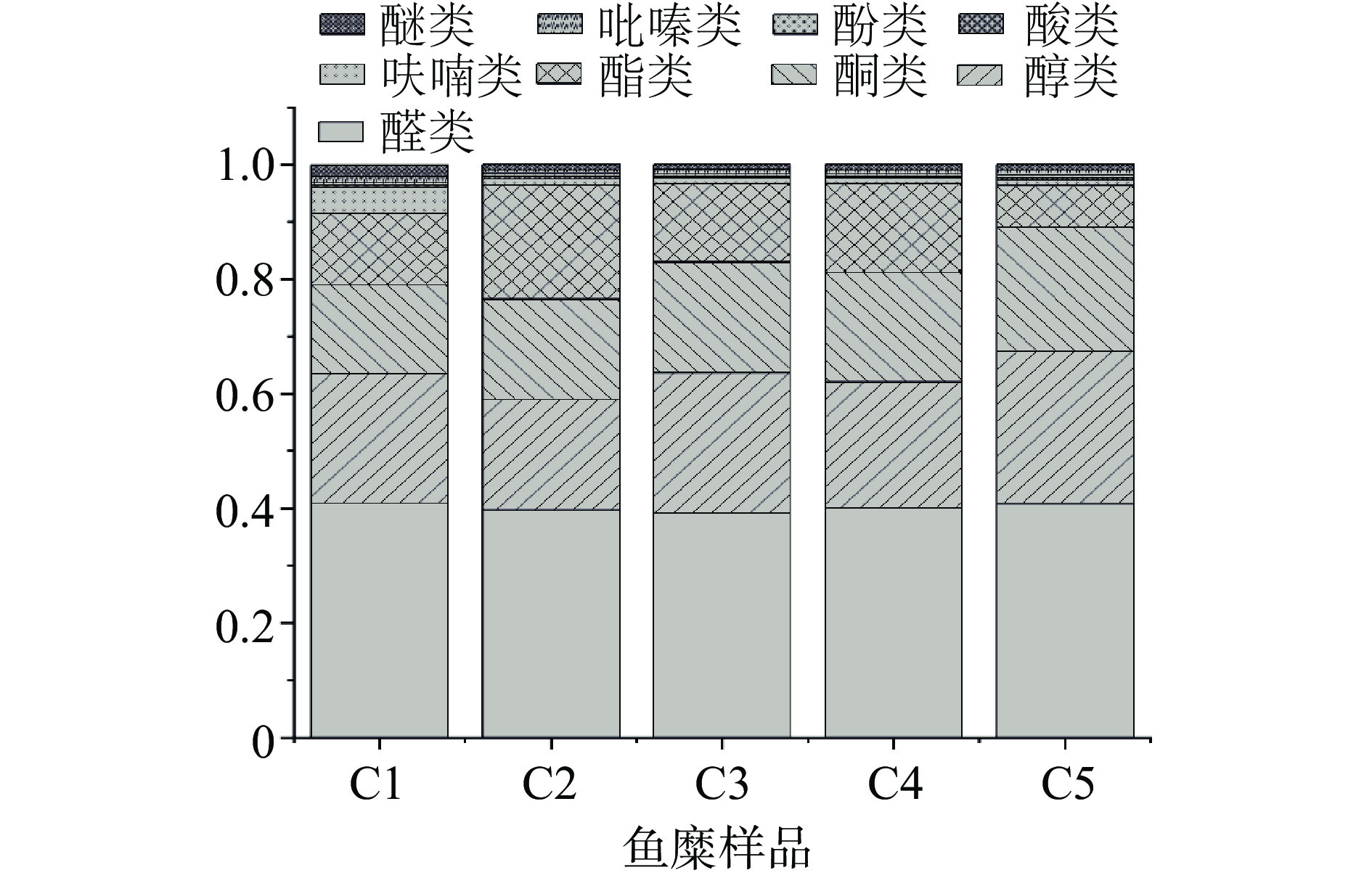
五种不同采肉次数的鱼糜样品主要是以醛类、酮类和醇类为主,其次是酯类、呋喃、醚类,酚类、吡嗪和酸类相对含量最低。不同样品的各类挥发性物质相对百分含量具有一定的差异性(图3)。醛类物质是水产品中主要的挥发性气味物质,己醛、(E)-2-庚烯醛等具有植物香、鲜鱼香等气味,来自鱼肉中脂肪的氧化和蛋白质的降解[19]。由图3可知,五组鱼糜样品醛类化合物相对含量基本相近,1次采肉组和5次采肉组的含量较高。醇类化合物是醛类在还原酶的作用下部分还原生成的,具有比较柔和的植物香和清香[20],样品中乙醇、3-甲基-1-丁醇、1-丁醇的含量较高,醇类化合物的总相对百分含量在采肉3次和采肉5次时较高。醇类物质继续氧化会产生酮类物质,由图3可知,3次采肉组和5次采肉组样品的酮类化合物含量较高。2-庚酮和2-丁酮可通过脂肪氧化以及美拉德反应产生,且酮类物质对于消除腥味具有一定的贡献[21]。酯类物质是由醇类和酸类物质通过酯化反应形成的[22],2次采肉组和4次采肉组含量较高,且乙酸乙酯,乙酸乙酯二聚体和3-甲基丁酸乙酯具有苹果香气和令人愉悦的花香[23]。鱼糜中的酸类化合物主要为具有醋酸味和臭味的短链脂肪酸,如乙酸、丙酸、丁酸等,主要是脂质的氧化产物[24]。五组样品的酸类物质相对百分含量均较低,且无较大差别。呋喃和吡嗪类化合物是氨基酸降解生成的α-氨基酸酮缩合反应生成[25],吡嗪类化合物相对百分含量较低,随着采肉次数的增加,吡嗪类化合物的相对百分含量逐渐降低,对风味的贡献值较低。酚类物质为苯酚,具有类似消毒水的味道,可能是由氨基酸降解产生[26]。
2.1.3 采肉次数不同鱼糜中挥发性化合物PCA分析
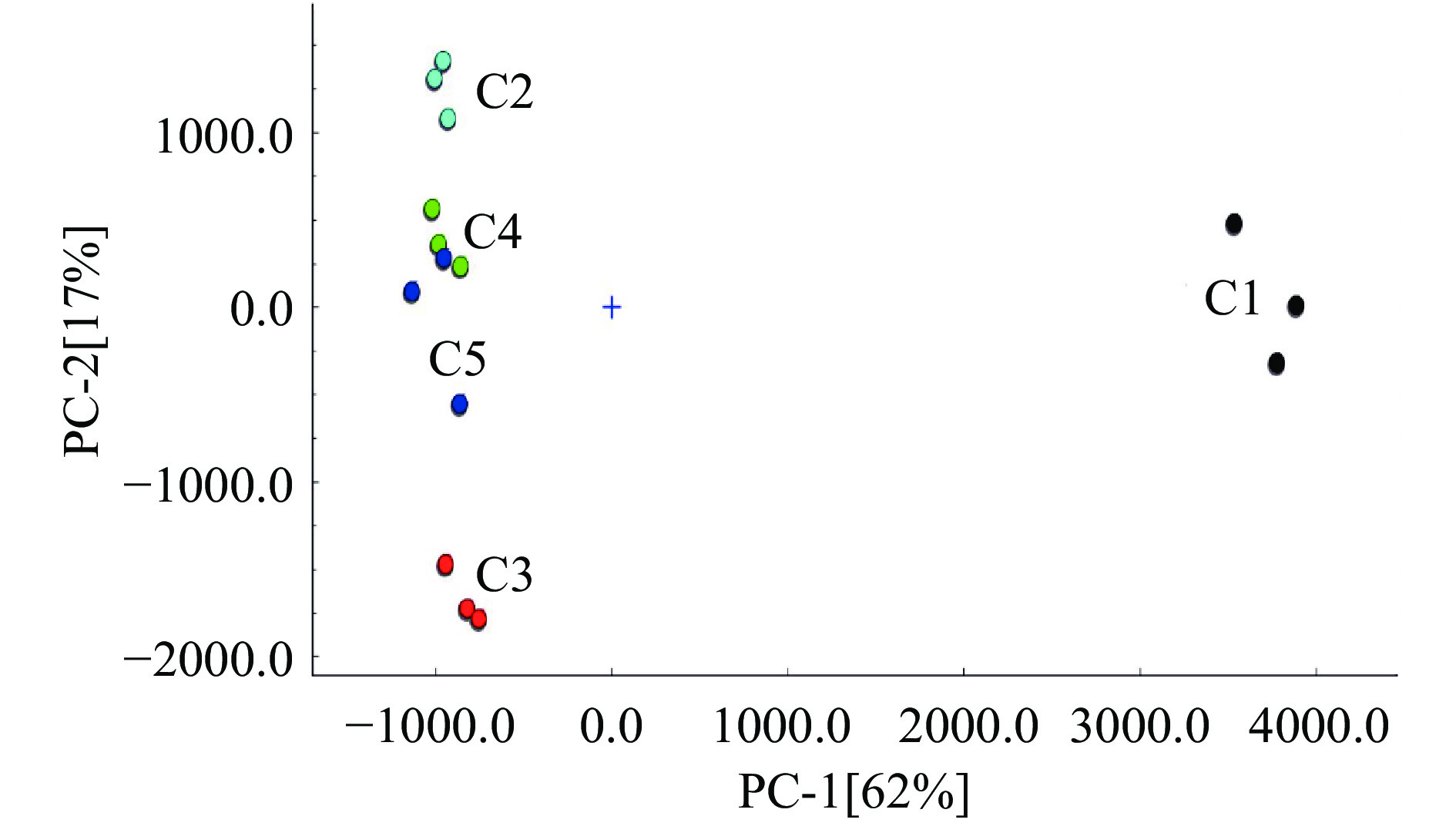
采用Dynamic PCA插件进行PCA处理,比较五种不同采肉次数的鱼糜样品的特征风味差异(图4)。从图4中可以看出不同采肉次数鱼糜样品组内之间距离较近,说明鱼糜样品的重复性良好,组间相距较远,说明采肉次数不同的鱼糜样品挥发性化合物之间差异明显。
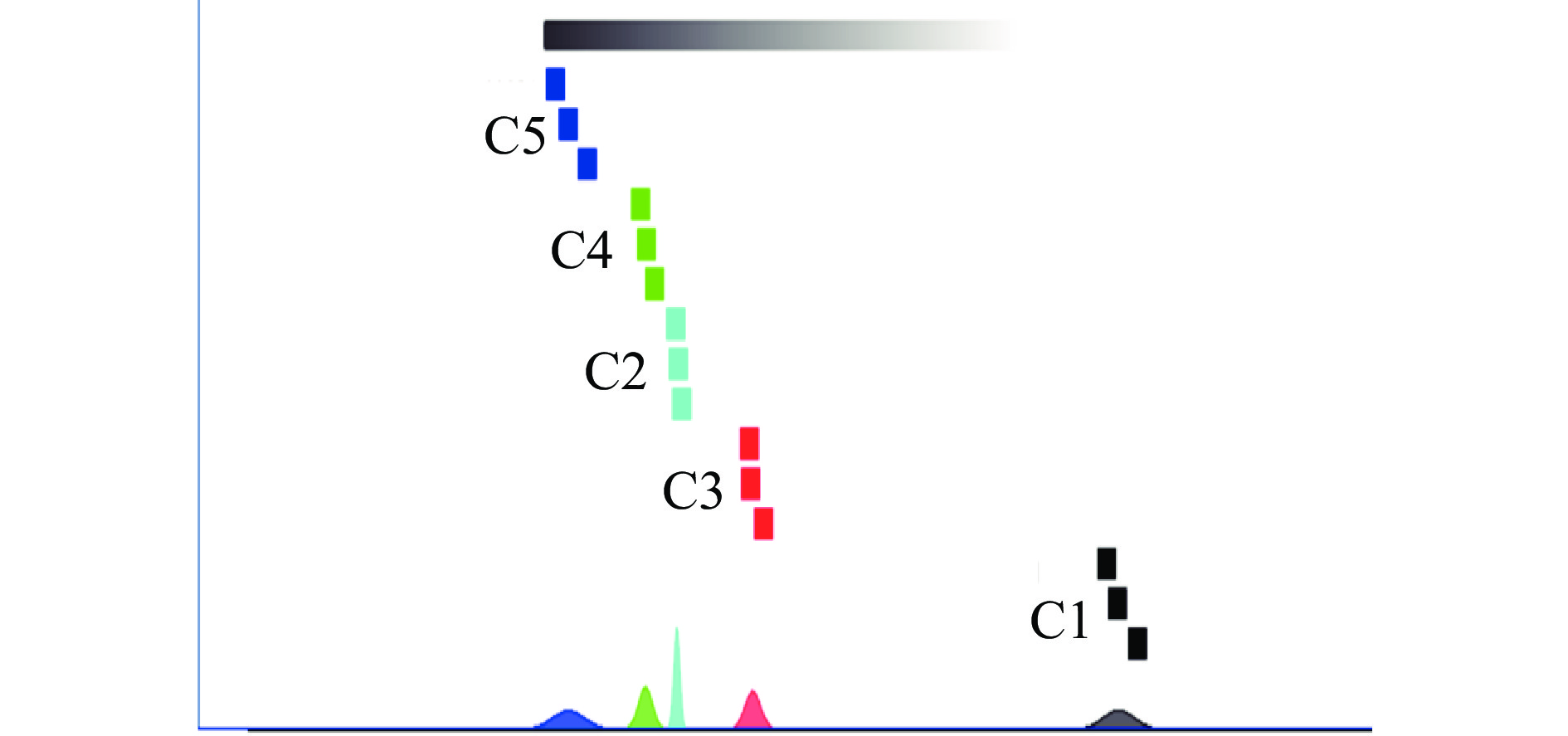
在PC1水平,可以将采肉次数不同的鱼糜分为两部分,即采肉次数为1的鱼糜样品为一类,采肉次数2~5次的鱼糜样品分为一类;图5为样品的最近邻-欧氏距离图,“最近邻”功能可根据所选评估区域中化合物的强度对样本进行快速比较。该算法计算每两个样本的之间的欧几里得距离。这样,就可以通过检索最小距离来找到“最近邻”。距离越近,说明两种样品之间的相似性越高,反之越低。由图5分析结果可知,C1与其它四个的样品的差距较大。
2.2 采肉次数不同对鱼糜脂肪氧化的影响
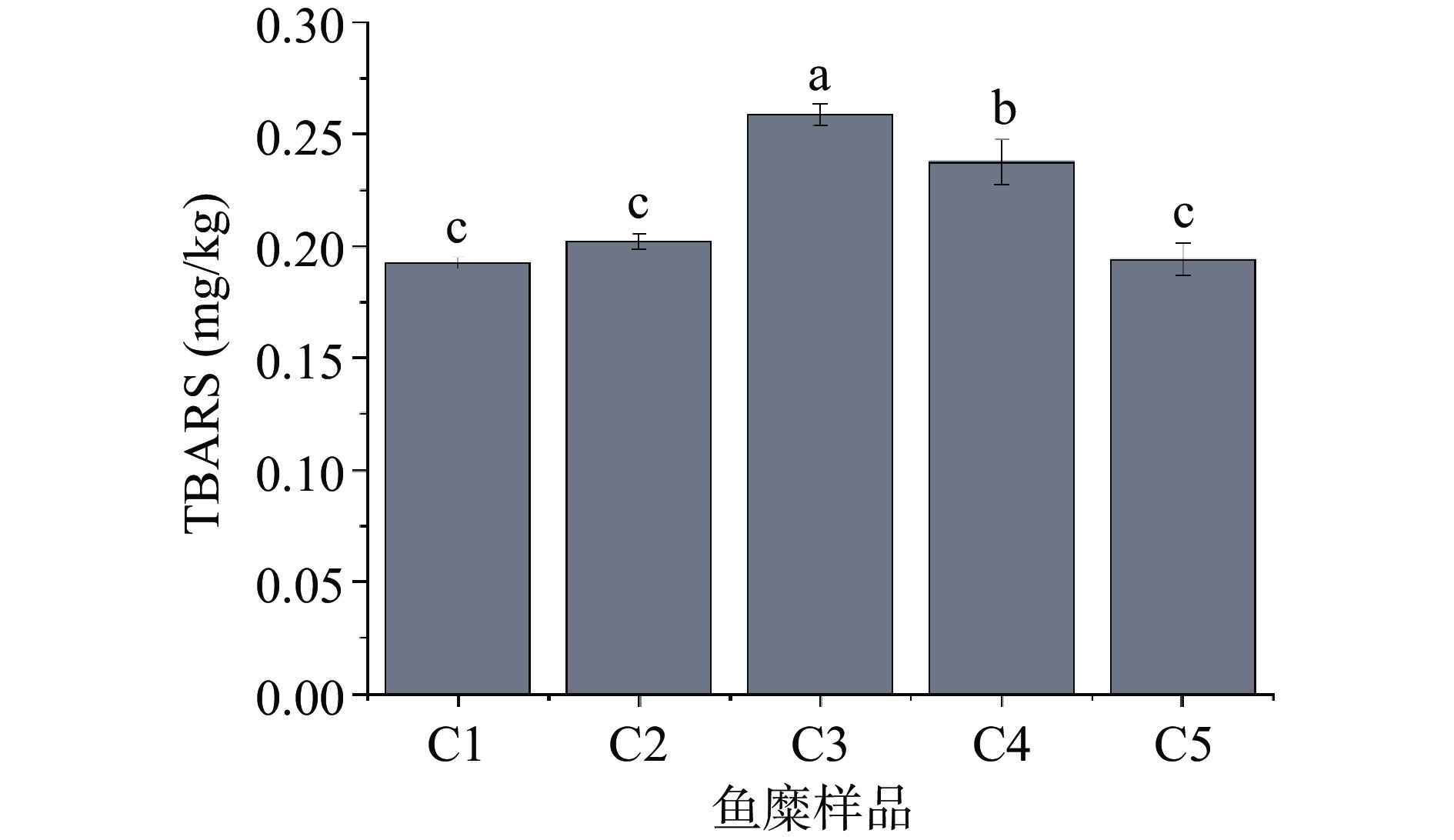
TBARS值与鱼肉脂肪氧化程度的相关性很大,随着氧化程度的加深,氧化产物不断增多,TBARS值不断增大[27]。从图6中可以看出,不同鱼糜样品的TBARS值存在差异。采肉次数增多,所制备的鱼糜样品TBARS值呈现先增加后下降的趋势。鱼糜在加工过程中,细碎的鱼肉暴露于空气与加工器械中增大了与氧气和金属的接触机会,使鱼糜及鱼糜制品在后续工艺中容易发生脂肪氧化[28]。鱼糜的风味成分也来源于肌原纤维蛋白结合的风味物质,经氧化后的肌原纤维蛋白二级结构发生变化,造成风味物质含量与未氧化组或氧化程度低组产生差异。采肉3次时,鱼糜样品脂肪氧化程度最深。从图2中可以看出2-甲基丁醛和壬醛这两种物质含量在C3中明显增加。氧化后的肌原纤维蛋白对2-甲基丁醛和壬醛有促释放的作用,与甘潇等[29]的研究一致。鱼糜中酮类、酸类化合物可能来源于脂肪氧化降解,TABRS值变化规律与上述几类物质相对含量变化规律基本一致[30]。
2.3 挥发性物质和TBARS值的相关性分析
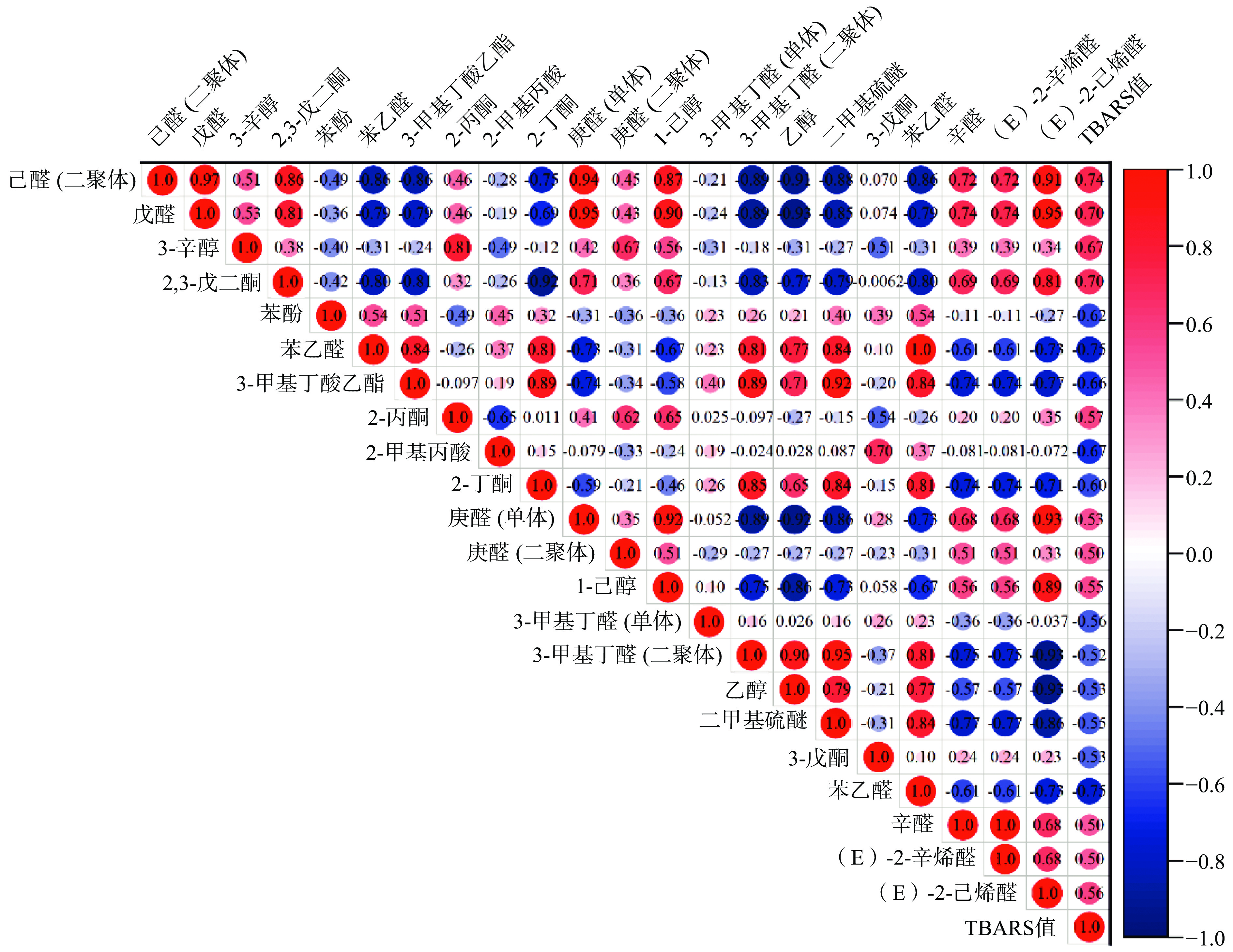
将脂肪氧化值TABRS值和挥风味发性物质进行Pearson相关性分析,结果如图7所示。挥发性风味物质中己醛、戊醛、辛醛、(E)-2-辛烯醛、2丙酮、2,3-戊二酮、3-辛醇、1-己醇等与脂肪氧化TBARS值呈中度正相关(r>0.5);苯乙醛、苯酚、3-甲基丁酸乙酯、2-甲基丙酸、2-丁酮等与脂肪氧化TBARS值呈中度负相关(r<−0.5)。表明上述挥发性风味物质的产生及含量变化与脂质氧化过程密切相关,或是参与了脂质氧化的某些途径。
2.4 采肉次数影响鱼糜风味特征的机制分析
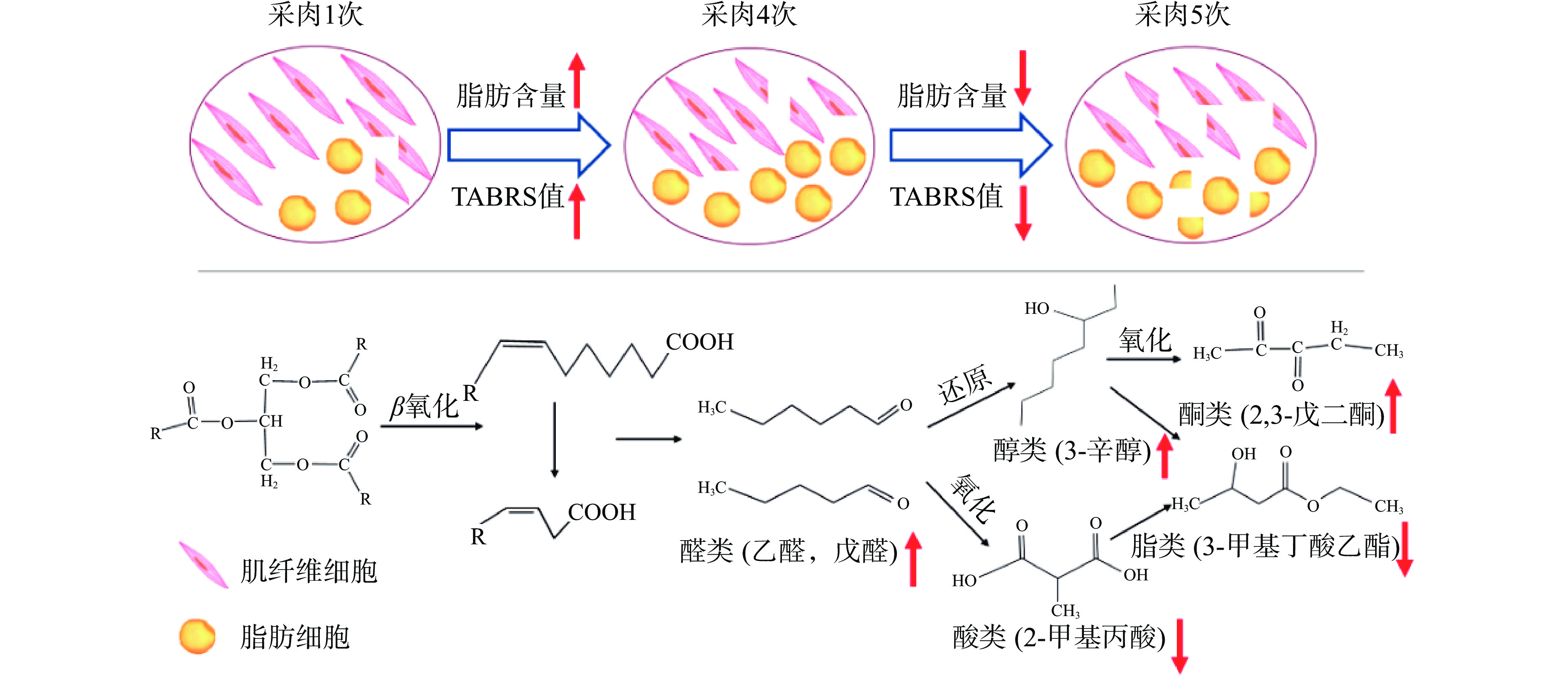
前期研究发现[2]:随着采肉次数的增加,不同鱼糜样品的脂肪含量存在差异,呈先增加后降低的趋势,原因可能是随着采肉次数增多靠近鱼体表侧的红肉所占比例越多,红肉中脂肪含量比远离鱼表侧的白肉低;随着采肉次数增加到5次,鱼肉和皮带及滚筒的物理摩擦、剪切作用增强,破裂的肌原纤维细胞和脂肪细胞增加,游离出的脂肪被水漂洗带走,因此脂肪含量反而降低。脂肪分解是脂质转换为风味化合物的第一步,因此脂肪含量的差异会影响鱼糜样品风味特征差异[31]。不同鱼糜样品的TBARS值呈现先增加后下降的趋势,与我们前期报道的脂肪含量的变化一致[2]。鱼糜的指纹图谱(图2)结果显示(E)-2-辛烯醛、庚醛、(E)-2-己烯醛、壬醛、己醛、(E)-2-戊烯醛、(E)-2-辛烯醛、戊醛、1-辛烯-3-醇、1-己醇、1-戊醇、3-辛酮、2,3-戊二酮、2-戊基呋喃等物质的含量呈现先增加后降低的变化趋势,其中壬醛、己醛、1-辛烯-3-醇等是鱼糜中代表性风味物质[3,6,15]。
Xu等[31]报道,在脂肪酶的催化作用下,脂质通过β氧化生成长链脂肪酸,然后进一步氧化分解生成醛类,其相对含量与脂肪氧化程度正相关。生成的醛类物质可被还原成醇类,或者氧化成酸类。醇类进一步氧化为酮类,或者与酸生成酯类[6,31]。图7结果显示己醛、戊醛、3-辛醇、2-甲基丙酸、2,3-戊二酮和3-甲基丁酸乙酯等与TBARS值呈中度相关(|r|>0.5)。因此,随着脂肪氧化程度增加,鱼糜中的脂肪酸可能主要氧化成己醛、戊醛等(图8)。在冻藏过程中,鱼糜中醛类可能被还原生成3-辛醇、1-己醇等,或者氧化生成2-甲基丙酸。进一步地,醇类被氧化成2,3-戊二酮等,或者与酸类(如2-甲基丙酸等)生成酯类。根据试验结果,推测采肉次数影响鱼糜风味特征的机制可能主要与脂肪氧化有关。需要注意地是本研究在探究采肉次数影响鱼糜风味特征的机制方面还存在一些局限性:许多物质既是氧化后的产物,又是后续氧化物质的前体物质,难以仅用相关性分析揭示全部变化规律;脂肪的氧化途径多样,涉及物质极多,需要结合脂质组学等技术手段分析;未对挥发性物质进行绝对含量测定,并结合其阈值进行计算。在后面,还需开展更多工作,以深入揭示采肉次数影响鱼糜风味特征的机制。
3. 结论
鱼糜中主要挥发性物质种类为醛、酮、醇、酯类,其主要风味特性物质为己醛、壬醛、辛醛、1-辛烯-3-醇、1-戊烯-3-醇、E-2-辛烯醛等,具有青草味、蘑菇香、鲜鱼味及鱼腥味,构成鱼糜的风味特征。随着采肉次数的增加,壬醛、己醛、1-辛烯-3-醇、2,3-戊二酮等物质的含量先增加后减少;鱼糜TBARS值也呈现先增加后降低的变化趋势。不同采肉次数下,鱼糜的风味特征变化机制可能主要与脂肪氧化相关。本课题确定了采肉次数影响鱼糜挥发性风味物质的规律,并初步阐明了其影响机制,研究结果为鱼糜以及鱼糜制品的工业化以及风味调控提供了一定的理论依据。在将来研究中,采用脂质组学结合定量GC-IMS等技术手段,有望深入揭示采肉次数影响鱼糜风味特征的机制。
-
表 1 鱼糜样品中挥发性化合物种类
Table 1 Volatile compounds in surimi samples
编号 化合物中(英)文名称 CAS# 分子式 分子量 保留指数 保留时间(s) 相对迁移
时间(ms)物质型态 1 癸醛(Decanal) C112312 C10H20O 156.3 1269.3 732.921 1.54651 2 壬醛(Nonanal) C124196 C9H18O 142.2 1110.8 505.027 1.48934 单体 3 壬醛(Nonanal) C124196 C9H18O 142.2 1110.8 505.027 1.94676 二聚体 4 (E)-2-辛烯醛((E)-2-Octenal) C2548870 C8H14O 126.2 1058.0 429.178 1.33379 5 辛醛(Octanal) C124130 C8H16O 128.2 1006.8 355.507 1.41505 6 1-辛烯-3-醇(1-Octen-3-ol) C3391864 C8H16O 128.2 986.2 332.104 1.15814 单体 7 1-辛烯-3-醇(1-Octen-3-ol ) C3391864 C8H16O 128.2 986.7 332.563 1.5979 二聚体 8 3-辛酮(3-Octanone) C106683 C8H16O 128.2 993.4 338.07 1.30775 9 6-甲基-5-庚烯-2-酮(6-Methyl-5-hepten-2-one) C110930 C8H14O 126.2 992.8 337.611 1.18686 10 安息香醛(Benzaldehyde) C100527 C7H6O 106.1 960.2 310.537 1.15059 11 环己酮(Cyclohexanone) C108941 C6H10O 98.1 899.3 260.06 1.14605 12 庚醛(Heptanal) C111717 C7H14O 114.2 903.2 263.272 1.33495 单体 13 庚醛(Heptanal) C111717 C7H14O 114.2 902.6 262.813 1.6931 二聚体 14 2-庚酮(2-Heptanone) C110430 C7H14O 114.2 893.8 255.471 1.25788 单体 15 2-庚酮(2-Heptanone) C110430 C7H14O 114.2 893.2 255.012 1.62963 二聚体 16 1-己醇(1-Hexanol) C111273 C6H14O 102.2 871.4 243.747 1.3267 17 (E)-2-己烯醛((E)-2-Hexenal) C6728263 C6H10O 98.1 847.1 231.564 1.17778 18 己醛(Hexanal) C66251 C6H12O 100.2 789.0 202.43 1.26255 单体 19 己醛(Hexanal) C66251 C6H12O 100.2 789.0 202.43 1.56268 二聚体 20 1-戊醇(1-Pentanol) C71410 C5H12O 88.1 761.5 191.307 1.2511 单体 21 1-戊醇(1-Pentanol) C71410 C5H12O 88.1 760.2 190.777 1.51343 二聚体 22 2-己酮(2-Hexanone) C591786 C6H12O 100.2 776.0 196.868 1.19153 23 (E)-2-戊烯醛((E)-2-Pentenal) C1576870 C5H8O 84.1 739.1 182.706 1.10303 24 戊醛(Pentanal) C110623 C5H10O 86.1 688.0 163.148 1.1921 单体 25 戊醛(Pentanal) C110623 C5H10O 86.1 684.3 162.333 1.42329 二聚体 26 1-丁醇(1-Butanol) C71363 C4H10O 74.1 661.3 157.118 1.37402 27 2-甲基丁醛(2-Methyl-butanal) C96173 C5H10O 86.1 640.6 152.458 1.16254 单体 28 2-甲基丁醛(2-Methyl-butanal) C96173 C5H10O 86.1 637.7 151.803 1.39957 二聚体 29 3-甲基丁醛(3-Methylbutanal) C590863 C5H10O 86.1 610.8 145.726 1.17873 单体 30 3-甲基丁醛(3-Methylbutanal) C590863 C5H10O 86.1 616.1 146.908 1.40571 二聚体 31 乙酸乙酯(Ethyl acetate) C141786 C4H8O2 88.1 572.0 136.948 1.09531 单体 32 乙酸乙酯(Ethyl acetate) C141786 C4H8O2 88.1 572.0 136.948 1.33455 二聚体 33 丁醛(Butanal) C123728 C4H8O 72.1 545.0 130.871 1.28302 34 2-丙酮(2-Propanone) C67641 C3H6O 58.1 511.4 123.283 1.11038 35 丙醛(Propanal) C123386 C3H6O 58.1 465.5 112.907 1.06617 36 乙醇(Ethanol) C64175 C2H6O 46.1 430.9 105.097 1.04407 37 2-戊基呋喃(2-Pentylfuran) C3777693 C9H14O 138.2 997.6 342.28 1.25447 38 2-丁酮(2-Butanone) C78933 C4H8O 72.1 543.9 130.609 1.24086 39 2-壬酮(2-Nonanone) C821556 C9H18O 142.2 1093.6 480.364 1.41241 40 苯乙醛(Benzeneacetaldehyde) C122781 C8H8O 120.2 1041.9 406.013 1.25564 41 2-甲基吡嗪(2-Methylpyrazine) C109080 C5H6N2 94.1 797.3 206.601 1.07746 42 2-甲基丙酸(2-Methylpropanoic acid) C79312 C4H8O2 88.1 773.3 195.832 1.16895 43 3-甲基-1-丁醇(3-Methyl-1-butanol) C123513 C5H12O 88.1 722.5 176.332 1.2437 单体 44 3-甲基-1-丁醇(3-Methyl-1-butanol) C123513 C5H12O 88.1 721.0 175.75 1.49028 二聚体 45 3-羟基-2-丁酮(Acetoin) C513860 C4H8O2 88.1 706.6 170.22 1.05737 单体 46 3-羟基-2-丁酮(Acetoin) C513860 C4H8O2 88.1 708.1 170.803 1.32961 二聚体 47 苯酚(Phenol) C108952 C6H6O 94.1 997.7 342.375 1.0791 48 3-辛醇(3-Octanol) C589980 C8H18O 130.2 993.9 338.478 1.39133 49 2,5-二甲基吡嗪(2,5-Dimethylpyrazine) C123320 C6H8N2 108.1 894.8 256.347 1.11503 50 3-甲基丁酸乙酯(Ethyl 3-methylbutanoate) C108645 C7H14O2 130.2 849.1 232.573 1.2523 51 二甲基硫醚(Dimethyl sulfide) C75183 C2H6S 62.1 497.0 120.009 0.96041 52 2-乙基呋喃(2-Ethylfuran) C3208160 C6H8O 96.1 692.1 164.634 1.07502 单体 53 2-乙基呋喃(2-Ethylfuran) C3208160 C6H8O 96.1 691.5 164.423 1.31004 二聚体 54 3-戊酮(3-Pentanone) C96220 C5H10O 86.1 689.3 163.577 1.10859 55 2,3-丁二酮(2,3-Butanedione) C431038 C4H6O2 86.1 594.4 142.02 1.16948 56 2,3-戊二酮(2,3-Pentanedione) C600146 C5H8O2 100.1 680.9 161.549 1.21549 57 (Z)-2-己烯醛((Z)-2-Hexenal) R218138 C6H10O 98.1 843.7 229.829 1.15277 单体 58 (Z)-2-己烯醛((Z)-2-Hexenal) R218138 C6H10O 98.1 845.4 230.676 1.52137 二聚体 -
[1] LONG K, ZHANG T, PARK J W, et al. Effect of modified washing process on water usage, composition and gelling properties of grass carp surimi[J]. Journal of the Science of Food and Agriculture,2022,102(15):7136−7143. doi: 10.1002/jsfa.12079
[2] LIU L L, XIONG Y X, YIN T, et al. Effects of repeated deboning on structure, composition, and gelling properties of silver carp surimi[J]. Journal of the Science of Food and Agriculture,2022,102(12):5312−5320. doi: 10.1002/jsfa.11885
[3] 郑文栋, 楼倚洋, 安玥琦, 等. 臭氧漂洗及冷冻贮藏对鲢鱼糜蛋白氧化和风味的影响[J]. 华中农业大学学报, 2023, 42(1):154-162. [ZHENG Wendong, LOU Yiyang, AN Yueqi, et al. Effects of ozone rinsing and freezing storage on protein oxidation and flavor of silver carp surimi[J]. Journal of Huazhong Agricultural University, 2023, 42(1):154-162.] ZHENG Wendong, LOU Yiyang, AN Yueqi, et al. Effects of ozone rinsing and freezing storage on protein oxidation and flavor of silver carp surimi[J]. Journal of Huazhong Agricultural University, 2023, 42(1): 154-162.
[4] SHI L, YIN T, HUANG Q L, et al. Effects of filleting methods on composition, gelling properties and aroma profile of grass carp surimi[J]. Food Science and Human Wellness,2021,10(3):308−315. doi: 10.1016/j.fshw.2021.02.022
[5] AN Y Q, QIAN Y P, MAGANA A, et al. Comparative characterization of aroma compounds in silver carp (Hypophthalmichthys molitrix), Pacific whiting ( Merluccius productus), and Alaska pollock ( Theragra chalcogramma) surimi by aroma extract dilution analysis, odor activity value, and aroma recombination studies[J]. Journal of Agriculture and Food Chemistry,2020,68(38):10403−10413. doi: 10.1021/acs.jafc.9b07621
[6] QIU J, CAI L B, XIONG S B, et al. Characterization of aroma profiles and volatile organic compounds in silver carp surimi gel by GC-IMS, SPME-GC-MS, and sensory evaluation:Affected by okara insoluble dietary fiber with varied particle sizes[J]. Food Chemistry Advances, 2023:100224.
[7] HE Y, PARK J W, YIN T. Biochemical and gelling properties of silver carp surimi as affected by harvesting season and chopping time[J]. Journal of Food Processing and Preservation,2019,43(12):e14247.
[8] NIE S, LI L H, WANG Y Q, et al. Discrimination and characterization of volatile organic compound fingerprints during sea bass ( Lateolabrax japonicas) fermentation by combining GC-IMS and GC-MS[J]. Food Bioscience,2022,50:102048. doi: 10.1016/j.fbio.2022.102048
[9] KOWALSKA D, BIELANSKI P, CHELMINSKA A. Effect linseed and fish oil supplements in feed on fatty acid profile and intramuscular fat oxidation in rabbits[J]. Zywnosc Nauka Technologia Jakosc (Poland), 2011.
[10] 徐永霞, 白旭婷, 冯媛, 等. 基于GC-IMS和化学计量学分析海鲈鱼肉蒸制过程中风味物质的变化[J]. 食品科学, 2021, 42(22):270−275. [XU Yongxia, BAI Xuting, FENG Yuan, et al. Changes of flavor compounds in sea bass during steaming process asanalyzed by gas chromatography-lon mobility spectroscopy and chemometrics[J]. Food Science, 2021, 42 (22):270−275.] XU Yongxia, BAI Xuting, FENG Yuan, et al. Changes of flavor compounds in sea bass during steaming process asanalyzed by gas chromatography-lon mobility spectroscopy and chemometrics[J]. Food Science, 2021, 42 (22): 270−275.
[11] 陈丽兰, 陈祖明, 袁灿. GC-IMS结合化学计量法分析不同炒制时间对郫县豆瓣酱挥发性化合物的影响[J]. 食品科学,2023,44(14):283−290. [CHEN Lilan, CHEN Zuming, YUAN Can, et al. Study on the effect of different cooking time on volatile compounds of Pixian bean paste by GC-IMS combined with chemometrics[J]. Food Science,2023,44(14):283−290.] CHEN Lilan, CHEN Zuming, YUAN Can, et al . Study on the effect of different cooking time on volatile compounds of Pixian bean paste by GC-IMS combined with chemometrics[J]. Food Science,2023 ,44 (14 ):283 −290 .[12] 王卉楠, 励建荣, 李学鹏, 等. 鱼糜组分间相互作用对其凝胶特性影响的研究进展[J]. 中国食品学报, 2022, 22(9):365−375. [WANG Huinan, LI Jianrong, LI Xuepeng, et al. Research progress on the effect of component interactions on the gel properties of surimi[J]. Chinese Journal of Food, 2022, 22(9):365−375.] WANG Huinan, LI Jianrong, LI Xuepeng, et al. Research progress on the effect of component interactions on the gel properties of surimi[J]. Chinese Journal of Food, 2022, 22(9): 365−375.
[13] 芮李彤, 刘畅, 夏秀芳. 水-冰-水动态变化引起冷冻肉类食品品质变化机理及控制技术研究进展[J]. 食品科学, 2023, 44(5): 187−196. [RUI Litong, LIU Chang, XIA Xiufang, et al. Research progress on the mechanism and control technologies of quality changes in frozen meat induced by water-ice-water dynamic transformation[J]. Food Science, 2023, 44(5): 187−196.] RUI Litong, LIU Chang, XIA Xiufang, et al. Research progress on the mechanism and control technologies of quality changes in frozen meat induced by water-ice-water dynamic transformation[J]. Food Science, 2023, 44(5): 187−196.
[14] ARROYO-MANZANARES N, MARTíN-GÓMEZ A, JURADO-CAMPOS N, et al. Target vs spectral fingerprint data analysis of iberian ham samples for avoiding labelling fraud using headspace–gas chromatography–ion mobility spectrometry[J]. Food Chemistry,2018,246:65−73. doi: 10.1016/j.foodchem.2017.11.008
[15] 阮秋凤. 鱼糜及鱼糜制品的特征风味成分与指纹图谱[D]. 武汉:华中农业大学, 2022. [RUAN Qiufeng, Characteristic flavor components and fingerprints of surimi and surimi products[D]. Wuhan:Huazhong Agricultural University, 2022.] RUAN Qiufeng, Characteristic flavor components and fingerprints of surimi and surimi products[D]. Wuhan: Huazhong Agricultural University, 2022.
[16] GUILLéN M D, ERRECALDE M C, SALMERóN J, et al. Headspace volatile components of smoked swordfish ( Xiphias gladius) and cod ( Gadus morhua) detected by means of solid phase microextraction and gas chromatography–mass spectrometry[J]. Food Chemistry,2006,94(1):151−156. doi: 10.1016/j.foodchem.2005.01.014
[17] ZHANG Q, DING Y C, GU S Q, et al. Identification of changes in volatile compounds in dry-cured fish during storage using HS-GC-IMS[J]. Food Research International,2020,137:109339. doi: 10.1016/j.foodres.2020.109339
[18] OGATA M, MIYAKE Y. Identification of substances in petroleum causing objectionable odour in fish[J]. Water Research,1973,7(10):1493−1504. doi: 10.1016/0043-1354(73)90121-8
[19] 张凯华, 臧明伍, 张哲奇, 等. 不同复热方式对猪耳朵制品挥发性风味和脂肪氧化的影响[J]. 食品科学,2018,39(14):242−248. [ZHANG Kaihua, ZANG Mingwu, ZHANG Zheqi, et al. Effect of reheating methods on volatile flavor constituents and lipid oxidation in cooked pig ear[J]. Food Science,2018,39(14):242−248.] doi: 10.7506/spkx1002-6630-201814036 ZHANG Kaihua, ZANG Mingwu, ZHANG Zheqi, et al . Effect of reheating methods on volatile flavor constituents and lipid oxidation in cooked pig ear[J]. Food Science,2018 ,39 (14 ):242 −248 . doi: 10.7506/spkx1002-6630-201814036[20] 冯媛, 赵洪雷, 曲诗瑶, 等. 海鲶鱼汤烹制过程中风味特性的变化[J]. 食品科学,2020,41(8):202−207. [FENG Yuan, ZHAO Honglei, QU Shiyao, et al. Changes in flavor characteristics of sea catfish broth during cooking process[J]. Food Science,2020,41(8):202−207.] FENG Yuan, ZHAO Honglei, QU Shiyao, et al . Changes in flavor characteristics of sea catfish broth during cooking process[J]. Food Science,2020 ,41 (8 ):202 −207 .[21] 顾赛麒, 唐锦晶, 周绪霞, 等. 腌腊鱼传统日晒干制过程中品质变化与香气形成[J]. 食品科学,2019,40(17):36−44. [GU Saiqi, TANG Jinjing, ZHOU Xuxia, et al. Quality change and aroma formation in cured fish during traditional sun drying processing[J]. Food Science,2019,40(17):36−44.] doi: 10.7506/spkx1002-6630-20180716-201 GU Saiqi, TANG Jinjing, ZHOU Xuxia, et al . Quality change and aroma formation in cured fish during traditional sun drying processing[J]. Food Science,2019 ,40 (17 ):36 −44 . doi: 10.7506/spkx1002-6630-20180716-201[22] 王兆明, 马云昊, 浦馨源, 等. 基于GC-IMS的符离集烧鸡挥发性物质指纹图谱分析[J]. 中国食品学报,2022,22(11):343−354. [WANG Zhaoming, MA Yunhao, PU Xinyuan, et al. The fingerprint analysis of violate flavor compounds in fuliji-braised chickenby gas chromatography-ion mobility spectroscopy[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(11):343−354.] WANG Zhaoming, MA Yunhao, PU Xinyuan, et al . The fingerprint analysis of violate flavor compounds in fuliji-braised chickenby gas chromatography-ion mobility spectroscopy[J]. Journal of Chinese Institute of Food Science and Technology,2022 ,22 (11 ):343 −354 .[23] 万鹏, 梁国平, 马丽娟, 等. 19个苹果品种果实香气成分的GC-MS分析[J]. 食品工业科技,2019,40(14):227−232. [WAN Peng, LIANG Guoping, MA Lijuan, et al. GC-MS analysis of fruit aroma components in 19 apple varieties[J]. Science and Technology of Food Industry,2019,40(14):227−232.] WAN Peng, LIANG Guoping, MA Lijuan, et al . GC-MS analysis of fruit aroma components in 19 apple varieties[J]. Science and Technology of Food Industry,2019 ,40 (14 ):227 −232 .[24] MAHMOUD M A A, BUETTNER A. Characterisation of aroma-active and off-odour compounds in German rainbow trout ( Oncorhynchus mykiss). Part II:Case of fish meat and skin from earthen-ponds farming[J]. Food Chemistry,2017,232:841−849. doi: 10.1016/j.foodchem.2016.09.172
[25] GE S, CHEN Y Y, DING S H, et al. Changes in volatile flavor compounds of peppers during hot air drying process based on headspace-gas chromatography-ion mobility spectrometry (HS-GC-IMS)[J]. Journal of the Science of Food and Agriculture,2020,100(7):3087−3098. doi: 10.1002/jsfa.10341
[26] 安玥琦. 鱼糜凝胶的交联结构对风味释放的影响与机制[D]. 武汉:华中农业大学, 2020. [AN Yueqi, Mechanism of flavor release affected by cross-linking structure in surimi gels[D]. Wuhan:Huazhong Agricultural University, 2020.] AN Yueqi, Mechanism of flavor release affected by cross-linking structure in surimi gels[D]. Wuhan: Huazhong Agricultural University, 2020.
[27] 黄晶晶, 张慧敏, 赵丽媛, 等. 酵母葡聚糖的前处理及其对白鲢鱼肉的去腥效果[J]. 食品科学, 2020, 41(20):54−60. [HUANG Jingjing, ZHANG Huimin, ZHAO Liyuan, et al. Yeast glucan pretreatment and its deodorization effect for silver arp mince[J]. Food Science, 2020, 41 (20):54−60.] HUANG Jingjing, ZHANG Huimin, ZHAO Liyuan, et al. Yeast glucan pretreatment and its deodorization effect for silver arp mince[J]. Food Science, 2020, 41 (20): 54−60.
[28] 励建荣, 王忠强, 仪淑敏, 等. 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展[J]. 食品科学, 2021, 42(21):1−7. [LI Jianrong, WANG Zhongqiang, YI Shumin, et al. Progress in research on the effect of natural antioxidants on the antioxidant capacity and quality of surimi and surimi products[J]. Food Science, 2021, 42 (21):1−7.] LI Jianrong, WANG Zhongqiang, YI Shumin, et al. Progress in research on the effect of natural antioxidants on the antioxidant capacity and quality of surimi and surimi products[J]. Food Science, 2021, 42 (21): 1−7.
[29] 甘潇, 赵玲, 吴倩, 等. 氧化及不同离子强度下猪肉肌原纤维蛋白结合风味物质的研究[J]. 食品工业科技, 2022, 43(23):35−41. [GAN Xiao, ZHAO Ling, WU Qian, et al. Effects of oxidation and different ionic environment on the binding of pork myofibrillar protein to flavor substances[J]. Science and Technology of Food Industry, 2022, 43 (23):35−41.] GAN Xiao, ZHAO Ling, WU Qian, et al. Effects of oxidation and different ionic environment on the binding of pork myofibrillar protein to flavor substances[J]. Science and Technology of Food Industry, 2022, 43 (23): 35−41.
[30] 潘晓倩, 张顺亮, 臧明伍, 等. 即食肉丸短期贮藏过程中脂质氧化产物与挥发性风味物质分析[J]. 食品科学, 2023, 44(12): 244−251. [PAN Xiaoqian, ZHANG Shunliang, ZANG Mingwu, et al. Analysis of lipid oxidation products and volatile flavor compounds in instant meatballs during short-term storage [J]. Food Science, 2023, 44(12): 244−251.] PAN Xiaoqian, ZHANG Shunliang, ZANG Mingwu, et al. Analysis of lipid oxidation products and volatile flavor compounds in instant meatballs during short-term storage [J]. Food Science, 2023, 44(12): 244−251.
[31] XU P F, LIU L, LIU K, et al. Flavor formation analysis based on sensory profiles and lipidomics of unrinsed mixed sturgeon surimi gels[J]. Food Chemistry: X,2023,17:100534. doi: 10.1016/j.fochx.2022.100534





 下载:
下载:

 下载:
下载:



