Antioxidant and Oxidative Stress Inhibitory Activities of Tolypocladium sinense Polysaccharide
-
摘要: 目的:探究中国弯颈霉菌丝体多糖(Tolypocladium sinense polysaccharide,TSP)的体外抗氧化活性和抑制过氧化氢诱导小鼠胰岛MIN6细胞氧化应激导致的细胞凋亡。方法:采用热水浸提法提取中国弯颈霉菌丝体多糖,随后测定其超氧阴离子自由基(superoxide anion,O−2·)、羟自由基(hydroxy radical,·OH)、对1,1-二苯基苦基苯肼自由基(P-1,1-diphenylpicryl phenylhydrazine radical,DPPH·)清除能力;采用200 μmol/L过氧化氢(hydrogen peroxide,H2O2)诱导小鼠胰岛MIN6细胞氧化应激,给予高剂量和低剂量TSP(0.625、0.156 mg/mL)进行保护,MTT法测定MIN6细胞生存率;倒置显微镜观察细胞形态;采用试剂盒测定培养基中乳酸脱氢酶(lactate dehydrogenase,LDH)水平,细胞内超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量;流式细胞术检测细胞凋亡;Western Blot检测核因子E2相关因子2(nuclear factor E2-related factor2,Nrf-2)和磷酸化c-Jun氨基末端激酶(phosphorylated c-jun N-terminal kinase,pJNK)相对表达量。结果:TSP对于三种自由基具有显著的清除效果;细胞实验结果显示,与过氧化氢模型组相比TSP高低剂量给药组细胞生存率显著上升(P<0.01,P<0.05);悬浮细胞数量极显著下降(P<0.01);培养基中LDH极显著含量下降(P<0.01);细胞凋亡率显著降低(P<0.01,P<0.05);细胞内SOD水平显著增高(P<0.01,P<0.05),丙二醛含量极显著下降(P<0.01);Western Blot结果显示相较于模型组,高剂量给药组Nrf-2表达量显著增高(P<0.05),高剂量和低剂量给药组pJNK表达量显著下降(P<0.01,P<0.05)。结论:TSP具有显著的抗氧化活性,能够通过调节Nrf-2和pJNK的表达来减少氧化应激导致的细胞凋亡。Abstract: Objective: To explore the antioxidant activity of Tolypocladium sinense polysaccharide (TSP) in vitro and its inhibitory effect on apoptosis of mouse islet MIN6 cells which were suffered from oxidative stress-induced by hydrogen peroxide. Methods: The T. sinense polysaccharides was extracted by hot water extraction, and then the scavenging activities of superoxide anion radical (O−2·), hydroxyl radical (·OH) and p-1,1-diphenylpicryl phenyl hydrazine radical (DPPH·) was determined. Oxidative stress of mouse islet MIN6 cells was induced by 200 μmol/L hydrogen peroxide (H2O2) and protected by high and low dose TSP (0.625, 0.156 mg/mL). The survival rate of MIN6 cells was determined by MTT method, and the cell morphology was observed by inverted microscope. The lactate dehydrogenase (LDH) level in culture medium, intracellular superoxide dismutase (SOD) activity and malondialdehyde (MDA) content were measured by kit. Apoptosis was detected by flow cytometry. The relative expressions of nuclear factor E2 related factor 2 (Nrf-2) and phosphorylated c-Jun N-terminal kinase (pJNK) were detected by Western Blot. Results: TSP had significant scavenging effect on three kinds of free radicals, and the results of cell experiment showed that compared with the hydrogen peroxide model group, the cell survival rate of high and low dose TSP group increased significantly (P<0.01, P<0.05), the number of suspension cells decreased significantly (P<0.01), the content of LDH in culture medium decreased significantly (P<0.01), and the rate of apoptosis decreased significantly (P<0.01, P<0.05). The level of intracellular SOD increased (P<0.01, P<0.05) and the content of MDA decreased significantly (P<0.01). The results of Western Blot showed that the expression of Nrf-2 in the high dose group was significantly higher than that in the model group (P<0.05), while the expression of pJNK in the high dose group and low dose group was significantly decreased (P<0.01, P<0.05). Conclusion: TSP has significant antioxidant activity, and can regulate the expression of Nrf-2 and pJNK to reduce apoptosis induced by oxidative stress.
-
Keywords:
- Tolypocladium sinense /
- polysaccharide /
- antioxidant activity /
- oxidative stress /
- apoptosis
-
冬虫夏草作为一种名贵中药,是特定真菌寄生于蝙蝠蛾幼虫后形成的结合体[1]。冬虫夏草具有抗氧化、增强免疫力、调节代谢等多种生物学功能[2]。天然的冬虫夏草主要生长在高海拔地区且自然资源稀少无法满足人们需求[3]。中国弯颈霉是天然冬虫夏草经过组织分离培养获得的无性型品种,其药理成分和生物活性与冬虫夏草基本相似[4]。
关于中国弯颈霉的国内外研究较少,早期主要集中在培养条件的探索和药理成分的分析[4−5]。近年来有研究报道了中国弯颈霉提取液能够抑制破骨细胞功能、促进成骨细胞的分化及矿化治疗小鼠的骨质疏松。此外有研究表明中国弯颈霉提取物能够增强γ辐射后的小鼠免疫力等[6−7]。本课题组前期研究发现,中国弯颈霉菌丝体能够有效抑制高脂饮食诱导小鼠高脂血症的发生发展,缓解肥胖引起的慢性炎症,降低小鼠的氧化应激水平[8]。中国弯颈霉菌丝体多糖(Tolypocladium sinense polysaccharide, TSP)是中国弯颈霉菌丝体的活性成分之一,目前关于其抗氧化和抑制氧化应激能力的相关研究尚未有明确报道。
本实验通过测定TSP对多种自由基的清除作用来分析其体外抗氧化活性。进一步使用过氧化氢诱导小鼠胰岛MIN6细胞氧化应激,通过测定氧化应激和细胞凋亡相关指标的变化,探索TSP对过氧化氢损伤MIN6细胞的保护作用,为TSP通过抗氧化和抑制氧化应激治疗疾病提供理论依据。
1. 材料与方法
1.1 材料与仪器
新鲜冬虫夏草 2020年6月采集于西藏那曲市;葡萄糖 天津市大茂化学试剂厂;蛋白胨、酵母浸粉 北京奥博星生物技术有限责任公司;硫酸镁 天津市巴斯夫化工有限公司;磷酸二氢钾 天津市福晨化学试剂厂;维生素(Vitamin C,VC) 陕西颐生堂药业有限公司;硫酸亚铁 天津天大化学试剂厂;水杨酸 恒兴试剂;对1,1-二苯基苦基苯肼(P-1,1-diphenylpicryl phenylhydrazine,DPPH) 上海麦克林生化试剂有限公司;小鼠胰岛MIN6细胞株 中国医学科学院基础医学研究所基础医学细胞中心;RPMI-1640培养基 Hyclone;胎牛血清 Clark;An-nexin V-FITC细胞凋亡检测试剂盒(货号FXP018-100) 四正柏生物;邻苯三酚、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(货号BC0175)、丙二醛(malondialdehyde,MDA)试剂盒(货号BC0025) 北京索莱宝科技有限公司;MTT试剂盒(货号C0009S)、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒(货号C0017)、BCA蛋白浓度测定试剂盒(货号P0010)、兔抗小鼠核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf-2)抗体 碧云天生物技术有限公司;磷酸化c-Jun氨基末端激酶(phosphorylated c-jun N-terminal kinase,pJNK)抗体 英国Abcam公司;HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)二抗、HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)二抗 美国Proteintech公司;小鼠胰岛MIN6细胞 中国医学科学院基础医学研究所基础医学细胞中心。
Infinite E Plex多功能全波段连续光谱检测仪 瑞士Tecan公司;Centrifuge 5424 R低温高速离心机 德国Eppendorf公司;JY300E电泳仪 北京君意东方电泳设备有限公司;UVP Chemstudio PLUS自动化分子成像仪 美国Analytik Jena US LLC公司;IX73P1F倒置显微镜 日本Olympus公司。
1.2 实验方法
1.2.1 中国弯颈霉菌丝体的分离和培养
采集新鲜冬虫夏草,组织分离培养得到纯种菌落,经过形态学分析和ITS序列比对确定为中国弯颈霉[8]。将分离培养获得的菌丝体按1:100的体积比接种到含有马铃薯200 g/L、葡萄糖20 g/L、蛋白胨5 g/L、酵母浸粉5 g/L、硫酸镁1 g/L、磷酸二氢钾2.5 g/L的液体培养基中,置于摇床上150 r/min,26 ℃培养96 h[1]。
1.2.2 中国弯颈霉菌丝体多糖的提取、纯化及糖含量测定
中国弯颈霉菌丝体培养96 h后离心(4000 r/min,15 min)收集菌丝体沉淀,使用热水浸提法提取中国弯颈霉菌丝体粗多糖[9]。随后,使用三氯乙酸法对中国弯颈霉菌丝体粗多糖进行纯化得到TSP[10],并使用苯酚-硫酸法检测TSP的糖含量[11]。
多糖提取率(%)=提取出多糖重量消耗菌丝体重量×100 (1) 多糖含量(%)=C1C2×100 (2) 式中:C1表示多糖溶液带入标准曲线得到的糖浓度;C2表示多糖溶液浓度。
1.2.3 TSP超氧阴离子自由基、羟自由基和DPPH自由基清除率测定
1.2.3.1 TSP超氧阴离子自由基清除率测定
称取TSP粉末0.1 g溶于10 mL蒸馏水中,得到10 mg/mL的TSP母液,精确量取0.4 mg/mL邻苯三酚溶液0.1 mL和磷酸盐缓冲液5 mL于试管中振荡摇匀,分别加入(5、2.5、1.25、0.625、0.3125、0.15625、0.078125 mg/mL)的TSP溶液1 mL再加入3.9 mL蒸馏水振荡摇匀,阳性对照使用相同浓度的VC替代TSP溶液,空白组用蒸馏水代替TSP溶液。使用酶标仪测量3~30 min内混合溶液320 nm处吸光度变化曲线,把各组曲线斜率带入公式计算TSP超氧阴离子自由基清除率[12]。
清除率(%)=(1−K样本K空白)×100 (3) 式中:K空白表示空白组吸光度曲线斜率;K样本表示样品组吸光度曲线斜率。
1.2.3.2 TSP羟自由基清除率测定
在试管中依次加入6 mmol/L硫酸亚铁溶液2 mL、不同浓度的TSP溶液2 mL和6 mmol/L过氧化氢溶液2 mL振荡摇匀,静置10 min后加入6 mmol/L水杨酸溶液2 mL振荡摇匀,在37 ℃水浴反应30 min,阳性对照组用相同浓度VC替代TSP,空白组用蒸馏水代替TSP溶液。使用酶标仪测量510 nm处吸光度,把各组吸光度值带入公式计算TSP羟自由基清除率[13]。
清除率(%)=(1−A样品A空白)×100 (4) 式中:A空白表示空白组吸光光度值;A样品表示样品组吸光度值。
1.2.3.3 TSP对DPPH自由基清除率测定
参考冯书珍等[14]的方法精确称取DPPH溶于无水乙醇配制成0.04 mg/mL的DPPH溶液。分别取不同浓度的TSP溶液2 mL加入DPPH溶液2 mL涡旋振荡摇匀,室温避光反应30 min后,离心(4000 r/min,15 min),取上清液测定517 nm处吸光度。阳性对照组用相同浓度VC替代TSP,对照组用无水乙醇代替DPPH溶液,空白组用蒸馏水代替TSP溶液,把各组吸光度值带入公式计算TSP对DPPH自由基的清除率。
清除率(%)=(1−A样品−A对照A空白)×100 (5) 式中:A空白表示空白组吸光度值;A样品表示样品组吸光度值,A对照表示对照组吸光度值
1.2.4 TSP对过氧化氢损伤MIN6细胞的保护作用
1.2.4.1 细胞培养
小鼠胰岛MIN6细胞株具有普通胰岛细胞的生理特性。细胞培养在含有10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的1640培养基中,培养条件为37 ℃,5% CO2。
1.2.4.2 TSP给药浓度和过氧化氢损伤浓度的选择
称取TSP粉末0.05 g溶于10 mL培养基得到5 mg/mL的含药培养基,量取3%过氧化氢溶液1 mL溶于439.5 mL培养基得到含2 mmol/L过氧化氢培养基母液。收取处于对数生长期的MIN6细胞,按每孔5×103个接种于96孔板培养24 h,分别用含TSP培养基(0~5 mg/mL)和含过氧化氢培养基(0~250 μmol/L)单独处理细胞24 h,最后使用MTT试剂盒检测生存率变化。选取对细胞生存率没有显著影响且对多种自由基具有较强清除作用的浓度作为TSP给药浓度。
生存率(%)=实验组OD450对照组OD450×100 (6) 1.2.4.3 实验分组
根据MTT结果进行实验分组:对照组(Control),正常培养48 h;模型组(Model),正常培养24 h后更换含200 μmol/L过氧化氢培养基培养24 h;高剂量给药组(High-TSP),正常培养24 h后更换含200 μmol/L过氧化氢和0.625 mg/mL TSP培养基培养24 h;低剂量给药组(Low-TSP),正常培养24 h后更换含200 μmol/L过氧化氢和0.156 mg/mL TSP培养基培养24 h。
1.2.4.4 细胞形态学观察
将MIN6细胞接种于6孔板后按照1.2.4.3的分组和处理方式培养48 h,在光学显微镜下拍照观察细胞的形态和贴壁状态,并计数160000 μm2范围内悬浮细胞数量。
1.2.4.5 LDH释放量检测
将细胞接种于24孔板按照1.2.4.3的分组和处理方式培养48 h收集培养基离心(1000 r/min,5 min)取上清液,用试剂盒进行测定。
1.2.4.6 流式细胞术检测凋亡
将细胞接种于6孔板按1.2.4.3分组和处理方式培养48 h收集细胞,按照试剂盒说明书依次加入Annexin V-FITC和碘化丙啶(propidium iodide,PI)避光孵育5 min后利用流式细胞仪检测。
1.2.4.7 氧化应激相关指标测定
将细胞接种于6孔板按1.2.4.3分组和处理方式培养48 h收集细胞,每5×106个细胞加入1 mL提取液,反复冻融使细胞裂解,离心(12000 r/min,15 min)收集上清,按照试剂盒说明书进行操作。
1.2.4.8 Western Blot检测蛋白
将按1.2.4.3分组和处理方式培养48 h的细胞收集进行蛋白提取,经BCA试剂盒测定蛋白浓度后,用SDS-PAGE凝胶将其分离并转至PVDF膜,5%脱脂奶粉封闭2 h,进行抗体孵育,并使用化学发光分析仪进行曝光。
1.3 数据处理
所有实验重复4次,数值采用均数±标准差(mean±SD)表示,实验数据使用SPSS 26.0进行统计分析。两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05表示差异具有统计学意义。
2. 结果与分析
2.1 TSP多糖含量测定
与大多数菌类相比[9,15−16],中国弯颈霉菌丝体多糖含量较低,使用热水浸提法的提取率为5.27%±0.27%。以葡萄糖浓度为横坐标,490 nm处吸光度值为纵坐标,绘制葡萄糖标准曲线得到的回归方程为:y=6.376x+0.1605,R2=0.9992,说明在0~0.1 mg/mL区间内,葡萄糖浓度与490 nm处吸光度值具有良好的线性关系。把菌丝体多糖490 nm处吸光度值带入方程经过计算后得出纯化前和纯化后中国弯颈霉菌丝体的多糖含量分别为28.74%±1.81%和75.27%±2.09%。
2.2 TSP体外自由基清除作用
研究发现TSP对多种自由基均具有较好的清除作用且呈剂量依赖趋势,TSP清除超氧阴离子自由基、羟自由基和DPPH自由基的IC50分别为1.16、0.55和0.68 mg/mL(图1A~图1C),其中TSP对羟自由基和DPPH自由基清除效果要优于超氧阴离子自由基。此外,TSP对于多种自由基的清除作用极显著低于VC组(P<0.01)。李泉等[9]提取杏鲍菇多糖并测定其对DPPH自由基清除作用的IC50为0.70 mg/mL。杨亚萍等[17]发现灵芝多糖清除超氧阴离子自由、羟自由基和DPPH自由基的IC50分别为1.25、0.88和1.04 mg/mL。上述菌类多糖对自由基的清除作用基本相似,TSP相较于普通灵芝多糖展示出了较强的自由基清除活性。
2.3 TSP对过氧化氢损伤MIN6细胞的保护作用
2.3.1 MIN6细胞的生存率
不同浓度TSP(0~5 mg/mL)处理MIN6细胞24 h后,与对照组相比1.25~5 mg/mL的TSP处理使得细胞生存率极显著降低(P<0.01),提示TSP浓度在较高范围能够抑制MIN6细胞增殖。TSP浓度在0.78~0.625 mg/mL范围内对MIN6细胞生存率没有显著影响(P>0.05)(图2A),结合自由基清除实验结果在此浓度范围内选取对自由基具有较强清除作用且差距较大的两个浓度作为高剂量给药组和低剂量给药组。因此分别选择0.625 mg/mL作为高剂量给药组,0.156 mg/mL作为低剂量给药组。
不同浓度的过氧化氢(0~250 μmol/L)处理MIN6细胞24 h后,与对照组相比较低浓度的过氧化氢促进了MIN6细胞的增殖活性,使得MIN6细胞的生存率出现极显著增高的现象(P<0.01)。随着过氧化氢的浓度增高,MIN6细胞的生存率逐渐降低(P<0.05),并呈现出剂量依赖趋势(图2B)。一般选取细胞生存率75%附近的浓度作为损伤浓度最佳,故本实验选择200 μmol/L过氧化氢处理MIN6细胞诱导氧化应激模型。
TSP对过氧化氢诱导的细胞生存率降低具有显著的保护作用(图2C),与对照组相比过氧化氢损伤模型组细胞生存率极显著下降(P<0.01),与模型组相比,高剂量组和低剂量组的细胞生存率显著升高(P<0.01,P<0.05)。MIN6细胞对于氧化应激高度敏感是糖尿病发生的关键因素之一[18],TSP给药能够保护氧化应激导致的细胞生存率降低展示出其对于缓解氧化应激相关疾病的潜力。
2.3.2 TSP改善过氧化氢损伤MIN6细胞的生长状态和细胞形态
细胞的正常形态是其发挥生理功能的重要保障[19],在倒置显微镜下观察MIN6细胞的生长状态发现(图3),与对照组相比过氧化氢刺激24 h后MIN6细胞悬浮数量极显著增多(P<0.01)贴壁状态较差(圆圈所示)、胞体变圆、丝状伪足明显缩短或消失(箭头所示)表明细胞生长状态较差。相对于过氧化氢模型组,高剂量和低剂量给药组悬浮细胞数量极显著减少(P<0.01),丝状伪足长度恢复。说明过氧化氢刺激导致MIN6细胞的正常生理结构破坏,TSP治疗能够逆转这一现象。
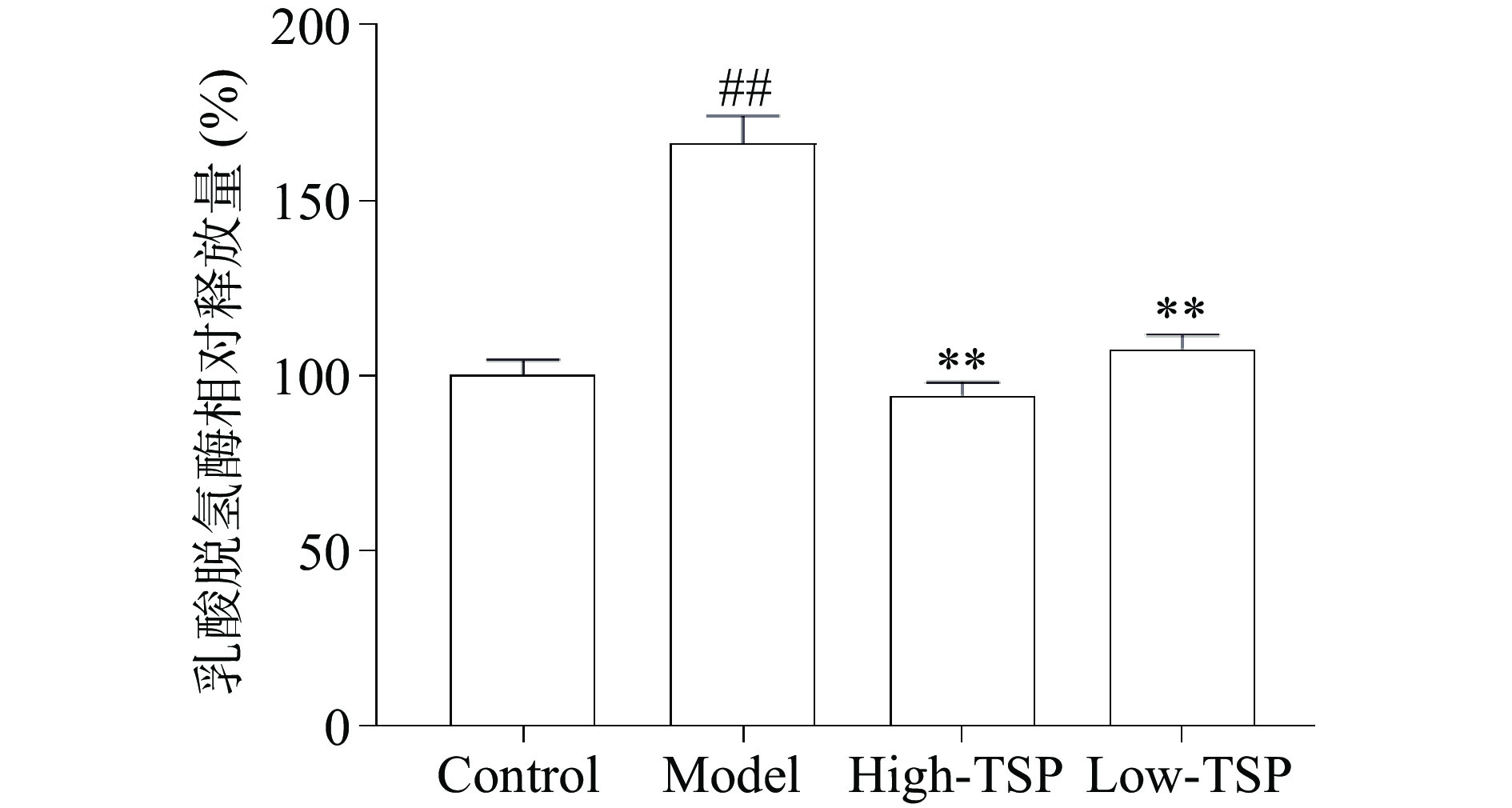
2.3.3 TSP能够减少过氧化氢损伤MIN6细胞的乳酸脱氢酶释放
正常情况下乳酸脱氢酶大量存在于细胞内部,当细胞膜结构受损后会释放到培养基中,通过测定培养基中乳酸脱氢酶的水平能够判断细胞膜系统的受损程度[20]。与对照组相比过氧化氢处理后的模型组乳酸脱氢酶释放量极显著上升(P<0.01)提示细胞膜完整性破坏(图4),与模型组相比TSP高低剂量给药组乳酸脱氢酶释放量极显著降低(P<0.01)。研究表明,TSP给药降低了培养基中乳酸脱氢酶的含量,说明TSP能够减轻氧化应激对于细胞膜的损伤,增加细胞膜结构的完整性。
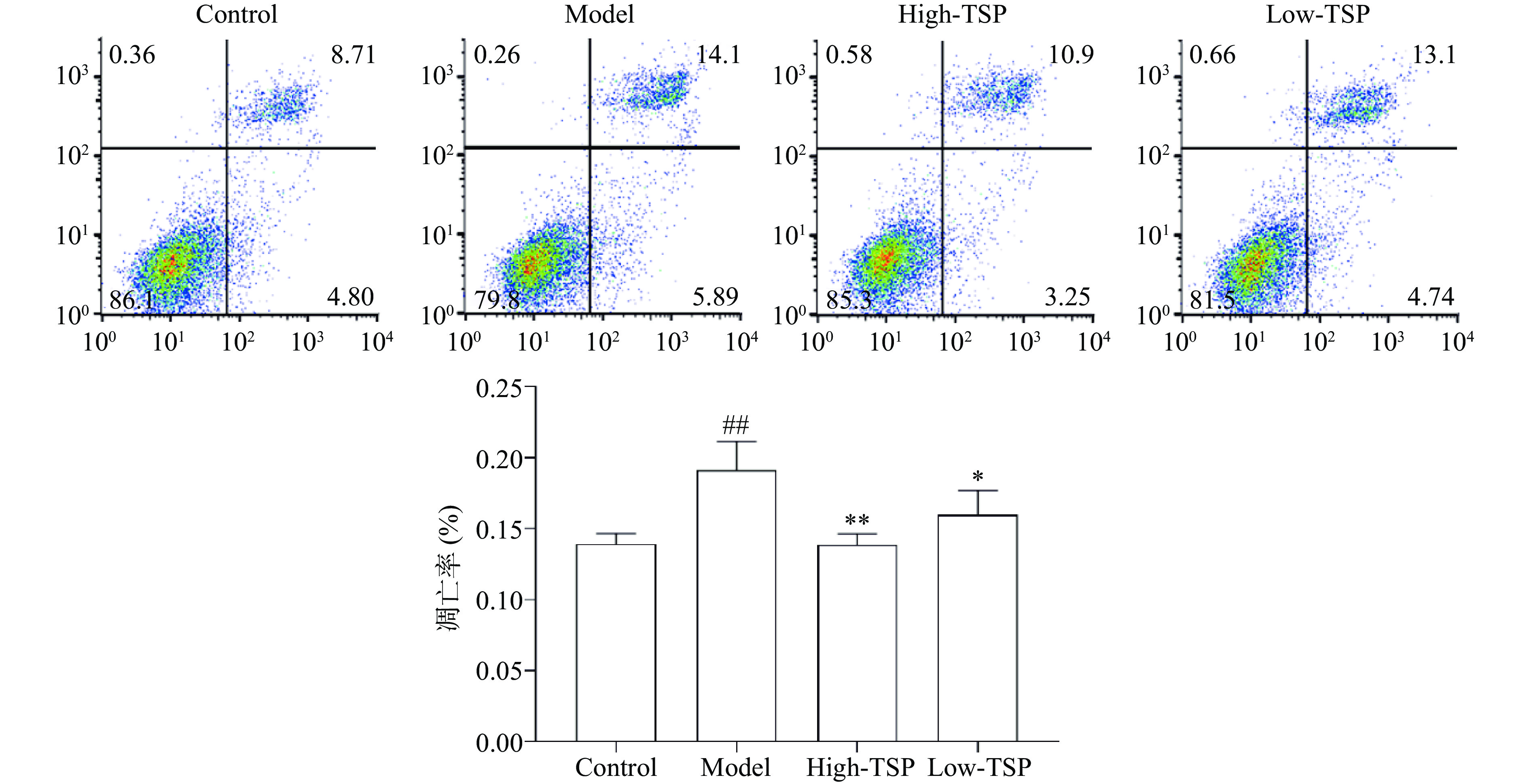
2.3.4 TSP能够降低过氧化氢损伤MIN6细胞的凋亡水平
细胞凋亡是机体维持自身稳态的重要机制,通常情况下细胞的凋亡水平能够反映出疾病的严重程度[21],如图5所示,过氧化氢处理组与对照组相比细胞凋亡率极显著上升(P<0.01),与模型组相比高剂量给药组和低剂量给药组细胞凋亡率显著下降(P<0.01,P<0.05),TSP给药能够显著降低过氧化氢诱导的细胞凋亡水平,同样展示出其具有治疗疾病的潜在药用价值。
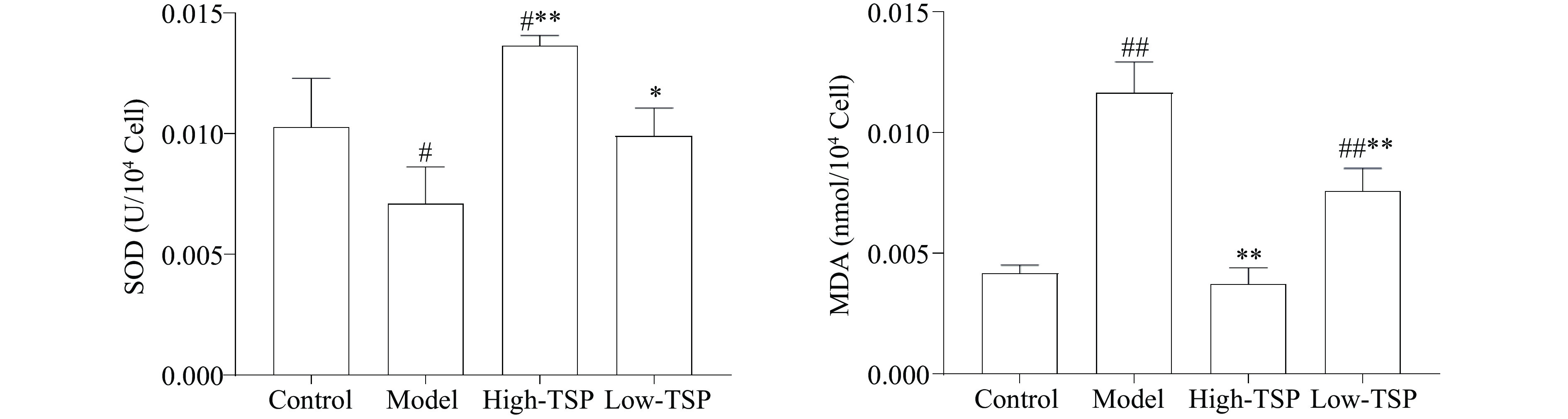
2.3.5 TSP降低过氧化氢损伤MIN6细胞的氧化应激水平
SOD是细胞内重要的抗氧化酶之一,主导多种自由基的清除过程,使细胞不受氧化损伤[22],MDA是细胞膜脂质过氧化产物能够反映细胞的氧化应激水平,其在细胞内过量堆积会诱导细胞能量代谢和信号传导障碍对细胞造成损伤[23]。与对照组相比,模型组细胞内SOD活力降低(P<0.05),MDA水平极显著升高(P<0.01),与模型组相比TSP高剂量给药组和低剂量给药组细胞内SOD活力显著升高(P<0.01,P<0.05),MDA水平显著下降(P<0.01)(图6),TSP给药能够通过降低细胞内MDA水平,增加SOD活力从而减少氧化应激导致的细胞损伤。
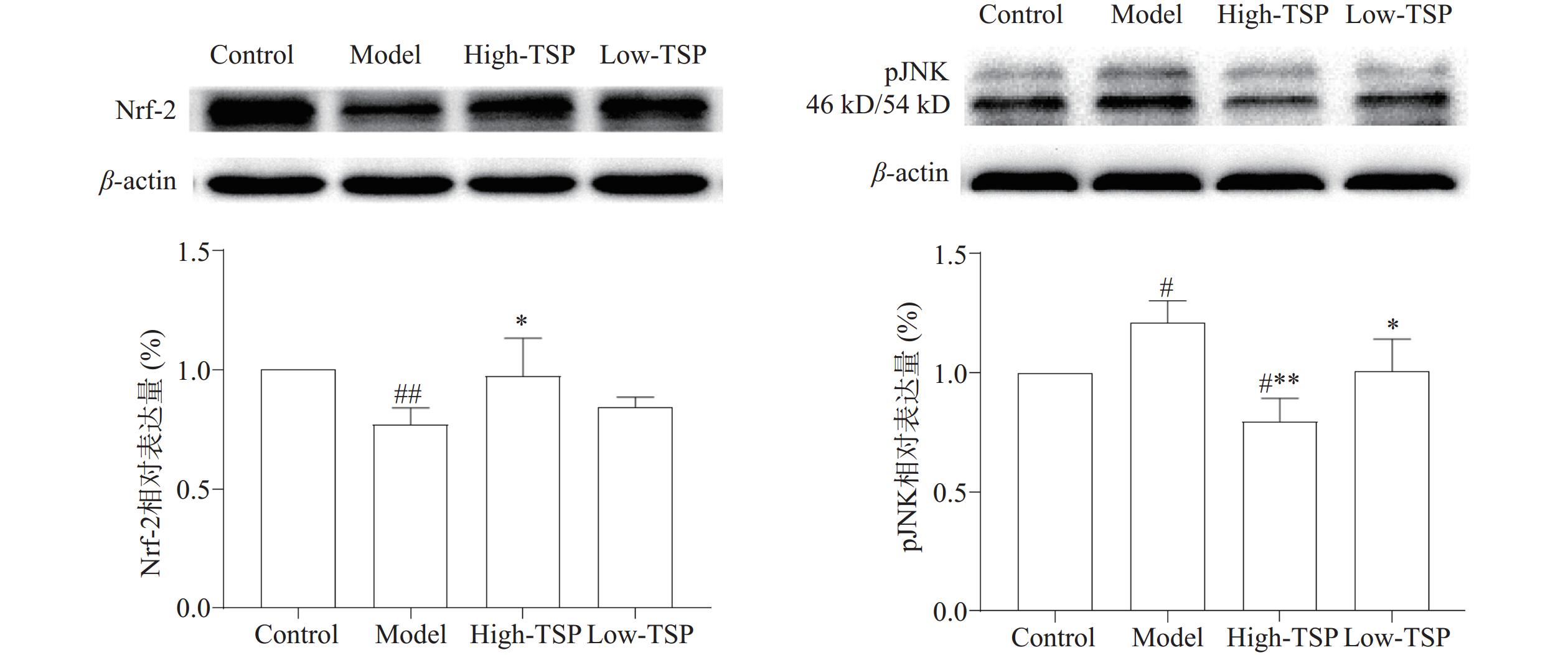
2.3.6 TSP调节过氧化氢损伤MIN6细胞中Nrf-2和pJNK的表达
Nrf-2是人体抗氧化防御系统的重要组成部分,能够通过上调SOD、谷胱甘肽过氧化物酶和过氧化氢酶等抗氧化酶的表达发挥保护细胞作用[24]。JNK是凋亡经典通路p38MAPK/JNK信号通路中的关键分子,磷酸化是其活化方式,研究证明细胞发生氧化应激后pJNK的表达增高从而诱导了凋亡的发生[25]。过氧化氢处理模型组细胞Nrf-2表达量极显著降低(P<0.01),pJNK表达量显著升高(P<0.05),与模型组相比高剂量给药组细胞中Nrf-2表达量显著增加(P<0.05),高低剂量给药组pJNK表达显著下降(P<0.01,P<0.05)(图7)。结果表明过氧化氢诱导细胞氧化应激从而导致了细胞凋亡的发生,TSP给药能够通过缓解氧化应激状态减少细胞凋亡的发生。
3. 讨论与结论
氧化应激是指体内的氧化系统与抗氧化系统失衡处于倾向氧化的状态[26],大量的自由基在组织和细胞中堆积,从而损伤细胞导致细胞的凋亡[27]。研究报道了氧化应激在疾病的发生和发展过程中扮演着重要角色[28],其中在2型糖尿病的胰岛β细胞中这一现象尤为显著[29],因此逆转氧化应激状态治疗疾病成为当下的研究热点[30−31]。例如在治疗糖尿病的过程中,研究者通过降低患者的氧化应激水平缓解胰岛β细胞的损伤[32]。
与大多数研究相似[33−34],本课题组初步探讨了TSP的体外抗氧化活性,自由基清除实验结果表明:TSP具有较好的抗氧化活性,对多种自由基均有显著的清除作用,与VC组相比依然有显著的差距。自由基清除实验可以证明中国弯颈霉菌丝体中多糖是一种主要的抗氧化成分,同时也是开展后续细胞内抑制氧化应激实验的基础。
为了探究TSP抑制氧化应激损伤的分子学机制,使用200 μmol/L的过氧化氢刺激MIN6细胞模拟氧化应激状态,并给予不同剂量的TSP保护,观察细胞各项指标的变化。本课题组首先探讨了TSP对过氧化氢损伤MIN6细胞生存率的影响,发现TSP给药能够显著恢复过氧化氢诱导的细胞生存率下降,表明TSP能够保护MIN6细胞免受过氧化氢的细胞死亡。细胞生存率对于研究细胞的生长状态具有很大的局限性,在一些情况下细胞可能并未死亡但是已经失去了正常的生理功能。正常的形态结构是细胞发挥生理作用的基础[19],本研究发现过氧化氢诱导的氧化应激模型组细胞悬浮数量增多和丝状伪足明显缩短,在这种状态下细胞的生理功能是被限制的,给予TSP保护能够显著恢复细胞形态,并可能恢复细胞的正常生理功能。乳酸脱氢酶是评价细胞状态的又一个常用指标,通过测定培养基中乳酸脱氢酶的水平能够判断细胞膜系统的受损程度[20]。本研究表明过氧化氢刺激损伤了细胞膜的完整性,TSP给药能够显著降低培养基中乳酸脱氢酶水平,增加细胞膜完整性。一些研究报道了2型糖尿病小鼠胰岛细胞凋亡水平显著升高,给予药物治疗后能够显著减少胰岛细胞凋亡,改善糖尿病症状,其部分作用可能与氧化应激水平降低相关[35]。本研究发现TSP给药能够显著降低过氧化氢诱导的细胞凋亡升高。总而言之,本研究从多角度证明了TSP对于过氧化氢损伤MIN6细胞的保护作用。
在一项代谢性疾病的研究中,通过药物治疗能够显著缓解模型小鼠的氧化应激状态,主要表现为降低MDA水平,提高SOD活力[36]。SOD作为细胞内一种重要的抗氧化酶能够催化超氧阴离子的清除过程,从而维持细胞的氧化与抗氧化平衡状态,MDA是细胞膜脂质过氧化产物,能够反应细胞的氧化应激水平[37]。TSP能够显著增加氧化应激损伤细胞内的SOD活力,降低细胞内MDA含量,这表明细胞氧化应激状态得到缓解,氧化与抗氧化的失衡得到恢复。总之,TSP能够增加MIN6细胞的抗氧化能力,减轻自由基对于细胞的损伤,其机制可能与TSP增加了Nrf-2的表达量相关[38]。有研究报道,三白草酮能够通过上调HT22细胞Nrf-2的表达抑制过氧化氢诱导的氧化应激损伤,进而减少细胞凋亡的发生[39]。Nrf-2是人体抗氧化防御系统的重要组成部分能够通过调节SOD、谷胱甘肽过氧化物酶和过氧化氢酶水平发挥作用[24],由此推测TSP的抗氧化应激作用可能是通过上调Nrf-2的表达水平,启动其下游抗氧化基因的表达,增加包括SOD在内的抗氧化酶活性来减少氧化应激对细胞造成的损伤。多种疾病的发生与氧化应激状态诱导的细胞凋亡密切相关[40],JNK作为凋亡经典通路p38MAPK/JNK信号通路中的关键分子与氧化应激导致的凋亡密切相关[41]。本研究发现TSP给药能够显著降低MIN6细胞中pJNK表达水平,结合流式细胞术结果分析发现给药后能够显著减少MIN6细胞凋亡的发生。猜测TSP可能通过增加Nrf-2的表达水平改善细胞内的氧化应激状态,从而降低pJNK表达和其诱导的细胞凋亡。但也有研究指出JNK的磷酸化对于Nrf-2的激活存在一定的促进作用[42]。由于氧化应激状态下,机体多种信号通路的相互作用可能发生改变,因此TSP在细胞内的抗氧化机制还需要进一步的深入研究。
综上所述,本研究发现TSP在体外具有较好的自由基清除作用,在细胞水平的实验发现TSP可以通过增加Nrf-2的表达来提高细胞的抗氧化能力进而减少过氧化氢诱导的细胞凋亡发生。由于本实验只是进行了细胞水平的探索,后续需要通过构建特殊疾病动物模型研究TSP对动物疾病状态下氧化应激水平和相关蛋白表达的影响,为中药多糖的应用提供新的理论依据。
-
-
[1] 高立文, 张臻, 周建芹, 等. 中国弯颈霉提取物抗氧化和抗肿瘤体外活性研究[J]. 食品科学,2009,30(5):227−232. [GAO L W, ZHANG Z, ZHOU J Q, et al. Study on anti-oxidant and anti-tumor activities in vitro of Tolypocladium sinense extracts[J]. Food Science,2009,30(5):227−232. doi: 10.3321/j.issn:1002-6630.2009.05.053 GAO L W, ZHANG Z, ZHOU J Q, et al . Study on anti-oxidant and anti-tumor activities in vitro of Tolypocladium sinense extracts[J]. Food Science,2009 ,30 (5 ):227 −232 . doi: 10.3321/j.issn:1002-6630.2009.05.053[2] 苑鹏, 刘鑫龙. 冬虫夏草提取物及其活性成分研究进展[J]. 农产品加工,2022(2):60−61. [YAN P, LIU X L. Research advances of extracts and active components from Cordyceps sinensis[J]. Farm Products Processing,2022(2):60−61. YAN P, LIU X L . Research advances of extracts and active components from Cordyceps sinensis[J]. Farm Products Processing,2022 (2 ):60 −61 .[3] 梁静, 李秀璋, 陈建博, 等. 青海省冬虫夏草资源适宜性区划分析[J]. 菌物学报,2022,41(11):1772−1785. [LIANG J, LI X Z, CHEN J B, et al. Suitability and regionalization of Chinese cordyceps in qinghai province, northwest china[J]. Mycosystema,2022,41(11):1772−1785. LIANG J, LI X Z, CHEN J B, et al . Suitability and regionalization of Chinese cordyceps in qinghai province, northwest china[J]. Mycosystema,2022 ,41 (11 ):1772 −1785 .[4] 方焕谋, 谭树明, 雷坚. 中国弯颈霉的培养性状和药理作用研究[J]. 菌物系统,1998,17(1):40−45. [FANG H M, TAN S M, LEI J, et al. Studies on cultural characters and pharmacological function of Tolypocladium sinense[J]. Mycosystem,1998,17(1):40−45. FANG H M, TAN S M, LEI J, et al . Studies on cultural characters and pharmacological function of Tolypocladium sinense[J]. Mycosystem,1998 ,17 (1 ):40 −45 .[5] 杨萍, 吕方, 米沙. 不同发酵条件对中国弯颈霉发酵产物成分影响的实验观察[J]. 天津药学,2007(5):3−6. [YANG P, LÜ F, MI S. Effect of different fermentation conditions on the components of the Tolypocladium sinense fermentation products[J]. Tianjin Pharmacy,2007(5):3−6. YANG P, LÜ F, MI S . Effect of different fermentation conditions on the components of the Tolypocladium sinense fermentation products[J]. Tianjin Pharmacy,2007 (5 ):3 −6 .[6] 王婷. 中国弯颈霉菌丝提取物抗γ辐射作用研究[D]. 南昌:江西中医药大学, 2022. [WANG T. The radiation protective effect of Tolypocladium sinense mycelium[D]. Nanchang:Jiangxi University of Chinese Medicine, 2022. WANG T. The radiation protective effect of Tolypocladium sinense mycelium[D]. Nanchang: Jiangxi University of Chinese Medicine, 2022.
[7] 彭伟彪. 中国弯颈霉提取液对去势小鼠骨质疏松症的作用及其机制研究[D]. 南昌:江西中医药大学, 2021. [PENG W B. Studies on the effect and mechanism of the Tolypocladium sinense extract on osteoporosis induced by ovariectomy[D]. Nanchang:Jiangxi University of Chinese Medicine, 2021. PENG W B. Studies on the effect and mechanism of the Tolypocladium sinense extract on osteoporosis induced by ovariectomy[D]. Nanchang: Jiangxi University of Chinese Medicine, 2021.
[8] WANG X L, LI L, BAI M J, et al. Dietary supplementation with Tolypocladium sinense mycelium prevents dyslipidemia inflammation in high fat diet mice by modulation of gut microbiota in mice[J]. Frontiers in Immunology,2022,13:977528. doi: 10.3389/fimmu.2022.977528
[9] 李泉, 潘少香, 张青青, 等. 杏鲍菇副产物多糖超声提取工艺优化及其体外抗氧化活性研究[J]. 中国果菜,2022,42(12):34−40. [LI Q, PAN S X, ZHANG Q Q, et al. Optimization of ultrasonic extraction process of polysaccharides from byproducts of Pleurotus eryngii and its antioxidant activity in vitro[J]. China Fruit & Vegetable,2022,42(12):34−40. LI Q, PAN S X, ZHANG Q Q, et al . Optimization of ultrasonic extraction process of polysaccharides from byproducts of Pleurotus eryngii and its antioxidant activity in vitro[J]. China Fruit & Vegetable,2022 ,42 (12 ):34 −40 .[10] 杨星星, 杨锦颖, 董庆军, 等. 马齿苋粗多糖除蛋白方法的筛选及优化[J]. 现代食品,2021(13):117−120. [YANG X X, YANG J Y, DONG Q J, et al. Screen and optimization of the methods for removing protein from crude polysaccharide in Portulaca oleracea L J]. Modern Food,2021(13):117−120.
[11] 王彦平, 娄芳慧, 陈月英, 等. 苯酚-硫酸法测定紫山药多糖含量的条件优化[J]. 食品研究与开发,2021,42(4):170−174. [WANG Y P, LOU F H, CHEN Y Y, et al. Optimization of analytical conditions for the determination of polysaccharides contents in purple yam by phenol-sulfuric acid method[J]. Food Research and Development,2021,42(4):170−174. WANG Y P, LOU F H, CHEN Y Y, et al . Optimization of analytical conditions for the determination of polysaccharides contents in purple yam by phenol-sulfuric acid method[J]. Food Research and Development,2021 ,42 (4 ):170 −174 .[12] 陈仕学, 姚元勇, 卢忠英, 等. 邻苯三酚自氧化法对茶叶中茶多酚的抗氧化性能应用研究[J]. 食品研究与开发,2020,41(17):29−36. [CHEN S X, YAO Y Y, LU Z Y, et al. Pyrogallol autoxidation and its application to tea polyphenols activity assay[J]. Food Research and Development,2020,41(17):29−36. CHEN S X, YAO Y Y, LU Z Y, et al . Pyrogallol autoxidation and its application to tea polyphenols activity assay[J]. Food Research and Development,2020 ,41 (17 ):29 −36 .[13] 胡晓彤, 叶玉洁, 石光, 等. 桑黄子实体多糖的提取及其对D-半乳糖诱导的3T3细胞损伤的保护作用[J]. 食品科学,2020,41(19):204−211. [HU X D, YE Y J, SHI G, et al. Extraction of polysaccharides from fruiting bodies of Phellinus igniarius and its protective effect on D-galactose induced 3T3 cell injury[J]. Food Science,2020,41(19):204−211. doi: 10.7506/spkx1002-6630-20190906-078 HU X D, YE Y J, SHI G, et al . Extraction of polysaccharides from fruiting bodies of Phellinus igniarius and its protective effect on D-galactose induced 3T3 cell injury[J]. Food Science,2020 ,41 (19 ):204 −211 . doi: 10.7506/spkx1002-6630-20190906-078[14] 冯书珍, 卢宇凤, 刘南英, 等. 海藻多糖的单糖组成对体外抗氧化活性的影响[J]. 天然产物研究与开发,2019,31(1):116−121. [FENG S Z, LU Y F, LIU N Y, et al. Effect of monosaccharide composition on antioxidant activity of algal polysaccharides[J]. Natural Product Research and Development,2019,31(1):116−121. FENG S Z, LU Y F, LIU N Y, et al . Effect of monosaccharide composition on antioxidant activity of algal polysaccharides[J]. Natural Product Research and Development,2019 ,31 (1 ):116 −121 .[15] 田淑雨, 鹿士峰, 吴杨洋, 等. 灵芝多糖不同提取方式的比较研究[J]. 食品安全质量检测学报,2018,9(18):4921−4928. [TIAN S Y, LU S F, WU Y Y, et al. Comparative study on different extraction methods of Ganoderma lucidum polysaccharide[J]. Journal of Food Safety and Quality,2018,9(18):4921−4928. doi: 10.3969/j.issn.2095-0381.2018.18.027 TIAN S Y, LU S F, WU Y Y, et al . Comparative study on different extraction methods of Ganoderma lucidum polysaccharide[J]. Journal of Food Safety and Quality,2018 ,9 (18 ):4921 −4928 . doi: 10.3969/j.issn.2095-0381.2018.18.027[16] 何皎, 孙晓菲, 潘琳, 等. 微波提取香菇多糖制备微胶囊的抑菌抗氧化活性研究[J]. 中国调味品,2023,48(2):71−75. [HE J, SUN X F, PAN L, et al. Study on antibacterial and antioxidant activity of microcapsules prepared with lentinan by microwave extraction[J]. China Condiment,2023,48(2):71−75. doi: 10.3969/j.issn.1000-9973.2023.02.013 HE J, SUN X F, PAN L, et al . Study on antibacterial and antioxidant activity of microcapsules prepared with lentinan by microwave extraction[J]. China Condiment,2023 ,48 (2 ):71 −75 . doi: 10.3969/j.issn.1000-9973.2023.02.013[17] 杨亚萍, 吕亚辉, 刘飞祥, 等. 灵芝菌丝体硒多糖结构表征、抗氧化活性及对小鼠运动疲劳的影响[J]. 中国食品添加剂,2023,34(6):109−118. [YANG Y P, LÜ Y H, LIU F X, et al. Structure characterization, antioxidant and effects of selenium polysaccharide from Ganoderma lucidum myceliumon on exercise fatigue in mice[J]. China Food Additives,2023,34(6):109−118. YANG Y P, LÜ Y H, LIU F X, et al . Structure characterization, antioxidant and effects of selenium polysaccharide from Ganoderma lucidum myceliumon on exercise fatigue in mice[J]. China Food Additives,2023 ,34 (6 ):109 −118 .[18] WU J M, GU X S, ZHANG J, et al. 4-OI protects MIN6 cells from oxidative stress injury by reducing LDHA-mediated ROS generation[J]. Biomolecules,2022,12(9):1236. doi: 10.3390/biom12091236
[19] PRASAD A, ALIZADEH E. Cell form and function: Interpreting and controlling the shape of adherent cells[J]. Trends in Biotechnology,2019,37(4):347−357. doi: 10.1016/j.tibtech.2018.09.007
[20] WANG J, HUANGFU M, LI X J, et al. Osthole induces apoptosis and Caspase-3/GSDME-dependent pyroptosis via NQO1-mediated ROS generation in HeLa cells[J]. Oxidative Medicine and Cellular Longevity,2022,2022:8585598.
[21] BERTHELOOT D, LATZ E, FRANKLIN B S. Necroptosis, pyroptosis and apoptosis:An intricate game of cell death[J]. Cellular & Molecular Immunology,2021,18(5):1106−1121.
[22] ZHAO H Q, ZHANG R F, YAN X Y, et al. Superoxide dismutase nanozymes:An emerging star for anti-oxidation[J]. Journal of Materials Chemistry B,2021,9(35):6939−6957. doi: 10.1039/D1TB00720C
[23] DEL R D, STEWART A J, PELLEGRINI N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutrition, Metabolism and Cardiovascular Diseases,2005,15(4):316−328. doi: 10.1016/j.numecd.2005.05.003
[24] SHI X W, ZHANG B, CHU Z L, et al. Wogonin inhibits cardiac hypertrophy by activating Nrf-2-mediated antioxidant responses[J]. Cardiovascular Therapeutics,2021,2021:9995342.
[25] YANG H Y, XIE Y, YANG D Y, et al. Oxidative stress-induced apoptosis in granulosa cells involves JNK, p53 and Puma[J]. Oncotarget,2017,8(15):25310−25322. doi: 10.18632/oncotarget.15813
[26] LI R, JIA Z Q, TRUSH M A. Defining ROS in biology and medicine[J]. React Oxyg Species (Apex),2016,1(1):9−21.
[27] DEMIRCI-ÇEKIÇ S, ÖZKAN G, AVAN A N, et al. Biomarkers of oxidative stress and antioxidant defense[J]. Journal of Pharmaceutical and Biomedical Analysis,2022,209:114477. doi: 10.1016/j.jpba.2021.114477
[28] HOU J, YUAN Y, CHEN P W, et al. Pathological roles of oxidative stress in cardiac microvascular injury[J]. Current Problems in Cardiology,2023,48(1):101399. doi: 10.1016/j.cpcardiol.2022.101399
[29] NAGANNA C M, PRASAD K Y, MAHENDRA V P, et al. Vanillic acid potentiates insulin secretion and prevents pancreatic beta-cells cytotoxicity under H2O2-induced oxidative stress[J]. Molecular Biology Reports,2023,50(2):1311−1320. doi: 10.1007/s11033-022-08046-0
[30] KOUTSALIARIS I K, MOSCHONAS I C, PECHLIVANI L M, et al. Inflammation, oxidative stress, vascular aging and atherosclerotic ischemic stroke[J]. Current Medicinal Chemistry,2022,29(34):5496−5509. doi: 10.2174/0929867328666210921161711
[31] FORMAN H J, ZHANG H Q. Targeting oxidative stress in disease:Promise and limitations of antioxidant therapy[J]. Nature Reviews Drug Discovery,2021,20(9):689−709. doi: 10.1038/s41573-021-00233-1
[32] LEH H E, LEE L K. Lycopene:A potent antioxidant for the amelioration of type II diabetes mellitus[J]. Molecules,2022,27(7):2335. doi: 10.3390/molecules27072335
[33] 罗学平, 李丽霞, 先元华, 等. 茶梗-竹叶提取物固体复合饮料制作及抗氧化效果研究[J]. 中国食品添加剂,2023,34(5):224−232. [LUO X P, LI L X, XIAN Y H, et al. Preparation of tea stem-bamboo leaf extract solid beverage and its antioxidant activity[J]. China Food Additives,2023,34(5):224−232. doi: 10.19804/j.issn1006-2513.2023.05.027 LUO X P, LI L X, XIAN Y H, et al . Preparation of tea stem-bamboo leaf extract solid beverage and its antioxidant activity[J]. China Food Additives,2023 ,34 (5 ):224 −232 . doi: 10.19804/j.issn1006-2513.2023.05.027[34] 凌楠, 罗春凤, 高崇斌, 等. 广西产铁皮石斛花提取物的细胞毒性及体外抗氧化活性研究[J]. 中国食品添加剂,2023,34(5):141−148. [LING N, LUO C F, GAO C B, et al. Study on cytotoxicity and in vitro antioxidant activities of extracts from Dendrobium offificinale flowers from Guangxi[J]. China Food Additives,2023,34(5):141−148. doi: 10.19804/j.issn1006-2513.2023.05.017 LING N, LUO C F, GAO C B, et al . Study on cytotoxicity and in vitro antioxidant activities of extracts from Dendrobium offificinale flowers from Guangxi[J]. China Food Additives,2023 ,34 (5 ):141 −148 . doi: 10.19804/j.issn1006-2513.2023.05.017[35] LIU Y T, HE T, LI H Q, et al. Liraglutide improves pancreatic islet beta cell apoptosis in rats with type 2 diabetes mellitus by inhibiting the IKK ε/NF κB pathway[J]. European Review for Medical and Pharmacological Sciences,2021,25(14):4818−4828.
[36] ZHOU Y F, TIAN S S, QIAN L, et al. DHA-enriched phosphatidylserine ameliorates non-alcoholic fatty liver disease and intestinal dysbacteriosis in mice induced by a high-fat diet[J]. Food & Function,2021,12(9):4021−4033.
[37] CHEN Y E, XU S J, LU Y Y, et al. Asperuloside suppressing oxidative stress and inflammation in DSS-induced chronic colitis and RAW264.7 macrophages via Nrf2/HO-1 and NF- κB pathways[J]. Chemico Biological Interactions,2021,344:109512. doi: 10.1016/j.cbi.2021.109512
[38] WU C, CHEN R L, WANG Y, et al. Acacetin alleviates myocardial ischaemia/reperfusion injury by inhibiting oxidative stress and apoptosis via the Nrf-2/HO-1 pathway[J]. Pharmaceutical Biology,2022,60(1):553−561. doi: 10.1080/13880209.2022.2041675
[39] 姜敏, 李露露, 吴桐, 等. 三白草酮通过调控海马Nrf2/HO-1表达减少酒精戒断大鼠抑郁样行为[J]. 中国病理生理杂志,2022,38(10):1803−1811. [JIANG M, LI L L, WU T, et al. Sauchinone attenuates alcohol withdrawal-induced depression-like be haviors in rats by modulating hippocampal Nrf2/HO-1 expression[J]. Chinese Journal of Pathophysiology,2022,38(10):1803−1811. JIANG M, LI L L, WU T, et al . Sauchinone attenuates alcohol withdrawal-induced depression-like be haviors in rats by modulating hippocampal Nrf2/HO-1 expression[J]. Chinese Journal of Pathophysiology,2022 ,38 (10 ):1803 −1811 .[40] LIAO C Y, CAI B X, FENG Y F, et al. Activation of JNK signaling promotes all-trans-retinal-induced photoreceptor apoptosis in mice[J]. Journal of Biological Chemistry,2020,295(20):6958−6971. doi: 10.1074/jbc.RA120.013189
[41] ZHANG L M, ZHEN R R, GU C, et al. Retraction note:Chinese medicine Di-Huang-Yi-Zhi protects PC12 cells from H2O2-induced apoptosis by regulating ROS-ASK1-JNK/p38 MAPK signaling[J]. BMC Complement Med Ther,2022,22(1):183. doi: 10.1186/s12906-022-03665-3
[42] 廖霞, 郑少杰, 卢可可, 等. 植物多酚通过Nrf2/ARE信号通路抗氧化作用研究进展[J]. 食品科学,2016,37(7):227−232. [LIAO X, ZHENG S J, LU K K, et al. Plant polyphenols exert antioxidant activity of by Nrf2/ARE signaling pathway:A review[J]. Food Science,2016,37(7):227−232. LIAO X, ZHENG S J, LU K K, et al . Plant polyphenols exert antioxidant activity of by Nrf2/ARE signaling pathway: A review[J]. Food Science,2016 ,37 (7 ):227 −232 . -
期刊类型引用(10)
1. 尉洁,张玲芳,胡顺安,秦孟春,马琳,李丹,段翠翠. 长白山区发酵酱菜中高产胞外多糖乳酸菌的筛选及多糖抗氧化性分析. 食品工业科技. 2024(02): 110-117 .  本站查看
本站查看
2. 赵丹,赵守祺,王烁,陈曦,杜仁鹏. 融合魏斯氏菌P2胞外多糖对巨噬细胞RAW264.7增殖及免疫调节活性的影响. 黑龙江大学自然科学学报. 2024(02): 200-206 .  百度学术
百度学术
3. 虞宁馨,于连升,齐心彤,葛菁萍,杜仁鹏. 肠膜明串珠菌葡聚糖蔗糖酶的生物信息学分析. 黑龙江大学自然科学学报. 2024(05): 544-552 .  百度学术
百度学术
4. 于连升,葛菁萍,平文祥,杜仁鹏. 环二鸟苷酸调控细菌胞外多糖生物合成的研究进展. 食品工业科技. 2023(09): 422-430 .  本站查看
本站查看
5. 张孟雨,李尧,彭嘉屹,陈禹豪,曾凤婷,钟青萍. 高产EPS乳酸片球菌的航天育种及其EPS性能研究. 食品工业科技. 2023(17): 158-167 .  本站查看
本站查看
6. 李旭阳,郭润晴,路江浩,鄢梦洁,张鹏,刘明月,杨玲. 嗜热链球菌S131对巨噬细胞的免疫调节作用研究. 食品与发酵工业. 2023(16): 247-252 .  百度学术
百度学术
7. 罗伟,杨立军,崔晨旭,王玉娇,陈琼,王锐丽,叶润. 内生菌协同发酵对半夏多糖及其生物活性的影响. 中南农业科技. 2023(08): 52-56+61 .  百度学术
百度学术
8. 杨立军,花娇娇,崔晨旭,贾艳娇,陈琼,赫丁轩. 一株高产胞外多糖半夏内生真菌的鉴定、发酵条件优化及生物活性测定. 中国酿造. 2023(11): 109-114 .  百度学术
百度学术
9. 唐华英,罗欣锦,张云野,杨睿睿,叶广彬,王长丽. 假肠膜明串珠菌GX-3产胞外多糖条件优化及其理化性质研究. 中国乳品工业. 2022(08): 15-19+26 .  百度学术
百度学术
10. 兰冬雪,瞿茜楠,黄天,姚国强,扎木苏,彭传涛,李兆杰. 益生菌活性代谢产物的研究及应用进展. 食品工业科技. 2022(24): 11-20 .  本站查看
本站查看
其他类型引用(0)






 下载:
下载:


 下载:
下载:



