Determination of 19 Organophosphorus Pesticide Residues in Green Tea by Magnetic Solid Phase Extraction Combined with Ultra High Performance Liquid Chromatography Tandem Mass Spectrometry
-
摘要: 本文采用化学共沉淀法合成磁性石墨烯(Fe3O4@G),并将其作为一种磁固相萃取剂用于绿茶中有机磷农药的萃取富集,结合超高效液相色谱串联质谱技术,建立同时检测绿茶中19种有机磷农药残留的分析方法。本实验选择吸附剂用量为40 mg,萃取时间20 min,样品溶液pH为7,3.0 mL丙酮解吸,氯化钠用量为4 g。结果表明,在5~500 μg/L范围内,线性相关系数大于0.999,制备的Fe3O4@G材料具有良好的稳定性和可重复利用性。检出限(LOD)在5.0~6.0 μg/kg,定量限(LOQ)在15.0~20.0 μg/kg。当样品加标水平为20.0、40.0、200.0 μg/kg时,回收率在61.2%~94.9%之间,相对标准偏差(RSD,n=6)在2.6%~10.2%之间。本方法适用范围广,前处理易操控,有机溶剂用量少,经济,安全,材料可重复使用,该磁分散固相萃取技术在茶叶中农药的富集分离有很好的应用前景。
-
关键词:
- 磁固相萃取 /
- 绿茶 /
- 有机磷农药 /
- 超高效液相色谱串联质谱
Abstract: Magnetic graphene (Fe3O4@G) was synthesized as a magnetic solid phase extractor for the extraction and enrichment of organophosphorus pesticides in green tea by chemical coprecipitation method. Based on this, ultra high performance liquid chromatography tandem mass spectrometry method was developed for the determination of 19 organophosphorus pesticide residues in green tea. 40 mg adsorbent and 4 g sodium chloride were used in this experiment with the pH of sample solution at 7 for 20 min extraction time, 3.0 mL acetone desorption. The result showed that the prepared Fe3O4@G material had good stability and reusability with the linear correlation coefficients greater than 0.999 in the range of 5~500 μg/L. The limits of detection (LOD) and the limits of quantitation (LOQ) were 5.0~6.0 μg/kg and 15.0~20.0 μg/kg, respectively. The recoveries were between 61.2% and 94.9% with the relative standard deviations (RSD, n=6) in the range of 2.6%~10.2% when the samples were labeled at 20.0, 40.0 and 200.0 μg/kg. This method was safe and economy with a wide application range, easier control of pretreatment, less amount of organic solvent and reusable materials, which has a good application prospect in the enrichment and separation of pesticides in tea by the magnetic dispersion solid phase extraction technology. -
农药在农业生产中常用于防治虫害,提高农作物产量,延长产品保质期等[1−2]。有机磷类农药是一类含有磷原子的有机酯类化合物的总称,主要用于防治植物病、虫、草害,具有高效、广谱、易降解特性,因而在茶树的种植中被广泛使用[3−4]。朱凤等[3]研究表明因食品中农药残留引发中毒的农药中有机磷农药占比最大,有机磷进入机体会使组织中的乙酰胆碱积累,导致中枢神经系统及胆碱能神经功能异常[5−6],甚至会诱导细胞癌变[7−8]。GB 2763-2021规定茶叶中大多数有机磷农药的最大残留限量在0.05 mg/kg[9],甚至规定部分高毒性有机磷农药被直接禁用[9−10]。茶叶中有机磷农药残留问题不可轻视,建立高效可靠的前处理方法对保障茶叶质量安全意义重大。
目前,检测有机磷常用的的前处理方法有固相萃取(SPE)[11−12]、固相微萃取(SPME)[13]、液液萃取(LLE)[14−15]、液液微萃取(LLME)[16]、QuEChERS技术[17]等。但上述方法存在前处理步骤繁琐、耗时长、有机溶剂用量大等不足。有机磷在基质复杂的茶叶中仅痕量存在,净化效果不理想会严重干扰目标物的测定[18]。因此,需要建立一种简单高效,快速且经济安全的前处理方法来富集茶叶样品中的有机磷。
磁固相萃取(MSPE)是将含有目标分析物的待测液中加入具有磁性的吸附剂,经过萃取,将目标物吸附,最后用外加磁场将吸附了目标物的吸附剂从待测溶液中分离的技术。该技术是一种新型前处理技术,具有操作简便、快捷、低成本、易操控等特点,目前被广泛研究[19−21]。石墨烯(G)具有共轭体系,比表面积大,化学稳定性好,可与含有苯环结构的有机分子产生强的π-π键堆积作用[22−24],从而选择性吸附目标物,目前已广泛用于污染物处理中[25−27]。而磁性石墨烯在复杂的食品样品基体以及极性污染物分析中的应用还较少。
本实验结合有机磷农药结构特点及实验室现有农药标品情况,选取19种有机磷农药为研究对象进行分析考察。将石墨烯与磁性纳米粒子相结合,用化学共沉淀法合成磁性石墨烯,并将磁固相萃取与超高效液相色谱串联质谱结合,建立同时检测绿茶中19种有机磷农药残留的方法。实验考察了吸附剂用量、萃取时间、样品溶液pH、洗脱剂条件和氯化钠用量对磁固相萃取效率的影响。本方法能避免传统固相萃取方法的时间耗损,检测快速准确,易操控,材料可重复利用,只需要少量的有机溶剂,经济,安全,该技术在复杂样品基质以及极性污染物的富集分离中有很好的参考价值。
1. 材料与方法
1.1 材料与仪器
绿茶 购自超市,为4月份采摘后加工生产,常温储存;石墨 中国Alfa化学有限公司;氨水(25%~28%)、盐酸(19%)、甲酸、甲醇、丙酮、乙腈、乙酸乙酯 色谱纯,美国Tedia公司;硫酸铁铵(NH4Fe(SO4)2·12H2O)、硫酸亚铁铵((NH4)2Fe(SO4)2·6H2O)、氯化铁(FeCl3·6H2O)、氯化钠、氢氧化钠、硫酸镁、乙酸钠、乙二醇 分析纯,中国国药集团;实验用水为超纯水 美国Millipore公司;甲胺磷、乐果、敌百虫、敌敌畏、氧乐果、辛硫磷、哒螨灵、内吸磷、毒死蜱、苯线磷、硫环磷、硫线磷、氯唑磷、杀扑磷、速灭磷、甲拌磷、毒虫畏、乙酰甲胺磷、水胺硫磷 标准品,德国Dr. Ehrenstorfer公司。
Agilent 1290-6460超高压液相色谱-三重四极杆串联质谱仪 美国Agilent公司;JSM-6480 LV扫描电镜 日本电子公司;N-EVAP112氮吹仪 美国Organomation公司;KQ2200E超声波清洗器 昆山市超声仪器有限公司;Buchi-R215旋转蒸发仪 北京陆德恒泰商贸有限公司;DF 101S集热式恒温加热磁力搅拌器 上海析牛莱伯仪器有限公司;DZF6020真空干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 磁性石墨烯的制备
按本实验室[28]和参考文献[29−30]方法制备,采用化学共沉淀法。分别取(NH4)2Fe(SO4)2·6H2O(2.04 g)、NH4Fe(SO4)2·12H2O(3.01 g)和石墨烯(0.6 g)溶于200 mL超纯水中,在氮气保护下混匀,以100 W,40 kHz超声20 min,在此过程逐滴加入8 moL/L氨水,保持pH11~12,缓慢将温度升至50 ℃,在此温度下1300 r/min搅拌反应1 h。将沉淀物由磁铁收集并用去离子水重复冲洗至中性,在真空下干燥得到黑褐色粉末即为磁性石墨烯(Fe3O4@G)。Fe3O4纳米粒子参照Zhao等[31]方法制备:称取6.8 g FeCl3·6H2O,18 g乙酸钠,快速加入250 mL乙二醇,保持1300 r/min搅拌反应30 min,充分溶解后将其全部倒入反应釜200 ℃下反应8 h,产物经磁分离后,依次用乙醇、去离子水洗涤3次,烘干备用。
1.2.2 标准溶液配制
农药标准储备液(100 μg/mL):准确称取10 mg(精确至0.01 mg)标准品于100 mL棕色容量瓶中,用乙腈溶解并定容至刻度,摇匀,4 ℃避光保存。
1.2.3 绿茶样品前处理
提取:参照GB 23200.121-2021[32]的茶叶提取条件并加以优化,将绿茶样品先浸湿后再用乙腈提取有机磷农药。称取1 g(精确至0.01 g)绿茶样品,加入15 mL水浸湿后涡匀,再加入10 mL乙腈,涡匀后,以100 W,40 kHz超声提取10 min,加入4 g氯化钠,均质后,以8000 r/min离心5 min。吸取全部上清液于鸡心瓶中,残渣用10 mL乙腈重复提取一次,合并上清液,于旋转蒸发仪上蒸干,用10 mL乙腈-水(1:9,v/v)复溶。取1.0 mL上述复溶液于10 mL容量瓶中,用乙腈-水(1:9,v/v)定容至刻度,备用。
净化:磁固相萃取部分参照刘丽文等[33]实验方法并加以改进。取上述全部溶液加入20 mg Fe3O4@G吸附剂,涡匀后振荡萃取20 min。将磁铁放试管底部聚集Fe3O4@G后弃去上清液,加入1 mL丙酮溶液,涡旋解吸1 min,磁分离后,取全部上清液于另一试管中。重复上述洗脱操作2次,合并上述解吸液,氮气吹干,随后用200 μL乙腈-水(1:9,v/v)溶解,供UHPLC-MS/MS分析。
1.2.4 色谱-质谱条件
色谱-质谱条件参照GB 23200.121-2021[32]的测试条件并加以优化。
1.2.4.1 色谱条件
Agilent Eclipse Proshell 120 C18柱(1.9 μm,100 mm×2.1 mm),流动相A为2 mmol/L甲酸铵−0.01%甲酸水溶液,B为2 mmol/L甲酸铵−0.01%甲酸甲醇溶液,梯度洗脱程序见表1。柱温:40 ℃;进样量10 μL。
表 1 19种有机磷农药梯度洗脱程序Table 1. Gradient elution procedures for 19 organophosphorus pesticides时间(min) 流速(mL/min) VA(%) VB(%) 0 0.3 97.0 3.0 1 0.3 97.0 3.0 1.5 0.3 85.0 15.0 2.5 0.3 50.0 50.0 18 0.3 30.0 70.0 23 0.3 2.0 98.0 27 0.3 2.0 98.0 27.1 0.3 97.0 3.0 30 0.3 97.0 3.0 注:VA、VB分别为流动相A、B的体积比。 1.2.4.2 质谱条件
19种有机磷农药均为ESI+模式;采集方式为多反应监测MRM;干燥器气温度:300 ℃,流速:10 L/min;稍流气温度:300 ℃,流速:11 L/min;雾化气压力:0.28 MPa;电喷雾电压:4.0 kV;毛细管电压:3.0 kV;详细优化参数见表2。
表 2 19种有机磷农药多反应监测模式参数Table 2. Multiple- reaction monitoring (MRM) parameters for 19 organophosphorus pesticides化合物 电离
模式驻留时
间(min)母离子
(m/z)子离子
(m/z)碎裂电
压
(V)碰撞能
量(eV)甲胺磷 ESI+ 2.58 142 125* 80 10 94 80 15 乐果 ESI+ 4.04 230 199* 80 5 171 80 10 敌百虫 ESI+ 4.06 257 221* 120 10 109 120 20 敌敌畏 ESI+ 5.27 221 145* 120 15 109 120 25 氧乐果 ESI+ 3.14 214.1 183* 80 5 125 80 20 辛硫磷 ESI+ 17.55 299 129* 80 20 97 80 30 哒螨灵 ESI+ 22.77 365 309* 95 10 147 95 25 内吸磷 ESI+ 8.92 259.1 89* 100 10 61 100 35 毒死蜱 ESI+ 21.52 350 198* 100 15 97.1 100 30 苯线磷 ESI+ 14.78 304.1 217* 140 5 202 140 10 硫环磷 ESI+ 4.49 256 228* 100 10 140 100 25 硫线磷 ESI+ 18.56 271 159.1* 80 18 131 80 34 氯唑磷 ESI+ 11.67 314.1 162.1* 100 15 120 100 20 杀扑磷 ESI+ 7.98 303.1 145* 80 5 85 80 15 速灭磷 ESI+ 4.03 225 193* 80 15 127 80 25 甲拌磷 ESI+ 16.8 261.1 199* 70 10 75 70 10 毒虫畏 ESI+ 16.41 359.1 155* 120 10 127 120 15 乙酰甲胺磷 ESI+ 2.95 184 143* 80 5 125 80 15 水胺硫磷 ESI+ 7.66 231 121* 100 15 109 100 25 注:*表示定量离子。 1.2.5 材料形貌表征
石墨烯磁化前后的形貌,采用SEM将材料在100000倍尺度下的形貌进行观察。
1.2.6 萃取性能测试条件
在10 mL空白样品提取液中加入50 μL 10 μg/mL的19种有机磷农药混合标准溶液,使其浓度均为50 μg/L,以回收率为指标,考察Fe3O4@G、G和Fe3O4对农药的萃取性能,每个实验重复3次。回收率按式(1)计算。
R(%)=Cf×VfCq×Vq×F×100 (1) 式中:R表示萃取回收率,%;Cf表示标曲测得样液中目标物的浓度,μg/L;Vf表示样液最终定容体积,mL;Cq表示加标浓度,μg/L;Vq表示加标体积,mL;F表示转换系数。
1.2.7 固相萃取优化条件
茶叶中有机磷的提取方法对测定结果至关重要,为达到最佳萃取效果,以10 mL空白样品提取液中固定每种农药浓度均为50 μg/L,以萃取效率为指标,依据报道[33−34]分别对不同吸附剂用量、萃取时间、溶液pH、解吸溶剂类型和氯化钠用量进行优化,每个实验重复3次。
吸附剂用量是影响萃取效率的重要参数,吸附剂过少会造成目标物不能被完全吸附,过多会浪费吸附材料。因此实验选取不同质量5.0、10.0、15.0、20.0、40.0、60.0 mg的Fe3O4@G材料进行考察。分别在10 mL空白样品提取液中加入不同量的吸附剂,涡匀振荡吸附20 min后,进行磁分离,HPLC-MS/MS分析上清液。萃取效率按式(2)计算。
R(%)=C0−CvC0×100 (2) 式中:R表示萃取效率,%;C0表示初始时样液中目标物的浓度,μg/L;Cv表示萃取平衡时标曲测得样液中目标物的浓度,μg/L。
充足的萃取时间是形成动态平衡的关键,磁固相萃取是通过质量传递使目标物在溶液与萃取材料之间形成动态平衡的过程。实验分别考察5、10、15、20、40、60 min对萃取效率的影响。准确称取40 mg吸附剂分别加入到10 mL空白样品提取液中,振荡吸附不同时间后,进行磁分离,HPLC-MS/MS分析上清液。萃取效率按式(2)计算。
样品溶液的pH影响吸附剂表面的电荷种类、密度及目标物存在状态有着重要的影响,本实验采用甲酸及氨水溶液调节空白样品溶液pH,考察溶液的pH2、3、4、5、6、7、8、9、10、11、12对有机磷农药萃取回收率的影响。分别准确称取40 mg吸附剂加入到10 mL空白样品提取液中,振荡吸附20 min后,进行磁分离,HPLC-MS/MS分析上清液。萃取效率按式(2)计算。
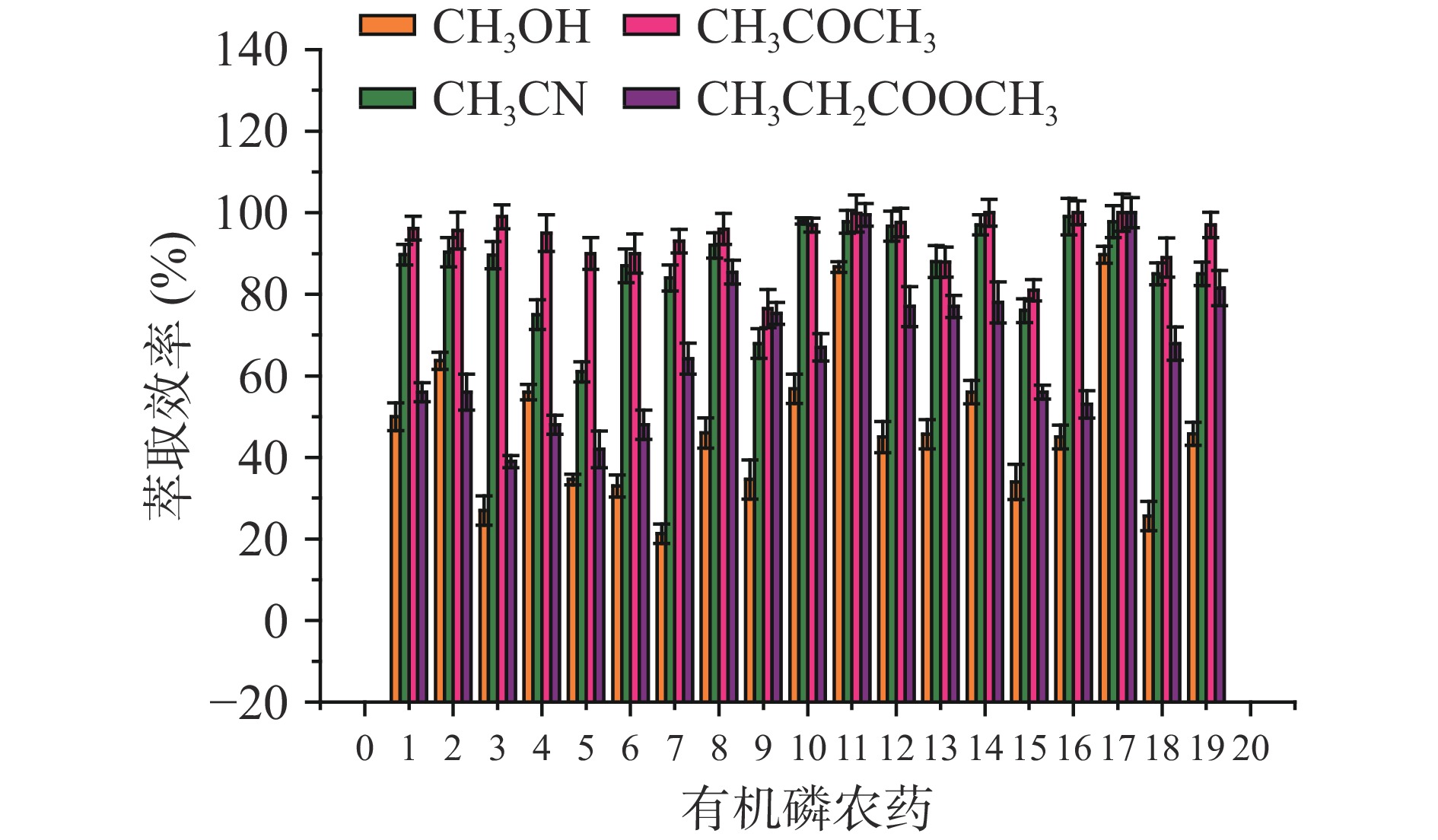
本实验分别考察四种洗脱有机溶剂,即甲醇、乙腈、丙酮和乙酸乙酯对19种有机磷农药的洗脱效果。10 mL空白样品提取液中目标物(固定每种有机磷浓度为50 μg/L)经振荡吸附,磁分离后,弃去上清液,将磁性材料用不同试剂涡旋洗脱,收集全部洗脱液,氮气吹干后,200 μL乙腈-水(1:9,v/v)溶解,供UHPLC-MS/MS分析。萃取效率按式(3)计算。
R(%)=C1×V1C0×V0×100 (3) 式中:R表示萃取效率,%;C0表示初始时样液中目标物的浓度,μg/L;V0表示初始时样液的体积,mL;C1表示解吸后标曲测得样液中目标物的浓度,μg/L;V1表示解吸后样液最终定容体积,mL。
在样品前处理中,氯化钠起到盐析作用,使有机相与水相分离,操江飞等[35]研究表明适量的氯化钠更有利于提高蔬果中有机磷回收率。本实验称取1 g空白绿茶样品,进行加标回收实验,有机磷农药加标水平为100.0 μg/kg,其余前处理步骤按照1.2.3进行,以回收率为指标,考察氯化钠用量为0.5、1.0、2.0、3.0、4.0、5.0 g时对盐析的影响。回收率按式(1)计算。
1.3 方法学考察
本实验用乙腈-水(1:9,v/v)溶液配制5~500 μg/L浓度范围的混合有机磷标准溶液,依据1.2.4色谱-质谱条件进行检测,取不含目标物的空白绿茶样品,按照1.2.3对样品前处理,采用低中高三个水平进行加标实验,加标水平分别为20.0、40.0、200.0 μg/kg(相当于10、20、100 μg/L),每个水平重复6次,
1.4 基质效应评价
实际绿茶样品基质复杂,可能含有大量大分子干扰目标物的测定,因此需要评价该实验的基质效应。基质效应(ME)为空白提取液中目标物的峰面积与标准纯样液中目标物峰面积之比[36]。
1.5 实际绿茶样品分析
为验证本研究建立的方法在实际应用中的可靠性,本方法分析20份绿茶样品,按照GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》[9]与GB 23200.121-2021《食品安全国家标准 植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》中茶叶限量的相关规定[32]进行分析。
1.6 数据处理
Agilent MassHunter Workstation Date Acguisition用于数据采集,Agilent MassHunter Quantitative Analysis用于数据分析。用WPS Office计算数据平均值、标准偏差、回收率及相对标准偏差(RSD),使用Origin 85制图。
2. 结果与分析
2.1 石墨烯和磁性石墨烯的表征
石墨烯磁化前后的形貌如石墨烯图(1a)以及Fe3O4@G图(1b)所示。如图1a所示,石墨烯具有褶皱的薄纱状片层结构,表面暴露大量的活性位点,为农药吸附提供了大量的空间。从图1b可以看出,Fe3O4修饰后的石墨烯的基本结构并没有发生改变,仍以薄纱片状存在。石墨烯表面分布大量粒径约为5~50 nm的Fe3O4纳米粒子,部分纳米粒子稍微有些聚合是由于负载程度已接近饱和的缘故。将Fe3O4纳米粒子修饰在石墨烯上,可能带来以下积极作用:a.Fe3O4是一种常用的MSPE吸附剂,促进吸附行为[28]。b.Fe3O4提供空间位阻,可有效阻止石墨烯堆叠团聚现象,提高石墨烯在水中的分散性[25−27]。c.Fe3O4被石墨烯夹层包围,可有效减少Fe3O4粒子间团聚和被环境溶液腐蚀的可能,有利于维持其磁性。
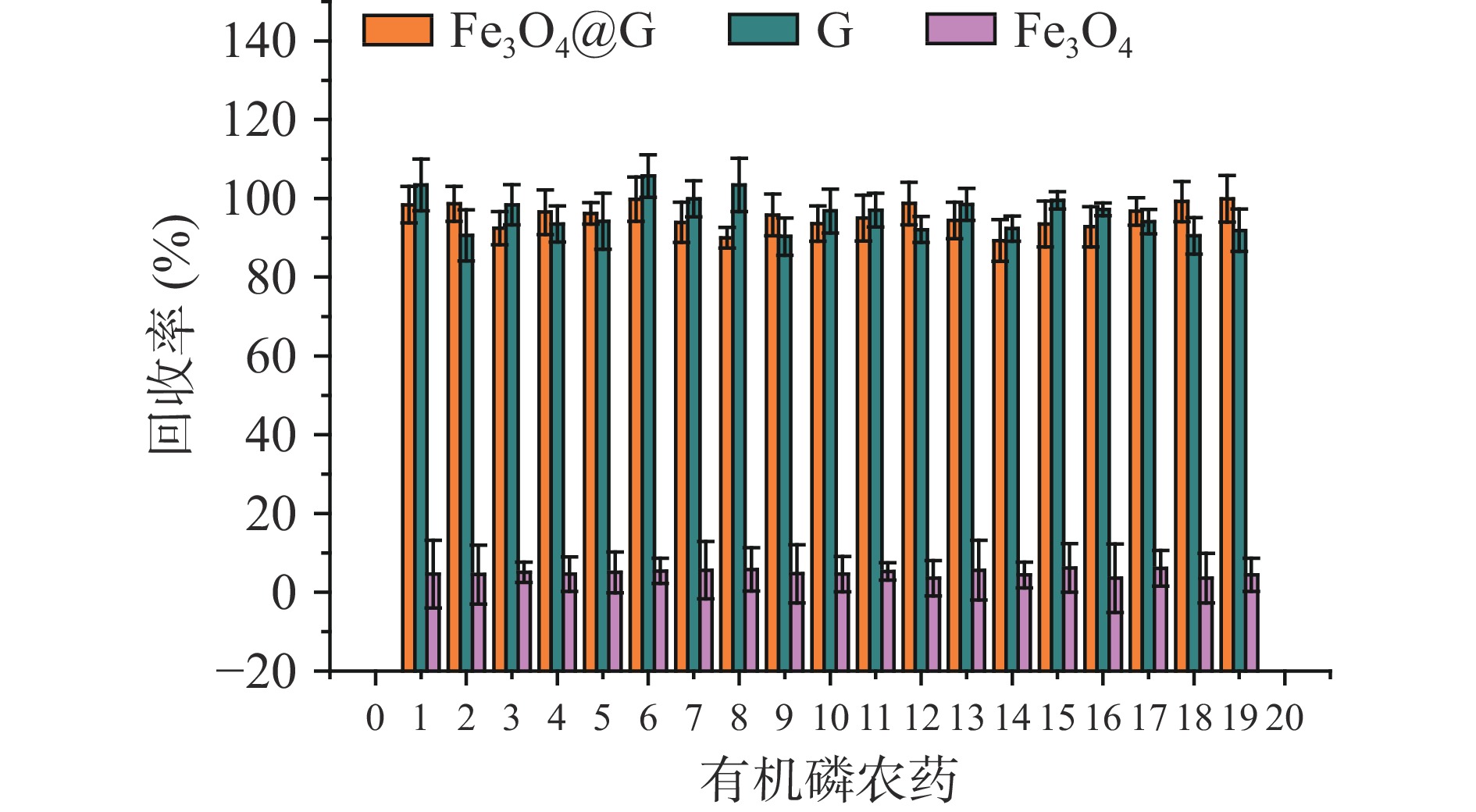
2.2 材料的农药萃取性能测试
图2结果表明,Fe3O4@G、G和Fe3O4对19种有机磷农药的萃取回收率对分别为89.3%~99.9%、92.3%~105.7%和1.2%~16.5%,说明Fe3O4纳米粒子对19种有机磷农药吸附作用较弱,石墨烯与19种有机磷农药之间的吸附作用是萃取过程中的主要作用力。Fe3O4@G对19种有机磷农药在萃取过程中可能产生以下若干相互作用力[28]。首先,石墨烯中每个碳原子都含有一个未成键的π电子,可与含有苯环的目标农药形成π-π共轭体系。其次,上述农药结构中可能含有供电子能力的O、N等,易与Fe3O4@G结构中大π键形成共用电子对,促进其吸附形成。再次,Fe3O4@G结构中含有未被还原的羧基基团,也可与农药中电负性强的原子形成氢键作用力。最后,Fe3O4负载在石墨烯表面,可使Fe3O4@G表面带有羟基基团,可能与目标农药化合物中极性基团形成分子间氢键作用力。
为考察不同批次Fe3O4@G材料吸附性能,实验室对合成3批次材料进行对比,针对19种有机磷种农药的萃取回收率均在80%~95%之间,每种农药的相对标准偏差均低于20%,重复性良好。
2.3 磁性固相萃取条件的优化
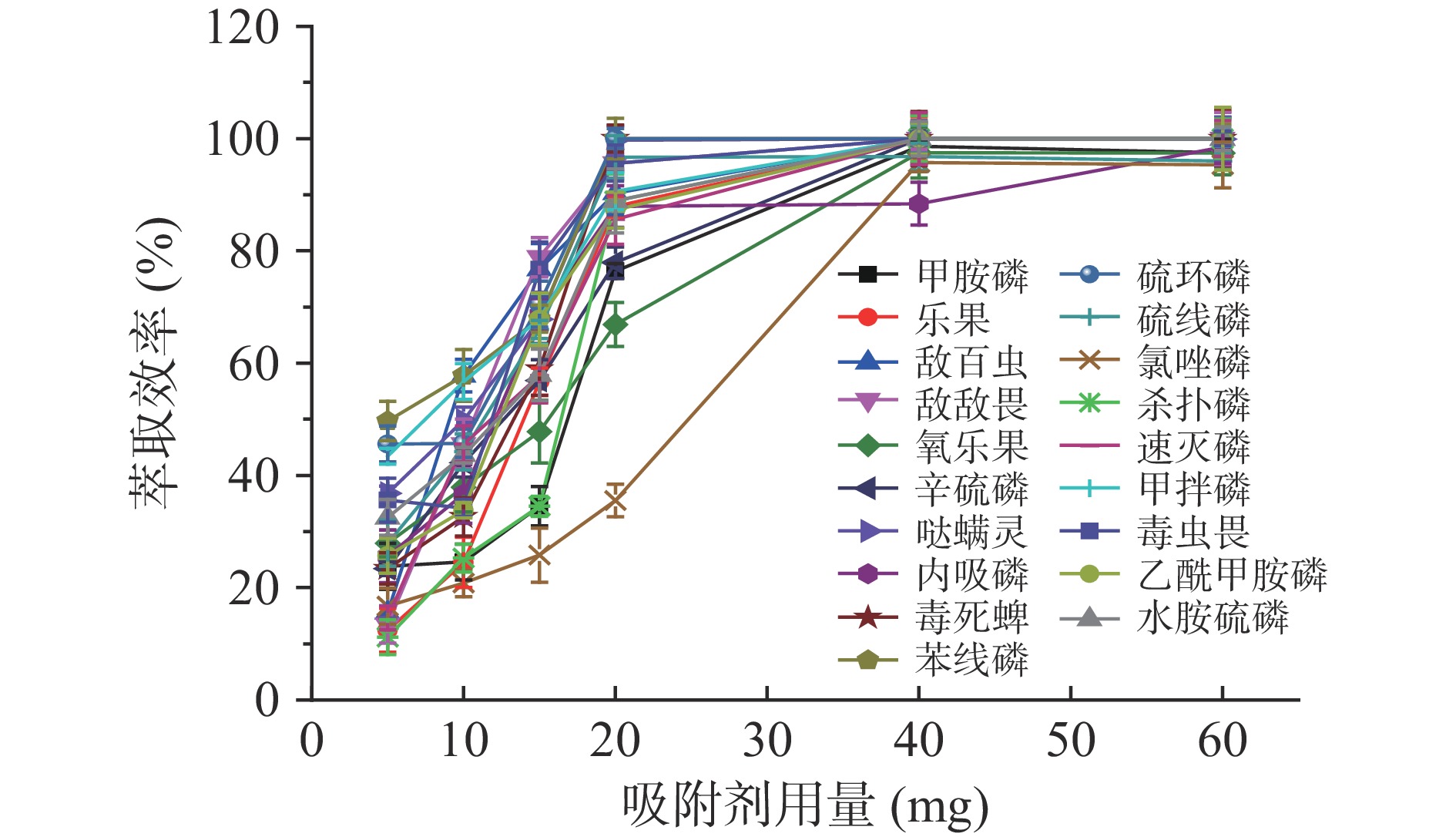
2.3.1 吸附剂用量对吸附效果的影响
如图3所示,当Fe3O4@G用量在5.0~40.0 mg条件下,前期萃取效率随吸附剂用量的增加而快速升高;当继续增加吸附剂用量,萃取效率基本不变。原因是吸附剂的投加量增加了可利用活性位数量,从而促进了有机磷在Fe3O4@G上的吸附行为。其中,哒螨灵、毒死蜱、苯线磷、硫环磷和硫线磷最少用量为20.0 mg,其余最少用量均为40.0 mg。为了保证吸附剂的最佳吸附利用率,实验最终确定Fe3O4@G用量为40.0 mg。
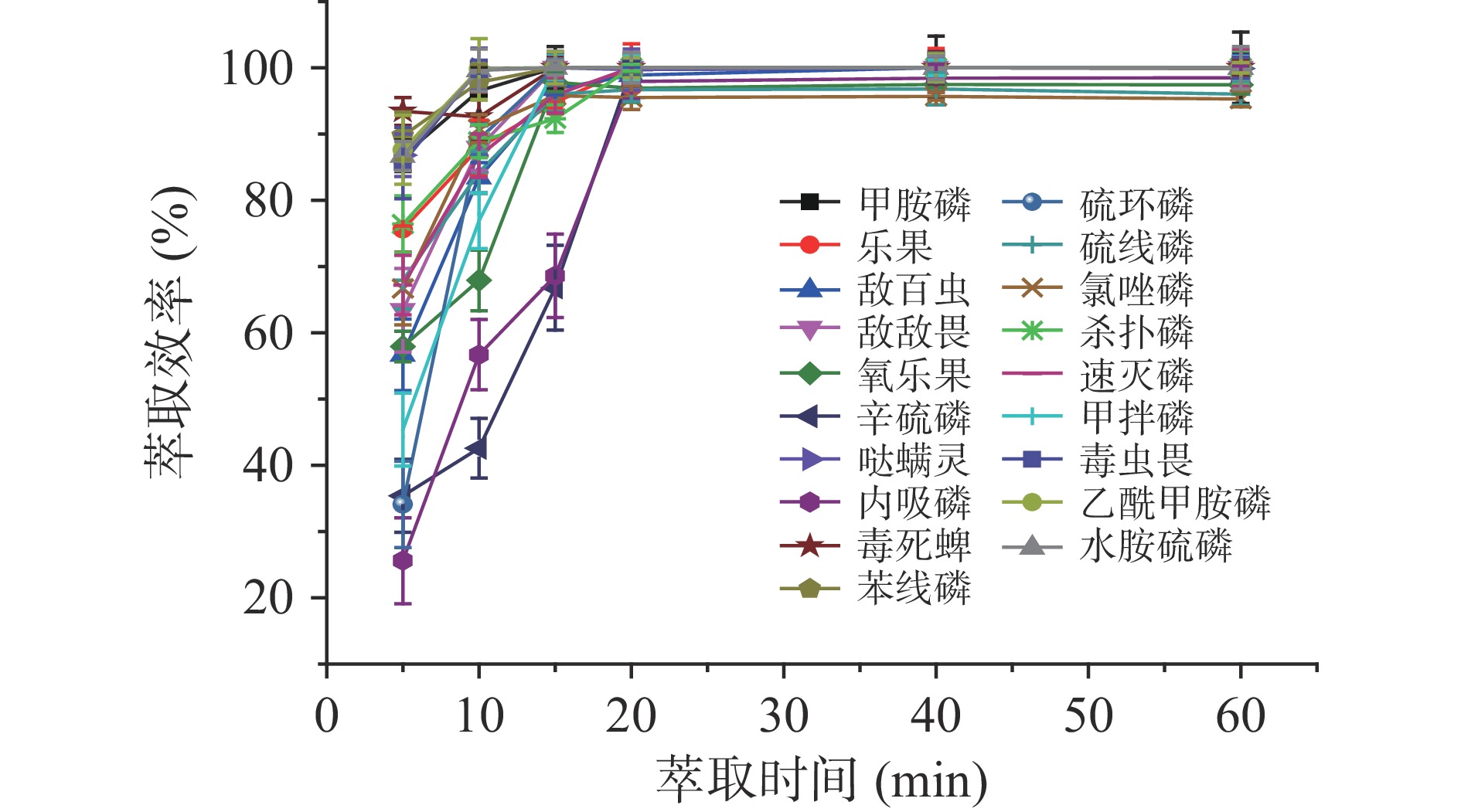
2.3.2 萃取时间对吸附效果的影响
如图4知,在前10 min内,有机磷的萃取效率随着时间延长而快速增加;10 min到20 min,萃取效率随时间缓慢增加;在20 min时,19种有机磷的萃取率达到最大,继续延长吸附时间萃取效率没有明显变化。此现象的原因是在反应初期Fe3O4@G表面有大量未被占据的活性位点,随着反应的进行,剩余可利用的活性位点数量逐渐减少,并且在固液两相中有机磷含量梯度的下降阻碍了Fe3O4@G的进一步吸附,也影响了有机磷向Fe3O4@G表面的扩散。因此,将萃取时间定为20 min。
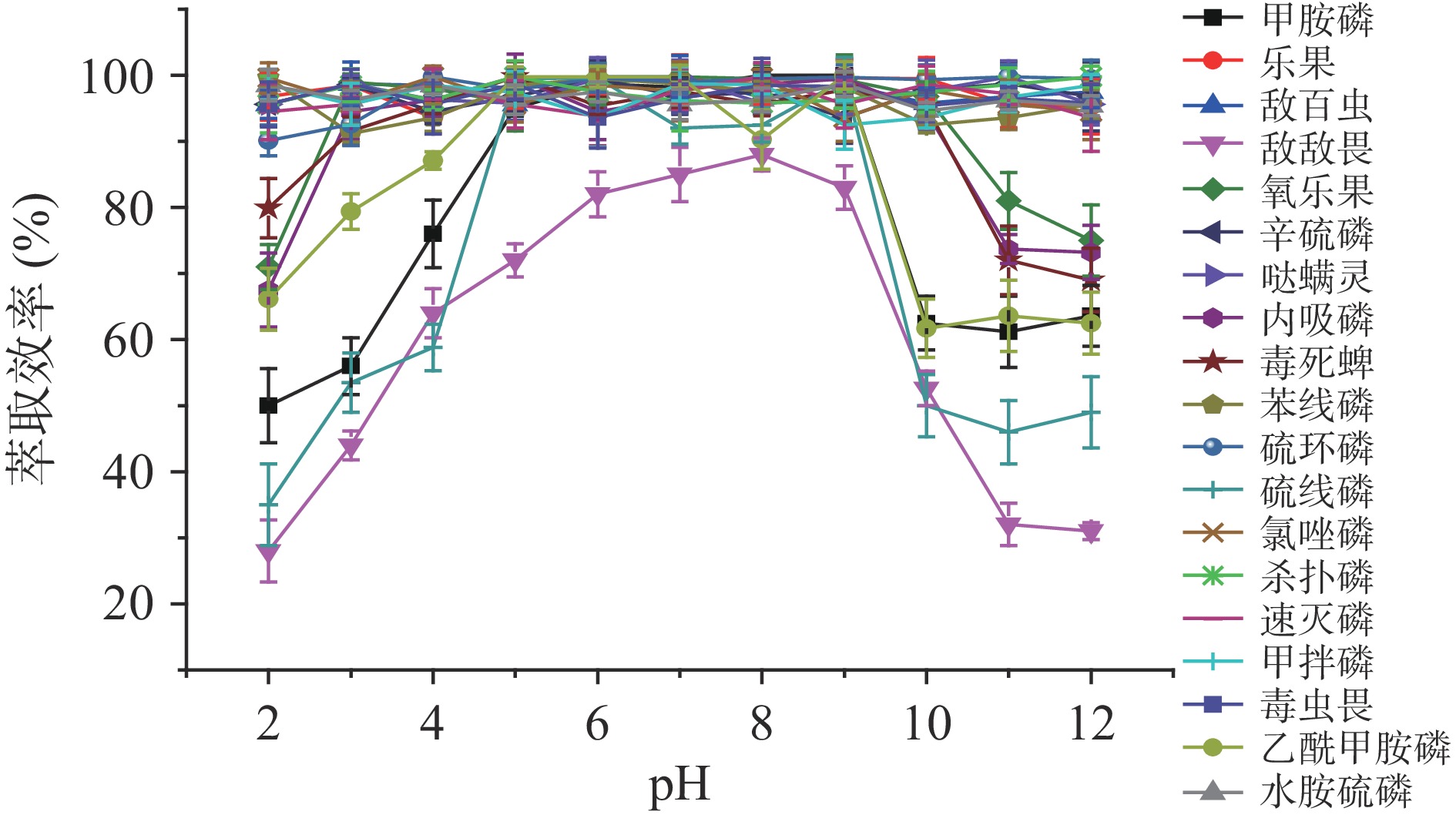
2.3.3 样品溶液pH的影响
本实验选择溶液pH在2~12范围对萃取效率的影响(见图5)。其中,溶液的pH在6~9范围,敌敌畏萃取效率最佳;溶液的pH在5~9范围,甲胺磷、硫线磷和乙酰甲胺磷萃取效率最佳;溶液的pH在3~10范围,氧乐果、内吸磷和毒死蜱萃取效率最佳,其余种类的农药溶液的pH在2~12范围萃取效率均无影响。综上,同时检测绿茶中19种有机磷农药残留时溶液的pH在6~9范围内最佳,绿茶样品经乙腈提取后采用乙腈-水(1:9,v/v)复溶,pH在7.0左右,利于19种有机磷农药的同时萃取,此pH下萃取效率为92.0%~99.8%。与此同时,考虑到实验操作的简便性,本实验无须调节溶液的pH。
2.3.4 洗脱剂的选择
从图6可以看出,丙酮和乙腈对19种目标农药的洗脱效果更佳,乙酸乙酯次之,甲醇相对较差。原因是丙酮沸点低,有机磷的沸点相对较高,萃取吹干过程中沸点低的物质能很好保护沸点高的物质[37]。同时,丙酮可使有机磷更好的溶解,选择丙酮不仅节约氮吹时间,且使有机磷在萃取吹干的过程中损失率降到最低[38],因此选取丙酮作为洗脱剂。
为将目标分析物从复合物中完全解吸出来,本文优化了洗脱溶剂量,选取丙酮体积分别为1.0、2.0、3.0、5.0、10.0 mL。结果表明当用3.0 mL(1.0 mL×3)丙酮,洗脱复合物时,分析物能被完全解吸。因此选择3.0 mL丙酮分3次解吸每次1.0 mL。
2.4 氯化钠用量的选择
结果表明,氯化钠用量0.5~1.0 g时,氯化钠全部溶解于水中,水相与乙腈相不分离;当氯化钠用量1.0~4.0 g时,氯化钠全部溶解于水中,水相与乙腈相开始分层,并且随着氯化钠用量的增加,上层分离出的乙腈相增多。由图7知,当氯化钠用量1.0 g时,有机磷回收率只有12.3%~35.6%,当氯化钠用量4.0 g时,有机磷回收率在85.8%~95.3%范围;氯化钠用量为4.0~5.0 g时,氯化钠没有全部溶解,有机磷的回收率基本维持不变。由于氯化钠用量4.0 g时,整体回收率均优于氯化钠用量1.0 g时的回收率,故选择氯化钠用量为4.0 g。
2.5 Fe3O4@G的重复使用性
为了研究Fe3O4@G吸附剂的重复使用性,按1.2.6萃取性能测试条件将解吸后的吸附剂重复于有机磷农药的磁性固相萃取实验中,结果表明吸附剂在重复使用15次之后,Fe3O4@G对19种目标农药依然保持良好的萃取能力。
2.6 方法学考察
19种目标农药线性相关系数均大于0.999。19种目标农药的LOD(S/N=3)为5.0~6.0 μg/kg,LOQ(S/N=10)在15.0~20.0 μg/kg之间,平均回收率在61.2%~94.9%之间,相对标准偏差RSD(n=6)在2.6%~10.2%之间。由此表明Fe3O4@G用于绿茶中19中农药精密度良好,准确度高。具体见表3。
表 3 绿茶中19种农药的线性范围、平均回收率与精密度Table 3. Linear range, average recoveries and relative standard deviation (RSD) of 19 target pesticides in green tea化合物 线性
范围
(μg/L)添加
水平
(μg/kg)回收率
(%)RSD
(%)
(n=6)MEs
(n=3)线性
相关
系数LOD
(μg/kg)LOQ
(μg/kg)化合物 线性
范围
(μg/L)添加
水平
(μg/kg)回收率
(%)RSD
(%)
(n=6)MEs
(n=3)线性
相关
系数LOD
(μg/kg)LOQ
(μg/kg)甲胺磷 5~500 20 68.9 10.2 0.81 0.9994 5.0 15.0 硫环磷 5~500 20 65.2 8.6 0.85 0.9999 5.0 15.0 40 73.6 8.0 0.88 40 70.9 8.1 0.92 200 85.7 7.4 0.93 200 82.4 5.0 0.95 乐果 20 64.5 9.8 0.88 0.9999 5.0 15.0 硫线磷 20 62.8 6.9 0.85 0.999 5.0 15.0 40 78.3 8.2 0.95 40 73.1 6.2 0.88 200 85.9 6.5 0.96 200 85.4 5.2 0.96 敌百虫 5~500 20 66.4 9.8 0.82 0.9992 6.0 20.0 氯唑磷 5~500 20 61.6 7.8 0.81 0.9995 5.0 15.0 40 73.6 7.2 0.85 40 65.8 6.4 0.83 200 88.0 5.4 0.88 200 80.8 2.6 0.92 敌敌畏 20 81.0 9.8 0.82 0.9993 5.0 15.0 杀扑磷 20 64.9 7.5 0.84 0.9991 5.0 15.0 40 77.6 7.9 0.82 40 74.6 7.3 0.89 200 84.3 5.2 0.98 200 92.8 2.6 0.98 氧乐果 20 67.8 8.5 0.88 0.9992 5.0 15.0 速灭磷 20 65.1 7.3 0.85 0.9993 5.0 15.0 40 76.9 7.1 0.89 40 74.0 6.8 0.92 200 94.3 3.5 0.92 200 94.6 3.7 0.95 辛硫磷 20 73.2 8.8 0.85 0.9995 5.0 15.0 甲拌磷 20 72.5 6.3 0.85 0.9994 5.0 15.0 40 83.5 5.4 0.87 40 88.1 5.2 0.90 200 94.3 4.8 0.94 200 94.9 4.2 0.92 哒螨灵 20 62.1 9.2 0.80 0.9996 5.0 15.0 毒虫畏 20 62.4 7.8 0.81 0.9995 5.0 15.0 40 70.7 7.4 0.82 40 78.4 8.3 0.88 200 85.6 6.0 0.90 200 93.5 3.4 0.89 内吸磷 20 74.3 8.8 0.82 0.9994 5.0 15.0 乙酰
甲胺磷20 68.6 7.6 0.83 0.9996 5.0 15.0 40 79.2 7.4 0.85 40 74.9 7.9 0.87 200 93.7 4.1 0.88 200 88.5 4.2 0.95 毒死蜱 20 61.2 9.5 0.89 0.9997 6.0 20.0 水胺硫磷 20 68.2 8.8 0.84 1.000 5.0 15.0 40 69.8 7.5 0.91 40 75.5 7.1 0.90 200 84.6 4.8 0.99 200 85.1 3.2 0.95 苯线磷 20 63.5 7.8 0.83 1.000 5.0 15.0 40 68.9 6.5 0.90 200 83.7 3.2 0.99 2.7 基质效应评价
基质效应比较结果如表3所示,基质中添加三个水平,每个水平重复三次。结果表明,19 种目标农药在空白绿茶基质中的ME为0.81~0.99之间,为弱基质抑制效应,因此,本实验可选用溶剂标准溶液外标法进行定量分析。
2.8 实际绿茶样品分析
经分析,在1份样品中检测到辛硫磷残留,含量为0. 04 mg/kg;在1份样品中检测到哒螨灵残留,含量为0.05 mg/kg;在1份样品中检测到氧乐果残留,含量为0.025 mg/kg;在1份样品中检测到毒虫畏残留,含量为0.02 mg/kg;在1份样品中检测到毒死蜱残留,含量为0.038 mg/kg。其他样品均未检测到上述19种农药残留。
3. 结论
本文采用化学共沉淀法合成磁性石墨烯Fe3O4@G并成功将其应用于分离富集绿茶中19种有机磷农药。本实验最佳前处理条件为:复合物用量为40 mg;萃取时间为20 min;氯化钠用量为4 g;洗脱剂为丙酮,洗脱剂用量为3 mL。在最优条件下,方法线性相关系数均大于0.999,19种有机磷农药的LOD为5.0~6.0 μg/kg,LOQ为15.0~20.0 μg/kg,连续6次重复操作所得相对标准偏差RSD在2.6%~10.2%之间,在实际样品中有较高的回收率。该方法前处理简单,有机溶剂用量少,适用范围广,材料可重复利用。该技术在复杂样品基质以及极性污染物的富集分离中有很好的参考价值。磁固相萃取是一种新型的样品前处理技术,在本实验中尚存在难以解决的问题:a.需要研究更简便的Fe3O4@G合成技术;b.尽可能降低本实验的检出限以提高检测准确性与灵敏度。
-
表 1 19种有机磷农药梯度洗脱程序
Table 1 Gradient elution procedures for 19 organophosphorus pesticides
时间(min) 流速(mL/min) VA(%) VB(%) 0 0.3 97.0 3.0 1 0.3 97.0 3.0 1.5 0.3 85.0 15.0 2.5 0.3 50.0 50.0 18 0.3 30.0 70.0 23 0.3 2.0 98.0 27 0.3 2.0 98.0 27.1 0.3 97.0 3.0 30 0.3 97.0 3.0 注:VA、VB分别为流动相A、B的体积比。 表 2 19种有机磷农药多反应监测模式参数
Table 2 Multiple- reaction monitoring (MRM) parameters for 19 organophosphorus pesticides
化合物 电离
模式驻留时
间(min)母离子
(m/z)子离子
(m/z)碎裂电
压
(V)碰撞能
量(eV)甲胺磷 ESI+ 2.58 142 125* 80 10 94 80 15 乐果 ESI+ 4.04 230 199* 80 5 171 80 10 敌百虫 ESI+ 4.06 257 221* 120 10 109 120 20 敌敌畏 ESI+ 5.27 221 145* 120 15 109 120 25 氧乐果 ESI+ 3.14 214.1 183* 80 5 125 80 20 辛硫磷 ESI+ 17.55 299 129* 80 20 97 80 30 哒螨灵 ESI+ 22.77 365 309* 95 10 147 95 25 内吸磷 ESI+ 8.92 259.1 89* 100 10 61 100 35 毒死蜱 ESI+ 21.52 350 198* 100 15 97.1 100 30 苯线磷 ESI+ 14.78 304.1 217* 140 5 202 140 10 硫环磷 ESI+ 4.49 256 228* 100 10 140 100 25 硫线磷 ESI+ 18.56 271 159.1* 80 18 131 80 34 氯唑磷 ESI+ 11.67 314.1 162.1* 100 15 120 100 20 杀扑磷 ESI+ 7.98 303.1 145* 80 5 85 80 15 速灭磷 ESI+ 4.03 225 193* 80 15 127 80 25 甲拌磷 ESI+ 16.8 261.1 199* 70 10 75 70 10 毒虫畏 ESI+ 16.41 359.1 155* 120 10 127 120 15 乙酰甲胺磷 ESI+ 2.95 184 143* 80 5 125 80 15 水胺硫磷 ESI+ 7.66 231 121* 100 15 109 100 25 注:*表示定量离子。 表 3 绿茶中19种农药的线性范围、平均回收率与精密度
Table 3 Linear range, average recoveries and relative standard deviation (RSD) of 19 target pesticides in green tea
化合物 线性
范围
(μg/L)添加
水平
(μg/kg)回收率
(%)RSD
(%)
(n=6)MEs
(n=3)线性
相关
系数LOD
(μg/kg)LOQ
(μg/kg)化合物 线性
范围
(μg/L)添加
水平
(μg/kg)回收率
(%)RSD
(%)
(n=6)MEs
(n=3)线性
相关
系数LOD
(μg/kg)LOQ
(μg/kg)甲胺磷 5~500 20 68.9 10.2 0.81 0.9994 5.0 15.0 硫环磷 5~500 20 65.2 8.6 0.85 0.9999 5.0 15.0 40 73.6 8.0 0.88 40 70.9 8.1 0.92 200 85.7 7.4 0.93 200 82.4 5.0 0.95 乐果 20 64.5 9.8 0.88 0.9999 5.0 15.0 硫线磷 20 62.8 6.9 0.85 0.999 5.0 15.0 40 78.3 8.2 0.95 40 73.1 6.2 0.88 200 85.9 6.5 0.96 200 85.4 5.2 0.96 敌百虫 5~500 20 66.4 9.8 0.82 0.9992 6.0 20.0 氯唑磷 5~500 20 61.6 7.8 0.81 0.9995 5.0 15.0 40 73.6 7.2 0.85 40 65.8 6.4 0.83 200 88.0 5.4 0.88 200 80.8 2.6 0.92 敌敌畏 20 81.0 9.8 0.82 0.9993 5.0 15.0 杀扑磷 20 64.9 7.5 0.84 0.9991 5.0 15.0 40 77.6 7.9 0.82 40 74.6 7.3 0.89 200 84.3 5.2 0.98 200 92.8 2.6 0.98 氧乐果 20 67.8 8.5 0.88 0.9992 5.0 15.0 速灭磷 20 65.1 7.3 0.85 0.9993 5.0 15.0 40 76.9 7.1 0.89 40 74.0 6.8 0.92 200 94.3 3.5 0.92 200 94.6 3.7 0.95 辛硫磷 20 73.2 8.8 0.85 0.9995 5.0 15.0 甲拌磷 20 72.5 6.3 0.85 0.9994 5.0 15.0 40 83.5 5.4 0.87 40 88.1 5.2 0.90 200 94.3 4.8 0.94 200 94.9 4.2 0.92 哒螨灵 20 62.1 9.2 0.80 0.9996 5.0 15.0 毒虫畏 20 62.4 7.8 0.81 0.9995 5.0 15.0 40 70.7 7.4 0.82 40 78.4 8.3 0.88 200 85.6 6.0 0.90 200 93.5 3.4 0.89 内吸磷 20 74.3 8.8 0.82 0.9994 5.0 15.0 乙酰
甲胺磷20 68.6 7.6 0.83 0.9996 5.0 15.0 40 79.2 7.4 0.85 40 74.9 7.9 0.87 200 93.7 4.1 0.88 200 88.5 4.2 0.95 毒死蜱 20 61.2 9.5 0.89 0.9997 6.0 20.0 水胺硫磷 20 68.2 8.8 0.84 1.000 5.0 15.0 40 69.8 7.5 0.91 40 75.5 7.1 0.90 200 84.6 4.8 0.99 200 85.1 3.2 0.95 苯线磷 20 63.5 7.8 0.83 1.000 5.0 15.0 40 68.9 6.5 0.90 200 83.7 3.2 0.99 -
[1] NARENDERAN S T, MEYYANATHAN S N, BABU B. Review of pesticide residue analysis in fruits and vegetables pre-treatment, extraction and detection techniques[J]. Food Research International,2020,133:109141. doi: 10.1016/j.foodres.2020.109141
[2] 赵广西, 刘志梅. 磁性石墨烯分散固相萃取测定水果中多种农药的残留量[J]. 食品安全导刊,2021,56(24):104−106. [ZHAO G X, LIU Z M. Determination of pesticide residues in fruit by magnetic graphene dispersed solid phase extraction[J]. China Food Safety,2021,56(24):104−106. doi: 10.16043/j.cnki.cfs.2021.24.056 ZHAO G X, LIU Z M . Determination of pesticide residues in fruit by magnetic graphene dispersed solid phase extraction[J]. China Food Safety,2021 ,56 (24 ):104 −106 . doi: 10.16043/j.cnki.cfs.2021.24.056[3] 朱凤, 丁荣, 徐浩, 等. 三维石墨烯金属网固相萃取测定有机磷农药残留[J]. 分析测试技术与仪器,2021,27(3):149−157. [ZHU F, DING R, XU H, et al. Three-dimensional graphene-based stainless-steel mesh as solid-phase extraction material for determination of organophosphorus pesticides[J]. Analy and Testing Eechnilogy and Instruments,2021,27(3):149−157. ZHU F, DING R, XU H, et al . Three-dimensional graphene-based stainless-steel mesh as solid-phase extraction material for determination of organophosphorus pesticides[J]. Analy and Testing Eechnilogy and Instruments,2021 ,27 (3 ):149 −157 .[4] 富利祥, 卓晓聪, 徐峰, 等. 测定人血中有机磷农药[J]. 中国法医学杂质,2022,37(6):565−570. [FU L X, ZHUO X C, XU F, et al. Determination of organophosphorus pesticides in human blood[J]. Chinese Journal of Forensic Medicine,2022,37(6):565−570. FU L X, ZHUO X C, XU F, et al . Determination of organophosphorus pesticides in human blood[J]. Chinese Journal of Forensic Medicine,2022 ,37 (6 ):565 −570 .[5] TEODORO M, BRIGUGLIO G, FENGA C, et al. Genetic polymorphisms as determinants of pesticide toxicity:Recent advances[J]. Toxicology Reports,2019,6:564−570. doi: 10.1016/j.toxrep.2019.06.004
[6] 吴肖肖, 梅秀明, 蒋迪尧, 等. 碳纳米材料在有机磷农药检测样品前处理中的应用研究进展[J]. 食品科技,2022,47(3):318−323. [WU X X, MEI X M, JIANG D Y, et al. Progress on application of carbon nanomaterials in sample pretreatment for organophosphorus pesticide detection[J]. Food Science and Technology,2022,47(3):318−323. doi: 10.3969/j.issn.1005-9989.2022.3.spkj202203046 WU X X, MEI X M, JIANG D Y, et al . Progress on application of carbon nanomaterials in sample pretreatment for organophosphorus pesticide detection[J]. Food Science and Technology,2022 ,47 (3 ):318 −323 . doi: 10.3969/j.issn.1005-9989.2022.3.spkj202203046[7] 张玉琪, 张瑾如, 王锋, 等. 对硫磷纳米抗体筛选及分子识别机制研究[J]. 分析化学,2019,47(9):1419−1428. [ZHANG Y Q, ZHANG J R, WANG F, et al. Selection of nanobody and recognition mechanism between nanobody and parathion[J]. Chinese Journal of Analytical Chemistry,2019,47(9):1419−1428. ZHANG Y Q, ZHANG J R, WANG F, et al . Selection of nanobody and recognition mechanism between nanobody and parathion[J]. Chinese Journal of Analytical Chemistry,2019 ,47 (9 ):1419 −1428 .[8] 冯春, 石志红, 吴兴强, 等. 加速溶剂萃取结合气相色谱三重四极杆质谱测定枸杞中有机磷农药多残留[J]. 分析测试学报,2019,38(4):417−422. [FENG C, SHI Z H, WU X Q, et al. Determination of organophosphorus pesticide residues in chinese wolfberry by gas chromatography-triple quadrupole mass spectrometry with accelerated solvent extraction[J]. Journal of Instrumental Analysis,2019,38(4):417−422. FENG C, SHI Z H, WU X Q, et al . Determination of organophosphorus pesticide residues in chinese wolfberry by gas chromatography-triple quadrupole mass spectrometry with accelerated solvent extraction[J]. Journal of Instrumental Analysis,2019 ,38 (4 ):417 −422 .[9] 中华人民共和国国家卫生和计划生育委员会, 中华人民共和国农业部, 国家食品药品监督管理总局. GB 2763-2021 食品安全国家标准 食品中农药最大残留限量[S]. 北京:中国标准出版社, 2021. [National Health and Family Planning Commission, People's Republic of China, Ministry of Agriculture of the People's Republic of China, State Food and Drug Administration. GB 2763-2021 National food safety standard-maximum residue limits for pesticides in food[S]. Beijing:China Standards Press, 2021. National Health and Family Planning Commission, People's Republic of China, Ministry of Agriculture of the People's Republic of China, State Food and Drug Administration. GB 2763-2021 National food safety standard-maximum residue limits for pesticides in food[S]. Beijing: China Standards Press, 2021.
[10] 丁浩东, 万红友, 秦攀, 等. 环境中有机磷农药污染状况、来源及风险评价[J]. 环境化学, 2019, 38(3):463−479. [DING H D, WAN H Y, QIN P, et al. Pollution status, sources and risk assessment of organophosphorus pesticides in the environment[J]. Environmental Chemistry, 2019, 38(3):463-479. [11] AZZOUZ A, KAILASA S K, IEE S S, et al. Review of nanomaterials as sorbents in solid-phase extraction for environmental samples[J]. TrAC Trends in Analytical Chemistry,2018,108:347−369. doi: 10.1016/j.trac.2018.08.009
[12] AMIRI A, TAYEBEE R, ABDAR A, et al. Synthesis of a zinc-based metal-organic framework with histamine as an organic linker for the dispersive solid-phase extraction of organophosphorus pesticides in water and fruit juice samples[J]. Journal of Chomatography A,2019,1597:39−45.
[13] PANG L, IANG P J, PANG R, et al. Ionogel-based ionic liquid coating for solid-phase microextraction of organophos-phorus pesticides from wine and juice samples[J]. Food Analytical Methods,2018,11(1):270−281.
[14] JIA C H, ZHUX D, WANG J H, et al. Combination of dispersive solid-phase extraction and salting-out homogeneous liquid-iquid extraction for the determination of organophosphorus pesticides in cereal grains[J]. Journal of Separation Science,2014,37(14):1862−1866. doi: 10.1002/jssc.201400251
[15] CHEN B, WU F Q, WU W D, et al. Determination of 27 pesticides in wine by dispersive liquid-liquid microextraction and gas chomatography-mass spectrometry[J]. Microchemical Journal,2016,126:415−422. doi: 10.1016/j.microc.2015.11.003
[16] CACHO J I, CAMPIILO N, VIÑAS P, et al. In situ ionic liquid dispersive liquid-liquid microextraction coupled togas chromatography-mass spectrometry for the determination of organophosphorus pesticides[J]. Journal of Chromatography A,2018,1559:95−101. doi: 10.1016/j.chroma.2017.12.059
[17] MAO X J, YAN A P, WANY Q, et al. Dispersive solid-phase extraction using micmpomus sorbent UiO-66 coupled to gas chromatography tandem mass spectrometry:A QuEChERS type method for the determination of organophosphorus pesticide residues in edible vegetable oils without matrix interfernce[J]. Journal of Agricultural and Food Chemistry,2019,67(6):1760−1770. doi: 10.1021/acs.jafc.8b04980
[18] 古飞燕, 邹玉婷, 段宁馨, 等. 茶叶中有机磷农药残留检测前处理技术的研究进展[J]. 食品科技,2022,47(4):335−442. [Gu F Y, ZHOU Y T, DUAN N X, et al. Research progress on pretreatment technology of detecting organophosphorus pesticides in tea[J]. Food Science and Technology,2022,47(4):335−442. Gu F Y, ZHOU Y T, DUAN N X, et al . Research progress on pretreatment technology of detecting organophosphorus pesticides in tea[J]. Food Science and Technology,2022 ,47 (4 ):335 −442 .[19] ASFARAM A, DIL E A, ARABKHANI P, et al. Magnetic Cu:CuO-GO nanocomposite for efficient dispersive micro-solid phase extraction of polycyclic aromatic hydrocarbons from vegetable, fruit, and environmental water samples by liquid chromatographic determination[J]. Talanta,2020,218:121131. doi: 10.1016/j.talanta.2020.121131
[20] HE X Q, CUI Y Y, ZHANG Y, et al. Fabrication of magnetic polydopamine@naphthyl microporous organic network nanosphere for efficient extraction of hydroxylated polycyclic aromatic hydrocarbons and p-nitrophenol from wastewater samples[J]. Journal of Chromatography A,2021,1651:462347. doi: 10.1016/j.chroma.2021.462347
[21] 彭俊标, 马晓国, 陈圆. 聚乙烯亚胺修饰磁性纳米材料固相萃取-火焰原子吸收光谱法测定水样中痕量Mo(VI)[J]. 分析测试学报,2021,40(6):960−964. [PENG J B, MA X G, CHEN Y. Determination of trace Mo(VI) in water samples by flame atomic absorption spectrometry with poly ethyleneimine modified magnetic nanomaterials based solid phase extraction[J]. Journal of Instrumental Analysis,2021,40(6):960−964. PENG J B, MA X G, CHEN Y . Determination of trace Mo(VI) in water samples by flame atomic absorption spectrometry with poly ethyleneimine modified magnetic nanomaterials based solid phase extraction[J]. Journal of Instrumental Analysis,2021 ,40 (6 ):960 −964 .[22] CAI K Q, ZHENG M X, XU H, et al. Gellan gum/graphene oxide aerogels for methylene blue purification[J]. Carbohydrate Polymers,2021,257:117624. doi: 10.1016/j.carbpol.2021.117624
[23] ZHAN W W, ZHU M, LAN J L, et al. Sb2S3@nitrogen-doped carbon coaxial nanotubes uniformly encapsulated with in 3D porous graphene aerogel for fast and stable sodium storage[J]. Chemical Engineering Journal,2021,408:128007. doi: 10.1016/j.cej.2020.128007
[24] WU Q, WU W, ZHAN X X, et al. Three-dimensional chitosan/graphene oxide aerogel for high efficiency solid-phase extraction of acidic herbicides in vegetables[J]. New Journal of Chemistry,2020,44(25):10654−10661. doi: 10.1039/D0NJ01960G
[25] 汤振华, 阅都盛. 四氧化三铁/还原氧化石墨烯合成及其在有机磷农药检测中应用研究[J]. 食品工业科技,2014,21(57):306−315. [TANG Z H, YUE D S. Synthesis of Fe3O4/reduced graphene oxide and its application in the determination of organophosphorus pesticide[J]. Science and Technology of Food Industry,2014,21(57):306−315. TANG Z H, YUE D S . Synthesis of Fe3O4/reduced graphene oxide and its application in the determination of organophosphorus pesticide[J]. Science and Technology of Food Industry,2014 ,21 (57 ):306 −315 .[26] 何晓明, 余鹏飞, 陈可, 等. 磁性石墨烯/ β-环糊精复合材料固相萃取-HPLC-MS/MS法检测饲料中的6中镇静剂和5种 β-受体激动剂[J]. 江苏农业科学,2019,47(24):188−193. [HE X M, YU P F, CHEN K, et al. Determination of 6 sedatives and 5 β-agonists in feed by magnetic graphene/ β-cyclodextrin composite solid phase extraction-HPLC-MS/MS method[J]. Jiangsu Agricultural Sciences,2019,47(24):188−193. HE X M, YU P F, CHEN K, et al . Determination of 6 sedatives and 5β-agonists in feed by magnetic graphene/β-cyclodextrin composite solid phase extraction-HPLC-MS/MS method[J]. Jiangsu Agricultural Sciences,2019 ,47 (24 ):188 −193 .[27] 白云, 李琴梅, 刘奕忍, 等. 石墨烯材料表面含氧官能团的表征研究[J]. 分析仪器,2020(4):83−88 [BAI Y, LI Q M, LIU Y R, et al. Analysis of oxygencontaining functional groups on the surface of graphene material[J]. Analytical Instrumentation,2020(4):83−88. BAI Y, LI Q M, LIU Y R, et al . Analysis of oxygencontaining functional groups on the surface of graphene material[J]. Analytical Instrumentation,2020 (4 ):83 −88 .[28] 董婵婵, 胡艳云, 吕亚宁, 等. 磁性石墨烯分散微固相萃取-液相色谱-四极杆串联质谱法测定畜禽肉中9 种非甾体抗炎剂[J]. 色谱,2016,34(9):850−859. [DONG C C, HU Y Y, LÜ Y N, et al. Magnetic graphene based dispersive micro -solid-phase extractioncoupled with liquid chromatography-tandemquadrupole mass spectrometry for the analysis of nine non steroidal anti-inflammatory drugs in livestock andpoultry meat[J]. Chinese Journal of Chromatography,2016,34(9):850−859. doi: 10.3724/SP.J.1123.2016.04039 DONG C C, HU Y Y, LÜ Y N, et al . Magnetic graphene based dispersive micro -solid-phase extractioncoupled with liquid chromatography-tandemquadrupole mass spectrometry for the analysis of nine non steroidal anti-inflammatory drugs in livestock andpoultry meat[J]. Chinese Journal of Chromatography,2016 ,34 (9 ):850 −859 . doi: 10.3724/SP.J.1123.2016.04039[29] HUMMER JR W S, OFFEMAN R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society,1958,80(6):1339. doi: 10.1021/ja01539a017
[30] YANG H F, LI F H, SHAN C S. Covalent functionalization of chemically converted graphene sheets via silane and its reinforcement[J]. Journal of Materials Chemistry,2009,19(26):4632−4638. doi: 10.1039/b901421g
[31] ZHAO Y B, QIU Z M, HUANG J Y. Preparation and analysis of Fe3O4 magnetic nanoparticles used as targeted-drug carriers[J]. Chinese Journal of Chemical Engineering,2008,16(3):451−455. doi: 10.1016/S1004-9541(08)60104-4
[32] 国家卫生健康委员会, 农业农村部, 国家市场监督管理总局. GB 23200.121-2021 《食品安全国家标准 植物源性食品中331种农药及其代谢物残留量的测定 液相色谱-质谱联用法》[S]. 北京:中国标准出版社, 2021. [National Health Commission, Ministry of Agriculture and Rural Affairs, State Administration for Market Supervision and Administration. GB 23200.121-2021 National food safety standard Determination of 331 pesticides and metabolites residues in foods of plant origin-liquid chromatography-tandem mass spectrometry method[S]. Beijing:China Standards Press, 2021. National Health Commission, Ministry of Agriculture and Rural Affairs, State Administration for Market Supervision and Administration. GB 23200.121-2021 National food safety standard Determination of 331 pesticides and metabolites residues in foods of plant origin-liquid chromatography-tandem mass spectrometry method[S]. Beijing: China Standards Press, 2021.
[33] 刘丽文, 李炳志, 曹晓林, 等. 基于金属有机骨架的磁固相萃取-高效液相色谱串联质谱法测定环境水样中的有机磷农药[J]. 烟台大学学报(自然科学与工程版),2022,35(1):19−27. [LIU L W, LI B Z, CAO X L, et al. Determination of organophosphorus pesticides in environmental water samples by high performance liquid chromatography-tandem mass spectrometry with magnetic solid phase extraction based on metal-organic frame works[J]. Jourmal of Yantai University ( Natural Science and Engineering Edition),2022,35(1):19−27. LIU L W, LI B Z, CAO X L, et al . Determination of organophosphorus pesticides in environmental water samples by high performance liquid chromatography-tandem mass spectrometry with magnetic solid phase extraction based on metal-organic frame works[J]. Jourmal of Yantai University ( Natural Science and Engineering Edition),2022 ,35 (1 ):19 −27 .[34] AFKHAMI A, MOOSAVI R. Cloud point extraction for the spectrophotometric determination of phosphorus(V) in water samples[J]. Journal of Hazardous Materials,2009,167(174):752−755.
[35] 操江飞, 谢春生, 李志安, 等. 碳气凝胶分散固相萃取-气相色谱法检测蔬果中有机磷农药残留[J]. 食品科学,2022,44(20):387−392. [CAO J F, XIE C S, LI Z A, et al. Determination of organophosphorus pesticide residues in vegetables based on carbon aerogel dispersive solid phase extraction-gas chromatography[J]. Food Science,2022,44(20):387−392. CAO J F, XIE C S, LI Z A, et al . Determination of organophosphorus pesticide residues in vegetables based on carbon aerogel dispersive solid phase extraction-gas chromatography[J]. Food Science,2022 ,44 (20 ):387 −392 .[36] 韩芳, 胡艳云, 张磊, 等. 虚拟分子印记固相萃取技术检测食品中10中三嗪类除草剂残留[J]. 分析化学,2012,40(11):1648−1653. [HAN F, HUY Y, ZHANG L, et al. Determination of triazanes residues in food dummy moleculary imprinted solid phase extraction based on molecular simulation[J]. Chinese Journal of Analytical Chemistry,2012,40(11):1648−1653. HAN F, HUY Y, ZHANG L, et al . Determination of triazanes residues in food dummy moleculary imprinted solid phase extraction based on molecular simulation[J]. Chinese Journal of Analytical Chemistry,2012 ,40 (11 ):1648 −1653 .[37] ZHOU D B, HAN F, DING L, et al. Magnetic C60 nanospheres based solid-phase extraction coupled with isotope dilution gas chromatography-mass spectrometry method for the determination of sixteen polycyclic aromatic hydrocarbons in Chinese herbal medicines[J]. Journal of Chromatography B,2020,1144:122076. doi: 10.1016/j.jchromb.2020.122076
[38] 宋仲容, 周翔, 蒋清香, 等. 基于Fe3O4@SiO2@NH2@C60的磁固相萃取/气相色谱-质谱联用检测中药材中多环芳烃[J]. 分析测试学报,2023,42(2):131−140. [SONG Z R, ZHOU X, JIANG Q X, et al. Determination of polycyclic aromatic hydrocarbons in chinese herbal medicines by gas chromatography-mass spectrometry with Fe3O4@SiO2@NH2@C60 magnetic solid phase extraction[J]. Journal of Instrumental Analysis,2023,42(2):131−140. SONG Z R, ZHOU X, JIANG Q X, et al . Determination of polycyclic aromatic hydrocarbons in chinese herbal medicines by gas chromatography-mass spectrometry with Fe3O4@SiO2@NH2@C60 magnetic solid phase extraction[J]. Journal of Instrumental Analysis,2023 ,42 (2 ):131 −140 . -
期刊类型引用(5)
1. 左煜,宋昕怡,谢婉茹. 农产品农药残留检测中高效液相色谱技术的应用现状、问题及对策研究. 食品安全导刊. 2025(05): 145-147 .  百度学术
百度学术
2. 周文杰,丁太刚,胡莹莹,崔海霞,张彦军. β-环糊精磁性碳纳米管固相萃取在检测蔬菜中4种有机磷农残中的应用. 食品安全导刊. 2024(07): 47-49 .  百度学术
百度学术
3. 罗景阳,李娇,关健,李巧莲,王岩松,袁帅. QuEChERS-高效液相色谱三重四级杆线性离子阱串联质谱法测定蔬菜中34种杀虫剂残留. 食品工业科技. 2024(17): 302-315 .  本站查看
本站查看
4. 古丽契热·阿地力. 食品中有机化学污染物的检测方法与控制技术分析. 中外食品工业. 2024(11): 58-60 .  百度学术
百度学术
5. 白晓云,马晓冲,齐晓茹,苏运聪,张耀广,李飞. 固相萃取-气相色谱-质谱法测定牛乳中54种农药残留. 乳业科学与技术. 2024(05): 12-19 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:


 下载:
下载:



