Effect and Mechanism of Armillaria mellea 07-22 Fermentation on the Degradation of Zearalenone
-
摘要: 本研究以蜜环菌Am-07-22为试验菌株,采用真菌生物发酵的方式降解玉米赤霉烯酮(ZEN),对蜜环菌降解ZEN的降解效果进行研究,包括菌株对不同浓度ZEN的降解效果以及不同培养时间、培养温度、初始pH和接种量对菌株降解ZEN的影响。然后对降解机理进行初探,分析了菌丝体、发酵上清液、细胞内容物对ZEN的降解作用,并研究了不同发酵时间、pH、金属离子对发酵上清液降解ZEN的影响,以及降解效果与菌株产漆酶活力的相关性分析。结果表明:蜜环菌Am-07-22对ZEN的降解效果良好,当ZEN浓度为5 μg/mL时,最适降解条件为培养时间8 d,培养温度27 ℃,初始pH7.0,接种量10%,此时对ZEN的降解率为78.72%。菌丝体、发酵上清液和细胞内容物对ZEN的降解率分别为47.42%、37.05%和13.08%,蜜环菌Am-07-22分泌的胞外酶是降解ZEN的主要方式,而且菌体细胞对ZEN也有一定的吸附作用。另外,发酵上清液对ZEN的降解率与漆酶酶活的相关性较高为0.973,且Cu2+对发酵上清液降解ZEN具有最佳的促进作用。Abstract: This study used Armillaria mellea 07-22 as the experimental strain to degrade zearalenone (ZEN) by fungal biological fermentation. The degradation effects of Armillaria mellea on ZEN were studied, including the degradation effects of different concentrations of ZEN by the strain and the effects of different culture time, culture temperature, initial pH value and inoculation amount on the degradation of ZEN by the strain. Then the degradation mechanism was explored, the degradation effects of mycelium, fermentation supernatant and cell contents on ZEN were analyzed, and the effects of different fermentation time, pH values, and metal ions on degradation of ZEN by fermentation supernatant were studied, and the correlation between degradation effect and laccase production activity of the strain was illustrated. The results showed that Armillaria mellea 07-22 had a good degradation effect on ZEN. When the ZEN concentration was 5 μg/mL, the optimal degradation conditions were culture time of 8 days, culture temperature of 27 ℃, initial pH of 7.0, and inoculation amount of 10%. At this time, the degradation rate of ZEN was 78.72%. The degradation rates of ZEN by mycelium, fermentation supernatant and cell contents were 47.42%, 37.05% and 13.08% respectively. The extracellular enzymes secreted by Am-07-22 were the main way to degrade ZEN, and the mycelium cells also had a certain adsorption effect on ZEN. In addition, the correlation between the degradation rate of ZEN by fermentation supernatant and laccase activity was 0.973, and Cu2+ had the best promoting effect on the degradation of ZEN by fermentation supernatant.
-
Keywords:
- zearalenone /
- Armillaria mellea /
- mycotoxin /
- microbial degradation /
- degradation mechanism
-
玉米赤霉烯酮(Zearalenone,ZEN)是一种非甾体雌激素真菌毒素,又称为F-2毒素,是一种主要由镰刀菌属真菌产生的次级代谢产物,主要存在于被污染的玉米、小麦、大米、大豆等谷物中[1]。ZEN会通过多种途径污染谷物,食品和饲料等,严重威胁人类健康和生命安全,其化学结构与许多类雌激素具有相似的特性,会激活雌激素受体,引起农产动物的流产、死胎、畸形胎等生殖障碍[2]。另外ZEN还会通过食物链进入人体,造成免疫损伤[3]、肝脏损伤[4]、具有遗传毒性[5]、诱发癌症[6]等危害。ZEN的污染及毒性危害较大,因此寻找到高效降解ZEN的方法变得尤为重要。
常见的降解玉米赤霉烯酮的方法包括物理方法、化学方法和生物方法[7]。物理方法主要通过热处理、紫外线辐射或γ射线照射、吸附剂吸附等[8−9]。化学方法包括氨化法、碱法、臭氧处理、氧水处理等[10]。但物理化学方法具有降解效率较低,破坏营养成分,引入其他化学物质等不利因素等限制。而生物方法因其具有高效性、高特异性、污染少逐渐成为真菌毒素降解的聚焦热点,研究表明玉米赤霉烯酮的生物降解主要来自以下两类:微生物降解和酶降解[11]。迄今为止,大量研究成果显示微生物具有显著的脱除玉米赤霉烯酮的作用,种类主要涉及乳酸菌、芽孢杆菌、曲霉菌和酵母菌等[12−13]。Zhao 等[14]和 Xu 等[15]研究发现芽孢杆菌可有效降解 ZEN。González 等[16]测试了11 种已经能证明降解 AFB1 的芽孢杆菌降解 ZEN 的能力,结果发现所有菌株在 30 ℃ 下培养72 h 内均能降解 ZEN。另外 Sun 等[17]从发酵大豆中分离出的食品级黑曲霉 FS10 在 PDB 培养基中能有效去除 ZEN,菌丝体和培养滤液也可降低 43.10%和 68.16% 的 ZEN。
尽管现阶段对细菌及相关酶降解ZEN的相关研究较为普遍,但大型食用真菌降解ZEN及相关机理的研究依然较少,国内外学者研究发现大型食用真菌能够代谢产生漆酶,并且漆酶在降解真菌毒素方面有着良好的应用[18]。Loi等[19]研究杏鲍菇漆酶Ery4和漆酶介体体系(LMSs)对多种真菌毒素及毒素联合使用的降解能力,结果对AFB1、FB1、OTA、ZEN和T-2毒素均有不同程度的降解效果。Song等[20]在毕赤酵母X33中表达了来自秀珍菇的漆酶基因Lac2,结果表明Lac2-ABTS 和 Lac2-AS两种体系在pH4~8及温度40~60 ℃范围内均为降解玉米赤霉烯酮的有效体系。
实验室前期研究发现蜜环菌Am-07-22具有能够降解真菌毒素的潜力,因此本试验在此基础上以玉米赤霉烯酮(ZEN)为研究对象,蜜环菌Am-07-22为试验菌株,通过生物发酵降解的技术,研究蜜环菌Am-07-22对ZEN的降解特性和相关机理,为玉米赤霉烯酮生物脱毒提供新的菌株资源,为食用菌应用于真菌毒素防控奠定理论基础。
1. 材料与方法
1.1 材料与仪器
菌种 蜜环菌Am-07-22(Armillaria mellea)由小麦和玉米深加工国家工程研究中心保藏;玉米赤霉烯酮ZEN固体标准品(纯度>99%) 购于青岛普瑞邦(Pribolab)生物工程有限公司,固体标准品用色谱级甲醇溶液溶解稀释,配制成浓度为100 μg/mL的ZEN标准储备液,于−20 ℃避光保存;蛋白酶K(≥30 units/mg protein)、SDS 上海阿拉丁生化科技股份有限公司;蜜环菌Am-07-22固体斜面培养基为12°Bé麦芽汁琼脂培养基;蜜环菌Am-07-22液体培养基 马铃薯20%、蚕蛹粉0.5%、葡萄糖1%、蔗糖1%、酵母浸粉2%、磷酸二氢钾 0.15%、七水合硫酸镁0.075%、维生素B1 0.001%,pH自然,121 ℃灭菌20 min。
1200型高效液相色谱仪 美国Agilent公司;JY 92-IIN超声波细胞破碎仪(配备φ6变幅杆) 宁波新芝生物科技股份有限公司;Allegra X-30R高速离心机 美国Beckman公司;DSX-18L-I手提式高压蒸汽灭菌锅 上海申安医疗器械厂;Stab S2振荡培养箱 上海润度生物科技有限公司;HH-S4数显恒温水浴锅 常州市金坛友联仪器研究所;BSA2245电子分析天平 Sartorious(北京)有限公司。
1.2 实验方法
1.2.1 菌种活化
参考何音华[21]的方法对菌种进行活化,将保藏的蜜环菌Am-07-22菌种转接至12°Bé新鲜麦芽汁琼脂斜面培养基中,并放置于培养箱,在27 ℃条件下培养至第12 d备用。
将活化好的蜜环菌Am-07-22菌株从固体斜面培养基中取8块1 cm3的菌体接种至30 mL液体培养基中,于27 ℃恒温摇床中振荡培养6 d,摇床转速为160 r/min,培养结束即为制得的一级种子液,于4 ℃的条件下保存。再将一级种子液打碎,以8%的接种量接种至200 mL的液体种子培养基中,于27 ℃、160 r/min的培养条件下再次振荡培养6 d,得到二级种子液。二级种子液也于4 ℃条件下保存。
1.2.2 ZEN的检测
参考骆翼[22]的高效液相色谱的ZEN检测条件并加以改进,具体的检测条件如下:
色谱柱:Extend-C18柱,柱长150 mm,内径4.6 mm,粒度5 μm。流动相:甲醇:水=70:30、柱温:25 ℃、流速:0.6 mL/min、进样量:20 μL、紫外吸收波长:236 nm。
吸取适量的ZEN标准储备液,用甲醇溶液稀释,配制成15、10、5、2、1、0.5、0.2 μg/mL的不同浓度ZEN工作液,于4 ℃避光保存。标准工作液经过0.22 μm滤膜过滤后,使用高效液相色谱仪进行检测。以ZEN浓度为横坐标,以高效液相色谱检测ZEN的峰面积为纵坐标绘制标准曲线。
1.2.3 蜜环菌Am-07-22降解ZEN效果及ZEN回收率的测定
将制备好的蜜环菌Am-07-22二级种子培养液(菌种浓度为75 g/L)破碎处理后,接种至ZEN含量为5 μg/mL的10 mL液体培养基中,接种量为10%,然后将反应体系在27 ℃,160 r/min的恒温摇床中振荡避光反应7 d。取1 mL上清液加入1 mL甲醇溶液进行ZEN的提取,然后在10000 r/min的条件下低温离心10 min,取上清再经过0.22 μm滤膜过滤后,使用高效液相色谱仪检测ZEN的含量,并计算ZEN的降解率。ZEN降解率计算公式如下:
玉米赤霉烯酮(ZEN)降解率(%)=ZEN对照组含量−样品组含量ZEN对照组含量×100 式中,ZEN对照组:ZEN含量为5 μg/mL未接种蜜环菌Am-07-22的液体培养基。
同时对该提取方法进行加标回收率的计算,分别添加0.5、2、10 μg/mL浓度的ZEN标准工作液,采用上述方法提取与检测,每个浓度3个平行。
1.2.4 ZEN浓度对蜜环菌Am-07-22降解的影响
将打碎的蜜环菌Am-07-22二级种子液接种至含有ZEN浓度分别为2、5、7.5、10、15 μg/mL的10 mL液体培养基中,接种量为10%,每个菌种3个平行,然后将反应体系在27 ℃,160 r/min的恒温摇床中振荡避光反应7 d。提取ZEN后使用高效液相色谱仪检测玉米赤霉烯酮的含量,每组3个平行,并计算ZEN的降解率和降解量。
1.2.5 培养时间、温度、初始pH和接种量对蜜环菌Am-07-22降解ZEN的影响
将打碎的蜜环菌Am-07-22二级种子液接种至含有ZEN浓度分别为5 μg/mL的10 mL 初始pH分别为4、5、6、7、8、9的液体培养基中,接种量分别为2.5%、5%、7.5%、10%、12.5%、15%,然后将反应体系在18、21、24、27、30、33 ℃,160 r/min的恒温摇床中振荡避光分别反应4、5、6、7、8、9 d。其中单因素固定条件为培养时间7 d、培养温度27 ℃、初始pH自然、接种量10%。使用高效液相色谱仪检测玉米赤霉烯酮的含量,每组3个平行,并计算ZEN的降解率。
1.2.6 蜜环菌Am-07-22降解ZEN活性部位的检测
将蜜环菌Am-07-22重新接种于液体种子培养基中,在27 ℃恒温摇床中以160 r/min转速的条件下振荡培养6 d。培养结束后用4层滤布过滤,收集所得到的菌丝体及发酵上清液,对降解ZEN的菌体种子发酵液活性部位进行检测,共分3组进行,以含有浓度为5 μg/mL的ZEN作为对照组,每组取3个重复样品进行试验。
参考金博文[23]的方法对不同组进行处理,A组(发酵上清液):取过滤后的上层发酵液,在4 ℃,10000 r/min的条件下低温离心10 min,收集上清液1 mL。B组(菌丝体组):称取过滤后的下层菌丝体1 g,用PBS缓冲液轻轻漂洗3~5次。C组(细胞破碎组):称取过滤后的下层菌丝体1 g,用PBS缓冲液轻轻漂洗3~5次,进行细胞超声破壁处理2 h(200 W,工作5 s,间歇5 s),然后在10000 r/min的条件下低温离心10 min,收集胞内液1 mL。将制备后的实验组加入稀释后的ZEN标准储备液(见1.1),体系中ZEN的浓度为5 μg/mL,反应体系在27 ℃、160 r/min条件下避光振荡培养7 d。
1.2.7 蜜环菌Am-07-22降解ZEN活性物质性质的初步分析
参考景思源[24]的处理方法对活性物质进行分析,分3组处理:1组(蛋白酶K组):取5 mL发酵上清液,加入250 μL蛋白酶K(终浓度为0.1 mg/mL),55 ℃处理2 h。2组(SDS组):取5 mL发酵上清液,加入250 μL SDS(终浓度为0.5 mg/mL),55 ℃处理2 h。3组(蛋白酶K+SDS组):取5 mL发酵上清液,加入250 μL蛋白酶K(终浓度为0.1mg/mL)和250 μL SDS(终浓度为0.5 mg/mL),55 ℃处理2 h。4组(100 ℃沸水浴组):取5 mL发酵上清液,在100 ℃条件下沸水浴处理20 min。
将不同处理后的4组发酵上清液用0.22 μm滤膜过滤后,向其中加入ZEN储备液,体系中ZEN的浓度为5 μg/mL,反应体系在27 ℃、160 r/min条件下避光振荡培养7 d。结束后使用高效液相色谱仪检测ZEN含量并计算降解率。同时用初始浓度为5 μg/mL ZEN的发酵上清液作为对照组。
1.2.8 蜜环菌Am-07-22产漆酶酶活测定
参考刘天睿等[25]的方法并加以改进,从发酵上清液中取样测定蜜环菌Am-07-22第1 d至第10 d产漆酶的酶活力,采用ABTS法测定漆酶酶活,以ABTS为底物,通过酶标仪测定漆酶活力。在200 μL酶活反应体系中先加入50 μL 0.5 mmol/L的ABTS及100 μL 0.2 mol/L柠檬酸钠缓冲溶液(pH4.0),混合均匀,再加入稀释10倍后的酶液50 μL启动反应,每隔1 min记录420 nm吸光度值的变化,在符合线性关系处求出斜率并换算出酶活力。漆酶酶活性的定义为以每分钟氧化1 μmol ABTS所需要的漆酶量作为1个酶的活力单位,酶活的单位为U/L。漆酶活力计算公式:
A=106/ε×N×V总/V酶×ΔOD/Δt 式中,ε为ABTS的摩尔吸光系数为36000 L/(mol·cm),N代表稀释倍数,V总代表酶活测定体系中的反应液的总体积,V酶代表反应添加的酶液体积。
1.2.9 发酵时间、pH、金属离子对蜜环菌Am-07-22发酵上清液降解ZEN的影响
参考韦锦范[26]的方法并加以改进,按照上述方法收集蜜环菌Am-07-22的发酵上清液,向其中加入浓度为5 μg/mL ZEN标准溶液,于27 ℃,160 r/min的条件下振荡反应。单因素固定条件为反应时间7 d、pH自然、未添加金属离子。分别在反应时间为1、2、3、4、5、6、7、8、9、10 d取样测定反应体系中ZEN含量的变化,并计算降解率。分析不同时间对蜜环菌Am-07-22发酵上清液降解ZEN的影响。另外再取发酵上清液分别调节pH为3、4、5、6、7、8、9、10,以及向其中加入浓度为10 mmol的Na+、K+、Mg2+、Zn2+、Cu2+、Fe2+、Fe3+、Mn2+金属离子,向其中加入浓度为5 μg/mL ZEN标准溶液,于27 ℃,160 r/min的条件下振荡反应,以不添加金属离子的发酵上清粗酶液反应7 d作为对照,每组三个重复。反应结束后取1 mL反应液加入等体积甲醇溶液进行玉米赤霉烯酮的提取,充分摇匀后在10000 r/min的条件下低温离心10 min,再经过0.22 μm滤膜过滤后,使用高效液相色谱仪检测玉米赤霉烯酮的含量,并计算ZEN的降解率。分析不同pH与不同金属离子对蜜环菌Am-07-22发酵上清液降解ZEN的影响。
1.3 数据处理
所有试验数据均为一式三份,并用“平均值±标准差”的形式表示。采用SPSS 23进行数据的显著性分析,P<0.05表示具有显著性差异。使用Pearson相关性分析法来分析ZEN降解率与漆酶酶活之间的相互关系。最后使用Origin 2019软件进行数据处理与图像绘制。
2. 结果与分析
2.1 蜜环菌Am-07-22对ZEN的降解效果
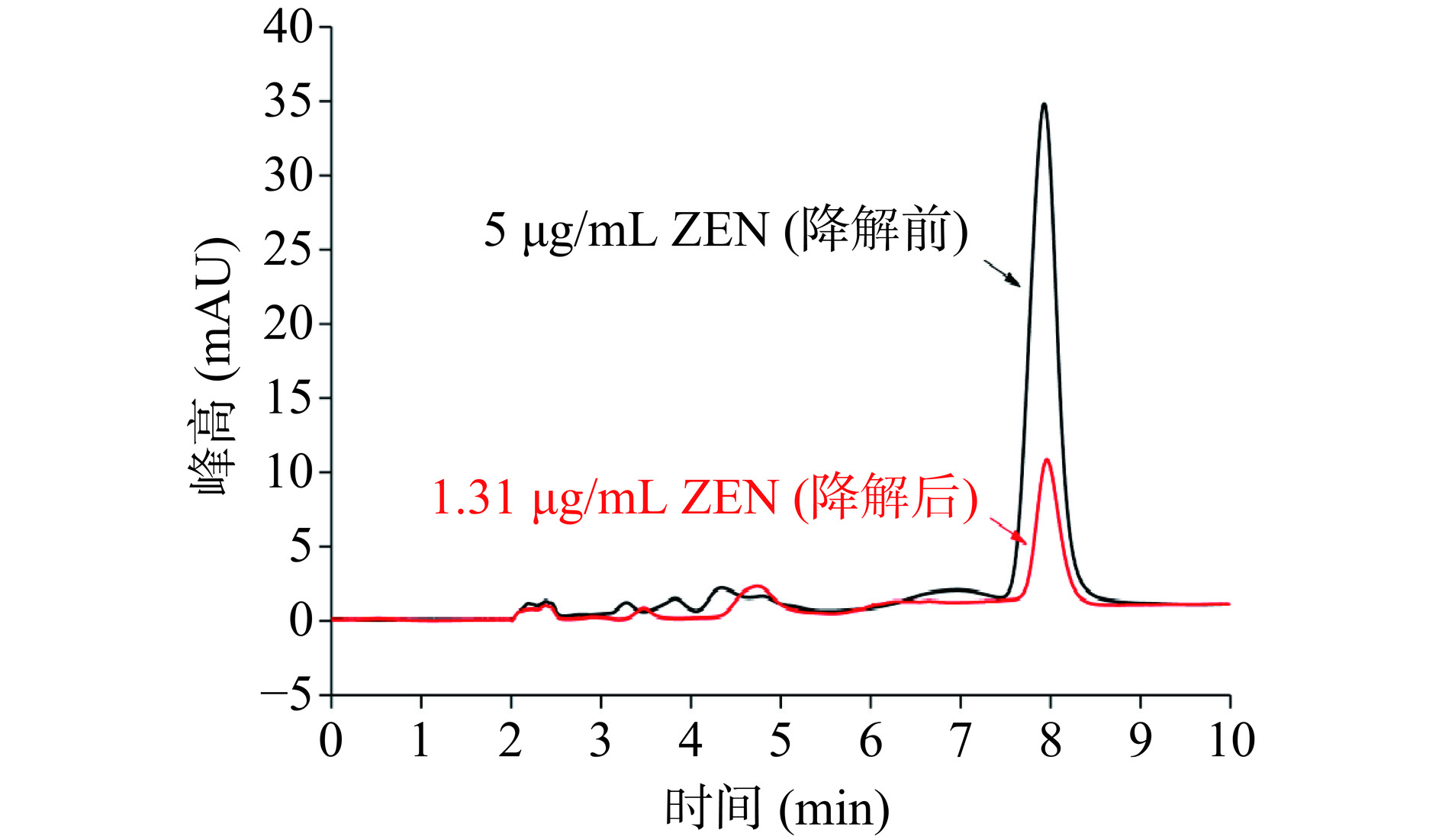
通过高效液相色谱法对不同浓度的ZEN进行测定,最终得到的标准标准曲线线性回归方程:y=150.13x+5.0423,其中R²=0.9999,表明线性关系良好。通过向培养基中添加5 μg/mL的ZEN,并利用蜜环菌Am-07-22菌株进行发酵降解,由图1的高效液相色谱图可知蜜环菌Am-07-22对5 μg/mL ZEN的降解效果良好,降解率可达73.83%。另外通过添加0.5、2、10 μg/mL浓度的ZEN,回收率测定分别为96.38%±1.28%、98.64%±0.37%、97.63%±0.95%。表明此方法对ZEN的回收率较高,准确性良好,符合检测标准。
2.1.1 ZEN浓度对蜜环菌Am-07-22降解效果的影响
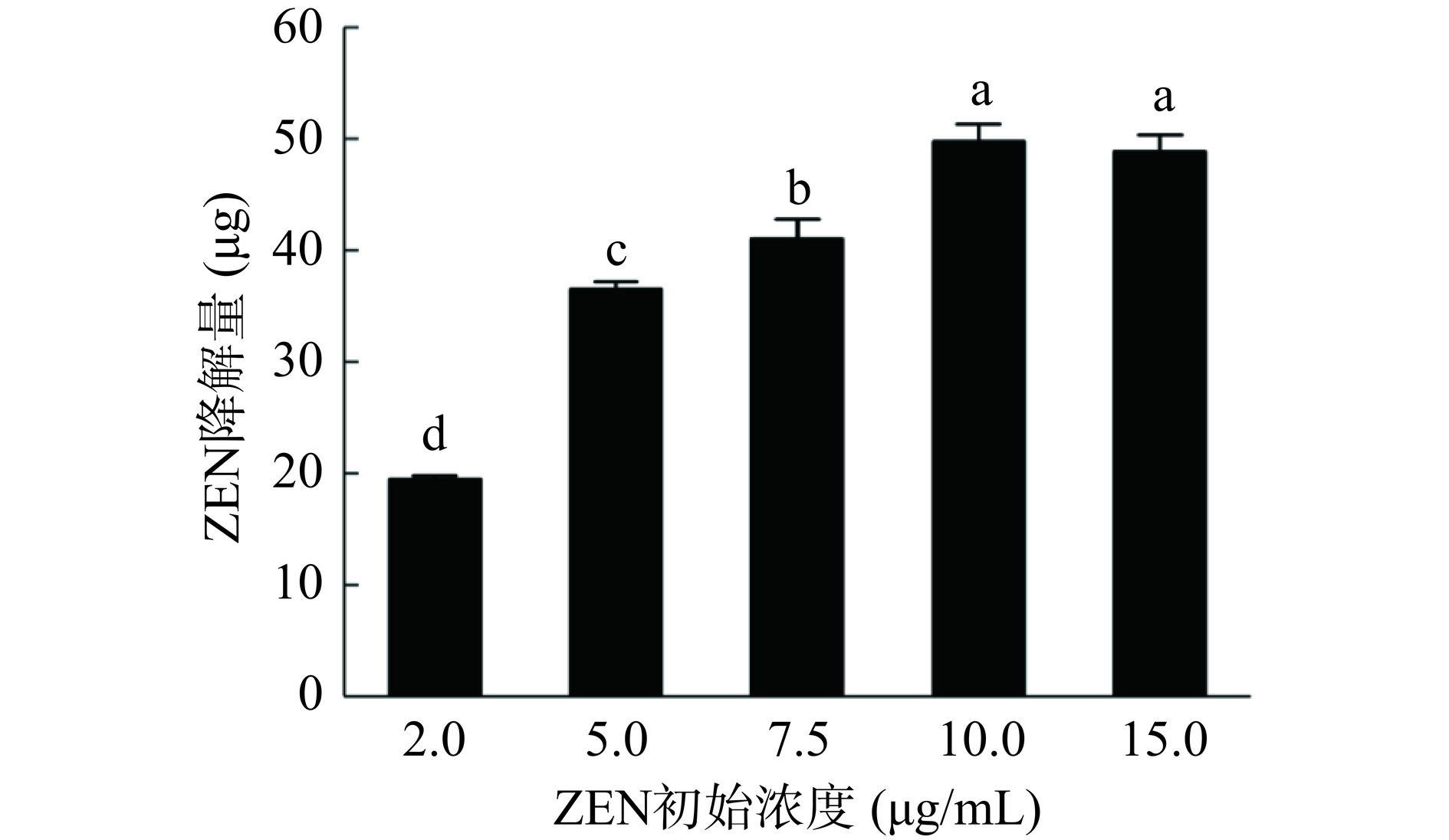
如图2所示,蜜环菌Am-07-22对不同浓度ZEN的降解率有所不同,当初始浓度为2 μg/mL 时降解率可达97.32%,ZEN浓度为5 μg/mL时具有73.83%±1.34%(图1中的液相色谱图出自此次实验)的降解率,而当ZEN的浓度升至10 μg/mL和 15 μg/mL时,降解率则更低分别为49.47%和32.55%。由此可见降解率随着ZEN浓度的升高而下降。但从图3中可以看出当初始浓度为2 μg/mL时对ZEN的降解量为19.46 μg,初始浓度为5 μg/mL时对ZEN的降解量为36.5 μg,而在初始浓度为10 μg/mL和15 μg/mL时可降解ZEN的量则均超过了48.82 μg,并且差异不显著(P>0.05),因此蜜环菌Am-07-22对ZEN的降解量逐渐升高且趋于稳定。在低浓度时,初始ZEN的含量本身较低,尽管降解率很高但最终的降解量依然较低,而在高浓度时初始ZEN的含量则较高,即使降解率有所下降,但降解量却不断增高,最后逐渐稳定达至降解上限。菌株对ZEN浓度为2 μg/mL的降解率已经超过97%,降解效果较好,为了节省成本,后续选择初始浓度为5 μg/mL的 ZEN进行实验。
2.1.2 培养时间对蜜环菌Am-07-22降解ZEN的影响
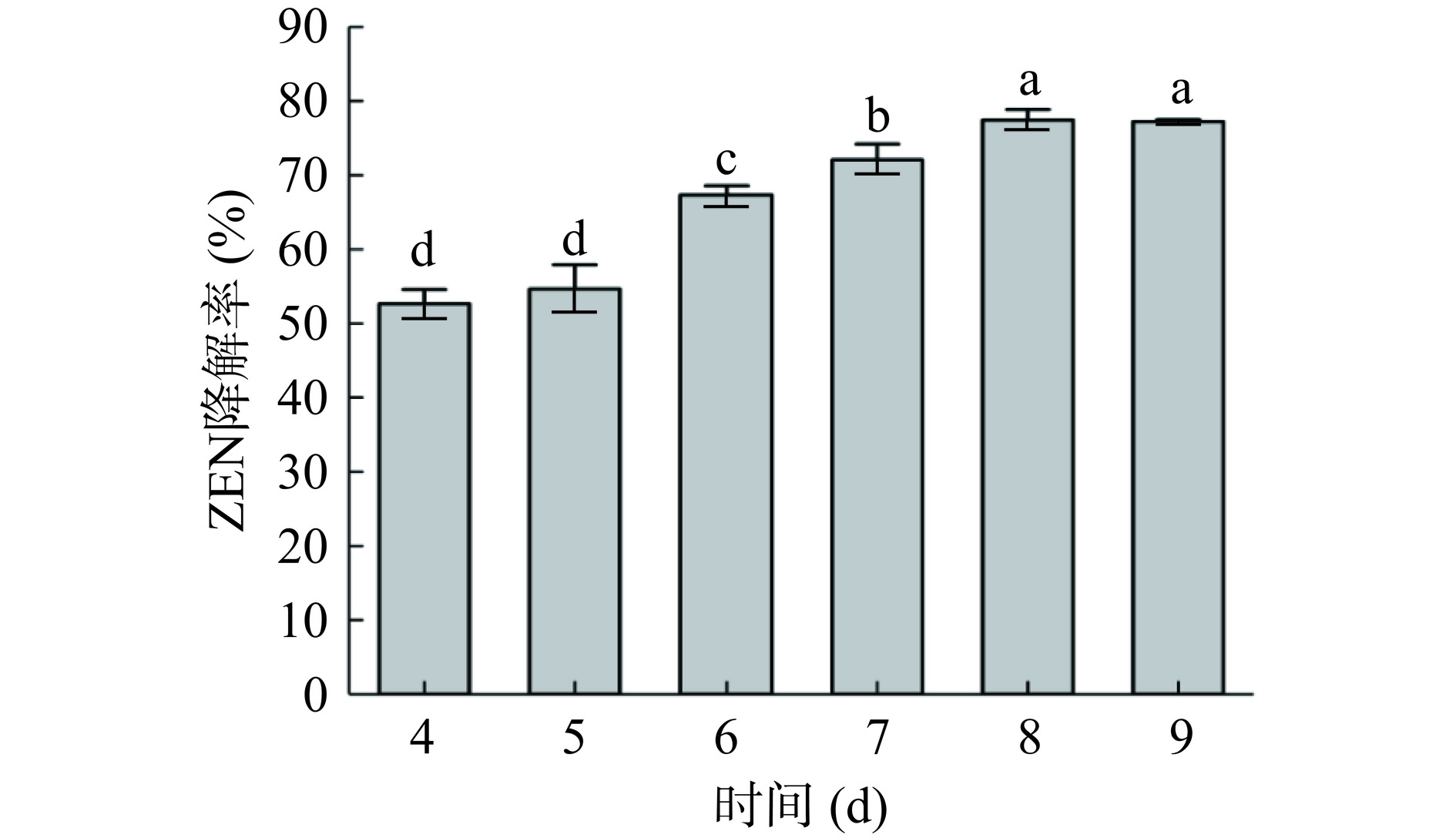
由图4可知,蜜环菌Am-07-22对ZEN的降解率会随着培养时间的延长而逐渐增大(P<0.05),从最开始的第4 d降解率为52.64%上升至第7 d的72.08%。而第8、9 d的降解率升至77.41%和77.23%,此时降解率的差异不显著(P>0.05),表明第8~9 d的降解率最高并已趋于稳定。这可能是因为8 d为蜜环菌Am-07-22的最佳生长时间,此时菌种活力最强,对ZEN的降解率也达到最大,即使延长培养时间,ZEN的降解率也不会有显著变化,这与Wang等[27]的研究结论相符。因此最佳的培养时间为第8 d。
2.1.3 培养温度对蜜环菌Am-07-22降解ZEN的影响
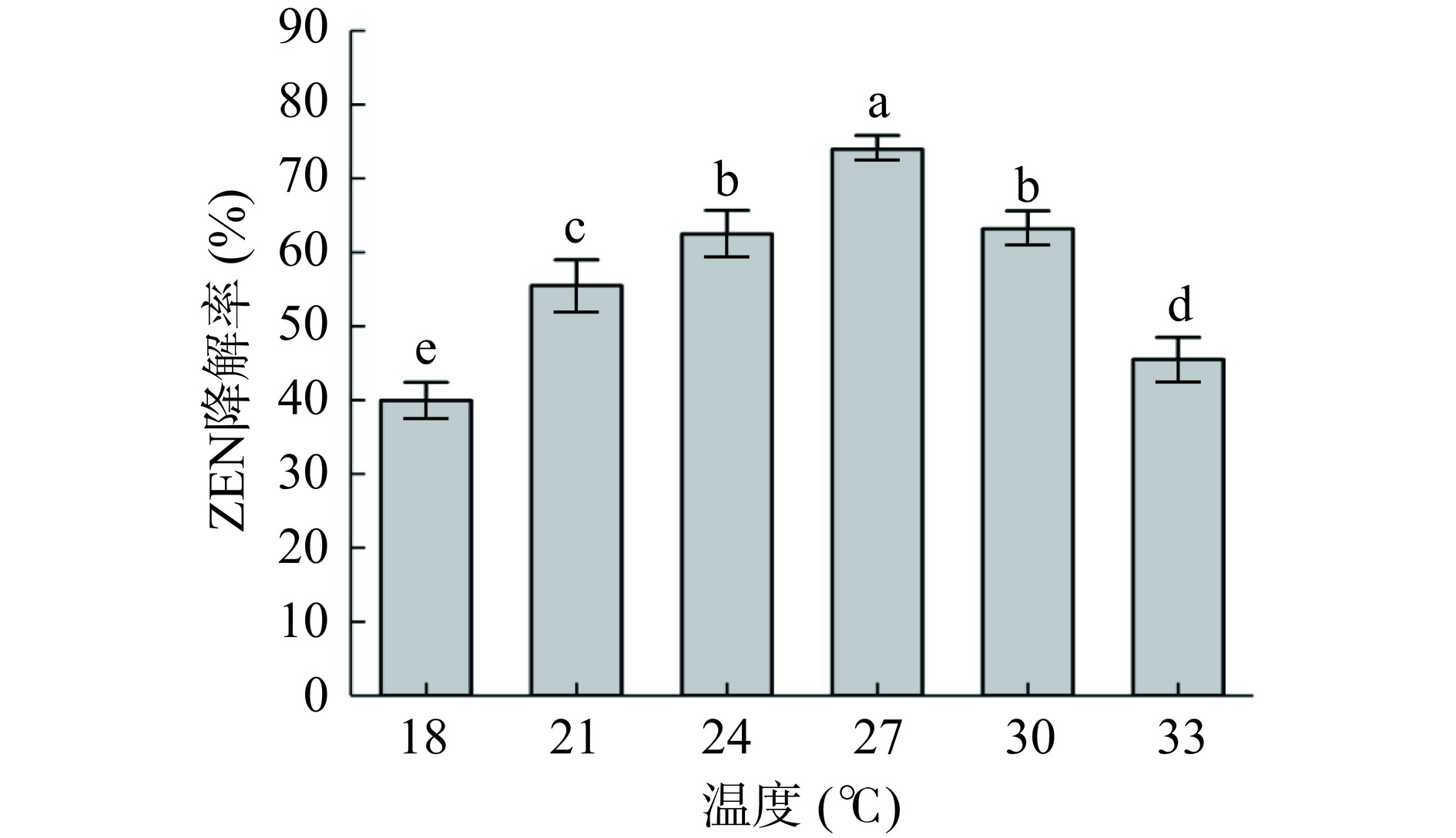
由图5可知,在18~27 ℃的范围内蜜环菌Am-07-22对ZEN的降解率随温度的升高而显著增大(P<0.05),从18 ℃时39.92%的降解率升高至27 ℃时的73.94%。而在27~33 ℃的条件下,降解率反而随温度升高而显著下降(P<0.05),其中在33 ℃时对ZEN降解率为45.52%。这表明过高或过低的温度对蜜环菌Am-07-22降解ZEN的影响均较大,在不适宜的温度条件下蜜环菌的生长环境变差,因此对ZEN的降解率也会降低,这一结果与Xu等[15]的研究相符,因此最佳的培养温度为27 ℃。
2.1.4 初始pH对蜜环菌Am-07-22降解ZEN的影响
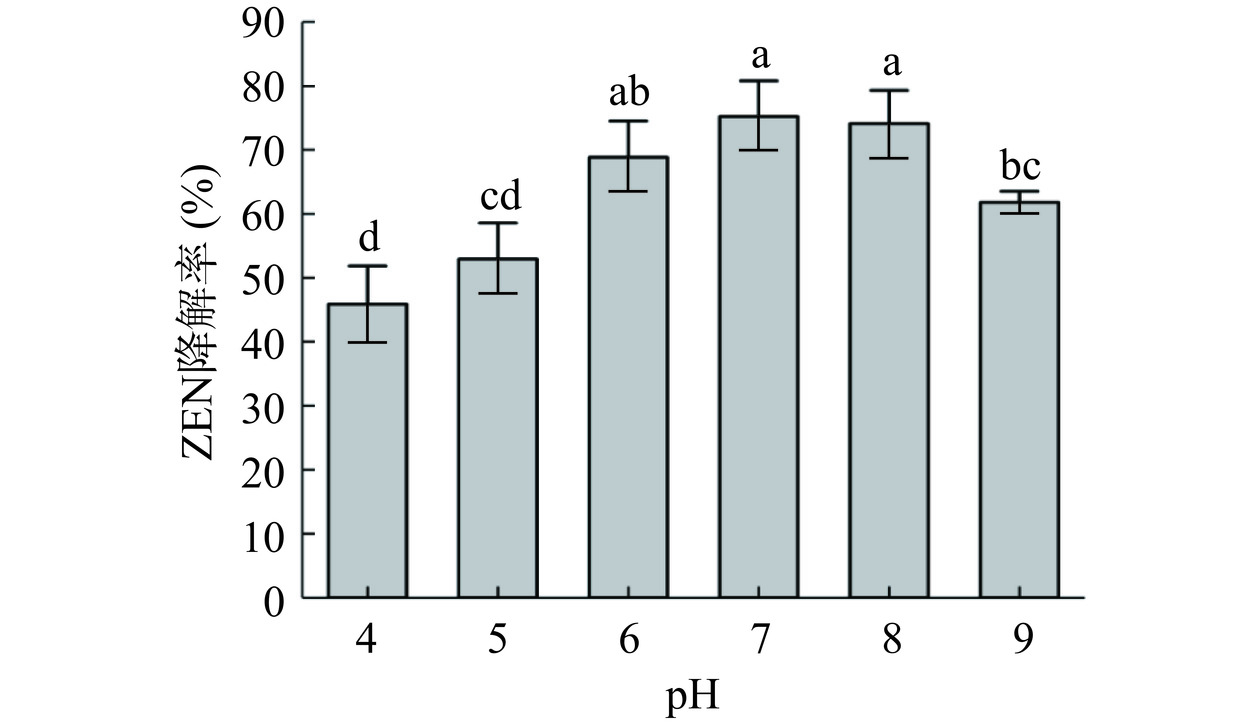
由图6可知,在pH4.0~9.0范围内随着pH的增大,蜜环菌Am-07-22对ZEN的降解率呈现先升高后降低的趋势(P<0.05),pH为7.0时的降解率最高可达75.22%。而pH为4.0及9.0时的降解率仅为45.89%和61.97%。这说明在过酸或过碱的环境下,降解效果均会受到影响。在pH为7.0~8.0的环境中降解效果最佳,降解率达到最高(自然pH为6.2,蜜环菌Am-07-22在此条件下的生长状态最好,但不是最佳的降解ZEN的初始pH),这与Tan等[28]的研究结果相近。因此选择初始pH为7.0作为降解ZEN最佳的初始pH。
2.1.5 菌液接种量对蜜环菌Am-07-22降解ZEN的影响
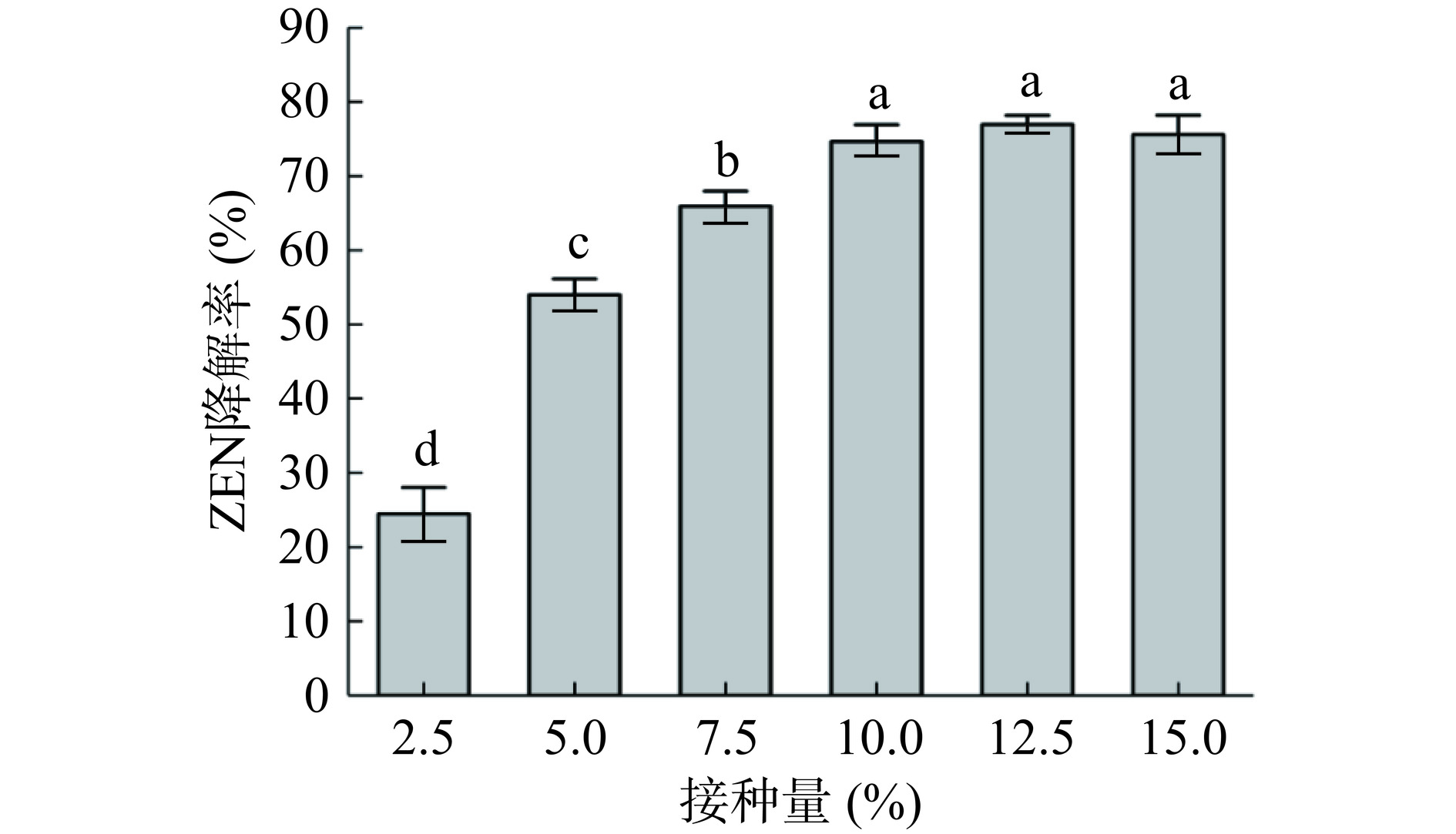
由图7可知,随着蜜环菌Am-07-22菌液接种量的增加,对ZEN的降解率逐渐升高(P<0.05)。最终在接种量为10%~15%时趋于恒定,此时的降解率均高于73%。这表明了蜜环菌Am-07-22在此时的生长环境中已然达到最大的生长量,接种量的增加也不会表现出对ZEN降解率的升高。为节省蜜环菌Am-07-22菌种用量,选择接种量10%作为最佳降解ZEN的接种量。最终选择的降解条件为培养时间8 d,培养温度27 ℃,初始pH7.0,接种量10%,此时对ZEN的降解率最佳为78.72%。
2.2 蜜环菌Am-07-22对ZEN的降解机理初探
2.2.1 蜜环菌Am-07-22降解ZEN的活性部位
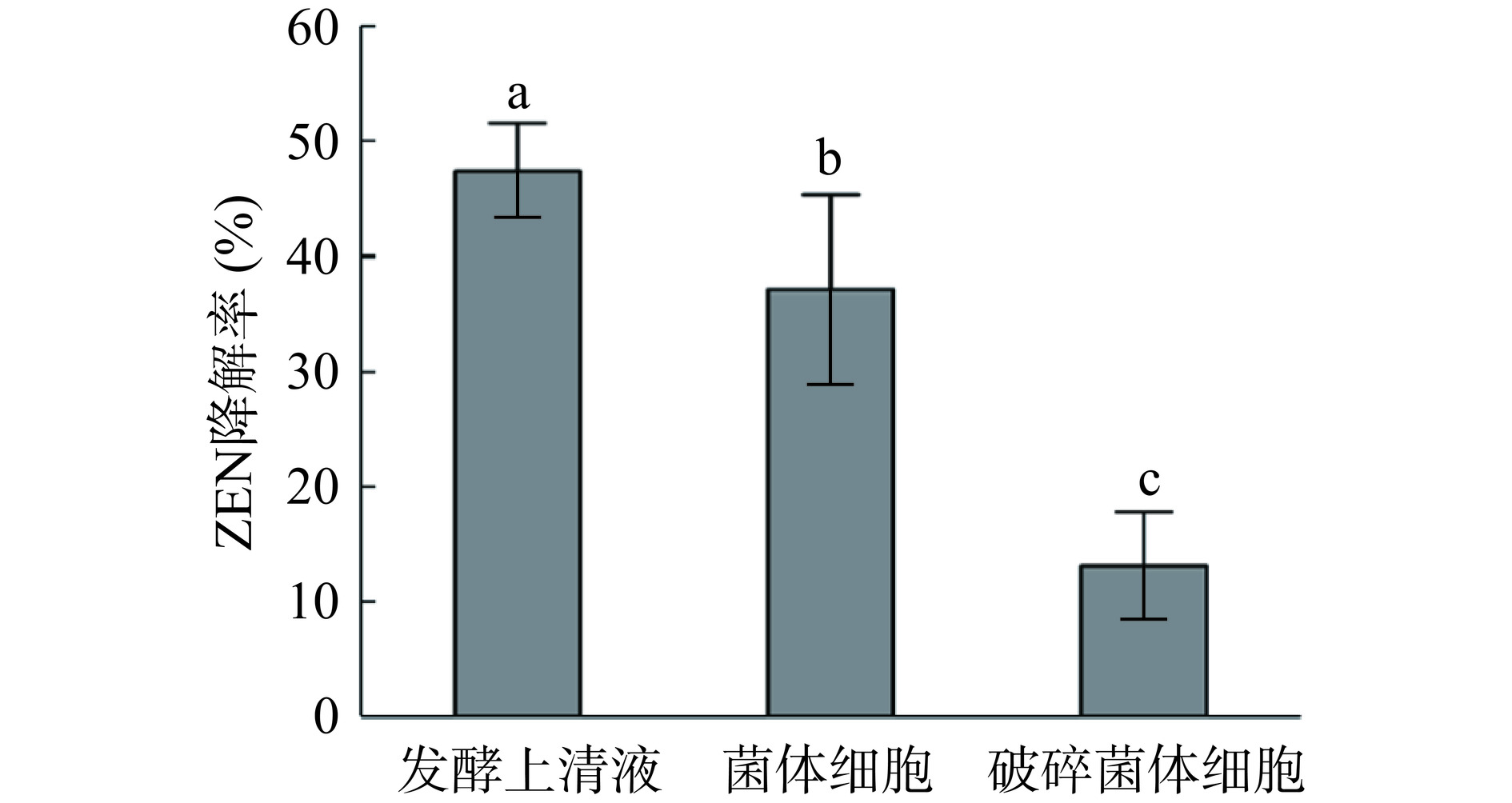
从图8中可以看出蜜环菌Am-07-22不同组分对ZEN的降解效果差异较为明显(P<0.05)。其中发酵上清液对ZEN的降解率最高为47.42%,而Am-07-22菌体细胞的降解率为37.05%,破碎后的菌体细胞对ZEN的降解率最低仅为13.08%。由此可以推断,蜜环菌Am-07-22对ZEN的清除作用不是单一的一种方式,存在多种途径。最主要的清除作用为发酵上清液对ZEN的降解作用,而菌体细胞对ZEN也有一定程度的吸附作用。
2.2.2 蜜环菌Am-07-22降解ZEN活性物质的分析
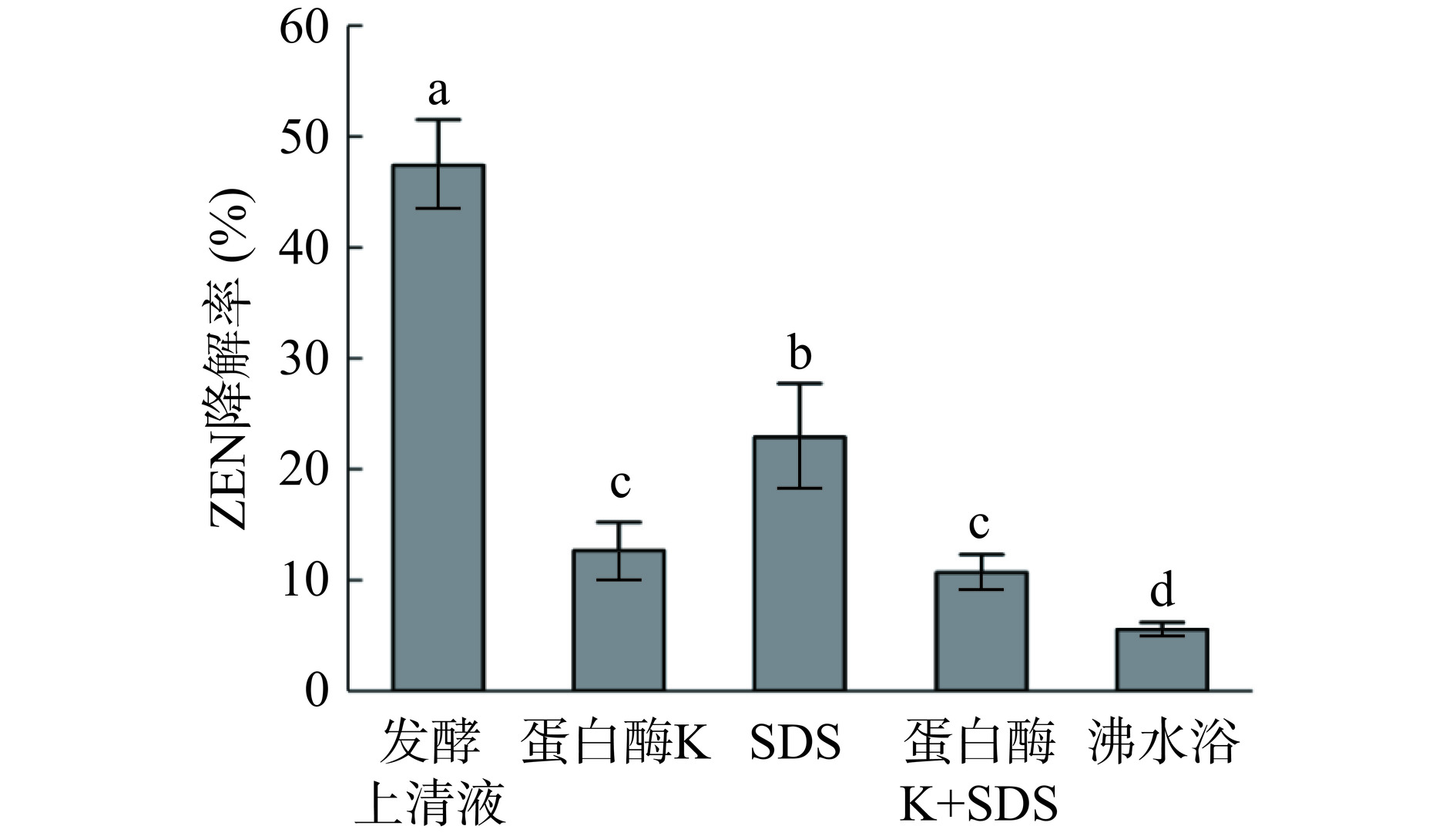
由图9可知,通过对蜜环菌发酵上清液进行蛋白酶K、SDS、沸水浴等处理,发现以上几种处理方式对ZEN降解有显著的影响(P<0.05)。蛋白酶K和SDS处理后的降解率分别为12.65%和22.89%,蛋白酶K+SDS共同处理的降解效果与蛋白酶单独处理的降解效果差异则不显著(P>0.05)。而沸水浴后对ZEN的降解率仅为5.55%,降解能力明显下降。推测在蜜环菌分泌的多种活性成分中,发酵上清液中存在的某种酶类会降解ZEN,蛋白酶K和沸水浴会破坏这种酶的结构导致酶活力下降,对ZEN的降解率由此下降,这与Imade等[29]的研究结果相符。而蜜环菌具有良好地产生漆酶的特点,Banu等[30]也研究发现漆酶对ZEN具有降解潜力。
2.2.3 发酵时间对蜜环菌Am-07-22发酵上清液降解ZEN影响及产漆酶酶活测定
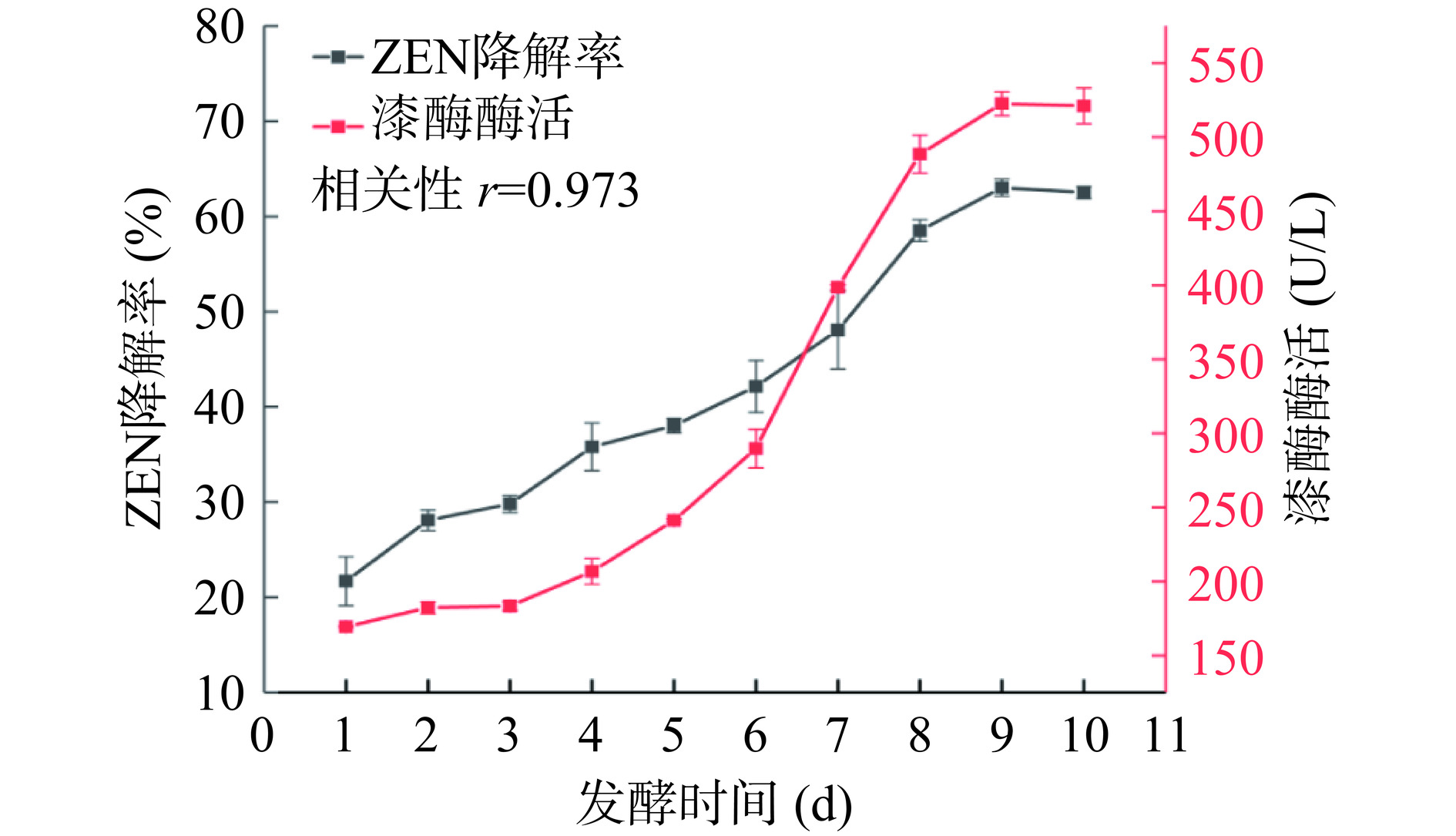
考察了发酵第1 d至第10 d蜜环菌Am-07-22发酵上清液中漆酶酶活力的变化及对ZEN降解效果的影响并侧重对两者之间的相关性进行分析。由图10可知,随着发酵时间的延长蜜环菌Am-07-22发酵上清液对ZEN的降解率逐渐增大(P<0.05),从第1 d 21.69%的降解率上升至第10 d 62.50%的降解率,而蜜环菌产漆酶的酶活力也随着发酵时间的延长逐渐升高(P<0.05),由第1 d的酶活仅为169.26 U/L,到第10 d的酶活则上升至521.11 U/L,这与ZEN的降解率升高保持一致。通过Pearson相关性来分析ZEN降解率与漆酶酶活之间的相互关系,结果证实在0.05的显著性水平上ZEN降解率与漆酶酶活之间存在着显著关联,其相关性为正且r=0.973。由此可以推测蜜环菌Am-07-22产生的漆酶可能在降解ZEN中起主要作用,这与Banu等[30]的研究结果相符。
2.2.4 不同pH对蜜环菌Am-07-22发酵上清液降解ZEN的影响
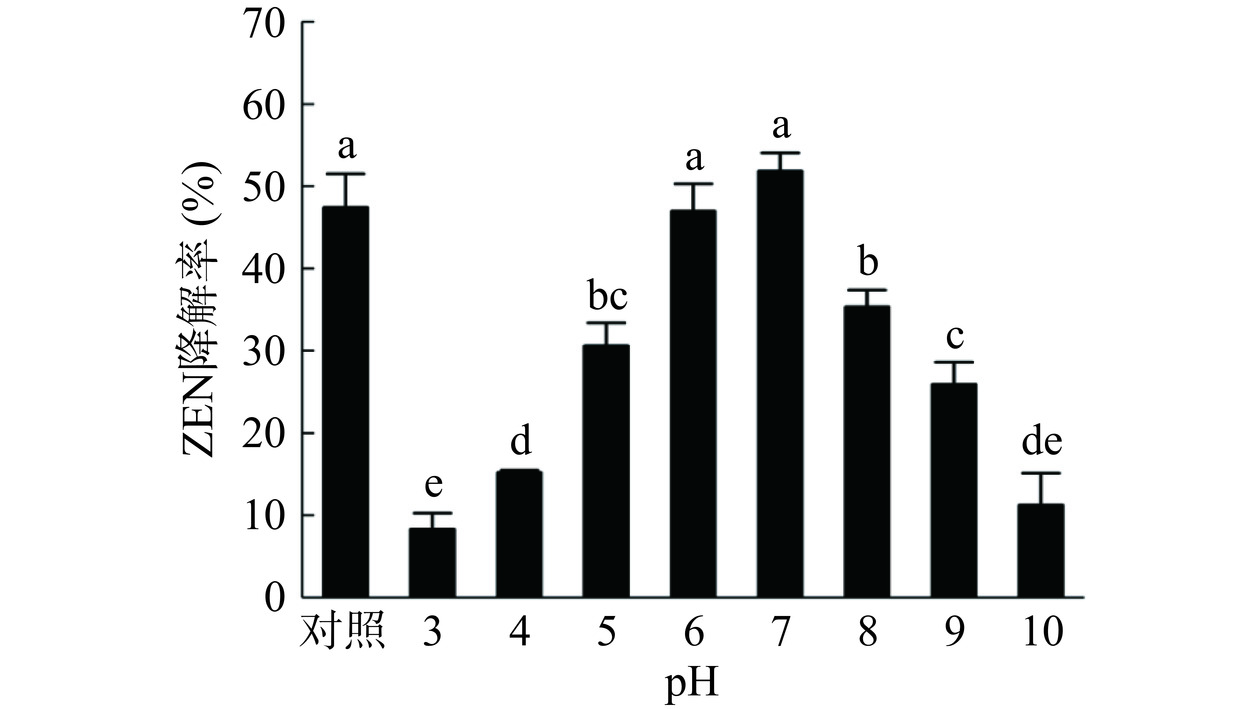
由图11可以看出不同pH对蜜环菌Am-07-22发酵上清液对ZEN的降解率影响较大。其中在pH为6.0~7.0时,ZEN的降解率最高为46.98%和51.84%。两者与不调节pH的发酵上清液对照组没有显著性差异(P>0.05)。而在酸性及碱性条件下,对ZEN的降解率显著降低(P<0.05),在pH为3.0和10.0时仅有8.29%和11.22%的降解率。表明了在过酸或过碱的条件下,发酵上清液中产生的漆酶会受环境影响结构被破坏,对ZEN的降解作用因此下降,因此在不适宜的pH条件下,漆酶无法有效地降解ZEN,致使对ZEN的降解率降低。在pH为6.0~7.0的范围内,均为降解ZEN的适宜条件,这与白长胜等[31]的研究结果相符。
2.2.5 不同金属离子对蜜环菌Am-07-22发酵上清液降解ZEN的影响
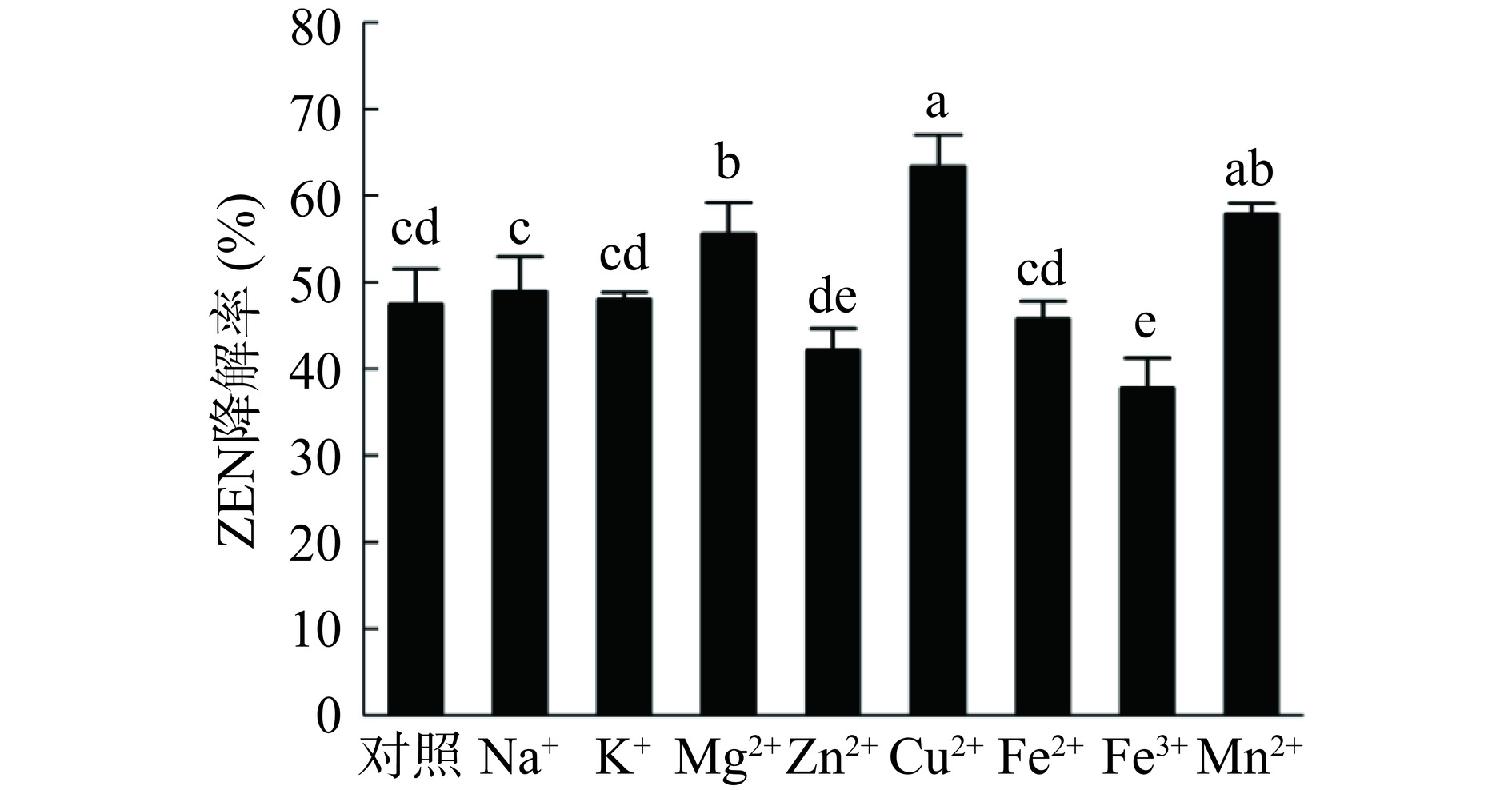
由图12可知,不同金属离子对蜜环菌Am-07-22发酵上清液降解ZEN的影响效果不尽相同,其中Na+、K+和Fe2+的添加对发酵上清液降解ZEN的效果与未添加金属离子时的降解效果差异不明显。 Zn2+、Fe3+的添加对ZEN降解率有一定的抑制作用(P<0.05),降解率分别为42.09%和37.76%,Fe3+的抑制效果最明显较对照降低了9.66%。而Cu2+、Mg2+、Mn2+的添加对发酵上清液降解ZEN的效果得到显著增强(P<0.05),添加Mg2+和Mn2+对ZEN的降解率分别为55.57%和57.80%,而添加Cu2+对发酵上清液降解ZEN的降解效果提升最高为63.37%,较未添加金属离子的对照组提高了15.95%。由此可以推断Cu2+会显著增强漆酶的酶活力,这与祝嫦巍等[32]的研究结果一致,推测原因可能与漆酶本身的结构有关,漆酶为含四个铜离子的多酚氧化酶,属于铜蓝氧化酶类,因此Cu2+存在的环境中会增强漆酶的活性。
3. 结论
本研究以蜜环菌Am-07-22为试验菌株,采用真菌生物发酵的方式降解玉米赤霉烯酮(ZEN)。其对5 μg/mL ZEN的降解率可达78.72%,最适的降解条件为培养时间8 d,培养温度27 ℃,初始pH7.0,接种量10%。蜜环菌Am-07-22发酵上清液中的活性成分是降解ZEN的主要方式,菌体细胞对ZEN也有一定的吸附作用。另外发酵上清液对ZEN的降解率与漆酶酶活的相关性较高,而且Cu2+对发酵上清液降解ZEN具有最佳的促进作用。因此可推断出蜜环菌Am-07-22发酵上清液中产生的漆酶在降解ZEN中起主要作用。本研究结果表明蜜环菌Am-07-22具有降解玉米赤霉烯酮的能力,为玉米赤霉烯酮的防治提供了新的研究思路。
-
-
[1] WU N, OU W, ZHANG Z, et al. Recent advances in detoxification strategies for zearalenone contamination in food and feed[J]. Chinese Journal of Chemical Engineering,2021,30(2):168−177.
[2] WANG J, XIE Y. Review on microbial degradation of zearalenone and aflatoxins[J]. Grain & Oil Science and Technology,2020,3(3):117−125.
[3] HUEZA I M, RASPANTINI P C, RASPANTINI L E, et al. Zearalenone, an estrogenic mycotoxin, is an immunotoxic compound[J]. Toxins (Basel),2014,6(3):1080−1095. doi: 10.3390/toxins6031080
[4] XU J, LI S, JIANG L, et al. Baicalin protects against zearalenone-induced chicks liver and kidney injury by inhibiting expression of oxidative stress, inflammatory cytokines and caspase signaling pathway[J]. International Immunopharmacology,2021,100(11):108097.
[5] FLYNN K M, NEWBOLD R R, FERGUSON S A. Multigenerational exposure to dietary nonylphenol has no severe effects on spatial learning in female rats[J]. Neurotoxicology,2002,23(1):87−94. doi: 10.1016/S0161-813X(02)00007-4
[6] KOWALSKA K, HABROWSKA-GÓRCZYŃSKA D E, DOMIŃSKA K, et al. The dose-dependent effect of zearalenone on mitochondrial metabolism, plasma membrane permeabilization and cell cycle in human prostate cancer cell lines[J]. Chemosphere,2017,180(8):455−466.
[7] LU Q, LUO J Y, RUAN H N, et al. Structure-toxicity relationships, toxicity mechanisms and health risk assessment of food-borne modified deoxynivalenol and zearalenone:A comprehensive review[J]. Science of The Total Environment,2022,806(P3):151192.
[8] ZHANG W, ZHANG L, JIANG X, et al. Enhanced adsorption removal of aflatoxin B1, zearalenone and deoxynivalenol from dairy cow rumen fluid by modified nano-montmorillonite and evaluation of its mechanism[J]. Animal Feed Science and Technology,2020,259(C):114366.
[9] QU M, TIAN S, YU H, et al. Single-kernel classification of deoxynivalenol and zearalenone contaminated maize based on visible light imaging under ultraviolet light excitation combined with polarized light imaging[J]. Food Control,2023,144(2):109354.
[10] MA C G, WANG Y D, HUANG W F, et al. Molecular reaction mechanism for elimination of zearalenone during simulated alkali neutralization process of corn oil[J]. Food Chemistry,2020,307(C):125546−125546.
[11] 赵仁勇, 宋斌. 玉米赤霉烯酮生物脱毒研究进展[J]. 河南工业大学学报(自然科学版),2018,39(2):113−121. [ZHAO R Y, SONG B. Advances in biological detoxification of zearalenone[J]. Journal of Henan University of Technology(Natural Science Edition),2018,39(2):113−121.] doi: 10.3969/j.issn.1673-2383.2018.02.020 ZHAO R Y, SONG B. Advances in biological detoxification of zearalenone[J]. Journal of Henan University of Technology(Natural Science Edition), 2018, 39(2): 113−121. doi: 10.3969/j.issn.1673-2383.2018.02.020
[12] KOSAWANG C, KARLSSON M, VÉLËZ H, et al. Zearalenone detoxification by zearalenone hydrolase is important for the antagonistic ability of Clonostachys rosea against mycotoxigenic Fusarium graminearum[J]. Fungal Biology,2014,118(4):364−373. doi: 10.1016/j.funbio.2014.01.005
[13] VEKIRU E, FRUHAUF S, HAMETNER C, et al. Isolation and characterisation of enzymatic zearalenone hydrolysis reaction products[J]. World Mycotoxin Journal,2016,9(3):1−12.
[14] ZHAO L, JIN H, LAN J, et al. Detoxification of zearalenone by three strains of Lactobacillus plantarum from fermented food in vitro[J]. Food Control,2015,54(8):158−164.
[15] XU J, WANG H, ZHU Z, et al. Isolation and characterization of Bacillus amyloliquefaciens ZDS-1:Exploring the degradation of zearalenone by Bacillus spp[J]. Food Control,2016,68(10):244−250.
[16] GONZÁLEZ PEREYRA M L, DI GIACOMO A L, LARA A L, et al. Aflatoxin-degrading Bacillus sp. strains degrade zearalenone and produce proteases, amylases and cellulases of agro-industrial interest[J]. Toxicon,2020,180(C):43−48.
[17] SUN X, HE X, XUE K S, et al. Biological detoxification of zearalenone by Aspergillus niger strain FS10[J]. Food and Chemical Toxicology,2014,72(10):76−82.
[18] OKWARA P C, AFOLABI I S, AHUEKWE E F. Application of laccase in aflatoxin B1 degradation:A review[J]. IOP Conference Series:Materials Science and Engineering,2021,1107(1):012178−012189. doi: 10.1088/1757-899X/1107/1/012178
[19] LOI M, FANELLI F, CIMMARUSTI M T, et al. In vitro single and combined mycotoxins degradation by Ery4 laccase from Pleurotus eryngii and redox mediators[J]. Food Control,2018,90(8):401−406.
[20] SONG Y, WANG Y, GUO Y, et al. Degradation of zearalenone and aflatoxin B1 by Lac2 from Pleurotus pulmonarius in the presence of mediators[J]. Toxicon,2021,201(15):1−8.
[21] 何音华. 蜜环菌发酵玉米蛋白粉产物中活性蛋白分离纯化及功能活性研究[D]. 长春:吉林农业大学, 2018. [HE Y H. Separation, purification and function activities of active proteins from the fermentation products of Armillaria mellea[D]. Changchun:Jilin Agricultural Unversity, 2018.] HE Y H. Separation, purification and function activities of active proteins from the fermentation products of Armillaria mellea[D]. Changchun: Jilin Agricultural Unversity, 2018.
[22] 骆翼. 玉米赤霉烯酮的微生物脱毒研究[D]. 上海:上海交通大学, 2014. [LUO Y. Study of detoxification of zearalenone by Bacillus spp D]. Shanghai:Shanghai Jiaotong University, 2014.
[23] 金博文. 玉米赤霉烯酮降解菌株的分离、鉴定及降解特性的研究[D]. 大连:大连理工大学, 2020. [JIN B W. Isolation, identification and degradation of a zearalenone-degrading Sphingobacterium multivorum[D]. Dalian:Dalian University of Technology, 2020.] JIN B W. Isolation, identification and degradation of a zearalenone-degrading Sphingobacterium multivorum[D]. Dalian: Dalian University of Technology, 2020.
[24] 景思源. 玉米赤霉烯酮降解菌株的筛选及其降解效果研究[D]. 长春:吉林大学, 2021. [JING S Y. Screening of zearalenone degrading bacteria and its degradation effect[D]. Changchun:Jilin University, 2021.] JING S Y. Screening of zearalenone degrading bacteria and its degradation effect[D]. Changchun: Jilin University, 2021.
[25] 刘天睿, 张薇薇, 王忠巧, 等. 蜜环菌胞外酶和多糖含量变化规律研究[J]. 中药材,2019,42(1):57−61. [LIU T R, ZHANG W W, WANG Z Q, et al. Law of content change of extracellular enzymes and polysaccharides in Armillaria gallica[J]. Journal of Chinese Medicinal Materials,2019,42(1):57−61.] doi: 10.13863/j.issn1001-4454.2019.01.012 LIU T R, ZHANG W W, WANG Z Q, et al. Law of content change of extracellular enzymes and polysaccharides in Armillaria gallica[J]. Journal of Chinese Medicinal Materials, 2019, 42(1): 57−61. doi: 10.13863/j.issn1001-4454.2019.01.012
[26] 韦锦范. 平菇漆酶菌株的筛选及其对黄曲霉毒素的降解研究[D]. 南宁:广西大学, 2019. [WEI J F. Screening of high-producing laccase Plurotus ostreatus strains and their degradation of aflatoxins[D]. Nanning:Guangxi University, 2019.] WEI J F. Screening of high-producing laccase Plurotus ostreatus strains and their degradation of aflatoxins[D]. Nanning: Guangxi University, 2019.
[27] WANG Y Q, GUIQIN B I, ZHANG H L, et al. Screening of chlorobenzene-degrading bacteria and a study of their degrading performance[J]. Industrial Water & Wastewater,2003,34(6):35−36.
[28] TAN H, ZHANG Z, HU Y, et al. Isolation and characterization of Pseudomonas otitidis TH-N1 capable of degrading zearalenone[J]. Food Control,2015,47(1):285−290.
[29] IMADE F N, HUMZA M, DADA O A, et al. Isolation and characterization of novel soil bacterium, Klebsiella pneumoniae strain GS7-1 for the degradation of zearalenone in major cereals[J]. Food Control,2023,143(1):109287−109287.
[30] BANU I, LUPU A, APRODU I. Degradation of zearalenone by laccase enzyme[J]. Scientific Study & Research Chemistry & Chemical Engineering Biotechnology Food Industry,2014,14(2):79−84.
[31] 白长胜, 刘秋瑾, 尹珺伊, 等. 产木质纤维素降解酶真菌的筛选及产酶特性[J]. 微生物学通报,2023,50(3):1098−1110. [BAI C S, LIU Q J, YIN J Y, et al. Screening and enzymatic characterization of the fungal strains producing lignocellulose-degrading enzymes[J]. Microbiology China,2023,50(3):1098−1110.] doi: 10.13344/j.microbiol.china.220632 BAI C S, LIU Q J, YIN J Y, et al. Screening and enzymatic characterization of the fungal strains producing lignocellulose-degrading enzymes[J]. Microbiology China, 2023, 50(3): 1098−1110. doi: 10.13344/j.microbiol.china.220632
[32] 祝嫦巍, 鲍广稳, 黄顺. 平菇漆酶对不同重金属胁迫的响应[J]. 环境科学研究,2015,28(10):1631−1637. [ZHU C W, BAO G W, HUANG S. Change in laccase activities of Pleurotus ostreatus in response to heavy metals in liquid culture[J]. Research of Environmental Sciences,2015,28(10):1631−1637.] doi: 10.13198/j.issn.1001-6929.2015.10.19 ZHU C W, BAO G W, HUANG S. Change in laccase activities of Pleurotus ostreatus in response to heavy metals in liquid culture[J]. Research of Environmental Sciences, 2015, 28(10): 1631−1637. doi: 10.13198/j.issn.1001-6929.2015.10.19





 下载:
下载:
 下载:
下载:
