Research Progress on Application of Deep Eutectic Solvent in the Extraction of Carotenoids
-
摘要: 类胡萝卜素是一种脂溶性化合物,具有抗氧化、保护视力等作用,对人体健康具有诸多益处。低共熔溶剂(Deep eutectic solvent,DES)是一种新型绿色溶剂,相较于传统有机溶剂,具有制备简单、生物相容性高、生物降解性好、溶剂化效率高、热稳定性好、挥发性低等优点,可应用于食物中天然物质的绿色高效提取,目前在类胡萝卜素提取上的研究尚处于起步阶段。本文简述了DES的性质与分类,重点综述了DES在提取类胡萝卜素上的研究进展,介绍了类胡萝卜素与DES的分离方法,指出了DES在类胡萝卜素提取分离上存在的问题,展望了DES用于类胡萝卜素提取分离的应用前景,以期为类胡萝卜素新型绿色提取溶剂的开发和应用提供借鉴。Abstract: Carotenoids are a class of fat-soluble compounds widely associated with human health, because of their antioxidant, vision-protective and other effects. Deep eutectic solvents (DESs) are a new generation of green solvents. DESs are convenient to produce and have higher biocompatibility, biodegradability, solvent efficiency, thermal stability, and lower volatility compared to traditional organic solvents. Although DES has exhibited effective extraction on natural substances in food, its application on the extraction of carotenoids have not yet been widely studied. In this paper, the characteristics and classification of DES are described, the application of DES on extraction of carotenoids is reviewed, the existing problems for the separation of carotenoids from DES are proposed, and the application perspective of DES in the extraction and separation of carotenoids is outlined, aiming to provide a reference for the development and application of new green solvents for carotenoid extraction.
-
Keywords:
- deep eutectic solvent /
- carotenoids /
- extraction /
- separation
-
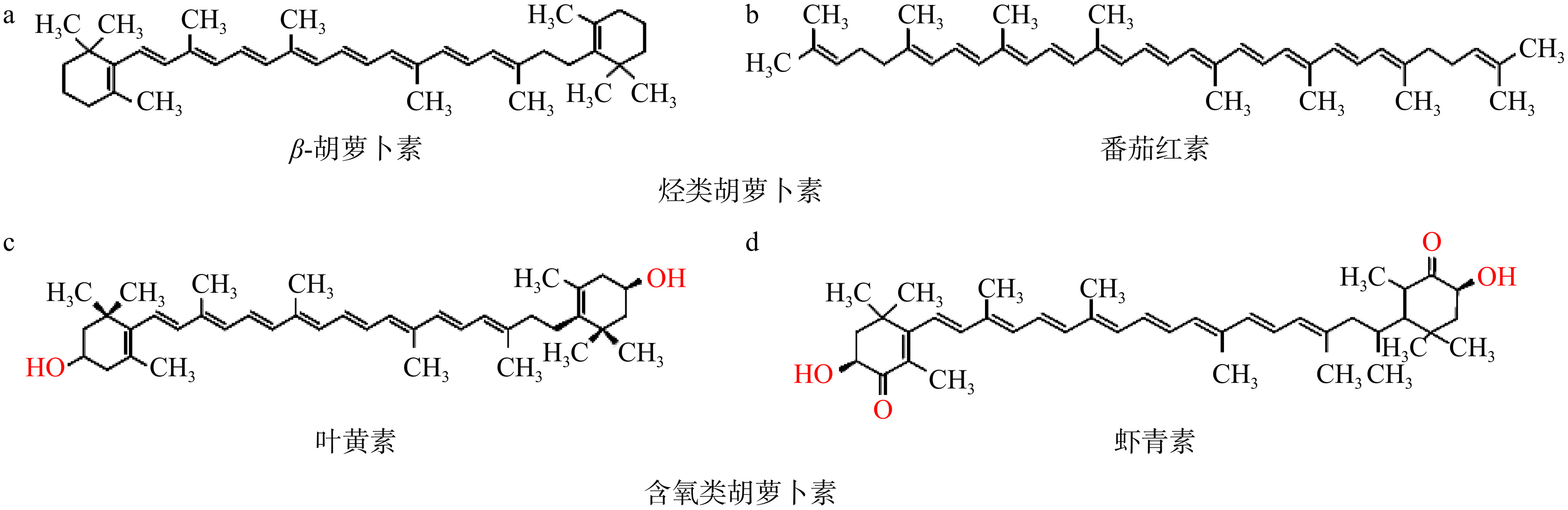
类胡萝卜素是一类重要的天然色素,普遍存在于动物、高等植物、藻类、真菌及细菌中[1]。类胡萝卜素是脂溶性四萜类化合物,具有聚异戊二烯结构,按照官能团的不同,可将其分为两大类:烃类和含氧类胡萝卜素(图1)[2]。烃类类胡萝卜素的分子结构中只含有碳氢元素,如β-胡萝卜素和番茄红素;而含氧类胡萝卜素的分子结构中除碳氢元素外,还含有氧元素,具有环氧基、羟基、酮基、羧基、甲氧基等含氧官能团,如虾青素和叶黄素[3]。类胡萝卜素的特殊分子结构赋予了其自身多种重要功能,如β-胡萝卜素分子结构中存在的多个不饱和双键和共轭双键,使其具有抗氧化、提高人体免疫力、抗辐射等生物活性[4−5];番茄红素分子结构中含有的11个共轭双键和2个非共轭双键的特殊结构赋予了其极强的抗氧化、免疫调节和抗癌能力,对心血管疾病、眼部疾病等也有一定的预防作用[6−7];叶黄素是构成人眼视网膜黄斑区域的主要色素,对于维持眼部健康、保护视力具有积极作用[8−9];虾青素分子多烯链两端存在的羟基(OH)和酮基(C=O)结构,使其具有降血糖、抗氧化、抗炎、抗肿瘤、预防心脑血管疾病和神经保护等功能[10−11]。此外,虾青素还具有较好的着色功能[12]。类胡萝卜素的这些重要功能,使其在食品、医药、化妆品等行业均具有较为广泛的应用[13]。但由于人体自身不能合成类胡萝卜素,必须依靠食物获得[14],因此从膳食或膳食补充剂中获取足量的类胡萝卜素,对于人体正常生理功能的发挥和身体健康的提升具有重要意义。
目前类胡萝卜素的产业化提取通常使用正己烷、丙酮和甲醇等有机溶剂[15]。有机溶剂提取法具有操作简单、提取率高等优点,广泛应用于工业化生产类胡萝卜素产品。但是,由于有机溶剂提取时存在挥发性强、对人体和环境有害等问题,寻求更环保和毒性更低的替代溶剂变得愈发重要。因此,研究人员一直致力于寻求新的可替代绿色溶剂,以获得更加绿色、安全的类胡萝卜素提取物。低共熔溶剂(Deep eutectic solvent,DES)是一种新型的绿色溶剂,具有在室温下蒸汽压低、绿色环保、制备过程简单、成本低、可生物降解等优点,且由于其结构的多样性和广泛的适用性[16],近年来受到了研究人员的广泛关注。在天然产物提取上,DES目前多应用于多酚类[17]、多糖类[18]和生物碱类[19]等生物活性物质的提取,而对类胡萝卜素的提取研究尚处于起步阶段。由于DES极性和粘度可调,其在类胡萝卜素的提取方面表现出很大的应用潜力[20]。
本文介绍了DES的性质和分类,综述了近年来DES在类胡萝卜素提取上的研究进展,总结了类胡萝卜素的分离及DES的回收方法,指出了目前DES提取类胡萝卜素存在的问题,并展望了DES在类胡萝卜素提取分离上的应用前景,以期为新型类胡萝卜素提取溶剂的开发和应用提供借鉴和参考。
1. 低共熔溶剂的性质和分类
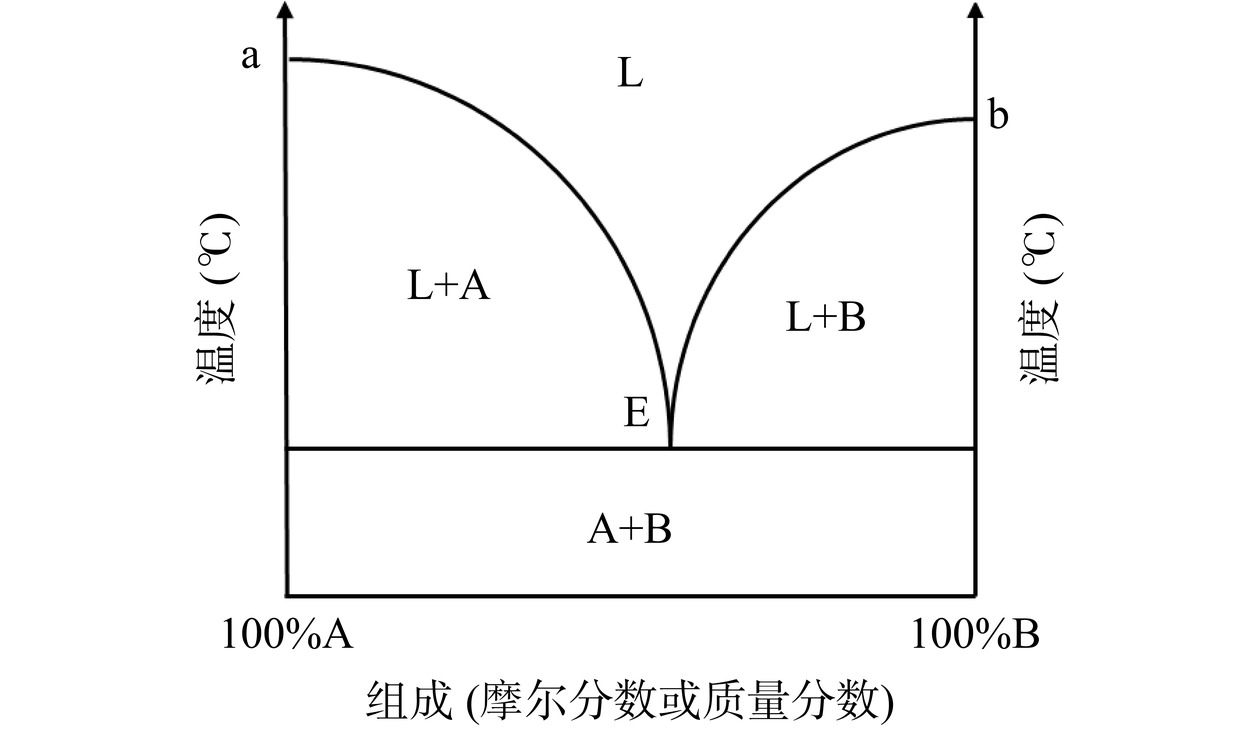
DES是一种新型的绿色溶剂,由氢键供体(Hydrogen bond donor,HBD)和氢键受体(Hydrogen bond acceptor,HBA)通过氢键作用形成,二者在一定温度下以一定摩尔比混合,制备的DES体系熔点至少低于其中一种组分[16,21](图2中E点即为DES熔点)。当使用天然物质作为组分时,所形成的DES被称为天然低共熔溶剂(Natural deep eutectic solvent,NADES)[22]。研究表明,DES具有制备简单、原料易得、成本低廉、可生物降解等优点。此外,DES还具有独特的溶解能力,既可用于亲水性化合物也可用于疏水性化合物的提取,且毒性低、粘度可调、极性范围广[23−24]。更重要的是,由于组分安全且绿色,DES被判定为无毒[25]。
由于HBA和HBD的种类繁多,形成的DES体系的理化性质也是可调节的,从而可以满足不同工业应用的广泛需求。根据对水的亲和力,DES可分为亲水性DES和疏水性DES。由于其固有的氢键作用力,大部分DES通常表现出高度的亲水性,组成成分具有较高的极性且可与水混溶;而疏水性DES由水溶性较差的物质组成,通常具有较低的粘度和极性,并且与水不混溶[26]。DES的亲水性和疏水性对生物活性物质的提取分离效果有很大影响,亲水性DES在提取极性较强的天然产物方面表现出较好的效果,如生物碱[27]、黄酮类[28]、黄嘌呤[29]、儿茶素[30]和精油[31]等,但不适合于含水或者亲脂性样品的提取。疏水性DES在类胡萝卜素等疏水性生物活性物质的提取上得到了成功的应用[32−33]。
2. 低共熔溶剂在类胡萝卜素提取上的应用
作为一种新型的绿色溶剂,DES在类胡萝卜素的提取上展现出巨大的潜力。目前,DES在类胡萝卜素提取上的应用方式主要有以下三种:a.DES作为溶剂直接提取;b.DES作为助剂,辅助有机溶剂提取;c.其他方法如超声波、微波和酶等辅助DES提取(详见表1)。由于类胡萝卜素自身具有较强的亲脂性,在其提取上多利用疏水性DES(如薄荷醇基DES和中链饱和脂肪酸基DES),这些DES在极性更弱的类胡萝卜素,如β-胡萝卜素和番茄红素的提取上表现出不错的效果。此外,也有一些研究利用极性相对较强的亲水性DES提取类胡萝卜素(如氯化胆碱基DES和醇基DES),这些DES对极性相对较强的类胡萝卜素,如叶黄素和虾青素的提取效果更好。
表 1 DES在类胡萝卜素提取中的应用Table 1. Application of DES in carotenoid extraction提取方式 类胡萝卜
素种类动植物来源 DES组成及其摩尔比 提取条件 提取结果 参考文献 HBA HBD 摩尔比 DES作为溶剂直接提取 叶黄素 微藻 百里酚 葑醇 1:1 料液比50 mL/g,温度60 ℃,
时间70 min6260 μg/g [34] 棕榈油 碳酸钾 甘油 1:4 料液比10 mL/g,时间180 min 1880 μg/g [35] β-胡萝卜素 枸杞 氯化胆碱 丙二酸 1:1 (2 g DES+30 mL甲醇+10 mL己烷)/g样品,温度20 ℃,时间240 min,
超声功率250 W10 μg/g [36] 南瓜 C8 C10 3:1 料液比7 mL/g,温度50 ℃,时间
10 min,超声功率60%(52.5 W/cm3)1057 μg/g [37] 虾青素 雨生红球藻 百里酚 油酸 3:1 料液比40 mL/g,时间360 min 提取率83% [38] β-胡萝卜素 复合维生
素果汁L-薄荷醇 丁基化羟
基甲苯3:1 料液比400 μL/mL,时间2 min 1.70 μg/mL [39] 西瓜汁 C9 C10:C11 2:1:1 时间0.5 min 2.32 μg/L [40] 番茄红素 西瓜汁 C9 C10:C11 2:1:1 时间0.5 min 3.85 μg/L [40] DES作为助剂,辅助有机溶剂提取 虾青素 虾废料 氯化胆碱 甘油 1:2 料液比10 mL/g,温度60 ℃,时间
10 min,超声功率50/60 Hz32.71 μg/g [41] 虾废料 氯化胆碱 酒石酸 2:1 料液比10 mL/g,温度30~35 ℃,时间
5 min,超声功率600 W78.50 μg/g [42]
[42]氯化胆碱 酒石酸 料液比20 mL/g,温度52 ℃,时间7 min,微波功率30 W 267 μg/g 三疣梭子蟹 甲基三苯基溴化膦 1,2-丁二醇 1:4 (40 mL丙酮+0.25 mg/mLDES)/g样品,时间90 min,超声功率65 W 73.49 μg/g [43] β-胡萝卜素 布里奇果 氯化胆碱 乙二醇 1:2 料液比20 mL/g,温度50 ℃,
时间30 min果浆:10060 μg/g [44] 甘油 1:2 [44] 甘油:木糖醇 1:2:0.5 果皮:10430 μg/g [44] 甘油:聚乙二醇 1:2:0.5 [44] 超声波辅助提取 番茄红素 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度70 ℃,时间
10 min,超声功率100 W1447 μg/g [45] 虾青素 虾壳 氯化胆碱 1,2-丁二醇 1:5 料液比15 mL/g,时间30 min,
超声功率70 W146 μg/g [46]
β-胡萝卜素番茄皮渣 乳酸乙酯 乙酸乙酯 30:70(v/v) 料液比100 mL/g,温度63 ℃,
时间20 min3950 μg/g [47] 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度63 ℃,
时间20 min2923 μg/g [47] 番茄红素 番茄皮渣 乳酸乙酯 乙酸乙酯 30:70(v/v) 料液比100 mL/g,温度63 ℃,
时间20 min76 μg/g [47] 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度63 ℃,
时间20 min83 μg/g [47] 酶法辅助
提取叶黄素 向日葵花 DL-薄荷醇 乳酸 1:2 料液比67 mL/g,温度40 ℃,时间
120 min,戊聚糖复合酶浓度0.58%(v/v)14490 μg/g [48] 注:C8-辛酸;C9-壬酸;C10-癸酸;C11-十一烷酸。 2.1 低共熔溶剂作为溶剂直接提取类胡萝卜素
DES作为溶剂直接提取类胡萝卜素的研究中,提取叶黄素的较多,且DES的提取效果优于有机溶剂。研究显示,百里酚-葑醇NADES对微藻中叶黄素的提取率是传统有机溶剂正庚烷-乙醇-水的6倍[34]。此外,碳酸钾-甘油DES也可成功地从粗棕榈油中提取叶黄素[35]。叶黄素是一种具有两个羟基的类胡萝卜素,具有一定的极性,故相较于极性低的传统有机溶剂,极性较强的DES对其提取效果更好。DES作为溶剂直接提取β-胡萝卜素的研究也有报道。亲水性较强的氯化胆碱:丙二酸(1:1)DES对枸杞中总胡萝卜素的提取率(10 μg/g)是有机溶剂(己烷:乙醇:丙酮:甲苯=10:6:6:7,v/v/v/v)和超临界CO2萃取的5倍多[36]。此外,疏水性较强的中链饱和脂肪酸基DES(辛酸:癸酸)也可成功地将β-胡萝卜素从南瓜中提取出来[37]。在结构上,相较于叶黄素,β-胡萝卜素的羟基数目更少,故其极性弱于叶黄素;但因β-胡萝卜素结构中存在2个β-紫罗酮环,赋予其比无环类胡萝卜素如番茄红素更强的极性,因此β-胡萝卜素具有相对中等的极性,使得亲水性较强的DES和疏水性较强的DES均能很好地提取该物质。
DES作为溶剂直接提取类胡萝卜素时,提取效果与DES和目标提取物之间的极性有较大关系。根据相似相溶原理,采用合适极性的DES提取极性相近的类胡萝卜素会有更好的效果。
2.2 低共熔溶剂作为助剂辅助有机溶剂提取类胡萝卜素
当DES作为助剂使用时,合适的DES种类及添加量,可以达到改变传统有机溶剂的粘度和极性的效果,更有利于类胡萝卜素的提取。DES作为助剂辅助有机溶剂提取类胡萝卜素的研究以虾青素提取为主。氯化胆碱-酒石酸DES辅助甲醇(80:20,v/v)对虾废料中虾青素的提取率是单独使用甲醇提取时的1.1倍(分别为267.00±2.50、239.20±0.63 μg/g)[42]。0.25 mg/mL的醇基DES(甲基三苯基溴化膦:1,2-丁二醇=1:4)作为助剂,辅助丙酮从三疣梭子蟹中提取虾青素的提取率是不加DES组的3倍多(分别为73、23 µg/g)[43]。虾青素结构中的-OH和C=O赋予了其自身较大的极性,有机试剂中添加合适浓度的DES可以降低溶剂粘度并增加萃取基质的极性。此外,DES浓度的增大也增加了其与目标化合物之间的氢键相互作用,也会使虾青素的提取率增加。故添加合适浓度的、极性较高的DES,诸如醇基DES和氯化胆碱基DES,可以使虾青素更好地溶解在极性相似的溶剂中,从而获得较高的提取率[49]。
以上研究表明,溶剂的粘度和极性都会对类胡萝卜素的提取结果产生很大的影响,添加合适种类和浓度的DES能够改善有机溶剂的极性和粘度,从而获得更高的类胡萝卜素提取率。
2.3 其他方法辅助低共熔溶剂提取类胡萝卜素
除了上述两种应用方式,也有研究利用超声波、微波或酶辅助DES提取类胡萝卜素。通过借助其他方法,可以进一步增强DES对类胡萝卜素的提取效果。其中,超声波辅助DES提取法的应用多集中于番茄红素和虾青素。研究显示,超声波辅助法有效提高了DL-薄荷醇-乳酸DES对番茄皮渣中番茄红素的提取效果,超声波辅助后的提取率是未经超声波辅助的1.6倍[45]。超声波辅助氯化胆碱-1,2-丁二醇DES对虾壳粉末中虾青素的提取率分别是室温搅拌法和加热辅助法的2.2倍和1.2倍(提取率分别为75、34、62 µg/g)[46]。超声波辅助法可以显著增强DES对类胡萝卜素的提取率可能是因为,一方面超声波和DES之间存在着协同作用,从而增强了传质效率,提高了类胡萝卜素的提取率。另一方面,超声波仪器发射的高频脉冲会产生空化气泡,当这些气泡在物质表面附近破裂时,会导致细胞破裂以及固体粉碎,从而使得溶剂的传质阻力降低,提高了传质效率[50]。此外,微波辅助和酶法辅助DES提取类胡萝卜素也得到了不错的效果,如微波辅助甲醇-氯化胆碱-酒石酸DES对虾废料中虾青素的提取率是微波辅助甲醇提取的1.1倍(提取率分别为267.00±2.50、239.20±0.63 μg/g)[42],酶法辅助DL-薄荷醇-乳酸DES对向日葵花中叶黄素的提取率是不加酶提取的9.9倍(分别为14490、1470 μg/g)[48]。
综上,DES作为溶剂,与各辅助方法之间具有协同作用,同时辅助手段又通过对植物基质或细胞的破坏作用增强传质效率,因此能大大增加类胡萝卜素的提取率。
2.4 低共熔溶剂的分离及类胡萝卜素的回收
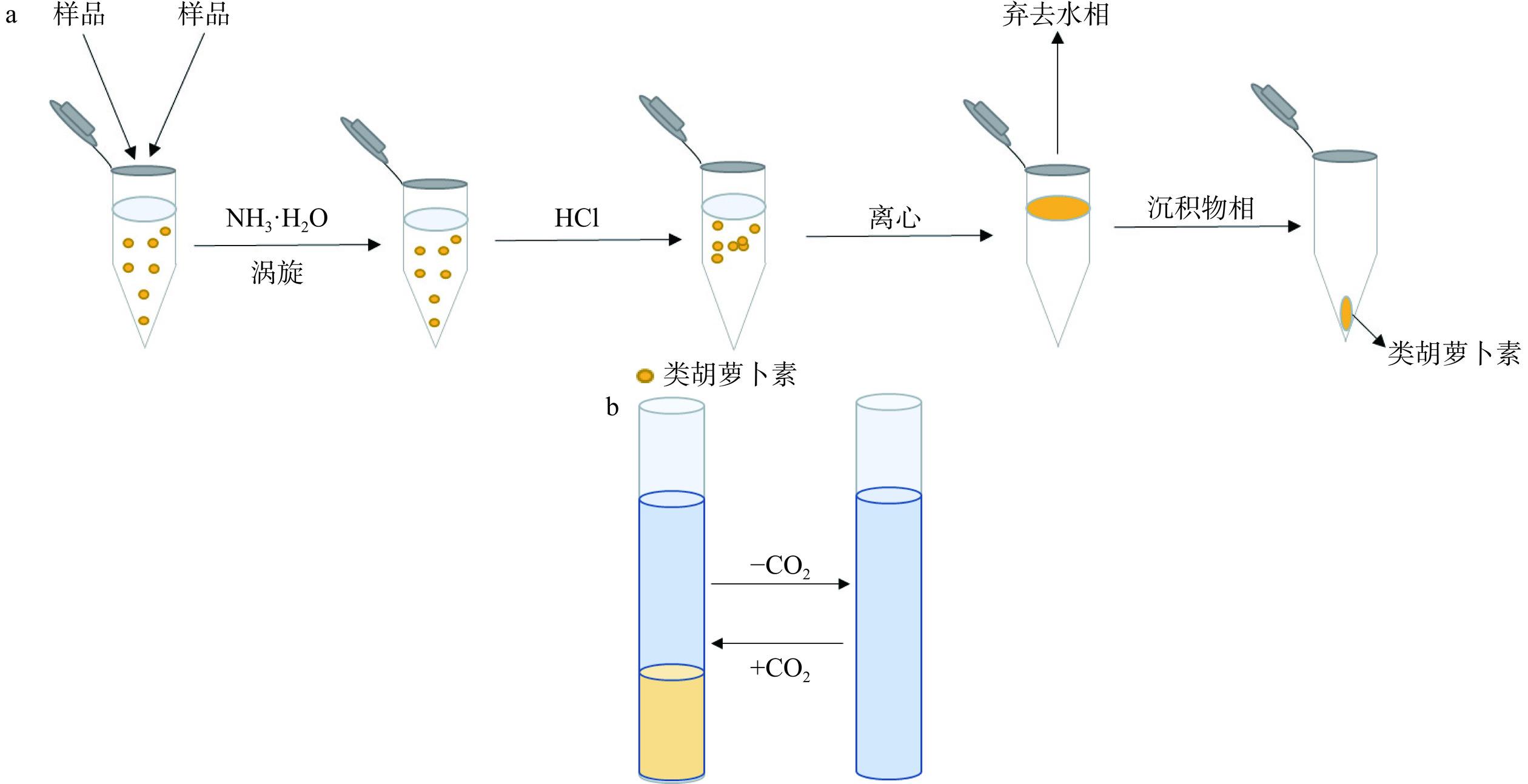
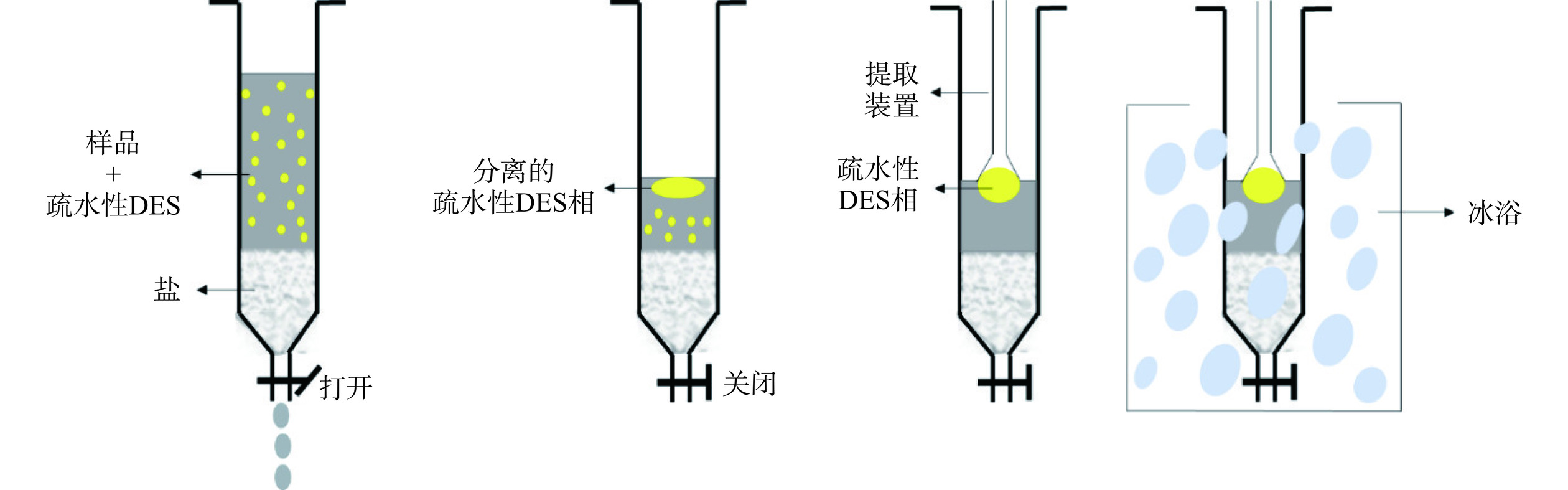
与挥发性有机溶剂相比,DES的优点之一是蒸汽压较低,然而这种优势会导致很难使用蒸发法从中回收生物活性物质。目前在类胡萝卜素的回收方面,研究多利用脂肪酸基NADES的极性可调性,将类胡萝卜素与提取溶剂分离开。如图3所示,NH3·H2O的加入可以使NADES提取物极性发生转变,从而将类胡萝卜素沉淀到底部,经简单过滤即可实现类胡萝卜素的分离;CO2可以使NADES和氨溶液之间发生相分离,经离心即可实现NADES的回收。整个分离回收过程能够实现溶剂极性的快速转换,且不需要复杂的试验操作,对试验环境和设备也没有很高的要求,可以用于类胡萝卜素的回收[37,40,51]。此外,虽然目前离心仍然是实验室最常用的分离方法,但Shahbodaghi等[52]发现,不采取离心操作,利用盐析效应用含盐固相萃取柱也能够更简单地从分散液中快速分离DES,程序如图4所示。一旦混浊的混合溶剂流经含盐固相萃取柱,样品溶液与盐之间的离子交换作用增加,从而也会使疏水性DES发生相分离。
3. 总结与展望
DES作为一种绿色溶剂,在类胡萝卜素提取方面已经得到了成功的应用,现有研究发现其提取效果普遍优于传统有机溶剂。目前,DES在类胡萝卜素的提取上主要有三种应用方式:a.DES作为溶剂直接提取;b.DES作为助剂辅助有机溶剂提取;c.其他方法辅助DES提取。当DES作为溶剂直接提取类胡萝卜素时,HBA和HBD种类的选择很大程度上决定着提取效果。合适粘度的DES可以增加传质效率,合适极性和溶剂化能力的DES能够更多地溶解目标化合物,获得更好的提取效果。当DES作为助剂辅助有机溶剂提取类胡萝卜素时,选择合适的DES种类及添加量,更有利于类胡萝卜素的提取。此外,借助其他方法,如超声波辅助DES提取类胡萝卜素,能够进一步增加类胡萝卜素的提取率。总的来说,DES由于其自身特有的性质,不论以何种方式应用于类胡萝卜素的提取,均表现出了比传统有机溶剂更好的提取效果。在实际操作中,充分考虑溶剂与目标化合物之间的极性关系,会得到更高的提取率。
虽然DES在类胡萝卜素的提取上已表现出了较大的优势,但是仍然存在一些问题,有待今后进一步的研究。a.继续开发探究其他更多类型的DES,目前用于类胡萝卜素提取的DES种类较少,HBA主要集中于中链饱和脂肪酸、氯化胆碱和萜烯类物质,HBD主要为单羧酸。b.进一步考察不同类型DES对同一种类胡萝卜素提取效果的影响,以及同种DES对不同类胡萝卜素提取效果的影响。独特的极性和可调节的粘度作为DES的优势,也是影响类胡萝卜素提取效果的关键因素,系统探究DES自身物理性质与类胡萝卜素提取率之间的关系,能够为今后更精准地开发用于类胡萝卜素提取的其他类型DES提供基础与支持。c.寻找更多DES与类胡萝卜素高效分离的方法,提取物与溶剂的分离是后续研究目标物质性质和应用的前提,然而目前的研究尚停留在对DES提取类胡萝卜素工艺的优化方面,对于DES与类胡萝卜素分离的方法报道较少,且现有的分离方法多基于中链饱和脂肪酸基DES,该方法是否同样适用于其他类型DES则有待进一步考察。d.进一步考察用于类胡萝卜素提取的DES的循环利用性能,真正实现提取溶剂的高效利用。e.鉴于DES的可设计性,未来研究中可以增加DES的组分构建三元DES。三元DES可以在二元DES提取效果的基础上,进一步实现对于特定类胡萝卜素的更高效提取,或者实现对于不同极性类胡萝卜素的同时高效提取,以达到更优良的提取效果。总体来说,DES对类胡萝卜素提取的研究仍处于初步阶段,今后还需开展更加系统全面的探究。
-
表 1 DES在类胡萝卜素提取中的应用
Table 1 Application of DES in carotenoid extraction
提取方式 类胡萝卜
素种类动植物来源 DES组成及其摩尔比 提取条件 提取结果 参考文献 HBA HBD 摩尔比 DES作为溶剂直接提取 叶黄素 微藻 百里酚 葑醇 1:1 料液比50 mL/g,温度60 ℃,
时间70 min6260 μg/g [34] 棕榈油 碳酸钾 甘油 1:4 料液比10 mL/g,时间180 min 1880 μg/g [35] β-胡萝卜素 枸杞 氯化胆碱 丙二酸 1:1 (2 g DES+30 mL甲醇+10 mL己烷)/g样品,温度20 ℃,时间240 min,
超声功率250 W10 μg/g [36] 南瓜 C8 C10 3:1 料液比7 mL/g,温度50 ℃,时间
10 min,超声功率60%(52.5 W/cm3)1057 μg/g [37] 虾青素 雨生红球藻 百里酚 油酸 3:1 料液比40 mL/g,时间360 min 提取率83% [38] β-胡萝卜素 复合维生
素果汁L-薄荷醇 丁基化羟
基甲苯3:1 料液比400 μL/mL,时间2 min 1.70 μg/mL [39] 西瓜汁 C9 C10:C11 2:1:1 时间0.5 min 2.32 μg/L [40] 番茄红素 西瓜汁 C9 C10:C11 2:1:1 时间0.5 min 3.85 μg/L [40] DES作为助剂,辅助有机溶剂提取 虾青素 虾废料 氯化胆碱 甘油 1:2 料液比10 mL/g,温度60 ℃,时间
10 min,超声功率50/60 Hz32.71 μg/g [41] 虾废料 氯化胆碱 酒石酸 2:1 料液比10 mL/g,温度30~35 ℃,时间
5 min,超声功率600 W78.50 μg/g [42]
[42]氯化胆碱 酒石酸 料液比20 mL/g,温度52 ℃,时间7 min,微波功率30 W 267 μg/g 三疣梭子蟹 甲基三苯基溴化膦 1,2-丁二醇 1:4 (40 mL丙酮+0.25 mg/mLDES)/g样品,时间90 min,超声功率65 W 73.49 μg/g [43] β-胡萝卜素 布里奇果 氯化胆碱 乙二醇 1:2 料液比20 mL/g,温度50 ℃,
时间30 min果浆:10060 μg/g [44] 甘油 1:2 [44] 甘油:木糖醇 1:2:0.5 果皮:10430 μg/g [44] 甘油:聚乙二醇 1:2:0.5 [44] 超声波辅助提取 番茄红素 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度70 ℃,时间
10 min,超声功率100 W1447 μg/g [45] 虾青素 虾壳 氯化胆碱 1,2-丁二醇 1:5 料液比15 mL/g,时间30 min,
超声功率70 W146 μg/g [46]
β-胡萝卜素番茄皮渣 乳酸乙酯 乙酸乙酯 30:70(v/v) 料液比100 mL/g,温度63 ℃,
时间20 min3950 μg/g [47] 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度63 ℃,
时间20 min2923 μg/g [47] 番茄红素 番茄皮渣 乳酸乙酯 乙酸乙酯 30:70(v/v) 料液比100 mL/g,温度63 ℃,
时间20 min76 μg/g [47] 番茄皮渣 DL-薄荷醇 乳酸 8:1 料液比120 mL/g,温度63 ℃,
时间20 min83 μg/g [47] 酶法辅助
提取叶黄素 向日葵花 DL-薄荷醇 乳酸 1:2 料液比67 mL/g,温度40 ℃,时间
120 min,戊聚糖复合酶浓度0.58%(v/v)14490 μg/g [48] 注:C8-辛酸;C9-壬酸;C10-癸酸;C11-十一烷酸。 -
[1] KOPEC R E, FAILLA M L. Recent advances in the bioaccessibility and bioavailability of carotenoids and effects of other dietary lipophiles[J]. Journal of Food Composition and Analysis,2018,68:16−30. doi: 10.1016/j.jfca.2017.06.008
[2] 陈璇. 黄酮类化合物(槲皮素、木犀草素)与类胡萝卜素(番茄红素、叶黄素)协同抗氧化作用及分子机制[D]. 南昌:南昌大学, 2022. [CHEN X. Synergistic antioxidant effects and mechanisms of flavonoids (quercetin, luteolin) and carotenoids (lycopene, lutein)[D]. Nanchang:Nanchang University, 2022.] CHEN X. Synergistic antioxidant effects and mechanisms of flavonoids (quercetin, luteolin) and carotenoids (lycopene, lutein)[D]. Nanchang: Nanchang University, 2022.
[3] 朱明明, 樊明涛, 何鸿举. 类胡萝卜素降解方式的研究进展[J]. 食品科学,2017,38(11):308−317. [ZHU M M, FAN M T, HE H J. Advances in methods for the degradation of carotenoids[J]. Food Science,2017,38(11):308−31.] ZHU M M, FAN M T, HE H J. Advances in methods for the degradation of carotenoids[J]. Food Science, 2017, 38(11): 308−31.
[4] 曲蕙名, 楚杰, 韩利文, 等. β-胡萝卜素提取方法、生理功能及应用研究进展[J]. 中国食物与营养,2017,23:37−41. [QU H M, CHU J, HAN L W, et al. Research progress on extraction methods, physiological function and application of β-carotene[J]. Food and Nutrition in China,2017,23:37−41.] doi: 10.3969/j.issn.1006-9577.2017.08.010 QU H M, CHU J, HAN L W, et al. Research progress on extraction methods, physiological function and application of β-carotene[J]. Food and Nutrition in China, 2017, 23: 37−41. doi: 10.3969/j.issn.1006-9577.2017.08.010
[5] 李艳艳. 低共熔溶剂微萃取用于色素检测技术研究[D]. 昆明:昆明理工大学, 2020. [LI Y Y. Research on pigment detection by eutectic solvent microextraction technology[D]. Kunming:Kunming University of Science and Technology, 2020.] LI Y Y. Research on pigment detection by eutectic solvent microextraction technology[D]. Kunming: Kunming University of Science and Technology, 2020.
[6] LIANG X, MA C, YAN X, et al. Advances in research on bioactivity, metabolism, stability and delivery systems of lycopene[J]. Trends in Food Science & Technology,2019,93:185−196.
[7] MCCLEMENTS D J. Nano-enabled personalized nutrition:Developing multicomponent-bioactive colloidal delivery systems[J]. Advances in Colloid and Interface Science,2020,282:102211. doi: 10.1016/j.cis.2020.102211
[8] 徐亚元, 李新甜, 戴竹青, 等. 界面结构对叶黄素纳米结构脂质载体生物可及性及稳定性的影响[J]. 中国食品学报,2023,23:20−29. [XU Y Y, LI X T, DAI Z Q, et al. Effect of interface structures on the stability and bioaccessibility of lutein nanostructured lipid carriers[J]. Journal of Chinese Institute of Food Science and Technology,2023,23:20−29.] doi: 10.16429/j.1009-7848.2023.03.003 XU Y Y, LI X T, DAI Z Q, et al. Effect of interface structures on the stability and bioaccessibility of lutein nanostructured lipid carriers[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23: 20−29. doi: 10.16429/j.1009-7848.2023.03.003
[9] 吕亚男, 顾青, 李东丽, 等. 叶黄素对转化生长因子-β2诱导的视网膜色素上皮细胞上皮-间质转化的影响[J]. 上海交通大学学报(医学版),2019,39:572−577, 571. [LÜ Y N, GU Q, LI D L, et al. Effects of lutein on transforming growth factor-β2 induced epithelial-mesenchymal transition in ARPE-19 cells[J]. Journal of Shanghai Jiao Tong University (Medical Science),2019,39:572−577, 571.] LÜ Y N, GU Q, LI D L, et al. Effects of lutein on transforming growth factor-β2 induced epithelial-mesenchymal transition in ARPE-19 cells[J]. Journal of Shanghai Jiao Tong University (Medical Science), 2019, 39: 572−577, 571.
[10] KANWUGU O N, GLUKHAREVA T V, DANILOVA I G, et al. Natural antioxidants in diabetes treatment and management:Prospects of astaxanthin[J]. Critical Reviews in Food Science and Nutrition,2022,62(18):5005−5028. doi: 10.1080/10408398.2021.1881434
[11] LANDON R, GUEGUEN V, PETITE H, et al. Impact of astaxanthin on diabetes pathogenesis and chronic complications[J]. Marine Drugs,2020,18(7):357. doi: 10.3390/md18070357
[12] YAO Q, MA J, CHEN X, et al. A natural strategy for astaxanthin stabilization and color regulation:interaction with proteins[J]. Food Chemistry,2023,402:134343. doi: 10.1016/j.foodchem.2022.134343
[13] 黄丹, 李芳华, 王菁, 等. 类胡萝卜素在化妆品中的应用研究进展[J]. 应用化工,2022,51(12):3658−3663. [HUANG D, LI F H, WANG J, et al. Research progress on the application of carotenoids in cosmetics[J]. Applied Chemical Industry,2022,51(12):3658−3663.] doi: 10.3969/j.issn.1671-3206.2022.12.046 HUANG D, LI F H, WANG J, et al. Research progress on the application of carotenoids in cosmetics[J]. Applied Chemical Industry, 2022, 51(12): 3658−3663. doi: 10.3969/j.issn.1671-3206.2022.12.046
[14] 师恩娟, 李智娴, 戴竹青, 等. 类胡萝卜素肠道吸收与代谢的影响因素研究进展[J]. 中国食品学报,2023,23(5):411−420. [SHI E J, LI Z X, DAI Z Q, et al. Research progress on factors affecting intestinal absorption and metabolism of carotenoids[J]. Journal of Chinese Institute of Food Science and Technology,2023,23(5):411−420.] SHI E J, LI Z X, DAI Z Q, et al. Research progress on factors affecting intestinal absorption and metabolism of carotenoids[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(5): 411−420.
[15] VECHIO H, MARIANO A B, VIEIRA R B. A new approach on astaxanthin extraction via acid hydrolysis of wet Haematococcus pluvialis biomass[J]. Journal of Applied Phycology,2021,33(5):2957−2966. doi: 10.1007/s10811-021-02495-z
[16] HANSEN B B, SPITTLE S, CHEN B, et al. Deep eutectic solvents:A review of fundamentals and applications[J]. Chemical Reviews,2021,121(3):1232−1285. doi: 10.1021/acs.chemrev.0c00385
[17] KALTSA O, LAKKA A, GRIGORAKIS S, et al. A green extraction process for polyphenols from elderberry (Sambucus nigra) flowers using deep eutectic solvent and ultrasound-assisted pretreatment[J]. Molecules,2020,25(4):921. doi: 10.3390/molecules25040921
[18] CAI C, WANG Y, YU W, et al. Temperature-responsive deep eutectic solvents as green and recyclable media for the efficient extraction of polysaccharides from Ganoderma lucidum[J]. Journal of Cleaner Production,2020,274:123047. doi: 10.1016/j.jclepro.2020.123047
[19] JIANG Z M, WANG L J, GAO Z, et al. Green and efficient extraction of different types of bioactive alkaloids using deep eutectic solvents[J]. Microchemical Journal,2019,145:345−353. doi: 10.1016/j.microc.2018.10.057
[20] YU J, LIU X, ZHANG L, et al. An overview of carotenoid extractions using green solvents assisted by Z-isomerization[J]. Trends in Food Science & Technology,2022,123:145−160.
[21] HIKMAWANTI N P E, RAMADON D, JANTAN I, et al. Natural deep eutectic solvents (NADES):Phytochemical extraction performance enhancer for pharmaceutical and nutraceutical product development[J]. Plants-Basel,2021,10(10):2091. doi: 10.3390/plants10102091
[22] BENVENUTTI L, FERREIRA ZIELINSKI A A, et al. Which is the best food emerging solvent:IL, DES or NADES?[J]. Trends in Food Science & Technology,2019,90:133−146.
[23] PAUL N, BANERJEE T. Study on the extraction of acetamiprid and imidacloprid from an aqueous environment using menthol-based hydrophobic eutectic solvents:Quantum chemical and molecular dynamics insights[J]. ACS Sustainable Chemistry & Engineering,2022,10(13):4227−4246.
[24] DEL MAR CONTRERAS-GAMEZ M, GALAN-MARTIN A, SEIXAS N, et al. Deep eutectic solvents for improved biomass pretreatment:Current status and future prospective towards sustainable processes[J]. Bioresource Technology,2023,369:128396. doi: 10.1016/j.biortech.2022.128396
[25] MAKOS P, SLUPEK E, GEBICKI J. Hydrophobic deep eutectic solvents in microextraction techniques-A review[J]. Microchemical Journal,2020,152:104384. doi: 10.1016/j.microc.2019.104384
[26] VAN OSCH D, DIETZ C, VAN SPRONSEN J, et al. A search for hydrophobic deep eutectic solvents based on natural components[J]. ACS Sustainable Chemistry & Engineering,2019,7(3):2933−2942.
[27] WANG M, WANG J, ZHOU Y, et al. Ecofriendly mechanochemical extraction of bioactive compounds from plants with deep eutectic solvents[J]. ACS Sustainable Chemistry & Engineering,2017,5(7):6297−6303.
[28] LI L, LIU J Z, LUO M, et al. Efficient extraction and preparative separation of four main isoflavonoids from Dalbergia odorifera T. chen leaves by deep eutectic solvents-based negative pressure cavitation extraction followed by macroporous resin column chromatography[J]. Journal of Chromatography B,2016,1033:40−48.
[29] MACHMUDAH S, LESTARI S D, WIDIYASTUTI, et al. Subcritical water extraction enhancement by adding deep eutectic solvent for extracting xanthone from Mangosteen pericarps[J]. Journal of Supercritical Fluids,2018,133:615−624. doi: 10.1016/j.supflu.2017.06.012
[30] JEONG K M, KO J, ZHAO J, et al. Multi-functioning deep eutectic solvents as extraction and storage media for bioactive natural products that are readily applicable to cosmetic products[J]. Journal of Cleaner Production,2017,151:87−95. doi: 10.1016/j.jclepro.2017.03.038
[31] YU G W, CHENG Q, NIE J, et al. DES-based microwave hydrodistillation coupled with GC-MS for analysis of essential oil from black pepper (Piper nigrum) and white pepper[J]. Analytical Methods,2017,9(48):6777−6784. doi: 10.1039/C7AY02072D
[32] CAO J, YANG M, CAO F, et al. Tailor-made hydrophobic deep eutectic solvents for cleaner extraction of polyprenyl acetates from Ginkgo biloba leaves[J]. Journal of Cleaner Production,2017,152:399−405. doi: 10.1016/j.jclepro.2017.03.140
[33] CAO J, YANG M, CAO F, et al. Well-designed hydrophobic deep eutectic solvents as green and efficient media for the extraction of artemisinin from Artemisia annua leaves[J]. ACS Sustainable Chemistry & Engineering,2017,5(4):3270−3278.
[34] FAN C, LIU Y, SHAN Y, et al. A priori design of new natural deep eutectic solvent for lutein recovery from microalgae[J]. Food Chemistry,2022,376:131930. doi: 10.1016/j.foodchem.2021.131930
[35] MANURUNG R, ALEXANDER. Minor component extraction from palm methyl ester using potassium carbonate glycerol based deep eutectic solvent (DES)[J]. Rasayan Journal of Chemistry,2018,11(4):1519−1524. doi: 10.31788/RJC.2018.1143079
[36] YU Z L, XIA M Q, LI X P, et al. Characterization of carotenoids in Lycium barbarum fruit by using UPC2-PDA-Q-TOF-MSE couple with deep eutectic solvents extraction and evaluation of their 5α-reductase inhibitory activity[J]. Frontiers in Chemistry,2016,10:1052000.
[37] STUPAR A, EREGELJ V, RIBEIRO B D, et al. Recovery of β-carotene from pumpkin using switchable natural deep eutectic solvents[J]. Ultrasonics Sonochemistry,2021,76(6):105638.
[38] PITACCO W, SAMORI C, PEZZOLESI L, et al. Extraction of astaxanthin from Haematococcus pluvialis with hydrophobic deep eutectic solvents based on oleic acid[J]. Food Chemistry,2022,379:132156. doi: 10.1016/j.foodchem.2022.132156
[39] DAL BOSCO C, DI LISIO V, D'ANGELO P, et al. Hydrophobic eutectic solvent with antioxidant properties:Application for the dispersive liquid-liquid microextraction of fat-soluble micronutrients from fruit juices[J]. ACS Sustainable Chemistry & Engineering,2021,9(24):8170−8178.
[40] LI H, ZHAO C, TIAN H, et al. Liquid-liquid microextraction based on acid-base-induced deep eutectic solvents for determination of β-carotene and lycopene in fruit juices[J]. Food Analytical Methods,2019,12:2777−2784. doi: 10.1007/s12161-019-01639-9
[41] DOS SANTOS C A, PADILHA C E A, DAMASCENO K S F S C, et al. Astaxanthin recovery from shrimp residue by solvent ethanol extraction using choline chloride:Glycerol deep eutectic solvent as adjuvant[J]. Journal of the Brazilian Chemical Society,2021,32(5):1030−1039.
[42] KOUTSOUKOS S, TSIAKA T, TZANI A, et al. Choline chloride and tartaric acid, a natural deep eutectic solvent for the efficient extraction of phenolic and carotenoid compounds[J]. Journal of Cleaner Production,2019,241:118384. doi: 10.1016/j.jclepro.2019.118384
[43] LEE Y R, ROW K H. Comparison of ionic liquids and deep eutectic solvents as additives for the ultrasonic extraction of astaxanthin from marine plants[J]. Journal of Industrial and Engineering Chemistry,2016,39:87−92. doi: 10.1016/j.jiec.2016.05.014
[44] LEITE P, ASSIS C, SANTOS E, et al. Choline chloride-based deep eutectic solvents do not improve the ethanolic extraction of carotenoids from buriti fruit (Mauritia flexuosa L.)[J]. Sustainable Chemistry Pharmacy,2021,20(6):100375.
[45] SILVA Y P A, FERREIRA T A P C, JIAO G, et al. Sustainable approach for lycopene extraction from tomato processing by-product using hydrophobic eutectic solvents[J]. Journal of Food Science and Technology-Mysore,2019,56(3):1649−1654. doi: 10.1007/s13197-019-03618-8
[46] ZHANG H, TANG B, ROW K H. A green deep eutectic solvent-based ultrasound-assisted method to extract astaxanthin from shrimp byproducts[J]. Analytical Letters,2014,47(5):742−749. doi: 10.1080/00032719.2013.855783
[47] LAZZARINI C, CASADEI E, VALLI E, et al. Sustainable drying and green deep eutectic extraction of carotenoids from tomato pomace[J]. Foods,2022,11(3):405. doi: 10.3390/foods11030405
[48] RICARTE G N, COELHO M A Z, MARRUCHO I M, et al. Enzyme-assisted extraction of carotenoids and phenolic compounds from sunflower wastes using green solvents[J]. 3 Biotech,2020,10(9):405. doi: 10.1007/s13205-020-02393-0
[49] BI W, TIAN M, ROW K H. Evaluation of alcohol-based deep eutectic solvent in extraction and determination of flavonoids with response surface methodology optimization[J]. Journal of Chromatography A,2013,1285:22−30. doi: 10.1016/j.chroma.2013.02.041
[50] LINARES G, ROJAS M L. Ultrasound-assisted extraction of natural pigments from food processing by-products:A review[J]. Frontiers in Nutrition,2022,9:891462. doi: 10.3389/fnut.2022.891462
[51] SED G, CICCI A, JESSOP P G, et al. A novel switchable-hydrophilicity, natural deep eutectic solvent (NaDES)-based system for bio-safe biorefinery[J]. RSC Advances,2018,8(65):37092−37097. doi: 10.1039/C8RA08536F
[52] SHAHBODAGHI M, FARAJI H, SHAHBAAZI H, et al. Sustainable and green microextraction of organophosphorus flame retardants by a novel phosphonium-based deep eutectic solvent[J]. Journal of Separation Science,2020,43(2):452−461. doi: 10.1002/jssc.201900504
[53] CICCI A, SED G, JESSOP P G, et al. Circular extraction:An innovative use of switchable solvents for the biomass biorefinery[J]. Green Chemistry,2018,20(17):3908−3911. doi: 10.1039/C8GC01731J
-
期刊类型引用(4)
1. 谢章荟,高静. 果蔬色泽在热加工和非热加工技术中的变化研究进展. 现代食品科技. 2024(05): 299-312 .  百度学术
百度学术
2. 张巍元,杨哲,王丁丁,闫鹏宇,陈正佳,孙梦影,孙昊雪,赵琰,刘艳平. Box-Behnken设计-响应面法优化芦笋粉中黄酮的提取工艺. 河北科技师范学院学报. 2024(02): 52-58 .  百度学术
百度学术
3. 李国胜. 食品中抗氧化物质的保存和摄入策略. 食品安全导刊. 2024(22): 101-103 .  百度学术
百度学术
4. 姜浩,郑晓青,程子贤,文芷懿,张沐棠,黎依琳,陈铎,梁一柱,陈椰娜,王宏,白卫东. 绿色低共熔溶剂提取柚皮中多酚类物质的鉴定. 农产品加工. 2024(22): 79-85 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



