Screening and Identification of Two Human Intestinal Strains Metabolizing Caffeic Acid and Exploring Their Metabolic Processes
-
摘要: 为了探索咖啡酸的体内代谢过程,本研究从人体肠道粪便中分离筛选出2株能代谢咖啡酸的菌株,通过细胞形态、16S rDNA序列和系统发育树分析了其菌株特征,并研究了两株菌株代谢咖啡酸过程中的细菌总数和pH变化,最后采用薄层层析法和高效液相色谱法对代谢产物进行确定,阐明咖啡酸代谢过程。结果表明,2株菌分别为腐生葡萄球菌(Staphylococcus xylosus)和奇异变形杆菌(Proteus mirabilis)。腐生葡萄球菌代谢咖啡酸含量从0.539 mg/mL在6 h后降至0.087 mg/mL,12 h后完全被代谢。而奇异变形杆菌,在6 h后咖啡酸含量从0.543 mg/mL降至0.352 mg/mL,24 h后完全被代谢。咖啡酸抑制了肠道菌的增殖,且腐生葡萄球菌代谢咖啡酸能力优于奇异变形杆菌,肠道菌代谢咖啡酸产物为间香豆酸。研究结果为进一步研究咖啡酸和肠道菌的相互作用提供依据。Abstract: In order to explore the metabolic process of caffeic acid in vivo, two strains that could metabolize caffeic acid were isolated and screened from human intestinal feces, their strain characteristics were analyzed by cell morphology, 16S rDNA sequence and phylogenetic tree, and the total number of bacteria and pH changes in the process of caffeic acid metabolism in the two strains were studied, and finally the metabolites were determined by thin layer chromatography and high performance liquid chromatography to elucidate the caffeic acid metabolism process. The results showed that the two strains were Staphylococcus xylosus strain and Proteus mirabilis strain. The content of caffeic acid metabolized by Staphylococcus xylosus strain decreased from 0.539 mg/mL to 0.087 mg/mL after 6 h and was completely metabolized after 12 h. However, the content of caffeic acid metabolized by Proteus mirabilis strain decreased from 0.543 mg/mL to 0.352 mg/mL after 6 h, and was completely metabolized after 24 h. Caffeic acid inhibited the proliferation of intestinal bacteria, and the ability of Staphylococcus xylosus strain to metabolize caffeic acid was better than that of Proteus mirabilis strain, and the product of caffeic acid metabolized by intestinal bacteria was m-coumaric acid. The results of the study provided a basis for further research on the interaction between caffeic acid and intestinal bacteria.
-
Keywords:
- caffeic acid /
- Staphylococcus xylosus strain /
- Proteus mirabilis strain /
- screening /
- metabolites
-
咖啡酸(Caffeic acid,CA)又叫做3,4-二羟基肉桂酸,是一类天然的酚类化合物[1]。咖啡酸广泛存在于多种物质中,包括水果、豆类、葡萄酒、橄榄油和咖啡等[2]。而近年来开展的科学研究也证实,咖啡酸有抗氧化[3]、清除自由基[4]、抗癌细胞[5]、抗病毒[6]、热耐受性强[7]、降血糖[8]等各种生理作用,在人体保健发挥着特殊的作用,是一类纯天然的活性物质。此外,作为一种金属的螯合体,咖啡酸也能够避免由紫外线造成的细胞损伤[9−10]。
目前的研究多集中于咖啡酸的生物活性功能研究,然而对咖啡酸是如何在人体内代谢进而发挥作用机制尚不明晰。人体肠道是发酵和消化的场所[11],其中的肠道菌群组成复杂,数量巨大,包括拟杆菌、肠杆菌科、芽孢杆菌等。然而,人体肠道菌群并非绝对恒定的,与年龄、环境、性别、饮食等多种因素相关,其中饮食是改变肠道菌群最直接可行的方法之一[12−14]。肠道是药物代谢的主要器官之一,多种化学功能物质都在肠道菌群的共同作用下进行新陈代谢过程,其中肠道菌群和肠壁酶起着十分关键的作用,利用药效学活性成分和粪便悬浮液与肠道菌群在厌氧条件下孵育,是研究中药物质代谢的最有效方法之一[15−17]。经科学研究的证实,咖啡酸在胃和小肠中的吸收率仅为30%左右,其主要吸收和代谢部位是结肠[18]。但肠道微生物与咖啡酸如何相互作用,参与咖啡酸代谢的肠道微生物以及代谢产物尚不清楚。
本研究旨在明确参与咖啡酸代谢的肠道微生物及它们之间的相互作用,并借助形态学研究,生理生化实验以及16S rRNA基因对两株肠道单菌株进行鉴定,将该菌直接运用于咖啡酸体外发酵中,并通过对咖啡酸发酵过程中指标研究,采用薄层层析法和高效液相分析法鉴定咖啡酸代谢产物,进一步阐明了咖啡酸的主要代谢方式以及代谢过程,为营养物质的靶向代谢的科学研究提供了必要的参考和依据。
1. 材料与方法
1.1 材料与仪器
人体肠道粪便 联系5名志愿者(3男2女),要求无消化系统疾病,3个月内未服用抗生素或益生菌;咖啡酸(AR,98%)、间香豆酸(≥98%)、3-(3-羟基苯基)丙酸(≥98%) 上海源叶生物科技有限公司;细菌基因组DNA提取试剂盒、琼脂粉 北京索莱宝科技有限公司;切胶回收试剂盒 OMEGA公司;Taq酶PCR试剂盒 武汉康为世纪生物科技有限公司;甲醇(≥99.5%)、甲酸(88%)、冰乙酸、氯仿 国药集团化学试剂有限公司;琼脂糖 北京擎科生物科技有限公司;BHI液体培养基 青岛高科技工业园海生物技术有限公司。
薄层色谱铝箔板 青岛邦凯高新技术材料有限公司;BXM-30R压力蒸汽灭菌器 上海博讯实业有限公司;SW-CJ-2FD超净工作台 北京东联哈尔仪器制造有限公司;V-5100紫外分光亮度计 上海精科实业有限公司;LRH-250生化培养箱 广东省医疗器械厂;凝胶成像系统、BioRad CFX 96梯度PCR仪 Eppendorf公司;Spectra Max iD3多功能酶标仪 美谷分子仪器上海有限公司;S210 pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 培养基的配制
BHI液体培养基:胰蛋白胨10.0 g/L,牛心浸粉17.5 g/L,氯化钠5.0 g/L,葡萄糖2.0 g/L,磷酸氢二钠(12H2O)2.5 g/L,调pH在7.4±0.2之间,高温高压115 ℃灭菌15 min。使用的BHI固体培养基所需琼脂粉量:20 g/L。
1.2.2 人体粪便样品预处理
称取1.00 g新鲜粪便,在超净台中加入10 mL无菌PBS,涡旋1~3 min,以1000 r/min离心5 min,将上清液移到无菌EP管中,加入无菌PBS 5000 r/min离心3 min,弃去上清液,洗涤两次并用无菌PBS重悬沉淀。部分粪便悬浮液用于实验,其余部分加入无菌厌氧甘油(0.04% L-半胱氨酸)中,等分并储存于−80 ℃以备用[19]。
1.2.3 咖啡酸贮存液的配制
准确称取50.0 mg咖啡酸粉末到2 mL无菌EP管中,加入1.0 mL 80%甲醇并倒置混合,在超净工作台中用无菌0.22 μm滤膜过滤灭菌,以获得50 mg/mL无菌咖啡酸储存溶液。保存在−40 ℃备用。
1.2.4 人体粪便菌的富集
取一定量粪便悬液,以5000 r/min离心5 min,弃去上清,再用PBS洗涤两次后,离心重悬,并按1:50的体积比例,接种至BHI液体培养基中,然后置于厌氧罐中放在37 ℃摇床上,200 r/min,厌氧培养24 h。
1.2.5 人类粪便菌代谢咖啡酸实验
1.2.5.1 咖啡酸体外发酵实验
将29.1 mL BHI液体培养基、300 μL咖啡酸母液(终浓度0.5 mg/mL)和600 μL人粪便细菌悬浮液加入到50 mL的锥形瓶中(未加咖啡酸的人粪便细菌悬浮液作为阴性对照)。之后将混合发酵液置于厌氧罐中,37 ℃下在200 r/min转速的振荡培养箱中避光发酵,在0、12、24、48、72 h时采样。将每个样品以13000 r/min离心3~5 min,然后将发酵液转移到1.5 mL EP管中并储存在−20 ℃。动态监测在发酵过程中细菌繁殖含量(OD600)和pH变化。
1.2.5.2 薄层层析法检测咖啡酸粪便体外发酵代谢产物
将1.2.5.1中体外发酵培养基解冻,利用薄层色谱法定性测定咖啡酸代谢情况[20],展开剂为氯仿:甲醇:水:甲酸:冰醋酸(15:5:0.5:1:1,V/V),以浓度为0.5 mg/mL咖啡酸、间香豆酸和5 mg/mL 3-(3-羟基苯基)丙酸为对照,在254 nm的紫外波长显色,比较比移值(Rf值)。如果样品的Rf值等于咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸的标准品,则表明样品含有咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸。
1.2.6 代谢咖啡酸肠道菌分离
根据1.2.5.2中的检测结果,将12 h的发酵液用BHI液体培养基稀释至10−4~10−6的梯度,于BHI固体培养基上进行涂布,置于恒温37 ℃的培养箱中厌氧培养12 h。将培养基中不同颜色、形态和大小的菌株挑至BHI液体培养基中,并在37 ℃下厌氧孵育12 h。将液体培养基中获得的菌株在BHI固体培养基中重复划线,以保证得到纯度较好的菌株,同时将得到的单菌落用50%厌氧甘油保存并储存在−80 ℃的冰箱中。
1.2.7 代谢咖啡酸菌株的筛选
将分离纯化的单个细菌以1:50的比例加入含有咖啡酸的BHI液体培养基中,咖啡酸的终浓度为0.5 mg/mL,置于37 ℃振荡器中厌氧孵育24 h,用薄层层析法测定咖啡酸代谢情况。
1.2.8 代谢咖啡酸菌株的鉴定
1.2.8.1 形态鉴定
将1.2.7中得到的可以代谢咖啡酸的菌株10、20号菌进行鉴定。根据《常见细菌系统鉴定手册》[21]和《伯杰氏细菌系统分类学手册》[22]对分离出的细菌进行细菌形态鉴定。
1.2.8.2 16S rRNA
基因分子生物学鉴定,以菌株10和20的基因组作为PCR扩增模板,正向和反向引物分别为8F:5'-AGAGTGATCCTGGCTCAG-3'/1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR反应(20 μL)如下:模板DNA 2 μL,KOD酶(1 unit/μL)0.4 μL,10×KOD缓冲液2 μL,dNTP (2 mmol/L)2 μL,引物(F+R)1.2 μL,MgSO4(25 mmol/L)1.2 μL,双蒸水(ddH2O)11.2 μL。PCR扩增参数设置为94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s持续35个循环,72 ℃再延伸2 min。将所得PCR扩增产物进行1%琼脂糖凝胶电泳。PCR扩增产物约为1600 bp,送往上海生工进行测序,16S rDNA序列在NCBI中进行BLAST同源序列检索,可以比较筛出菌株与已知菌株的系统发育关系和系统发育状态,如果同源性大于99%,则确认它们是同一类型的细菌,并使用Mega X软件创建系统发育树。
1.2.9 筛选菌株代谢咖啡酸能力
将10、20号菌划线活化后接至BHI液体培养基中,在37 ℃厌氧环境下孵育24 h,最后再按1:50(v/v)的比例加入到含有咖啡酸的BHI液体培养基中,咖啡酸的最终浓度为0.5 mg/mL。将其置于厌氧罐中,37 ℃下进行厌氧发酵,并在发酵过程中动态监测细菌生长含量(OD600)和pH的变化。最后通过薄层层析法和高效液相法鉴定咖啡酸的代谢产物。
1.2.9.1 发酵过程中菌株生长曲线的测定
将菌株以1:50的比例加入到含有咖啡酸的BHI液体培养基中,置于37 ℃摇床上厌氧培养,在0、6、12、24、48 h取样,用紫外分光亮度计测定OD600,并在相同条件下重复实验3次。
1.2.9.2 发酵过程中pH测定
将菌株以1:50的比例加入含咖啡酸的BHI液体培养基中,置于37 ℃摇床中厌氧培养,在0、6、12、24、48 h取样,以1:50比例接种菌株的BHI液体培养基为对照,用pH计测定pH,在相同条件下重复实验3次。
1.2.9.3 发酵过程中咖啡酸代谢情况测定
用薄层层析法测定咖啡酸代谢情况,参照张学佳[23]的方法稍作修改。以氯仿:甲醇:水:甲酸:冰乙酸(15:5:0.5:1:1,V/V)为展开剂,浓度为0.5 mg/mL的咖啡酸、间香豆酸和5 mg/mL标准品3-(3-羟基苯基)丙酸为对照,在254 nm的紫外波长显色,比较比移位值(Rf值)。如果样品的Rf值等于咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸的标准品,则表明样品含有咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸。
1.2.9.4 发酵过程中咖啡酸代谢产物的测定
咖啡酸代谢产物的测定参照张砚垒[24]的方法略作修改。利用高效液相色谱法检测咖啡酸代谢产物,取2 mL发酵液样品13000 r/min离心2 min,取上清过0.45 μm滤膜。高效液相色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为甲醇,流动相B为0.1%甲酸,流速为0.8 mL/min;梯度洗脱表见表1,柱温20 ℃,进样量20 μL,检测波长280 nm。
表 1 流动相梯度洗脱程序Table 1. Gradient elution program of mobile phase时间(min) 流动相 A(%) 流动相 B(%) 0~5 10 90 5~30 30 70 30~45 65 35 45~55 10 90 1.3 数据处理
实验均重复三次取平均值,所有实验结果均用平均值±标准差来表示,采用Mega X软件建立系统发育树,用统计学分析软件SPSS进行实验结果显著性分析,Excel 2019进行数据统计并分析,由Graph Pad Prism 8软件进行实验数据作图。
2. 结果与分析
2.1 人粪便菌群体外发酵咖啡酸动态变化
OD600可以用于评价细菌在培养基中的繁殖能力[25]。如图1A所示,体外培养条件下,人体粪便菌群在前12 h快速增殖,在48~72 h之间逐渐趋于平台期。人体粪便菌群达到平台期时,菌液的OD600为0.89。当培养基中添加咖啡酸后,人体粪便菌群在前12 h同样呈现快速增殖趋势,但是12 h后,菌群生长速率缓慢。发酵72 h后,人体粪便菌群的OD600为0.69,最大吸光值低于无咖啡酸添加的对照组(图1A)。结果表明,浓度为0.5 mg/mL的咖啡酸会抑制人体粪便菌群体外增殖。
pH是监测微生物发酵过程的一个重要参数,因此检测了培养基pH的动态变化[26−27]。如图1B所示,在0~12 h,粪便菌组和粪便菌+咖啡酸组的pH都呈现下降趋势。其中,粪便菌组的pH从7.28下降至6.85,而粪便菌+咖啡酸组的pH从7.26降至6.78。从12~72 h,两组的pH均逐渐上升。其中,粪便菌组的pH升高至8.36,粪便菌+咖啡酸组的pH升高至7.98。然而在整个发酵过程中,粪便菌组的pH一直比粪便菌+咖啡酸组的pH高,和OD600的实验现象吻合,咖啡酸对人体粪便菌发酵有抑制效果,这与骆成尧等[28−29]研究结果相似。而0~12 h出现下降的原因推测是生成了代谢产物,且代谢产物为酸性从而使pH下降。
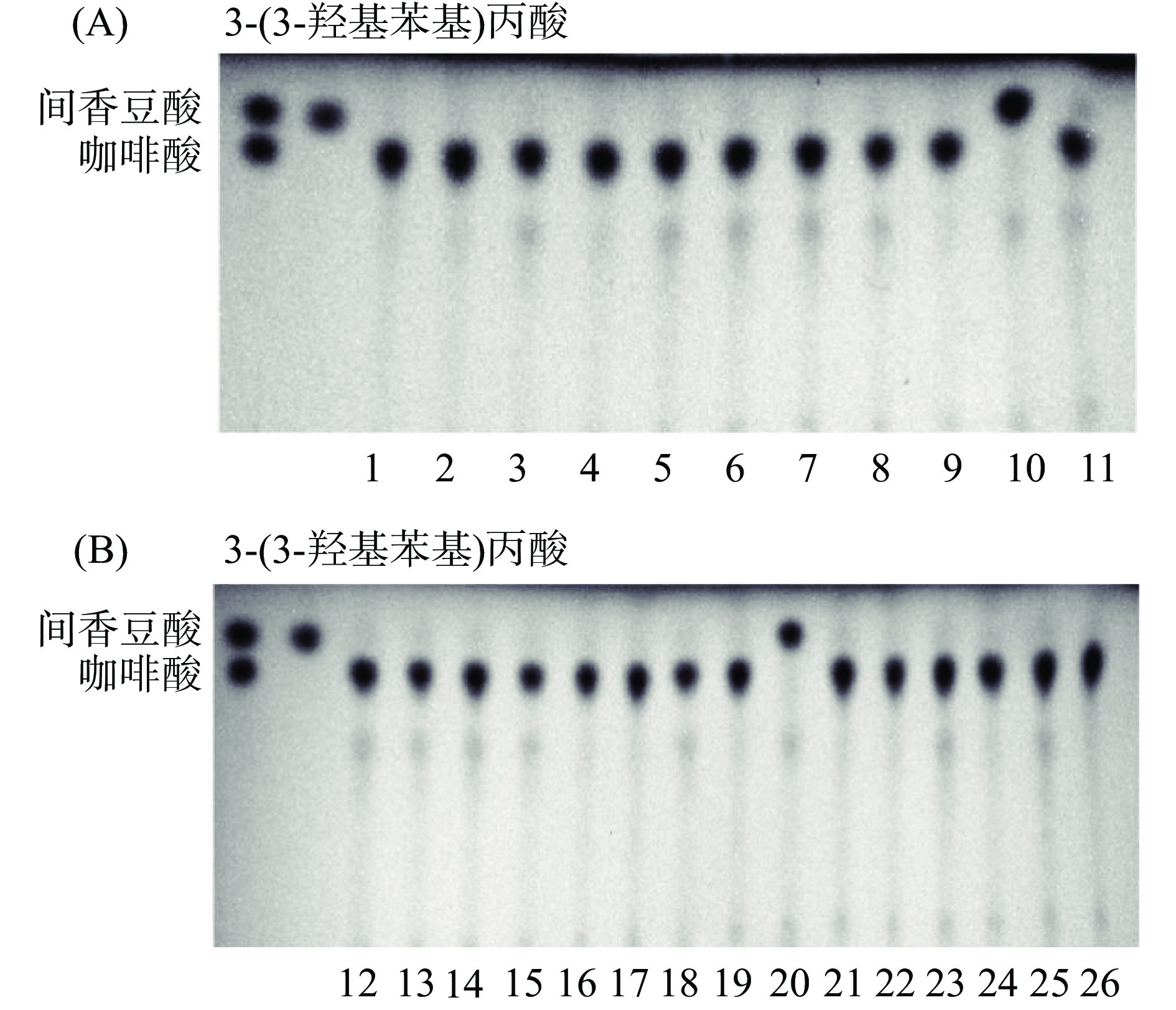
图1C可以看出,咖啡酸粪便发酵液第12 h已经开始代谢直至24 h咖啡酸被完全代谢。代谢产物在与间香豆酸标准品相同的Rf值处出现斑点,并且随着发酵时间的延长,颜色逐渐加深,在12 h颜色最深,但12 h之后颜色又逐渐减少。
2.2 参与咖啡酸代谢的肠道微生物筛选
将人类粪便菌悬液进行梯度稀释,涂布在BHI固体培养基平板上,然后再挑取26个单克隆,接种到含有咖啡酸的液体培养基中进行发酵。厌氧发酵12 h后,收集培养基,并利用薄层层析法分析培养液中咖啡酸及其代谢产物的改变。如图2A和2B所示,第10号、20号肠道菌可以代谢咖啡酸。
2.3 咖啡酸代谢菌株的形态及鉴定
2.3.1 菌株形态学观察
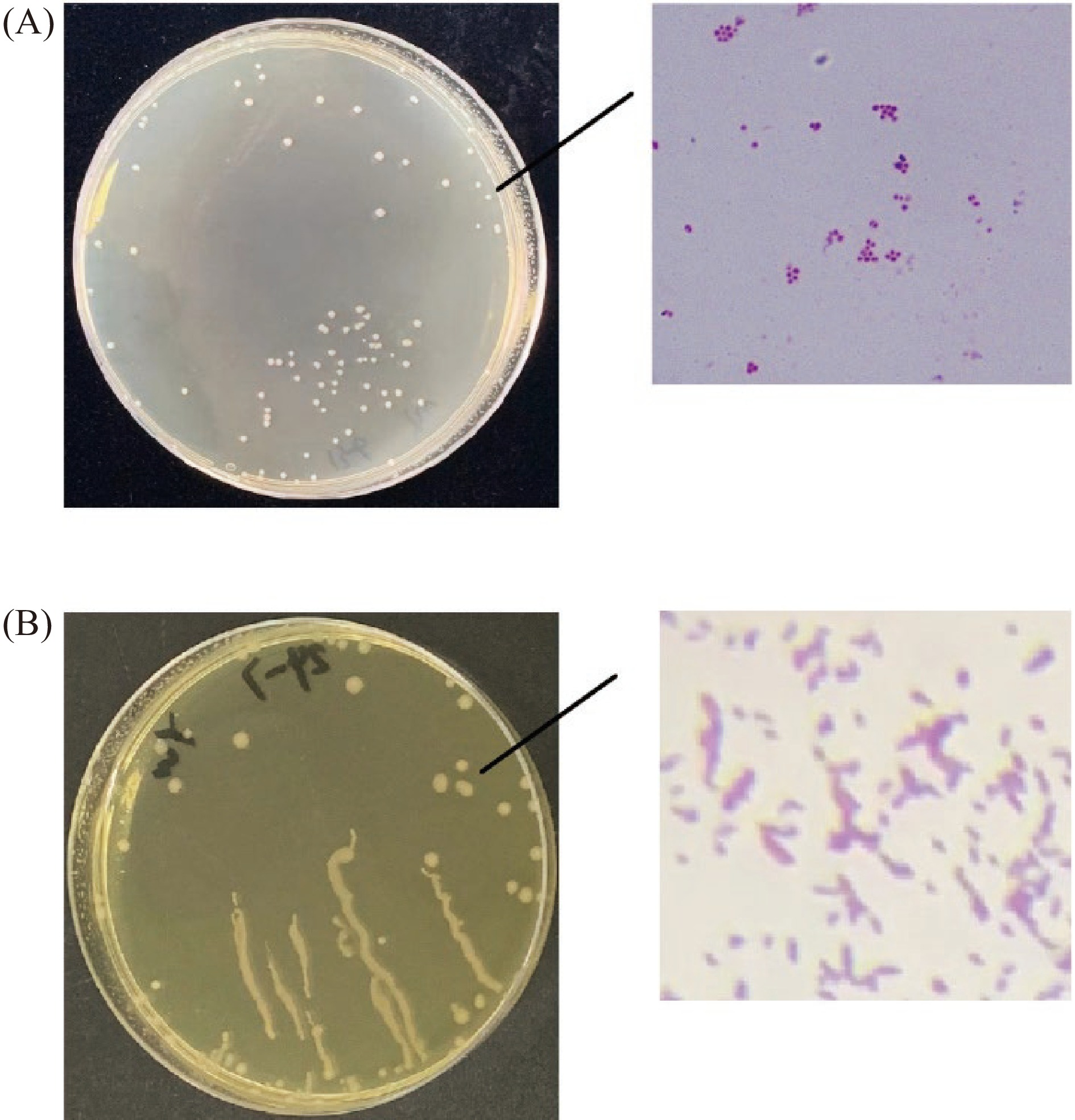
采用梯度稀释法将10号菌和20号菌在BHI固体培养基上划线。10号菌的形态如图3A所示。菌落呈圆形,湿润,边缘光滑,中间凸起为白色,边缘略带黄色。20号菌的形态如图3B所示。菌落透明或半透明,灰白色,边缘整齐,中间凸起。根据菌落形态特征,初步判断两种菌株均为细菌。利用革兰氏染色初步确认了10号菌为革兰氏阴性菌,在显微镜下成葡萄状球菌,而20号菌为革兰氏阴性菌,在显微镜下成杆型。
2.3.2 分子生物学鉴定
利用引物对所提取的基因组DNA进行扩增,所扩增的结果如图4所示,在1500 bp左右出现了目的条带,条带整齐,能够进行测序分析。利用Snap Gene Viewer软件对测序序列进行拼接,借助NCBI中的BLAST和数据库中已知菌株的16S rRNA基因进行序列比对,选择相似度最高的菌株来判断10号和20号的种属状况。结果表明,10号菌株的16S rRNA基因序列与数据库中已知腐生葡萄球菌的16S rRNA基因的相似性大于99%。20号菌株的16S rRNA基因序列与数据库中已知奇异变形杆菌的16S rRNA基因的相似性大于99%。为更加清楚该菌株与已知菌株的亲缘关系及分类地位,构建系统发育树,结果显示10号菌与Staphylococcus xylosus strain Fop 108A和Staphylococcus xylosus strain JCM 2418在系统发育树聚为一支(图5A),20号菌与Proteus mirabilis strain ATCC 29906在系统发育树聚为一支(图5B)。
2.4 肠道菌株代谢咖啡酸分析
2.4.1 菌株生长曲线和发酵液pH变化分析
在发酵过程中监测筛选菌株代谢咖啡酸的生长情况和pH的动态变化。如图6A所示,腐生葡萄球菌组在前6 h快速增殖,36 h到达最高时,菌液的OD600为0.77。加入咖啡酸后,腐生葡萄球菌在前6 h呈现快速增长趋势,36 h之后到达平台期时菌液OD600为0.85。如图6C所示,奇异变形杆菌组同样在前6 h呈现快速增长趋势,24 h菌液OD600为0.62,36 h突然增长达到峰值0.84后又随着发酵时间的增加,培养基中的营养成分减少,菌株的生存能力降低。加入咖啡酸后,在24 h到达平台期时菌液OD600为0.56,同样也在36 h增长达到峰值0.69后恢复到平台期。结果显示,咖啡酸抑制腐生葡萄球菌和奇异变形杆菌的体外增殖,对奇异变形杆菌的抑制效果大于腐生葡萄球菌。
根据研究,咖啡酸会被菌株分解产生间香豆酸等代谢产物,从而导致pH的改变,所以,pH的变化是反应发酵过程中一项关键参数[30]。从图6B中可以看出,腐生葡萄球菌代谢咖啡酸发酵6 h时pH下降至6.11,推测可能生成了酸性代谢产物,而6 h之后pH又出现回升直至48 h到达7.19,可能生成的酸性代谢产物进一步代谢生成了碱性代谢产物。而图6D中奇异变形杆菌代谢咖啡酸12 h之后pH才出现回升直至48 h到达7.54,推测可能奇异变形杆菌代谢咖啡酸的能力可能没有腐生葡萄球菌强。
2.4.2 菌株发酵过程中代谢产物的检测
对腐生葡萄球菌和奇异变形杆菌发酵咖啡酸不同时间的发酵液进行薄层层析检测。从图7A可以看到,腐生葡萄球菌从6 h开始已经将咖啡酸代谢,12 h之后咖啡酸代谢完全,代谢产物12 h之后也没有出现增加现象。图7B中,奇异变形杆菌也在第6 h就可以将咖啡酸代谢,24 h时咖啡酸就已经代谢完全,代谢产物24 h之后也没有出现增加的现象。但从图中可以看出,腐生葡萄球菌代谢咖啡酸的效果优于奇异变形杆菌。
2.4.3 菌株发酵过程中代谢产物确定
采用HPLC法更精确反映咖啡酸变化及其确定代谢产物。由图8和图9可知,根据三种标准品的出峰时间不同确定腐生葡萄球菌和奇异变形杆菌可以将咖啡酸代谢为间香豆酸。
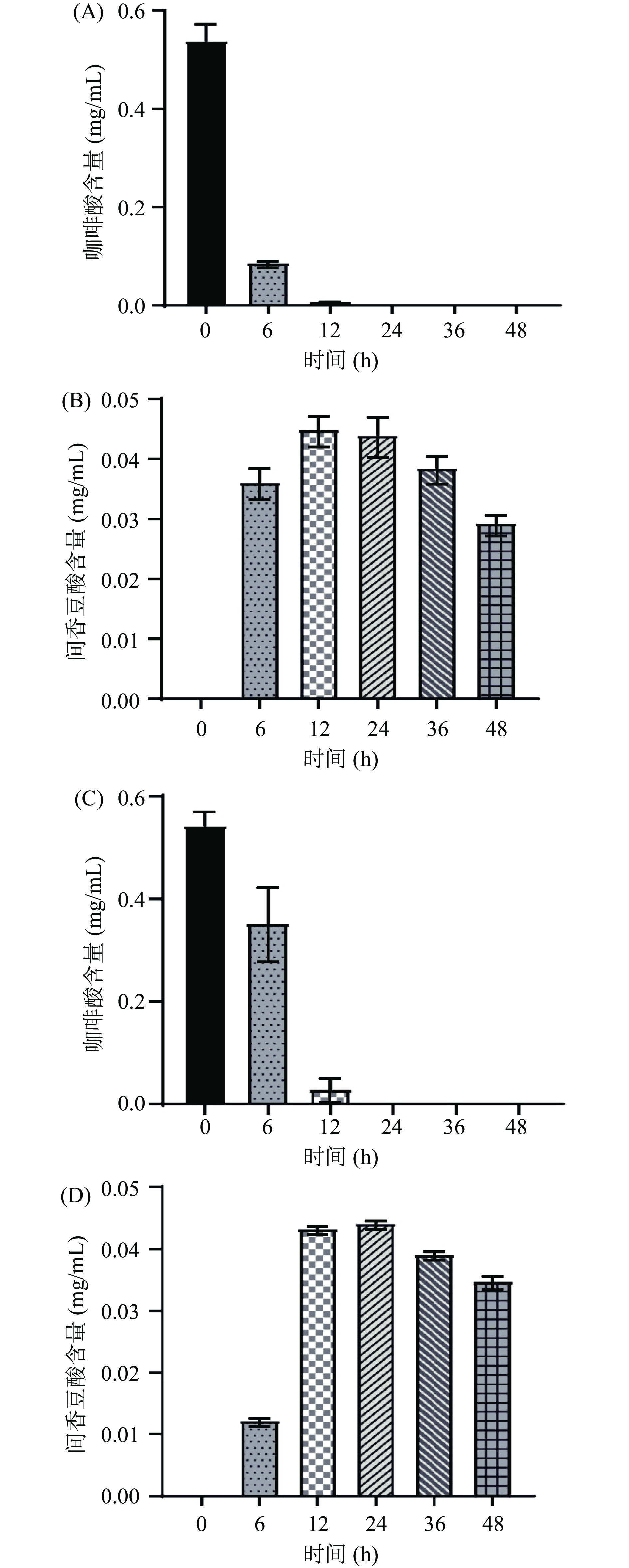
对HPLC结果进行定量分析,从图10A中看出咖啡酸6 h含量从0.539 mg/mL降至0.087 mg/mL,12 h之后基本被完全代谢。图10C中看到咖啡酸在第6 h含量从0.543 mg/mL降至0.352 mg/mL,第12 h含量降至0.030 mg/mL,24 h之后被完全代谢。从中可以看出,腐生葡萄球菌代谢咖啡酸的能力比奇异变形杆菌好。
代谢产物间香豆酸的变化可以从图10B中看出,腐生葡萄球菌发酵咖啡酸第6 h间香豆酸生成,第12 h间香豆酸浓度达到峰值0.045 mg/mL,12 h之后间香豆酸含量开始降低,直至48 h降至0.029 mg/mL。奇异变形杆菌发酵咖啡酸从图10D中可以看到间香豆酸从第6 h开始生成,第24 h浓度达到峰值0.044 mg/mL,24 h之后间香豆酸含量开始降低,直至48 h为0.035 mg/mL。可以看出腐生葡萄球菌代谢咖啡酸的能力优于奇异变形杆菌,但是两株菌代谢的间香豆酸都在24 h后逐渐降低,推测间香豆酸有可能进一步代谢生成了其它代谢产物。
通过薄层层析法和高效液相色谱法检测可以看到腐生葡萄球菌和奇异变形杆菌在代谢咖啡酸过程中代谢产物为间香豆酸。这与魏玲[31]的研究相同,在大鼠体内代谢咖啡酸产物中检测出13种代谢产物中就有间香豆酸。腐生葡萄球菌和奇异变形杆菌在自然界中广泛存在,具有丰富的生物学功能,周华书[32]和闫建英等[33]只对其安全性和耐药性进行研究并未研究其它药用作用。本实验通过对其代谢途径进行研究为两株菌以及咖啡酸新的研究方向奠定了基础。
3. 结论
本研究通过对人体粪便样品中分离出两株肠道单菌各项指标的检测,发现随着发酵过程的进行,咖啡酸代谢为间香豆酸,间香豆酸又进一步代谢生成其他酚酸类化合物导致pH呈现先下降后上升趋势。发酵12 h后,咖啡酸被腐生葡萄球菌完全代谢,同时在发酵12 h时,间香豆酸浓度达到峰值0.045 mg/mL;而奇异变形杆菌在发酵24 h后完全代谢咖啡酸,间香豆酸的浓度在发酵24 h达到峰值0.044 mg/mL。综上,咖啡酸抑制了肠道菌的增殖,人肠道来源的腐生葡萄球菌和奇异变形杆菌可代谢咖啡酸,且腐生葡萄球菌代谢能力优于奇异变形杆菌,对咖啡酸在肠道微生物作用下代谢机制的研究具有指导意义,但详细的机制还需要进一步研究。
-
表 1 流动相梯度洗脱程序
Table 1 Gradient elution program of mobile phase
时间(min) 流动相 A(%) 流动相 B(%) 0~5 10 90 5~30 30 70 30~45 65 35 45~55 10 90 -
[1] 张弛. 咖啡酸对LPS诱导小鼠乳房炎的治疗作用研究[D]. 扬州:扬州大学, 2020. [ZHANG Chi. Study on the therapeutic effect of caffeic acid on LPS-induced mastitis in mice[D]. Yangzhou:Yangzhou University, 2020. ZHANG Chi. Study on the therapeutic effect of caffeic acid on LPS-induced mastitis in mice[D]. Yangzhou: Yangzhou University, 2020.
[2] 任家毅. 咖啡酸、绿原酸抗H5N1禽流感病毒作用的分子模拟研究[D]. 广州:暨南大学, 2019. [REN Jiayi. Molecular simulation of caffeic acid and chlorogenic acid against H5N1 avian influenza virus[D]. Guangzhou:Jinan University, 2019. REN Jiayi. Molecular simulation of caffeic acid and chlorogenic acid against H5N1 avian influenza virus[D]. Guangzhou: Jinan University, 2019.
[3] 刘畅, 常超, 陈瑞达, 等. 咖啡酸苯乙酯对HepG2细胞氧化应激和脂质代谢的调节作用[J]. 食品科学,2023,44(17):86−93. [LIU C, CHANG C, CHEN R D, et al. Regulation of oxidative stress and lipid metabolism of caffeate in HepG2 cells[J]. Food Science,2023,44(17):86−93. LIU C, CHANG C, CHEN R D, et al . Regulation of oxidative stress and lipid metabolism of caffeate in HepG2 cells[J]. Food Science,2023 ,44 (17 ):86 −93 .[4] 王小玲. 咖啡酸对硝基苯乙酯对小鼠糖尿病肾病的作用及其肾脏代谢物分析[D]. 重庆:西南大学, 2018. [WANG Xiaoling. Effect of caffeic acid p-nitrophenethyl ester on diabetic nephropathy in mice and analysis of renal metabolites[D]. Chongqing:Southwest University, 2018. WANG Xiaoling. Effect of caffeic acid p-nitrophenethyl ester on diabetic nephropathy in mice and analysis of renal metabolites[D]. Chongqing: Southwest University, 2018.
[5] 周向军, 邹亚丽, 孙文媛, 等. 咖啡酸与牛血红蛋白的相互作用及抗氧化研究[J]. 食品研究与开发,2022,43(11):109−117. [ZHOU X J, ZOU Y L, SUN W Y, et al. Interaction and antioxidant study between caffeic acid and bovine hemoglobin[J]. Food Research and Development,2022,43(11):109−117. ZHOU X J, ZOU Y L, SUN W Y, et al . Interaction and antioxidant study between caffeic acid and bovine hemoglobin[J]. Food Research and Development,2022 ,43 (11 ):109 −117 .[6] 刘丹丹. 咖啡酸和阿魏酸对巨噬细胞焦亡的作用机制研究[D]. 扬州:扬州大学. [LIU Dandan. Mechanism of caffeic acid and ferulic acid on pyroptosis of macrophages[D]. Yangzhou:Yangzhou University, 2022. LIU Dandan. Mechanism of caffeic acid and ferulic acid on pyroptosis of macrophages[D]. Yangzhou: Yangzhou University, 2022.
[7] 张雯, 孙雅丽, 王琳, 等. 咖啡酸及其衍生物药理作用研究进展[J]. 动物医学进展,2021,42(8):103−106. [ZHANG W, SUN Y L, WANG L, et al. Research progress on pharmacological effects of caffeic acid and its derivatives[J]. Progress in Veterinary Medicine,2021,42(8):103−106. ZHANG W, SUN Y L, WANG L, et al . Research progress on pharmacological effects of caffeic acid and its derivatives[J]. Progress in Veterinary Medicine,2021 ,42 (8 ):103 −106 .[8] ZHANG B Y, WANG Y P, LU R R, et al. Pickering emulsion stabilized by casein-caffeic acid covalent nanoparticles to enhance the bioavailability of curcumin in vitro and in vivo[J]. Journal of the Science of Food and Agriculture,2023,24(6):126−121.
[9] 赵英良, 张玲, 韦克毅, 等. 咖啡酸对UVB损伤人角质形成细胞的保护作用机制研究[J]. 现代药物与临床,2022,37(9):1953−1958. [ZHAO Y L, ZHANG L, WEI K Y, et al. Study on the protective mechanism of caffeic acid on UVB damage to human keratinocytes[J]. Modern Medicine and Clinic,2022,37(9):1953−1958. ZHAO Y L, ZHANG L, WEI K Y, et al . Study on the protective mechanism of caffeic acid on UVB damage to human keratinocytes[J]. Modern Medicine and Clinic,2022 ,37 (9 ):1953 −1958 .[10] 任伟, 尹君, 范俊兵, 等. 咖啡酸螯合锌的体外生物活性研究[J]. 河南化工,2022,39(11):28−31. [REN W, YIN J, FAN J B, et al. In vitro biological activity of zinc chelate chelate of caffeic acid[J]. Henan Chemical Industry,2022,39(11):28−31. REN W, YIN J, FAN J B, et al . In vitro biological activity of zinc chelate chelate of caffeic acid[J]. Henan Chemical Industry,2022 ,39 (11 ):28 −31 .[11] GUERGOLETTO K B, et al. In vitro fermentation of jucara pulp ( Euterpe edulis) by human colonic microbiota[J]. Food Chemistry,2016,196:251−258. doi: 10.1016/j.foodchem.2015.09.048
[12] 胡璨鑫. 中国人肠道来源的Prevotella copri/YF2菌株的基因组学和转录组学研究[D]. 厦门:厦门大学, 2019. [HU Canxin. Genomics and transcriptomics of Prevotella copri/YF2 strain of intestinal origin Chinese[D]. Xiamen:Xiamen University, 2019. HU Canxin. Genomics and transcriptomics of Prevotella copri/YF2 strain of intestinal origin Chinese[D]. Xiamen: Xiamen University, 2019.
[13] CHRISTENSEN L F, GARCÍA-BÉJAR B, BANG-BERTHELSEN C H, et al. Extracellular microbial proteases with specificity for plant proteins in food fermentation[J]. International Journal of Food Microbiology,2022,381:109889. doi: 10.1016/j.ijfoodmicro.2022.109889
[14] 封雪, 吕晓超, 惠香. 微生物在食品发酵中的应用探究[J]. 食品安全导刊, 2022(10):169−171. [FENG X, LÜ X C, HUI X. Research on the application of microorganisms in food fermentation[J]. Food Safety Guide, 2022(10):169−171. FENG X, LÜ X C, HUI X. Research on the application of microorganisms in food fermentation[J]. Food Safety Guide, 2022(10): 169−171.
[15] 黄茂光, 谢胜, 王金鑫, 等. 中药调节肠道菌群治疗溃疡性结肠炎的研究进展[J]. 中国实验方剂学杂志,2024,30(2):267−275. [HUANG M G, XIE S, WANG J X, et al. Research progress of traditional Chinese medicine regulating intestinal flora in the treatment of ulcerative colitis[J]. Chinese Journal of Experimental Medical Formulae,2024,30(2):267−275. HUANG M G, XIE S, WANG J X, et al . Research progress of traditional Chinese medicine regulating intestinal flora in the treatment of ulcerative colitis[J]. Chinese Journal of Experimental Medical Formulae,2024 ,30 (2 ):267 −275 .[16] 彭海英, 寇芳芳, 文姝. 肠道菌群与代谢综合征研究进展[J]. 中国微生态学杂志, 2022, 34(11):1352−1355. [PENG H Y, KOU F F, WEN S. Research progress of intestinal flora and metabolic syndrome[J]. Chinese Journal of Microecology, 2022, 34(11):1352−1355. PENG H Y, KOU F F, WEN S. Research progress of intestinal flora and metabolic syndrome[J]. Chinese Journal of Microecology, 2022, 34(11): 1352−1355.
[17] ZHAO F, GUAN S Z, FU Y J, et al. Lycium barbarum polysaccharide attenuates emotional injury of offspring elicited by prenatal chronic stress in rats via regulation of gut microbiota[J]. Biomed Pharmacother,2021,143:112087. doi: 10.1016/j.biopha.2021.112087
[18] 胡玲玲, 胡扬, 宋辉, 等. 绿原酸在肝微粒体和肠道菌群中的体外代谢研究[J]. 食品安全质量检测学报,2021,12(20):8198−8206. [HU L L, HU Y, SONG H, et al. In vitro metabolism of chlorogenic acid in liver microsomes and intestinal flora[J]. Journal of Food Safety and Quality Detection,2021,12(20):8198−8206. HU L L, HU Y, SONG H, et al . In vitro metabolism of chlorogenic acid in liver microsomes and intestinal flora[J]. Journal of Food Safety and Quality Detection,2021 ,12 (20 ):8198 −8206 .[19] DING Y, YAN Y M, PENG Y J, et al. In vitro digestion under simulated saliva, gastric and small intestinal conditions and fermentation by human gut microbiota of polysaccharides from the fruits of Lycium barbarum[J]. International Journal of Biological Macromolecules,2019,125:751−760. doi: 10.1016/j.ijbiomac.2018.12.081
[20] 范真. 铁冬青化学成分及其肠道菌体外代谢转化研究[D]. 广州:广州中医药大学, 2014. [FAN Z. Study on the chemical composition of iron holly and its intestinal bacteria metabolism transformation in vitro[D]. Guangzhou:Guangzhou University of Chinese Medicine, 2014. FAN Z. Study on the chemical composition of iron holly and its intestinal bacteria metabolism transformation in vitro[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2014.
[21] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:66−95. [DONG X Z, CAI M Y. Handbook of systematic identification of common bacteria[M]. Beijing:Science Press, 2001:66−95. DONG X Z, CAI M Y. Handbook of systematic identification of common bacteria[M]. Beijing: Science Press, 2001: 66−95.
[22] R E 布坎南. 伯杰细菌鉴定手册[M]. 北京:科学出版社, 1984:450−454. [R E Buchanan. Berger's handbook of bacterial identification[M]. Beijing:Science Press, 1984:450−454. R E Buchanan. Berger's handbook of bacterial identification[M]. Beijing: Science Press, 1984: 450−454.
[23] 张雪佳. 维药唇香草化学成分多样分析与对酪氨酸酶活性影响的研究[D]. 乌鲁木齐:新疆医科大学, 2015. [ZHANG X J. Analysis of diverse chemical components of Uyghur lip vanilla and its effect on tyrosinase activity[D]. Urumqi:Xinjiang Medical University, 2015. ZHANG X J. Analysis of diverse chemical components of Uyghur lip vanilla and its effect on tyrosinase activity[D]. Urumqi: Xinjiang Medical University, 2015.
[24] 张砚垒. 不同品种红枣营养成分分析及抗氧化活性研究[D]. 泰安:山东农业大学, 2021. [ZHANG Y L. Analysis of nutrient composition and antioxidant activity of different varieties of jujube[D]. Taian:Shandong Agricultural University, 2021. ZHANG Y L. Analysis of nutrient composition and antioxidant activity of different varieties of jujube[D]. Taian: Shandong Agricultural University, 2021.
[25] C RÖSCH, TAVERNE N, VENEMA K, et al. Effects of in vitro fermentation of barley β-glucan and sugar beet pectin using human fecal inocula on cytokine expression by dendritic cells[J]. Molecular Nutrition & Food Research,2017,61(1):24−30.
[26] MAKKL K, DEEHAN C E, WALTER J, et al. The impact of dietary fiber on gut microbiota in host health and disease[J]. Cell Host Microbe,2018,23(6):705−715. doi: 10.1016/j.chom.2018.05.012
[27] ZHENG L X, CHEN X Q, ZHANG Z L. Current trends in marine algae polysaccharides:The digestive tract, microbial catabolism, and prebiotic potential[J]. International Journal of Biological Macromolecules,2020,151:344−354. doi: 10.1016/j.ijbiomac.2020.02.168
[28] 骆成尧. 绿原酸与咖啡酸体外代谢机制及相互作用研究[D]. 南昌:南昌大学, 2012. [LUO C Y. Study on metabolic mechanism and interaction between chlorogenic acid and caffeic acid in vitro[D]. Nanchang:Nanchang University, 2012. LUO C Y. Study on metabolic mechanism and interaction between chlorogenic acid and caffeic acid in vitro[D]. Nanchang: Nanchang University, 2012.
[29] ROCIO G, DAVID B, MARIA D, et al. Metabolism of different dietary phenolic compounds by the urolithin-producing human-gut bacteria Gordonibacter urolithinfaciens and Ellagibacter isourolithinifaciens[J]. Food & Function,2020,11(8):7012−7022.
[30] 邱萌霞, 果秀梅, 薛冰, 等. 合成绿原酸内生细菌的筛选、鉴定及发酵培养基的初步优化[J]. 天津科技大学学报,2022,37(2):1−6,42. [QIU M X, GUO X M, XUE B, et al. Screening, identification and preliminary optimization of fermentation medium for endophytic bacteria synthesized chlorogenic acid[J]. Journal of Tianjin University of Science and Technology,2022,37(2):1−6,42. QIU M X, GUO X M, XUE B, et al . Screening, identification and preliminary optimization of fermentation medium for endophytic bacteria synthesized chlorogenic acid[J]. Journal of Tianjin University of Science and Technology,2022 ,37 (2 ):1 −6,42 .[31] 魏玲. 咖啡酸在大鼠体内Ⅱ相代谢产物研究[D]. 天津:天津医科大学, 2010. [WEI L. Study on phase II metabolites of caffeic acid in rats[D]. Tianjin:Tianjin Medical University, 2010. WEI L. Study on phase II metabolites of caffeic acid in rats[D]. Tianjin: Tianjin Medical University, 2010.
[32] 周华书. 一株史氏鲟源腐生葡萄球菌的分离鉴定及其基因组分析[J]. 渔业研究,2021,43(5):461−471. [ZHOU H S. Isolation and genomic analysis of a strain of Staphylococcus saprophytic from sturgeon[J]. Fishery Research,2021,43(5):461−471. ZHOU H S . Isolation and genomic analysis of a strain of Staphylococcus saprophytic from sturgeon[J]. Fishery Research,2021 ,43 (5 ):461 −471 .[33] 闫建英, 李虎, 邢潇月, 等. 鸡源奇异变形杆菌的分离鉴定及生物学特性分析[J]. 中国动物保健,2023,25(3):55−57. [YAN J Y, LI H, XING X Y, et al. Isolation and identification and biological characteristics analysis of Proteus mirabilis from chicken[J]. China Animal Health,2023,25(3):55−57. YAN J Y, LI H, XING X Y, et al . Isolation and identification and biological characteristics analysis of Proteus mirabilis from chicken[J]. China Animal Health,2023 ,25 (3 ):55 −57 . -
期刊类型引用(2)
1. 彭婷,江丹,陈阳,王玉,赖富丽,陈志元,黄林恋. 响应面法优化桑叶提取液脱色工艺及其对α-葡萄糖苷酶抑制活性. 食品与发酵科技. 2024(06): 62-69 .  百度学术
百度学术
2. 郑霖华,吴启赐,陈巧玲,林佳燕,廖苑萍. 细梗香草皂苷活性炭脱色工艺及抑菌活性研究. 中国食品添加剂. 2021(11): 67-72 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:







 下载:
下载:



