Optimization of Phosphorylation of Polysaccharides from Chicory (Cichoricum intybus var. foliosum Hegi) by Response Surface Method
-
摘要: 采用磷酸盐法对结球菊苣多糖(Cichoricum intybus var. foliosum Hegi)进行磷酸化修饰,通过响应面法优化磷酸化修饰结球菊苣多糖的工艺条件,并考察磷酸化结球菊苣多糖的抗氧化活性。结果显示,磷酸化修饰结球菊苣多糖的最佳条件为:多糖与三聚磷酸钠摩尔比1:10,反应温度81 ℃,反应时间3.3 h,反应pH为7.1,此条件下多糖中磷含量为4.75%。红外光谱分析结果证实,修饰后的结球菊苣多糖含有磷酸酯基团。抗氧化活性试验结果表明,与结球菊苣多糖相比,磷酸化结球菊苣多糖对DPPH自由基的清除率提高了11.28%,因此,磷酸化修饰后的结球菊苣多糖抗氧化活性显著提高。Abstract: Phosphorylation modification of chicory (Cichoricum intybus var. foliosum Hegi) polysaccharide was explored by phosphate method. The conditions for the phosphorylation of chicory polysaccharide were optimized by response surface methodology. At the same time, the antioxidant activity for phosphorylated chicory polysaccharide was still explored. The results showed that the optimal conditions for the phosphorylation of chicory polysaccharide was as follows: Molar ratio of polysaccharide to sodium tripolyphosphate was 1:10, temperature was 81 ℃, time was 3.3 h and pH was 7.1. Under these conditions, the content of phosphate in polysaccharides was 4.75%. The results of infrared spectrum analysis confirmed that the modified chicory polysaccharides contained phosphate groups. The results of antioxidant activity test showed that the DPPH radical scavenging rate of phosphorylated chicory polysaccharide increased by 11.28% compared with chicory polysaccharide. In conclusion, the antioxidant activity of chicory polysaccharide could be improved by phophorylation modification.
-
结球菊苣(Cichoricum intybus var. foliosum Hegi),是菊苣属的一种多年宿根性草本植物。作为一种药食两用植物,红菊苣颜色鲜艳,营养价值很高,既可以直接食用也有很高的药用价值[1]。结球菊苣含有多种活性成分,其中结球菊苣多糖含量最多。菊苣多糖具有抗氧化、消炎调节免疫系统、抗肿瘤、抗病毒等生物活性[2−3]。
结构修饰可以改变多糖的分子量、取代基团类型和分子结构,从而影响多糖的生物活性[4]。到目前为止,常见的几种化学改性方法包括羧甲基化[5]、硫酸化[6]、硒化[7]、磷酸化[8−9]、乙酰化[10]等。磷酸化后的多糖与天然多糖比一些基团(例如羟基等)被磷酸根所取代,分子量也同时发生了改变,从而导致其多糖生物活性增强[11−13]。Lin等[14]对川牛膝多糖磷酸化研究发现磷酸化修饰后提高了其免疫活性;胡晓波等[15]对桑葚多糖磷酸化修饰前后的抗氧化活性研究,实验表明磷酸化修饰后的桑葚多糖的抗氧化活性增强。常用的磷酸化方法有三氯氧磷(POCl3)[16]、磷酸及其酸酐[17]、磷酸盐[18]等。三氯氧磷法反应时间短、操作步骤简单的优点,但是氯化氧磷的使用可能会导致目标分子降解,反应过程中氢离子浓度增加,需要在反应过程中加入碱性试剂,如吡啶和三乙胺来中和,防止多糖降解[19−21];磷酸及其酸酐或二者混合物是最早使用的磷酸化试剂,磷酸基团活性大,但是磷酸及其酸酐主要的缺点是在反应过程中容易导致糖样降解[22],产物收率不高,取代度也不理想[23−24];磷酸盐法是一种温和的多糖磷酸化反应[25],常用于多糖磷酸化修饰的磷酸盐试剂主要有多聚磷酸钠[26]、磷酸氢二钠、三偏磷酸钠[27]、磷酸二氢钠及这些盐的混合物[28],磷酸盐法制备工艺简便、安全、经济效益高[29],产生的副产物和有毒有害物较少,在工业生产中应用最为普及。本文选择三聚磷酸钠作为磷酸化试剂,反应无有机试剂参与,方便后续处理。
多糖本身具有多种生物活性,理论上磷酸化修饰能够提高多糖抗氧化活性,随着结构分析方法的日渐完善,磷酸化修饰多糖有更广泛的应用前景。截至目前,结球菊苣多糖的磷酸化尚未见报道,因此,本文以结球菊苣为原料,用复合酶法水解浸提结球菊苣多糖,通过单因素实验确定反应时间、反应温度、多糖与磷酸化试剂摩尔比、反应pH,从而设计响应面试验优化磷酸化修饰工艺条件,并且通过测定其对DPPH自由基清除能力,来确定磷酸化结球菊苣多糖的抗氧化活性,为结球菊苣多糖及其磷酸化衍生物的开发与利用提供参考。
1. 材料及方法
1.1 材料与仪器
结球菊苣 上海金山区银龙蔬菜配送有限公司;果胶酶、纤维素酶(酶活大于15000 U/g) 国药集团化学试剂有限公司;AB-8大孔树脂、DEAE-52纤维素、葡聚糖G-200/G-15 北京索莱宝公司;半水酒石酸锑钾、钼酸铵、浓盐酸、氢氧化钠、硫酸、抗坏血酸、硫酸钠、三聚磷酸钠等 均为分析纯,天津大茂公司;DPPH 色谱纯,国药集团化学试剂有限公司。
UV1100型紫外分光光度计 上海天美公司;Synergy2多功能酶标仪 美国伯腾公司;恒温培养振荡器 上海智城公司;MRS微波消解仪 美国CEM公司;RE-6000型旋转蒸发器 上海亚荣公司;GT2型冻干机 德国SRK公司;Vector22型傅立叶变换红外光谱 美国尼高力公司。
1.2 实验方法
1.2.1 结球菊苣多糖的制备
采用复合酶法对结球菊苣多糖进行水解浸提。取50 g干燥后的结球菊苣粉末,加入复合酶(纤维素酶0.1 g,果胶酶0.025 g),按料液比1:30于55 ℃条件下,摇床振荡2 h,85 ℃灭酶10 min,将灭酶后反应液抽滤除去沉淀,收集上清液。Sevage法脱蛋白、AB-8大孔树脂脱色后,以蒸馏水为洗脱溶剂用纤维素DEAE-52、葡聚糖G-200除杂,经冷冻干燥后得结球菊苣多糖。
1.2.2 磷含量测定
有关磷含量测定参考《水质总磷的测定钼酸铵分光光度法》(GB 11893-1989)中的方法来进行,并按照该实验略微修改。
磷标准曲线的制作:分别取25 mL的去离子水以及等梯度浓度的磷标准液(0.24、0.48、0.72、0.96、1.2 mg/L)在150 ℃下微波消解15 min,待冷却后用50 mL容量瓶加水定容,将全部的定容液放入50 mL锥形瓶中依次加入10%的抗坏血酸溶液1 mL,半分钟后加入钼酸盐溶液2 mL混匀之后室温放置15 min后,测定在700 nm的吸光值。以吸光度为纵坐标,磷酸根浓度为横坐标,得到磷含量标准曲线。y=0.0035+0.07112x,R2=0.9981。
0.2 g的结球菊苣多糖跟13 mL的去离子水,加入50 mg硫酸钠混匀,再加入2 mL的0.1 g/mL的三聚磷酸钠,用1 mol/L的HCl或者1 mol/L的NaOH调节pH到7,80 ℃反应3 h之后,用预处理后的SepHadex G-15凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥。
总磷含量的测定:取冷冻干燥的磷酸化多糖样品1 mg加去离子水定容至10 mL,从中取出1 mL的稀释液,用去离子水定容到25 mL,在150 ℃下微波消解15 min,冷却后加水定容到50 mL,加入10%的抗坏血酸溶液1 mL,30 s后加入钼酸盐溶液2 mL混匀室温放置15 min,测定在700 nm处的吸光值。
游离磷含量的测定:取冷冻干燥的磷酸化多糖样品1 mg加水定容至50 mL,依次加入10%的抗坏血酸溶液1 mL,30 s后加入钼酸盐溶液2 mL混匀之后室温放置15 min后,测定在700 nm处的吸光值。
采用上述测定方法,对冷冻干燥的磷酸化多糖样品磷含量进行测量和计算,以样品中的磷含量作为反应结果的衡量标准,计算公式如下:
多糖修饰样品磷含量(%)=总磷含量−游离磷含量多糖修饰样品质量×100 1.2.3 结球菊苣多糖磷酸化单因素实验
1.2.3.1 反应时间对磷酸化修饰效果的影响
取5个锥形瓶分别加0.2 g的结球菊苣多糖跟13 mL的去离子水,加入50 mg硫酸钠混匀,再加入2 mL 0.1 g/mL的三聚磷酸钠水溶液(结球菊苣多糖与三聚磷酸钠的摩尔比为1:10),调pH到7,在80 ℃反应2、3、4、5、6 h后取出冷却,用预处理后的SepHadex G-15凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.2 反应温度对磷酸化的影响
取5个锥形瓶分别加0.2 g的结球菊苣多糖跟13 mL的去离子水,加入50 mg硫酸钠混匀,再加入2 mL 0.1 g/mL的三聚磷酸钠水溶液,调pH到7,分别在60、70、80、90、95 ℃条件下反应3 h后取出冷却,用预处理后的SepHadex G-15凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.3 pH对磷酸化的影响
取5个锥形瓶分别加0.2 g的结球菊苣多糖跟13 mL的去离子水,加入50 mg硫酸钠混匀,再加入2 mL 0.1 g/mL的三聚磷酸钠水溶液,分别调pH到4、6、7、8、9,在80 ℃条件下反应3 h后取出冷却,用预处理后的SepHadex G-15凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.4 多糖与磷酸化试剂摩尔比对磷酸化的影响
取5个锥形瓶分别加0.2 g的结球菊苣多糖及13 mL的去离子水,加入50 mg硫酸钠混匀,分别加入1.2、1.6、2、2.4、2.8 mL的0.1 g/mL三聚磷酸钠水溶液(获得多糖与磷酸化试剂摩尔比1:6、1:8、1:10、1:12、1:14),调pH到7,在80 ℃条件下反应3 h后取出冷却,用预处理后的SepHadex G-15凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测量样品总磷和游离磷含量。
1.2.4 结球菊苣多糖磷酸化响应面法优化工艺条件
在单因素实验基础上,以磷酸化结球菊苣多糖磷含量为考察指标,对反应时间(A)、反应温度(B)、反应pH(C)、多糖与磷酸化试剂摩尔比(D)进行响应面优化。采用Design-Expert 8.0软件设计响应面试验(见表1),选用Box-Behnken design(BBD)模型,以磷酸化产物中磷含量为响应值,做4因素3水平二次回归正交组合试验。
表 1 响应面因素与水平表Table 1. Response Surface Factors and Levels因素 水平 −1 0 1 A反应时间(h) 2 3 4 B反应温度(℃) 70 80 90 C反应pH 6 7 8 D多糖与磷酸化试剂摩尔比 1:8 1:10 1:12 1.2.5 磷酸化结球菊苣多糖的傅里叶红外光谱的测定
将冷冻干燥的磷酸化结球菊苣多糖与KBr混合均匀、压片,在波数400~4000 cm−1进行红外光谱扫描,将磷酸化反应前后的红外光谱变化进行比较。
1.2.6 DPPH自由基清除能力试验
用无水乙醇在100 mL容量瓶中配制浓度为0.5 mmol/l的DPPH-乙醇溶液,放冰箱保存备用。将抗坏血酸与纯化后的磷酸化前后结球菊苣多糖溶液用水分别稀释到0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL,取1 ml的DPPH乙醇溶液,分别向其中加入1 mL不同质量浓度的抗坏血酸与磷酸化前后结球菊苣多糖溶液,在室温下避光静置30 min,在波长517 nm处测定吸光度(A样品)。再用乙醇代替DPPH-乙醇溶液作为对照组测定吸光度(A对照);用蒸馏水代替待测样品做空白组,测定吸光度(A空白)。DPPH自由基清除率计算公式如下:
自由基清除率(%)=A空白−(A样品−A对照)A空白×100 1.3 数据处理
本实验所有实验数据均重复测定三次,结果取平均值。采用SPSS Statistics 26和Origin 2021软件进行数据分析及作图及显著性分析(P<0.05),采用Design-Expert 8.0软件设计响应面实验并对数据进行回归分析。
2. 结果与分析
2.1 单因素实验结果
2.1.1 反应时间对磷酸化的影响
以结球菊苣多糖磷含量作为指标,来确定磷酸化修饰程度,磷含量越高表示磷酸根基团的接枝率越高,即磷酸化修饰程度越高[29]。反应时间对磷含量的影响见图1,由图1可以看出,随着反应时间的进行磷含量呈先增大后减少的变化趋势,在2~3 h范围内时,多糖修饰样品中的磷含量随着时间的延长而逐渐增加,当反应3 h时,磷含量达到最大值(4.57%),在3~6 h范围内,随着时间的增加磷含量呈下降趋势。在对多糖进行磷酸化反应时,时间太短磷酸化反应不完全,磷的取代度较低,但是长时间的高温反应又会使多糖结构破坏,降低磷酸化多糖的取代度,所以多糖修饰样品中的磷含量会一开始随着时间的增加而增加,在到达一定时间后又会随着时间的增加而降低[30]。
2.1.2 反应温度对磷酸化的影响
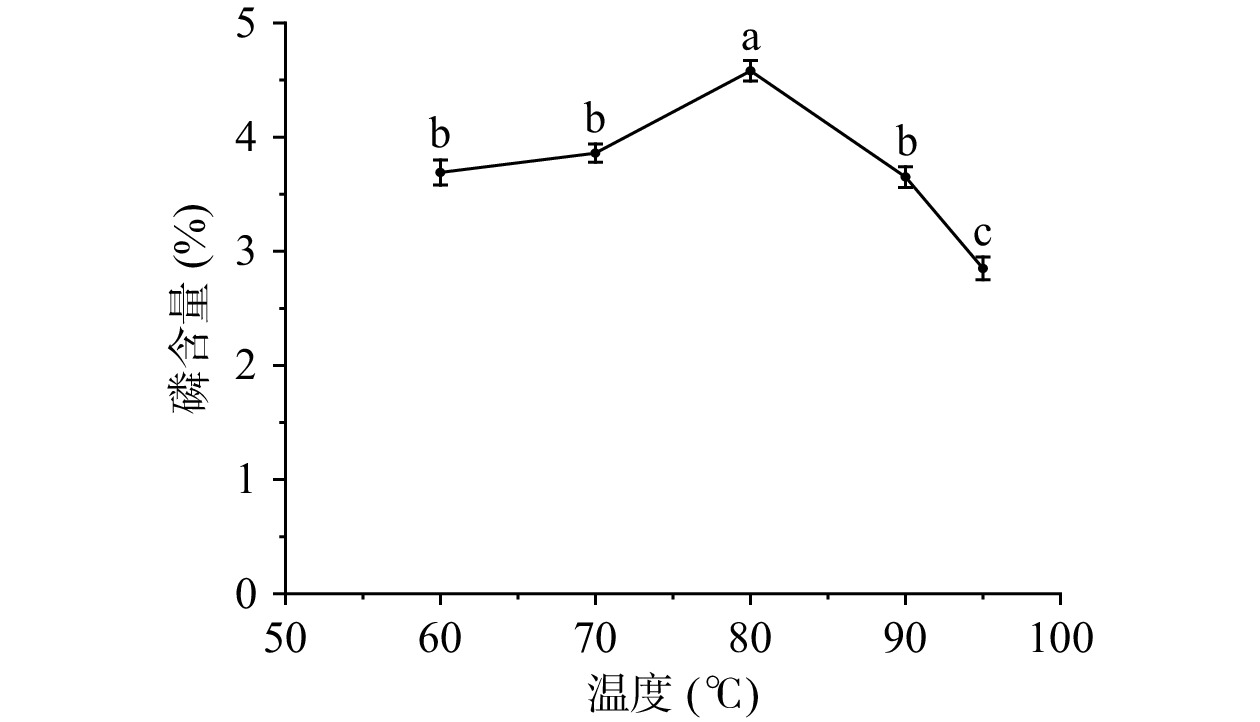
反应温度对磷含量的影响见图2,由图2可以看出在60~80 ℃时,随着温度的提高多糖修饰样品中的磷含量呈现不断增加的趋势,当温度为80 ℃到达最大值(4.58%),在80~95 ℃时,磷含量随温度的提高呈减少的趋势。在对多糖磷酸化修饰时,温度较低磷酸化的反应缓慢,磷的取代度较低,随着温度的升高,接枝量提高。可能是因为温度升高,使多糖分子的反应活性增强,磷酸酯化的程度也随之增加,当温度进一步升高时,由于过高的温度导致多糖结构的破坏,从而磷含量降低[30]。
2.1.3 pH对磷酸化的影响
pH对磷含量的影响见图3,由图3可以看出在pH为4~7时,随pH的增加多糖修饰样品中的磷含量呈上升的趋势,当pH为7时到达最大值(4.56%),在pH为7~9时,随pH的增加多糖修饰样品中的磷含量呈下降的趋势。在磷酸化多糖时过酸或者过碱都会造成接枝率降低,原因可能是三聚磷酸钠在较低的pH下不稳定,会分解成活性较低的焦磷酸钠和正磷酸钠,而pH过高会导致磷酸酯化的逆反应增强,使磷酸根水解降低接枝率。只有在合适的pH下,才有比较高的磷酸根取代度[30]。
2.1.4 多糖与磷酸化试剂摩尔比对磷酸化的影响
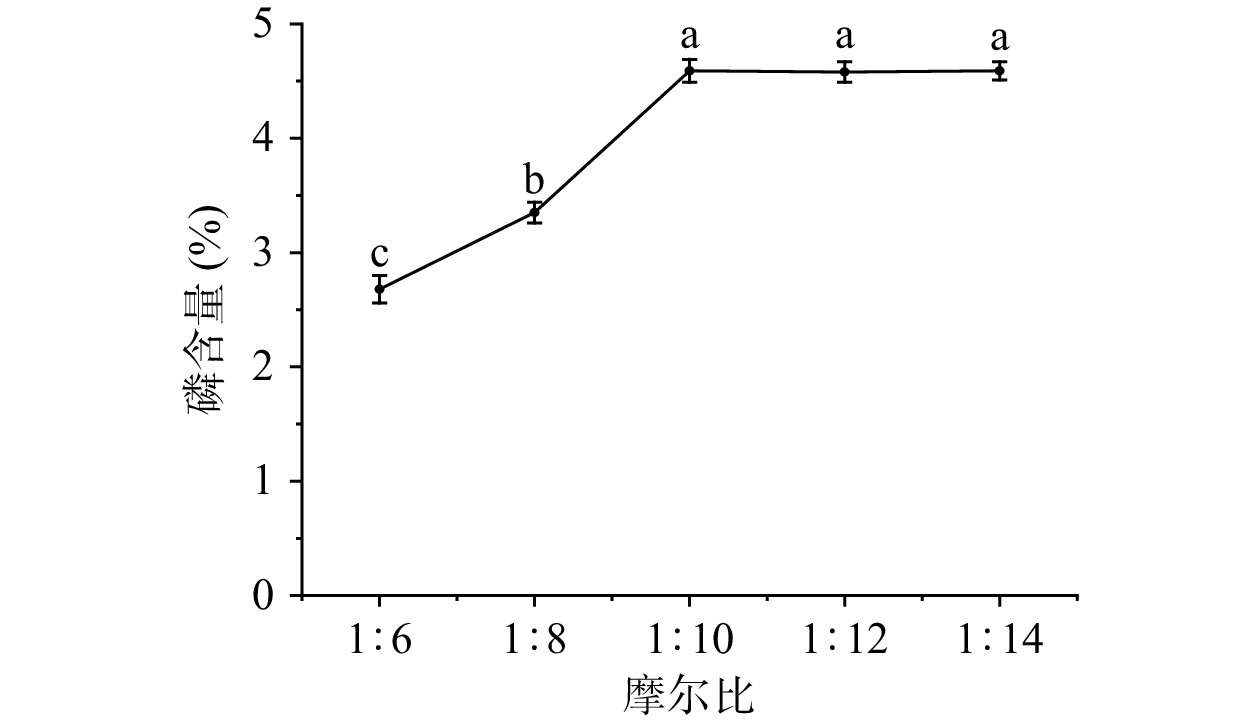
多糖与磷酸化试剂摩尔比对磷含量的影响见图4,由图4可以看出在摩尔比1:6~1:10时,随着磷酸盐的增加样品中的磷含量呈上升趋势,当多糖与磷酸化试剂摩尔比为1:10时到达最大值(4.48%),进一步增加摩尔比磷含量趋于稳定不再增加。在一定范围内,反应所需磷酸根未达到饱和,菊苣多糖结合磷的含量随磷酸盐的量增加而增加,而当摩尔比达到1:10时,磷酸根维持平衡,这可能是因为磷酸盐多于反应所需,多糖结合的磷酸根已达到饱和[30]。
2.2 结球菊苣多糖磷酸化工艺优化结果
2.2.1 响应面试验设计及结果
在单因素实验结果的基础上,对结球菊苣多糖磷酸化工艺条件进行优化,用Design Expert 8.0软件设计4因素3水平的二次回归响应面,得到试验数据,磷酸化结球菊苣多糖响应面试验设计及响应值见表2,并作回归模型方差和显著性分析,结果见表3。
表 2 响应面试验设计及结果Table 2. Response surface test design and results实验号 因素 磷含量(%) A B C D 1 1 −1 0 0 3.4 2 0 0 0 0 4.86 3 0 −1 1 0 3.02 4 0 0 0 0 4.29 5 0 −1 −1 0 2.66 6 −1 1 0 0 3.23 7 1 1 0 0 3.5 8 −1 0 0 1 3.1 9 −1 0 1 0 3.45 10 −1 0 0 −1 3.43 11 1 0 0 1 4.21 12 1 0 0 −1 3.33 13 0 0 −1 −1 2.71 14 0 0 0 0 4.57 15 0 0 1 1 3.21 16 −1 0 −1 0 3.12 17 0 0 1 −1 2.99 18 0 1 0 −1 2.59 19 1 0 −1 0 3.36 20 1 0 1 0 3.63 21 0 −1 0 −1 2.4 22 0 1 0 1 3.2 23 0 0 0 0 4.73 24 0 1 1 0 3.24 25 0 −1 0 1 2.81 26 0 1 −1 0 2.93 27 −1 −1 0 0 3.2 28 0 0 0 0 4.41 29 0 0 −1 1 2.51 表 3 回归模型的方差分析Table 3. Analysis of variance of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 11.92 14 0.8512 20.66 <0.0001 ** A 0.30 1 0.30 7.30 0.0172 * B 0.12 1 0.12 2.91 0.1099 C 0.42 1 0.42 10.24 0.0064 ** D 0.21 1 0.21 5.11 0.0402 * AB 0.0012 1 0.0012 0.029 0.8656 AC 0.0009 1 0.0009 0.022 0.8846 AD 0.37 1 0.37 8.88 0.0099 ** BC 0.0006 1 0.0006 0.015 0.9037 BD 0.01 1 0.01 0.24 0.6299 CD 0.044 1 0.044 1.07 0.3184 A2 0.59 1 0.59 14.23 0.0021 B2 5.23 1 5.23 126.99 <0.0001 C2 4.33 1 4.33 105.05 <0.0001 D2 4.79 1 4.79 116.27 <0.0001 残差 0.5768 14 0.04120 失拟项 0.3631 10 0.03631 0.6797 0.7180 不显著 纯误差 0.2137 4 0.05342 总差 12.4939 28 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 对试验结果进行二次回归分析,计算得到回归方程:Y=4.57+0.16A+0.1B+0.19C+0.13D+0.018AB−0.015AC+0.3AD−0.012BC+0.05BD+0.1CD−0.3A2−0.9B2−0.82C2−0.86D2。由表3可以得出,总决定系数R2=0.9538,表明此模型拟合良好,实验值与预测值之间的差异很小,校正系数R2Adj=0.9077,表明此模型可以解释90.77%的响应值;此模型的P<0.0001,失拟项P=0.7180,说明回归方程理想,模型显著。综上所述,该模型可用于分析和预测磷酸化修饰结球菊苣多糖的工艺优化。
2.2.2 响应面试验的交互作用分析
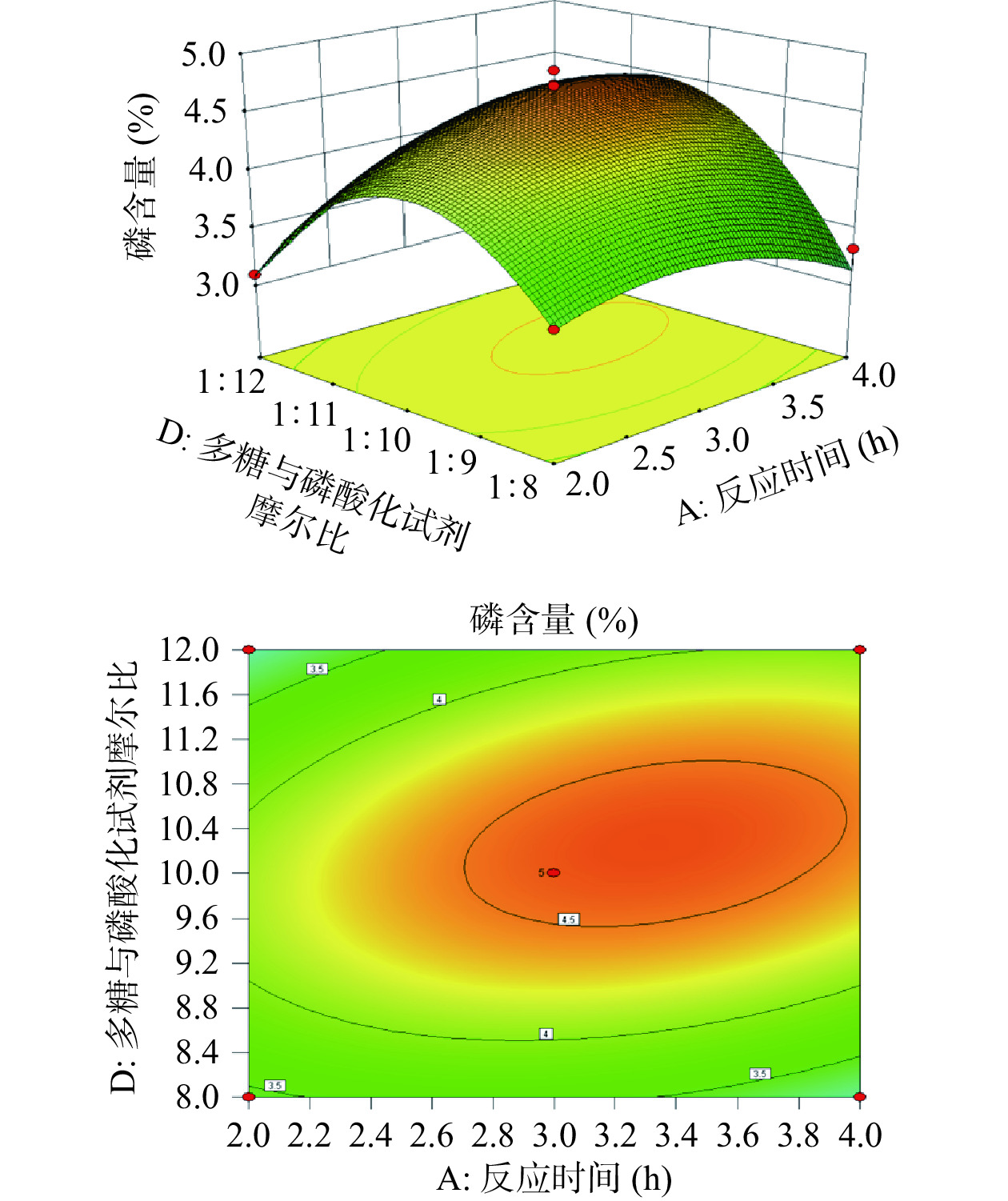
根据表3的数据可以得到,分别将模型中的两个因素固定在中间水平,得到另外两个因素交互作用对磷含量的子模型并根据模型绘制三维曲面图,见图5。
由图5可知,响应面交互图呈降落伞状,响应面交互图坡度越大表明磷含量的变化越快,即更为显著。这说明多糖与磷酸化试剂的摩尔比、反应时间之间的交互性对磷含量有明显的影响。
2.2.3 模型的优化及验证实验
通过Design Expert软件对试验进行优化,按照回归模型预测可得到结球菊苣多糖磷酸化的最佳工艺条件为:反应时间3.34 h,反应温度80.62 ℃,多糖与磷酸化试剂的摩尔比1:10.29和反应pH7.12,在此反应条件下结球菊苣多糖磷含量为4.62%。为验证此结果的可靠性,进行三次平行试验,根据实际情况修正工艺条件为:反应时间3.3 h,反应温度81 ℃,多糖与磷酸化试剂摩尔比1:10,调整反应pH为7.1,测得多糖磷含量平均值为4.75%,该值与模型预测值接近,验证了该模型的可靠性。
2.3 磷酸化前后结球菊苣多糖的红外光谱分析
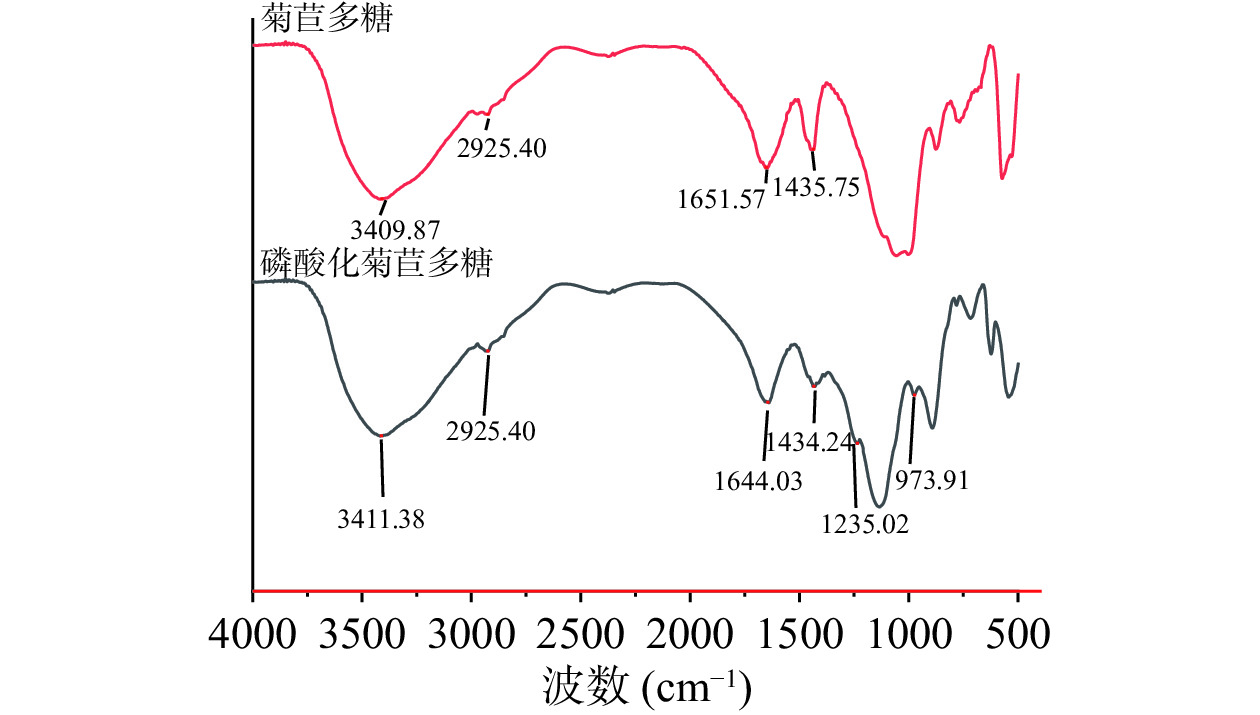
由图6可以看出该吸收峰为典型的多糖吸收峰,并且磷酸化前后峰型未发生较大变化,说明多糖的主体结构没有变化。磷酸化结球菊苣多糖和结球菊苣多糖在3409 cm−1附近处的吸收峰为-OH的伸缩振动吸收峰,表明磷酸化结球菊苣多糖和结球菊苣多糖中含有分子内氢键;2925、1435 cm−1附近处为C-H的伸缩振动吸收峰,为糖类的特征吸收峰;其中1651 cm−1附近处的吸收峰是羰基C=O键的吸收峰。除此之外,磷酸化结球菊苣多糖在1235 cm−1处的吸收峰为P=O键的伸缩振动吸收峰,973 cm−1处的吸收峰为P-O-C键的吸收峰,这两个峰的出现表明有磷酸基团接入[15]。综上,磷酸化修饰结球菊苣多糖成功,所得产物为磷酸化结球菊苣多糖。
2.4 磷酸化结球菊苣多糖DPPH自由基清除能力分析
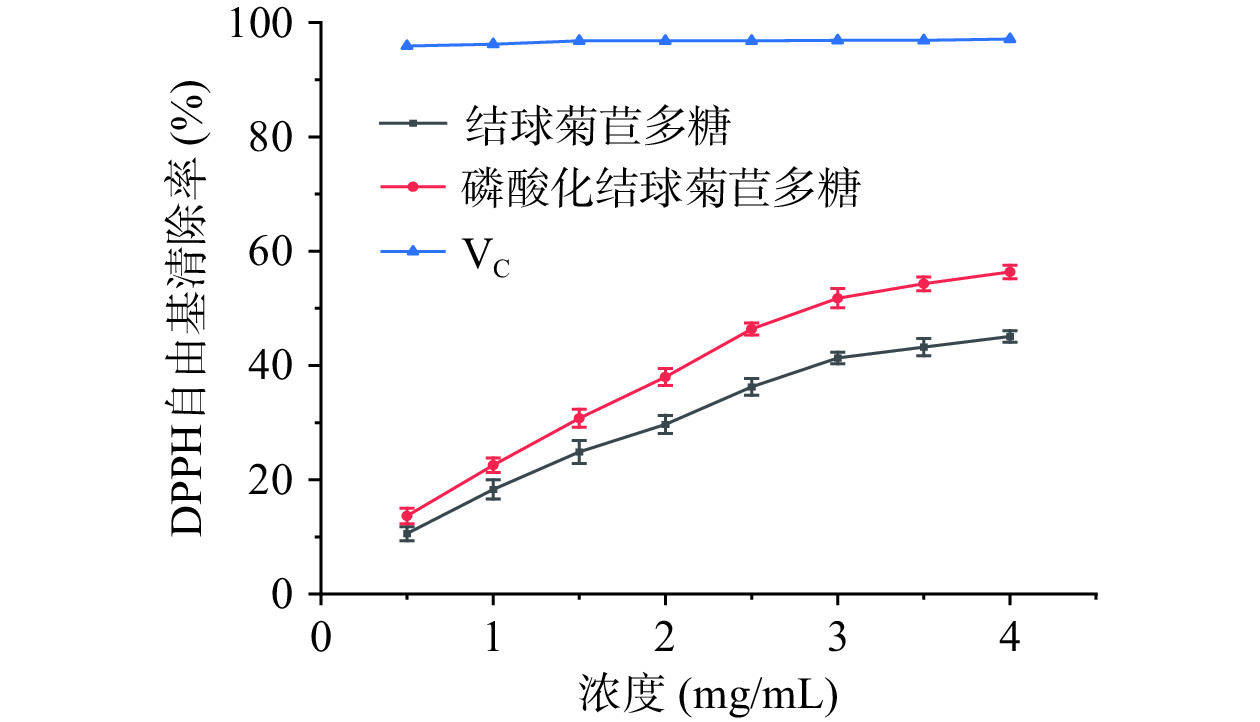
由图7可知,磷酸化结球菊苣多糖在一定浓度范围内,浓度与清除率呈现量效关系,并且浓度越高,多糖对DPPH自由基的清除率越高。在浓度为4 mg/mL时,磷酸化结球菊苣多糖和结球菊苣多糖的清除率分别为56.36%、45.08%,磷酸化结球菊苣多糖较结球菊苣多糖的清除率提高了11.28%,说明磷酸化修饰提高了结球菊苣多糖清除DPPH自由基的能力[26]。多糖的抗氧化活性是因其含有羟基等还原性基团,结球菊苣多糖经过磷酸化修饰后其分子结构发生了改变,从而影响了结球菊苣多糖的抗氧化活性。但目前磷酸化结球菊苣多糖的抗氧化作用机理还不明确,仍需进一步探讨研究。
3. 结论
通过单因素与响应面试验优化后,得到磷酸化修饰结球菊苣多糖的最优工艺参数,在最优工艺参数下制备的磷酸化结球菊苣多糖中磷含量为4.75%±0.04%,与模型预期值4.62%接近。红外光谱显示结球菊苣多糖成功引入了磷酸根基团,说明磷酸化修饰成功。抗氧化活性试验结果表明,磷酸化结球菊苣多糖较结球菊苣多糖具有更强的抗氧化活性,在磷酸化结球菊苣多糖浓度为4 mg/mL时,对DPPH自由基的清除率为56.36%,说明通过磷酸化修饰的方法能够提高结球菊苣多糖的抗氧化活性,磷酸化结球菊苣多糖在食品工业中具有作为新型食品添加剂和抗氧化剂的潜力。后续可进一步考察磷酸化结球菊苣多糖的抗肿瘤活性、抗病毒活性和免疫调节活性等更多生物活性,扩展磷酸化结球菊苣多糖在食品药品领域的开发与利用。
-
表 1 响应面因素与水平表
Table 1 Response Surface Factors and Levels
因素 水平 −1 0 1 A反应时间(h) 2 3 4 B反应温度(℃) 70 80 90 C反应pH 6 7 8 D多糖与磷酸化试剂摩尔比 1:8 1:10 1:12 表 2 响应面试验设计及结果
Table 2 Response surface test design and results
实验号 因素 磷含量(%) A B C D 1 1 −1 0 0 3.4 2 0 0 0 0 4.86 3 0 −1 1 0 3.02 4 0 0 0 0 4.29 5 0 −1 −1 0 2.66 6 −1 1 0 0 3.23 7 1 1 0 0 3.5 8 −1 0 0 1 3.1 9 −1 0 1 0 3.45 10 −1 0 0 −1 3.43 11 1 0 0 1 4.21 12 1 0 0 −1 3.33 13 0 0 −1 −1 2.71 14 0 0 0 0 4.57 15 0 0 1 1 3.21 16 −1 0 −1 0 3.12 17 0 0 1 −1 2.99 18 0 1 0 −1 2.59 19 1 0 −1 0 3.36 20 1 0 1 0 3.63 21 0 −1 0 −1 2.4 22 0 1 0 1 3.2 23 0 0 0 0 4.73 24 0 1 1 0 3.24 25 0 −1 0 1 2.81 26 0 1 −1 0 2.93 27 −1 −1 0 0 3.2 28 0 0 0 0 4.41 29 0 0 −1 1 2.51 表 3 回归模型的方差分析
Table 3 Analysis of variance of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 11.92 14 0.8512 20.66 <0.0001 ** A 0.30 1 0.30 7.30 0.0172 * B 0.12 1 0.12 2.91 0.1099 C 0.42 1 0.42 10.24 0.0064 ** D 0.21 1 0.21 5.11 0.0402 * AB 0.0012 1 0.0012 0.029 0.8656 AC 0.0009 1 0.0009 0.022 0.8846 AD 0.37 1 0.37 8.88 0.0099 ** BC 0.0006 1 0.0006 0.015 0.9037 BD 0.01 1 0.01 0.24 0.6299 CD 0.044 1 0.044 1.07 0.3184 A2 0.59 1 0.59 14.23 0.0021 B2 5.23 1 5.23 126.99 <0.0001 C2 4.33 1 4.33 105.05 <0.0001 D2 4.79 1 4.79 116.27 <0.0001 残差 0.5768 14 0.04120 失拟项 0.3631 10 0.03631 0.6797 0.7180 不显著 纯误差 0.2137 4 0.05342 总差 12.4939 28 注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。 -
[1] 朱建星, 尹元元, 王红艳, 等. 乙醇溶液体系酶解-微波辅助提取红菊苣总苷[J]. 食品工业科技,2017,38(20):83−89. [ZHU J X, YIN Y Y, WANG H Y, et al. Enzymatic hydrolysis in the ethanol solution and microwave assisted extraction technology of total glycosides from Cichoricum intybus var. foliosum Hegi[J]. Science and Technology of Food Industry,2017,38(20):83−89.] ZHU J X, YIN Y Y, WANG H Y, et al. Enzymatic hydrolysis in the ethanol solution and microwave assisted extraction technology of total glycosides from Cichoricum intybus var. foliosum Hegi[J]. Science and Technology of Food Industry, 2017, 38(20): 83−89.
[2] ZHU H, WANG Z J, WU Y L, et al. Untargeted metabonomics reveals intervention effects of chicory polysaccharide in a rat model of non-alcoholic fatty liver disease[J]. International Journal of Biological Macromolecules,2019,128:363−375. doi: 10.1016/j.ijbiomac.2019.01.141
[3] 薛顺, 朱金芳, 马丽, 等. 正交试验法筛选菊苣根中多糖的提取工艺[J]. 新疆农业大学学报,2018,41(2):128−132. [XUE S, ZHU J F, MA L, et al. Orthogonal test method for screening polysaccharide extraction from chicory (Cichorium intybus L.) roots[J]. Journal of Xinjiang Agricultural University,2018,41(2):128−132.] XUE S, ZHU J F, MA L, et al. Orthogonal test method for screening polysaccharide extraction from chicory (Cichorium intybus L.) roots[J]. Journal of Xinjiang Agricultural University, 2018, 41(2): 128−132.
[4] LI Z W, DU Z M, WANG Y W, et al. Chemical modification, characterization, and activity changes of land plant polysaccharides:A review[J]. Polymers (Basel), 2022, 14(19):4161.
[5] 郝辉, 龚梅秋, 刘远上, 等. 甜茶多糖的提取、羧甲基化修饰及抗氧化活性研究[J]. 陕西农业科学,2022,68(11):37−42. [HAO H, GONG M Q, LIU Y S, et al. Study on extraction, carboxymethylation and antioxidant activity of sweet tea polysaccharide[J]. Shaanxi Journal of Agricultural Sciences,2022,68(11):37−42.] HAO H, GONG M Q, LIU Y S, et al. Study on extraction, carboxymethylation and antioxidant activity of sweet tea polysaccharide[J]. Shaanxi Journal of Agricultural Sciences, 2022, 68(11): 37−42.
[6] CHEN L, HUANG G. The antiviral activity of polysaccharides and their derivatives[J]. Int J Biol Macromol,2018,115:77−82. doi: 10.1016/j.ijbiomac.2018.04.056
[7] 李晓娇, 闵诗碧, 曹凯红, 等. 龙陵紫皮石斛多糖的硒化修饰及其抗氧化活性[J]. 食品研究与开发,2022,43(20):117−124. [LI X J, MIN S B, CAO K H, et al. Selenization modification and antioxidant activity of Dendrobium devonianum Paxt. polysaccharide from Longling[J]. Food Research and Development,2022,43(20):117−124.] LI X J, MIN S B, CAO K H, et al. Selenization modification and antioxidant activity of Dendrobium devonianum Paxt. polysaccharide from Longling[J]. Food Research and Development, 2022, 43(20): 117−124.
[8] CHEN L, HUANG G. Antioxidant activities of phosphorylated pumpkin polysaccharide[J]. Int J Biol Macromol,2019,125:256−261. doi: 10.1016/j.ijbiomac.2018.12.069
[9] FENG H, FAN J, LIN L, et al. Immunomodulatory effects of phosphorylated radix Cyathulae officinalis polysaccharides in immunosuppressed mice[J]. Molecules, 2019, 24(22).
[10] 吕伟, 陈子龙, 刘思美, 等. 乙酰化玉竹多糖的合成工艺优化[J]. 化学与生物工程,2022,39(7):21−25. [LÜ W, CHEN Z L, LIU S M, et al. Optimization of synthesis process of acetylated polysaccharide from Polygonatum odoratum (Mill.) druce[J]. Chemistry & Bioengineering,2022,39(7):21−25.] LÜ W, CHEN Z L, LIU S M, et al. Optimization of synthesis process of acetylated polysaccharide from Polygonatum odoratum (Mill.) druce[J]. Chemistry & Bioengineering, 2022, 39(7): 21−25.
[11] XIA S, ZHAI Y, WANG X, et al. Phosphorylation of polysaccharides:A review on the synthesis and bioactivities[J]. Int J Biol Macromol,2021,184:946−954. doi: 10.1016/j.ijbiomac.2021.06.149
[12] HUO N, AMEER K, WU Z, et al. Preparation, characterization, structural analysis and antioxidant activities of phosphorylated polysaccharide from Sanchi (Panax notoginseng) flower[J]. J Food Sci Technol,2022,59(12):4603−4614. doi: 10.1007/s13197-022-05539-5
[13] WANG J, WANG Y, XU L, et al. Synthesis and structural features of phosphorylated Artemisia sphaerocephala polysaccharide[J]. Carbohydr Polym,2018,181:19−26. doi: 10.1016/j.carbpol.2017.10.049
[14] LIN L, YANG J, YANG Y, et al. Phosphorylation of radix Cyathula officinalis polysaccharide improves its immune-enhancing activity[J]. Journal of Carbohydrate Chemistry,2020,39(1):50−62. doi: 10.1080/07328303.2019.1700996
[15] 胡晓波, 汪小明, 完颜红影, 等. 桑葚多糖的磷酸化修饰及其抗氧化活性研究[J]. 食品科技,2022,47(2):215−220. [HU X B, WANG X M, WANYAN H Y, et al. Phosphorylation modification and antioxidation activity of polysaccharides from mulberry[J]. Food Science and Technology,2022,47(2):215−220.] HU X B, WANG X M, WANYAN H Y, et al. Phosphorylation modification and antioxidation activity of polysaccharides from mulberry[J]. Food Science and Technology, 2022, 47(2): 215−220.
[16] CHEN F, HUANG G, YANG Z, et al. Antioxidant activity of Momordica charantia polysaccharide and its derivatives[J]. International Journal of Biological Macromolecules,2019,138:673−680. doi: 10.1016/j.ijbiomac.2019.07.129
[17] HU H, LI H, HAN M, et al. Chemical modification and antioxidant activity of the polysaccharide from Acanthopanax leucorrhizus[J]. Carbohydrate Research, 2020, 487:107890.
[18] XIE L M, SHEN M Y, WEN P W, et al. Preparation, characterization, antioxidant activity and protective effect against cellular oxidative stress of phosphorylated polysaccharide from Cyclocarya paliurus[J]. Food and Chemical Toxicology, 2020, 145:111754.
[19] HU S, SONG L, PAN H F, et al. Thermal properties and combustion behaviors of flame retarded epoxy acrylate with a chitosan based flame retardant containing phosphorus and acrylate structure[J]. Journal of Analytical and Applied Pyrolysis,2012,97:109−115. doi: 10.1016/j.jaap.2012.06.003
[20] 张雪红, 刘利娜, 林翠梧. 果胶的磷酸化修饰及其免疫活性研究[J]. 粮油食品科技,2017,25(3):65−69. [ZHANG X H, LIU L N, LIN C W. Study on phosphorylation modification and immunocompetence of pectin[J]. Science and Technology of Cereals, Oils and Foods,2017,25(3):65−69.] ZHANG X H, LIU L N, LIN C W. Study on phosphorylation modification and immunocompetence of pectin[J]. Science and Technology of Cereals, Oils and Foods, 2017, 25(3): 65−69.
[21] 任勤. 壳聚糖磷酸酯糖用澄清剂的制备及其应用工艺研究[D]. 南宁:广西大学, 2017. [REN Q. Study on preparation and application of clarifier for chitosan phosphate ester sugar[D]. Nanning:Guangxi University, 2017.] REN Q. Study on preparation and application of clarifier for chitosan phosphate ester sugar[D]. Nanning: Guangxi University, 2017.
[22] 张灿, 丁娅, 杨波, 等. N-亚甲基磷酸盐壳聚糖衍生物的设计、合成和表征[J]. 中国天然药物,2004(2):33−37. [ZHANG C, DING Y, YANG B, et al. Design, synthesis and characterization of N-methylenephosphate chitosan derivatives[J]. Chinese Journal of Natural Medicines,2004(2):33−37.] ZHANG C, DING Y, YANG B, et al. Design, synthesis and characterization of N-methylenephosphate chitosan derivatives[J]. Chinese Journal of Natural Medicines, 2004(2): 33−37.
[23] 曹维琴. 磷酸化糖类燃料电池的构建及性能研究[D]. 扬州:扬州大学, 2019. [CAO W Q. Construction and performance study of phosphorylated sugar fuel cells[D]. Yangzhou:Yangzhou University, 2019.] CAO W Q. Construction and performance study of phosphorylated sugar fuel cells[D]. Yangzhou: Yangzhou University, 2019.
[24] SUFLET DM, CHITANU GC, POPA VI. Phosphorylation of polysaccharides:New results on synthesis and characterization of phosphorylated cellulose[J]. React Funct Polym,2006,66(11):1240−1249. doi: 10.1016/j.reactfunctpolym.2006.03.006
[25] 辛灵莹. 乳酸乳球菌胞外多糖磷酸化及其生物活性研究[D]. 南京:南京师范大学, 2012. [XIN L Y. Study on phosphorylation and biological activity of extracellular polysaccharide from Lactococcus lactis[D]. Nanjing:Nanjing Normal University, 2012.] XIN L Y. Study on phosphorylation and biological activity of extracellular polysaccharide from Lactococcus lactis[D]. Nanjing: Nanjing Normal University, 2012.
[26] 季舒婷, 谢静茹, 赵培, 等. 松树蕈多糖磷酸化修饰工艺及其抗氧化活性[J]. 常熟理工学院学报,2018,32(5):106−114. [JI S T, XIE J R, ZHAO P, et al. Phosphorylation modification process and antioxidant activity of pine mushroom polysaccharide[J]. Journal of Changshu Institute of Technology,2018,32(5):106−114.] JI S T, XIE J R, ZHAO P, et al. Phosphorylation modification process and antioxidant activity of pine mushroom polysaccharide[J]. Journal of Changshu Institute of Technology, 2018, 32(5): 106−114.
[27] 张明均, 李坚斌, 朱静. 雪莲果低聚果糖磷酸化修饰研究[J]. 食品科技,2018,43(4):277−282. [ZHANG M J, LI J B, ZHU J. Study on phosphorylation modification of fructooligosaccharides from snow lotus fruit[J]. Food Science and Technology,2018, 43(4):277−282.
[28] CAO Y Y, JI Y H, LIAO A M, et al. Effects of sulfated, phosphorylated and carboxymethylated modifications on the antioxidant activities in-vitro of polysaccharides sequentially extracted from Amana edulis[J]. Int J Biol Macromol,2020,146:887−896. doi: 10.1016/j.ijbiomac.2019.09.211
[29] PENG Y, BAI X, XU H, et al. Phosphorylation, characterization, and antioxidant activity of polysaccharides from Flammulina Velutipes scraps[J]. American Journal of Biochemistry and Biotechnology,2022,18(3):279−288. doi: 10.3844/ajbbsp.2022.279.288
[30] 李益, 钱慈, 郭明, 梁东军. 香菇多糖磷酸化修饰的工艺研究[J]. 黑龙江大学自然科学学报,2013,30(5):664−670. [LI Y, QIAN C, GUO M, LIANG D J. Study on the technology of phosphorylation modification of lentinan[J]. Journal of Natural Science of Heilongjiang University,2013,30(5):664−670.] doi: 10.13482/j.issn1001-7011.2013.05.010 LI Y, QIAN C, GUO M, LIANG D J. Study on the technology of phosphorylation modification of lentinan[J]. Journal of Natural Science of Heilongjiang University, 2013, 30(5): 664−670. doi: 10.13482/j.issn1001-7011.2013.05.010





 下载:
下载:


 下载:
下载:



