Establishment and Application of Molecularly Imprinted Electrochemical Sensors for the Detection of Chloramphenicol Residues in Foods of Animal Origin
-
摘要: 实验将分子印迹技术与电化学工作站结合,利用多壁碳纳米管与金、铂纳米粒子对电极进行双敏化处理,用以增强玻碳电极表面电子转移速率,增强电化学传感器电流响应值,从而降低检测限。采用扫描电镜和电化学手段进行表征;通过吸附动力学试验与等温吸附试验对分子印迹修饰的电极进行研究,确定吸附性能,并对其选择性进行分析;以修饰后的电极检测实际样品鸡肉、鱼肉和牛奶中的氯霉素,分析其检测效果。结果表明,修饰后的电极表面具有杂乱的多壁碳纳米管状结构,从电化学循环伏安法(cyclic voltammetry,CV)、电化学阻抗谱(electrochemical impedance spectroscopy,EIS)可以清楚地看出电极的修饰效果,多壁碳纳米管与金、铂纳米粒子对电极表面电子传导速率的增强效果明显。分子印迹修饰对其结构类似物具有良好的选择性;传感器在氯霉素浓度为0.66~56.66 µg/L之间呈现出良好的线性关系,R2>0.99,检出限为0.45 nmol/L(0.146 µg/L)。在对实际样品鸡肉、鱼肉和牛奶的检测中,氯霉素的回收率分别为83.72%~103.43%,相对标准偏差(RSD)为2.61%~6.03%,该结果满足GB/T 27404-2008定量分析检测要求(被测组分<0.1 mg/kg,回收率范围为60%~120%),且试验方法具有极低的检测限。Abstract: A novel electrochemical sensor was fabricated for the rapid and sensitive detection of chloramphenicol (CAP). The experiments combined molecular imprinting technology with electrochemical workstation, using multi-walled carbon nanotubes (MWCNTs) and gold-platinum nanoparticles to double sensitize the electrode, which was used to enhance the electron transfer rate on the surface of the glassy carbon electrode (GCE) and enhance the current response value of the electrochemical sensor, thus reducing the detection limit. Characterization was carried out using scanning electron microscopy and electrochemical methods. Study the adsorption performance of molecularly imprinted modified electrodes through adsorption kinetics experiments and isothermal adsorption experiments, and analyze their selectivity. Detect chloramphenicol in actual samples of chicken, fish, and milk using modified electrodes and analyze their detection effectiveness. Results showed that, the modification effect of the electrode could be clearly seen from the cyclic voltammetry (CV) and electrochemical impedance spectroscopy (EIS), and the enhancement of the electron conduction rate on the electrode surface by MWCNTs and gold-platinum nanoparticles (Au-PtNPs) was obvious. The adsorption properties of the molecularly imprinted modified electrodes were studied by adsorption kinetic tests and isothermal adsorption tests to determine the adsorption properties and analyze their selectivity. The experiments showed good selectivity for its structural analogues, and the analyticity of the sensor was evaluated, and the sensor showed good linearity between CAP concentrations of 0.66 and 56.66 µg/L with R2>0.99 and a detection limit of 0.45 nmol/L (0.146 µg/L). The recoveries of CAP were 83.72%~103.43% with the relative standard deviations (RSDs) of 2.61%~6.03% in the assays of actual samples of chicken, fish and milk, respectively, which met the requirements of GB/T 27404-2008 for quantitative analysis and detection (the measured components were <0.1 mg/kg and the recoveries ranged from 60% to 120%). Compared with other literature methods, the test method has extremely low detection limits.
-
氯霉素类抗生素(chloramphenicols,CAP)是一类由委内瑞拉链霉菌中提取的广谱抗生素[1−2],因其对人体具有危害性,但现在仍被用于兽药和动物饲料中用于疾病的预防及治疗,对消费者的健康和食品安全产生影响[3−4]。当前开发的氯霉素检测方法用于氯霉素残留物在水生环境中的检测,使用色谱和电泳[5−6],但是检测手段前处理复杂,操作要求高,因此需要开发简单便捷的检测方法[7−8]。
分子印迹技术是当前最先进的识别技术,能够选择性检测特定物质[9−10]。电化学技术是一种灵敏的检测手段,具有方便快捷、操作要求低等优点[11],适合作为现场检测的手段[12−13],尤其是与分子印迹技术结合更能充分发挥出两者的高灵敏与特异性的特点[11,14]。为了进一步提高检测的灵敏度,多种材料修饰的电化学传感器被开发出来以增强电子传导速率[15−17],这些电极被无机、有机和聚合物材料修饰[18−20]。其中纳米材料修饰的电极由于其机械强度高、对光学性质有增强作用、比表面积大和导电性能高等特点,在传感器应用领域引起了人们的广泛兴趣[21−23]。在各种纳米材料中,多壁碳纳米管(multi-walled carbon nanotubes,MWCNTs)由于其特殊的结构和稳定的电子增强性能而被用作电极改性剂[24−26],有效地促进电极表面与介质之间的电子转移,MWCNTs有助于提高电极的灵敏度[27−28],例如Xu等[29]利用多巴胺在水中自聚合产生聚多巴胺的特性在多壁碳纳米管表面制备了以日落黄为模板分子的分子印迹聚合物(molecularly imprinted polymers,MIP)层,实现了对日落黄的灵敏检测,检测限为1.4 nmol/L。多壁碳纳米管的加入极大地降低了检出限,并展现出良好的稳定性。此外某些纳米粒子如金纳米粒子、铂纳米粒子、银纳米粒子等也是极好的电极增敏材料,根据报道,金、铂纳米粒子组合有极好的电化学性能[30−32],其不仅具有增强电子传导速率的作用,其中的金纳米粒子还具有很强的吸附特性,可以极大地增加传感器的灵敏度。赵丽娟[33]研制了一种分子印迹电化学传感器,用于测定双酚A。将金纳米粒子(gold nanoparticles,AuNPs)修饰到玻碳电极(glassy carbon electrode,GCE)表面,直接电聚合生成分子印迹聚合物(MIPs/AuNPs/GCE)。金纳米粒子能显著提高MIPs的电导率,检测限为1.1×10−9 mol/L,实现了灵敏检测。
本文利用分子印迹技术与电化学工作站结合,以多壁碳纳米管与金、铂纳米粒子对玻碳电极进行双敏化处理,在提高电流响应的基础上增加吸附能力,以邻苯二胺(o-phenylenediamine,o-PD)为功能单体与氯霉素分子通过电化学聚合形成分子印迹薄膜,提高传感器的灵敏性。通过扫描电镜与电化学方法对合成的材料进行表征。建立分子印迹电化学传感器检测方法,并应用到鸡肉、鱼肉和牛奶中氯霉素的残留检测,以期为氯霉素的检测方法提供参考。
1. 材料与方法
1.1 材料与仪器
氯霉素(CAP,98%)、磺胺甲基嗪(SMZ)、土霉素(OTC,≥98%)、噻霉素(TAP,99.5%)、阿莫西林(AMC)、氯金酸(HAuCl4)、纳米铂(3 nm,0.997 g/mL) 阿拉丁生化科技有限公司;多壁碳纳米管(MWCNTs) 青岛恒立德石墨有限公司;o-苯二胺(C6H8N2)、甲醇(CH3OH)、乙酸(CH3COOH)、乙腈(C2H3N)、乙酸钠(CH3COONa)、氯化钾(KCl)、乙醇(C2H5OH)、己亚硫酸钾(III)(K3[Fe(CN)6])、亚铁氰化钾(K4[Fe(CN)6]·3H2O)、硝酸(HNO3) 中国上海国药控股化学试剂有限公司;鸡、鱼、牛奶 市售。
CHI760E电化学工作站 上海辰华有限公司;S4800型扫描电子显微镜 日立公司;TU-1901型紫外分光光度计 北京普析通用仪器有限公司。
1.2 实验方法
1.2.1 玻碳电极预处理
直径为3 mm的玻碳电极依次用1.0,0.3,0.05 μm的氧化铝粉末按照粒径不同从大到小进行抛光处理,抛光处理至电极表面光滑无划痕,随后用去离子水超声清洗,之后再在体积比为1:1的硝酸水溶液、无水乙醇和超纯水中分别超声清洗,在氮气流下吹干。将干燥的电极置于5 mmol/L的铁氰化钾溶液中进行CV扫描,电位范围为−0.2~+0.8 V,扫描速度为50 mV/s,当氧化还原峰性稳定,并且氧化峰与还原峰之间的峰位差小于100 mV时,说明电极表面已经无杂质,将玻碳电极用二次蒸馏水清洗后吹干备用。
1.2.2 多壁碳纳米管的纯化
根据文献[34]进行多壁碳纳米管的纯化,利用硝酸与浓硫酸共同作用除去多壁碳纳米管中的杂质颗粒与催化剂。将多壁碳纳米管加入到装有硝酸和浓硫酸的圆底烧瓶中,混匀后100 ℃水浴加热,冷却后进行稀释洗涤至中性后得到纯化的多壁碳纳米管。
1.2.3 金纳米粒子的制备
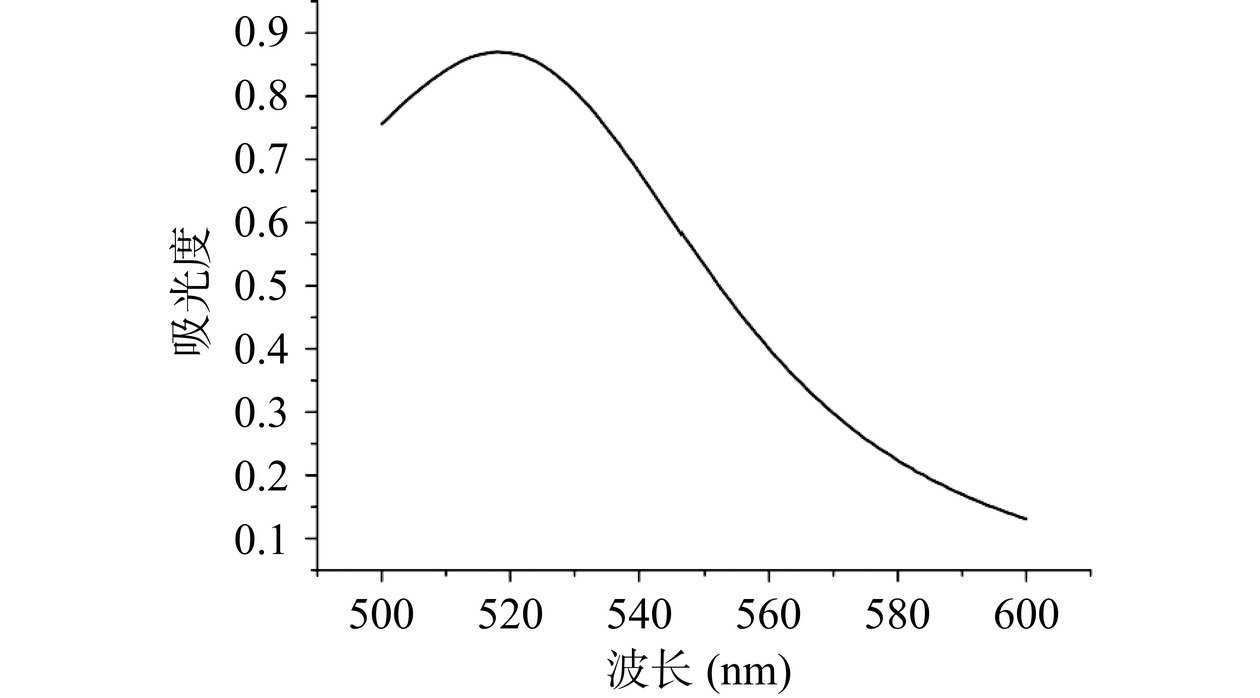
本实验所需的金纳米粒子需人工合成,利用经典的柠檬酸还原氯金酸法制备所需金纳米粒子。使用全新的锥形瓶进行合成,将锥形瓶中加入200 mL蒸馏水并在强磁力搅拌下煮沸2 min,清洗后倒掉沸水,取99 mL超纯水加入与1 mL 1%氯金酸溶液加入到清洗后的锥形瓶中保持磁力搅拌,加热至沸腾,保持煮沸、强磁力搅拌条件下迅速加入2 mL 1%柠檬酸三钠水溶液,待溶液颜色不再变化时撤去热源搅拌至室温,用超纯水定容至100 mL,4 ℃冰箱贮存。通过对合成的金纳米粒子进行紫外扫描,紫外吸收图如图1所示,通过紫外吸收峰对金纳米粒子粒径进行计算,得到其粒径为8 nm的金纳米粒子,浓度为0.24 mmol/L。
1.2.4 MWCNTs/GCE的制备
MWCNTs修饰玻碳电极(MWCNTs/GCE)的制备方法如下:用甲基丙烯酰胺将纯化的多壁碳纳米管进行溶解,超声30 min使其分散均匀,配制成3 mg/mL的多壁碳纳米管混合物。取该混合物10 μL滴涂在洁净玻碳电极表面,封闭条件、室温下干燥,备用。
1.2.5 Au/Pt/MWCNTs/GCE的制备
将金纳米粒子与铂纳米粒子按2:3混合后,超声30 min保证混合均匀,取10 μL金铂纳米粒子混合溶液滴涂到经多壁碳纳米管修饰的玻碳电极表面,封闭条件下置于40 ℃干燥箱中烘干,得到Au-Pt/MWCNTs/GCE。
1.2.6 印迹/非印迹修饰电极的制备
氯霉素分子印迹膜修饰的Au-Pt/MWCNTs/GCE的制备方法:实验采用电聚合的方法将分子印迹薄膜修饰到Au-Pt/MWCNTs/GCE表面,将Au-Pt/MWCNTs/GCE插入到事先通氮气除氧的含有5 mmol/L邻苯二胺和5 mmol/L氯霉素醋酸盐缓冲溶液(5 mmol/L,pH5.2)预聚合液中通过伏安循环进行电化学聚合。伏安循环电聚合参数为:聚合电位0~0.8 V,扫描速率50 mV/s,扫描圈数为15圈。分子印迹膜电聚合结束以后,将电极用超纯水清洗。模板分子的洗脱过程是将MIPs/Au-Pt/MWCNTs/GCE放入到甲醇:乙酸体积比9:1的洗脱液中磁力搅拌50 min,最终得到具有氯霉素印迹空穴的分子印迹聚合物。
同时,作为对照,制备非印迹聚合物(NIPs/Au-Pt/MWCNTs/GCE),其制备过程除预聚合液中不含氯霉素外其余条件与MIPs/Au-Pt/MWCNTs/GCE制备完全相同。
1.2.7 修饰电极和检测条件的确定
为了让电化学传感器具有更加有效准确地检测效果,本实验从多壁碳纳米管的修饰量、金、铂纳米粒子的比例、聚合液中邻苯二胺(功能单体)与氯霉素(模板分子)的比例、电聚合圈数、不同洗脱液的洗脱效果、最佳洗脱液的洗脱时间和洗脱后检测的吸附时间进行实验条件的确定。利用修饰后电流响应值与修饰前电流响应值之比评价修饰效果。利用方波伏安法对多壁碳纳米管的修饰量进行表征。
1.2.8 电极表征
本实验通过扫描电镜与电化学手段对实验电极进行表征,用以验证电极的修饰效果。在已优化好的条件下对电极表面进行修饰,利用扫描电镜对电极表面形貌进行表征,可以清楚地展现各修饰手段对电极表面的作用效果,证明各修饰手段对电极表面形貌进行的改变。此外,通过电化学手段对各阶段电极进行表征,清楚地展示不同修饰手段对电极表面的电化学特性造成的改变。
1.2.8.1 扫描电镜表征
利用优化好的条件在电极表面进行修饰,随后进行喷金处理,将喷金后的裸电极、多壁碳纳米管修饰的电极、金、铂修饰的电极和分子印迹修饰的电极进行扫描电镜表征,通过扫描电镜图比较不同手段修饰后电极表面。
1.2.8.2 电化学手段表征
对不同修饰阶段的电极利用循环伏安法进行表征,通过循环伏安曲线对电极表面电化学性能进行研究,验证修饰手段产生的电化学性能的改变。此外,通过电化学阻抗谱对电极表面电荷转移电阻情况进行表征,与伏安循环图相印证证实修饰效果。
1.2.9 分子印迹电化学传感器性能评价
1.2.9.1 氯霉素分子印迹电化学检测方法的建立
本实验采用SWV对不同浓度氯霉素进行测定,建立了氯霉素测定方法。
方波伏安曲线测定(SWV):将条件优化至最佳,经过10 min完成不同浓度吸附作用的工作电极放入5 mmol/L [Fe(CN)6]3−/4−溶液中进行测定。SWV测定参数:扫描电压:−0.3~0.7 V,扫描速度:25 mV/s。
1.2.9.2 电化学传感器的实际检测效果
为验证所构建的分子印迹电化学传感器对于痕量残留氯霉素的检测效果及实际检测能力,市购鱼肉、鸡肉和牛奶作为实际检测的样品,并分别进行加标回收实验。将提取后的实际添加样在修饰好的工作电极上孵育11 min后插入到含5 mmol/L [Fe(CN)6]3−/4−溶液中进行测定。将测定的实验结果进行线性回归分析,对电化学传感器性能进行评价。方波伏安法测定参数:扫描电压:−0.3~0.7 V,扫描速度:25 mV/s。
1.2.9.3 电化学传感器的选择性、稳定性评价
本实验分别通过单标实验和对混标实验对所建立方法的选择性进行测定。另外将吸附了10 μg/L的电极进行连续7次扫描,以评价传感器的稳定性。
1.3 数据处理
本研究所采用的数据均以原始数据为基础,使用2010版Excel对数据进行统计分析,数据均表示为平均值,通过标准偏差、相对标准偏差以及相关系数对数据进行分析评估,并在Origin 2019软件中作图。
2. 结果与分析
2.1 电化学修饰条件的确定
2.1.1 多壁碳纳米管(MWCNTs)修饰量的确定
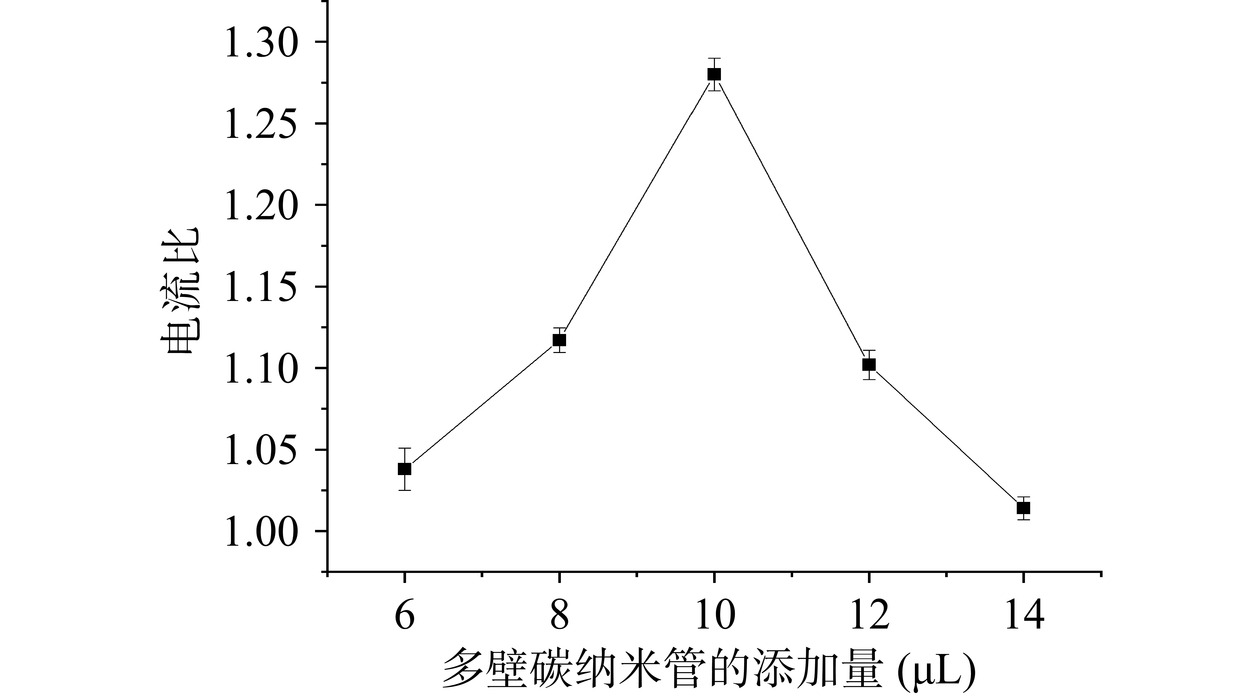
利用修饰后电流响应值与修饰前电流响应值之比评价修饰效果。利用方波伏安法对多壁碳纳米管的修饰量进行表征。由图2可以看出,随着多壁碳纳米管的添加量不断增加,电流响应值不断增大,当修饰量为10 μL时,电流达到最大值,随后再增加修饰量,电流响应减小。造成这种现象的原因是随着多壁碳纳米管添加量的增加,对电极表面电子转移速率的增强效果逐渐变大[35],当修饰量超过10 μL时,过量的多壁碳纳米管在电极表面积聚,多壁碳纳米管层变厚,从而阻碍了电子传导速率,最终使得电流值减小[29]。所以多壁碳纳米管的最佳修饰量为10 μL。
2.1.2 金、铂纳米粒子比例及修饰量的确定
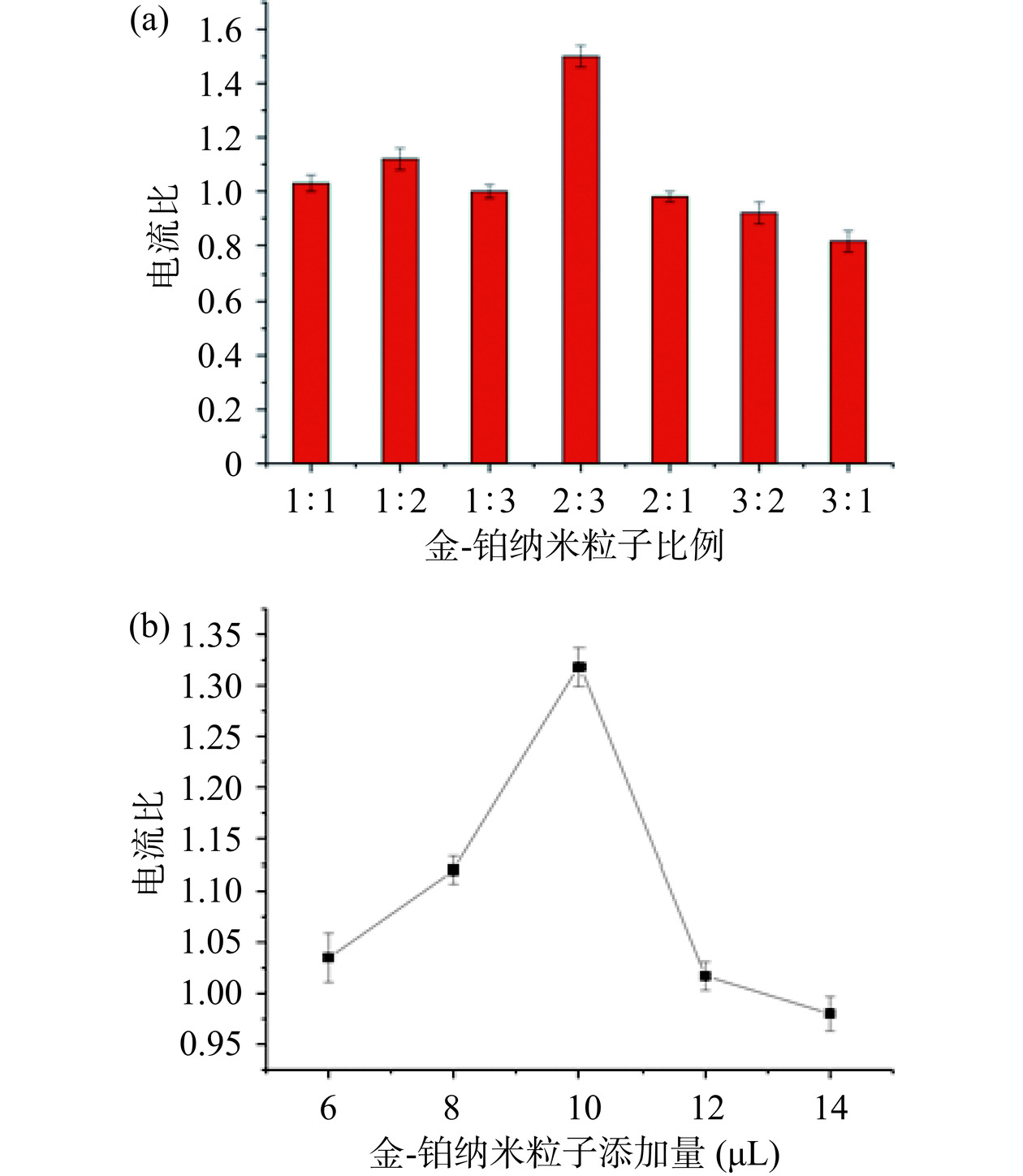
由图3(a)可以看出,在不同比例的金、铂纳米粒子组合中,金纳米粒子与铂纳米粒子比例为2:3时对电极的电流增强效果最强。因此,金、铂比例为2:3为最佳比例。此外,金、铂纳米粒子的修饰量也对后续修饰过程产生重要影响。由图3(b)可知,随着金、铂纳米粒子修饰量的不断增加,电极表面电流响应不断增加,当修饰量为10 μL时电流响应达到最大值,随后继续增加修饰量,电流响应值不再增加甚至减小,随着修饰量的增加,金、铂纳米粒子对电极表面电子转移速率的增强效果越来越明显,当超过10 μL时,增强效果逐渐减弱,这是因为添加的金、铂纳米粒子干燥后在电极表面堆积,阻碍了电子转移速率[36]。因此,金、铂纳米粒子修饰量最佳为10 μL。
2.1.3 模板分子与功能单体比例
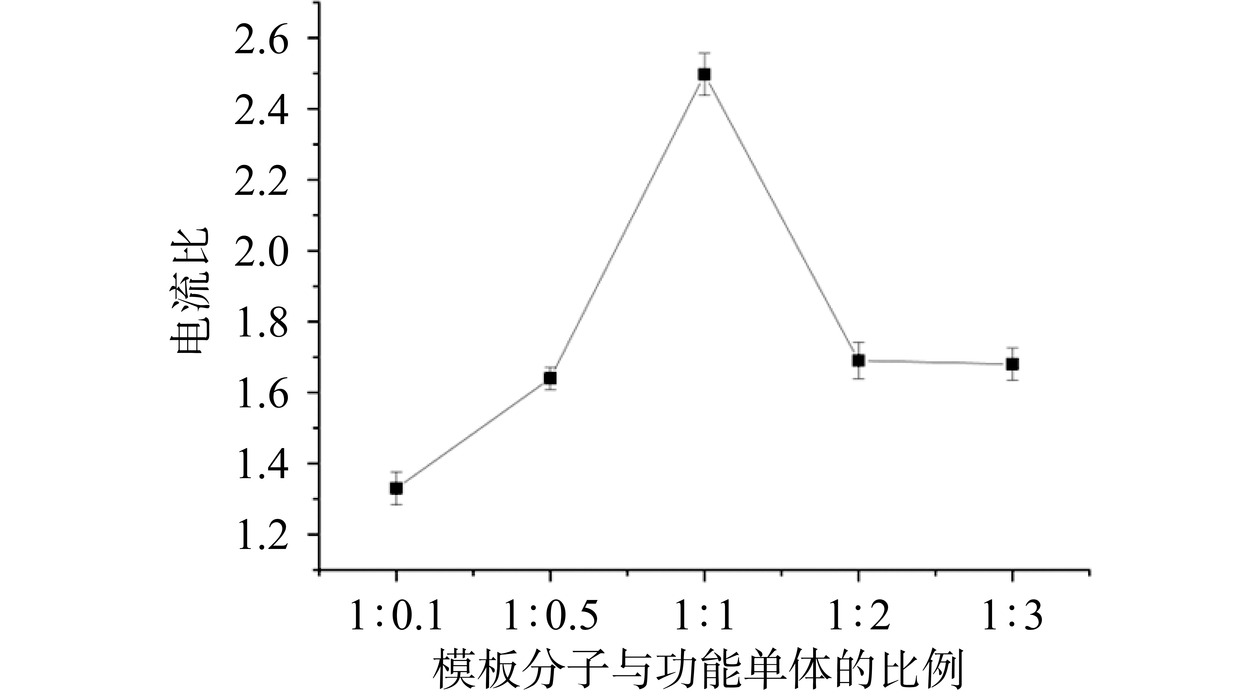
在分子印迹聚合物的制备过程中,功能单体与模板分子比例的确定是最重要的一步,合适的功能单体与模板分子比例能够使印迹薄膜获得足够多的印迹位点,并且使印迹膜保持良好的印迹效果,因此本实验选择了不同比例的功能单体与模板分子进行比较,固定模板分子氯霉素的浓度为5 mmol/L,在模板分子与功能单体比例为1:0.1,1:0.5,1:1,1:2,1:3行试验,探究不同聚合液比例修饰的分子印迹电化学传感器电流响应信号的变化,实验结果显示随着功能单体邻苯二胺浓度不断增加,修饰后的电极电流响应不断降低。在此,本实验采用洗脱后电流响应值与聚合后电流响应值的比值进行表征。实验结果如图4所示,可以看出,当功能单体比例不断增加,电流比不断增加,当模板分子与功能单体比例为1:1时,电流比最大,此后随着功能单体邻苯二胺不断增加,电流比开始下降。造成这种现象的原因是随着功能单体不断增加,越来越多的邻苯二胺聚合到电极表面,阻碍了氯霉素结合,聚合后对电极表面包覆效果逐渐增强,阻碍了电子传导速率,所以电流信号不断下降。对于电流比值的现象,原因是初始阶段功能单体结合的模板分子数量有限,洗脱后电流变化不大,随着功能单体邻苯二胺的增加,结合的模板分子氯霉素不断增加,洗脱后电流变化变大,此后继续增加邻苯二胺的量,形成分子印迹聚合物中聚邻苯二胺的比例增多,阻碍了与氯霉素的结合,所以洗脱后电流响应增加量有限,这也导致了电流比下降[37]。总体而言,当邻苯二胺与氯霉素比例为1:1时,洗脱前后电流变化量较大,因此模板分子与功能单体的最佳比例为1:1。
2.1.4 电聚合圈数的确定
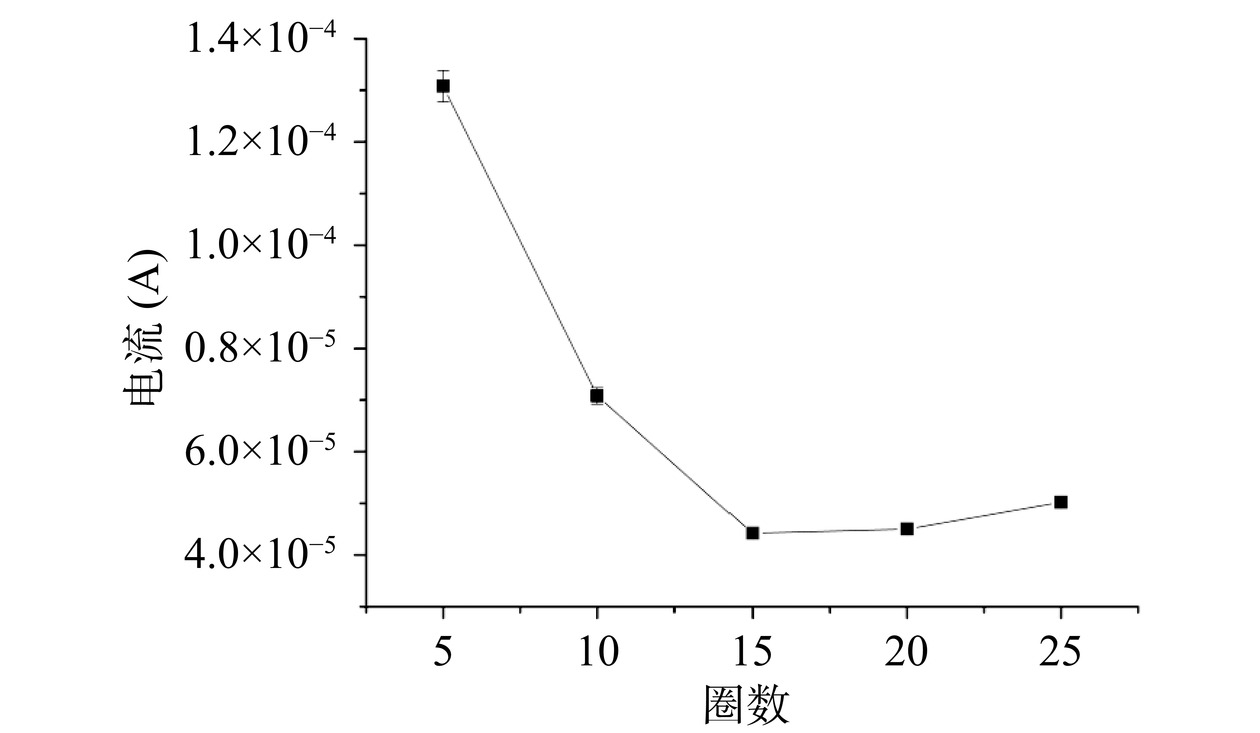
电聚合圈数影响着分子印迹膜的形成,聚合圈数不足导致分子印迹膜无法完全修饰电极,印迹空穴太少,聚合圈数过多会使印迹层变厚,影响后续实验洗脱难度,也会影响电化学传感器电流信号的稳定性[38]。
如图5所示,随着电聚合圈数的增加,电流响应逐渐减弱,说明分子印迹膜对电极表面的修饰逐渐完善,当电聚合圈数为15圈时,电流响应将至最低,说明分子印迹膜对电极的包覆最完整,此后随着电聚合圈数的增加,电流几乎不变或略有上升,这是因为对电极表面的包覆已经完整,随着聚合圈数增加,分子印迹膜厚度增加,使电极表面印迹层不稳定脱落引起的。因此,电化学圈数最佳为15圈。
2.1.5 洗脱液的确定
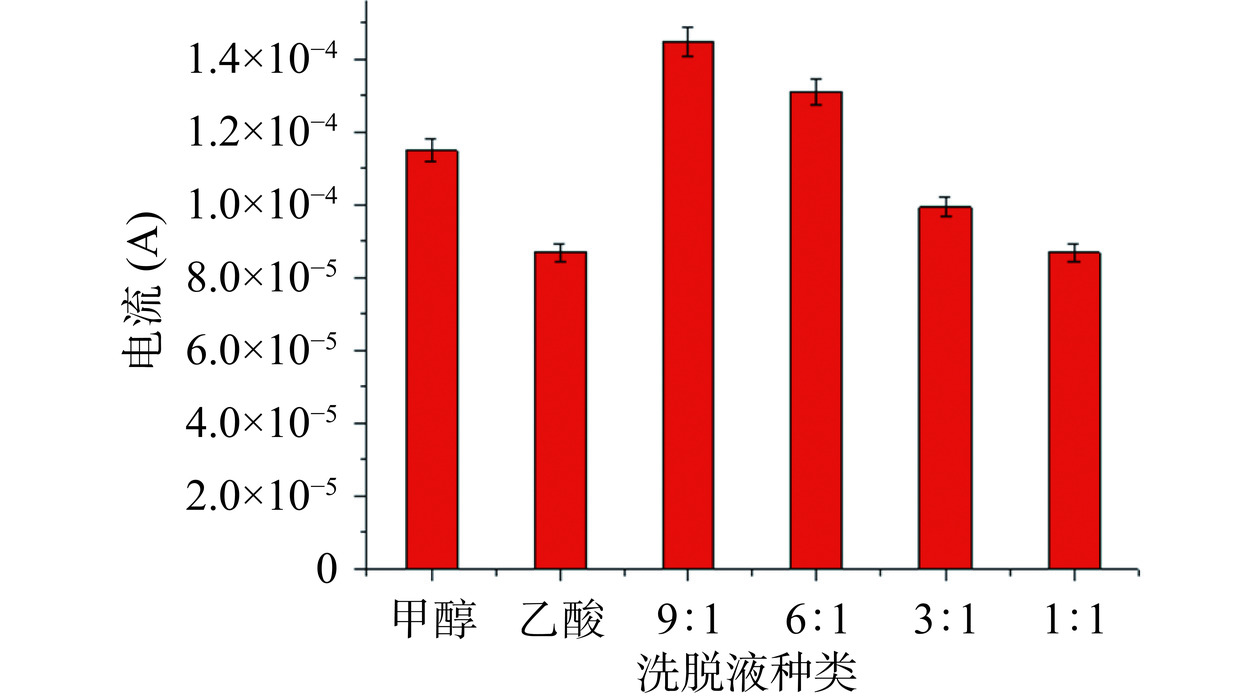
电极表面修饰分子印迹层后需要对模板分子进行洗脱,因此洗脱液的选择尤为重要,合适的洗脱液不仅能够有效地将模板分子去除,而且还能保证印迹空穴的完整性,这是保证分子印迹技术特异性识别的关键一步。为了合理的选择最佳洗脱液,本实验对不同洗脱液的洗脱效果进行比较,实验结果如图6。从图6中可以看出各类洗脱液均对印迹电极有一定的作用,甲醇对于印迹电极的洗脱作用较弱,而乙酸对于印迹电极的洗脱作用过强,导致印迹膜被洗掉,使得乙酸洗脱后的电流响应与裸电极电流响应相似。随后将甲醇与乙酸进行不同比例混合检验洗脱效果。通过实验得知,以甲醇/乙酸(9:1)作为洗脱液时,能够有效地去除印迹薄膜中的模板分子,使印迹分子层暴露出更多的印迹位点,最终结果是洗脱前后传感器的电流响应变化值最大。因此,选择甲醇/乙酸(9:1)作为洗脱液进行后续实验。
2.1.6 洗脱时间的确定
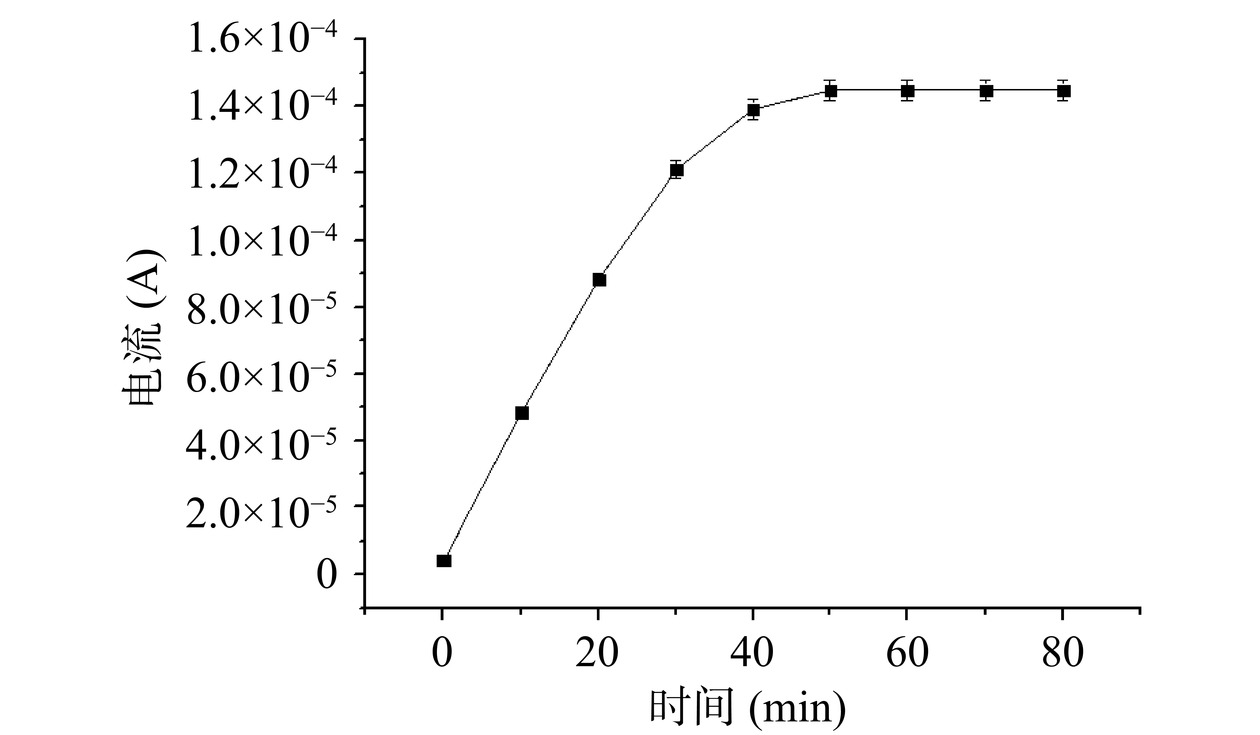
通过实验对洗脱时间进行了优化。确定合适的洗脱时间能够在保证洗脱完全的基础上最大程度的节约时间,提高检测效率。从图7中可以看出,随着洗脱时间的增加,传感器电流响应信号不断增强,50 min后电流强度达到最高且随着洗脱时间的增加电流强度不再增加,说明模板分子氯霉素已经被完全洗脱下来。因此,选择50 min为最佳的洗脱时间。洗脱过程的结束也可从洗脱液中氯霉素紫外吸收峰不再增加中得到印证。
2.1.7 印记聚合物吸附吸附时间及吸附浓度的确定
吸附实验包括吸附动力学实验和等温吸附实验,合适的吸附时间的确定同样能够提高实验的效率和准确性。
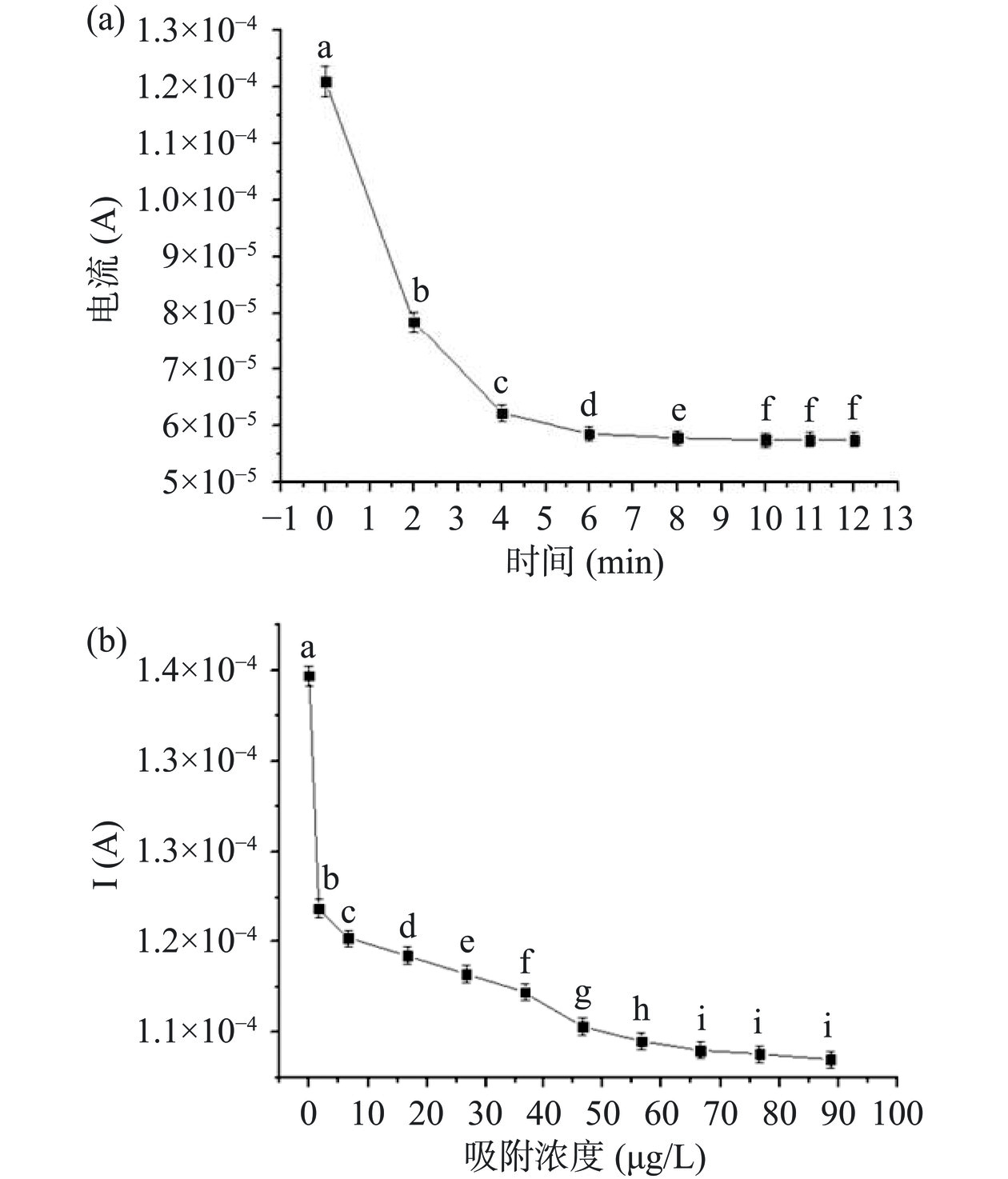
印迹聚合物洗脱后吸附试验结果如图8(a)所示,将200 μg/L的氯霉素标准溶液在电极表面孵育进行吸附,图8(a)中表示了吸附时间与电流强度变化关系图,随着吸附时间的增加,电流信号逐渐降低,下降速率逐渐的变缓,当吸附时间为10 min时,电流信号到达最低值,随后继续增加吸附时间电流信号几乎不变,表明到达了吸附平衡。因此,后续实验采用10 min为氯霉素的吸附时间。造成这种现象的原因是吸附初期,印迹位点数量多,吸附速度快,随着吸附过程的进行,越来越多的印迹位点被占据,由于空间位阻的存在导致后续吸附进程速度下降,最后到达吸附平衡[39]。
等温吸附试验是表征电极最大吸附能力的实验,通过对洗脱后的印迹聚合物不断增加吸附浓度得到结果如图8(b)所示,随着吸附浓度的增加,电流信号不断下降,下降速率呈现先快后慢的特点,当浓度在60 μg/L之前呈现规律下降,超过60 μg/L后仍然下降,但变化不大。
2.2 修饰电极表征
2.2.1 不同修饰阶段电极扫描电镜图
本实验采用扫描电镜(SEM)来表征GCE与MWCNTs/GCE、Au-PtNPs/MWCNTs/GCE、MIPs/Au-PtNPs/MWCNTs/GCE不同修饰阶段电极的形貌特点。
如图9为不同修饰阶段电极表面扫描电镜图。图9(a)为裸玻碳电极表面形貌扫描电镜图,从图9(a)中可以看出电极表面平整光滑,无杂质;图9(b)为纯化后多壁碳纳米管修饰的玻碳电极表面扫描电镜图,可以看出电极表面附着有明显的管状结构,该结构的存在增加了电极表面的比表面积;图9(c)为金、铂纳米粒子修饰的电极,由扫描电镜图可以看出纳米粒子已经分布在多壁碳纳米管及其周围;图9(d)为印迹修饰后的电极表面,与金、铂修饰后的扫描电镜图相比,印迹修饰后的扫描电镜图中可以看出明显的隔层状,且看不到多壁碳纳米管结构,说明分子印迹薄膜已经聚合到电极表面,完成对电极的包覆。
2.2.2 不同修饰阶段电极的电化学性能表征
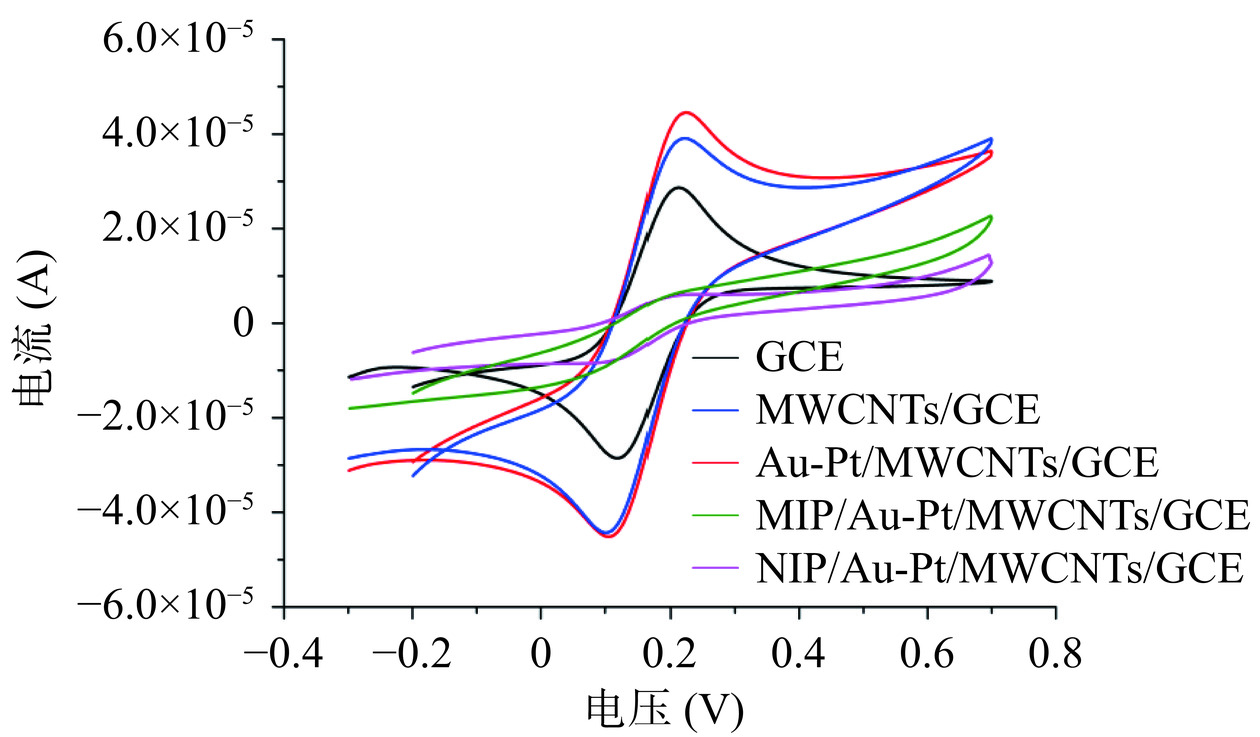
伏安循环是一种用来表征电极性能的常用方式,能明显的看出电子传导性能,本实验对裸玻碳电极(GCE)、纯化后多壁碳纳米管修饰的电极(MWCNTs/GCE)、金、铂纳米粒子修饰的电极(Au-PtNPs/MWCNTs/GCE)、印迹修饰电极(MIPs/Au-PtNPs/MWCNTs/GCE)、非印迹修饰电极(NIPs/Au-PtNPs/MWCNTs/GCE)进行CV表征。
在电解液中得出的CV曲线如图10所示。从循环伏安曲线中可以看出,裸玻碳电极具有两个明显的铁氰化钾氧化还原峰,当经过纯化的多壁碳纳米管修饰到电极表面后,从其CV曲线可以看出,铁氰化钾的氧化还原峰电流信号得到明显增强,电流响应是裸GCE电流的1.85倍,从曲线中可以看出,裸玻碳电极具有两个明显的氧化还原峰,当经过纯化的多壁碳纳米管修饰到电极表面后,氧化还原峰电流信号得到明显增强,电流响应是裸GCE电流的1.85倍。这是因为多壁碳纳米管具有良好的电化学性能,可以极大地提高电子转移速率。其次,管状结构具有很高的化学稳定性、纵横比、生物相容性,增加了电极表面的面积。随着金、铂纳米粒子修饰到电极表面,铁氰化钾的氧化还原峰电流再次增强,与裸玻碳电极电流相比,电流增加了2.3倍,电流的增加是因为金、铂纳米粒子的修饰,金、铂纳米粒子本身具有极高的电导率,修饰后提高了电极表面的电子传导速率,增加了电极表面的比表面积,与多壁碳纳米管协同作用,使得电化学传感器的电流响信号应进一步增强。随后在电极表面进行电化学聚合分子印迹层,通过CV法进行电化学聚合后,电流响应如图10所示,可以看出聚合分子印迹层后的电流响应明显降低,这是因为通过电化学聚合,功能单体邻苯二胺与模板分子氯霉素在电极表面形成了不导电的分子印迹聚合物薄膜,薄膜的存在阻碍了电极表面的电子传递,因此电化学聚合后的电流响应降低[40]。与印迹聚合物相比,非印迹聚合物电流响应更低,这是因为聚合液中不含模板分子氯霉素,通过电化学聚合,邻苯二胺直接在电极表面形成致密的膜,所以形成的膜与电极可以更加紧密的结合,对电子传导的阻碍作用也更加明显。由伏安循环曲线图可以得知将复合材料成功修饰到电极表面,并获得明显效果。
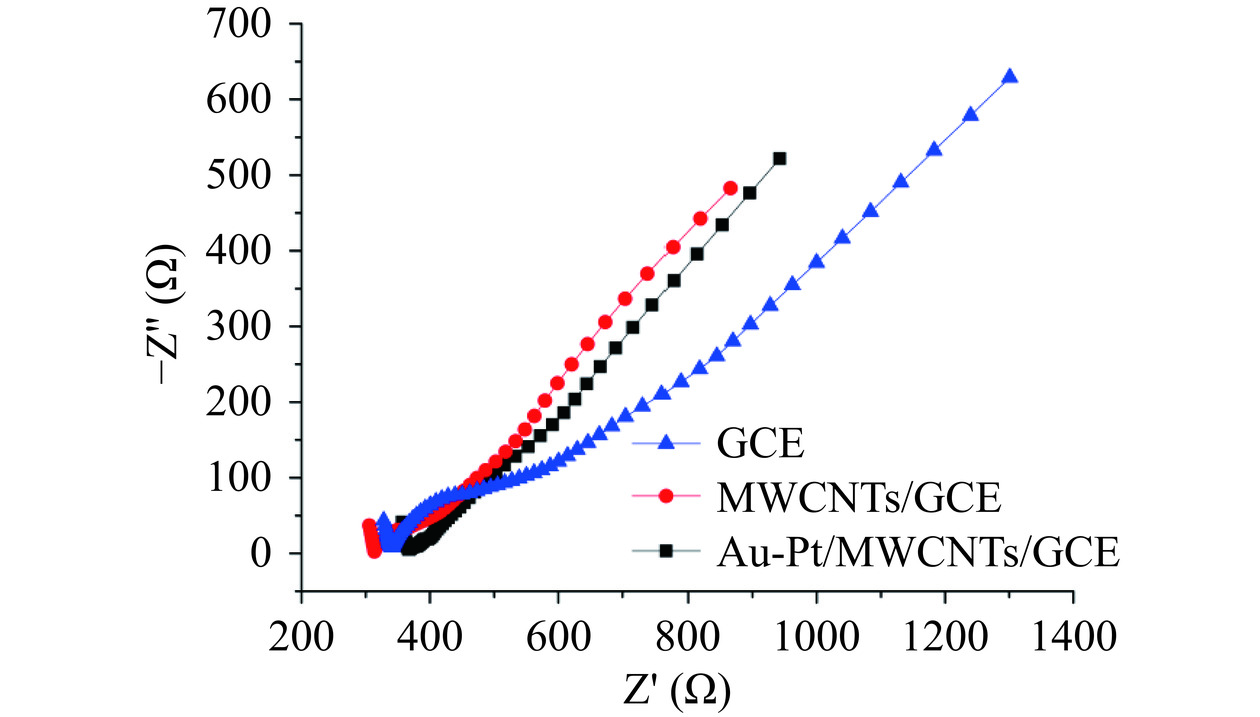
电化学阻抗谱是对电极性能进行表征的有效手段。为了表征对电极修饰不同过程产生的变化,将不同修饰阶段的电极(GCE、MWCNTs/GCE、Au-PtNPs/MWCNTs/GCE)插入到5 mmol/L的铁氰化钾探针溶液中进行EIS表征。根据已发表的文献报道可知,EIS图半圆直径大小与电极的电荷转移电阻Rct呈现正相关,即EIS图中半圆直径越大,表明电荷转移电阻越大,图11分别为GCE、MWCNTs/GCE、Au-PtNPs/MWCNTs/GCE的EIS图,从图11中可以看出,裸GCE电极的EIS曲线具有一个明显的半圆区域,说明裸电极表面具有一定的电荷转移电阻;当多壁碳纳米管修饰以后,EIS图显示半圆减小,说明电极表面电荷转移电阻减小,再次印证了多壁碳纳米管对电极表面电子转移的增强作用;当金、铂纳米粒子修饰到MWCNTs/GCE电极表面时,EIS曲线显示几乎没有半圆存在,说明电极的电荷转移电阻变的极小,这也进一步证明了金、铂纳米粒子优秀的电化学性能,可以增强电极表面电流响应。
2.3 印迹和非印迹电化学传感器性能表征
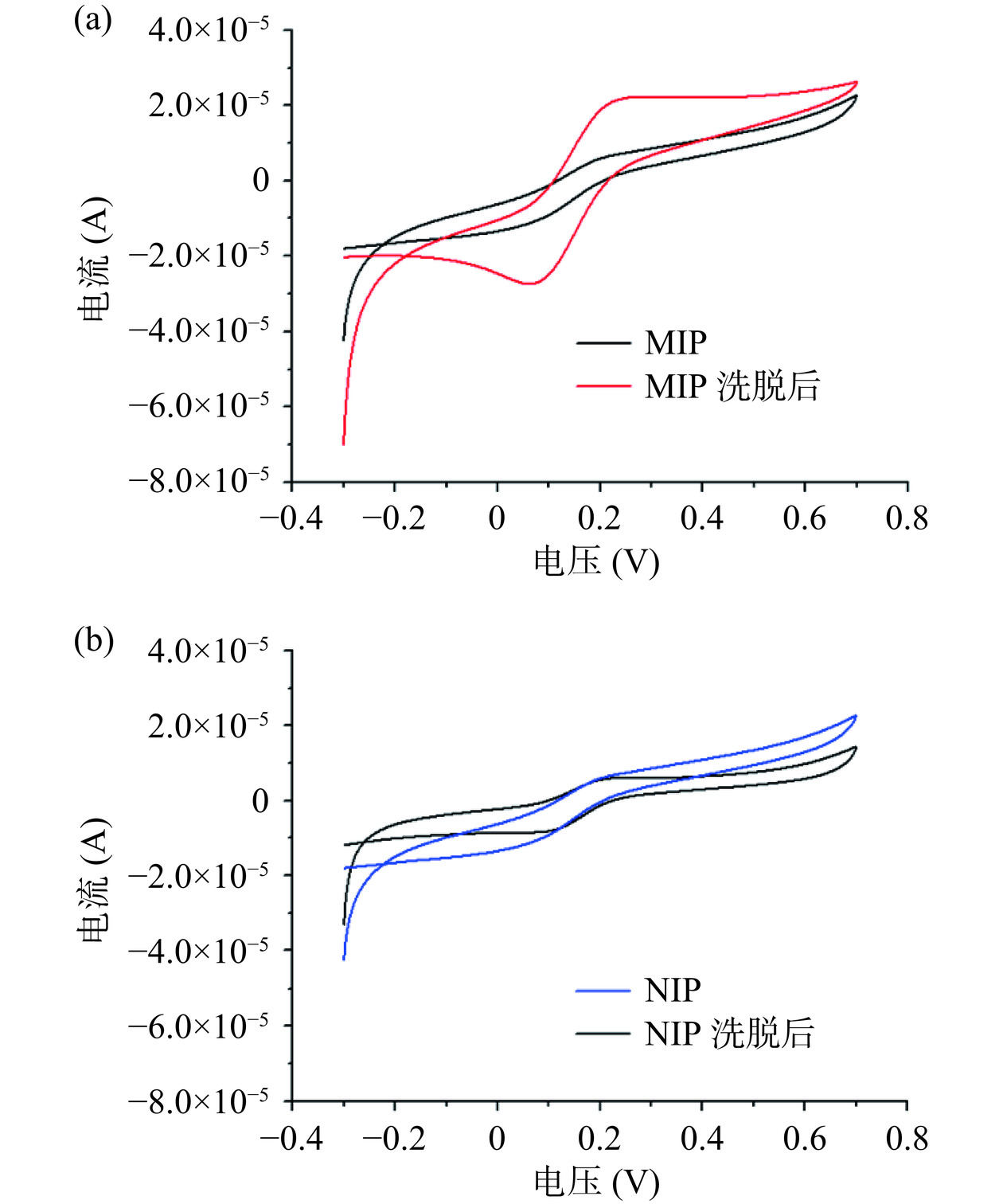
为了评价印迹和非印迹电化学传感的性能,因此在实验中对印迹电极(MIPs/Au-PtNPs/MWCNTs/GCE)和非印迹电极(NIPs/Au-PtNPs/MWCNTs/GCE)洗脱前后CV曲线进行测量。
如图12所示,从印迹、非印迹洗脱前后两CV曲线中可以看出,图12(a)中印迹聚合物修饰的电极(MIPs/Au-PtNPs/MWCNTs/GCE)洗脱前几乎没有铁氰化钾的氧化还原峰,这是因为不导电的分子印迹聚合物已经实现了对Au-PtNPs/MWCNTs/GCE电极表面的包覆;当氯霉素模板分子从印迹聚合物中洗脱后,传感器电流出现明显变化,这说明洗脱过后,模板分子被除去,暴露出印迹位点,铁氰化钾探针可以通过暴露的印迹位点到达电极表面从而重新产生比较强的电流响应信号。图12(b)为非印迹修饰电极在铁氰化钾溶液中的CV曲线,可以看出NIPs/Au-PtNPs/MWCNTs/GCE洗脱前后的CV曲线差别不大,这是由于聚合过程不存在模板分子氯霉素,所以形成了更加致密的邻苯二胺膜,致密的邻苯二胺膜更加有效地隔绝了铁氰化钾与电极的接触,使其没有铁氰化钾的氧化还原电流,从洗脱后NIPs/Au-PtNPs/MWCNTs/GCE的CV曲线可以看出,经过洗脱液洗脱后,CV曲线变化不明显,因为印迹膜中不含模板分子,洗脱后电极表面不会产生或产生极少的空穴,电极表面主要还是致密的不导电物质邻苯二胺薄膜,所以铁氰化钾几乎不能到达电极表面,导致传感器表产生的电流响应十分微小。结合图12的实验结果可以看出,模板分子氯霉素通过电化学聚合成功的印迹到电极表面并且能够通过洗脱液完成洗脱。
2.4 分子印迹电化学传感器性能评价
2.4.1 氯霉素分子印迹电化学检测方法的建立
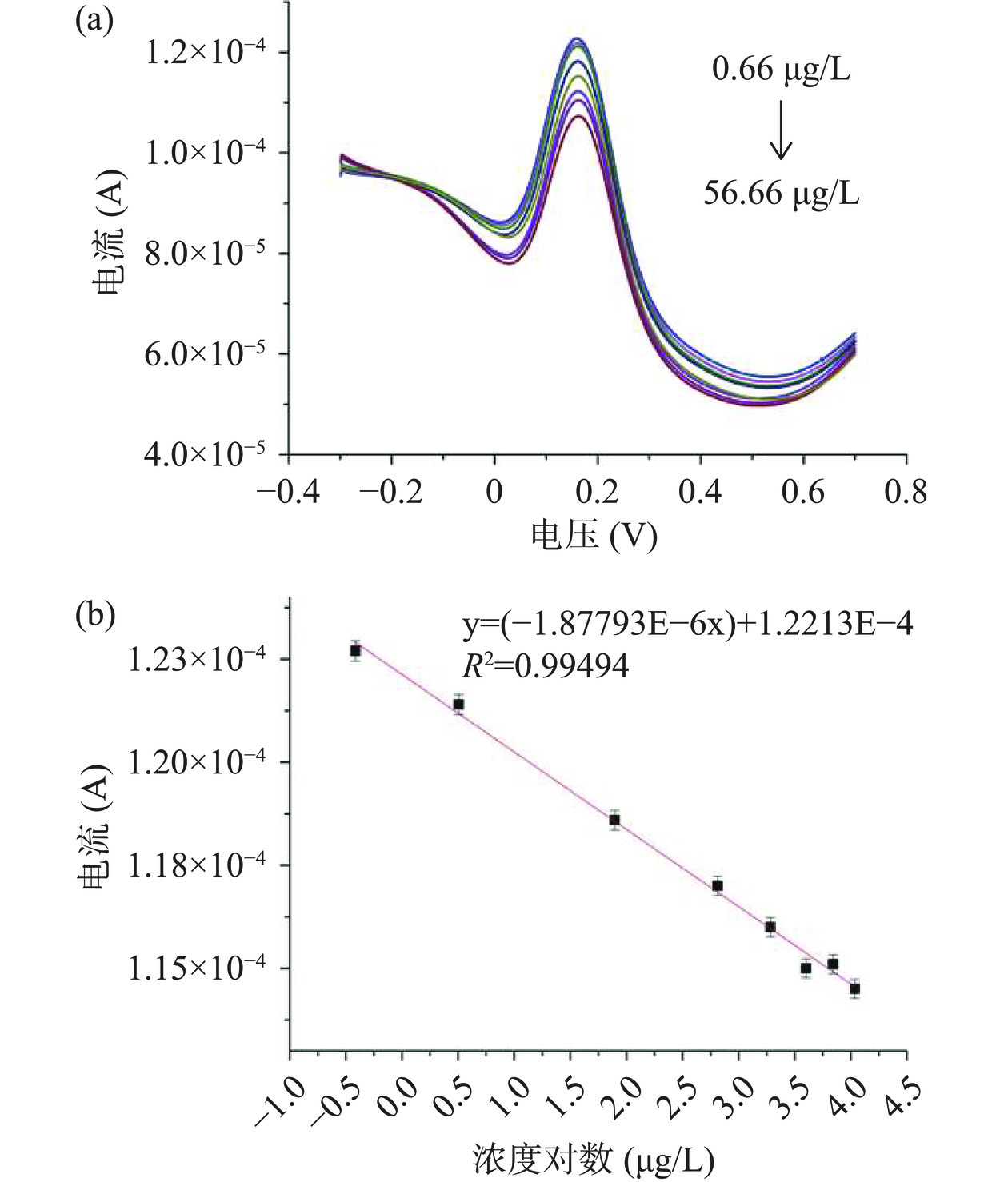
本实验采用方波伏安法(square wave voltammetry,SWV)对不同浓度氯霉素进行测定,将先前优化的条件应用于实验条件,验证氯霉素对研制的传感器电流的影响,建立了氯霉素测定方法。如图13(a)所示为电化学传感器在0.66~56.66 μg/L浓度条件下的SWV响应曲线。实验所得的SWV曲线具有明显的电流响应和良好的还原峰。如图13(b)所示,不同浓度氯霉素引起的还原峰电流响应值与氯霉素浓度的对数成反比,符合能斯特方程。通过计算公式得到该传感器对氯霉素的检出限为0.146 μg/L(S/N=3),通过数据显示出构建的分子印迹电化学传感器可以灵敏的检验氯霉素。
利用方波伏安法对非印迹传感器性能进行分析,如图14所示为非印迹传感器电极在不同浓度下的SWV图。从图14中可以看出,随着氯霉素浓度增加,传感器电流响应并没有如印迹传感器一样呈现规律性,这表明非印迹传感器对氯霉素并没有吸附作用,由此可以看出印迹效果的成功。
2.4.2 电化学传感器的实际检测效果
对方法的可行性进行进一步验证,实验选取鸡肉、鱼肉和牛奶三种实际样品的3个浓度(1、5、10 μg/L)水平进行加标实验,通过加标回收率评价检测方法效果,通过内标法进行测定结果计算见表1,氯霉素回收率在80.21%~103.43%之间,标准差范围在2.61%~6.03%(N=3)之间,该结果满足检测要求。与其他文献方法(表2)比较,试验方法具有极低的检测限。
表 1 三种浓度CAP的加标回收率及精密度(n=3)Table 1. Standard recovery and precision SMZ three concentrations (n=3)样品 加标量(μg/L) 回收率(%) RSD(%) 鸡肉 1 83.72 4.36 5 92.32 3.28 10 98.31 6.03 鱼肉 1 103.43 3.23 5 87.71 3.72 10 92.72 5.38 牛奶 1 86.19 5.03 5 93.21 4.77 10 100.33 2.61 2.4.3 电化学传感器的选择性评价
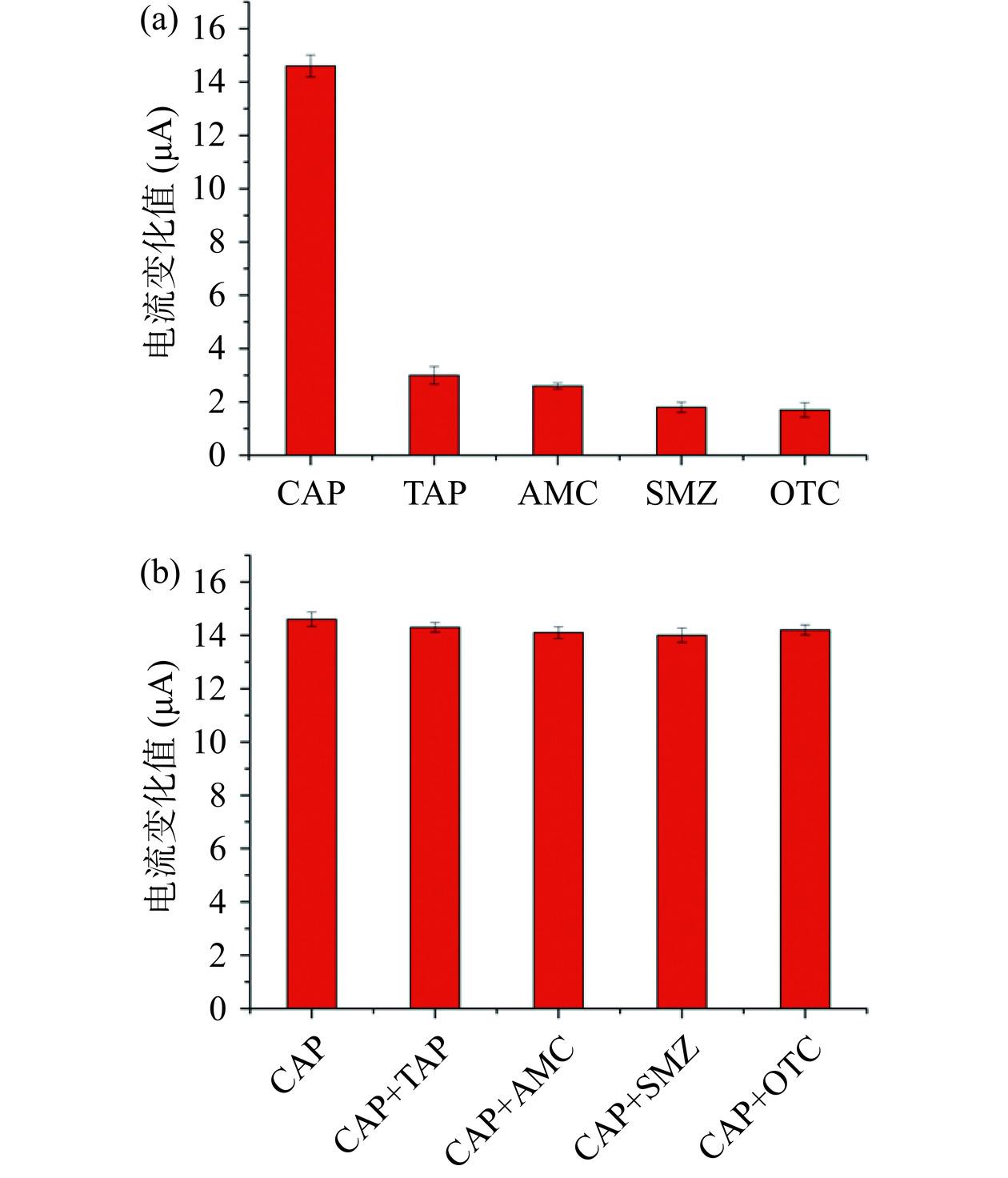
传感器的选择性是评价传感器性能的重要依据,因此本实验选择两种氯霉素的结构类似物甲砜霉素、羟氨苄青霉素和两种其他种类的抗生素磺胺二甲基嘧啶和土霉素进行验证。
单标实验:将10 μg/L的各种标准溶液在制备好的电极表面孵育,随后进行电化学检测,测得结果如图图15(a)所示,由图15(a)可知,在各种抗生素中,该印迹电化学传感器对氯霉素的电流响应变化值最高,而其余测试结果显示电流变化较小,造成这种现象的原因是在电极表面洗脱后得到的印迹空穴与氯霉素结构一致,当氯霉素进入印迹空穴后形成了完整的薄膜层,阻碍了氧化还原探针与电极表面接触,所以电流变化明显,而TAP、AMC、SMZ、OTC电流变化小是因为印迹空穴与这些药物结构不匹配,导致空穴仍然暴露,铁氰化钾溶液能够比较轻易地与电极表面接触,导致电流响应变化不大。然而氯霉素结构类似物也有一定的电流响应,原因是结构类似于氯霉素,能与印迹空穴有一定结合但结合不紧密,导致电流响应有一定的变化。
混标实验:将氯霉素分别与其它类药物进行混合,随后在印迹电极表面完成孵育后再进行电化学检测,实验结果如图15(b)所示。由图15(b)可知,当混合物进行检测时,电流响应产生变化,变化范围不超过10%,这表明该印迹电极具有较好的抗干扰能力。
2.4.4 电化学传感器的稳定性评价
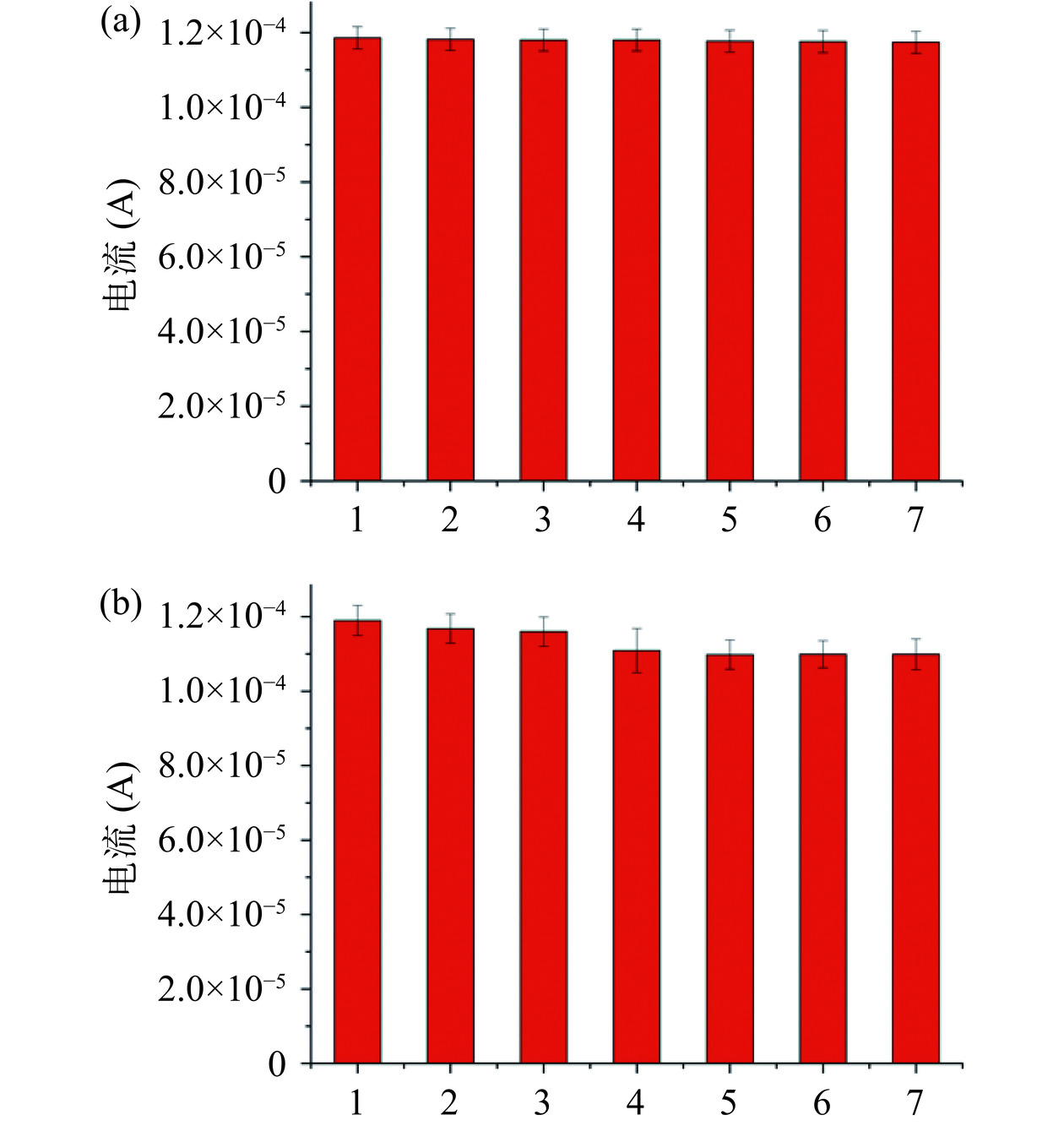
传感器的检测稳定性是检测的重要依据,为了评价传感器的稳定性,将吸附了10 μg/L的电极进行连续7次扫描,测量的实验结果如图16(a)所示,可以看出,电流变化比较小(RSD为1.01%),这表明印迹电极具有良好的稳定性。
将在10 μg/L吸附结束后的电极重新洗脱,再次吸附进行测量。重复上述操作连续测量7次,实验结果如图16(b)所示,洗脱后重新测量的电流响应有略微下降,在第三次重复洗脱后、吸附再次测量显示几乎无变化,这表明所制备的分子印迹电化学传感器具有良好的稳定性和可重复利用性,峰值电流的RSD为4.07%。
3. 结论
本实验采用多壁碳纳米管与贵重金属纳米粒子耦合对电极进行双敏化处理,多壁碳纳米管的引入可增大电极的活性面积,使电极表面形成规则的形貌、大的比表面积和良好的稳定性,随后利用金、铂纳米粒子电化学性能,能够使生物分子更好的进行固定并保持其生物活性,两者共同促进玻碳电极表面的电子传导速率,极大地提高了电流信号和修饰层的稳定性,以邻苯二胺为功能单体形成了对氯霉素选择性识别的印迹薄膜,从而实现对氯霉素的特异性检测。同时,形成的分子印迹薄膜状结构有利于模板分子的洗脱,此外薄膜结构具有使洗脱后的印迹位点暴露完全的优点,大大提高检测效率。所开发的电化学传感器具有很低的检测限和高灵敏度,稳定性和特异性好,适用于食品基质中氯霉素的快速测量,在食品安全方面具有较高的潜在应用价值。
-
表 1 三种浓度CAP的加标回收率及精密度(n=3)
Table 1 Standard recovery and precision SMZ three concentrations (n=3)
样品 加标量(μg/L) 回收率(%) RSD(%) 鸡肉 1 83.72 4.36 5 92.32 3.28 10 98.31 6.03 鱼肉 1 103.43 3.23 5 87.71 3.72 10 92.72 5.38 牛奶 1 86.19 5.03 5 93.21 4.77 10 100.33 2.61 -
[1] GAILLARD T, MADAMET M, TSOMBENG F F, et al. Antibiotics in malaria therapy:Which antibiotics except tetracyclines and macrolides may be used against malaria[J]. Malaria Journal,2016,15(1):34−37. doi: 10.1186/s12936-016-1086-z
[2] MASIÁ A, SUAREZ-VARELA M M, LLOPIS-GONZALEZ A, et al. Determination of pesticides and veterinary drug residues in food by liquid chromatography-mass spectrometry:A review[J]. Analytica Chimica Acta,2016,936:40−61. doi: 10.1016/j.aca.2016.07.023
[3] AZHAR M R, ABID H R, SUN H, et al. Excellent performance of copper based metal organic framework in adsorptive removal of toxic sulfonamide antibiotics from wastewater[J]. Journal of Colloid and Interface Science,2016,478:344−352. doi: 10.1016/j.jcis.2016.06.032
[4] WANG B, LIU J H, YU J, et al. Broad spectrum detection of veterinary drugs with a highly stable metal-organic framework[J]. J Hazard Mater,2020,382:121018. doi: 10.1016/j.jhazmat.2019.121018
[5] WU D, DU D, LIN Y. Recent progress on nanomaterial-based biosensors for veterinary drug residues in animal-derived food[J]. TrAC Trends in Analytical Chemistry,2016,83:95−101. doi: 10.1016/j.trac.2016.08.006
[6] CHEN H, CHEN H, YING J, et al. Dispersive liquid–liquid microextraction followed by high-performance liquid chromatography as an efficient and sensitive technique for simultaneous determination of chloramphenicol and thiamphenicol in honey[J]. Analytica Chimica Acta,2009,632(1):80−85. doi: 10.1016/j.aca.2008.10.068
[7] ZAREI K, GHORBANI M. Fabrication of a new ultrasensitive AuNPs-MIC-based sensor for electrochemical determination of streptomycin[J]. Electrochimica Acta,2019,299:330−338. doi: 10.1016/j.electacta.2019.01.016
[8] KIKUCHI H, SAKAI T, TESHIMA R, et al. Total determination of chloramphenicol residues in foods by liquid chromatography-tandem mass spectrometry[J]. Food Chemistry,2017,230:589−593. doi: 10.1016/j.foodchem.2017.03.071
[9] EKOMO V M, BRANGER C, BIKANGA R, et al. Detection of bisphenol a in aqueous medium by screen printed carbon electrodes incorporating electrochemical molecularly imprinted polymers[J]. Biosensors and Bioelectronics,2018,112:156−161. doi: 10.1016/j.bios.2018.04.022
[10] CARDOSO A R, TAVARES A P M, SALES M G F. In-situ generated molecularly imprinted material for chloramphenicol electrochemical sensing in waters down to the nanomolar level[J]. Sensors and Actuators B:Chemical,2018,256:420−428. doi: 10.1016/j.snb.2017.10.114
[11] HUANG Q, ZHAO Z, NIE D, et al. Molecularly imprinted poly(thionine)-based electrochemical sensing platform for fast and selective ultratrace determination of patulin[J]. Analytical Chemistry,2019,91(6):4116−4123. doi: 10.1021/acs.analchem.8b05791
[12] WANG A. Culture-independent rapid detection methods for bacterial pathogens and toxins in food[J]. Comp Rev Food Sci Food Safe,2015,43:53−71.
[13] GUO Y, GIRMATSION M, LI H W, et al. Rapid and ultrasensitive detection of food contaminants using surface-enhanced Raman spectroscopy-based methods[J]. Crit Rev Food Sci Nutr,2021,61(21):3555−3568. doi: 10.1080/10408398.2020.1803197
[14] YU W, TANG Y, SANG Y, et al. Preparation of a carboxylated single-walled carbon-nanotube-chitosan functional layer and its application to a molecularly imprinted electrochemical sensor to quantify semicarbazide[J]. Food Chemistry,2020,333:127524. doi: 10.1016/j.foodchem.2020.127524
[15] ZHANG L, LIU Z, XIONG C, et al. Selective recognition of Histidine enantiomers using novel molecularly imprinted organic transistor sensor[J]. Organic Electronics,2018,61:254−260. doi: 10.1016/j.orgel.2018.05.063
[16] WANG J, YUE X, WANG P, et al. Electrochemical technologies for lithium recovery from liquid resources:A review[J]. Renewable and Sustainable Energy Reviews,2022,154:111813. doi: 10.1016/j.rser.2021.111813
[17] GIMKIEWICZ C, HEGNER R, GUTENSOHN M F, et al. Study of electrochemical reduction of CO2 for future use in secondary microbial electrochemical technologies[J]. Chem Sus Chem,2017,10(5):958−967. doi: 10.1002/cssc.201601675
[18] FENG S, LI Y, ZHANG R, et al. A novel electrochemical sensor based on molecularly imprinted polymer modified hollow N, S-Mo2C/C spheres for highly sensitive and selective carbendazim determination[J]. Biosensors and Bioelectronics,2019,142:111491. doi: 10.1016/j.bios.2019.111491
[19] ZHANG Y, LIU Z, WANG Y, et al. Directly assembled electrochemical sensor by combining self-supported CoN nanoarray platform grown on carbon cloth with molecularly imprinted polymers for the detection of Tylosin[J]. Journal of Hazardous Materials,2020,398:122778. doi: 10.1016/j.jhazmat.2020.122778
[20] AYANKOJO A G, REUT J, CIOCAN V, et al. Molecularly imprinted polymer-based sensor for electrochemical detection of erythromycin[J]. Talanta,2020,209:120502. doi: 10.1016/j.talanta.2019.120502
[21] REZAEI B, BOROUJENI M K, ENSAFI A A. Development of Sudan II sensor based on modified treated pencil graphite electrode with DNA, o-phenylenediamine, and gold nanoparticle bioimprinted polymer[J]. Sensors and Actuators B:Chemical,2016,222:849−856. doi: 10.1016/j.snb.2015.09.017
[22] YAN Z, GAN N, LI T, et al. A sensitive electrochemical aptasensor for multiplex antibiotics detection based on high-capacity magnetic hollow porous nanotracers coupling exonuclease-assisted cascade target recycling[J]. Biosensors and Bioelectronics,2016,78:51−57. doi: 10.1016/j.bios.2015.11.019
[23] GU J, DAI H, KONG Y, et al. Chiral electrochemical recognition of cysteine enantiomers with molecularly imprinted overoxidized polypyrrole-Au nanoparticles[J]. Synthetic Metals,2016,222:137−143. doi: 10.1016/j.synthmet.2016.05.007
[24] CHEN X, ZHANG S, SHAN X, et al. Derivative chiral copper(Ⅱ) complexes as template of an electrochemical molecular imprinting sol-gel sensor for enantiorecognition of aspartic acid[J]. Analytica Chimica Acta,2019,1072:54−60. doi: 10.1016/j.aca.2019.04.039
[25] ZHANG L, WANG G, WU D, et al. Highly selective and sensitive sensor based on an organic electrochemical transistor for the detection of ascorbic acid[J]. Biosensors and Bioelectronics,2018,100:235−241. doi: 10.1016/j.bios.2017.09.006
[26] IDIL N, HEDSTRÖM M, DENIZLI A, et al. Whole cell based microcontact imprinted capacitive biosensor for the detection of Escherichia coli[J]. Biosensors and Bioelectronics,2017,87:807−815. doi: 10.1016/j.bios.2016.08.096
[27] YÁÑEZ-SEDEÑO P, GONZÁLEZ-CORTÉS A, CAMPUZANO S, et al. Multimodal/multifunctional nanomaterials in (bio) electrochemistry:Now and in the coming decade[J]. Nanomaterials,2020,10(12):2556. doi: 10.3390/nano10122556
[28] SUN N, WU H, SHEN X, et al. Nanomaterials in proteomics[J]. Advanced Functional Materials,2019,29(26):1900253. doi: 10.1002/adfm.201900253
[29] XU S, LIN G, ZHAO W, et al. Necklace-like molecularly imprinted nanohybrids based on polymeric nanoparticles decorated multiwalled carbon nanotubes for highly sensitive and selective melamine detection[J]. ACS Applied Materials & Interfaces,2018,10(29):24850−24859.
[30] LEE J M, KIM Y B, PARK J W. Pulse electrochemical meso/micro/nano ultraprecision machining technology[J]. Journal of Nanoscience and Nanotechnology,2013,13(11):7741−7744. doi: 10.1166/jnn.2013.7716
[31] PARK J, HWANG J C, KIM G G, et al. Flexible electronics based on one‐dimensional and two‐dimensional hybrid nanomaterials[J]. InfoMat,2019,2(1):33−56.
[32] ADHIKARI B, GOVINDHAN M, CHEN A. Carbon nanomaterials based electrochemical sensors/biosensors for the sensitive detection of pharmaceutical and biological compounds[J]. Sensors,2015,15(9):22490−22508. doi: 10.3390/s150922490
[33] 赵丽娟. 基于分子印迹聚合物膜的电化学传感器的制备与应用[D]. 武汉:武汉大学, 2015. [ZHAO L J. Fabrication and application electrochemical sensors based onmolecularly imprinted polymer films[D]. Wuhan:Wuhan University, 2015.] ZHAO L J. Fabrication and application electrochemical sensors based onmolecularly imprinted polymer films[D]. Wuhan: Wuhan University, 2015.
[34] 黄玉霞. 食品中四环素类抗生素残留高选择性吸附材料的制备与应用[D]. 济南:齐鲁工业大学, 2019. [HUANG Y X. Preparation and application of highlyselective adsorbent for tetracycline antibiotics residues in food[D]. Jinan:Qilu University of Technology, 2019.] HUANG Y X. Preparation and application of highlyselective adsorbent for tetracycline antibiotics residues in food[D]. Jinan: Qilu University of Technology, 2019.
[35] AI J, GUO H, XUE R, et al. A self-probing, gate-controlled, molecularly imprinted electrochemical sensor for ultrasensitive determination of p-nonylphenol[J]. Electrochemistry Communications,2018,89:1−5. doi: 10.1016/j.elecom.2018.02.008
[36] CHI H, CUI X, LU Y, et al. Colorimetric determination of cysteine based on Au@Pt nanoparticles as oxidase mimetics with enhanced selectivity[J]. Microchimica Acta,2022,189(1):66.
[37] FATHIMA R, MUJEEB A. Enhanced nonlinear and thermo optical properties of laser synthesized surfactant-free Au-Pt bimetallic nanoparticles[J]. Journal of Molecular Liquids,2021,343:117711. doi: 10.1016/j.molliq.2021.117711
[38] LIU B, HE P, KONG H, et al. Peptide-induced synthesis of graphene-supported Au/Pt bimetallic nanoparticles for electrochemical biosensor application[J]. Macromolecular Materials and Engineering,2022,307(5):2100886. doi: 10.1002/mame.202100886
[39] LIU C, HUANG J, WANG L. Electrochemical synthesis of a nanocomposite consisting of carboxy-modified multi-walled carbon nanotubes, polythionine and platinum nanoparticles for simultaneous voltammetric determination of myricetin and rutin[J]. Microchimica Acta,2018,185(9):540.
[40] RAO H, ZHAO X, LIU X, et al. A novel molecularly imprinted electrochemical sensor based on graphene quantum dots coated on hollow nickel nanospheres with high sensitivity and selectivity for the rapid determination of bisphenol S[J]. Biosensors and Bioelectronics,2018,100:341−347. doi: 10.1016/j.bios.2017.09.016
[41] LIU S, LAI G, ZHANG H, et al. Amperometric aptasensing of chloramphenicol at a glassy carbon electrode modified with a nanocomposite consisting of graphene and silver nanoparticles[J]. Microchimica Acta,2017,184(5):1445−1451. doi: 10.1007/s00604-017-2138-y
[42] CAO L, ZHANG Q, DAI H, et al. Separation/concentration-signal-amplification in-one method based on electrochemical conversion of magnetic nanoparticles for electrochemical biosensing[J]. Electroanalysis,2018,30(3):517−524. doi: 10.1002/elan.201700653
[43] CHEN H, WANG J, MENG L, et al. Thin-layered MoS2/polyaniline nanocomposite for highly sensitive electrochemical detection of chloramphenicol[J]. Chinese Chemical Letters,2016,27(2):231−234. doi: 10.1016/j.cclet.2015.09.018
-
期刊类型引用(2)
1. 张黎梅,汪云飞,陈艳,董天秋,马文思,陈娴. HPLC-DAD法测定养生茶中的双氯芬酸钠. 食品与发酵科技. 2025(01): 169-172 .  百度学术
百度学术
2. 李肖斐. 超高效液相色谱-串联质谱法测定酵素梅中12种酚汀(酚丁)、酚酞及其酯类衍生物或类似物. 食品安全导刊. 2025(07): 105-109 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:


 下载:
下载:



