Effect of Ozone Micro-Nano-Bubbles Treatment on “Green” and the Mechanism in Soybean Sprout
-
摘要: 为研究臭氧微纳米气泡(ozone micro-nano-bubbles,Ozone MNBs)处理黄豆芽对LED白光照射下黄豆芽“绿化”的影响及其调控机制,本实验以黄豆芽为材料,采用4 mg/L Ozone MNBs处理黄豆芽,测定LED白光照射下黄豆芽生理品质,叶绿素合成和分解相关酶及物质变化。结果表明:与蒸馏水处理对照组相比,4 mg/L Ozone MNBs处理可以显著降低LED白光照射下黄豆芽的“绿化”现象,诱导提高黄豆芽中叶绿素降解酶[叶绿素酶(Chlase)、叶绿素降解过氧化物酶(Chl-POX)、脱镁螯合酶(MD)和脱镁叶绿素酶(PPH)]活性,降低了叶绿素合成前体物[δ-氨基乙酰丙酸(ALA)和尿卟啉原Ⅲ(Urogen Ⅲ)],叶绿素、叶绿素a(Chl a)和叶绿素b(Chl b)含量。降低了ADP、ATP和辅酶Ⅱ[NADP+和NADPH]含量。4 mg/L Ozone MNBs处理可影响黄豆芽叶绿素合成和分解相关酶的活性和相关物质的含量,对抑制LED白光照射下黄豆芽“绿化”有较好的效果。Abstract: In order to explore the effect of ozone micro-nano-bubbles (Ozone MNBs) on “green” and the regulative mechanism in soybean sprout, this study took soybean sprout as the experimental material, treated with 4 mg/L Ozone MNBs and stored in white LED condition. Physical quality, synthesizing and decomposing of chlorophyll (enzyme activity and substance) were measured in soybean sprout. Compared with control group, 4 mg/L Ozone MNBs treatment could significantly inhibit the “green”, enhance the activities of chlorophyllase (Chlase), chlorophyll degrading peroxidase (Chl-POX), Mg-dechelatase (MD) and pheophytinase (PPH). And it decreased the levels of precursors in chlorophyll synthesis [δ-aminolevulinic acid (ALA) and Urogen Ⅲ], chlorophyll, chlorophyll a and chlorophyll b. Additionally, it declined the content of ADP, ATP, NADP+ and NADPH in soybean sprout. Thus, 4 mg/L Ozone MNBs treatment affected the substance and enzyme activity of synthesizing and decomposing of chlorophyll, effectively hindered “green” in soybean sprout under white LED.
-
Keywords:
- soybean sprout /
- Ozone MNBs /
- white LED /
- synthesizing of chlorophyll /
- mechanism
-
黄豆中含有丰富的营养物质,例如:蛋白质、脂肪、碳水化合物以及一些矿物质等营养元素。在发芽过程中,会增加一些维生素类物质的产生,并且蛋白质的利用率大大提高,此外,一些棉籽糖、鼠李糖等不利于人体吸收利用的物质也得到分解,以上变化对人体是极有利的,避免了吃黄豆后人体产生胀气现象[1]。但黄豆芽在售卖过程中无法保持持续避光,极易发生光合作用出现“绿化”现象,会影响消费者的购买欲,对黄豆芽产业发展有不利影响。其中光照是导致黄豆芽“绿化”最直接的因素,故抑制“绿化”是提高黄豆芽商品价值的重要条件。Ozone MNBs是近年来一项新兴的保鲜技术,已有研究发现,臭氧具有抑制植物光合作用发生的功能,而将Ozone MNBs技术应用在抑制黄豆芽“绿化”上的报道较少。
微纳米气泡由微米和纳米气泡组成,直径小于50 µm,具有较强的溶水能力,并且在水中具有稳定性[2]。臭氧是一种强氧化剂,具有杀菌作用,目前已广泛应用在果蔬采后保鲜方面[3−4]。但是臭氧在水中具有不稳定、易分解的特性[5],通过与微纳米气泡结合可增加臭氧在水中的溶解量和保持其浓度恒定的作用[6−7],很好地解决了臭氧在水中不稳定易分解的弊端。研究发现Ozone MNBs在果蔬保鲜方面有一定的应用,王雪青等[8]采用4 mg/L Ozone MNBs处理菠菜,发现处理组能够提高菠菜的抗氧化能力,减缓菠菜营养物质损耗,提高了菠菜的耐贮性。运用1.8 mg/L Ozone MNBs处理番茄苗,显示两种空气传播病原菌分生孢子受到明显的抑制,说明Ozone MNBs在番茄空气传播病害防治中的应用是可行的[7]。对板栗进行多种水洗处理时,与自来水冲洗相比,Ozone MNBs处理显著降低了采后板栗的腐烂率和相关微生物群落(好氧细菌、霉菌/丝状真菌和酵母)生长,提高了板栗的贮藏品质[9]。然而,Ozone MNBs处理对芽菜类的研究尚少。
本实验以黄豆芽为材料,在20 ℃下,用LED白光照射,探究4 mg/L Ozone MNBs处理对黄豆芽叶绿素降解酶,叶绿素合成前体物,叶绿素含量,ADP、ATP和辅酶Ⅱ含量等指标的影响,以期为延长黄豆芽货架期提供理论参考。
1. 材料与方法
1.1 材料与仪器
黄豆芽 购买于北京市超市发连锁有限公司,挑选当日新鲜折损率较小的袋装黄豆芽,20 min内运回实验室,进行实验;丙酮、无水乙醇、石油醚、甲醇、二胺四乙酸(EDTA)、磷酸二氢钠、磷酸氢二钠 天津市科密欧化学试剂有限公司;酚酞指示剂、NaOH、KCl、NaCl 西陇科学股份有限公司;HCL、Triton X-100、Tris 北京化学试剂有限公司;叶绿素a 美国Sigma公司;Tricine 翌圣生物科技(上海)股份有限公司;噻唑蓝溴化四唑(MTT)、葡萄糖-6-磷酸、吩嗪乙硫酸盐(PES)、4-香豆酸 上海阿拉丁生化科技股份有限公司;ATP、ADP 上海源叶生物科技有限公司; 5-氨基乙酰丙酸、胆色素原、尿卟啉原III、1,5-二磷酸羧化酶/加氧酶试剂盒 上海酶联生物科技有限公司;以上试剂均为分析纯。
3S-T臭氧发生器、3S-J5000臭氧检测仪 北京同林科技有限公司;MF-5000微纳米气泡发生装置 上海行恒科技有限公司;UV-1800紫外分光光度计 日本岛津公司;IKA M20研磨机 德国艾卡仪器设备有限公司;D-37520离心机 北京诚茂兴业科技发展有限公司;XMTD-6000型数显恒温水浴锅 余姚金电仪表有限公司;Varioskan LUX多功能酶标仪 赛默飞世尔科技(中国)有限公司;KQ-50TDB超声波清洗机 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 Ozone MNBs处理
本实验以黄豆芽为材料,以0.5~5 mg/L浓度的Ozone MNBs对其进行预实验筛选适宜浓度,多次重复实验证明4 mg/L处理对抑制黄豆芽“绿化”效果最佳。随后在臭氧检测仪监测下将臭氧浓度调至4 mg/L,随后接入微纳米气泡发生器,用产生的4 mg/L浓度的Ozone MNBs处理黄豆芽,对照组用蒸馏水代替Ozone MNBs。将12 kg黄豆芽用Ozone MNBs处理5 min后取出,吸水纸吸干表面多余水分,装入厚度为0.03 mm的自封袋,置于温度20 ℃,湿度95%,稳定LED白光照射条件下模拟货架期销售环境,并于0、12、24、36、48 h取样测定相应指标。剩余样品液氮冷冻,置于−80 ℃冰箱,后续指标测定时研磨成粉。
1.2.2 失重率和可滴定酸(TA)含量的测定
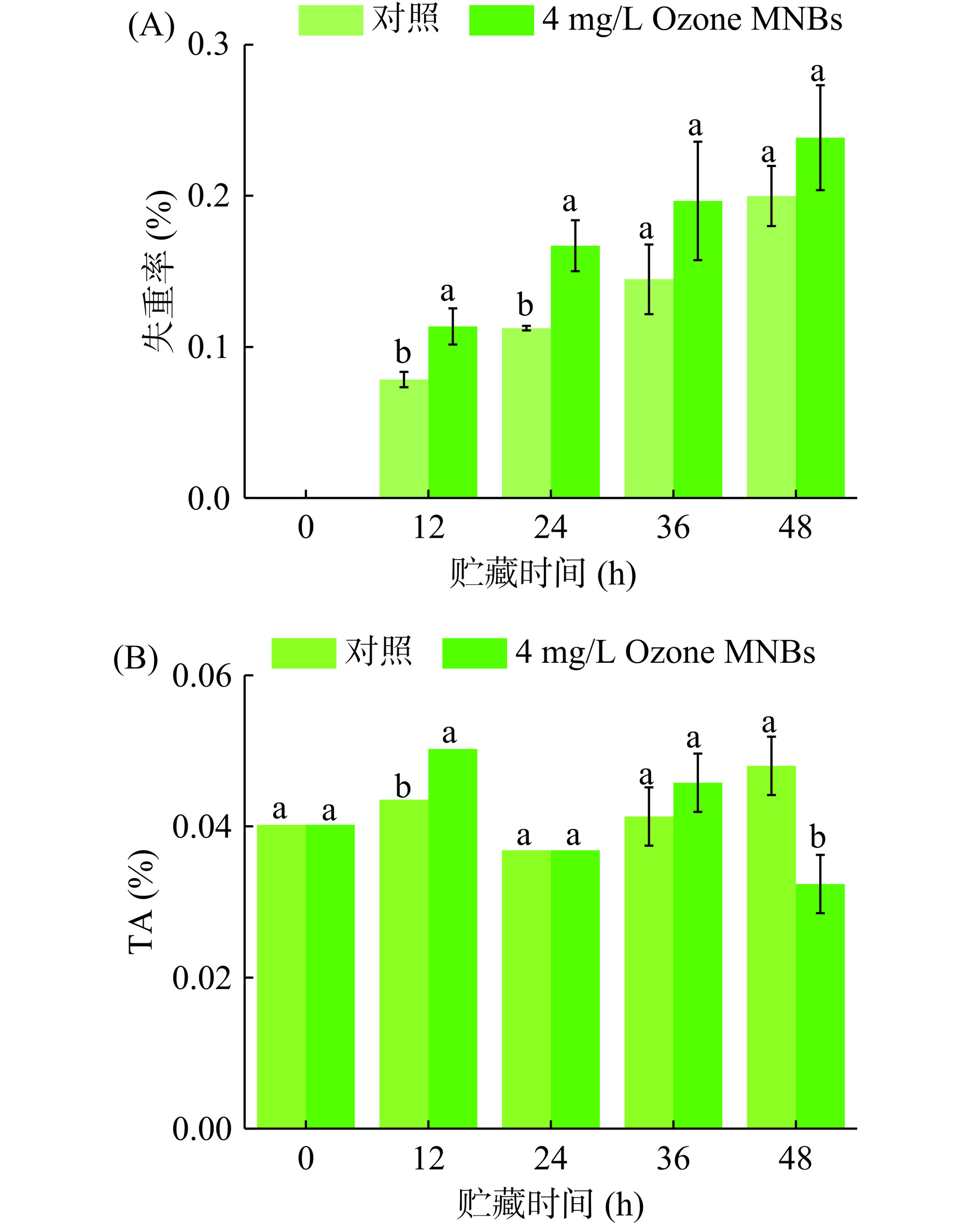
失重率和TA遵循Martínez-Romero等[10]的方法。TA含量利用酸碱电位滴定法测定,酚酞作为指示剂,样品:蒸馏水按照1:10比例均浆,过滤,取滤液。用0.1 mol/L NaOH滴定样品滤液至溶液变红为止,结果以%表示。
失重率(%)=(W1−W2)/W1×100 式中,W1为0 h样品重量;W2为取样点样品重量。
1.2.3 ADP、ATP、Urogen Ⅲ、ALA、胆色素原(PBG)和1,5-二磷酸羧化酶/加氧酶(RuBisCO)含量
根据酶联免疫试剂盒(上海酶联生物科技有限公司)方法进行实验测定。
1.2.4 NADP(H)含量测定
NADP(H)含量测定根据陈梦茵等[11]和Zhang等[12]的实验方法进行测定。1 g样品加入5 mL 0.1 mol/L HCl用于NADP测定,1 g样品加入5 mL 0.1 mol/L NaOH用于NADPH测定。混和液沸水浴5 min,冰浴冷却,4 ℃,10000×g离心10 min。上层清液分别用0.1 mol/L NaOH或HCl中和至pH为7,随后进行离心,离心条件同上。最终上层清液即为提取液。
50 μL上层清液加入60 μL 1 mol/L Tricine-NaOH缓冲液,60 μL 40 mmol/L乙二胺四乙酸(EDTA),60 μL 4.2 mmol/L MTT,60 μL 16.6 mmol/L吩嗪乙硫酸盐(PES),60 μL 25 mmol/L葡萄糖-6-磷酸和450 μL 0.1 mol/L NaCl溶液中,37 ℃水浴5 min。随后加入50 μL 200 U/mL的葡萄糖-6-磷酸脱氢酶(G6PDH)溶液,37 ℃下孵育40 min。最后加入600 μL 6 mol/L NaCl溶液终止反应。将所获得的反应混合物4 ℃,10000×g离心10 min,用4 mL 95%乙醇溶解的沉淀,570 nm下测定吸光值。结果以nmol/mL为单位表示(全程弱光操作)。
1.2.5 叶绿素a、叶绿素b和叶绿素含量测定
根据Shi等[13]的方法来测定黄豆芽叶绿素a,叶绿素b和叶绿素含量。称取1 g组织样品加入10 mL丙酮-乙醇(2:1)溶液中,摇匀。4 ℃条件下12000×g离心10 min取上层清液,然后用紫外分光光度计测定上层清液在645 nm和663 nm下的吸光值,叶绿素a和叶绿素b的质量浓度:
ρa=12.72A663−2.59A645 ρb=22.88A645−4.67A663 叶绿素总量ρT=ρa+ρb=20.29A645+8.05A663 叶绿素含量(mg/kg)=ρ×Vm×1000 式中,ρ为由公式计算得叶绿素的质量浓度,mg/L;V为样品提取液总体积,mL;m为样品质量,kg。
1.2.6 叶绿素降解酶活性测定
1.2.6.1 底物的制备
以下前处理均采用Shi等[13]的方法制备。纯叶绿素 a(Chla)试剂 10 mg,根据所需的浓度用丙酮溶液配制。叶绿酸a(Chlin a)的制备:40 mL石油醚加入到6 mL 200 µg/mL叶绿素a丙酮溶液中,将被分离出来的醚相用蒸馏水(20 mL)冲洗三次,最后加入1.33 mL 300 mg/mL KOH甲醇溶液制备成Chlin a。分离出Chlin a的沉淀并溶解在蒸馏水中。脱镁叶绿素 a(Phy a)制备:叶绿素丙酮溶液中加入一滴0.1 mol/L的HCl,2 min后加入一滴0.1 mol/L NaOH中和。Phy a浓度的确定通过测定消光系数为156000 mol/L/cm的波长为409 nm处吸光值计算。
1.2.6.2 丙酮粉的制备
3 g样品在22.5 mL冷丙酮(−20 ℃)溶解,−20 ℃静置15 min,然后于4 ℃,12000×g下离心5 min,取沉淀再加22.5 mL冷丙酮,重复2~3次至沉淀中绿色褪去,沉淀即为丙酮粉。
1.2.6.3 粗酶液提取
Chlase提取:0.2 g丙酮粉与3 mL 50 mmol/L PBS(pH7.0)缓冲液混合,其中缓冲液包括50 mmol/L KCl和0.24% Triton X-100,放入30 ℃恒温条件,搅拌30 min,然后12000×g离心5 min,取上层清液。MD提取:0.1 g丙酮粉与1 mL 50 mmol/L PBS(pH7.0)缓冲液混合,缓冲液配制与叶绿素酶提取过程中所用相同,混合液放入0 ℃下搅拌1 h,随后在4 ℃,12000×g离心20 min,取上层清液。Chl-POX提取:0.15 g丙酮粉与10 mL 10 mmol/L PBS(pH7.0)缓冲液混合,0 ℃下搅拌1 h。4 ℃,10000×g离心20 min,取上层清液。PPH提取:0.15 g丙酮粉与1.5 mL 50 mmol/L pH8.0 Tris-HCl 缓冲液混合,0 ℃下搅拌1 h,4 ℃,15000×g离心15 min,取上层清液。
1.2.6.4 Chlase活性的测定
Chlase活性的测定采用Han等[14]的方法。反应液由0.5 mL pH7.5 100 mmol/L PBS(含0.24% Triton X-100),0.5 mL酶液以及0.2 mL 200 µg/mL Chla丙酮溶液组成。反应液25 ℃水浴40 min,随后加入4 mL冷丙酮终止反应,再加4 mL正己烷,充分混合,4 ℃,12000×g 离心5 min。测定下层相667 nm处的吸光值,单位为nmol/(g·h)。
1.2.6.5 Chl-POX活性测定
Chl-POX活性测定运用Asumi等[15]的方法,反应液:0.5 mL酶液,0.2 mL Chla 丙酮溶液(80 µg/mL),0.1 mL H2O2(0.3%),0.1 mL Triton X-100(1%),0.1 mL 4-香豆酸(5 mmol/L)、1.5 mL pH5.5 PBS缓冲液(0.1 mol/L)。反应液25 ℃保温10 min后测定668 nm处吸光值,单位为nmol/(g·min)。
1.2.6.6 MD活性测定
MD活性测定运用Suzuki等[16]的方法,反应液包含:0.2 mL酶液,0.75 mL Tris-HCl缓冲液(50 mmol/L pH8.0)和0.3 mL Chlin a。反应液37 ℃保温10 min后测定686 nm处吸光值,单位为OD/(g·min)。
1.2.6.7 PPH活性测定
PPH活性测定运用Aiamla-or等[17]的方法,反应液由0.35 mL酶液,75 µL Triton X-100(2.0%),0.1 mL Phy a,0.7 mL Tris-HCl缓冲液(50 mmol/L pH8.0)构成。反应液25 ℃保温90 min后加入4 mL冷丙酮终止,再加入4 mL正己烷,充分混合,4 ℃,12000×g离心5 min。测定丙酮层在667 nm处的吸光值,单位为nmol/(kg·min)。
1.3 数据处理
采用WPS 2022软件进行数据处理,利用SPSS 22.0软件对数据进行单因素方差分析(P<0.05)。运用Origin 2022软件制图,不同字母表示显著性差异(P<0.05)。
2. 结果与分析
2.1 Ozone MNBs处理对黄豆芽外观品质的影响
外观品质是反映果蔬品质变化最直观的指标。由图1可以看出在LED白光照射24 h后对照和Ozone MNBs处理组黄豆芽均出现“绿化”现象,其中对照组“绿化”程度较Ozone MNBs处理组更明显。这是因为臭氧本身具有抑制光合作用的能力,同时微纳米气泡可进入果蔬内部的缝隙,从而加强了臭氧抑制光合作用发生的效果[18−19]。说明Ozone MNBs处理可有效维持黄豆芽的外观品质,减弱“绿化”发生。
2.2 Ozone MNBs处理对黄豆芽失重率和TA的影响
失重是所有果蔬贮藏过程中不可避免的一个基础变化,对果蔬品质影响较大。有研究表明,臭氧能够有效地抑制植物进行光合作用,但持续的臭氧处理会促进植物衰老,造成不可逆损伤[20]。因此利用Ozone MNBs技术进行短时处理可能会降低臭氧对黄豆芽的损伤。图2A显示,整个LED白光照射贮藏过程中,Ozone MNBs处理组和对照组失重率均呈一直增长趋势。Ozone MNBs处理后,失重率明显较对照组大。可能是因为黄豆芽含水量高,并且细胞膜较薄,受到Ozone MNBs刺激后破坏细胞膜结构,加速了水分损失[21]。另外,图2B显示TA含量变化在Ozone MNBs处理组和对照组中均较为稳定,除12和48 h外,整个过程中两组差异不显著(P>0.05),说明Ozone MNBs对TA含量的影响相对较小。
2.3 Ozone MNBs处理对黄豆芽ADP、ATP、NADP+和NADPH含量的影响
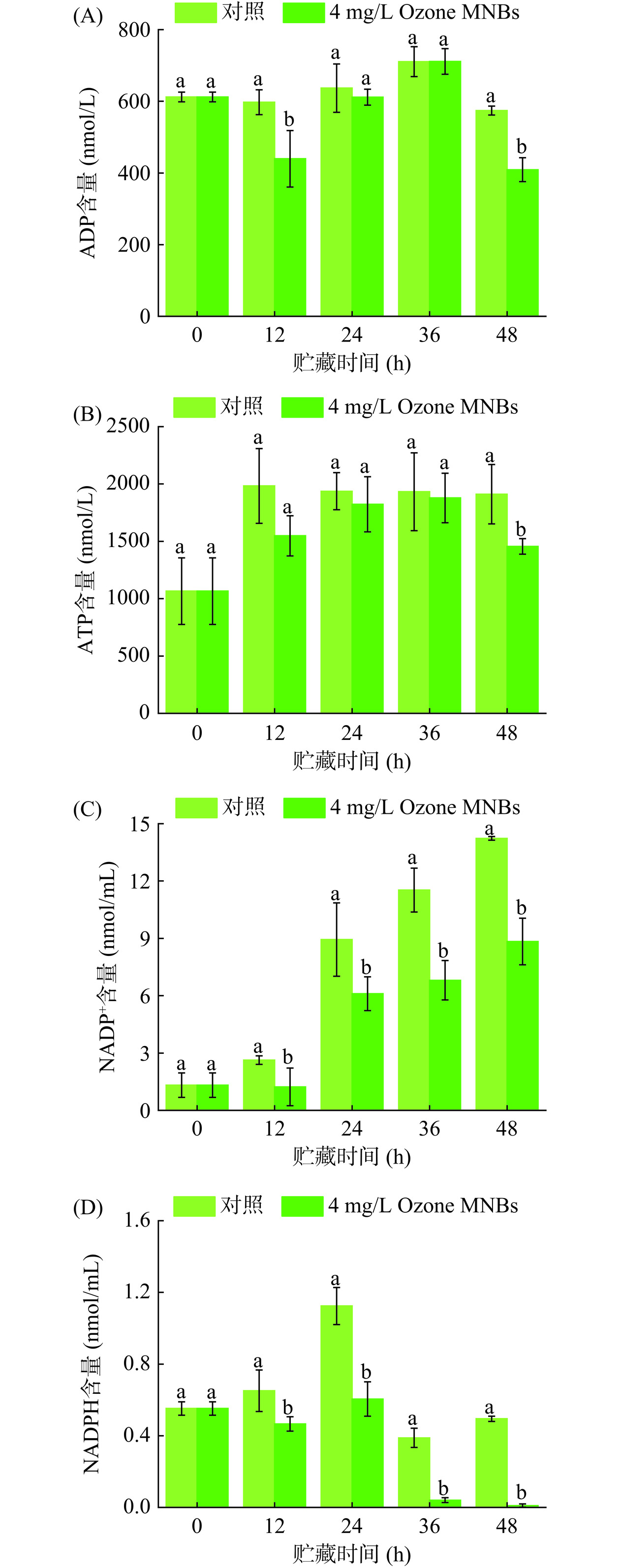
黄豆芽“绿化”主要是发生了光合作用,此过程较为复杂,涉及光吸收、电子传递、光合磷酸化、碳同化等重要反应步骤。此过程伴随着能量变化,叶绿体类囊体膜催化ADP与Pi结合形成ATP。在形成ATP的同时,还释放了氧并形成还原型辅酶Ⅱ(NADPH)[22]。若光合作用增强时,会促进能量的产生。如图3A显示,整个LED白光照射贮藏过程中,Ozone MNBs处理组和对照组ADP含量均呈先升后降趋势,36 h时Ozone MNBs处理组和对照组均达到峰值分别为711.167 nmol/L和710.733 nmol/L,对照组含量整体高于Ozone MNBs处理组,12 h和48 h差异显著(P<0.05)。图3B的ATP含量变化均呈先增长然后缓慢下降的趋势,并且对照组含量高于Ozone MNBs处理组。由图3C可知,NADP+含量整体呈一直增长趋势,12~48 h对照组和Ozone MNBs处理组差异显著(P<0.05),48 h时两组达到最大值,分别为14.23 nmol/mL和8.84 nmol/mL。图3D显示,NADPH含量整体呈先升后降趋势,整个贮藏期间对照组含量高于Ozone MNBs处理组,且12~48 h对照组含量明显更高(P<0.05)。ADP、ATP、NADP+、NADPH在Ozone MNBs组较对照组含量低,说明Ozone MNBs降低了光合磷酸化过程,从而降低光合作用的发生,有效延缓了黄豆芽的“绿化”。
2.4 Ozone MNBs处理对黄豆芽Urogen Ⅲ、ALA和PBG含量的影响
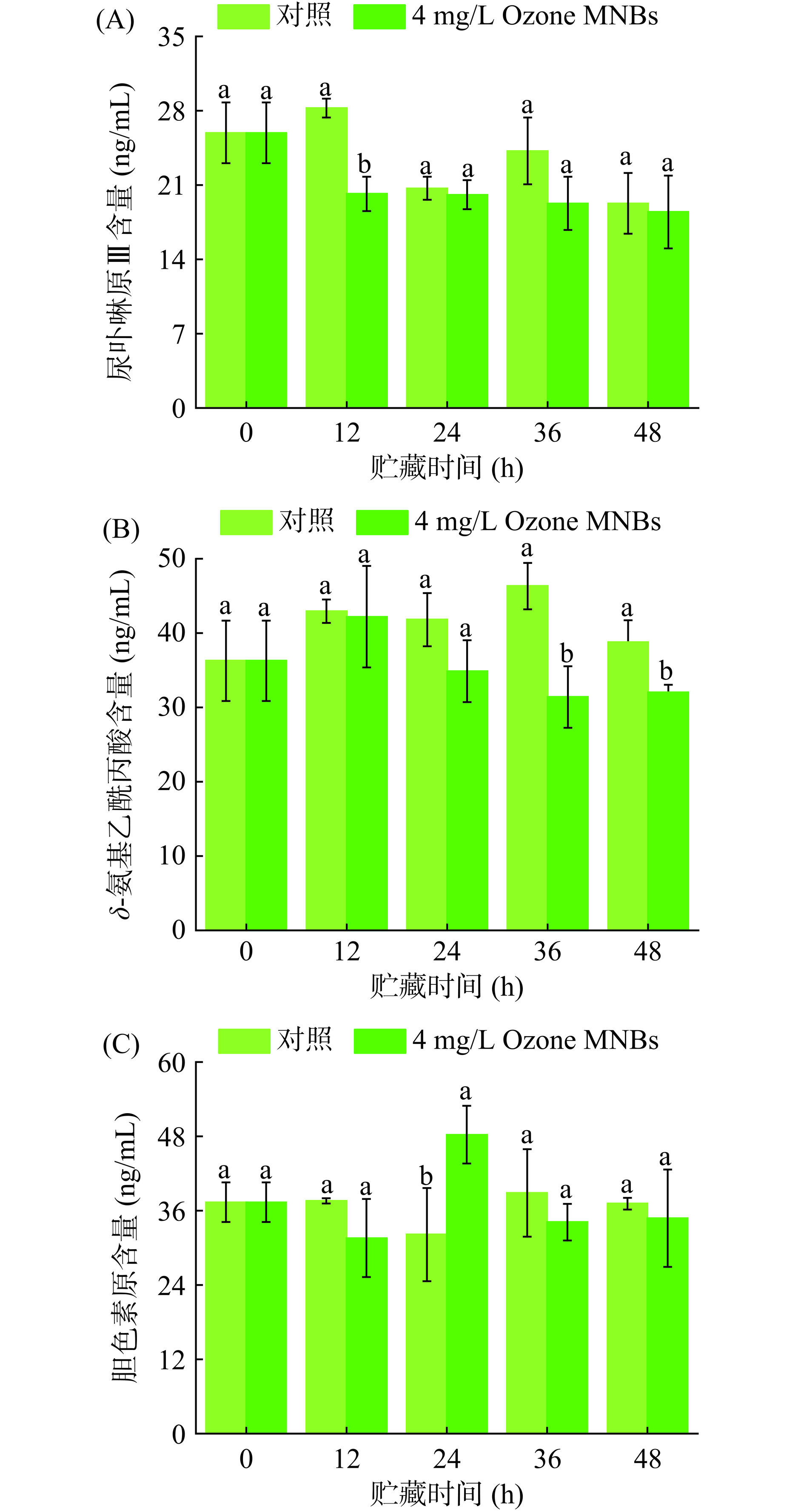
Urogen Ⅲ、ALA和PBG作为叶绿素合成前体物,能够对叶绿素合成过程具有较好的调控作用[23−24],这些前体物质含量降低可能会降低叶绿素的合成速率。当黄豆芽叶绿素含量降低时,“绿化”现象会减弱。图4A显示,整个LED白光照射贮藏过程中,Ozone MNBs处理组Urogen Ⅲ含量呈下降趋势,对照组则为先升后降。对照组含量始终高于Ozone MNBs处理组,在12 h时Ozone MNBs处理组和对照组之间差异显著(P<0.05),此时两组含量分别为20.175 ng/mL和28.252 ng/mL。图4B的ALA含量变化均呈先增长后下降的趋势,对照组在36 h达到峰值为46.323 ng/mL,而Ozone MNBs处理组在12 h已达到最大值为42.207 ng/mL。此过程中对照组含量高于Ozone MNBs处理组,尤其在24 h以后效果明显。由图4C可知,PBG含量呈一个较为稳定的趋势,除24 h Ozone MNBs处理组大于对照组外,其余贮藏时间对照组均大于Ozone MNBs处理组。Urogen Ⅲ和ALA含量变化说明Ozone MNBs会降低叶绿素合成前体物质,可能对黄豆芽“绿化”具有抑制效果。
2.5 Ozone MNBs处理对黄豆芽叶绿素a、叶绿素b和叶绿素含量的影响
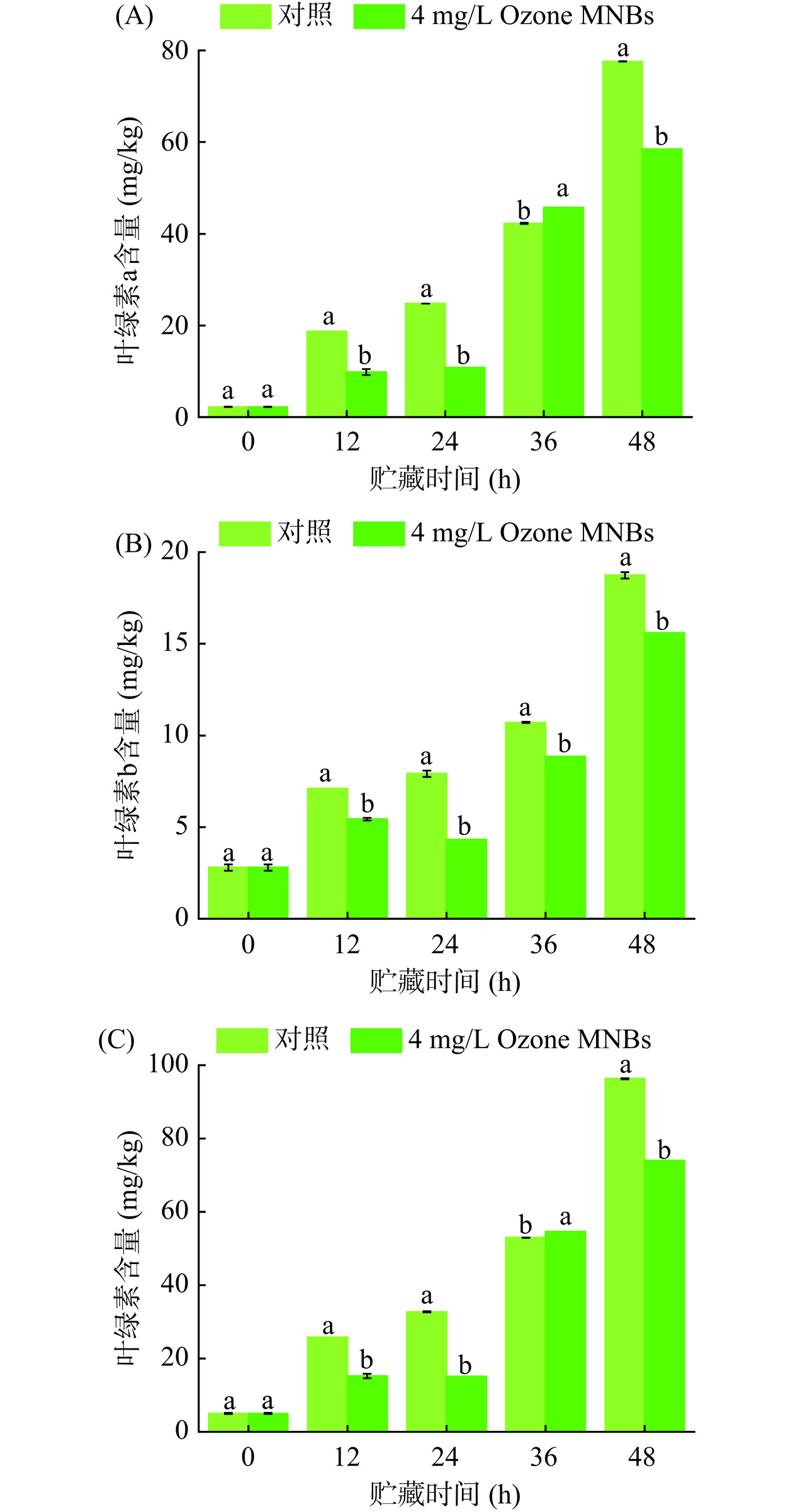
叶绿素是反映植物颜色变化的关键因素,其作为光系统的重要组成部分,具有捕获和转换光能的基本功能[23]。叶绿素合成过程首先由谷氨酸合成叶绿素a,随后叶绿素a和叶绿素b的相互转换,最后叶绿素a降解[25]。因此,叶绿素a和叶绿素b含量变化是光合作用是否发生的重要指标。图5A显示,LED白光照射贮藏过程中,叶绿素a含量均呈一直增长趋势,除36 h外,对照组含量明显高于Ozone MNBs处理组(P<0.05),48 h时Ozone MNBs处理组和对照组达到最大值分别为58.460 mg/kg和77.598 mg/kg。图5B的叶绿素b含量变化趋势同叶绿素a变化趋势相似,对照组含量一直明显高于Ozone MNBs处理组(P<0.05),在48 h达到最大值分别为18.739 mg/kg和15.597 mg/kg。由图5C可知,叶绿素含量变化趋势同叶绿素a、b含量变化趋势相似,除36 h Ozone MNBs处理组与对照组含量相似外,其余贮藏时间内对照组均显著大于Ozone MNBs处理组(P<0.05)。以上叶绿素a、叶绿素b和总叶绿素含量的变化说明Ozone MNBs处理降低了叶绿素合成,同时也回应了光合作用减弱,黄豆芽“绿化”的延缓。
2.6 Ozone MNBs处理对黄豆芽RuBisCO活性的影响
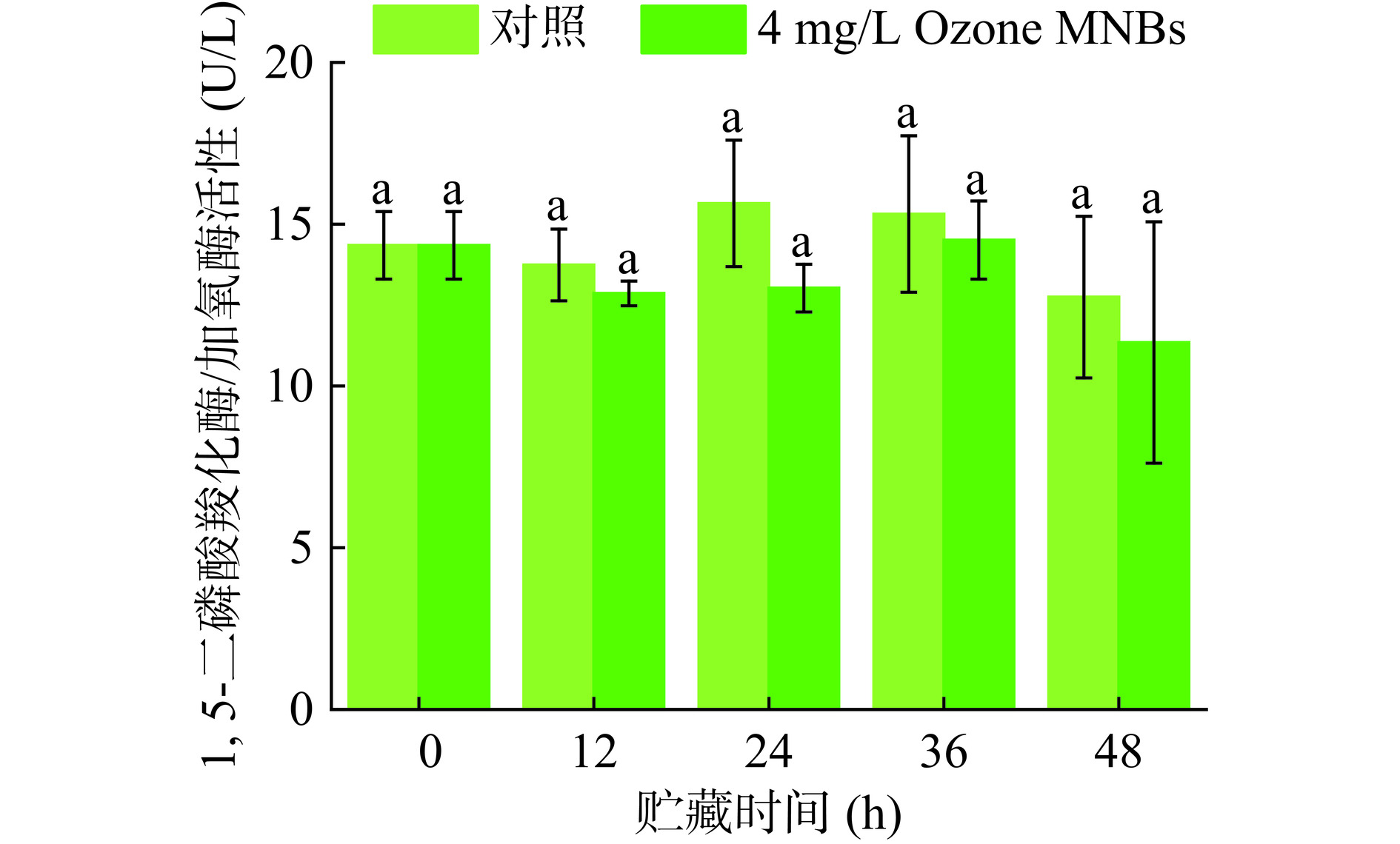
RuBisCO酶是光合作用反应中重要的羧化酶,光呼吸中不可缺少的加氧酶,在光合作用过程中,RuBisCO最大羧化速率决定了光合作用的能力,臭氧可通过抑制蛋白合成、加速蛋白分解来降低RuBisCO的活性[26]。由图6可知,LED白光照射过程中,RuBisCO活性均呈先升后降趋势,对照组和Ozone MNBs处理组活性分别在24 h和36 h达到峰值,分别为15.641 U/L和14.507 U/L,然而整个过程Ozone MNBs处理组和对照组两组差异不显著,这说明Ozone MNBs对RuBisCO活性影响相对较小。
2.7 Ozone MNBs处理对黄豆芽Chl-POX、PPH、MD和Chlase活性的影响
产生黄豆芽“绿化”现象除了与光合作用有关外,也可能是叶绿素降解相关酶的影响。Chlase是叶绿素分解代谢途径中的第一酶,催化Chl a生成脱镁叶绿素a;Chl-POX可以在体外降解Chl a,生成中间产物OHChl a,然后MD会进一步催化叶绿素降解,通过去除脱植基叶绿素a的Mg2+产生脱镁叶绿素a,PPH则会促进生成脱镁叶绿素a/b[13]。这些催化的产物会加速叶绿素降解,降低果蔬绿色色素产生。图7A显示,Chlase活性呈一直下降趋势,整个过程中,对照组活性低于Ozone MNBs处理组,且12~36 h对照组活性显著低于Ozone MNBs处理组(P<0.05)。图7B表明,整个LED白光照射贮藏过程中,Ozone MNBs处理组的Chl-POX活性呈先升后降趋势,在36 h时达到最大值83.016 nmol/(g·min),但是对照组Chl-POX活性变化不明显,其中12、24和36 h两组差异显著(P<0.05),Ozone MNBs处理组明显高于对照组。图7C显示,MD活性整体呈先升后降趋势,12 h时活性最大,分别为0.890 OD/(g·min)和1.496 OD/(g·min),另外,Ozone MNBs处理组活性也是高于对照组,其中12~36 h对照组和Ozone MNBs处理组差异显著(P<0.05)。由图7D知,除24 h外,Ozone MNBs处理组达到944.116 nmol/(kg·min),其余时间点PPH活性整体呈下降趋势,并且Ozone MNBs处理组活性高于对照组。结果说明Ozone MNBs提高了叶绿素的一系列降解酶活性,使得叶绿素合成受到抑制,可能是臭氧本身具有抑制光合作用的能力,微纳米气泡可促进其进入果蔬内部,从而抑制了光合作用的发生[18−19],降低了黄豆芽“绿化”的发生。
3. 结论
本文以黄豆芽为原料,探究了Ozone MNBs技术对黄豆芽生理品质和叶绿素合成和分解的调控作用。研究结果表明,LED白光照射下,Ozone MNBs处理的黄豆芽光合作用受到显著抑制,“绿化”程度明显降低。处理组黄豆芽失水较对照组严重,但在货架期内整体失重率变化较小。同时Ozone MNBs处理还降低了黄豆芽ALA、Urogen Ⅲ、叶绿素、叶绿素a、叶绿素b、ADP、ATP、NADP+和NADPH含量,诱导提升了Chl-POX、PPH、MD和Chlase酶活性。据此认为,Ozone MNBs技术可降低黄豆芽“绿化”现象,与降低黄豆芽光合作用相关酶活性和物质积累、提升叶绿素降解酶活性有关。以上发现对其应用在调节绿叶植物生长具有重要意义。
-
-
[1] 刘飞, 麻成金. 预处理对冻干黄豆芽品质的影响[J]. 食品研究与开发,2005,26(6):87−89. [LIU F, MA C J. Effect of pretreatment technology on quality of soybean sprout in freeze-drying condition[J]. Food Research and Development,2005,26(6):87−89.] LIU F, MA C J. Effect of pretreatment technology on quality of soybean sprout in freeze-drying condition[J]. Food Research and Development, 2005, 26(6): 87−89.
[2] TAKAHASHI M. ζ Potential of microbubbles in aqueous solutions:Electrical properties of the gas-water interface[J]. Journal of Physical Chemistry B,2005,109(46):21858−21864. doi: 10.1021/jp0445270
[3] 白华飞, 张昭其. 臭氧在果蔬贮藏保鲜上的应用[J]. 食品科技,2003(1):80−82. [BAI H F, ZHANG Z Q. The application of ozone on storage of fruits and vegetables[J]. Food Science and Technology,2003(1):80−82.] doi: 10.3969/j.issn.1005-9989.2003.01.031 BAI H F, ZHANG Z Q. The application of ozone on storage of fruits and vegetables[J]. Food Science and Technology, 2003(1): 80−82. doi: 10.3969/j.issn.1005-9989.2003.01.031
[4] 姚开, 贾冬英, 谭敏. 臭氧在果蔬加工中的应用[J]. 食品科学,2002,23(5):149−151. [YAO K, JIA D Y, TAN M. Study on sterilization mechanism of ozone and its application to processing fruits and vegetables[J]. Food Science,2002,23(5):149−151.] YAO K, JIA D Y, TAN M. Study on sterilization mechanism of ozone and its application to processing fruits and vegetables[J]. Food Science, 2002, 23(5): 149−151.
[5] KARACA H, VELIOGLU Y S. Ozone applications in fruit and vegetable processing[J]. Food Reviews International,2007,23(1):91−106. doi: 10.1080/87559120600998221
[6] HE H M, ZHENG L, LI Y F, et al. Research on the feasibility of spraying micro/nano bubble ozonated water for airborne disease prevention[J]. Ozone:Science & Engineering,2015,37(1):78−84.
[7] IKEURA H, KOBAYASHI F, TAMAKI M. Removal of residual pesticides in vegetables using ozone microbubbles[J]. Journal of Hazardous Materials,2011,186(1):956−959. doi: 10.1016/j.jhazmat.2010.11.094
[8] 王雪青, 左进华, 闫志成, 等. 臭氧微纳米气泡处理对菠菜采后保鲜的影响[J]. 食品科学,2020,41(23):190−196. [WANG X Q, ZUO J H, YAN Z C, et al. Effect of ozone micro-nano-bubble treatment on postharvest preservation of spinach[J]. Food Science,2020,41(23):190−196.] doi: 10.7506/spkx1002-6630-20191102-014 WANG X Q, ZUO J H, YAN Z C, et al. Effect of ozone micro-nano-bubble treatment on postharvest preservation of spinach[J]. Food Science, 2020, 41(23): 190−196. doi: 10.7506/spkx1002-6630-20191102-014
[9] LEE U, JOO S, KLOPFENSTEIN N B, et al. Efficacy of washing treatments in the reduction of post-harvest decay of chestnuts (Castanea crenata ‘Tsukuba’) during storage[J]. Canadian Journal of Plant Science,2016,96(1):1−5. doi: 10.1139/cjps-2015-0089
[10] MARTÍNEZ-ROMERO D, ALBURQUERQUE N, VALVERDE J M, et al. Postharvest sweet cherry quality and safety maintenance by Aloe vera treatment:A new edible coating[J]. Postharvest Biology and Technology,2006,39(1):93−100. doi: 10.1016/j.postharvbio.2005.09.006
[11] 陈梦茵, 林河通, 洪延康, 等. DNP和ATP对Phomopsis longanae Chi侵染的龙眼果实病害发生、能荷状态和呼吸代谢的调控[J]. 现代食品科技,2015,31(5):49−58,89. [CHEN M Y, LIN H T, HONG Y K, et al. Regulation of 2, 4-dinitrophenol and adenosine triphosphate on disease development, energy status, and respiratory metabolism of Phomopsis longanae Chi-infected longan fruit[J]. Modern Food Science and Technology,2015,31(5):49−58,89.] CHEN M Y, LIN H T, HONG Y K, et al. Regulation of 2, 4-dinitrophenol and adenosine triphosphate on disease development, energy status, and respiratory metabolism of Phomopsis longanae Chi-infected longan fruit[J]. Modern Food Science and Technology, 2015, 31(5): 49−58,89.
[12] ZHANG S, LIN H T, LIN Y F, et al. Energy status regulates disease development and respiratory metabolism of Lasiodiplodia theobromae (Pat.) Griff. & Maubl. -infected longan fruit[J]. Food Chemistry, 2017, 231:238-246.
[13] SHI J Y, GAO L P, ZUO J H, et al. Exogenous sodium nitroprusside treatment of broccoli florets extends shelf life, enhances antioxidant enzyme activity, and inhibits chlorophyll-degradation[J]. Postharvest Biology and Technology,2016,116:98−104. doi: 10.1016/j.postharvbio.2016.01.007
[14] HAN C, ZUO J, WANG Q, et al. Effects of chitosan coating on postharvest quality and shelf life of sponge gourd (Luffa cylindrica) during storage[J]. Scientia Horticulturae,2014,166:1−8. doi: 10.1016/j.scienta.2013.09.007
[15] ASUMI F, YASUO S, HIROFUMI T, et al. Effects of postharvest ethanol vapor treatment on activities and gene expression of chlorophyll catabolic enzymes in broccoli florets[J]. Postharvest Biology and Technology,2010,55:97−102. doi: 10.1016/j.postharvbio.2009.08.010
[16] SUZUKI T, SHIOI Y. Re-examination of Mg-dechelation reaction in the degradation of chlorophylls using chlorophyll in a as a substrate[J]. Photosynthesis Research,2002,74:217−223. doi: 10.1023/A:1020915812770
[17] AIAMLA-OR S, NAKAJIMA T, SHIGYO M, et al. Pheophytinase activity and gene expression of chlorophyll-degrading enzymes relating to UV-B treatment in postharvest broccoli (Brassica oleracea L. Italica Group) florets[J]. Postharvest Biology and Technology,2012,63:60−66. doi: 10.1016/j.postharvbio.2011.08.003
[18] AMAKI K. 小气泡水的流动特性及用于洗涤的可能性[J]. 中国洗涤用品工业,2018,213(11):71−76. [AMAKI K. The flow behaviors of fine-bubble mixture water and its application in cleaning[J]. China Cleaning Industry,2018,213(11):71−76.] doi: 10.16054/j.cnki.cci.2018.11.008 AMAKI K. The flow behaviors of fine-bubble mixture water and its application in cleaning[J]. China Cleaning Industry, 2018, 213(11): 71−76. doi: 10.16054/j.cnki.cci.2018.11.008
[19] 马艳泽, 杨熙来, 徐彦森, 等. 四种常见树木叶片光合模型关键参数对臭氧浓度升高的响应[J]. 植物生态学报,2022,46(3):9. [MA Y Z, YANG X L, XU Y S, et al. Response of key parameters of leaf photosynthetic models to increased ozone concentration in four common trees[J]. Chinese Journal of Plant Ecology,2022,46(3):9.] MA Y Z, YANG X L, XU Y S, et al. Response of key parameters of leaf photosynthetic models to increased ozone concentration in four common trees[J]. Chinese Journal of Plant Ecology, 2022, 46(3): 9.
[20] TARJA S, ELINA H, MATTI R, et al. Interactive effects of elevated ozone and springtime frost on growth and physiology of birch (Betula pendula) in field conditions[J]. Trees,2008,22(3):291−301. doi: 10.1007/s00468-007-0184-5
[21] 李景, 王欣, 王振华, 等. 臭氧和气溶胶复合污染对杨树叶片光合作用的影响[J]. 植物生态学报,2020,44(8):854−863. [LI J, WANG X, WANG Z H, et al. Effects of ozone and aerosol pollution on photosynthesis of poplar leaves[J]. Chinese Journal of Plant Ecology,2020,44(8):854−863.] doi: 10.17521/cjpe.2020.0022 LI J, WANG X, WANG Z H, et al. Effects of ozone and aerosol pollution on photosynthesis of poplar leaves[J]. Chinese Journal of Plant Ecology, 2020, 44(8): 854−863. doi: 10.17521/cjpe.2020.0022
[22] NIKKANEN L. Dynamic regulation of photosynthesis by chloroplast thioredoxin systems[D]. Finland: University of Turku, 2018:9−10.
[23] HIROSHI Y, TAKESHI I, KENJI N, et al. Genetic analysis of chlorophyll synthesis and degradation regulated by balance of chlorophyll metabolism[J]. Plant Physiology,2022,189(1):419−432. doi: 10.1093/plphys/kiac059
[24] ALAMRI S, SIDDIQUI M, MUKHERJEE S, et al. Molybdenum-induced endogenous nitric oxide (NO) signaling coordinately enhances resilience through chlorophyll metabolism, osmolyte accumulation and antioxidant system in arsenate stressed-wheat (Triticum aestivum L.) seedlings[J]. Environmental Pollution (Barking, Essex:1987), 2022, 292(Pt A):118268.
[25] GAO J L, WANG H, YUAN Q P, et al. Structure and function of the photosystem supercomplexes[J]. Frontiers in Plant Science,2018,9:357. doi: 10.3389/fpls.2018.00357
[26] DIZENGREMEL P, LE THIEC D, HASENFRATZ-SAUDER M-P, et al. Metabolic-dependent changes in plant cell redox power after ozone exposure[J]. Plant Biology,2009(11):35−42.






 下载:
下载:

 下载:
下载:



