Biological Characteristics, Genome-wide Characteristics of A Bacteriophage of Vibrio parahaemolyticus and Its Application in Food
-
摘要: 目的:分析1株副溶血性弧菌噬菌体474x1的生物学特性、全基因组及在食品中的抑菌效果。方法:以副溶血性弧菌474菌株为宿主菌,从海鲜市场基围虾分离噬菌体474x1,利用透射电镜观察其形态,并绘制一步生长曲线,分析474x1对温度及pH的敏感性。分析474x1全基因组序列,根据474x1末端酶大亚基构建系统进化树。通过测定菌落总数评价噬菌体对虾肉中副溶血弧菌的抑制效果。结果:分离到1株新型的副溶血弧菌噬菌体,命名为474x1,该噬菌体能够裂解23株副溶血弧菌中的19株(19/23=82.61%)。电镜观察474x1具有典型的短尾病毒科病毒形态特征。最佳感染复数(MOI)为0.01,一步生长曲线显示474x1的潜伏期为10 min,裂解量为115 PFU/cell。该噬菌体能够在较大的温度范围(30~60 ℃)和pH(4~11)范围内维持活性。474x1全基因组长47830 bp,包含69个开放阅读框(open reading frames,ORFs),其中14个具有特定功能的基因。比较基因组学分析474x1与短尾噬菌体科弧菌属噬菌体Vp41s3基因组具有较高同源性,进化分析表明474x1与副溶血弧菌噬菌体Vp41s3亲缘性最高。在应用实验中,在4 ℃下MOI=1000的实验组在第3 h相较对照组菌量下降了0.39 lgCFU/mL。MOI=10000的实验组在第12 h相较对照组菌量下降了0.92 lgCFU/mL,在25 ℃下MOI=1000,MOI=10000的实验组相较对照组在第6 h时菌量分别下降1.04、1.82 lgCFU/mL,表明噬菌体474x1能够显著抑制虾肉中宿主菌的生长。结论:从基围虾中分离鉴定1株新的副溶血性弧菌噬菌体,该噬菌体裂解量大,潜伏期短,在60 ℃以下表现出较好的稳定性,pH耐受范围宽,在食品中也有良好的抑菌效果,为防控水产品副溶血性弧菌的致病株奠定了基础。Abstract: Objective: The purpose of this study was to investigate the biological characteristics, whole genome, and antibacterial effect of V. parahaemolyticus phage 474x1 in food. Methods: The phage 474x1 was isolated from shrimp purchased from seafood market with V. parahaemolyticus strain 474 as host strain. The morphology of phage 474x1 was observed by transmission electron microscopy. One-step growth curve was determined, and its sensitivity to temperature and pH was assessed. The whole genome sequence of 474x1 was analyzed, and a phylogenetic tree was constructed based on the sequence of large subunit of phage terminase. The inhibitory effect of the phage on V. parahaemolyticus in shrimp meat was evaluated using the total colony count method. Results: A lytic phage against V. parahaemolyticus was isolated which named 474x1, and it could lyse 19 out of 23 strains of V. parahaemolyticus (82.61%). The phage had typical characteristics of a tailed bacteriophage in Myoviridae. The optimal multiplicity of infection (MOI) was 0.01, and the one-step growth curve showed that the latent period of 474x1 was 10 min, and the burst size was 115 PFU/cell. The phage was active over a wide range of temperature (30~60 ℃) and pH (4~11). The whole genome of 474x1 was 47830 bp long, and 69 open reading frames were predicted and annotated, including 14 genes with specific functions. Comparative genomics analysis showed that 474x1 had high homology with Vibrio phage Vp41s3, and phylogenetic analysis also indicated that 474x1 was most closely related to the phage Vp41s3. In the application experiment, the number of bacteria in the experimental group with MOI=1000 at 4 ℃ decreased by 0.39 lgCFU/mL compared to the control group at 3 h, while the experimental group with MOI=10000 at 4 ℃ decreased by 0.92 lgCFU/mL compared to the control group at 12 h. At 25 ℃, the number of bacteria in the MOI=1000 and MOI=10000 groups decreased by 1.04 lgCFU/mL and 1.82 lgCFU/mL at 6 h, respectively. The results indicated that phage 474x1 could significantly inhibit the growth of host bacteria in shrimp meat. Conclusion: A new V. parahaemolyticus phage was isolated from shrimp, which had large burst size, short latent period, and showed good stability below 60 ℃ and tolerated a wide range of pH. In addition, the phage had good bacteriostatic effect in food, laying a foundation for the prevention and control of pathogenic strains of V. parahaemolyticus.
-
副溶血性弧菌(Vibrio parahaemolyticus,Vp)是一种常见于河口和海洋环境的革兰氏阴性嗜盐细菌。食用未加工成熟的海产品是人类感染副溶血性弧菌的主要原因[1]。近年来海鲜类食品在市场广泛流通,导致该菌由沿海向内陆传播蔓延,甚至超过沙门氏菌和志贺氏菌,成为腹泻的首要病原菌[2]。在过去的几十年里,由于抗生素的过度使用,副溶血性弧菌中出现了抗生素耐药性[3]。因此,迫切需要既安全又对消费者友好的新的控制方法。
噬菌体是细菌病毒,在自然界中广泛存在,目前噬菌体在副溶血弧菌控制方面已有多篇报道。袁琳等[4]研究了噬菌体SHOU24对即食对虾中副溶血性弧菌的抑制效果,结果表明,经噬菌体处理的副溶血性弧菌的生长延滞期增长了4.04 h,噬菌体在常温条件下能使即食虾中副溶血性弧菌的浓度下降1个数量级,噬菌体SHOU24可显著降低即食对虾中的副溶血性弧菌数量。郑小双等[5]评价了副溶血性弧菌噬菌体VppMIX的抑菌效果,结果显示在25 ℃恒温保藏12 h后,不同剂量噬菌体VppMIX处理的黄鱼样品中副溶血性弧菌数量比对照组降低了1.41~4.98 lgCFU/g。可见噬菌体十分适合用于海产品等易腐败食品中主要病原菌的控制。
目前,已报道的副溶血性弧菌裂解性噬菌体数量有限,为了丰富该致病菌的噬菌体库,本研究以10株实验室保存的副溶血弧菌为宿主菌,从湖北省武汉不同地点采集的样品中分离烈性噬菌体,分析其形态、裂解谱、一步生长曲线、pH及温度稳定性等生物学特征,进行基因组比较,并以人工污染的基围虾作为模型,研究噬菌体在贮藏温度下对模拟污染虾肉的抑菌效果,为开发噬菌体抑制剂提供理论支持。
1. 材料与方法
1.1 材料与仪器
23株副溶血弧菌分离株 武汉轻工大学微生物实验室,其中ATCC17802为食品源标准菌株,F6、F7、F22、F23来源于食品,Vp27、Vp33、Vp41、Vp44、460、461、469、470、474、475、485、486、O56、O514来源于病人,H128、H256、H512为抗生素诱导株。选取其中10株细菌用于分离副溶血弧菌噬菌体;虾肉样品 武汉常青花园武商量贩、常青花园菜市场、盒马鲜生(武汉太和里店);TCBS琼脂 青岛海博生物技术有限公司;Agar琼脂粉 飞扬生物有限公司;酵母提取素、胰蛋白胨 北京瑞达恒辉公司;氯化钠、无水乙醇 上海国药集团化学试剂有限公司;96孔微量培养板 美国康宁公司;0.22 μL针头过滤器 天津津腾公司;一次性注射器 金塔有限公司;DNaseⅠ、RNase A、蛋白酶K Takara公司。
DRP-9062型电热恒温培养箱 上海森信实验仪器有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;DHG-9053A电热鼓风干燥箱 上海一恒科学仪器有限公司;PHS-25 pH计、CP214型电子天平 奥豪斯仪器公司;S4OPL201超纯水机 上海乐枫科技有限公司;Mini 15K离心机 杭州奥盛仪器有限公司;DB150L高压灭菌锅 北京亚欧德鹏科技有限公司;CMBR全自动生长曲线分析系统 芬兰Bio screen。
1.2 实验方法
1.2.1 噬菌体的分离与纯化
取虾肉样品25 g加入225 mL生理盐水,均质2 min,混合液以5000 r/min离心10 min,取5 mL上清液加入5 mL LB液体培养基中,同时分别加入100 μL处于对数生长期的10株副溶血弧菌,37 ℃振荡培养8 h后5000 r/min离心10 min,取上清液过0.22 μm滤膜,滤液经10倍梯度稀释后与宿主菌混合,使用双层平板法[6],37 ℃培养6~8 h检测噬菌斑。挑取单个空斑至1 mL SM缓冲液中,4 ℃过夜,用SM缓冲液稀释噬菌体液,取适宜梯度加入宿主菌制成双层平板,37 ℃培养6~8 h,重复培养5次,得到纯化噬菌体。
1.2.2 噬菌体效价测定
纯化的噬菌体液进行10倍稀释,将10−5、10−6及10−7的噬菌体液100 μL分别与100 μL对数期的宿主菌混合,利用双层平板法[6]观察噬菌斑的个数。
噬菌体效价(PFU/mL)=噬菌斑数量×稀释倍数×10
1.2.3 噬菌体透射电镜观察
参考Ramírez-Orozco等[7]方法,采用磷钨酸负染法进行透射电镜观察噬菌体形态,并利用软件Digital Micrograph Demo 3.9.1测量噬菌体头部直径和尾长。
1.2.4 噬菌体宿主谱测定
使用点斑法测定噬菌体的宿主谱[8],取3.7 mL LB半固体培养基加入0.1 mL宿主菌(109 CFU/mL),颠倒混匀后倾倒在固体培养基上,待凝固后,滴加噬菌体悬液(109 PFU/mL)10 μL,置37 ℃培养箱中培养8~12 h,观察裂解圈的形成。
1.2.5 噬菌体的最佳感染复数(multiplicity of infection,MOI)
按照不同的MOI值(0.001、0.01、0.1、1、10、100、1000)将噬菌体与宿主菌混合,对不同MOI值的噬菌体效价进行测定[6],效价最高的MOI值则为噬菌体的最佳感染复数。
1.2.6 噬菌体的一步生长曲线
将噬菌体原液与宿主菌以最佳感染复数混合,在37 ℃水浴锅中温浴10 min,使噬菌体尽可能多地吸附到宿主菌上。将混合液4 ℃、8000 r/min离心2 min,弃上清液使用等体积LB培养基(3% NaCl)重悬,重悬2次,取1 mL重悬液加入到9 mL LB培养基(3% NaCl)。从0 min开始,每隔10 min取500 μL于4 ℃、8500 r/min离心2 min,测定噬菌体效价[6]。
1.2.7 噬菌体的热稳定性
提前准备不同温度(30、40、50、60、70 ℃)的水浴锅,将噬菌体原液稀释到107 PFU/mL,取1 mL噬菌体原液于1.5 mL离心管中,将离心管放入不同温度的水浴锅中温浴。从0 min开始,每隔30 min测定离心管中噬菌体效价[6]。
1.2.8 噬菌体的pH稳定性
提前准备不同pH的PBS缓冲液,将100 µL噬菌体效价为107 PFU/mL的噬菌体原液加入到900 µL预先准备好的不同pH的PBS缓冲液中,使得混合后体系的最终pH分别为(2、3、4、5、6、7、8、9、10、11、12、13),于37 ℃水浴锅中温浴2 h。使用双层平板法测定噬菌体效价[6]。
1.2.9 噬菌体全基因组提取和功能基因分析
噬菌体全基因组提取采用苯酚-氯仿法,具体步骤参考文献[9]。委托上海泽塔公司对提取的噬菌体474x1基因组进行全基因组测序,并对噬菌体基因组进行拼接,得到完整的基因组序列。使用DNA Statistics(http://www.geneinfinity.org/sms/sms_dnastats.html)对噬菌体基因组序列进行分析,包括四种碱基的组成比例、GC平均含量。使用JSpeciesWS(https://jspecies.ribohost.com/jspeciesws/)对从NCBI数据库上下载的10株弧菌噬菌体全基因组完整序列进行平均核苷酸同一性(ANI)统计,得到矩阵。使用微生信在线工具(http://www.bioinformatics.com.cn/plot_basic_matrix_heatmap_064)绘制热图。使用RAST在线注释工具(https://rast.nmpdr.org/)对全基因序列进行基因预测。使用tRNAscan-SE(https://www.swmath.org/software/8005)在线工具预测全基因组中有无tRNA基因。使用NCBI数据库的BLASTn对预测的各个基因进行逐个检索分析,推测其基因功能。用BRIG(0.95)软件绘制基因组圈图。使用VFDB数据库(https://www.mgc.ac.cn/VFS/)预测噬菌体474x1基因组中可能存在的毒力基因,使用CARD数据库(https://card.mcmaster.ca/)预测基因组中可能存在的抗生素抗性基因。使用MEGA 7.0软件建立基于末端酶大亚基的进化树,分析噬菌体474x1的亲缘性。
1.2.10 噬菌体对基围虾中副溶血性弧菌的抑制作用
参考葛强等[10]的实验步骤稍作改进,将购买的新鲜虾去壳,用无菌刀将虾肉切为1 cm×1 cm的样品,重约1 g,将肉样煮沸30 min后置于无菌平皿中。在样品中接种100 μL 1.0×105 lgCFU/mL副溶血性弧菌474,于超净台中风干10 min使其吸附后用封口膜封住,作为对照组。实验组应在副溶血性弧菌474吸附后另外分别接种100 μL 1.0×108 lgCFU/mL(MOI=1000)和100 μL 1.0×109 lgCFU/mL(MOI=10000)的噬菌体悬液,常温条件下静置10 min使其吸附后用封口膜封住。将样品置于4 ℃,在第0、3、6、9、12 h分别取样,将样品放入10 mL离心管中,加入5 mL生理盐水,3000 r/min离心10 min,使虾肉沉淀,取上清液进行适当梯度稀释,取1 mL稀释液采用平板计数法检测虾肉中副溶血性弧菌的菌量,从而检测噬菌体的抑菌效果。
1.3 数据处理
采用Excel 2019计算数据平均数和标准差、Origin 2022进行折线图绘制和IBM SPSS Statistics 23的独立样本T检验进行显著性分析。
2. 结果与分析
2.1 副溶血弧菌噬菌体形态学特征
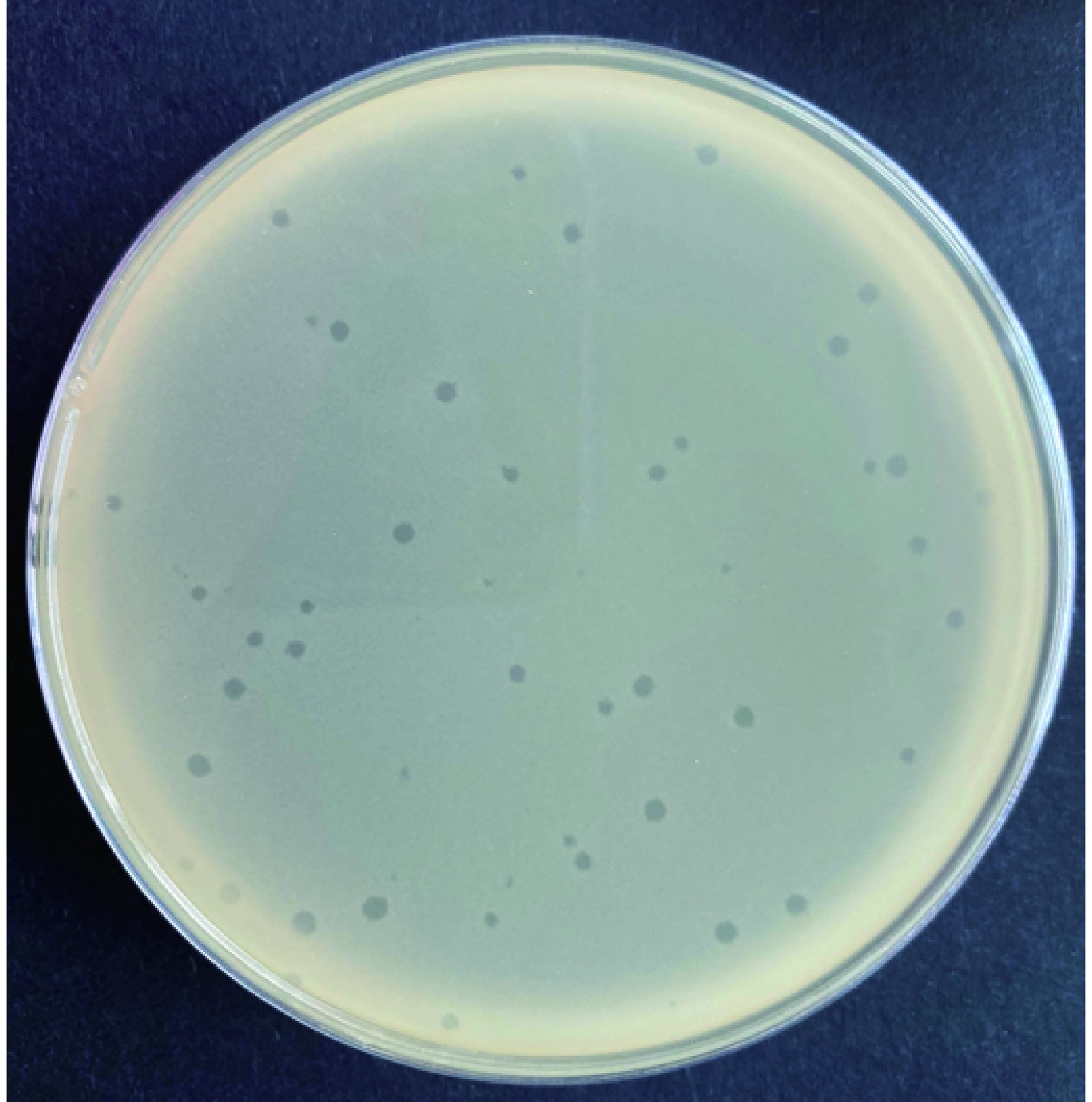
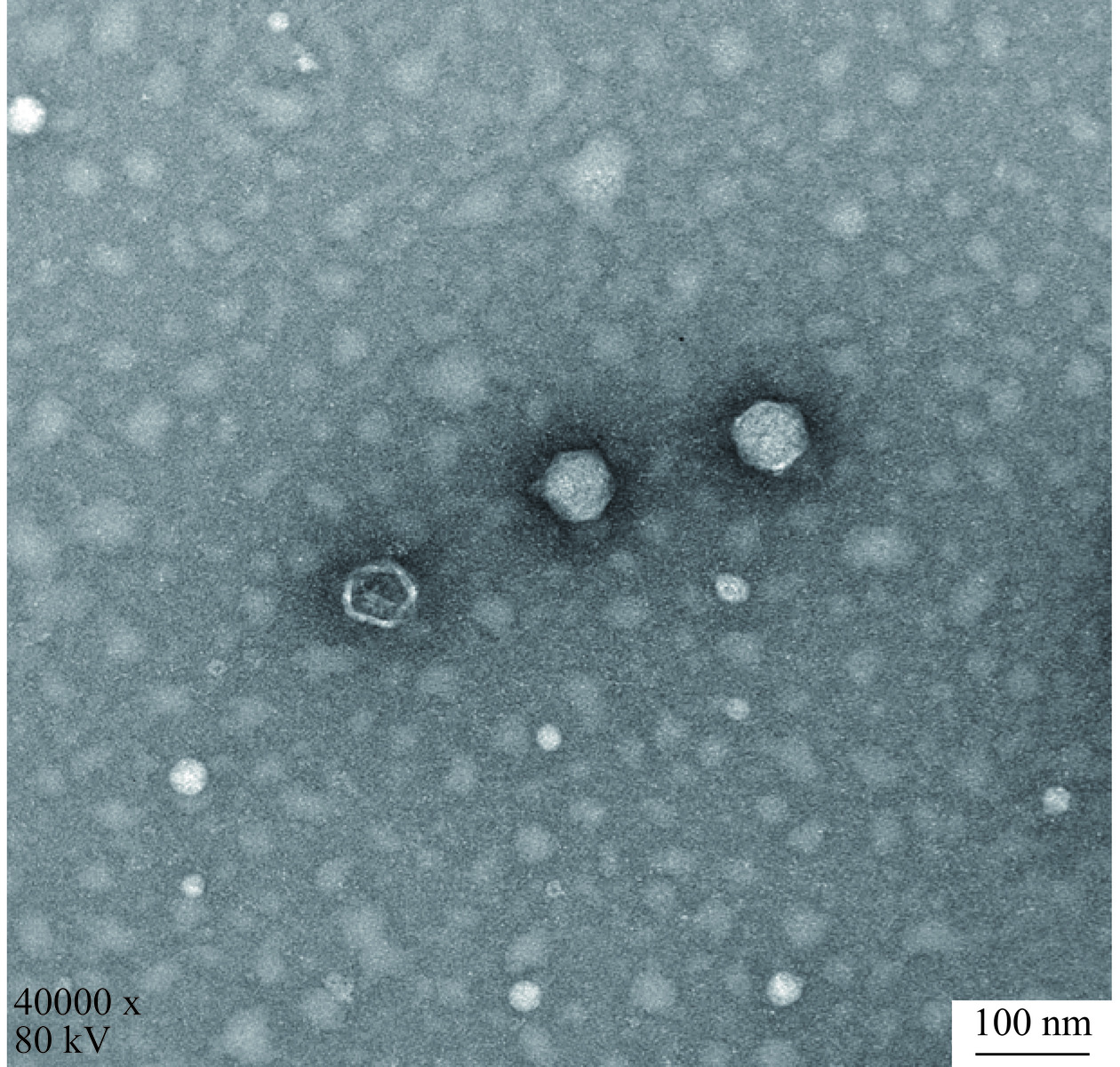
以副溶血弧菌474菌株为宿主菌从海鲜市场基围虾样品中成功分离出1株裂解性较强副溶血弧菌噬菌体,命名为474x1。培养后474x1可在474菌株的菌苔上形成清晰、透明的噬菌斑,直径1.5~2 mm(图1)。电镜下观察噬菌体的头部呈六边形,直径约70.8 nm,尾长约18.3 nm。具有典型的有尾噬菌体目短尾病毒科病毒形态特征(图2)。
2.2 副溶血弧菌噬菌体474x1宿主谱
副溶血弧菌噬菌体474x1宿主谱如表1。噬菌体474x1能够裂解23株副溶血弧菌中的19株(19/23=82.61%),表明噬菌体474x1对耐药副溶血弧菌具有良好的裂解能力。
表 1 副溶血弧菌噬菌体474x1宿主谱Table 1. Host range of V. parahaemolyticus phage 474x1序号 菌株种类 菌株编号 耐药性 裂解能力 1 副溶血弧菌 ATCC17802 CHL,AMP,AMC − 2 副溶血弧菌 ATCC33846 CHL,AMP,AMC,CXM + 3 副溶血弧菌 F6 CHL,AMP,AMC + 4 副溶血弧菌 F7 CHL,AMP,AMC + 5 副溶血弧菌 F22 CHL,AMP,AMC + 6 副溶血弧菌 F23 CHL,AMP,AMC + 7 副溶血弧菌 Vp27 CHL,AMP,AMC + 8 副溶血弧菌 Vp33 CHL,AMP,AMC − 9 副溶血弧菌 Vp41 CHL,AMP,AMC,NAL + 10 副溶血弧菌 Vp44 CHL,AMP,AMC,CXM − 11 副溶血弧菌 460 CHL,AMP,AMC,CXM + 12 副溶血弧菌 461 CHL,AMP,AMC,CXM + 13 副溶血弧菌 469 CHL,AMP,AMC,KAN + 14 副溶血弧菌 470 CHL,AMP,AMC + 15 副溶血弧菌 474 CHL,AMP,AMC + 16 副溶血弧菌 475 CHL,AMP,AMC + 17 副溶血弧菌 485 CHL,AMP,AMC + 18 副溶血弧菌 486 CHL,AMP,AMC + 19 副溶血弧菌 O56 CHL,AMP,AMC + 20 副溶血弧菌 O514 CHL,AMP,AMC − 21 副溶血弧菌 H128 CHL,AMP,AMC,CIP,NAL + 22 副溶血弧菌 H256 CHL,AMP,AMC,CIP,NAL + 23 副溶血弧菌 H512 CHL,AMP,AMC,CIP,NAL + 注:+代表副溶血弧菌噬菌体474x1能够裂解该细菌,−代表副溶血弧菌噬菌体474x1不能够裂解该细菌;CHL(氯霉素);AMP(氨苄西林);AMC(阿莫西林);CXM(头孢辛夫);CZO(头孢唑林);KAN(卡那霉素);NAL(萘啶酸);CIP(环丙沙星)。 2.3 副溶血弧菌噬菌体474x1最佳感染复数
表2为副溶血弧菌噬菌体474x1效价测定结果。当MOI为0.01时,噬菌体效价达到最大为9.66 lgPFU/mL,说明噬菌体474x1在感染副溶血弧菌474时,噬菌体与宿主菌的数量的比值为0.01时,可增殖最多的噬菌体。
表 2 副溶血弧菌噬菌体474x1的最佳感染复数Table 2. Multiplicity of infection of V. parahaemolyticus phage 474x1MOI 初始噬菌体效价
(lgPFU/mL)初始宿主菌浓度
(lgCFU/mL)噬菌体最终效价
(lgPFU/mL)0.001 5 8 8 0.01 5 7 9.66 0.1 5 6 9.61 1 5 5 9.07 10 5 4 8.20 100 5 3 8.07 1000 5 2 7.04 2.4 副溶血弧菌噬菌体474x1一步生长曲线
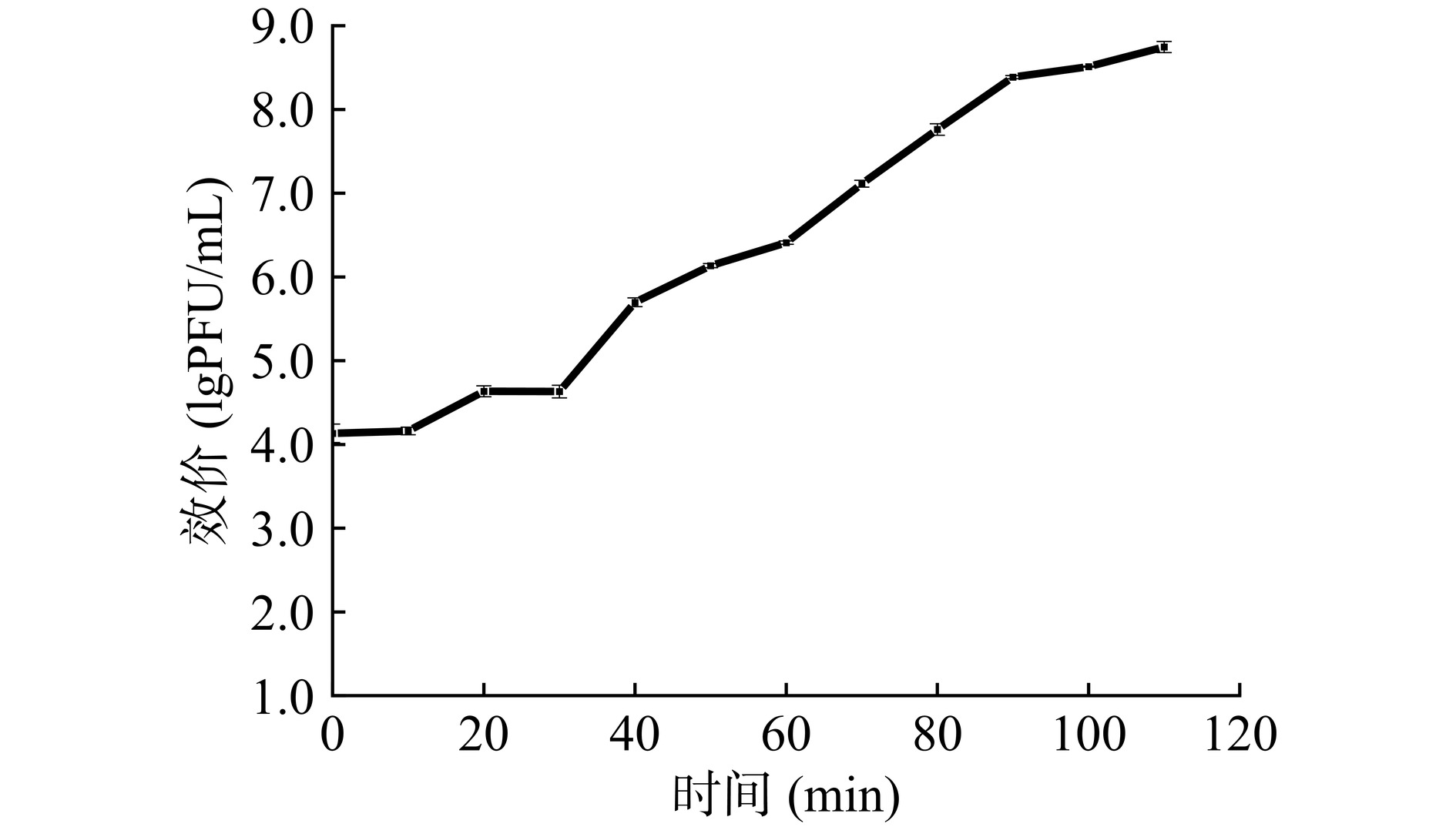
以培养时间为横坐标,以反应体系中噬菌体效价的对数为纵坐标绘制噬菌体的一步生长曲线。如图3所示,噬菌体474x1的潜伏期为10 min,裂解期为10~90 min,裂解末期噬菌体效价达到8.81 lgPFU/mL,裂解量为115 PFU/cell。
2.5 副溶血弧菌噬菌体474x1热稳定性和pH稳定性
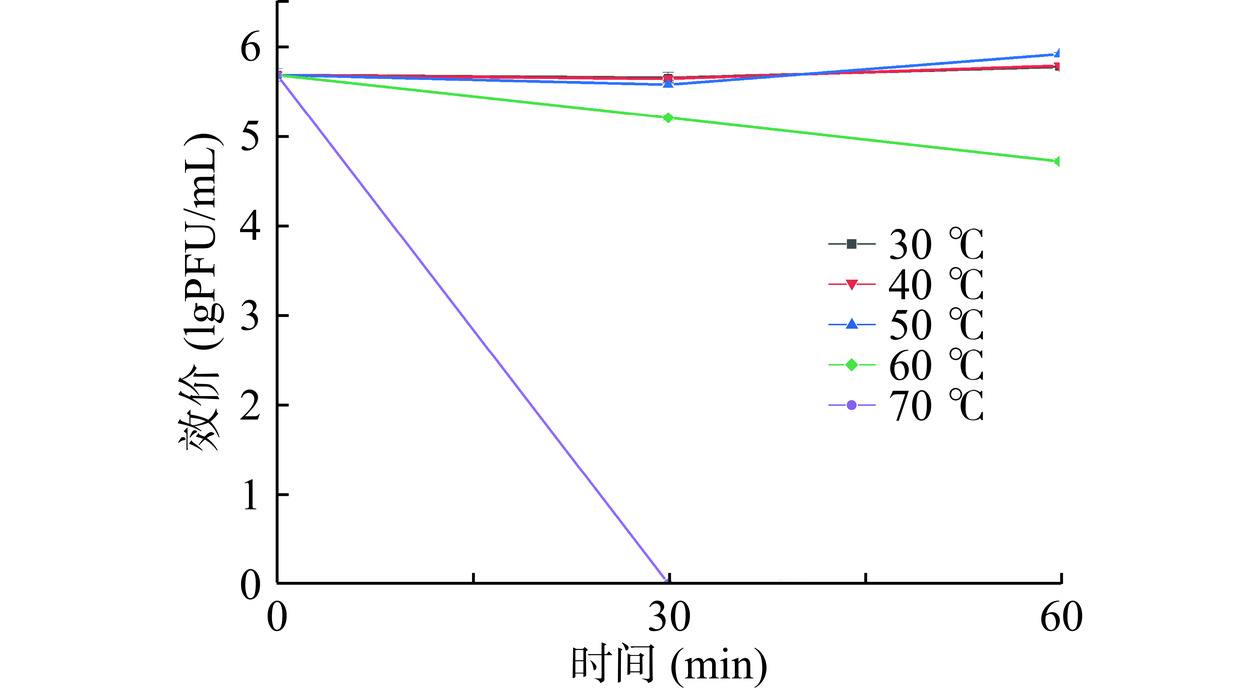
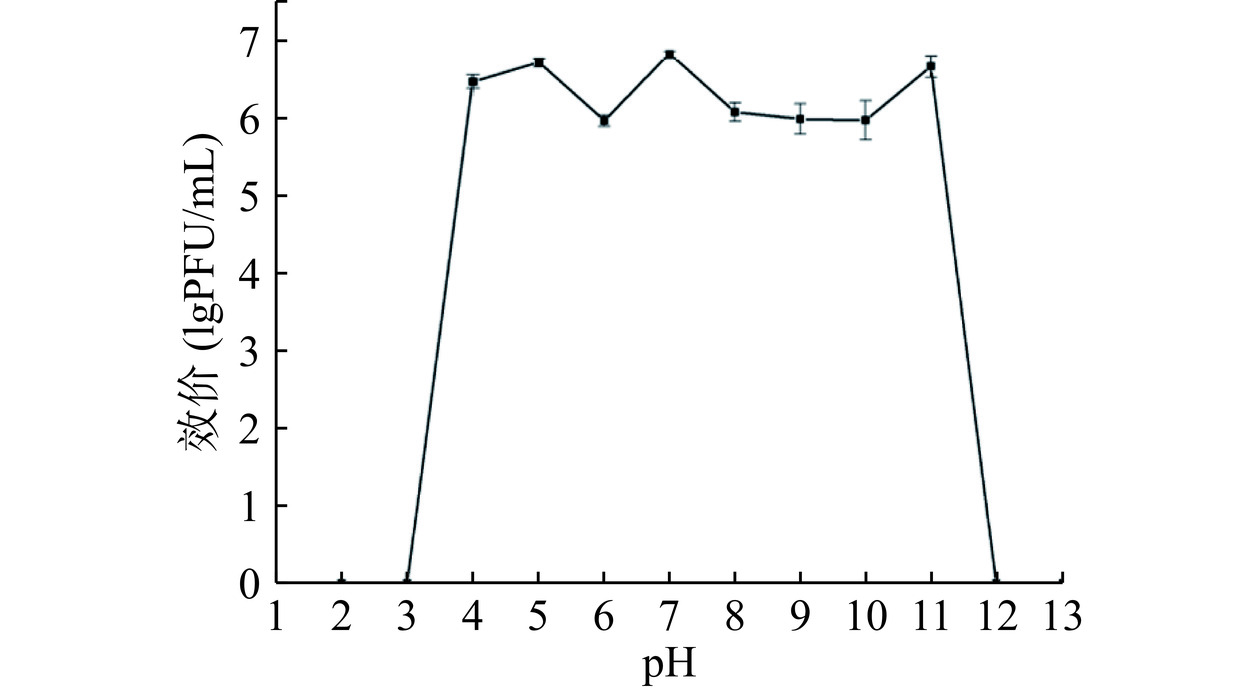
噬菌体对温度的敏感性如图4所示,474x1在30~50 ℃的范围内活性稳定,70 ℃时其活性迅速下降,30 min被完全灭活;60 ℃孵育1 h后效价可减少1个数量级。474x1的效价在pH4~11之间均较稳定,但pH>11和pH<4条件下孵育2 h后活性丧失(图5)。
2.6 副溶血弧菌噬菌体474x1全基因组DNA的提取
使用苯酚-氯仿法提取了噬菌体474x1全基因组DNA,用超微量分光光度计测定提取的噬菌体474x1 DNA终浓度为220 ng/mL且OD260/280为1.88,说明提取出的DNA浓度适宜且含有的杂质较少,满足测序要求。
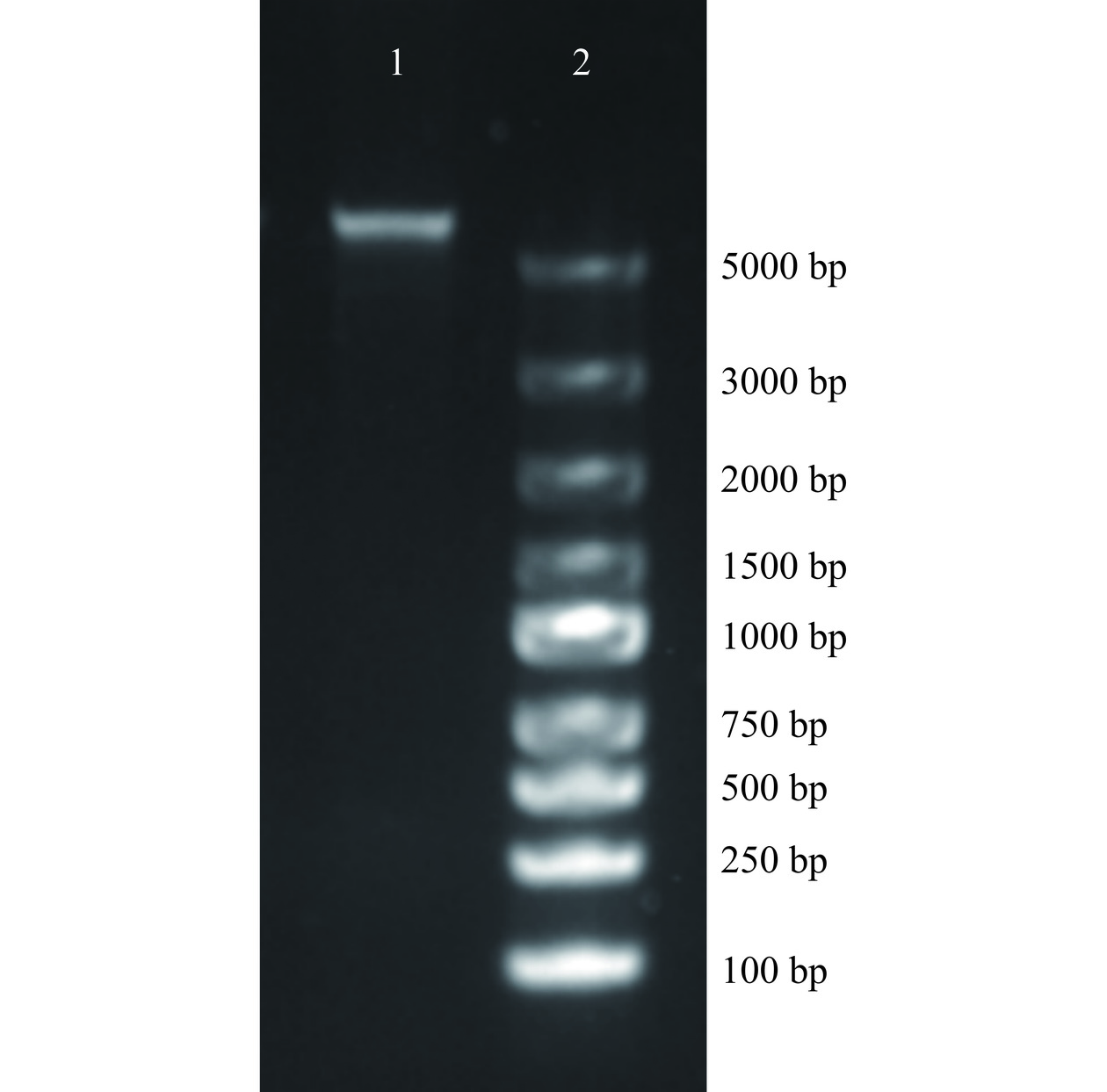
噬菌体474x1DNA进行琼脂糖凝胶电泳结果如图6所示,可以发现DNA电泳条带单一无其它条带,且DNA分子量较大,说明完整地提取出了噬菌体474x1的基因组DNA。
2.7 副溶血弧菌噬菌体474x1全基因组分析
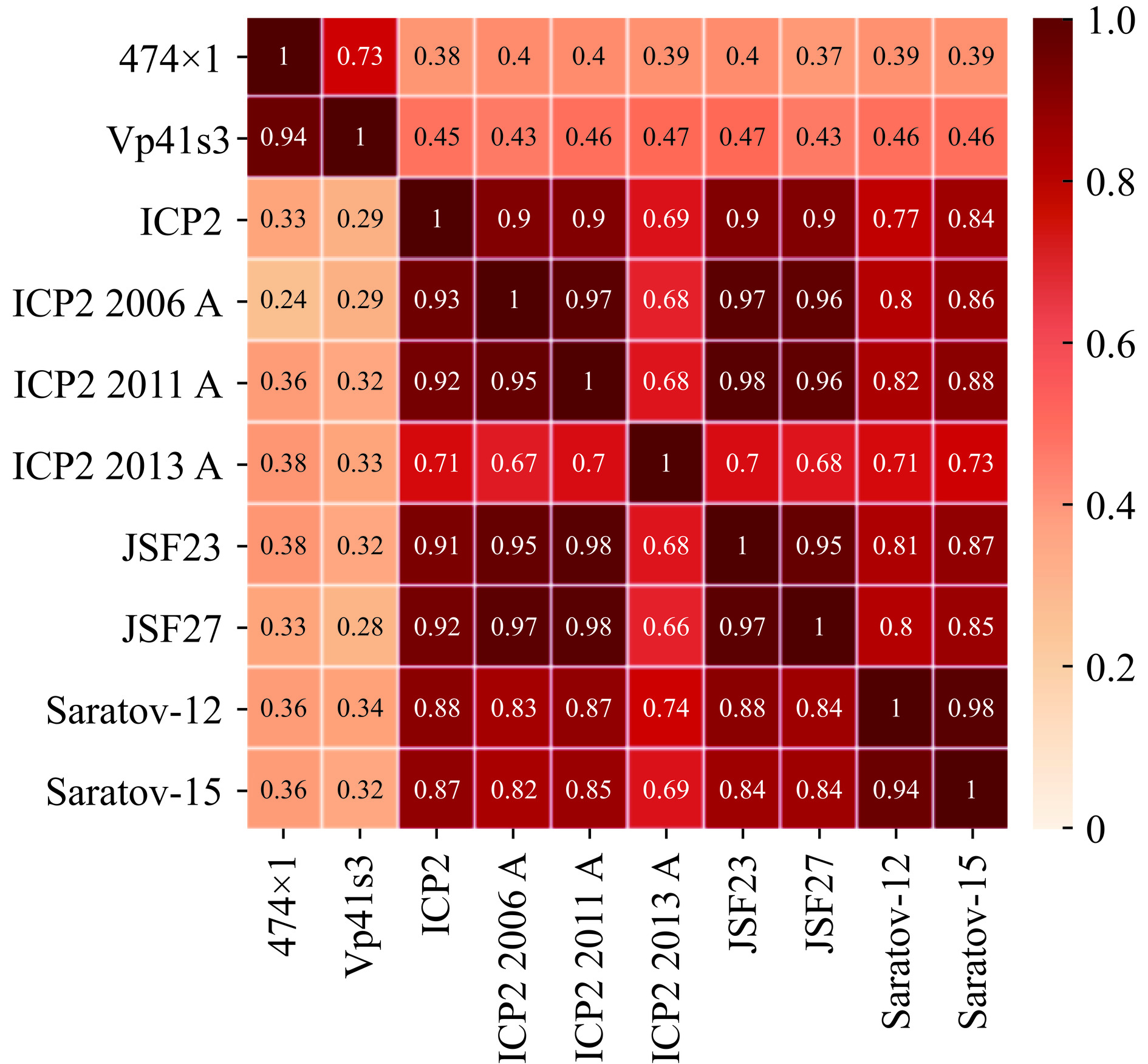
噬菌体474x1的基因组长度为47830 bp,碱基分布情况为A(30.42%)、T(29.16%)、C(20.45%)、G(19.96%),GC平均含量为40.41%。噬菌体474x1全基因组序列BLASTn比较结果显示,噬菌体474x1与副溶血弧菌噬菌体Vp41s3(索引号:MZ073369.1)有较高的同源性,同源性99.06%,覆盖率为77%。但与其他弧菌噬菌体同源性均小于80%,如与霍乱弧菌噬菌体ICP2(索引号:HQ641345.1)同源性为78.55%,与创伤弧菌噬菌体Saratov-15(索引号:MT767883.1)同源性为78.45%。ANI热图显示474x1与副溶血弧菌噬菌体Vp41s3同源性最高(同一性×覆盖率=73%),但与其他噬菌体基因组同源性均小于50%(图7)。
2.8 副溶血弧菌噬菌体474x1基因组功能基因注释
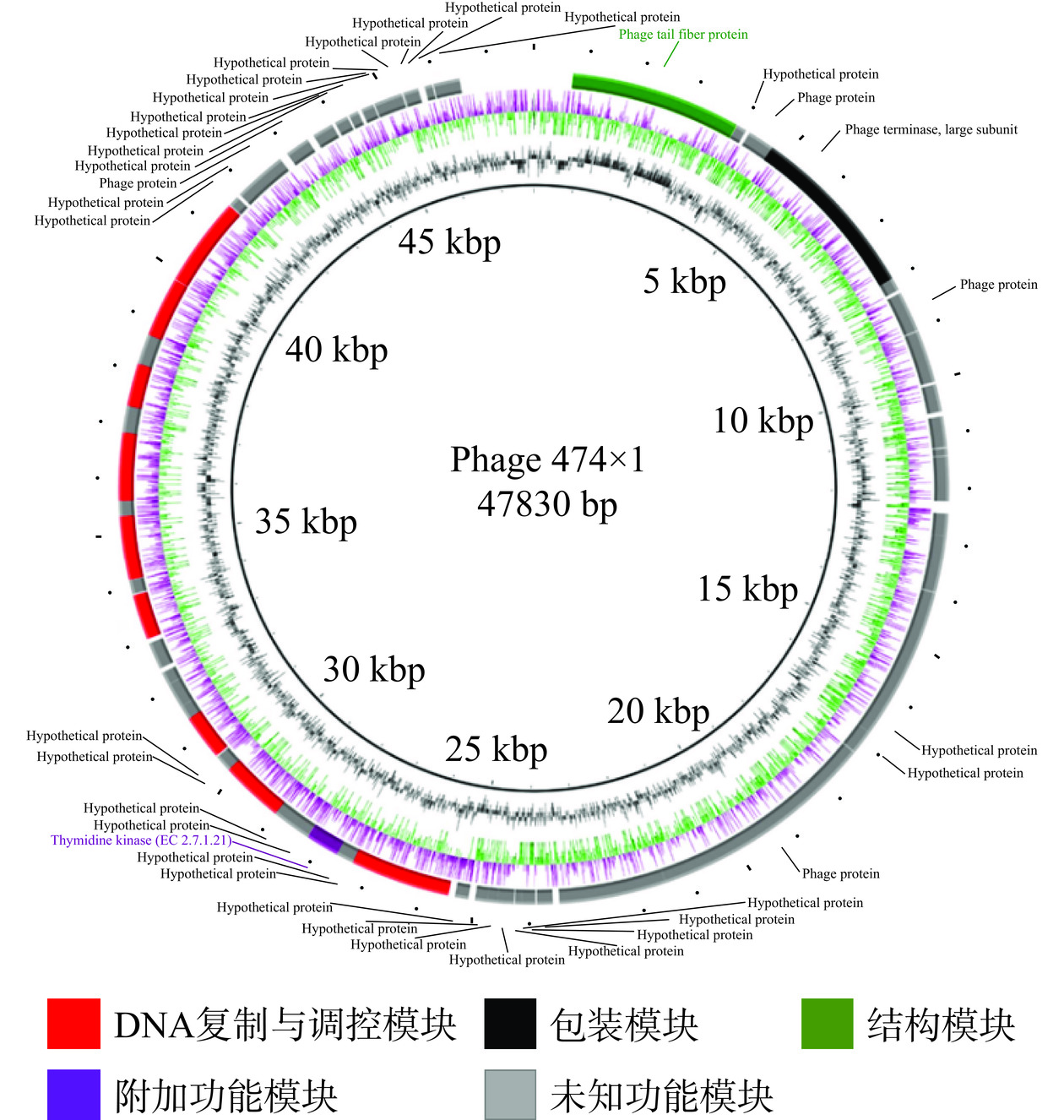
使用RAST在线注释工具进行功能基因注释。结果显示,噬菌体474x1基因组共有69个开放阅读框(open reading frame,ORFs),其中有24个ORFs位于正链上,45个ORFs位于负链上。基因组长度为47830 bp,最长的ORFs为4245 bp,最短的仅126 bp,平均长度643 bp。ORFs总长为44376 bp,占全长的92.78%。经BLAST比对,推测出的69个ORFs中有14个ORFs已确定功能。通过这些特征基因功能将其分为4个模块,包括DNA复制与调控模块(ORF29、ORF35、ORF36、ORF39、ORF45、ORF47、ORF49、ORF51、ORF54、ORF55)、DNA包装模块(ORF4、ORF5)、结构模块(ORF1)、附加功能模块(ORF32)。除了这14个具有特定功能的基因外,其他的ORFs都为假定蛋白,约占79.71%,其基因组图谱如图8所示。采用tRNAscan-SE筛查全基因组中无tRNA基因,表明474x1依赖宿主翻译。通过VFDB数据库和CARD数据库预测噬菌体474x1基因组不含毒力基因与抗生素抗性基因。因此,该结果表明噬菌体474x1应用于食源性致病菌防控的安全性。
2.9 副溶血弧菌噬菌体474x1进化树分析
基于噬菌体474x1ORF4末端酶大亚基构建的系统发育进化树如图9所示,副溶血弧菌噬菌体474x1与副溶血弧菌噬菌体Vp41s3(短尾噬菌体)在同一个进化分支上,另外与霍乱弧菌噬菌体ICP2,创伤弧菌噬菌体Saratov-12、Saratov-15形成一簇,有着很近的亲缘关系。
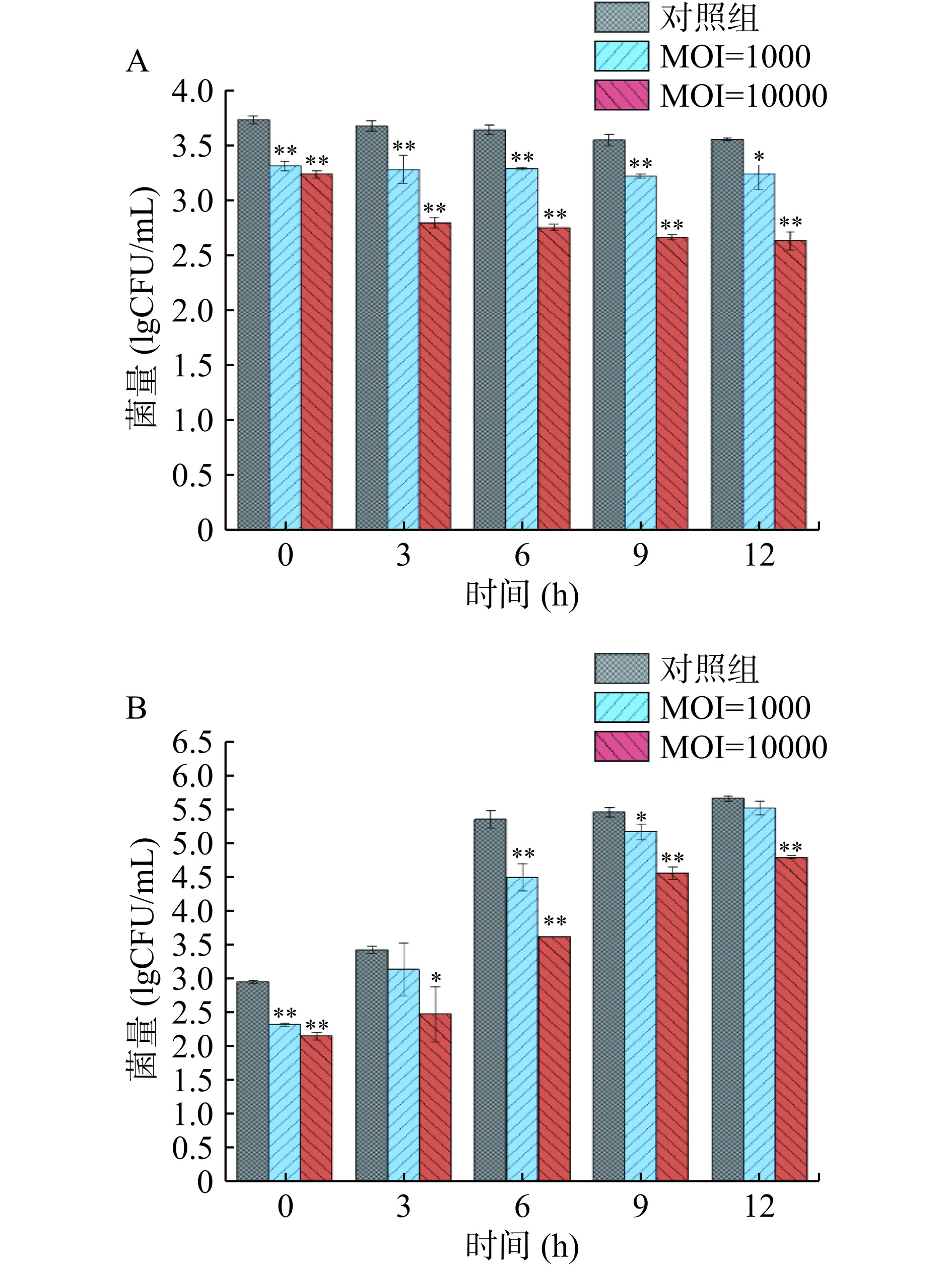
2.10 噬菌体对基围虾中副溶血性弧菌的抑制作用
虾肉在4 ℃放置12 h,副溶血弧菌浓度变化如图10A所示。在放置期间,接种5 lgCFU/mL细菌的对照组菌量没有明显增长,从第0 h的3.73 lgCFU/mL下降到第12 h的3.55 lgCFU/mL。实验组的菌量相比于对照组在12 h内均有明显下降,具有统计学差异(P<0.05),MOI=1000实验组在第3 h相较对照组菌量下降了0.39 lgCFU/mL,MOI=10000实验组在第12 h相较对照组菌量下降了0.92 lgCFU/mL,具有极显著性差异(P<0.01)。
虾肉在25 ℃放置12 h,副溶血弧菌浓度变化如图10B所示。在放置期间,接种5 lgCFU/mL细菌的对照组菌量呈稳步增长的趋势,在第12 h增长到5.66 lgCFU/mL。实验组的菌量相比于对照组在12 h内均有明显下降,MOI=1000实验组在第6 h相较对照组菌量下降了1.04 lgCFU/mL,MOI=10000在第6 h相较对照组菌量下降了1.82 lgCFU/mL,具有极显著性差异(P<0.01)。
3. 讨论与结论
目前,国内已有学者相继分离出副溶血弧菌烈性噬菌体,丁云娟等[11]从水产品市场的污水中分离出来一株烈性噬菌体qdvp001,彭勇等[12]从青岛岸边海水中分离出两株副溶血弧菌噬菌体VPp2、VPp3。本实验室周敏等[13]从海鲜内脏、污水中分离出一株烈性噬菌体F23s1。本实验也从基围虾样品中分离出宽谱噬菌体474x1,对研发生物抑菌剂有重要价值。
本研究中,宿主谱的结果表明474x1能够裂解23株耐药副溶血弧菌中的19株,表现出较宽的裂解谱范围,宿主谱的差异可能是由于细菌细胞表面存在的受体的差异影响了噬菌体的吸附[14]。此外,噬菌体吸附具有高度特异性,这也意味着噬菌体对其他细菌是无害的,特别是那些有益的菌群。这也表明,474x1可以在未来用于防治特定的细菌性疾病,如弧菌病。
MOI指的是噬菌体与宿主菌的比率。不同的噬菌体感染和杀灭细菌的方式不同,因此具有不同的最佳MOI。例如两株副溶血性弧菌裂解噬菌体VB_VPS_BA3和VB_VPS_CA8,最佳MOI为0.1[15]。Ibrahim等[16]对一株能够裂解溶藻弧菌、哈维氏弧菌和副溶血弧菌的烈性噬菌体PhVh6测定的最佳MOI为1。在本研究中,噬菌体增殖的最佳MOI为0.01,表明以较低数量噬菌体感染宿主菌时,最终能获得高效价的噬菌体,在生产中可用较低的成本得到大量噬菌体。
研究噬菌体的一步生长曲线可以发现噬菌体的生长规律[17]。挑选出潜伏期短裂解量大的噬菌体,对提高工业生产有巨大意义。474x1的潜伏期与噬菌体VppYZU92[5]相似,后者的潜伏期较短为10 min,裂解量为35 PFU/cell。另一株噬菌体VppYZU64的潜伏期较长为35 min,但裂解量为150 PFU/cell[5]。在本研究中,474x1的潜伏期较短且裂解量偏大,为10 min和115 PFU/cell,十分适合规模化制备。
在各种胁迫条件下对噬菌体效价稳定性的测定结果有助于为噬菌体在细菌控制中的应用提供参考[18−19]。在本研究中,测定了噬菌体对温度和pH的抵抗力,以确定这些噬菌体对副溶血性弧菌感染的生防效果。温度是影响噬菌体存活的一个重要因素[20]。它在噬菌体的附着、穿透和增殖过程中起着重要作用[21]。在本研究中,474x1在50 ℃下稳定,在60 ℃孵育1 h后效价下降,在70 ℃以上30 min后完全失活,当应用于食品粗加工环境中时,它仍然可以存活。此外,环境的酸碱度会影响噬菌体的稳定性[19]。据报道,低pH影响噬菌体聚集,降低其在细菌细胞上的吸附能力[22]。474x1在较宽的pH范围保持高效价,与vap04相似[23]。
本实验选择了2种贮藏温度,其中,4 ℃代表保藏温度,25 ℃代表室温。4 ℃下副溶血弧菌菌量均低于25 ℃下同一时间点菌量,这可能是因为低温会抑制副溶血弧菌的生长。随着贮藏时间的延长,25 ℃下MOI=1000和MOI=10000实验组中的菌量均明显下降,在第12 h时实验组中副溶血性弧菌数量分别比对照组降低0.18、0.87 lgCFU/mL,说明噬菌体474x1能够显著(P<0.01)抑制宿主菌的生长,但不能完全杀灭副溶血弧菌。高璐[23]在噬菌体对鱼汁的抑菌实验中,三株噬菌体Vmp03、Vpp07、Vap04在鱼汁分别对其宿主菌均有一定的抑制能力。在25 ℃条件下,经过Vmp03处理后的实验组相较对照组的菌量在第8 h下降约2 lgCFU/mL;经过Vpp07、Vap04处理后的实验组相较对照组的菌量在第6 h下降约1 lgCFU/mL。本实验在25 ℃下MOI=1000,MOI=10000的实验组相较对照组在第6 h时菌量分别下降1.04、1.82 lgCFU/mL,抑菌效果和高璐的研究相似。
综上所述,474x1是一株新的副溶血性弧菌噬菌体。该噬菌体裂解谱宽、裂解量大、潜伏期短。它在高温下失活,但在60 ℃以下表现出较好的稳定性,能耐受宽范围的pH,在食品中也有良好的抑菌效果,由于缺乏抗生素抗性基因和毒力基因,474x1在不久后将会用来防控水产品副溶血性弧菌。
-
表 1 副溶血弧菌噬菌体474x1宿主谱
Table 1 Host range of V. parahaemolyticus phage 474x1
序号 菌株种类 菌株编号 耐药性 裂解能力 1 副溶血弧菌 ATCC17802 CHL,AMP,AMC − 2 副溶血弧菌 ATCC33846 CHL,AMP,AMC,CXM + 3 副溶血弧菌 F6 CHL,AMP,AMC + 4 副溶血弧菌 F7 CHL,AMP,AMC + 5 副溶血弧菌 F22 CHL,AMP,AMC + 6 副溶血弧菌 F23 CHL,AMP,AMC + 7 副溶血弧菌 Vp27 CHL,AMP,AMC + 8 副溶血弧菌 Vp33 CHL,AMP,AMC − 9 副溶血弧菌 Vp41 CHL,AMP,AMC,NAL + 10 副溶血弧菌 Vp44 CHL,AMP,AMC,CXM − 11 副溶血弧菌 460 CHL,AMP,AMC,CXM + 12 副溶血弧菌 461 CHL,AMP,AMC,CXM + 13 副溶血弧菌 469 CHL,AMP,AMC,KAN + 14 副溶血弧菌 470 CHL,AMP,AMC + 15 副溶血弧菌 474 CHL,AMP,AMC + 16 副溶血弧菌 475 CHL,AMP,AMC + 17 副溶血弧菌 485 CHL,AMP,AMC + 18 副溶血弧菌 486 CHL,AMP,AMC + 19 副溶血弧菌 O56 CHL,AMP,AMC + 20 副溶血弧菌 O514 CHL,AMP,AMC − 21 副溶血弧菌 H128 CHL,AMP,AMC,CIP,NAL + 22 副溶血弧菌 H256 CHL,AMP,AMC,CIP,NAL + 23 副溶血弧菌 H512 CHL,AMP,AMC,CIP,NAL + 注:+代表副溶血弧菌噬菌体474x1能够裂解该细菌,−代表副溶血弧菌噬菌体474x1不能够裂解该细菌;CHL(氯霉素);AMP(氨苄西林);AMC(阿莫西林);CXM(头孢辛夫);CZO(头孢唑林);KAN(卡那霉素);NAL(萘啶酸);CIP(环丙沙星)。 表 2 副溶血弧菌噬菌体474x1的最佳感染复数
Table 2 Multiplicity of infection of V. parahaemolyticus phage 474x1
MOI 初始噬菌体效价
(lgPFU/mL)初始宿主菌浓度
(lgCFU/mL)噬菌体最终效价
(lgPFU/mL)0.001 5 8 8 0.01 5 7 9.66 0.1 5 6 9.61 1 5 5 9.07 10 5 4 8.20 100 5 3 8.07 1000 5 2 7.04 -
[1] HAN N, MIZAN M F R, JAHID I K, et al. Biofilm formation by Vibrio parahaemolyticus on food and food contact surfaces increases with rise in temperature[J]. Food Control,2016,70:161−166. doi: 10.1016/j.foodcont.2016.05.054
[2] 刘秀梅, 陈艳, 王晓英, 等. 1992~2001年食源性疾病暴发资料分析-国家食源性疾病监测网[J]. 卫生研究,2004,33:725−727. [LIU Xiumei, CHEN Yan, WANG Xiaoying, et al. Analysis of foodborne disease outbreak data in 1992~2001 National Foodborne Disease Surveillance Network[J]. Health Research,2004,33:725−727.] doi: 10.3969/j.issn.1000-8020.2004.06.025 LIU Xiumei, CHEN Yan, WANG Xiaoying, et al. Analysis of foodborne disease outbreak data in 1992~2001 National Foodborne Disease Surveillance Network[J]. Health Research, 2004, 33: 725−727. doi: 10.3969/j.issn.1000-8020.2004.06.025
[3] LEE L H, AB MUTALIB N S, LAW J W, et al. Discovery on antibiotic resistance patterns of Vibrio parahaemolyticus in selangor reveals carbapenemase producing Vibrio parahaemolyticus in marine and freshwaterfish[J]. Frontiers in Microbiology,2018,9:2513. doi: 10.3389/fmicb.2018.02513
[4] 袁琳, 张昭寰, 崔泽林, 等. 副溶血性弧菌噬菌体的分离及其在即食虾中的应用[J]. 食品工业科技,2014,35(21):175−178. [YUAN Lin, ZHANG Zhaohuan, CUI Zelin, et al. Isolation of bacteriophages of Vibrio parahaemolyticus and its application in ready-to-eat shrimp[J]. Science and Technology of Food Industry,2014,35(21):175−178.] doi: 10.13386/j.issn1002-0306.2014.21.030 YUAN Lin, ZHANG Zhaohuan, CUI Zelin, et al. Isolation of bacteriophages of Vibrio parahaemolyticus and its application in ready-to-eat shrimp[J]. Science and Technology of Food Industry, 2014, 35(21): 175−178. doi: 10.13386/j.issn1002-0306.2014.21.030
[5] 郑小双, 高璐, 张辉, 等. 副溶血性弧菌广谱裂解性噬菌体的筛选及其在海产品安全控制中的应用[J]. 食品科学,2019,40(10):141−148. [ZHENG Xiaoshuang, GAO Lu, ZHANG Hui, et al. Screening of broad-spectrum lytic bacteriophages of Vibrio parahaemolyticus and its application in seafood safety control[J]. Food Science,2019,40(10):141−148.] doi: 10.7506/spkx1002-6630-20180621-405 ZHENG Xiaoshuang, GAO Lu, ZHANG Hui, et al. Screening of broad-spectrum lytic bacteriophages of Vibrio parahaemolyticus and its application in seafood safety control[J]. Food Science, 2019, 40(10): 141−148. doi: 10.7506/spkx1002-6630-20180621-405
[6] 罗梓丹, 耿尚, 韩光丽, 等. 一株新型牛源肺炎克雷伯菌噬菌体的分离鉴定[J]. 微生物学通报,2021,9:3184−3193. [LUO Zidan, GENG Shang, HAN Guangli, et al. Isolation and identification of a novel strain of Klebsiella pneumoniae bacteriophage[J]. Microbiology China,2021,9:3184−3193.] doi: 10.13344/j.microbiol.china.201216 LUO Zidan, GENG Shang, HAN Guangli, et al. Isolation and identification of a novel strain of Klebsiella pneumoniae bacteriophage[J]. Microbiology China, 2021, 9: 3184−3193. doi: 10.13344/j.microbiol.china.201216
[7] RAMIREZ-OROZCO M, SERRANO-PINTO V, OCHOA-ÁLVAREZ N, et al. Genome sequence analysis of the Vibrio parahaemolyticus lytic bacteriophage VPMS1[J]. Archives of Virology,2013,158(11):2409−2413. doi: 10.1007/s00705-013-1726-3
[8] MINH D H, MINH S H, HONJOH K I, et al. Isolation and biocontrol of extended spectrum beta-lactamase (ESBL) producing Escherichia coli contamination in raw chicken meat by using lytic bacteriophages[J]. LWT-Food Science and Technology,2016,71:339−346. doi: 10.1016/j.lwt.2016.04.013
[9] 周政, 李敏. 介绍一种高效、简单的DNA沉淀法[J]. 生命的化学,1999(1):32. [ZHOU Zheng, LI Min. Introduction of an efficient and simple DNA precipitation method[J]. Chemistry of Life,1999(1):32.] doi: 10.3969/j.issn.1000-1336.1999.01.012 ZHOU Zheng, LI Min. Introduction of an efficient and simple DNA precipitation method[J]. Chemistry of Life, 1999(1): 32. doi: 10.3969/j.issn.1000-1336.1999.01.012
[10] 葛强. 广西猪源奇异变形杆菌的耐药分析及一株奇异变形杆菌噬菌体的分离鉴定与初步应用[D]. 南宁:广西大学, 2021. [GE Qiang. Drug resistance analysis of Proteus mirabilis of Guangxi pig origin and isolation and identification and preliminary application of a strain of Proteus mirabilis bacteriophage[D]. Nanning:Guangxi University, 2021.] GE Qiang. Drug resistance analysis of Proteus mirabilis of Guangxi pig origin and isolation and identification and preliminary application of a strain of Proteus mirabilis bacteriophage[D]. Nanning: Guangxi University, 2021.
[11] 丁云娟, 彭勇, 林洪, 等. 一株副溶血弧菌噬菌体的分离鉴定及生理特性[J]. 微生物学通报,2011,38(11):1639−1646. [DING Yunjuan, PENG Yong, LIN Hong, et al. Isolation and identification and physiological characteristics of a bacteriophage of Vibrio parahaemolyticus[J]. Microbiology China,2011,38(11):1639−1646.] doi: 10.13344/j.microbiol.china.2011.11.004 DING Yunjuan, PENG Yong, LIN Hong, et al. Isolation and identification and physiological characteristics of a bacteriophage of Vibrio parahaemolyticus[J]. Microbiology China, 2011, 38(11): 1639−1646. doi: 10.13344/j.microbiol.china.2011.11.004
[12] 彭勇, 王静雪, 丁云娟, 等. 两株副溶血弧菌噬菌体的分离鉴定及裂解性能[J]. 水产科学,2012,31(11):645−650. [PENG Yong, WANG Jingxue, DING Yunjuan, et al. Isolation, identification and lysis performance of two V. parahaemolytic bacteriophages[J]. Fisheries Science,2012,31(11):645−650.] doi: 10.3969/j.issn.1003-1111.2012.11.003 PENG Yong, WANG Jingxue, DING Yunjuan, et al. Isolation, identification and lysis performance of two V. parahaemolytic bacteriophages[J]. Fisheries Science, 2012, 31(11): 645−650. doi: 10.3969/j.issn.1003-1111.2012.11.003
[13] 周敏, 杨后继, 夏海, 等. 一种副溶血弧菌裂解酶、其编码基因及其应用[P]. 湖北省:CN112813058B, 2022-03-08. [ZHOU Min, YANG Houji, XIA Hai, et al. Coding gene and application of a Vibrio parahaemolyticus lyase[P]. Hubei Province:CN112813058B, 2022-03-08.] ZHOU Min, YANG Houji, XIA Hai, et al. Coding gene and application of a Vibrio parahaemolyticus lyase[P]. Hubei Province: CN112813058B, 2022-03-08.
[14] RAKHUBA D V, KOLOMIETS E I, SZWAJCER D E Y, et al. Bacteriophage receptors, mechanisms of phage adsorption and penetration into host cell[J]. Microbiol,2010,59(3):145−155.
[15] YANG M, LIANG Y, HUANG S, et al. Isolation and characterization of the novel phages vB_VpS_BA3 and vB_VpS_CA8 for lysing Vibrio parahaemolyticus[J]. Frontiers in Microbiology,2020,11:259. doi: 10.3389/fmicb.2020.00259
[16] IBRAHIM W W, AZNAN A S, SAARI N A, et al. In vitro characterization of lytic bacteriophage PhVh6 as potential biocontrol agent against pathogenic Vibrio harveyi[J]. Aquacult, Aquar, Conserv Legis,2017,10:64−76.
[17] 付汉清. 对虾养殖源弧菌噬菌体的分离、鉴定及其全基因组学研究[D]. 厦门:集美大学, 2018. [FU Hanqing. Isolation and identification of Vibrio bacteriophages from shrimp culture and their whole genome research[D]. Xiamen:Jimei University, 2018.] FU Hanqing. Isolation and identification of Vibrio bacteriophages from shrimp culture and their whole genome research[D]. Xiamen: Jimei University, 2018.
[18] LEE H S, CHOI S, SHIN H, et al. Vibrio vulnificus bacteriophage SSP002 as a possible biocontrol agent[J]. Applied and Environmental Microbiology,2014,80(2):515. doi: 10.1128/AEM.02675-13
[19] KRASOWSKA A, BIEGALSKA A, AUGUSTYNIAK D, et al. Isolation and characterization of phages infecting Bacillus subtilis[J]. Biomed Research International, 2015, 179597.
[20] OLSON M R, AXLER E P, HICKS R E. Effect of freezing and storage temperature on MS2 viability[J]. Journal of Virological Methods,2004,122:147−152. doi: 10.1016/j.jviromet.2004.08.010
[21] JONCZYK E, KłAK M, MIĘDZYBRODZKI R, et al. The influence of external factors on bacteriophages-review[J]. Folia Microbiologica,2011,56(3):191−200. doi: 10.1007/s12223-011-0039-8
[22] LANGLET J, GABORIAUD F, GANTZER C. Effect of pH on plaque forming unit counts and aggregation of MS2 bacteriophage[J]. Journal of Applied Microbiology,2007,103:1632−1638. doi: 10.1111/j.1365-2672.2007.03396.x
[23] 高璐. 水产品中弧菌污染、胁迫响应及其噬菌体靶向抑菌研究[D]. 扬州:扬州大学, 2019. [GAO Lu. Study onVibrio contamination, stress response and phage targeted bacteriostatic in aquatic products[D]. Yangzhou:Yangzhou University, 2019.] GAO Lu. Study on Vibrio contamination, stress response and phage targeted bacteriostatic in aquatic products[D]. Yangzhou: Yangzhou University, 2019.
-
期刊类型引用(1)
1. 谢丹莹,贾超祥,杨晨,张赛宇,刘一,李和平,郭爽,王月影. 1株蜡样芽孢杆菌噬菌体的分离与生物学特性分析. 黑龙江畜牧兽医. 2024(24): 71-75+140 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:

 下载:
下载:



