Components, Processing Characteristics and Aroma of Xinjiang Qiamagu (Brassica rapa L.) Powder Prepared by Different Drying Methods
-
摘要: 恰玛古粉是恰玛古常见的加工产品形式,可做为药食兼用的产品或半成品。为了解不同干燥方法所制恰玛古粉品质的差异,以生长在新疆帕米尔高原的恰玛古为原料,采用自然晾晒、冷风干燥、热风干燥、真空干燥和冷冻干燥五种干燥方式干燥恰玛古,经过粉碎制得恰玛古粉,对恰玛古粉的主要营养成分、物理特性和加工特性进行分析测定,并采用电子鼻和GC-MS对恰玛古粉的香气成分进行了分析。结果表明,冷冻干燥对恰玛古粉中各营养成分的保存较完整,其中VC和蛋白质含量相比其他保留最多,冷风干燥次之;冷冻干燥组L*为90.31,粉体色泽最好,呈乳白色,冷冻干燥对恰玛古色泽的影响最小,冷风干燥次之;冷冻干燥所制得的恰玛古粉溶解度相对最低,为0.055 g/g,相比其他干燥方式,冻融稳定性也较好,为0.068%;其中所含有的香气成分种类和相对含量最多,冷风干燥次之;故而冷冻干燥对恰玛古风味物质有较好的保留。综上,冷冻干燥可作为生产高质量恰玛古粉的首选干燥方式;考虑到加工生产成本方面,冷风干燥可作为一种较优干燥方式备选。Abstract: Qiamagu (Brassica rapa L) is a plant that can be used both as an edible and medicinal plant. Qiamagu powder is a common form of processed product, which can be used as an ingredient in direct edible products or other products. In order to understand the influence of different drying methods on the quality of Qiamagu powder, this paper took Qiamagu produced in Pamir Plateau of Xinjiang as raw material, and used five drying methods: Natural drying (ND), cold air drying (CD), hot air drying (HD), vacuum drying (VD) and freeze-drying (FD) to dry Qiamagu slices, and then mashed them to Qiamagu powder. The main nutritional components, physical properties and processing characteristics of Qiamagu powder were analyzed and tested. The aroma components of the powder were analyzed by electronic nose and GC-MS. The results showed that the FD powder maintained completely all nutrient components of Qiamagu, especially VC and protein content, followed by CD powder. The color of FD powder was milky white with brightness L* being 90.31. The browning of FD powder was the least, followed by CD powder. The solubility of FD powder was the lowest (0.055 g/g), and its stability was good (0.068%). The types and relative contents of aroma components in FD powder were the most, followed by CD powder. Therefore, FD had better retention of the Qiamagu flavor. In summary, FD could be used as the preferred drying method for producing high-quality Qiamagu powder. Considering the cost of industrial production, CD could be used as a better alternative drying method.
-
Keywords:
- Qiamagu (Brassica rapa L) powder /
- drying methods /
- components /
- processing characteristics /
- aroma
-
恰玛古(Brassica rapa L.)学名芜菁或蔓菁,系维吾尔文名称[1]。恰玛古是十字花科芸苔属,两年生草本植物,是世界上最古老的栽培蔬菜之一[2]。恰玛古外形酷似扁型萝卜,个头较小,呈白色,药食同源,营养丰富。恰玛古在我国新疆种植广泛,是新疆人民喜爱的并有较长食用历史的药食同源植物[3]。恰玛古主要含有多糖、黄酮、硫代葡萄糖苷类和脂肪酸等化合物,不仅具有降血糖[4]、增强免疫[5]、抗辐射[6]、抗癌[7]、抗菌、抑制甲状腺素合成[8]、抗突变[9]、抗衰老的作用[10],而且还具有抗缺氧[5]、清热解毒[7]和缓解疲劳的作用[11]。
目前国内外对于恰玛古的研究多集中于功能成分含量的测定及其提取工艺的优化、恰玛古复合果蔬汁的研究[12]、抗氧化多糖片剂的制备[13]和提取功能性物质[14]的工艺优化[15]以及脆片品质[16],也有对其根汁和叶汁、极性部位水提物、种子等功能成分方面的研究。
新鲜的恰玛古散发着芥辣味,且采后在常温环境中容易失水,不便长途运输。对恰玛古进行(脱水)干燥处理、改善风味是近些年的研究方向,然而对于恰玛古粉方面的研究工作尚未见报道。因此恰玛古粉加工将成为恰玛古加工的主要方向。本研究对产自新疆帕米尔高原的恰玛古,采用5种干燥方式进行干燥,然后制成恰玛古粉,对所得的恰玛古粉的品质进行较为全面的对比分析,以期揭示上述干燥方法对恰玛古干燥品质的影响规律,为优化恰玛古粉的加工提供理论依据,为恰玛古资源的合理利用提供参考。
1. 材料与方法
1.1 材料与仪器
恰玛古 新疆喀什市塔什库尔干县种植户,选取新鲜采摘的带叶且大小匀称的鲜恰玛古;氯化钠、柠檬酸、蔗糖、硝酸、异抗坏血酸钠、考马斯亮蓝G250等 均为分析纯,国药集团化学试剂有限公司。
YCFZD-2A冷风干燥机 杭州文门特有限公司;DHG-9053A电热恒温干燥箱 上海喆钛机械制造有限公司;DZF-6020真空干燥箱 上海齐欣科学仪器有限公司;ALPHR1-2LD plus冷冻干燥机 德国Christ公司;5810R多功能离心机 齐楠欧莱伯电子商务有限公司;UDKl52全自动凯氏定氮仪 意大利VELP公司;550PD马弗炉 美国VULCAN公司;SuperNose电子鼻 上海瑞芬智能科技有限公司;QP2010气相色谱质谱联用仪 日本岛津公司;100 µm聚二甲基硅氧萃取头 美国Supelc公司;手动顶空固相微萃取进样器 美国珀金-埃尔默公司。
1.2 实验方法
1.2.1 恰玛古干燥前处理
取新鲜恰玛古,洗净泥土,去皮,切分薄厚为0.5 mm。
1.2.2 干燥工艺
自然晾晒:放置于室外阳面进行昼夜连续晾干,气温30 ℃,昼夜温差为3 ℃,空气湿度13%~25%,无持续风向,风力:一级,风速:11 km/h;冷风干燥:设定箱内温度为37 ℃,箱内湿度为20%,温差为2 ℃,风速为自动;热风干燥:烘箱温度设定为55 ℃;真空干燥:真空度为0.08 MPa,烘箱温度为55 ℃;冷冻干燥:冷阱温度−45~−40 ℃,真空度不高于70 Pa。以上均干制到恰玛古切片的含水率降至安全含水率(5%,wb)。
1.2.3 恰玛古粉基本营养成分的测定
水分含量测定:参照GB 5009.3-2016《食品中水分的测定》;蛋白质含量测定:参照GB 5009.5-2010《食品安全国家标准食品中蛋白质的测定》;淀粉含量测定:参照GB 5009.9-2016《食品中淀粉的测定》;总糖含量测定:参照王联珠等[17]的方法;灰分的测定:参照GB 5009-2010《食品中灰分的测定》高温灼烧法;VC含量测定:参照赵晓梅等[18]的方法;可溶性膳食纤维(SDF)和不溶性膳食纤维(IDF)含量的测定:参照GB 5009.88-2008《食品中膳食纤维的测定》以及Prosky等[19]的方法。
1.2.4 恰玛古粉物理特性的测定
1.2.4.1 色泽的测定
测量恰玛古粉样品的L*、a*和b*。色差结果以ΔE表示,采用式(1)计算。ΔE值表示在干燥过程中恰玛古粉的颜色变化。ΔE值越小,表明恰玛古粉的色泽变化程度越小。
ΔE=√ΔL*2+Δa*2+Δb*2 (1) 1.2.4.2 堆积密度测定
参照陈启聪等[20]的测定方法。将恰玛古粉装入10 mL量筒(m1)中,振实至粉体填充至量筒刻度,称量恰玛古粉和量筒的总质量m2(g)。恰玛古粉的堆积密度(d0)表示为10 mL恰玛古粉的质量,采用式(2)计算。
d0(g/mL)=m2−m110 (2) 式中:m1为容量瓶的质量,g;m2为恰玛古粉和容量瓶的总质量,g。
1.2.4.3 复水性的测定
参照Kim等[21]的方法,采用式(3)计算。
复水性(%)=M2−M1M1×100 (3) 式中:M1和M2分别为恰玛古粉复水前和复水后的质量,g。
1.2.4.4 分散性的测定
参照刘钊等[22]的方法。精密称取1.25 g恰玛古粉置于100 mL烧杯中,加入50 mL蒸馏水,放于恒温磁力搅拌器中,温度设置为25 ℃,转速设置为40 r/min,从开始到全部溶解的时间(s)即为恰玛古粉的分散性。
1.2.4.5 湿润下沉性的测定
参照侯小桢等[23]的方法。取5 g恰玛古粉,均匀分散于50 mL蒸馏水的水面上,记录恰玛古粉全部湿润下沉的时间(s)。
1.2.4.6 吸湿性的测定
吸湿性(%)=Δm/(m+mi)1+mi/m×100 (4) 式中:Δm为恰玛古粉质量的变化量,g;m为恰玛古粉的初始质量,g;mi为恰玛古粉放进干燥器前的水分含量,g。
1.2.4.7 流动性的测定
参照薛雪萍[27]的方法。将一个漏斗垂直固定在铁架台上,使漏斗嘴距桌面高度为10 cm,在桌面铺一张洁净的白纸,取50 g恰玛古粉从漏斗加入,测定恰玛古粉在白纸上形成锥形的底部直径。
1.2.5 恰玛古粉加工特性的测定
1.2.5.1 持水性测定
参照Singh等[28]的方法,采用式(5)计算。
持水能力=M2−(M1+M)20M (5) 式中:M为恰玛古粉的质量,g;M1为离心管质量,g;M2为恰玛古粉和离心管的总质量,g。
1.2.5.2 持油性测定
参照文献[29]的方法,采用式(6)计算。
持油能力=M2−(M1+M)20M (6) 式中:M为恰玛古粉的质量,g;M1为离心管质量,g;M2为恰玛古粉和离心管的总质量,g。
1.2.5.3 溶解度的测定
与Iwuoha[30]的方法一致,采用式(7)计算。
溶解度=V×0.5×[(M3−M2)/M1]×100 (7) 式中:M1为恰玛古粉的质量,g;V为上清液体积,mL;M2为恒重的铝盒质量,g;M3为干燥至恒重的恰玛古粉和铝盒的总质量,g。
1.2.5.4 乳化性和乳化稳定性的测定
与Elkhalifa等[31]的方法一致,分别采用式(8)和(9)计算。
乳化性(%)=H1H2×100 (8) 乳化性稳定性(%)=H3H4×100 (9) 式中:H1为离心后乳化层高度;H2为离心后总高度;H3为水浴后乳化层高度;H4为水浴后总高度。
1.2.5.5 冻融稳定性
同Badin等[32]的方法一致,用冻融析水率来反映试样冻融稳定性的高低。采用式(10)计算。
冻融析水率(%)=(m2−m3)(m2−m1)×100 (10) 式中:m1离心管质量,g;m2未冻结样品的离心析出物质量(带离心管)质量,g;m3冻融样品的离心析出物质量(带离心管)质量,g;
1.2.6 恰玛古粉香气成分的测定
1.2.6.1 电子鼻测定方法
电子鼻采用 Airsense Analytical Software软件控制仪器并处理数据;稳定性分析仪的数据采用Origin 2022作图。取适量不同干燥方式处理下的恰玛古粉置于电子鼻的试样瓶中,加盖密封,待仪器启动预热后,采用顶空取样进行风味测试,PEN3 电子鼻传感器敏感物质如表1所示,每组样品平行测三次。
表 1 PEN3电子鼻传感器敏感物质Table 1. Sensitive materials of PEN3 electronic nose sensor编号 传感器 敏感物质 S1 W1C 芳烃化合物 S2 W5S 氮氧化物 S3 W3C 氨、芳香分子 S4 W6S 氢化物 S5 W5C 烯烃、芳族、极性分子 S6 W1S 烷类 S7 W1W 硫化合物 S8 W2S 检测醇,部分芳香族化合物 S9 W2W 芳烃化合物,硫的有机化合物 S10 W3S 烷类和脂肪族 1.2.6.2 顶空固相微萃取-气相色谱-质谱联用测定方法
取0.3 g恰玛古粉于顶空瓶中,70 ℃恒温水浴条件下顶空萃取40 min,解析5 min。
GC条件:DB-5MS色谱柱;升温程序:60 ℃保持2 min,以10 min 内升至150 ℃,保持2 min,由150 ℃升至230 ℃,用时4 min;进样口温度230 ℃;采用不分流方式进样。
MS条件:电子能量70 eV;离子源温度230 ℃;全扫描模式。
通过检索和查阅,用峰面积归一化法计算所得不同样品中的香气成分的相对含量。
1.3 数据处理
所有试验均重复三次,采用IBM SPSS Statistics 19.0软件对实验所得数据进行ANOVA(LSD)差异显著性分析(P<0.05)以及香气成分的相对含量的分析,使用Origin 2022版软件进行雷达图绘制。
2. 结果与分析
2.1 干燥方式对恰玛古粉基本营养成分的影响
恰玛古粉的基本营养成分以及各组分的含量是研发恰玛古加工品和估算其食用价值的依据。本研究测定分析了以下五组恰玛古粉的基本营养成分,结果如表2。
表 2 恰玛古粉的基本营养成分Table 2. Basic nutrients of Qiamagu (Brassica rapa L.) powder干燥方式 水分含量
(g/100 g)总糖含量
(g/100 g)淀粉含量
(g/100 g)蛋白质含量
(g/100 g)SDF含量
(g/100 g)IDF含量
(g/100 g)抗坏血酸含量
(mg/100 g)灰分含量
(g/100 g)自然晾晒 4.53±0.42c 45.4±0.76c 6.28±0.52c 1.34±0.04b 1.1±0.06b 5.86±0.08a 0.25±0.07b 3.45±0.01b 冷风干燥 3.64±0.22a 49.4±0.14a 6.98±0.50a 1.45±0.02a 1.1±0.04b 7.22±0.06b 0.32±0.05a 3.67±0.02a 热风干燥 3.93±0.15a 47.7±0.53b 6.78±0.49b 1.33±0.01b 1.1±0.03a 7.61±0.01b 0.23±0.04c 3.12±0.05c 真空干燥 4.13±0.38b 48.1±0.35a 6.82±0.51a 1.32±0.04c 1.1±0.05b 7.56±0.07b 0.26±0.06b 3.15±0.05c 冷冻干燥 2.93±0.17a 48.3±0.23a 7.38±0.49a 1.47±0.03a 1.1±0.03a 6.62±0.05a 0.39±0.04a 3.77±0.04a 注:a表示与自然晾晒比较,P<0.05;b表示与冷风干燥比较,P<0.05;c表示与热风干燥比较,P<0.05;d表示与真空干燥比较,P<0.05,表3~表4同。 表2的结果显示,5组恰玛古粉的水分含量均低于5%,达到了安全贮藏条件,其中冷冻干燥所制得的恰玛古粉水分含量仅为2.93%,低于其他组,而自然晾晒所制得的恰玛古粉含水量临界安全贮藏含水量,因此经自然晾晒干燥方式所制得的恰玛古粉不利于贮藏。冷风干燥组产品总糖含量较高于其他组,自然晾晒组总糖含量最低。冷冻干燥组的恰玛古粉淀粉含量最高,高于其他组,而自然晾晒组淀粉含量最低。冷冻干燥组和冷风干燥组蛋白质含量均高于其他组,二者在蛋白质含量方面相差不大。冷冻干燥组中抗坏血酸含量最高,冷风干燥组仅次之,自然晾晒和真空干燥对抗坏血酸的影响较大,但二者相比相差不大;热风干燥组抗坏血酸的含量最少。抗坏血酸对温度和氧气较为敏感,在较高温度和氧气浓度中易发生变化,故而不同干燥方式下恰玛古粉抗坏血酸含量的差异与其干燥过程中温度、氧含量和持续干燥时间有关。真空干燥和热风干真空干燥组和热风干燥组的恰玛古粉灰分含量较低,考虑到可能与二者干燥过程温度较高有关。总体而言,冷冻干燥对于各营养成分的保存都较好,尤其是对于抗坏血酸的保留;分析考虑冷冻干燥过程恰玛古处于低温条件,对恰玛古粉的营养成分保护较好;而冷风干燥条件下的总糖含量最高,对于蛋白质和淀粉的保存也相对较好。表明冷冻干燥可作为制备高质量恰玛古粉的最优干燥方式,考虑到成本投入,冷风干燥为较优干燥方式。
2.2 干燥方式对恰玛古粉色泽的影响
色差是果蔬最重要的性质之一[33]。不同干燥方式处理所制得的恰玛古粉所发生的颜色变化如表3所示。由表3可看出,自然晾晒组恰玛古粉亮度L*最小,为77.81,b*值高于其他组,说明自然晾晒这种干制方式对恰玛古片的色泽影响最大,呈黄褐色,无光泽感。而冷冻干燥组正好相反,L*为90.53,a*值和b*值低于其他组,恰玛古粉颜色最符合新鲜恰玛古的颜色,粉体整体呈现乳白色,鲜亮,有光泽。热风干燥组和真空干燥组的a*值和b*值都高于冷冻干燥组,这可能是因为恰玛古片在高温条件下发生反应而造成产品颜色更为偏红或黄褐色。不同干燥方式下恰玛古粉的色差值∆E,从小到大顺序依次为:冷冻干燥、真空干燥、冷风干燥、热风干燥和自然晾晒。冷冻干燥对恰玛古粉颜色的影响最小,色差值∆E为1.158,推断冷冻干燥通过减少色差来保留抗坏血酸,二者有一定的相关性;真空干燥次之,色差值∆E为4.689,自然晾晒和热风干燥对恰玛古色泽的影响都较大。故冷冻干燥方式下恰玛古粉颜色最接近新鲜恰玛古的颜色,冷冻干燥是对恰玛古粉颜色影响最小的一种干燥方式。自然晾晒所得恰玛古片的∆E值最大,考虑到当地气候干燥,气温较高,但昼夜温差较大,而自然晾晒使物料暴露在外界环境中,在干燥过程中条件不易控制,可能发生了一些反应使产品色泽劣化,自然晾晒产品卫生和质量不易保证,很可能影响后续进一步加工。故而自然晾晒不是一种理想的恰玛古干制方式。
表 3 不同干燥方式恰玛古粉的色差值Table 3. Color deviation of Qiamagu (Brassica rapa L.) made by different drying methods干燥方式 L* a* b* ∆E 自然晾晒 77.81±0.47 2.80±0.06 12.11±0.57 12.31±0.14 冷风干燥 85.28±0.08a 2.71±0.21 10.65±0.65ab 4.808±0.08 热风干燥 84.69±0.61a 2.59±0.21 13.57±0.15ab 7.142±0.42 真空干燥 85.28±0.88a 3.52±0.31abc 8.90±0.66abc 4.689±0.89 冷冻干燥 90.53±1.00abcd 1.05±0.22abcd 8.52±0.29abc 1.158±0.58 F值 216.806 86.213 87.574 P值 <0.001 <0.001 <0.001 2.3 干燥方式对恰玛古粉功能特性的影响
不同干燥方式所制得恰玛古粉的物理特性由表4可知,冷冻干燥组的恰玛古粉堆积密度最大,为0.5694g/mL,而冷风干燥组堆积密度最小,为0.3930 g/mL;冷冻干燥组的复水性最大,高于其他组,为8.84%,而真空干燥组复水性仅为7.55%;考虑到可能与干燥过程中物料所处温度和真空度有关。热风干燥组分散性最大,真空干燥组分散性最小;真空干燥粉润湿下沉性最大,而吸湿性最小,五组粉的吸湿性差异不是很大;真空干燥组的流动性最大,为2.90 cm,自然晾晒组流动性最小,为2.34 cm。
表 4 恰玛古粉的功能特性Table 4. Functional characteristics of Qiamagu (Brassica rapa L.) powder项目 自然晾晒 冷风干燥 热风干燥 真空干燥 冷冻干燥 物理特性 堆积密度(g/mL) 0.4433±0.0727 0.3930±0.1209 0.4142±0.1009 0.4425±0.1344 0.5694±0.0883 复水性(%) 7.64±0.73 7.85±0.44 8.11±0.16 7.55±0.34c 8.84±0.21abcd 分散性(s) 7471.00±74.68 7446.20±59.29 7565.60±73.90ab 7371.20±63.58ac 7454.20±65.69 润湿下沉性(s) 241.40±11.95 203.00±17.90a 224.20±16.77b 250.60±13.28bc 192.80±17.60acd 吸湿性(%) 0.71±0.11 0.72±0.07 0.71±0.10 0.69±0.07 0.72±0.13 流动性(cm) 2.34±0.36 2.45±0.37 2.63±0.30 2.90±0.63 2.76±0.30 加工特性 持水性(g/mL) 0.28±0.06 0.21±0.06 0.26±0.05 0.21±0.08b 0.17±0.10ad 持油性(g/mL) 0.031±0.007 0.034±0.009 0.029±0.007 0.037±0.009 0.035±0.006 溶解度(g/g) 0.081±0.008 0.076±0.005 0.127±0.008ab 0.096±0.010abc 0.055±0.008abcd 乳化性(%) 0.56±0.07 0.54±0.06 0.59±0.07 0.41±0.08abc 0.51±0.08d 乳化稳定性(%) 0.47±0.08 0.45±0.10 0.47±0.10 0.43±0.06 0.44±0.13 冻融析水率(%) 0.072±0.009 0.069±0.016 0.073±0.008 0.075±0.013 0.068±0.009 不同方式干燥的恰玛古粉的加工特性由表4可知,热风干燥和真空干燥方式下得到的恰玛古粉溶解度较高,分别为0.127和0.096 g/g,冷冻干燥溶解度最低,仅为0.055 g/g,其原因可能是真空干燥和热风干燥所制得的恰玛古粉处于较高的温度进行干燥,改变了细胞的结构,使原本细胞中的物质结构遭到破坏,也对淀粉的分子结构产生不同程度的改变,使得游离淀粉较多,故而二者所制得的恰玛古粉的淀粉含量和对应的溶解度也较高,反之冷冻干燥工艺制得的恰玛古粉溶解度较低。恰玛古粉的持水性和持油性存在明显差异,其中冷冻干燥组的持水值最低,为0.035 g/mL;真空干燥组的持油值最高,为0.31 g/mL;真空干燥粉虽然持水值较小,但其持油值最高(0.037 g/mL);冷冻干燥组次之(0.035 g/mL),热风干燥最低(0.029 g/mL)。持油性除了与恰玛古中亲油物质密切相关外,还可能与温度有关,低温可以使恰玛古粉质地疏松、多孔,颗粒空隙变大,而油脂分子相对较大,容易被截堵和滞留。五组恰玛古粉的持油值都很低,可能与恰玛古在干燥加工过程中大分子物质发生变化、蛋白质分子结构发生变化等有关。热风干燥组的乳化性和乳化稳定性分别为0.59%和0.47%,高于其他四种干燥方式,可能是此种干燥工艺改变了恰玛古中相关蛋白质的空间结构和疏水基团。而真空干燥的乳化稳定性为0.43%,原因可能在于温度和真空度的影响。五组恰玛古粉的冻融析水率也有较大差异,热风干燥组与真空干燥组的冻融析水率分别为0.073%和0.075%,冷冻干燥为0.068%,表明冷冻干燥所制得的恰玛古粉冻融稳定性较好,适合于作为冷冻食品辅料配方进行添加。
2.4 对不同干燥方式下所制得的恰玛古粉香气成分的分析
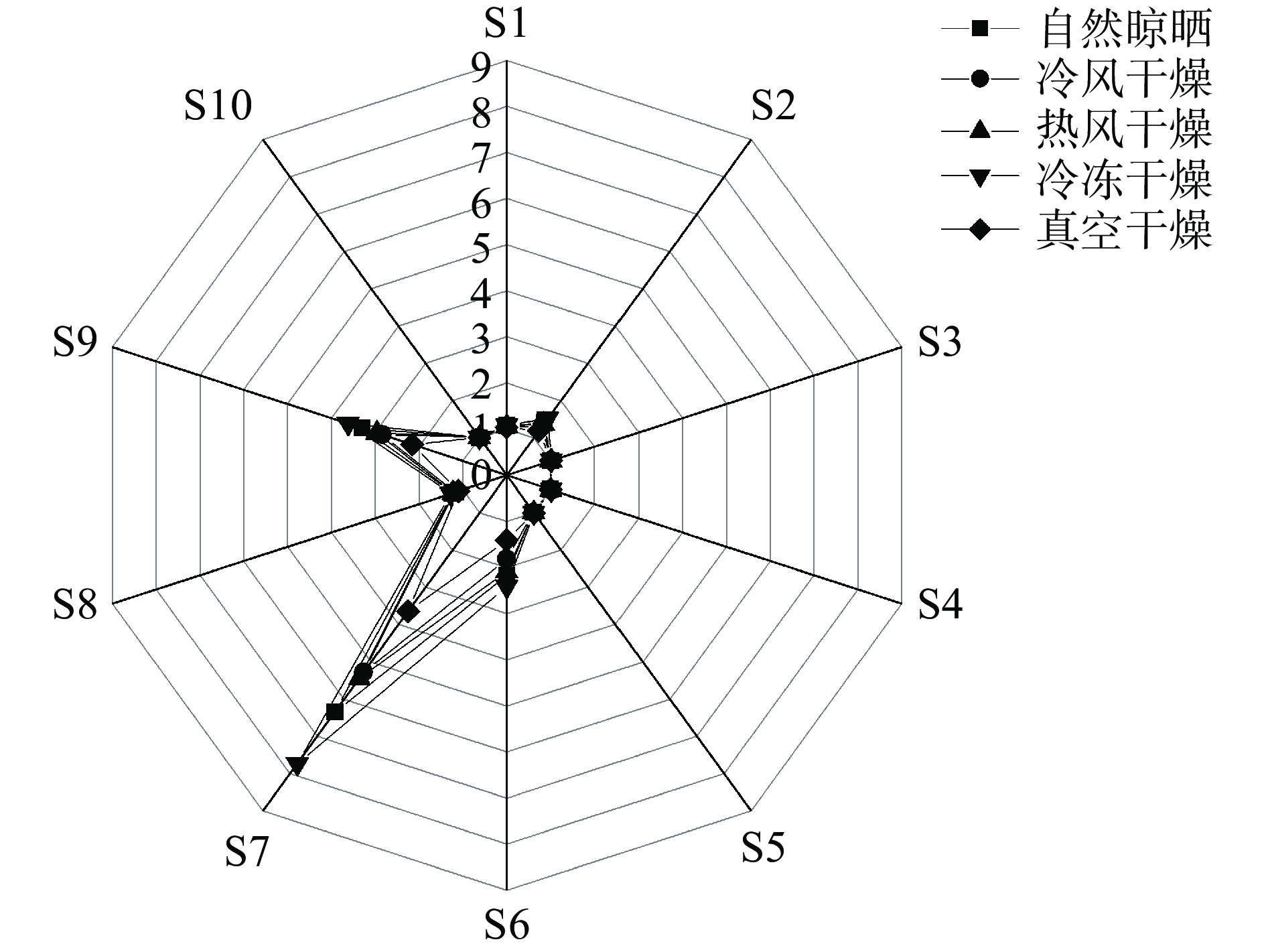
由图1可知,五组样品粉所含香气味成分种类没有明显差异,但编号S7和S9对样品的响应值都较大,表明恰玛古粉中含硫的化合物和芳烃化合物的气味组分浓度较高。其中冷冻干燥组和真空干燥组硫的化合物浓度明显高于其他组。由于电子鼻技术对于各气味组分测定以及定量分析的局限,运用HS-SPME-GC-MS法对上述五种不同干燥方式所制得的恰玛古粉的香气成分进一步检测和分析,计算所得不同样品中的香气成分的相对含量见表5。
表 5 不同干燥方式对恰玛古粉香气成分相对含量的影响Table 5. Effects of different drying methods on the relative contents of aromatic components in Qiamagu (Brassica rapa L.) powder序号 化合物 分子式 相似度 相对含量(%) 自然晾晒 冷风干燥 热风干燥 真空干燥 冷冻干燥 1 1,5-己二烯醇 C6H10O 92 - 1.63 0.21 0.33 2 2,2,4-三甲基-1,3-戊二醇 C8H18O2 90 0.81 1.1 - - 0.27 3 2-乙基己醇 C8H18O 93 - 1.6 - 4.23 0.1 4 2-丁基-辛醇 C12H26O 94 - - - 0.3 - 5 2-乙基-1-癸醇 C12H26O 95 - - - 0.18 - 6 1-(2-甲氧基-1-甲基乙氧基)异丙醇 C7H16O3 96 0.2 - - 0.25 0.88 7 苯乙醇 C8H10O 97 0.04 2.72 2.18 2.98 8.44 醇类小计 0.85 7.05 2.18 8.15 10.02 8 壬醛 C9H18O 95 0.06 6.36 4.25 5.03 3.04 9 反式-2-壬烯醛 C9H16O 86 0.18 0.31 0.51 3.43 - 10 庚醛 C7H14O 90 0.72 1.77 0.47 - 3.44 11 反式-2-壬烯醛 C9H16O 96 0.36 0.71 - 2.21 2.05 12 苯甲醛 C7H6O 87 0.37 - 0.41 - - 13 正辛醛 C8H16O 88 0.65 0.51 0.34 - - 14 苯乙醛 C8H8O 96 0.64 1.38 0.36 1.28 2.21 15 十一醛 C11H22O 94 - 0.23 0.13 0.03 1.12 16 癸醛 C10H20O 86 0.02 1.12 2.11 2.26 3.12 醛类小计 3 12.39 8.47 14.24 13.98 17 三芥子酸甘油酯 C6H11NS 87 - 0.49 - 10.63 6.87 18 2-苯基乙基异硫代氰酸酯 C9H9NS 89 - - - 14.55 0.91 19 异硫氰酸丁酯 C5H9NS 95 0.27 0.14 0.51 0.33 0.19 20 苯甲酸乙基己酯 C15H22O2 95 - 0.27 0.19 - - 21 亚硫酸戊基十三烷基酯 91 3.28 1.11 0.08 2.93 0.44 22 硫代异氰酸环戊酯 C6H9NS 97 1.1 1.15 0.21 0.92 0.02 23 异硫氰酸苯乙酯 C9H9NS 95 0.96 2.25 - 0.45 - 24 甲基膦酸二甲酯 C3H93P 96 0.32 2.33 1.3 - 0.13 25 十八烷基戊基硫酸酯 93 0.27 0.24 1.37 0.91 0.18 26 3-丁烯基异硫氰酸酯 C5H7NS 94 - 15.53 0.67 0.06 2.83 27 2-苯基乙基异硫代氰酸酯 C9H9NS 92 - 1.94 - 8.66 10.02 28 2-苯乙基异氰酸酯 C9H9NO 86 - - - 0.69 - 酯类小计 6.2 25.45 4.33 40.13 21.59 29 5-甲硫基戊腈 C6H11NS 95 5.37 20.91 22.69 21.82 48.86 30 苯代丙腈 C9H9N 89 0.6 9.65 15.44 0.13 14.22 31 5-己腈 C6H9N 93 2.71 2.22 0.52 0.64 0.25 32 6-(甲硫基)己腈 C7H13NS 89 - 4.46 3.44 10.29 - 腈类小计 8.68 37.24 42.11 32.88 69.56 33 正辛基丙基硫醚 C4H10S 86 0.52 0.41 0.78 0.01 0.03 34 二乙二醇单丁醚 C8H18O3 95 0.06 0.42 10.67 5.51 0.18 35 5-(甲基)异硫氰酸 C7H13N2 86 - 0.34 0.29 6.48 0.32 36 2,6,10-三甲基十五烷 C18H38 87 - - - 1.07 0.69 37 十二烷异丙基醚 C15H32O 86 0.29 0.11 0.18 0.35 0.41 38 二乙二醇丁醚 C8H18O3 88 4.13 - 2.68 0.67 8.66 39 正丙基壬基醚 85 0.5 0.27 - 0.06 0.31 醚类小计 5.5 1.55 14.6 14.15 10.6 40 6-氯己基酯-丙戊酸 86 0.32 0.28 - 0.38 41 十二烯基丁二酸酐 C16H26O3 89 0.71 0.29 0.11 - - 42 己酸 C6H12O2 91 0.37 - 0.21 - 0.56 43 棕榈酸;十六酸 C16H32O2 87 0.09 0.28 11.42 - 3.21 44 硬脂酸;十八碳烷酸 C18H36O2 97 3.41 - 1.23 1.14 - 酸类小计 4.9 0.85 12.97 1.14 4.15 45 (E)-1,5-庚二烯 C7H12 94 - 0.25 - - 0.65 46 9-甲氧基-3-壬炔 C10H18O 86 - 0.66 - - 0.76 47 1-(甲硫基)-己烷 C7H16S 89 0.02 - - 0.01 0.33 48 4-甲基十四烷 C15H32 86 0.52 0.79 0.53 0.3 0.15 49 2,6,10-三甲基十三烷 C16H34 86 0.02 0.11 0.3 0.93 0.65 50 2,6,10,14-四甲基-十六烷 C20H42 93 0.01 0.93 0.65 0.52 0.31 51 1-甲醛-1-甲基-3-环己烯 C8H12O 92 - 0.39 - 0.91 0.11 52 1-异硫氰酸-5-(甲硫基)-戊烷 C7H13NS2 94 0.52 - 0.36 0.65 3.35 53 11-(1-乙基丙基)-十二烷 C26H54 89 - 0.21 - - 0.52 54 2-溴十二烷 C12H25Br 85 0.32 0.83 0.03 0.15 0.02 55 2,6,10-三甲基十二烷 C15H32 86 0.2 1.95 - 0.19 0.18 烷烃类小计 1.6 6.12 1.87 3.66 7.03 56 (3E,5E)-辛-3,5-二烯-2-酮 C8H12O 96 - 0.49 - 0.4 0.35 57 2-氧代-1-(4-溴丁基)哌啶酮 C9H16BrNO 85 2.13 1.15 0.57 0.32 0.24 58 4-羟基-α-宁酮 C10H16O2 86 0.32 - - - - 59 N-(4-溴正丁基)-2-哌啶酮 C9H16BrNO 92 - - - 0.62 - 60 左旋香芹酮 C10H14O 89 - - - - 0.15 酮类小计 2.45 1.64 0.57 1.34 0.74 注:“-”表示未检出。 异硫氰酸盐的硫代葡萄糖苷产物在恰玛古中很常见[34],恰玛古中的硫代葡萄糖苷被芥子苷酶促降解可以产生异硫氰酸酯、腈、硫氰酸盐、恶唑烷硫酸盐和烷腈类等多种重要含硫的化合物[35]。芥子苷酶可以从完整的植物组织中的硫代葡萄糖苷中分离出来[36],但是当组织被压碎或者植物内发生自溶时也会释放出来。故而不同加工处理后的恰玛古滋气味也会有所不同[37]。考虑可能干燥方式影响芥子苷酶等多种酶的活性,产生出多种芳香物质,从而赋予了恰玛古粉特殊的气味。由上表可知测出5种干燥方式所制得的恰玛古粉中有60种香气物质,其中包括醇类7种,醛类9种,酯类13种,腈类4种,醚类7种,自然晾晒中含有风味物质42种,冷风干燥含有风味物质49种,热风干燥含有风味物质37种,真空干燥含有风味物质49种,冷冻干燥含有风味物质51种。分析考虑与干燥过程中温度、真空度、氧含量和持续干燥时间有关。自然晾晒中含有的风味物质相对含量为33.18%,冷风干燥中含有的风味物质相对含量为92.29%,热风干燥含有中含有的风味物质相对含量为87.1%,真空干燥中含有的风味物质相对含量为115.68%,冷冻干燥中含有的风味物质相对含量为137.66%。
五种干燥方式下恰玛古粉香气成分含量既有相似性,也有差异性,共同含有26种香气成分,但其含量差异很大,恰玛古粉的主要挥发性物质为腈类和酯类物质,其中5-甲硫基戊腈、苯代丙腈和5-己腈的相对含量居多,五种干燥方式下测得恰玛古粉中含有烷烃类物质种类较多,其中4-甲基十四烷、2,6,10-三甲基十三烷和2-溴十二烷相对含量较多。醇类和醛类物质含量在冷冻干燥和真空干燥中都较高,考虑可能与真空度和低温有关,低温和真空有利于酮类和醛类物质的增加[38];五组恰玛古粉中含有的酮类物质的种类差异较大,其中真空干燥粉检出N-(4-溴正丁基)-2-哌啶酮,而其他组未检出;自然晾晒粉中检出4-羟基-α-宁酮,而其他组未检出;冷冻干燥粉检出左旋香芹酮,而其他组均未检出。对此有待进一步深入而全面的研究分析。综上分析,冷冻干燥所制得的恰玛古粉中的香气成分种类最多,风味物质相对含量也最多;冷冻干燥对恰玛古风味物质有更好的保留。
3. 结论
五组恰玛古粉中的淀粉含量相近,冷冻干燥组中蛋白质和总糖含量最多;真空干燥组和热风干燥组的灰分含量相比较冷冻干燥组低,冷风干燥组的总糖含量最高,对于蛋白质和淀粉的保留仅次于冷冻干燥;冷冻干燥对恰玛古粉颜色的影响最小,热风干燥对粉色泽的影响最大。综合分析,冷冻干燥可以保留较多恰玛古粉基本营养成分,也对恰玛古色泽影响最小。
热风干燥组和真空干燥组的恰玛古粉溶解度较高,冷冻干燥组的持水能力和溶解度都最低,热风干燥组乳化性和乳化稳定性最高,冷冻干燥组的恰玛古粉冻融稳定性较好,可以考虑用于冷冻食品。
运用电子鼻检测后的气味雷达图显示出恰玛古粉中散发出较浓的含硫的化合物的气味,结合气质分析,其中含硫化合物主要2-苯基乙基异硫代氰酸酯、硫代异氰酸环戊酯、异硫氰酸苯乙酯、5-甲硫基戊腈、5-(甲基)异硫氰酸、6-甲硫基己腈和异硫氰酸丁酯等。检测出5种干燥方式所制得的恰玛古粉含有60种香气物质,相比较后得出冷冻干燥含有的香气成分种类最多,风味物质相对含量也最大,冷冻干燥对恰玛古风味物质有更好地保留。
综上所述,冷冻干燥处理的恰玛古粉含水量最低,也能够较完整的保存恰玛古的营养价值,因此冷冻干燥可作为恰玛古粉产品生产上值得推介的干燥方式。考虑到实际生产中成本耗资方面,冷风干燥也不失为恰玛古粉产品生产上值得推广的干燥方式。恰玛古粉的加工有较大的发展创新空间,后期还需进一步研究其他加工和干制方式,以便为恰玛古粉开辟更为合适的加工和干制方式。
-
表 1 PEN3电子鼻传感器敏感物质
Table 1 Sensitive materials of PEN3 electronic nose sensor
编号 传感器 敏感物质 S1 W1C 芳烃化合物 S2 W5S 氮氧化物 S3 W3C 氨、芳香分子 S4 W6S 氢化物 S5 W5C 烯烃、芳族、极性分子 S6 W1S 烷类 S7 W1W 硫化合物 S8 W2S 检测醇,部分芳香族化合物 S9 W2W 芳烃化合物,硫的有机化合物 S10 W3S 烷类和脂肪族 表 2 恰玛古粉的基本营养成分
Table 2 Basic nutrients of Qiamagu (Brassica rapa L.) powder
干燥方式 水分含量
(g/100 g)总糖含量
(g/100 g)淀粉含量
(g/100 g)蛋白质含量
(g/100 g)SDF含量
(g/100 g)IDF含量
(g/100 g)抗坏血酸含量
(mg/100 g)灰分含量
(g/100 g)自然晾晒 4.53±0.42c 45.4±0.76c 6.28±0.52c 1.34±0.04b 1.1±0.06b 5.86±0.08a 0.25±0.07b 3.45±0.01b 冷风干燥 3.64±0.22a 49.4±0.14a 6.98±0.50a 1.45±0.02a 1.1±0.04b 7.22±0.06b 0.32±0.05a 3.67±0.02a 热风干燥 3.93±0.15a 47.7±0.53b 6.78±0.49b 1.33±0.01b 1.1±0.03a 7.61±0.01b 0.23±0.04c 3.12±0.05c 真空干燥 4.13±0.38b 48.1±0.35a 6.82±0.51a 1.32±0.04c 1.1±0.05b 7.56±0.07b 0.26±0.06b 3.15±0.05c 冷冻干燥 2.93±0.17a 48.3±0.23a 7.38±0.49a 1.47±0.03a 1.1±0.03a 6.62±0.05a 0.39±0.04a 3.77±0.04a 注:a表示与自然晾晒比较,P<0.05;b表示与冷风干燥比较,P<0.05;c表示与热风干燥比较,P<0.05;d表示与真空干燥比较,P<0.05,表3~表4同。 表 3 不同干燥方式恰玛古粉的色差值
Table 3 Color deviation of Qiamagu (Brassica rapa L.) made by different drying methods
干燥方式 L* a* b* ∆E 自然晾晒 77.81±0.47 2.80±0.06 12.11±0.57 12.31±0.14 冷风干燥 85.28±0.08a 2.71±0.21 10.65±0.65ab 4.808±0.08 热风干燥 84.69±0.61a 2.59±0.21 13.57±0.15ab 7.142±0.42 真空干燥 85.28±0.88a 3.52±0.31abc 8.90±0.66abc 4.689±0.89 冷冻干燥 90.53±1.00abcd 1.05±0.22abcd 8.52±0.29abc 1.158±0.58 F值 216.806 86.213 87.574 P值 <0.001 <0.001 <0.001 表 4 恰玛古粉的功能特性
Table 4 Functional characteristics of Qiamagu (Brassica rapa L.) powder
项目 自然晾晒 冷风干燥 热风干燥 真空干燥 冷冻干燥 物理特性 堆积密度(g/mL) 0.4433±0.0727 0.3930±0.1209 0.4142±0.1009 0.4425±0.1344 0.5694±0.0883 复水性(%) 7.64±0.73 7.85±0.44 8.11±0.16 7.55±0.34c 8.84±0.21abcd 分散性(s) 7471.00±74.68 7446.20±59.29 7565.60±73.90ab 7371.20±63.58ac 7454.20±65.69 润湿下沉性(s) 241.40±11.95 203.00±17.90a 224.20±16.77b 250.60±13.28bc 192.80±17.60acd 吸湿性(%) 0.71±0.11 0.72±0.07 0.71±0.10 0.69±0.07 0.72±0.13 流动性(cm) 2.34±0.36 2.45±0.37 2.63±0.30 2.90±0.63 2.76±0.30 加工特性 持水性(g/mL) 0.28±0.06 0.21±0.06 0.26±0.05 0.21±0.08b 0.17±0.10ad 持油性(g/mL) 0.031±0.007 0.034±0.009 0.029±0.007 0.037±0.009 0.035±0.006 溶解度(g/g) 0.081±0.008 0.076±0.005 0.127±0.008ab 0.096±0.010abc 0.055±0.008abcd 乳化性(%) 0.56±0.07 0.54±0.06 0.59±0.07 0.41±0.08abc 0.51±0.08d 乳化稳定性(%) 0.47±0.08 0.45±0.10 0.47±0.10 0.43±0.06 0.44±0.13 冻融析水率(%) 0.072±0.009 0.069±0.016 0.073±0.008 0.075±0.013 0.068±0.009 表 5 不同干燥方式对恰玛古粉香气成分相对含量的影响
Table 5 Effects of different drying methods on the relative contents of aromatic components in Qiamagu (Brassica rapa L.) powder
序号 化合物 分子式 相似度 相对含量(%) 自然晾晒 冷风干燥 热风干燥 真空干燥 冷冻干燥 1 1,5-己二烯醇 C6H10O 92 - 1.63 0.21 0.33 2 2,2,4-三甲基-1,3-戊二醇 C8H18O2 90 0.81 1.1 - - 0.27 3 2-乙基己醇 C8H18O 93 - 1.6 - 4.23 0.1 4 2-丁基-辛醇 C12H26O 94 - - - 0.3 - 5 2-乙基-1-癸醇 C12H26O 95 - - - 0.18 - 6 1-(2-甲氧基-1-甲基乙氧基)异丙醇 C7H16O3 96 0.2 - - 0.25 0.88 7 苯乙醇 C8H10O 97 0.04 2.72 2.18 2.98 8.44 醇类小计 0.85 7.05 2.18 8.15 10.02 8 壬醛 C9H18O 95 0.06 6.36 4.25 5.03 3.04 9 反式-2-壬烯醛 C9H16O 86 0.18 0.31 0.51 3.43 - 10 庚醛 C7H14O 90 0.72 1.77 0.47 - 3.44 11 反式-2-壬烯醛 C9H16O 96 0.36 0.71 - 2.21 2.05 12 苯甲醛 C7H6O 87 0.37 - 0.41 - - 13 正辛醛 C8H16O 88 0.65 0.51 0.34 - - 14 苯乙醛 C8H8O 96 0.64 1.38 0.36 1.28 2.21 15 十一醛 C11H22O 94 - 0.23 0.13 0.03 1.12 16 癸醛 C10H20O 86 0.02 1.12 2.11 2.26 3.12 醛类小计 3 12.39 8.47 14.24 13.98 17 三芥子酸甘油酯 C6H11NS 87 - 0.49 - 10.63 6.87 18 2-苯基乙基异硫代氰酸酯 C9H9NS 89 - - - 14.55 0.91 19 异硫氰酸丁酯 C5H9NS 95 0.27 0.14 0.51 0.33 0.19 20 苯甲酸乙基己酯 C15H22O2 95 - 0.27 0.19 - - 21 亚硫酸戊基十三烷基酯 91 3.28 1.11 0.08 2.93 0.44 22 硫代异氰酸环戊酯 C6H9NS 97 1.1 1.15 0.21 0.92 0.02 23 异硫氰酸苯乙酯 C9H9NS 95 0.96 2.25 - 0.45 - 24 甲基膦酸二甲酯 C3H93P 96 0.32 2.33 1.3 - 0.13 25 十八烷基戊基硫酸酯 93 0.27 0.24 1.37 0.91 0.18 26 3-丁烯基异硫氰酸酯 C5H7NS 94 - 15.53 0.67 0.06 2.83 27 2-苯基乙基异硫代氰酸酯 C9H9NS 92 - 1.94 - 8.66 10.02 28 2-苯乙基异氰酸酯 C9H9NO 86 - - - 0.69 - 酯类小计 6.2 25.45 4.33 40.13 21.59 29 5-甲硫基戊腈 C6H11NS 95 5.37 20.91 22.69 21.82 48.86 30 苯代丙腈 C9H9N 89 0.6 9.65 15.44 0.13 14.22 31 5-己腈 C6H9N 93 2.71 2.22 0.52 0.64 0.25 32 6-(甲硫基)己腈 C7H13NS 89 - 4.46 3.44 10.29 - 腈类小计 8.68 37.24 42.11 32.88 69.56 33 正辛基丙基硫醚 C4H10S 86 0.52 0.41 0.78 0.01 0.03 34 二乙二醇单丁醚 C8H18O3 95 0.06 0.42 10.67 5.51 0.18 35 5-(甲基)异硫氰酸 C7H13N2 86 - 0.34 0.29 6.48 0.32 36 2,6,10-三甲基十五烷 C18H38 87 - - - 1.07 0.69 37 十二烷异丙基醚 C15H32O 86 0.29 0.11 0.18 0.35 0.41 38 二乙二醇丁醚 C8H18O3 88 4.13 - 2.68 0.67 8.66 39 正丙基壬基醚 85 0.5 0.27 - 0.06 0.31 醚类小计 5.5 1.55 14.6 14.15 10.6 40 6-氯己基酯-丙戊酸 86 0.32 0.28 - 0.38 41 十二烯基丁二酸酐 C16H26O3 89 0.71 0.29 0.11 - - 42 己酸 C6H12O2 91 0.37 - 0.21 - 0.56 43 棕榈酸;十六酸 C16H32O2 87 0.09 0.28 11.42 - 3.21 44 硬脂酸;十八碳烷酸 C18H36O2 97 3.41 - 1.23 1.14 - 酸类小计 4.9 0.85 12.97 1.14 4.15 45 (E)-1,5-庚二烯 C7H12 94 - 0.25 - - 0.65 46 9-甲氧基-3-壬炔 C10H18O 86 - 0.66 - - 0.76 47 1-(甲硫基)-己烷 C7H16S 89 0.02 - - 0.01 0.33 48 4-甲基十四烷 C15H32 86 0.52 0.79 0.53 0.3 0.15 49 2,6,10-三甲基十三烷 C16H34 86 0.02 0.11 0.3 0.93 0.65 50 2,6,10,14-四甲基-十六烷 C20H42 93 0.01 0.93 0.65 0.52 0.31 51 1-甲醛-1-甲基-3-环己烯 C8H12O 92 - 0.39 - 0.91 0.11 52 1-异硫氰酸-5-(甲硫基)-戊烷 C7H13NS2 94 0.52 - 0.36 0.65 3.35 53 11-(1-乙基丙基)-十二烷 C26H54 89 - 0.21 - - 0.52 54 2-溴十二烷 C12H25Br 85 0.32 0.83 0.03 0.15 0.02 55 2,6,10-三甲基十二烷 C15H32 86 0.2 1.95 - 0.19 0.18 烷烃类小计 1.6 6.12 1.87 3.66 7.03 56 (3E,5E)-辛-3,5-二烯-2-酮 C8H12O 96 - 0.49 - 0.4 0.35 57 2-氧代-1-(4-溴丁基)哌啶酮 C9H16BrNO 85 2.13 1.15 0.57 0.32 0.24 58 4-羟基-α-宁酮 C10H16O2 86 0.32 - - - - 59 N-(4-溴正丁基)-2-哌啶酮 C9H16BrNO 92 - - - 0.62 - 60 左旋香芹酮 C10H14O 89 - - - - 0.15 酮类小计 2.45 1.64 0.57 1.34 0.74 注:“-”表示未检出。 -
[1] 张涛, 安熙强, 程江南, 等. 维药恰玛古的化学成分及生物活性研究进展[J]. 中国药房,2017,28(7):982−986 ZHANG T, AN X Q, CHENG J N, et al. Research progress on chemical composition and biological activity of Brassica rapa[J]. China Pharmacy,2017,28(7):982−986.
[2] LIANG Y S, KIM H K, LEFEBER A W M, et al. Identification of phenylpropanoids in methyl jasmonate treated Brassica rapa leaves using two-dimensional nuclear magnetic resonance spectroscopy[J]. Chromatogr A,2006,1112:148−155. doi: 10.1016/j.chroma.2005.11.114
[3] 王萍, 于新, 陈于陇, 等. 恰玛古食用与药用研究进展[J]. 仲恺农业工程学院学报,2021,34(1):63−70 WANG P, YU X, CHEN Y L, et al. Advances in research on edible and medicinal use of Qiamagu[J]. Journal of Zhongkai University of Agriculture and Engineering,2021,34(1):63−70.
[4] 白颖慧, 鲁碧楠, 庞宗然. 5种药食同源维药防治2型糖尿病研究进展[J]. 天津中医药大学学报,2016,15(6):428−432 BAI Y H, LU B N, PANG Z R. Research progress on prevention and treatment of type 2 diabetes with five kinds of medicine and food homologous drugs[J]. Journal of Tianjin University of Traditional Chinese Medicine,2016,15(6):428−432.
[5] GONG L X, LI J J, LIU Y F, et al. Studies on synergetic effect of Tibet turnip combined with bamboo leaf flavonoid for promoting human being's tolerant ability to hypoxia[J]. Journal of Chinese Institute of Food Science and Technology,2014,14:7−15.
[6] ZHANG Y, TANG W M, NI M, et al. Effects of Tibetan turnip and its processed products on human tolerance to hypoxia[J]. Journal of Chinese Institute of Food Science and Technology,2014,35:178−182.
[7] FERNANDES F, VALENTAO P, SOUSA C, et al. Chemical and antioxidative assessment of dietary turnip ( Brassica rapa var. rapa L. )[J]. Food Chemistry,2007,105:1003−1010. doi: 10.1016/j.foodchem.2007.04.063
[8] NINOMIYA M, EFDI M, INUZUKA T, et al. Chalcone glycosides from aerial parts of Brassica rapa L. ‘hidabeni’, turnip[J]. Phytochemistry Letters,2010,3:96−99. doi: 10.1016/j.phytol.2010.02.004
[9] XIE Y, JIANG S P, SU D H, et al. Composition analysis and anti-hypoxia activity of polysaccharide from Brassica rapa L.[J]. International Journal of Biological Macromolecules,2010,47:528−533.
[10] AGRAWAL A A, KURASHIGE N S, et al. A role for isothiocyanates in plant resistance against the specialist herbivore Pieris rapae[J]. Journal of Chemical Ecology, 2003, 29: 1403–1415.
[11] CHU B Q, CHEN C, LI J J, et al. Effects of Tibetan turnip ( Brassica rapa L.) on promoting hypoxia-tolerance in healthy humans[J]. Journal of Ethnopharmacology,2017,195:246−254.
[12] 尹俊涛, 刘艳怀, 雷勇, 等 . 恰玛古无花果复合果蔬汁工艺[J]. 食品工业,2021 ,42 (12 ):201 −205 .YIN J T, LIU Y H, LEI Y, et al . Processing technology of compound juice made from Brassica rapa L. and Ficus carica L.[J]. Food Industry,2021 ,42 (12 ):201 −205 .[13] 张谦筱, 安熙强, 白利平, 等. 恰玛古多糖的抗氧化功能及其片剂的制备工艺[J]. 食品安全质量检测学报,2017,8(6):2079−2085 ZHANG Q X, AN X Q, BAI L P, et al. Antioxidant function of Brassica rapa L. polysaccharide and processing technology of its tablet[J]. Journal of Food Safety Quality Inspection,2017,8(6):2079−2085.
[14] 孟伊娜, 过利敏, 张谦. 恰玛古脆片不同干燥方式工艺初探[J]. 中国农学通报,2016,32(29):41−52 MENG Y N, GUO L M, ZHANG Q. Different drying conditions of Brassica rapa L. chips[J]. Chinese Agricultural Science Bulletin,2016,32(29):41−52.
[15] 高琦, 李加恒, 韩昊廷, 等. 基于灰色关联分析法研究不同干燥方式对芜菁脆片的影响[J]. 食品科学,2019,40(5):95−101 GAO Q, LI J H, HAN H T, et al. Study on the influence of different drying methods on turnip chips based on grey relational analysis[J]. Food Science,2019,40(5):95−101.
[16] 徐庚, 王庆惠, 马月虹, 等 . 不同干燥工艺对恰玛古制干特性的影响[J]. 新疆农业科学,2019 ,56 (10 ):1869 −1878 .XU G, WANG Q H, MA Y H, et al . Experimental research of the hot drying process of Brassica rapa L.[J]. Xinjiang Agricultural Sciences,2019 ,56 (10 ):1869 −1878 .[17] 王联珠, 李晓庆, 顾晓慧, 等. 干海参外源性总糖的测定方法[J]. 食品科学,2013,34(14):293−297 WANG L Z, LI X Q, GU X H, et al. A method for determination of exogenous total sugar in dried sea cucumber[J]. Food Science,2013,34(14):293−297.
[18] 赵晓梅, 江英, 吴玉鹏, 等. 果蔬中VC含量测定方法的研究[J]. 食品科学,2006,27(3):197−199 ZHAO X M, JIANG Y, WU Y P, et al. Assay research on VC in fruit and vegetable[J]. Food Science,2006,27(3):197−199.
[19] PROSKY L, ASP N G, SCHWEIZER T F, et al. Determination of insoluble, soluble, and total dietary fiber in foods and food products:inter laboratory study[J]. Journal-Association of Official Analytical Chemists,1988,71(5):1017−1023.
[20] 陈启聪, 黄惠华, 王娟, 等. 香蕉粉喷雾干燥工艺优化[J]. 农业工程学报,2010,26(8):331−337 doi: 10.3969/j.issn.1002-6819.2010.08.056 CHEN Q C, HUANG H H, WANG J, et al. Optimization of spray drying technology in processing banana powder[J]. Transactions of the CSAE,2010,26(8):331−337. doi: 10.3969/j.issn.1002-6819.2010.08.056
[21] KIM S H, CHIO Y J, LEE H, et al. Physicochemical properties of jujube powder from air, vacuum, and freeze drying and their correlations[J]. Journal of the Korean Society for Applied Biological Chemistry,2012,55:271−279. doi: 10.1007/s13765-012-1039-3
[22] 刘钊, 黄彬兰. 百香果茶固体饮料的速溶性[J]. 食品工业,2021,42(4):145−149 LIU Z, HUANG B L. The instant dissolution of passion fruit tea solid beverage[J]. Food Industry,2021,42(4):145−149.
[23] 侯小桢, 章斌, 陈添象, 等. 柠檬汁对茶汤及速溶绿茶粉品质的影响[J]. 安徽农业科学,2017,45(6):79−81 HOU X Z, ZHANG B, CHEN T X, et al. Influence of lemon juice on quality of tea infusion and instant green tea powder[J]. Journal of Anhui Agriculture Science,2017,45(6):79−81.
[24] CAI Y Z, CROKE H. Production and propertied of spray-dried Amaranthus betacyanin pigments[J]. Journal of Food Science,2000,65(6):1248−1252.
[25] CAPARINO O A, TANG J, NINDO C I, et al. Effect of drying methods on the physical properties and microstructures of mango ( Philippine ‘ Carabao’ var.) powder[J]. Journal of Food Engineering,2012,11:135−148.
[26] FERRARI C C, GERMER S P M, AGUIRRE J M. Effects of spray-drying conditions on the physicochemical properties of blackberry powder[J]. Drying Technology,2012,30:154−163. doi: 10.1080/07373937.2011.628429
[27] 薛雪萍. HACCP体系在葡萄籽超微粉胶囊生产中的应用[D]. 杨凌:西北农林科技大学, 2007 XUE X P. The application of HACCP system in grape seeds ultrafine-powder capsule processing[D]. Yangling:Northwest A&F University, 2007.
[28] SINGH J, SINGH N, SHARMA T R, et al. Physicochemical, rheological and cookie making properties of corn and potato flours[J]. Food Chemistry,2003,83(3):387−393. doi: 10.1016/S0308-8146(03)00100-6
[29] 沈晓萍, 卢晓黎, 闫志农. 工艺方法对马铃薯粉品质的影响[J]. 食品科学,2004,25(10):108−112 SHEN X P, LU X L, YAN Z N. Effect of different process technology on the quality of potato granules and potato flakes[J]. Food Science,2004,25(10):108−112.
[30] IWUOHA C I. Comparative evaluation of physicochemical qualities of flours from steam-processed yam tubers[J]. Food Chemistry,2004,85(4):541−551. doi: 10.1016/j.foodchem.2003.06.022
[31] ELKHALIFA A E O, SCHIFFLER B, BERNHARDT R. Effect of fermentation on the functional properties of sorghum flour[J]. Food Chemistry,2005,92(1):1−5. doi: 10.1016/j.foodchem.2004.05.058
[32] BADIN E E, ROSSI Y E, MONTENGRO M A, et al. Thermal processing of raspberry pulp:Effect on the color and bioactive compounds[J]. Food and Bioproducts Processing,2020,124:469−477. doi: 10.1016/j.fbp.2020.08.016
[33] JUN G. Newton-Gauss curvature matrix based cDBN for online edible fungus drying prediction model[J]. Future Generation Computer Systems,2018,81:273−279. doi: 10.1016/j.future.2017.10.004
[34] RAHIMI F, RAHMANPOUR S, et al. Archives of phytopathology and plant protection[J]. Archives of Phytopathology and Plant Protection,2013,10:1−14.
[35] BROWN P D, MORRA M J. Glucosinolate-containing plant tissues as bioherbicides[J]. Journal of Agricultural and Food Chemistry,1995,43:3070−3074. doi: 10.1021/jf00060a015
[36] BONES A M, ROSSITEER J T. The myrosinase-glucosinolate system, its organisation and biochemistry[J]. Physiologia Plantarum,1996,97:194−208. doi: 10.1111/j.1399-3054.1996.tb00497.x
[37] MITHEN R. Glucosinolates-biochemistry, genetics and biological activity[J]. Plant Growth Regulation,2001,34:91−103. doi: 10.1023/A:1013330819778
[38] 康志敏, 郭东旭, 何梦影, 等. 不同干燥工艺对鲜玉米粉品质及风味的影响[J]. 食品工业科技,2020,41(18):58−63,69 doi: 10.13386/j.issn1002-0306.2020.18.009 KANG Z M, GUO D X, HE M Y, et al. Effect of different drying methods on the quality and flavor profiles of fresh corn flour[J]. Science and Technology of Food Industry,2020,41(18):58−63,69. doi: 10.13386/j.issn1002-0306.2020.18.009





 下载:
下载:
 下载:
下载:
