Recent Advances in the Separation, Characterization, and Application of Starch Hierarchy
-
摘要: 淀粉是人类饮食的主要组成部分,具有淀粉颗粒、淀粉外壳、淀粉小体、直链淀粉和支链淀粉等丰富的多层级结构,可作为食品加工中多种理想的原料,因此涉及到各个层级结构的分离,而为了能够在合适范围内应用,还需要通过不同表征方法对多层级结构的结构特性进行准确表征。因此,本文对淀粉各层级结构的分离方法和结构表征进行了分析,并介绍了淀粉多层级结构不同的应用范围,以期为淀粉资源的开发和利用提供一定参考。Abstract: Starch is a major component of the human diet and has several hierarchies including granule, shell, blocklet, amylose and amylopectin, which can be used as the raw materials in food processing. In order to be applied in a suitable range, this involves the selection of separation methods and the accurate characterization of the structural properties of each starch hierarchy. Therefore, this paper analyzes the separation and characterization methods for each starch hierarchy, introduces their different applications, and thus provides some references for the development and utilization of starch resources.
-
Keywords:
- starch /
- hierarchies /
- separation /
- characterization /
- application
-
淀粉由于来源广、成本低且可降解,在食品、材料和制药等领域中应用十分广泛[1]。淀粉由复杂的多层级结构组成,其最基本的分子组成单位是直链淀粉和支链淀粉[2],两者通过形成螺旋结构参与小体结构的组成,随后淀粉小体层层堆砌排列形成壳层结构[3-4],淀粉壳层再以同心环方式交替排列,最终构成了完整的淀粉颗粒[5]。然而,淀粉颗粒的致密结构会限制其在工业生产中的应用。因此许多研究通过物理、化学、酶解处理或联合处理的方法,打开淀粉的颗粒结构,制备具有新性能与新用途的改性淀粉或淀粉衍生物[6-7]。例如通过热处理使淀粉颗粒完全糊化而制备淀粉凝胶[8],通过热处理结合酶解法破坏淀粉颗粒的外层结构制备多孔淀粉[9]等。因此,根据淀粉多层级结构特点对其进行层级拆分以提高天然淀粉利用效率的研究已成为新的研究方向。
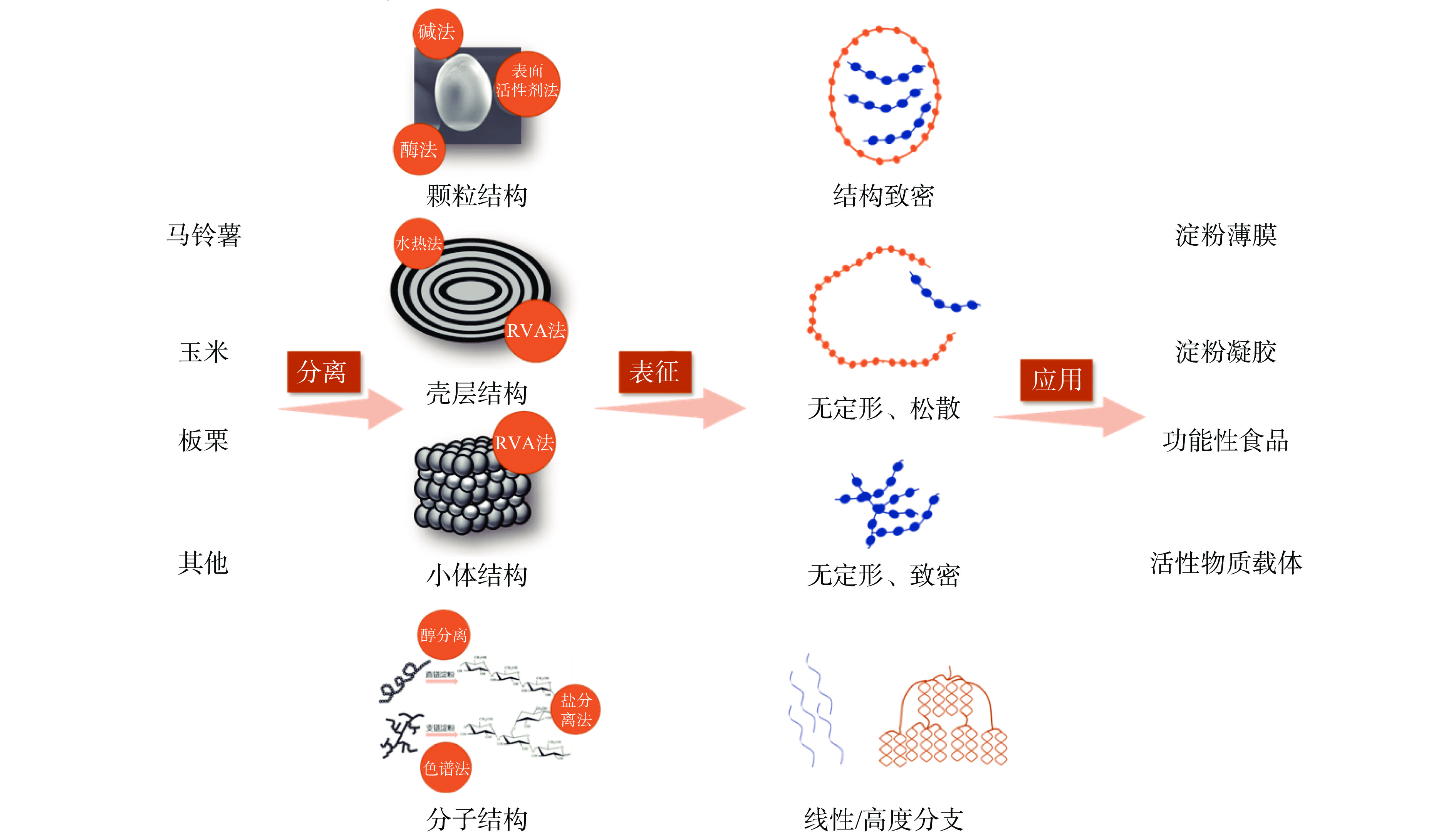
淀粉各层级结构具有鲜明的结构特性,目前已经有许多研究对其分离方法进行了建立,包括淀粉颗粒、淀粉外壳、淀粉小体、直链淀粉和支链淀粉。通过碱液、酶或表面活性剂处理可以分离出不同来源的淀粉颗粒,将其进行糊化处理后能够分离获得淀粉外壳和淀粉小体,也可以通过醇分离、盐分离或色谱法处理获得直链淀粉和支链淀粉。分离获得淀粉各层级结构后,可以从形貌观察、有序结构(长程有序、短程有序和螺旋结构)和精细结构(淀粉链结构)三个方面对淀粉多层级结构的形貌特征和形成机制、结晶区和无定形区比例以及分子量和链长分布进行表征。而根据淀粉各层级结构性质的差异,可以分别将其应用于功能性食品研发、多功能淀粉薄膜制备和风味物质包埋等食品工业生产中,实现天然淀粉的高效利用。
因此,本文从分离方法、结构表征和潜在应用三个方面对淀粉多层级结构的研究进行总结,以期为淀粉材料及淀粉基产品的开发与应用提供理论参考。
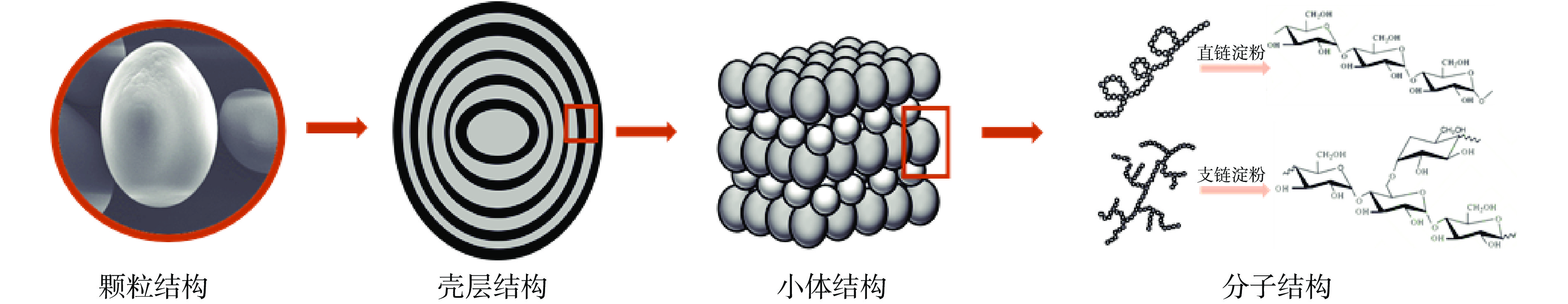
1. 淀粉多层级结构简介
目前可以将淀粉分为四个层级结构进行探究(图1),分别是颗粒、壳层、小体和分子结构[10-11]。天然淀粉主要以颗粒形式存在,不同来源淀粉的颗粒大小和形态存在着明显差异。完整的颗粒结构由交替排列的壳层结构组成,即软壳层和硬壳层[5],软壳层的连接作用导致淀粉颗粒具有一定弹性,硬壳层的存在又能够在一定程度上限制颗粒的膨胀[12]。其中,最外侧的硬壳层(即淀粉外壳)是淀粉颗粒抵御外界环境的第一道屏障,一定程度上决定了淀粉颗粒的性质[13]。
软壳层和硬壳层结构分别由不同尺寸的小体结构组成。作为组成壳层结构的基本单元[3-4],小体结构可以分为“正常小体”和“缺陷小体”,由支链淀粉分子参与构成的“正常小体”直径较小,紧密排列而形成坚硬的外壳层,抵御酸、热等外界条件的破坏;由直链淀粉分子参与构成的“缺陷小体”则主要排列在颗粒内部形成软壳层,并形成了颗粒内部孔洞[11]。不同尺寸的淀粉小体是由直链淀粉和支链淀粉通过螺旋结构组成的[3-4],因此直链淀粉和支链淀粉则是淀粉多层级结构的基础[2]。直链淀粉是主要由葡萄糖脱去水分后通过α-1,4糖苷键形成的线性大分子,而支链淀粉是由α-1,4和α-1,6糖苷键形成的多支链聚合物[7]。
针对以上不同层级的淀粉结构,目前研究已经建立了一系列分离方法,能够获得的淀粉结构包括淀粉颗粒、淀粉外壳、淀粉小体、直链淀粉和支链淀粉。
2. 淀粉不同层级结构的分离
2.1 淀粉颗粒
目前淀粉颗粒的主要分离方法包括碱法、酶法和表面活性剂法,根据不同试剂将与淀粉紧密结合的蛋白质或纤维素进行水解或络合,从而实现淀粉颗粒的分离[14-16]。
碱法是最常见的分离方法,李敏等[14]通过对比不同处理方法,发现通过碱法获得藜麦淀粉纯度最高,达到88.76%;曹甜甜等[16]则通过单因素和正交试验对碱法工艺参数进行了优化,获得了纯度约80%的鹰嘴豆淀粉;氢氧化钠溶液作为碱法处理过程中最常用的试剂,可以使蛋白质分子中的氢键发生断裂,从而促进蛋白质的溶解,再利用淀粉不溶于碱液和冷水的特性使其分离。由碱法分离得到淀粉通常纯度较高,但分离过程中产生的大量碱液也会对环境产生一定的污染。而张增江等[15]则通过酶解处理分离获得了纯度高于99%的板栗淀粉;钟雪瑶等[17]也通过响应面法实现了面包果淀粉的酶法工艺的优化;酶法主要通过加入蛋白酶水解蛋白质来分离淀粉,具有处理条件温和、污染小和效率高等优点。此外,郭晓冬等[18]对比不同方法后发现通过表面活性剂分离得到的小米淀粉得率较高,蛋白质残留量也较低;表面活性剂法是利用烷基苯磺酸钠等使蛋白质变性、形成络合物,从而与淀粉分离,这种分离方法得到的淀粉蛋白质和脂质的残留量较低,但也存在一定的污染问题,只适用于实验室分离。
常见淀粉来源包括马铃薯、玉米和小麦等,目前研究已经将工业淀粉的分离扩展到各种淀粉来源中,如藜麦、板栗和水果废弃物等。由于以上分离方法具有不同的工艺特点,因此需要将不同工艺进行对比,筛选出不同淀粉来源的最佳分离方法。此外,还可以通过多种方法联用对工艺进行优化,以获得具有特定理化特性的淀粉,为深加工产品的开发提供新的可能。
2.2 淀粉外壳
目前通过完全糊化法和不完全糊化法均能够分离获得淀粉外壳[19-20],作为淀粉颗粒最外层的结构,淀粉外壳是限制淀粉反应活性的主要影响因素[21-22]。
在完全糊化分离过程中,需要保证体系中水含量足够高以确保淀粉颗粒达到最大膨胀体积,以及温度足够高使淀粉完全糊化而最终破裂。例如,Zhang等[23]在95 ℃下将0.5%玉米淀粉和马铃薯淀粉悬浮液加热30 min,离心弃去上清液后,用 90 ℃热水冲洗离心沉淀,得到了玉米淀粉和马铃薯淀粉的皱缩状外壳结构,并伴随有大量的碎片。不完全糊化法则通过快速黏度分析仪(RVA)对0.5%天然淀粉悬浮液进行处理,最高处理温度范围控制在低于糊化温度10 ℃到糊化温度之间。室温静置分离出沉淀,冻干后得到具有内部空腔和表面孔洞的淀粉外壳[12,20]。
以上两种方法制备得到的淀粉外壳具有不同形态特征,完全糊化法制备的淀粉外壳由于经历了高温糊化,结构皱缩并伴有大量碎片;而不完全糊化法制备的淀粉外壳则能够保留一定的空间立体结构,可以分别将其应用于制备淀粉薄膜、递送活性物质等不同的生产领域中。
2.3 淀粉小体
在小体分离方法的研究过程中,Huang等[9,24-25]通过不完全糊化法淀粉小体进行了分离,通过RVA对1%天然淀粉悬浮液进行不完全糊化处理,最高处理温度范围控制在低于糊化温度5~10 ℃,之后再室温静置并冻干上清液,得到相互连接为串珠状的淀粉小体。现有研究表明不完全糊化方法制备得到的主要是直径较大的、由直链淀粉分子参与构成的“缺陷小体”,但对参与外壳结构组成的“正常小体”的分离方法还有待探究[13]。从外壳和缺陷小体结构的组成来看,两种不同类型的淀粉小体直链淀粉含量具有一定差异,因此推测两者在结构和特征性质方面也会有所不同。
2.4 直链淀粉和支链淀粉
目前,常见的直链淀粉和支链淀粉分离方法有醇分离法、盐分离法和色谱法[26-27]。
醇分离法在实验室中的应用最为广泛,分离过程中直链淀粉会和醇类物质形成螯合物而沉淀析出,获得的淀粉纯度较高,但分离步骤略有繁琐,适用于实验室中的小批量分离[28]。盐分离法主要适用于工业生产,由于直链淀粉和支链淀粉在相同盐浓度下的盐析温度不同,在冷却过程中直链淀粉分子会首先析出,随后支链淀粉沉淀析出,此方法可将不同分子量级的直链淀粉进行分离,获得的直链淀粉和支链淀粉同样具有较高纯度,并且适用于大批量工业生产[27]。色谱法根据直链淀粉和支链淀粉的分子量差异对两者进行分离,当淀粉溶液通过层析柱时,分子尺寸更大的支链淀粉分子先被洗脱下来。色谱法分离的淀粉纯度最高,但由于仪器上样量较少,分离效率不高,因此多用于淀粉的纯度检验。现有研究中常通过醇分离法和色谱法相互结合,实现对直链淀粉和支链淀粉的分离和纯度鉴定,例如Lemos等[28]通过醇分离法从马铃薯淀粉、玉米淀粉、木薯淀粉和香蕉淀粉中分离获得了直链淀粉和支链淀粉,并结合色谱法测定了淀粉纯度(见表1)。
表 1 不同来源的淀粉各层级结构分离方法Table 1. The separation method of starch hierarchy from different sources分离物质 分离方法 淀粉种类 参数条件与分离过程 特点或适用条件 参考文献 淀粉颗粒 碱法 藜麦淀粉 料液比1:5与0.2%NaOH混合,反复过滤、离心、水洗后低温烘干 应用广泛,分离纯度高 [14] 酶法 板栗淀粉 料液比1:4与碱性蛋白酶混合,酶解时间100 min,酶用量0.22%,酶解温度43 ℃,反复过滤、离心、水洗后低温烘干 条件温和、破损率低、污染小、效率高 [15] 表面活性剂法 小米淀粉 料液比1:4与1%的表面活性剂(SDS)混合,反复过滤、离心、水洗后低温烘干 蛋白质和脂质的残留量较低 [18] 淀粉外壳 完全糊化法(水热) 玉米淀粉、马铃薯
淀粉在95 ℃下将0.5%淀粉悬浮液加热30 min,离心弃去上清液后,用90 ℃热水冲洗离心沉淀2遍获得淀粉外壳 外壳结构皱缩并产生大量碎片 [23] 不完全糊化法(RVA) 马铃薯、红薯、木薯、豌豆、玉米和
小麦淀粉淀粉乳浓度0.5%,最高处理温度范围在低于糊化温度10 ℃到糊化温度之间。室温静置1 h后,分离下层沉淀冻干,获得淀粉外壳 外壳结构保留着较高完整性 [12,29] 淀粉小体 不完全糊化法(RVA) 马铃薯、红薯、木薯、 豌豆、玉米和
小麦淀粉淀粉乳浓度1%,最高处理温度范围在低于糊化温度30 ℃到糊化温度之间。室温静置1 h后,分离上层液体冻干,获得淀粉小体 小体结构呈现为串珠状,部分发生融合膨胀 [9,24,30] 直链淀粉支链淀粉 醇分离法 马铃薯淀粉、玉米淀粉、木薯淀粉和香蕉淀粉 淀粉乳浓度2%,磷酸盐缓冲液调节至pH 6.0~6.3,98 ℃下加热搅拌,随后进行冰浴(0~2 ℃),离心1 h分离上清液(直链淀粉)和沉淀(支链淀粉)后加入丁醇提纯 纯度较高,适用于
实验室[28] 盐分离法 马铃薯淀粉 淀粉乳浓度10%,加入10%~13%的硫酸镁溶液,先将淀粉溶液在加压加热至溶解,冷却至80 ℃,离心分离直链淀粉;冷却至20 ℃,分离出支链淀粉 纯度较高,适用于
工业生产[31] 色谱法 马铃薯淀粉、玉米淀粉、木薯淀粉和香蕉淀粉 75 mg样品加入15 mL DMSO中,水浴搅拌加热1 h,随后室温搅拌24 h;再次加热搅拌后,0.2 μm尼龙膜过滤,将100 μL注入色谱仪中,柱温55 ℃,流动相为新的超纯水,流速为
1 mL/min;根据保留时间分析淀粉纯度可用于纯度检验,适用于实验室 [28] 3. 淀粉不同层级结构的表征
淀粉多层级结构表征是对其进行特性分析和应用研究的基础,因此对比和总结不同层级结构的表征技术至关重要。如表2所示,多种显微镜技术可以对比分析淀粉不同层级结构的内外形态和特征结构,进一步对内部有序结构的探究可以从长程有序、短程有序和螺旋结构三个方面入手。此外,还可以对比淀粉不同层级结构的分子量和链长分布规律,在淀粉链精细结构层面解释其结构特性及应用差异。
表 2 淀粉不同层级结构的表征方法Table 2. The characterization of starch hierarchy表征技术 适用的表征结构 关键指标 获取的信息 参考文献 形貌观察 光学显微镜(OM) 偏光显微镜(PLM) 颗粒、外壳 大小形态、 偏光十字 根据淀粉颗粒在大小和形态上的差异可以判断淀粉来源;微晶径向排列有序的淀粉颗粒具有偏光十字,失序则消失 [7, 29] 激光共聚焦显微镜(CLSM) 颗粒、外壳 特征结构分布 结合染色法后观察荧光亮度,以及空腔、通道和直链淀粉等特征结构分布 [33,35−36] 扫描电镜(SEM) 颗粒、外壳、小体 超微形态 观察表面超微形态的差异(孔隙、凸起和裂痕等) [10] 透射电镜(TEM) 颗粒、外壳、小体、直链淀粉、支链淀粉 内部结构 结合切片技术观察内部形态;结合图像对比度分析并量化尺寸分布;从纳米尺度观察淀粉链在溶液中折叠、弯曲和聚集等形态 [35,38] 原子力显微镜(AFM) 颗粒、小体 三维结构、尺寸分布 通过三维图片观察淀粉表面粗糙度并量化小体尺寸分布 [34] 长程有序结构 广角X射线衍射(WAXRD) 颗粒、外壳、小体、直链淀粉、支链淀粉 晶型 判断淀粉颗粒中微晶晶体结构信息
(A、B、C型衍射峰)[41,54] 相对结晶度 分析淀粉在长程结构上结晶区及无定形区相对含量 [24] 短程有序结构 傅里叶变换红外光谱(FTIR) 颗粒、外壳、小体、直链淀粉、支链淀粉 1047/1022 cm−1、
1022/995 cm−11047/1022 cm−1及1022/995 cm−1吸收峰强度的比值变化可以反映结构中短程有序结构的变化;特征峰的变化可以反映淀粉是否与其他物质发生了相互作用而形成了复合物 [25] 激光共焦显微拉曼光谱(Raman) 颗粒、直链淀粉、支链淀粉 2900、1343 、
865、480 cm−1相关特征带代表直链淀粉与支链淀粉/单螺旋与双螺旋的比率;480 cm−1处半高全宽 (FWHH)越低意味着分子结构更有序;特征峰的变化可以反映淀粉是否与其他物质发生了相互作用而形成了一定复合物 [47,49−50] 13C交叉极化/魔角旋转固体核磁共振(13C CP/MAS NMR) 颗粒、直链淀粉、支链淀粉 化学位移、 分峰拟合 通过区分结晶区和无定形区的化学位移对图谱进行分峰获得亚谱,随后进行拟合量化无定形区域、单双螺旋所占比例;结合分子模拟技术分析糖苷键扭转角和分子链构象 [51] 精细结构 尺寸排阻色谱(SEC) 颗粒、外壳、小体、直链淀粉、支链淀粉 数均分子量(Mn)、重均分子量(Mw)、旋转半径(Rz)和分子构象 Mw与直链淀粉和支链淀粉含量有关,随着支链淀粉含量的增加而增加;Rz和分子构象与样品在溶液中的聚集状态有关 [12,24,52] 高效阴离子交换色谱(HPAEC) 颗粒、外壳、小体、直链淀粉、支链淀粉 聚合度(DP)、链长分布(CLD) 根据A链(DP 6~12)、B1链(DP 13~24)、B2链(DP 25~36)和B3链(DP≥37)所占比例分析淀粉链长分布变化 [25] 3.1 形貌观察
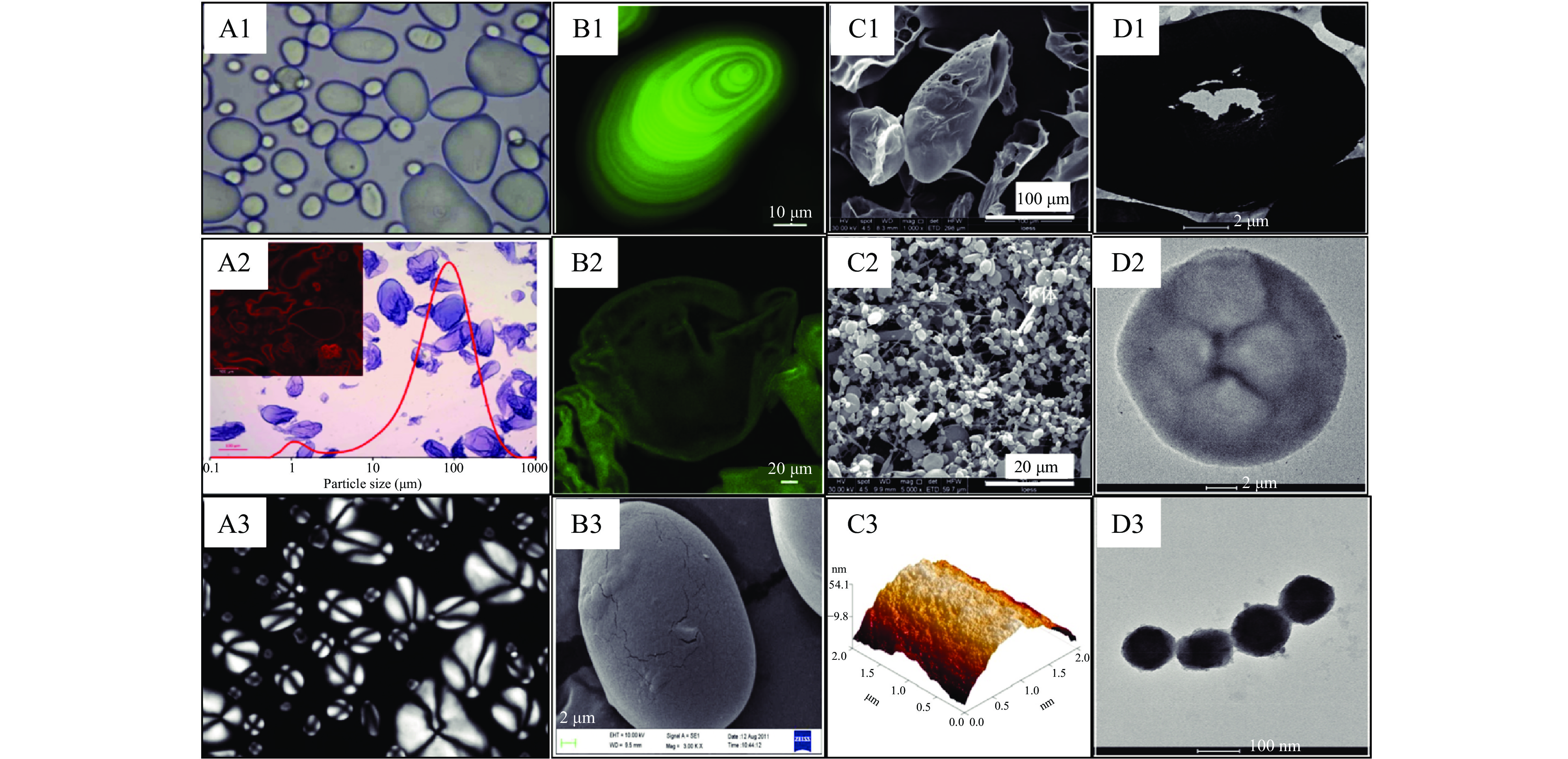
淀粉各层级结构的表面和内部的形貌特征可以通过各类显微镜技术进行直接观察。光学显微镜(OM)和偏光显微镜(PLM)是观察淀粉颗粒和淀粉外壳的基础手段[29,32](图2A1~A3)。此外,激光共聚焦扫描显微镜(CLSM)可以结合染色剂对进一步对特征结构的观察进行补充[33-36],包括淀粉颗粒的交替排列的同心环结构(图2B1)及外壳内部中空结构[12](图2B2)。
![]() 图 2 淀粉不同层级结构的形貌观察注:OM:A1-马铃薯淀粉颗粒[37];A2-马铃薯淀粉外壳(完全糊化法制备),比例尺=100 μm[19];PLM:A3-马铃薯淀粉颗粒的偏光十字[37];CLSM:B1、B2-马铃薯淀粉颗粒和淀粉外壳(不完全糊化法制备)[12];SEM:B3-马铃薯淀粉颗粒的表面裂痕[37];C1、C2-马铃薯淀粉外壳和淀粉小体[12,24];AFM:C3-马铃薯淀粉颗粒表面的小体结构[34];TEM:D1-马铃薯淀粉颗粒的中央空腔[38];D2、D3高直链大米淀粉外壳和小体[35]。Figure 2. Morphology observation of starch hierarchy
图 2 淀粉不同层级结构的形貌观察注:OM:A1-马铃薯淀粉颗粒[37];A2-马铃薯淀粉外壳(完全糊化法制备),比例尺=100 μm[19];PLM:A3-马铃薯淀粉颗粒的偏光十字[37];CLSM:B1、B2-马铃薯淀粉颗粒和淀粉外壳(不完全糊化法制备)[12];SEM:B3-马铃薯淀粉颗粒的表面裂痕[37];C1、C2-马铃薯淀粉外壳和淀粉小体[12,24];AFM:C3-马铃薯淀粉颗粒表面的小体结构[34];TEM:D1-马铃薯淀粉颗粒的中央空腔[38];D2、D3高直链大米淀粉外壳和小体[35]。Figure 2. Morphology observation of starch hierarchy扫描电子显微镜(SEM)能够精确地观察淀粉表面的超微结构,例如马铃薯淀粉颗粒的表面裂痕(图2B3)[36]、淀粉外壳表面的开口(图2C1)[12]以及淀粉小体的串珠状结构[24](图2C2)。原子力显微镜(AFM)可以进一步对表征超微结构进行补充,常用于检测淀粉颗粒表面粗糙度并量化小体尺寸分布[36],如图2C3可以观察到马铃薯淀粉表面不均匀的小体结构,且其直径范围为10~100 nm[34]。淀粉的内部超微结构则主要通过透射电子显微镜(TEM)进行观察,结合切片技术可以观察淀粉颗粒内部的不规则中央空腔(图2D1)[38],通过图像对比度分析观察到中空的淀粉外壳,以及从外壳中完全释放的淀粉小体(图2D2、D3)[35]。此外,还以可以在纳米尺度下观察分子结构在溶液中的分布状态,包括淀粉链的折叠、弯曲和聚集等[39]。
通过形貌观察可以发现,淀粉外壳在一定程度上保留了淀粉颗粒的三维立体结构,同时空间结构更加开放;淀粉小体则呈现为复杂的串珠状结构;直链淀粉和支链淀粉则失去了三维立体结构。结合多种显微镜技术可以直观地说明从颗粒、壳层、小体到分子结构是对淀粉多层级结构的层层拆解,未来对各层级内部结构和形成机制的深入探究或许能够通过显微镜技术与切片技术结合进行更加精确的表征。目前,关于各层级结构的内部有序性已建立了一系列表征分析方法,同样为其特性和应用差异提供了一定的参考依据。
3.2 有序结构表征
淀粉多层级结构的内部有序结构的表征方向可以分为长程有序结构、短程有序结构和螺旋结构。淀粉分子通过螺旋结构(单、双螺旋)的周期性重复排列形成了半结晶生长环以及结晶片层,进而构成了淀粉颗粒的长程有序结构,导致不同类型淀粉具有不同的晶型结构[4, 25]。晶型相关信息可以通过广角X射线衍射(WAXRD)来表征。而没有参与周期性重复排列的螺旋结构形成了短程有序结构,可以通过傅里叶变换红外光谱(FTIR)和激光共焦显微拉曼光谱(Raman)进行分析。单螺旋和双螺旋的量化则主要通过13C交叉极化/魔角旋转固体核磁共振(13C CP/MAS NMR)进行分析[40]。
3.2.1 WAXRD
WAXRD可以从结晶类型和相对结晶度两个方面表征淀粉的长程有序结构。目前,根据XRD图谱可以将天然淀粉颗粒的晶型分为A、B和C型,据此可以进一步计算获得淀粉颗粒的相对结晶度用以表征长程结构的有序性[41-42]。而在分离其他淀粉多层级结构的过程中淀粉颗粒的晶型结构被破坏,因此外壳、小体、直链淀粉和支链淀粉的衍射峰均呈现为弥散峰,长程有序结构的特征衍射峰型消失[12,24,43],相对结晶度均显著降低,说明在分离过程中淀粉颗粒的长程有序结构被破坏,其他淀粉层级结构均含有较高比例的无定形结构。此外,通过XRD图谱的变化探究淀粉各层级结构与其他物质之间的相互作用也是一个可行的研究方向。
3.2.2 FTIR
FTIR可以用于检测淀粉中化学基团的振动模式以确定短程有序结构的变化,其中衰减总反射(ATR)模式具有无损、易制备、可重复等特点,因此广泛应用于表征淀粉短程有序结构 [8,44]。FTIR通常采集范围在4000~400 cm−1,1047 cm−1附近的吸收峰代表淀粉分子结晶区的有序结构;1022 cm−1附近的吸收峰代表淀粉无定形区随机螺旋的结构特征;995 cm−1处的吸收峰代表淀粉链间通过-OH形成的有序氢键结构。1047/1022 cm−1及1022/995 cm−1吸收峰强度的比值可以反应淀粉短程有序结构的变化[42,45]。
目前有研究通过FTIR对比了淀粉颗粒、外壳和小体短程有序结构的变化[25],发现外壳和小体在1047/1022 cm−1的比值低于淀粉颗粒,1022/995 cm−1的比值则高于淀粉颗粒,这说明在分离外壳和小体的过程中,淀粉短程有序性被破坏,致密性减弱,外壳和小体均含有较高比例的无定形结构。但直链淀粉、支链淀粉与颗粒、外壳、小体之间短程有序结构的对比还有待探究,可以推测分子结构的分离过程同样会导致短程有序结构的破坏。如今对直链淀粉、支链淀粉短程有序结构的探究通常集中在证明与其他物质之间的相互作用及分析两者相互作用的位点方面[46]。因此,通过FTIR探究外壳和小体结构与活性物质或营养物质的相互作用也具有一定的应用前景。
3.2.3 Raman
Raman可以用于检测淀短程有序结构和直链淀粉/支链淀粉的比率[8,47],通常的光谱采集范围是3200~100 cm−1,2910 cm−1左右的特征峰强度取决于支链淀粉双螺旋含量的变化;1337 cm−1左右的特征峰强度取决于直链淀粉单螺旋含量的变化;865 cm−1处的特征峰值与直链淀粉双螺旋的相对含量有关[48-49],这些特征峰强度的比例变化常用于分析淀粉中直链淀粉/支链淀粉的比率或单螺旋/双螺旋结构的比率。另外,480 cm−1处的强特征峰常用于表示多糖聚合度,据此计算得出的半高全宽(FWHM)用于评估淀粉中的短程有序结构,FWHM值越低,表明短程分子有序性越高[50]。
通过分析颗粒、外壳和小体Raman光谱特征峰的差异或许可以进一步解释淀粉多层级结构内部单螺旋和双螺旋的组织排列和形成机制。此外,Raman光谱在直链淀粉和支链淀粉中的应用主要集中在分析特征峰的变化判断与其他物质复合物的形成,应用于淀粉多层级结构之间短程有序结构的对比仍有待探索。
3.2.4 13C CP/MAS NMR
核磁共振可以实现无损化表征淀粉分子结构,1H和13C谱是最常见的核磁共振光谱。其中,高场核磁可以提供分子化学方面的信息[7],低场强核磁可以根据弛豫时间的测定来评估分子动力学,测定氢核的驰豫时间来反映体系中水分子流动性。以应用最为广泛的13C交叉极化/魔角旋转固体核磁共振(13C CP/MAS NMR)为代表,13C CP/MAS NMR可以通过区分结晶区和无定形区在图谱上的化学位移和驰豫时间实现对螺旋结构(单、双螺旋)的量化[42]。
13C CP/MAS NMR在量化淀粉颗粒的螺旋结构方面应用较为普遍,而外壳和小体的有序结晶区和无定形区以及单螺旋和双螺旋比例的变化则有待探究,以进一步为淀粉多层级结构形成机制提供分子水平信息。此外,13C CP/MAS NMR还可以结合分子模拟技术将直链淀粉或支链淀粉信号区域的化学位移与葡萄糖苷键的扭转角和分子链构象相互结合进行分析[51],有助于深入解析其构效关系,扩大其在食品工业中的应用范围。
3.3 精细结构表征
如表2所示,淀粉链的精细结构通常根据直链淀粉和支链淀粉的重均分子量(Mw)、聚合度(DP)和链长分布(CLD)来表征。尺寸排阻色谱(SEC)和高效阴离子交换色谱(HPAEC)是淀粉链精细结构分析过程中最常用的表征技术。
3.3.1 SEC
淀粉多层级结构的全链长分布和平均分子量可以通过SEC进行分析[52]。由SEC与示差折光检测器(RI)串联测定后可以间接计算获得淀粉的平均分子量,也可以通过SEC与多角度激光光散射仪(MALLS)串联直接获得重均分子量(Mw)、旋转半径(Rz)和分子构象等。目前研究中SEC-MALLS-RI联用应用最广泛,可以进一步提高检测精度[8,25]。
对比淀粉颗粒、外壳和小体结构的分子量则发现,外壳的Mw和Rz均大于淀粉颗粒,说明外壳含有更多的支链淀粉,且在溶液中占据更大的体积,结构更加疏松;但小体的Mw和Rz较淀粉颗粒更小,说明小体的直链淀粉含量更高,且在溶液中占据的体积更小,结构更为致密,其分子构象均呈现为无规则线团状[12,24]。通过SEC分析可以发现,直链淀粉与支链淀粉的比例不同导致了颗粒、外壳和小体结构的分子量和淀粉链聚集状态的不同,其中结构更为疏松的外壳结构可能表现出更高的生化反应活性,有利于拓展淀粉资源的应用范畴,也可以为解释淀粉不同层级结构的性质和应用差异提供分子水平的重要参考。
3.3.2 HPAEC
HPAEC与脉冲电流检测器(PAD)串联是目前应用最广泛的研究支链淀粉链长分布(DP<100)的方法,可分离不同聚合度下各个色谱峰,经过异淀粉酶脱支后链段可根据聚合度分为:fa链(DP 6~12)、fb1链(DP 13~24)、fb2链(DP 25~36)和fb3链(DP≥37)[53]。但单独通过HPAEC-PAD法无法检测出完整的链长分布,因此通常同时采用SEC-MALLS-RI和HPAEC-PAD实现对淀粉链分子结构的完全表征。
目前研究对比了六种天然淀粉(马铃薯、红薯、木薯、豌豆、玉米和小麦淀粉)结构中颗粒、外壳和小体的支链淀粉链长分布[12,24-25],发现颗粒和外壳整体支链淀粉链长分布趋势相同,但外壳fb2、fb3链比例有所增加,说明具有较长侧链的支链淀粉参与了外壳结构的组成;而小体结构中fa、fb1链比例高于淀粉颗粒,说明较多比例的直链淀粉参与了小体结构的组成。以上研究结果证明了淀粉各层级结构之间链长分布的差异性,对各层级结构的分子量和淀粉链聚集状态的分析进行了补充。相对于淀粉颗粒,结构更加疏松的外壳结构具有更长侧链的支链淀粉组成,而结构更加致密的小体结构则主要有更多比例的短直链淀粉构成。因此,结合以上表征技术,可以依次从结构致密性、内部有序性和分子链水平的角度对淀粉多层级结构特性和应用的差异性进行解释。
4. 淀粉不同层级结构的潜在应用
如图3所示,将分离获得的淀粉多层级结构进行表征后,可以发现各层级结构的致密性、内部有序性和分子链水平的差异,因此可以根据淀粉多层级结构特性的差异分别将其应用于不同食品工业领域中。
4.1 淀粉颗粒
淀粉作为日常饮食中主要的碳水化合物摄入来源,可以为人类活动提供所需能量,根据不同来源淀粉颗粒的酶解特性的差异可以应用于制备不同消化速率的功能性食品[22];根据其糊化特性可以应用于制备淀粉薄膜类和凝胶类产品[4]。不同直链淀粉含量的淀粉颗粒所制备的薄膜或凝胶性质不同,例如,高直链淀粉含量的淀粉颗粒可以更快地形成淀粉凝胶,但也更容易发生老化,往往导致凝胶具有较低的透明度、较差的弹性和较高的硬度,在冻融过程中直链淀粉也更容易发生重新排列破坏凝胶结构,因此较高直链淀粉含量的淀粉颗粒所制备的凝胶较不适宜应用于冷冻食品;相反地,具有更多支链淀粉含量的淀粉颗粒形成的凝胶则透明度、弹性、黏性和冻融稳定性更高,适宜应用于糖果、凉粉等食品类工业生产中[25]。
目前,由于淀粉颗粒在室温下不可溶解,并且自身吸附性较差,其应用范围受到了一定限制,因此目前的研究趋势集中在通过物理、化学和酶处理等多种方法制备具有改良性能的改性淀粉或淀粉衍生物。例如,通过热处理或酶处理制备具有强吸附特性的多孔淀粉,被广泛应用于风味物质包埋与缓释[55-56],通过醇法处理制备的冷水可溶性淀粉,即保留了颗粒的完整性,又具有更强的黏合稳定性[57]。
4.2 淀粉外壳
淀粉外壳具有较低的直链淀粉含量和较高比例的无定形结构,这种介于颗粒和糊化淀粉之间的结构特性使其具有较高的反应活性,因此在室温下具有较好的冷水溶解性、吸附特性和较高的酶解速率[20]。由不完全糊化法制备的淀粉外壳具有较好冷水溶解性,可以在室温下快速水合,因此是制备增稠剂和粘合剂的潜在原料[25]。此外,淀粉外壳还具有较好的吸附性,能够暴露出更多淀粉表面的亲水羟基和亲脂亚甲基,可以作为生物活性物质载体应用于药物和营养素的递送。另一方面,淀粉外壳还具有较高酶解速率,可以通过添加淀粉外壳制备具有快消化率的淀粉产品,还可以用于制备咽喉含片,将活性化合物递送到口腔后通过淀粉酶水解进行释放[20]。
因此,作为一种多功能性的淀粉多层级结构,淀粉外壳在营养物质递送、风味物质包埋和药物控制释放方面具有广阔的应用前景。但目前淀粉外壳的相关研究还主要集中在基本性质和结构特性的探索,在淀粉外壳在食品工业中的应用研究还有待进一步开拓。
4.3 淀粉小体
淀粉小体含有较高比例的直链淀粉,线性的直链淀粉之间更容易形成氢键,因此淀粉小体结构较为致密,导致其抗酶解能力更强。较高的直链淀粉含量也会使淀粉小体更容易发生老化,因此体系中含有较高比例的抗性淀粉,可以用于制备具有抗消化特性的功能性食品,是有减肥需求或患糖尿病人士的饮食首选。此外,较高的直链淀粉含量也有利于淀粉分子之间相互缔合而提高淀粉薄膜的致密性,可以用于制备柔韧性较好的淀粉薄膜;同时直链淀粉的老化过程也会使制备的淀粉薄膜具有较强的机械性能,因此淀粉小体结构可以用于制备具有可食用、可生物降解的强韧性薄膜。目前研究对比发现[25],不同淀粉类型制备的淀粉小体经过流延法制备的淀粉薄膜性能均优于天然淀粉颗粒制备的淀粉薄膜,可以根据淀粉薄膜的不同应用需求选择不同来源的淀粉小体进行制备。但淀粉小体薄膜具有较差的透明度和水溶性,可以通过额外添加增塑剂、增强剂等进一步提升淀粉小体薄膜的性能[58]。
与淀粉外壳相似,目前对淀粉小体的研究同样集中在性质和结构方面,具体如何实现在食品工业中的应用依旧有待探索,在未来研究过程中可以根据淀粉小体的抗酶解特性和成膜特性对其应用实现进一步的开发。
4.4 直链淀粉和支链淀粉
作为一种线性聚合物,直链淀粉具有较好的成膜特性和抗酶解性能,被广泛应用于制备淀粉薄膜和功能性食品。由直链淀粉制备的淀粉薄膜具有较好的透明度、柔韧性、隔氧性和隔油性,且具有可食用性,可以替代聚苯乙烯广泛应用于食品工业的薄膜生产中,是一种环境友好的生产原料[27]。此外,直链淀粉在食品加工过程中会发生老化而产生大量的抗性淀粉,因此直链淀粉制备的食品适合糖尿病和高血压患者食用,直链淀粉还可以作为脂肪替代物用于制备低脂低卡食品。而支链淀粉作为一种高度支化的聚合物,容易发生糊化而形成粘稠体系,因此可以作为粘合剂和增稠剂应用于食品体系中,还可以经过各种处理加工为变性淀粉进一步提高其透明度和稳定性。
近年来,许多研究发现直链淀粉或支链淀粉可以与特定活性物质发生相互作用而形成复合物[59]。其中,直链淀粉主要通过形成具有疏水空腔的单螺旋结构对疏水性风味物质、脂质等化合物进行包埋,化合物可以通过非共价键与线性直链淀粉结合,且直链淀粉的结合能力、螺旋尺寸结构和结合位点与化合物的性质存在一定关联性。而具有高度分支结构的支链淀粉受空间位阻影响,化合物主要与支链淀粉的支链侧链产生相互作用[60],因此直链淀粉相较于支链淀粉在应用上具有一定的优势。直链淀粉和支链淀粉的聚合度会显著影响其结合能力,直链淀粉分子链较短或支链淀粉的支链较短均不利于复合物的稳定性[61]。目前,关于直链淀粉和支链淀粉与小分子化合物的相互作用已进一步结合分子模拟技术进行了研究,可以对真实实验结果进行补充和完善,有利于进一步扩大直链淀粉和支链淀粉的应用范围。
5. 结论与展望
淀粉颗粒、外壳、小体、直链淀粉和支链淀粉等丰富的多层级结构资源是食品加工中重要的原料,其利用过程分别涉及了分离、表征等关键技术。首先,碱处理是淀粉颗粒最常见的分离方法,但表面活性剂法分离出的淀粉颗粒蛋白质和脂质含量更低,但两者都具有一定污染性,酶法处理条件则更加温和;通过糊化处理可以分离出两种不同形态的淀粉外壳,其中不完全糊化法能够分离出的淀粉外壳能够保留一定的空间立体结构,也可以根据此方法分离出串珠状的淀粉小体;此外,醇分离法和色谱法可以依次对直链淀粉和支链淀粉进行分离和纯度检验,盐分离法则常见于工业生产之中。在分离获得淀粉各层级结构后,可以从形貌观察、有序结构和精细结构三个方面对淀粉各层级结构的形貌特征和形成机制、结晶区和无定形区比例以及分子量和链长分布进行表征。
基于上述分离和表征,多层级结构的应用成为可能,其中,淀粉颗粒往往通过改性后应用在风味物质包埋和黏合剂等,而具有疏松结构的外壳和高度支化的支链淀粉是生产粘合剂和快消化食品的理想原料,结构更加致密的小体和线性直链淀粉则在淀粉薄膜的制备和慢消化食品研发方面具有较大应用前景。虽然淀粉多层级结构与其功能特性的探究已成为近年来淀粉研究中的热点,但还需进一步完善不同层级结构的分离方法和结构表征技术,以期为开发新的应用领域和实现淀粉资源的高效开发提供有力支撑。
-
图 2 淀粉不同层级结构的形貌观察
注:OM:A1-马铃薯淀粉颗粒[37];A2-马铃薯淀粉外壳(完全糊化法制备),比例尺=100 μm[19];PLM:A3-马铃薯淀粉颗粒的偏光十字[37];CLSM:B1、B2-马铃薯淀粉颗粒和淀粉外壳(不完全糊化法制备)[12];SEM:B3-马铃薯淀粉颗粒的表面裂痕[37];C1、C2-马铃薯淀粉外壳和淀粉小体[12,24];AFM:C3-马铃薯淀粉颗粒表面的小体结构[34];TEM:D1-马铃薯淀粉颗粒的中央空腔[38];D2、D3高直链大米淀粉外壳和小体[35]。
Figure 2. Morphology observation of starch hierarchy
表 1 不同来源的淀粉各层级结构分离方法
Table 1 The separation method of starch hierarchy from different sources
分离物质 分离方法 淀粉种类 参数条件与分离过程 特点或适用条件 参考文献 淀粉颗粒 碱法 藜麦淀粉 料液比1:5与0.2%NaOH混合,反复过滤、离心、水洗后低温烘干 应用广泛,分离纯度高 [14] 酶法 板栗淀粉 料液比1:4与碱性蛋白酶混合,酶解时间100 min,酶用量0.22%,酶解温度43 ℃,反复过滤、离心、水洗后低温烘干 条件温和、破损率低、污染小、效率高 [15] 表面活性剂法 小米淀粉 料液比1:4与1%的表面活性剂(SDS)混合,反复过滤、离心、水洗后低温烘干 蛋白质和脂质的残留量较低 [18] 淀粉外壳 完全糊化法(水热) 玉米淀粉、马铃薯
淀粉在95 ℃下将0.5%淀粉悬浮液加热30 min,离心弃去上清液后,用90 ℃热水冲洗离心沉淀2遍获得淀粉外壳 外壳结构皱缩并产生大量碎片 [23] 不完全糊化法(RVA) 马铃薯、红薯、木薯、豌豆、玉米和
小麦淀粉淀粉乳浓度0.5%,最高处理温度范围在低于糊化温度10 ℃到糊化温度之间。室温静置1 h后,分离下层沉淀冻干,获得淀粉外壳 外壳结构保留着较高完整性 [12,29] 淀粉小体 不完全糊化法(RVA) 马铃薯、红薯、木薯、 豌豆、玉米和
小麦淀粉淀粉乳浓度1%,最高处理温度范围在低于糊化温度30 ℃到糊化温度之间。室温静置1 h后,分离上层液体冻干,获得淀粉小体 小体结构呈现为串珠状,部分发生融合膨胀 [9,24,30] 直链淀粉支链淀粉 醇分离法 马铃薯淀粉、玉米淀粉、木薯淀粉和香蕉淀粉 淀粉乳浓度2%,磷酸盐缓冲液调节至pH 6.0~6.3,98 ℃下加热搅拌,随后进行冰浴(0~2 ℃),离心1 h分离上清液(直链淀粉)和沉淀(支链淀粉)后加入丁醇提纯 纯度较高,适用于
实验室[28] 盐分离法 马铃薯淀粉 淀粉乳浓度10%,加入10%~13%的硫酸镁溶液,先将淀粉溶液在加压加热至溶解,冷却至80 ℃,离心分离直链淀粉;冷却至20 ℃,分离出支链淀粉 纯度较高,适用于
工业生产[31] 色谱法 马铃薯淀粉、玉米淀粉、木薯淀粉和香蕉淀粉 75 mg样品加入15 mL DMSO中,水浴搅拌加热1 h,随后室温搅拌24 h;再次加热搅拌后,0.2 μm尼龙膜过滤,将100 μL注入色谱仪中,柱温55 ℃,流动相为新的超纯水,流速为
1 mL/min;根据保留时间分析淀粉纯度可用于纯度检验,适用于实验室 [28] 表 2 淀粉不同层级结构的表征方法
Table 2 The characterization of starch hierarchy
表征技术 适用的表征结构 关键指标 获取的信息 参考文献 形貌观察 光学显微镜(OM) 偏光显微镜(PLM) 颗粒、外壳 大小形态、 偏光十字 根据淀粉颗粒在大小和形态上的差异可以判断淀粉来源;微晶径向排列有序的淀粉颗粒具有偏光十字,失序则消失 [7, 29] 激光共聚焦显微镜(CLSM) 颗粒、外壳 特征结构分布 结合染色法后观察荧光亮度,以及空腔、通道和直链淀粉等特征结构分布 [33,35−36] 扫描电镜(SEM) 颗粒、外壳、小体 超微形态 观察表面超微形态的差异(孔隙、凸起和裂痕等) [10] 透射电镜(TEM) 颗粒、外壳、小体、直链淀粉、支链淀粉 内部结构 结合切片技术观察内部形态;结合图像对比度分析并量化尺寸分布;从纳米尺度观察淀粉链在溶液中折叠、弯曲和聚集等形态 [35,38] 原子力显微镜(AFM) 颗粒、小体 三维结构、尺寸分布 通过三维图片观察淀粉表面粗糙度并量化小体尺寸分布 [34] 长程有序结构 广角X射线衍射(WAXRD) 颗粒、外壳、小体、直链淀粉、支链淀粉 晶型 判断淀粉颗粒中微晶晶体结构信息
(A、B、C型衍射峰)[41,54] 相对结晶度 分析淀粉在长程结构上结晶区及无定形区相对含量 [24] 短程有序结构 傅里叶变换红外光谱(FTIR) 颗粒、外壳、小体、直链淀粉、支链淀粉 1047/1022 cm−1、
1022/995 cm−11047/1022 cm−1及1022/995 cm−1吸收峰强度的比值变化可以反映结构中短程有序结构的变化;特征峰的变化可以反映淀粉是否与其他物质发生了相互作用而形成了复合物 [25] 激光共焦显微拉曼光谱(Raman) 颗粒、直链淀粉、支链淀粉 2900、1343 、
865、480 cm−1相关特征带代表直链淀粉与支链淀粉/单螺旋与双螺旋的比率;480 cm−1处半高全宽 (FWHH)越低意味着分子结构更有序;特征峰的变化可以反映淀粉是否与其他物质发生了相互作用而形成了一定复合物 [47,49−50] 13C交叉极化/魔角旋转固体核磁共振(13C CP/MAS NMR) 颗粒、直链淀粉、支链淀粉 化学位移、 分峰拟合 通过区分结晶区和无定形区的化学位移对图谱进行分峰获得亚谱,随后进行拟合量化无定形区域、单双螺旋所占比例;结合分子模拟技术分析糖苷键扭转角和分子链构象 [51] 精细结构 尺寸排阻色谱(SEC) 颗粒、外壳、小体、直链淀粉、支链淀粉 数均分子量(Mn)、重均分子量(Mw)、旋转半径(Rz)和分子构象 Mw与直链淀粉和支链淀粉含量有关,随着支链淀粉含量的增加而增加;Rz和分子构象与样品在溶液中的聚集状态有关 [12,24,52] 高效阴离子交换色谱(HPAEC) 颗粒、外壳、小体、直链淀粉、支链淀粉 聚合度(DP)、链长分布(CLD) 根据A链(DP 6~12)、B1链(DP 13~24)、B2链(DP 25~36)和B3链(DP≥37)所占比例分析淀粉链长分布变化 [25] -
[1] REN F, WANG J W, XIE F W, et al. Applications of ionic liquids in starch chemistry: A review[J]. Green Chemistry,2020,22(7):2162−2183. doi: 10.1039/C9GC03738A
[2] CHI C D, LI X X, ZHANG Y P, et al. Digestibility and supramolecular structural changes of maize starch by non-covalent interactions with gallic acid[J]. Food & Function,2017,8(2):720−730.
[3] BERTOFT E. Understanding starch structure: recent progress[J]. Agronomy-Basel,2017,7(3):56. doi: 10.3390/agronomy7030056
[4] XU H B, ZHOU J P, LIU X, et al. Methods for characterizing the structure of starch in relation to its applications: A comprehensive review[J]. Critical Reviews in Food Science and Nutrition,2021,30:1−8.
[5] BULEON A, COLONNA P, PLANCHOT V, et al. Starch granules: Structure and biosynthesis[J]. International Journal of Biological Macromolecules,1998,23(2):85−112. doi: 10.1016/S0141-8130(98)00040-3
[6] BHATT P, KUMAR V, GOEL R, et al. Structural modifications and strategies for native starch for applications in advanced drug delivery[J]. Biomed Research International,2022,2022:2188940.
[7] CHOI S H, KIM H Y, OH S M, et al. Infusion efficiency of sodium fluorescein into various starches[J]. Food Science and Biotechnology,2019,28(1):99−102. doi: 10.1007/s10068-018-0455-5
[8] WANG X Y, LIU S Y, AI Y F. Gelation mechanisms of granular and non-granular starches with variations in molecular structures[J]. Food Hydrocolloids,2022,129:107658. doi: 10.1016/j.foodhyd.2022.107658
[9] 冯朵, 丁振, 曹盼盼, 等. 预处理辅助酶解制备多孔淀粉及其在食品领域中的应用[J]. 美食研究,2022,39(2):87−94. [FENG D, DING Z, CAO P P, et al. Porous starch prepared by pre-treatment assisted enzymatic hydrolysis and its application in food field[J]. Journal of Researches on Dietetic Science and Culture,2022,39(2):87−94. FENG D, DING Z, CAO P P, et al. Porous starch prepared by pre-treatment assisted enzymatic hydrolysis and its application in food field[J]. Journal of Researches on Dietetic Science and Culture, 2022, 39(2): 87-94.
[10] HUANG J, WEI M, REN R, et al. Morphological changes of blocklets during the gelatinization process of tapioca starch[J]. Carbohydrate Polymers,2017,163:324−329. doi: 10.1016/j.carbpol.2017.01.083
[11] HUANG J, WEI N, LI H, et al. Outer shell, inner blocklets, and granule architecture of potato starch[J]. Carbohydrate Polymers,2014,103:355−358. doi: 10.1016/j.carbpol.2013.12.064
[12] 马芸. 淀粉颗粒外壳的分离及其性质与结构研究[D]. 西安: 陕西科技大学, 2018 MA Y. Properties and structure of the outer shells separating from starch granules[D]. Xi'an: Shaanxi University of Science and Technology, 2018.
[13] 陈治光. 不同加工条件下淀粉分子构象和次级相互作用力变化规律研究[D]. 西安: 陕西科技大学, 2021 CHEN Z G. Study on the change rules of starch molecular conformation and secondary interaction under different processing conditions[D] Xi'an: Shaanxi University of Science and Technology, 2021.
[14] 李敏, 张倩芳, 栗红瑜, 等. 基于不同提取方法对藜麦淀粉性质的比较[J]. 食品研究与开发,2022,43(1):17−24. [LI M, ZHANG Q F, LI H Y, et al. Comparison between quinoa starches isolated using different extraction methods[J]. Food Research and Development,2022,43(1):17−24. LI M, ZHANG Q F, LI H Y, et al. Comparison between quinoa starches isolated using different extraction methods[J]. Food Research and Development, 2022, 43(1): 17-24.
[15] 张增江, 王竹, 朱俊超, 等. 板栗淀粉的提取工艺优化及其性质分析[J]. 现代食品科技,2022,38(7):225−231. [ZHANG Z J, WANG Z, ZHU J C, et a1. Optimization of extraction process for chestnut starches and analysis of their properties[J]. Modem Food Science and Technology,2022,38(7):225−231. ZHANG Z J, WANG Z, ZHU J C, et a1. Optimization of extraction process for chestnut starches and analysis of their properties[J]. Modem Food Science and Technology, 2022, 38(7): 225-231.
[16] 曹甜甜, 王思玉, 彭修春, 等. 鹰嘴豆淀粉提取工艺的研究[J]. 现代食品,2021(15):49−51, 55. [CAO T T, WANG S Y, PENG X C, et al. Study on extraction technology of chickpea starch[J]. Process Technology,2021(15):49−51, 55. CAO T T, WANG S Y, PENG X C, et al. Study on extraction technology of chickpea starch[J]. Process Technology, 2021, (15): 49-51, 55.
[17] 钟雪瑶, 王少曼, 张彦军, 等. 响应面法优化面包果淀粉的酶法提取工艺[J]. 食品工业科技,2020,41(21):139−144. [ZHONG X Y, WANG S M, ZHANG Y J, et a1. Optimization of enzymatic extraction technology of starch from breadfruit by response surface methodology[J]. Science and Technology of Food Industry,2020,41(21):139−144. ZHONG X Y, WANG S M, ZHANG Y J, et a1. Optimization of enzymatic extraction technology of starch from breadfruit by response surface methodology[J]. Science and Technology of Food Industry, 2020, 41(21): 139-144.
[18] 郭晓冬, 李颖. 小米淀粉提取方法的比较[J]. 中国粮油学报,2011,26(5):26−29. [GUO X D, LI Y. Comparative study on methods for extracting starch from millet[J]. Journal of the Chinese Cereals and Oils Association,2011,26(5):26−29. GUO X D, LI Y. Comparative study on methods for extracting starch from millet[J]. Journal of the Chinese Cereals and Oils Association, 2011, 26(5): 26-29.
[19] ZHANG B, DHITAL S, FLANAGAN B M, et al. Mechanism for starch granule ghost formation deduced from structural and enzyme digestion properties[J]. Journal of Agricultural and Food Chemistry,2014,62(3):760−771. doi: 10.1021/jf404697v
[20] FANG C L, HUANG J R, PU H Y, et al. Cold-water solubility, oil-adsorption and enzymolysis properties of amorphous granular starches[J]. Food Hydrocolloids,2021,117:106669. doi: 10.1016/j.foodhyd.2021.106669
[21] PILLING E, SMITH A M. Growth ring formation in the starch granules of potato tubers[J]. Plant Physiology,2003,132(1):365−371. doi: 10.1104/pp.102.018044
[22] 任瑞珍. 酶解法研究三种薯类淀粉的壳层和小体结构[D]. 西安: 陕西科技大学, 2015 REN R Z. Shells and blocklets of three tuber starches as indicated by enzymolysis approach[D] Xi'an: Shaanxi University of Science and Technology, 2015.
[23] ZHANG B, SELWAY N, SHELAT K J, et al. Tribology of swollen starch granule suspensions from maize and potato[J]. Carbohydrate Polymers,2017,155:128−135. doi: 10.1016/j.carbpol.2016.08.064
[24] 王倩. 淀粉小体与分子结构关系的研究[D]. 西安: 陕西科技大学, 2018 WANG Q. The relationship between blocklets and molecular structure of starch[D] Xi'an: Shaanxi University of Science and Technology, 2018.
[25] 方晨璐. 三种形状无定形淀粉的制备、特征性质及分子结构研究[D]. 西安: 陕西科技大学, 2020 FANG C L. Preparation, characteristic properties and molecular structures of three amorphous starches of different shapes[D] Xi'an: Shaanxi University of Science and Technology, 2020.
[26] 陈德经, 罗敏, 苏文. 西洋参直链淀粉与支链淀粉的分离纯化与含量检测[J]. 保鲜与加工,2020,20(3):146−149. [CHEN D J, LUO M, SU W. The separation, purification and determination of the amylose and amylopectin from American ginseng[J]. Storage and Process,2020,20(3):146−149. CHEN D J, LUO M, SU W. The separation, purification and determination of the amylose and amylopectin from American ginseng[J]. Storage and Process, 2020, 20(3): 146-149.
[27] 钟雨越. 玉米直链淀粉的提取与高直链淀粉膜的制备[D]. 杨凌: 西北农林科技大学, 2018. ZHONG Y Y. Isolation of amylose from corn and preparation of high-amylose corn starch based films[D]. Yangling: Northwest A&F University, 2018.
[28] LEMOS P V F, BARBOSA L S, RAMOS I G, et al. Characterization of amylose and amylopectin fractions separated from potato, banana, corn, and cassava starches[J]. International Journal of Biological Macromolecules,2019,132:32−42. doi: 10.1016/j.ijbiomac.2019.03.086
[29] 严青. 不完全糊化法研究淀粉颗粒的外壳和小体结构[D]. 西安: 陕西科技大学, 2015 YAN Q. Outer shells and blocklets of starch granules as indicated by insufficient gelatinization[D] Xi'an: Shaanxi University of Science and Technology, 2015.
[30] 魏毛毛. 淀粉糊化过程中小体形态变化和不完全糊化颗粒性质研究[D]. 西安: 陕西科技大学, 2017 WEI M M. Morphological changes of blocklets during the gelatinization process and the properties of insufficient gelatinization starch granules[D] Xi'an: Shaanxi University of Science and Technology, 2017.
[31] 刘洁, 刘亚伟. 直链淀粉与支链淀粉的分离方法[J]. 粮食与饲料工业,2005(2):15−17. [LIU J, LIU Y W. Methods of separating amylose from amylopetin[J]. Cereal and Feed Industry,2005(2):15−17. LIU J, LIU Y W. Methods of separating amylose from amylopetin[J]. Cereal and Feed Industry. 2005, (2): 15-17.
[32] 黄强, 罗发兴, 杨连生. 淀粉颗粒结构的研究进展[J]. 高分子材料科学与工程,2004,20(5):19−23. [HUANG Q, LUO F X, YANG L S. Progress of research on the starch granules[J]. Polymer Materials Science and Engineering,2004,20(5):19−23. HUANG Q, LUO F X, YANG L S. Progress of research on the starch granules[J]. Polymer Materials Science and Engineering, 2004, 20(5): 19-23.
[33] BLENNOW A, HANSEN M, SCHULZ A, et al. The molecular deposition of transgenically modified starch in the starch granule as imaged by functional microscopy[J]. Journal of Structural Biology,2003,143(3):229−241. doi: 10.1016/j.jsb.2003.08.009
[34] CHEN L, MA R R, ZHANG Z P, et al. Comprehensive investigation and comparison of surface microstructure of fractionated potato starches[J]. Food Hydrocolloids,2019,89:11−19. doi: 10.1016/j.foodhyd.2018.10.017
[35] MA M T, XU Z K, CHEN X J, et al. Architecture of outer shell and inner blocklets of rice starch granule is related to starch granule-associated proteins[J]. Food Hydrocolloids,2022,127:107551. doi: 10.1016/j.foodhyd.2022.107551
[36] LU F, ZHU X F, TAO H, et al. Controlling starch surface characteristics - Impact on dough formation in a reconstituted dough system[J]. Lwt-Food Science and Technology,2022,163:113591. doi: 10.1016/j.lwt.2022.113591
[37] 蒲华寅. 等离子体作用对淀粉结构及性质影响的研究[D]. 广州: 华南理工大学, 2013 PU H Y. Effects of plasma on structure and properties of starch[D]. Guangzhou: South China University of Technology, 2013.
[38] SUJKA M, JAMROZ J. Ultrasound-treated starch: SEM and TEM imaging, and functional behaviour[J]. Food Hydrocolloids,2013,31(2):413−419. doi: 10.1016/j.foodhyd.2012.11.027
[39] PUTAUX J L, BULEON A, CHANZY H. Network formation in dilute amylose and amylopectin studied by TEM[J]. Macromolecules,2000,33(17):6416−6422. doi: 10.1021/ma000242j
[40] WARREN F J, GIDLEY M J, FLANAGAN B M. Infrared spectroscopy as a tool to characterise starch ordered structure-a joint FTIR-ATR, NMR, XRD and DSC study[J]. Carbohydrate Polymers,2016,139:35−42. doi: 10.1016/j.carbpol.2015.11.066
[41] WANG S J, COPELAND L. Effect of alkali treatment on structure and function of pea starch granules[J]. Food Chemistry,2012,135(3):1635−1642. doi: 10.1016/j.foodchem.2012.06.003
[42] 王超. 高静压糊化大米淀粉结构及机制研究[D]. 北京: 中国农业大学, 2020 WANG C. Study on the structure and mechanism of high static pressure gelatinized rice starch[D]. Beijing: China Agricultural University, 2020.
[43] ZHU Y C, CUI B, YUAN C, et al. A new separation approach of amylose fraction from gelatinized high amylose corn starch[J]. Food Hydrocolloids,2022,131:107759. doi: 10.1016/j.foodhyd.2022.107759
[44] WANG S Q, WU T H, CUI W J, et al. Structure and in vitro digestibility on complex of corn starch with soy isoflavone[J]. Food Science & Nutrition,2020,8(11):6061−6068.
[45] WANG Y Y, ZHAN J L, LU H, et al. Amylopectin crystal seeds: Characterization and their effect on amylopectin retrogradation[J]. Food Hydrocolloids,2021,111:106409. doi: 10.1016/j.foodhyd.2020.106409
[46] SUN B H, TIAN Y Q, CHEN L, et al. Linear dextrin as curcumin delivery system: Effect of degree of polymerization on the functional stability of curcumin[J]. Food Hydrocolloids,2018,77:911−920. doi: 10.1016/j.foodhyd.2017.11.038
[47] LU H, TIAN Y Q, MA R R. Assessment of order of helical structures of retrograded starch by Raman spectroscopy[J]. Food Hydrocolloids,2023,134:108064. doi: 10.1016/j.foodhyd.2022.108064
[48] GUO Z B, JIA X Z, LIN X, et al. Insight into the formation, structure and digestibility of lotus seed amylose-fatty acid complexes prepared by high hydrostatic pressure[J]. Food and Chemical Toxicology,2019,128:81−88. doi: 10.1016/j.fct.2019.03.052
[49] ZHENG Y X, OU Y J, ZHANG C, et al. The impact of various exogenous type starch on the structural properties and dispersion stability of autoclaved lotus seed starch[J]. International Journal of Biological Macromolecules,2021,175:49−57. doi: 10.1016/j.ijbiomac.2021.01.175
[50] HUANG S Q, CHAO C, YU J L, et al. New insight into starch retrogradation: The effect of short-range molecular order in gelatinized starch[J]. Food Hydrocolloids,2021,120:106921. doi: 10.1016/j.foodhyd.2021.106921
[51] MAZEAU K, NISHIYAMA Y, OGAWA Y, et al. Crystal and molecular structure of V-amylose complexed with butan-1-ol[J]. Polymer,2022,243:124651. doi: 10.1016/j.polymer.2022.124651
[52] XU J C, KUANG Q R, WANG K, et al. Insights into molecular structure and digestion rate of oat starch[J]. Food Chemistry,2017,220:25−30. doi: 10.1016/j.foodchem.2016.09.191
[53] LEE S, LEE J H, CHUNG H J. Impact of diverse cultivars on molecular and crystalline structures of rice starch for food processing[J]. Carbohydrate Polymers,2017,169:33−40. doi: 10.1016/j.carbpol.2017.03.091
[54] LOPEZ-RUBIO A, FLANAGAN B M, GILBERT E P, et al. A novel approach for calculating starch crystallinity and its correlation with double helix content: A combined XRD and NMR study[J]. Biopolymers,2008,89(9):761−768. doi: 10.1002/bip.21005
[55] LACERDA L D, LEITE D C, DA SILVEIRA N P. Relation-ships between enzymatic hydrolysis conditions and properties of rice porous starches[J]. Journal of Cereal Science,2019,89:102819.
[56] 施晓丹, 汪少芸. 多孔淀粉的制备与应用研究进展[J]. 中国粮油学报,2021,36(2):187−195. [SHI S D, WANG S Y. Research progress in preparation and application of porous starch[J]. Journal of the Chinese Cereals and Oils Association,2021,36(2):187−195. SHI S D, WANG S Y. Research progress in preparation and application of porous starch[J]. Journal of the Chinese Cereals and Oils Association, 2021, 36(2): 187-195.
[57] 孟鑫, 刘妍, 田园, 等. 改性淀粉胶粘剂的研究进展[J]. 化学与粘合,2022,44(3):248−52. [MENG X, LIU Y, TIAN Y, et al. Research progress in modified starch adhesives[J]. Chemistry and Adhesion,2022,44(3):248−52. MENG X, LIU Y, TIAN Y, et al. Research Progress in Modified Starch Adhesives[J]. Chemistry and Adhesion, 2022, 44(3): 248-52.
[58] 闫倩倩, 孔青, 续飞, 等. 改性淀粉基可食性膜的制备及性能研究[J]. 中国粮油学报,2021,36(2):41−46. [YAN Q Q, KONG Q, XU F, et al. Preparation and properties of edible films based on modified starch[J]. Journal of the Chinese Cereals and Oils Association,2021,36(2):41−46. YAN Q Q, KONG Q, XU F, et al. Preparation and properties of edible films based on modified starch [j]. journal of the chinese cereals and oils association, 2021, 36(2): 41-46.
[59] 刘华玲, 史苗苗, 周亚萍, 等. 茶多酚/直链淀粉复合物的制备及表征[J]. 食品工业科技,2019,40(2):113−118. [LIU H L, SHI M M, ZHOU Y P, et al. Preparation and characterization of tea polyphenols/amylose complexes[J]. Science and Technology of Food Industry,2019,40(2):113−118. LIU H L, SHI M M, ZHOU Y P, et al. Preparation and characterization of tea polyphenols/amylose complexes[J]. Science and Technology of Food Industry, 2019, 40(2): 113-118.
[60] 朱立斌, 徐飞, 李博, 等. 支链聚合度对菠萝蜜支链淀粉与月桂酸复合物理化特性的影响[J]. 食品工业科技,2021,42(21):65−72. [ZHU L B, XU F, LI B, et al. Effect of polymerization degree of amylopectin on the physical and chemical properties of complexes of Jackfruit amylopectin and lauric acid[J]. Science and Technology of Food Industry,2021,42(21):65−72. ZHU L B, XU F, LI B, et al. Effect of polymerization degree of amylopectin on the physical and chemical properties of complexes of Jackfruit amylopectin and lauric acid[J]. Science and Technology of Food Industry, 2021, 42(21): 65-72.
[61] WULFF G, AVGENAKI G, GUZMANN M S P. Molecular encapsulation of flavours as helical inclusion complexes of amylose[J]. Journal of Cereal Science,2005,41(3):239−249. doi: 10.1016/j.jcs.2004.06.002





 下载:
下载:
 下载:
下载:
