Effects of Royal Jelly Peptide on Motor Ability and Gene Expression in Zebrafish Model of Alzheimer's Disease
-
摘要: 目的:探究蜂王浆酶解产物(蜂王浆肽)对阿尔茨海默症(Alzheimer's disease,AD)模型斑马鱼的影响。方法:将150尾(4 dpf)的野生型AB品系斑马鱼随机分为正常组、模型组、盐酸多奈哌齐阳性对照组(3.33 μg/mL)、蜂王浆酶解液冻干粉-1组(LPR-1,1000 μg/mL)和蜂王浆酶解液冻干粉-2组(LPR-2,1000 μg/mL),于6孔板中进行实验,每孔容量为3 mL,每组30尾。除正常组外,其它组斑马鱼采用水溶给予六水氯化铝(180 μmol/L)方法建立AD斑马鱼模型。各实验组同时给予相应药物处理24 h后,对其运动功能障碍恢复功效、反应能力改善功效、乙酰胆碱酯酶(AchE)抑制功效与脑凋亡抑制功效进行评价,同时计算TNF-α、caspase-3和BDNF基因的相对表达量,分析其对相关基因的影响。结果:LPR-1、LPR-2给药组和模型对照组比较,斑马鱼总运动距离延长(高度显著,P<0.01),每分钟光暗运动速度差值与BDNF基因相对表达量极显著提升(P<0.001);乙酰胆碱酯酶(AchE)荧光值(极显著,P<0.001)与脑部凋亡细胞荧光强度(高度显著,P<0.01)下降,TNF-α基因相对表达量(高度显著,P<0.01)与caspase-3基因相对表达量(显著,P<0.05)降低。结论:LPR-1和LPR-2均具有防治阿尔茨海默症功效,具有在防治阿尔茨海默症功能食品开发中的应用潜力。Abstract: Objective: Investigation of the trait improvement impact of royal jelly enzymatic products (royal jelly peptides) on Alzheimer's disease (AD) model zebrafishes. Methods: 150 wild-type AB strain zebrafishes (4 days after fertilization, 4 dpf) were randomly divided into normal group, model control group, donepezil hydrochloride positive control group (3.33 μg/mL), royal jelly enzymatic digest lyophilized powder-1 group (LPR-1, 1000 μg/mL) and royal jelly enzymatic digest lyophilized powder-2 group (LPR-2, 1000 μg/mL), and these groups were added in 6-well plates, respectively. The volume of each well was 3 mL, and 30 tails of zebrafishes were employed in each group. Except for the normal group, zebrafishes in other groups were treated with aluminum chloride hexahydrate (180 μmol/L) to establish AD models. The efficacy of recovery of motor dysfunction, improvement of responsiveness, inhibition of acetylcholinesterase (AchE) and inhibition of apoptosis were evaluated for each experimental group after treated with corresponding drugs simultaneously for 24 h. The relative expressions of TNF-α, caspase-3 and BDNF genes were also calculated and their effects on related genes were analyzed. Results: Compared to the model control group, the LPR-1 and LPR-2 administration groups zebrafishes showed prolonged total locomotor distance (highly significant, P<0.01), the differential speed of light and dark motion per minute (P<0.001) and the relative expression of BDNF gene (P<0.001) were significantly increased. Acetylcholinesterase (AchE) fluorescence values (extremely significant, P<0.001) and brain apoptotic cell fluorescence intensity (highly significant, P<0.01) were decreased, and the relative expression of TNF-α gene (highly significant, P<0.01) and caspase-3 gene (significant, P<0.05) were also decreased. Conclusion: Both of LPR-1 and LPR-2 have anti-Alzheimer's disease efficacy, and have potential for the development of functional foods for the prevention or treatment of Alzheimer's disease.
-
阿尔茨海默症(Alzheimer's disease,AD)又称老年痴呆症,是一种起病隐匿、进行性发展的神经系统退行性疾病[1]。以记忆力下降和认知功能障碍为特征的复杂的多因素慢性进行性精神衰退疾病[2],临床表现为进行性记忆和认知能力减退[3]、语言障碍、精神运动异常等症状。患者早期以近记忆下降为主,疾病后期远期记忆也受累及,日常生活受到影响,表现为学习新知识困难,工作主动性下降,承担新任务无法胜任,并随时间推移而加重,伴有语言障碍、计算障碍,视空间障碍,丧失日常技能,失去认知能力,最终导致大部分脑部和身体组织器官受损甚至死亡[4−5]。
阿尔茨海默症发病原因及发病机理非常复杂,目前仍未阐明[6],尚无特效的治疗药物。蜂王浆作为一种多领域认知增强剂,可以恢复阿尔茨海默症模型的认知功能障碍[7],蜂王浆的提取物能显著地提高神经干细胞向神经元、星状细胞和胶质细胞的分化,是一种对大脑具有神经营养和神经保护作用的食品。其作用机制可能与以下几个方面有关:促进神经保护系统相关神经元的转录和免疫反应活性,增强海马神经元生长抑素基因的表达[8];降低血浆总胆固醇和低密度脂蛋白胆固醇水平[9],增强神经元的代谢活动,减少阿尔茨海默症发病机制中有毒的β-淀粉样蛋白(Aβ)水平,减轻神经退行性变和氧化应激水平,并增加海马区新神经元的增殖[10−12]。
目前的研究大多聚焦于蜂王浆原料对阿尔茨海默症功能的研究,蜂王浆是蜂王的主要食物,由水、蛋白质、碳水化合物、脂质、矿物质等组成的乳液体系,营养丰富,蛋白质占比达15%,它有助于提升蜂王的繁殖力,可以有效促进神经保护系统相关神经元的转录和免疫反应活性,但蜂王浆味酸,口感涩,质地粘稠且不易保存,制约了其发展,蜂王浆酶解为多肽后可以改善其不良风味,增加稳定性,更加方便贮藏运输,但是否具有防治阿尔茨海默症功效值得探究。蜂王浆组成复杂,发挥功效成分不明确,酶解后制备成肽测定其活性功能更有助于明确其作用组分。研究表明,将原料蛋白酶解为多肽后,也有明显的防治阿尔茨海默症功效[13]。本文以蜂王浆酶解产物(蜂王浆肽)为样品,六水氯化铝建立斑马鱼阿尔茨海默症模型,探讨蜂王浆肽对阿尔茨海默症模型斑马鱼的影响,为蜂王浆类防治阿尔茨海默症功能产品的开发提供数据支持。
1. 材料与方法
1.1 材料与仪器
蜂王浆 山东丰采健康产业有限公司;蜂王浆酶解液冻干粉-1(LPR-1)、蜂王浆酶解液冻干粉-2(LPR-2) 实验室自制;酸性蛋白酶 南宁庞博生物工程有限公司,100000 U/g;野生型AB品系斑马鱼 杭州环特杭州环特生物科技股份有限公司;黑色素等位基因突变Albino品系斑马鱼 杭州环特杭州环特生物科技股份有限公司;盐酸多奈哌齐 加拿大TRC公司;六水氯化铝 上海阿拉丁生化科技股份有限公司;二甲基亚砜(DMSO) Sigma公司;吖啶橙 上海麦克林生化科技有限公司;乙酰胆碱酯酶检测试剂盒 AAT Bioquest公司;甲基纤维素 上海阿拉丁生化科技股份有限公司;RNA快速提取试剂盒 上海奕杉生物;第一链合成试剂盒 天根生化科技(北京)有限公司。
SZX7解剖显微镜 OLYMPUS公司;VertA1CCD相机 上海土森视觉科技有限公司;AZ100电动聚焦连续变倍荧光显微镜 Nikon公司;Zebra Lab 3.22行为分析仪 ViewPoint公司;SPARK多功能酶标仪 TECAN公司;CFX96荧光定量PCR仪 BIO-RAD公司;BE-6100微孔板迷你离心机 海门市其林贝尔仪器制造有限公司;OSE-Y30高速组织研磨器 天根生化科技(北京)有限公司。
1.2 实验方法
1.2.1 LPR-1与LPR-2的制备
称取一定量的蜂王浆,在料液比(蜂王浆:水)1:4(g/mL),初始pH为5,酶解温度为45 ℃,加酶量9000 U/g时使用酸性蛋白酶酶解5 h;在料液比(蜂王浆:水)为1:4(g/mL),酶解温度为55 ℃,加酶量为10000 U/g时使用酸性蛋白酶酶解4 h,酶解结束后沸水浴10 min,8000 r/min离心20 min后取上清冷冻干燥待用。分别将上述酶解液冻干粉配制成200 mg/mL溶液,过膜后经葡聚糖凝胶G-15层析分离,超纯水洗脱,洗脱条件:流速3.5 mL/min,上样量为1 mL。在上述两种酶解条件,相同洗脱条件下洗脱,在第一种酶解条件下,收集1800~2700 s的洗脱峰,命名为LPR-1,在第二种酶解条件下,收集2900~4400 s的洗脱峰,命名为LPR-2。
1.2.2 最小中毒浓度(minimum toxic concentration,MTC)测定
LPR-1,LPR-2分别用标准稀释水配制成20.0 mg/mL的母液,分装后−20 ℃储存。盐酸多奈哌齐[14−15]用DMSO配制成3.33 mg/mL母液,−20 ℃储存。将150尾受精后4 d(4 dpf)野生型AB品系斑马鱼随机分为正常组、模型组、盐酸多奈哌齐阳性对照组(3.33 μg/mL)、蜂王浆酶解液冻干粉-1组(LPR-1)和蜂王浆酶解液冻干粉-2组(LPR-2)于6孔板中,每孔容量为3 mL,每组30尾。除正常组外,其它组斑马鱼采用水溶给予六水氯化铝(180 μmol/L)建立AD斑马鱼模型,实验组同时给予相应药物(浓度见表2),28 ℃处理24 h后,测定样品对模型斑马鱼的MTC。
表 2 样品防治阿尔茨海默症功效浓度摸索实验结果(n=30)Table 2. Concentration of sample for prevention and treatment of AD (n=30)组别 浓度(μg/mL) 死亡数(尾) 死亡率(%) 表型 正常对照组 − 0 0 未见明显异常 模型对照组 − 0 0 未见明显异常 LPR-1 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 10 33 − LPR-2 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 30 100 − 1.2.3 运动功能障碍恢复功效评价
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼,参照“1.2.2”建立斑马鱼阿尔茨海默症模型,28 ℃处理24 h后,每个实验组随机选择10尾斑马鱼转移至96孔板中,200 μL/尾,1尾/孔,利用行为分析仪采集数据,分析斑马鱼总运动距离,以该指标的统计学分析结果评价样品运动功能障碍恢复功效。
1.2.4 反应能力改善功效评价
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼,参照“1.2.2”建立斑马鱼阿尔茨海默症模型,28 ℃处理24 h后,每个实验组随机选取10尾斑马鱼,利用行为分析仪测定光暗刺激下斑马鱼的每分钟光暗速度差值,以该指标的统计学分析结果评价样品反应能力改善功效。
1.2.5 乙酰胆碱酯酶(acetylcholinesterase,AchE)抑制功效评价
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼,参照“1.2.2”建立斑马鱼阿尔茨海默症模型,28 ℃处理48 h后,将斑马鱼转移到96孔板,采用乙酰胆碱酯酶测定试剂盒,利用多功能酶标仪采集数据,分析斑马鱼分析斑马鱼体内乙酰胆碱酯酶[16−17]荧光值,以该指标的统计学分析结果评价样品对乙酰胆碱酯酶的抑制功效。
1.2.6 脑凋亡抑制功效评价
随机选取4 dpf黑色素等位基因突变Albino品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。参照“1.2.2”建立斑马鱼阿尔茨海默症模型,28 ℃处理24 h后,用吖啶橙(AO)对凋亡细胞进行染色,染色结束后每个实验组随机选择10尾斑马鱼置于荧光显微镜下拍照,用NIS-ElementsD 3.20高级图像处理软件分析并采集数据,分析斑马鱼脑部凋亡细胞的荧光强度,以该指标的统计学分析结果评价样品对脑凋亡的抑制功效[18]。
1.2.7 对相关基因的影响
随机选取4 dpf野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼。参照“1.2.2”建立斑马鱼阿尔茨海默症模型,28 ℃处理24 h后,使用RNA快速提取试剂盒提取斑马鱼总RNA,用紫外-可见光分光光度计测定RNA的浓度及A260/A280比值,A260/A280比值均在1.8~2.2之间[19],表明提取得到斑马鱼总RNA质量较好,可用于后续qPCR实验。引物序列见表1。取2.00 μg斑马鱼样品总RNA,按照cDNA第一链合成试剂盒说明操作,合成20.0 μL cDNA,通过qPCR检测β-actin、TNF-α、caspase-3[20]和BDNF[21]基因的表达。qPCR方法:采用CFX96实时荧光定量聚合酶链反应体系(95 ℃下2 min;95 ℃下5 s,60 ℃下30 s,40个循环)。反应体积为10 μL(cDNA 4.5 μL,正向引物0.25 μL,反向引物0.25 μL,5 μL SYBR Green)。用β-actin作为基因表达的内参,计算TNF-α、caspase-3和BDNF基因的RNA相对表达量。
表 1 引物序列信息Table 1. Primer sequence information基因 引物序列 β-actin Forward 5′-TCGAGCAGGAGATGGGAACC-3′ Reverse 5′-CTCGTGGATACCGCAAGATTC-3′ TNF-α Forward 5′-AGGAGAGTTGCCTTTACCGC-3′ Reverse 5′-AATGGATGGCAGCCTTGGAA-3′ Caspase-3 Forward 5′-GGACATGCGGATACGGAGAC-3′ Reverse 5′-TGCAGATGCCCCATCCTTAC-3′ BDNF Forward 5′-TGGGTAAATCGCGACTGGTT-3′ Reverse 5′-CTGTTGGAACATTTTCCCCTATG-3′ 1.3 数据处理
统计学处理结果采用平均值±标准误差(Mean±SE)表示。用SPSS26.0软件进行统计学分析,P<0.05表明差异具有统计学意义。采用Origin 2019 软件作图。
2. 结果与分析
2.1 最小中毒浓度(MTC)测定
MTC是药物引起毒性反应的最小浓度,其是药物安全性的评价指标之一[22]。由表2可知,LPR-1在浓度为1000 μg/mL时死亡率为0%,且与模型对照组状态相似。浓度为2000 μg/mL时死亡率为33%。LPR-2在浓度为1000 μg/mL时死亡率为0%,且与模型对照组状态相似。浓度为2000 μg/mL时死亡率为100%。综上,LPR-1,LPR-2对防治阿尔茨海默症功效评价的MTC均为1000 μg/mL。
2.2 运动功能障碍恢复功效评价
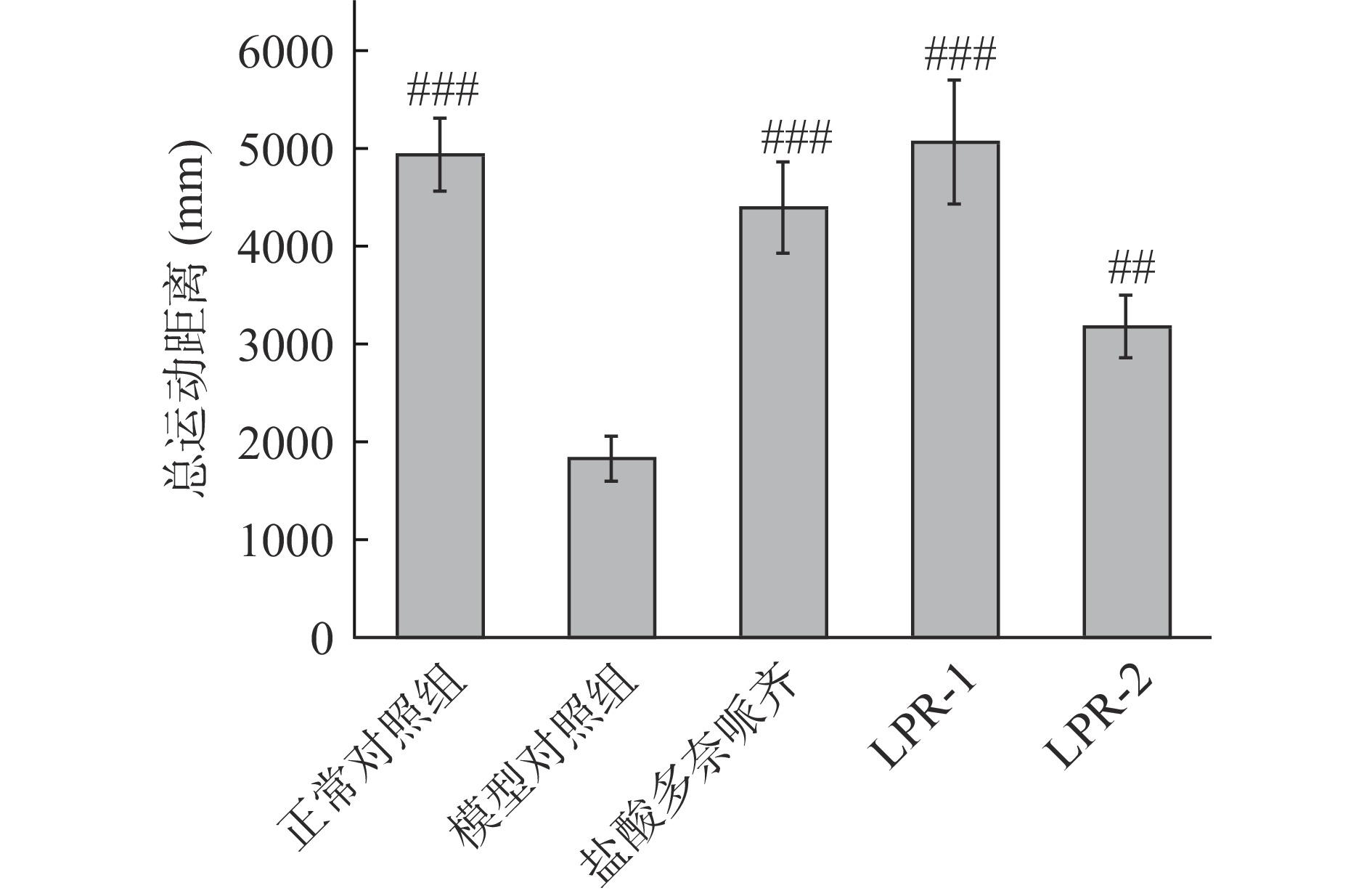
运动能力下降是AD患者典型的临床表现之一,通过行为分析仪分析可检测样品改善斑马鱼运动能力的效果。由图1和图2可知,模型组斑马鱼总运动距离较正常组显著性下降(极显著,P<0.001),表明造模成功,LPR-1组,LPR-2组和模型对照组比较,斑马鱼总运动距离延长,分别延长1.8倍(极显著,P<0.001)和0.7倍(高度显著,P<0.01),阳性对照盐酸多奈哌齐组延长1.4倍。实验结果表明LPR-1,LPR-2均具有对运动功能障碍恢复的功效。
2.3 反应能力改善功效评价
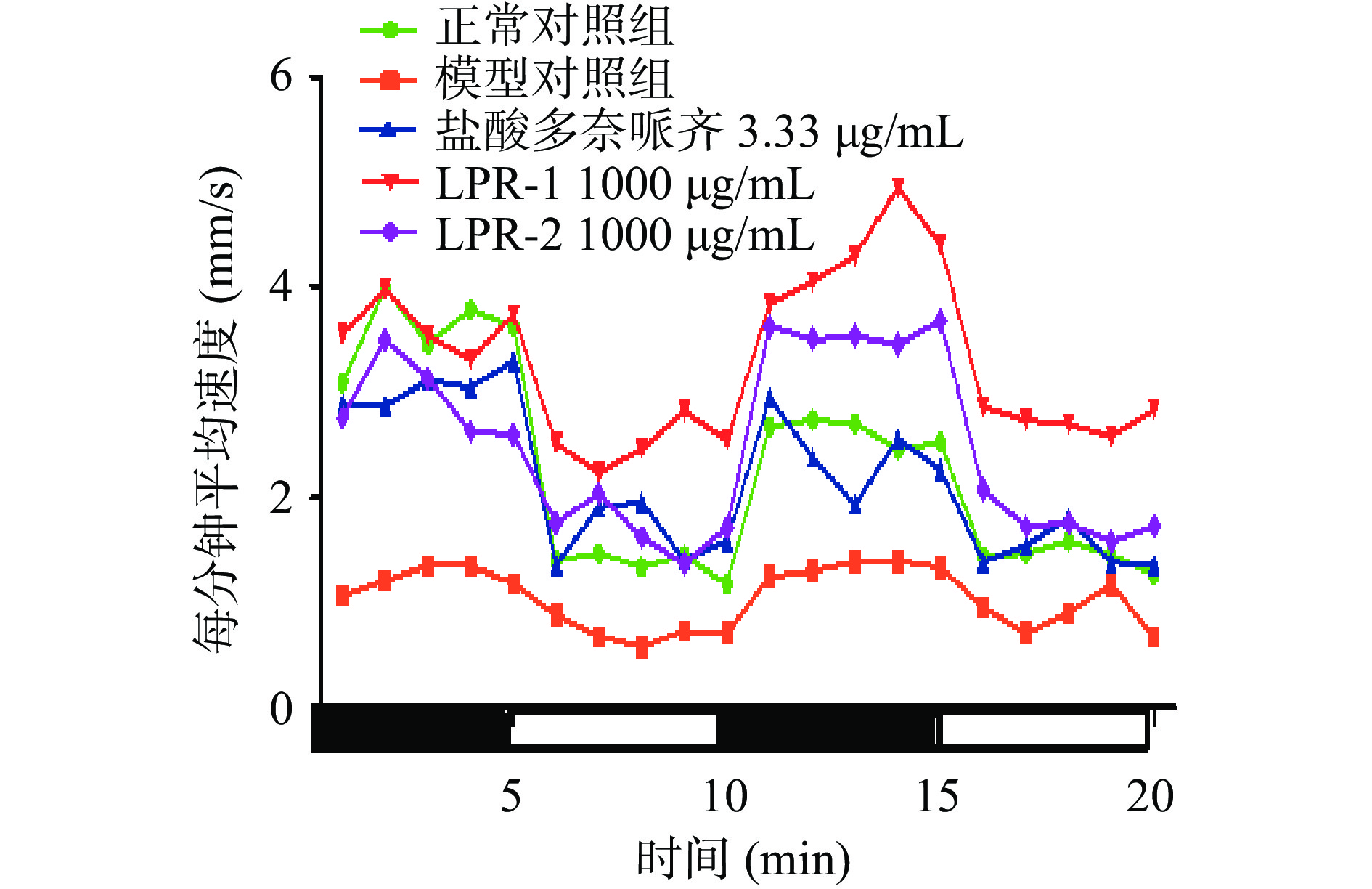
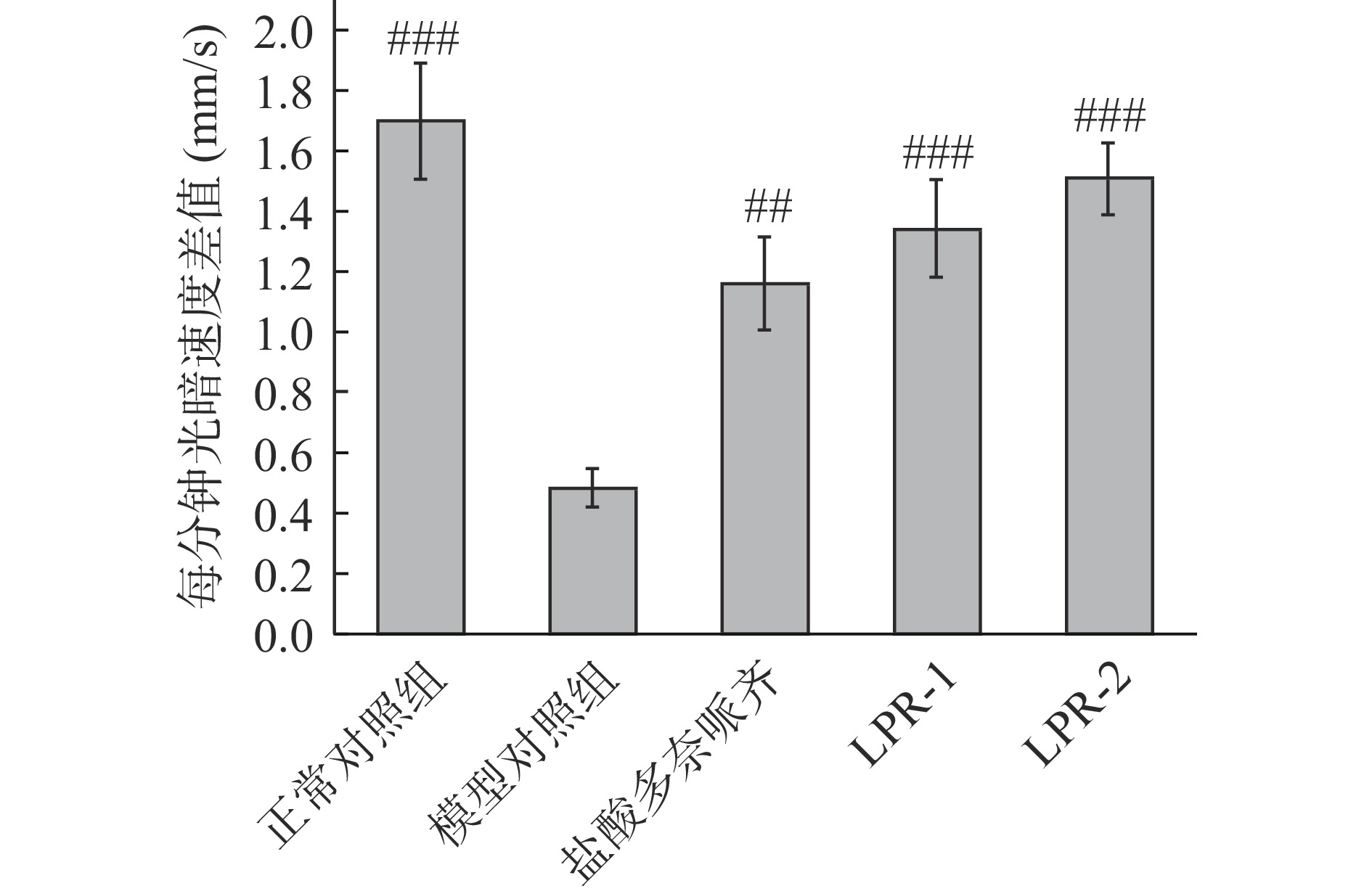
反应能力下降是AD患者典型的临床表现之一,通过明暗交替行为学实验可检测样品改善AD斑马鱼对应激刺激的恢复能力。从图3可以看出,模型组斑马鱼每分钟平均速度均低于其他组,结合图4可知,模型组较正常组每分钟光暗速度差值极显著下降(P<0.001),表明造模成功,LPR-1组,LPR-2组和模型对照组比较,斑马鱼每分钟光暗速度差值均极显著延长(P<0.001),分别延长1.8倍、2.1倍,阳性对照盐酸多奈哌齐组延长1.4倍。实验结果表明LPR-1,LPR-2均具有对反应能力改善的功效。
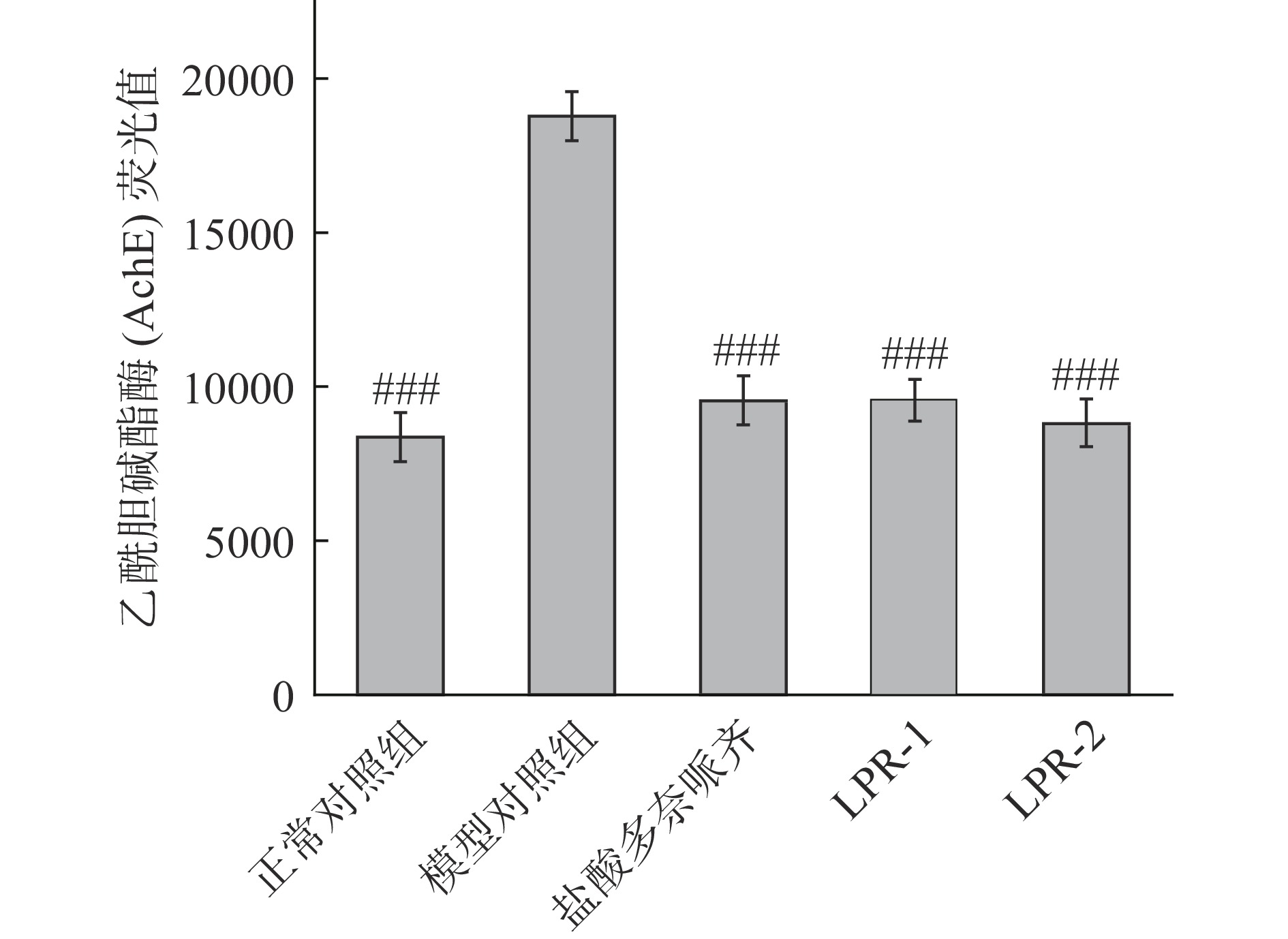
2.4 乙酰胆碱酯酶抑制功效评价
尽管阿尔茨海默病的病因尚不清楚,但使用乙酰胆碱酯酶抑制剂来减少神经递质乙酰胆碱的分解已经成为轻到中度阿尔茨海默病患者的主要对症治疗方式。乙酰胆碱酯酶抑制剂已被发现在广泛的动物模型中可以改善认知障碍,并已被中国用于阿尔茨海默病的治疗[17]。由图5可知,LPR-1组,LPR-2组和模型对照组比较,斑马鱼AchE荧光值均极显著降低(P<0.001),分别降低49%和53%,阳性对照盐酸多奈哌齐组降低49%。实验结果表明LPR-1,LPR-2均具有乙酰胆碱酯酶抑制功效。
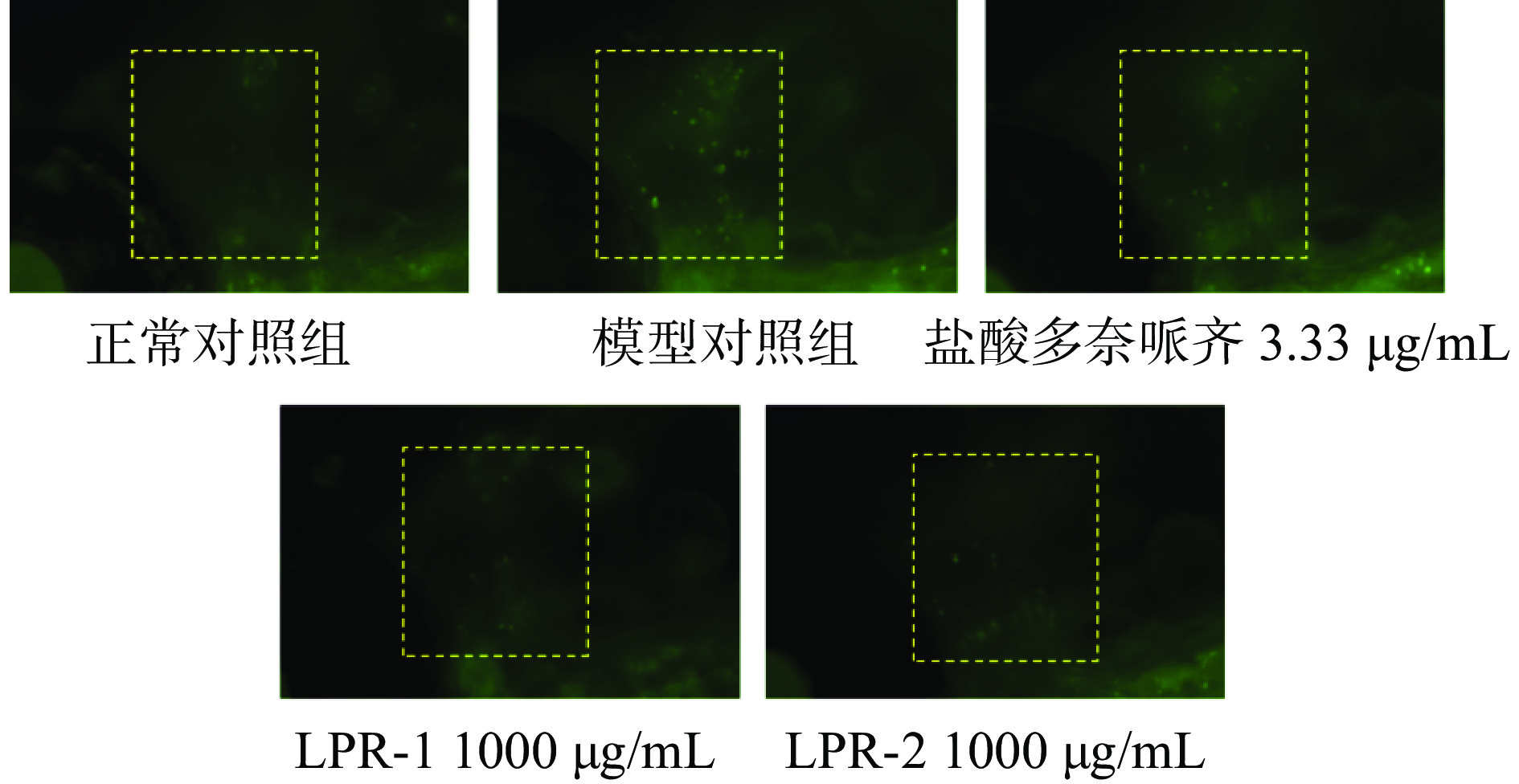
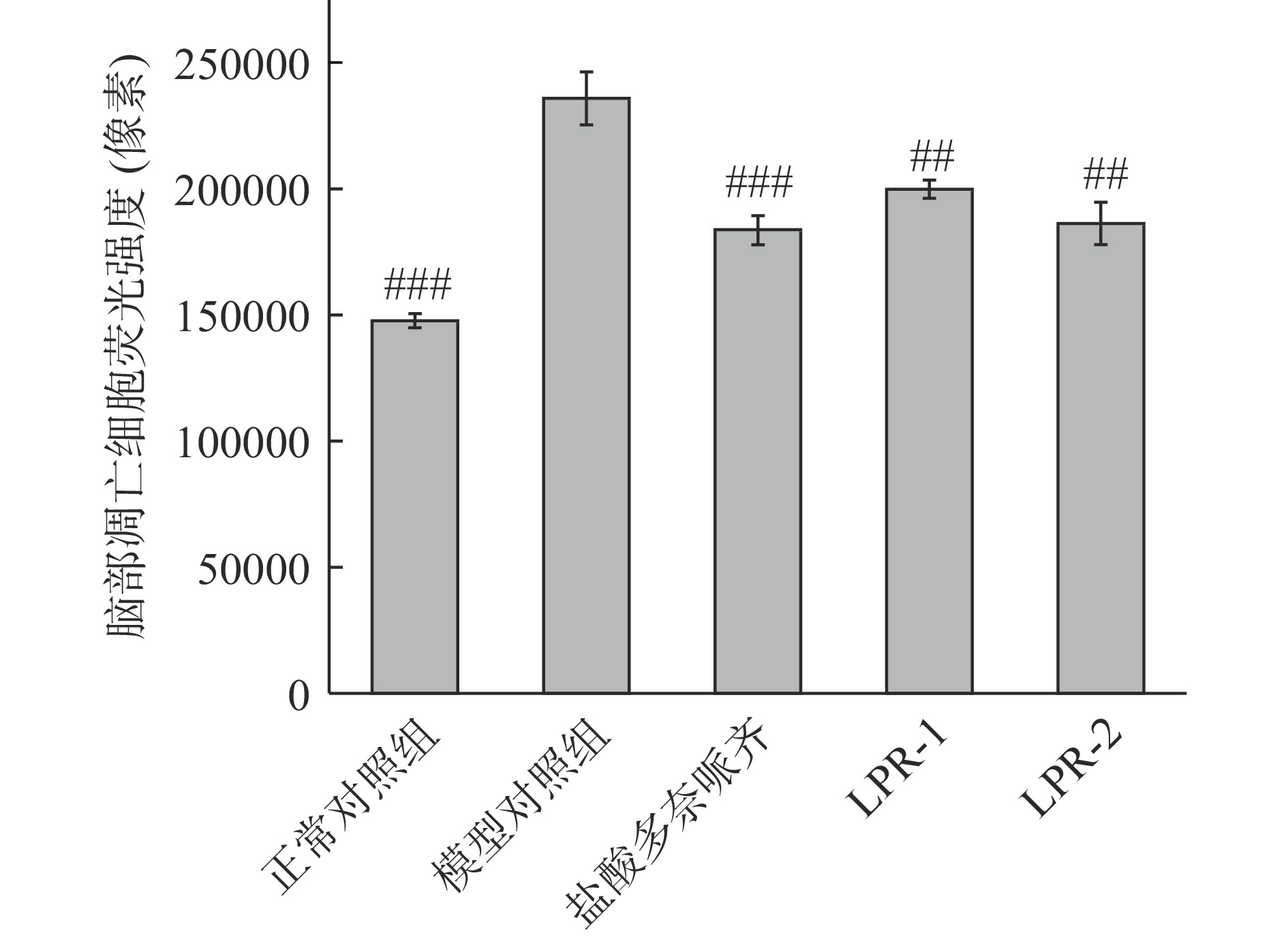
2.5 脑凋亡抑制功效评价
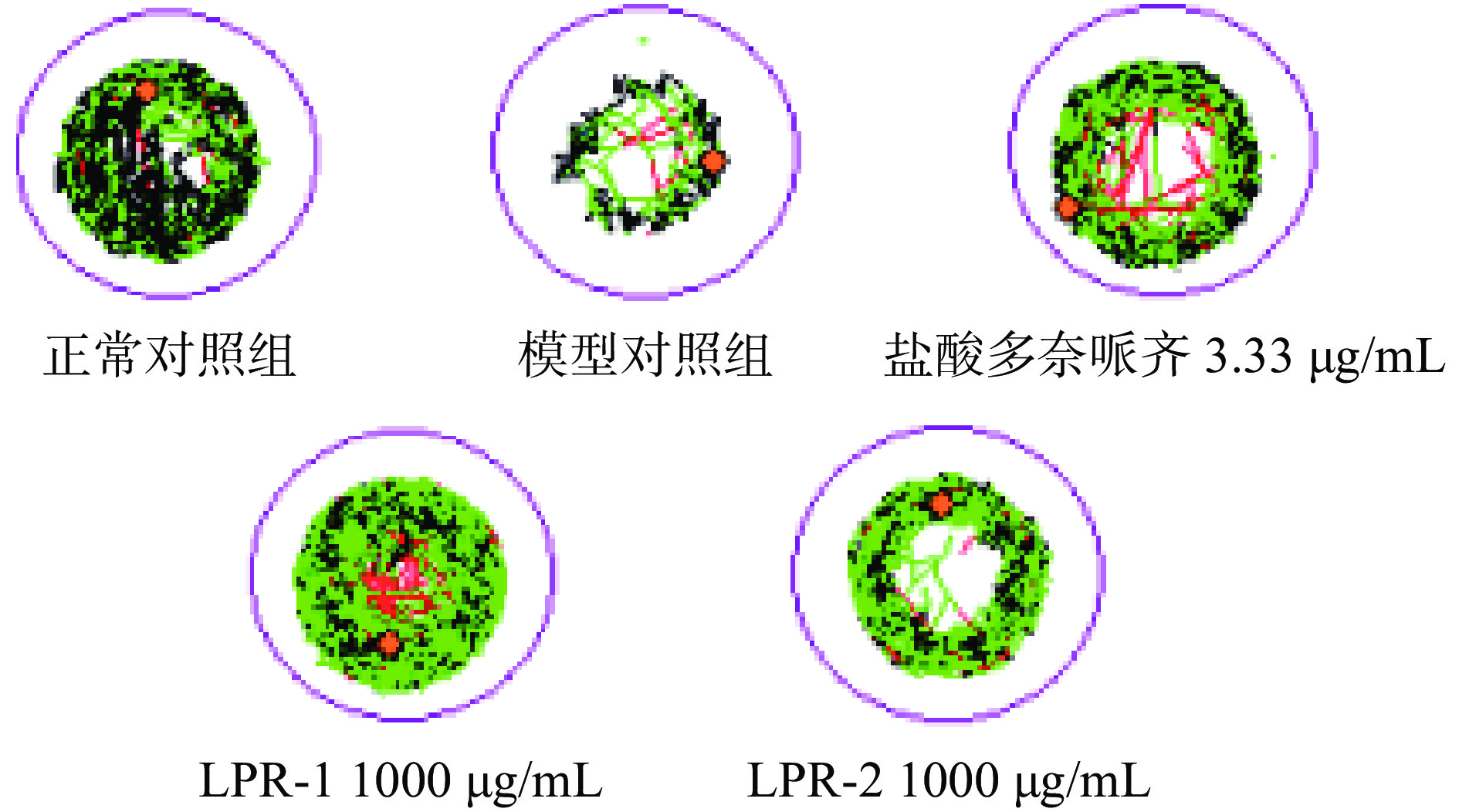
斑马鱼脑区细胞凋亡情况检测脑区细胞凋亡是AD典型的病理学特征之一,通过AO染色后可以对各组斑马鱼脑区细胞凋亡情况进行检测,验证斑马鱼AD样行为与脑区细胞凋亡的关联一致性[18]。从图6中可看出模型组的荧光颗粒较正常组显著增加,表明造模成功,图7经过定量分析显示,LPR-1、LPR-2和模型对照组比较,斑马鱼脑部凋亡细胞荧光强度降低(高度显著,P<0.01),分别降低15%、21%,阳性对照盐酸多奈哌齐组降低22%。实验结果表明LPR-1,LPR-2均具有抑制斑马鱼脑凋亡功效。
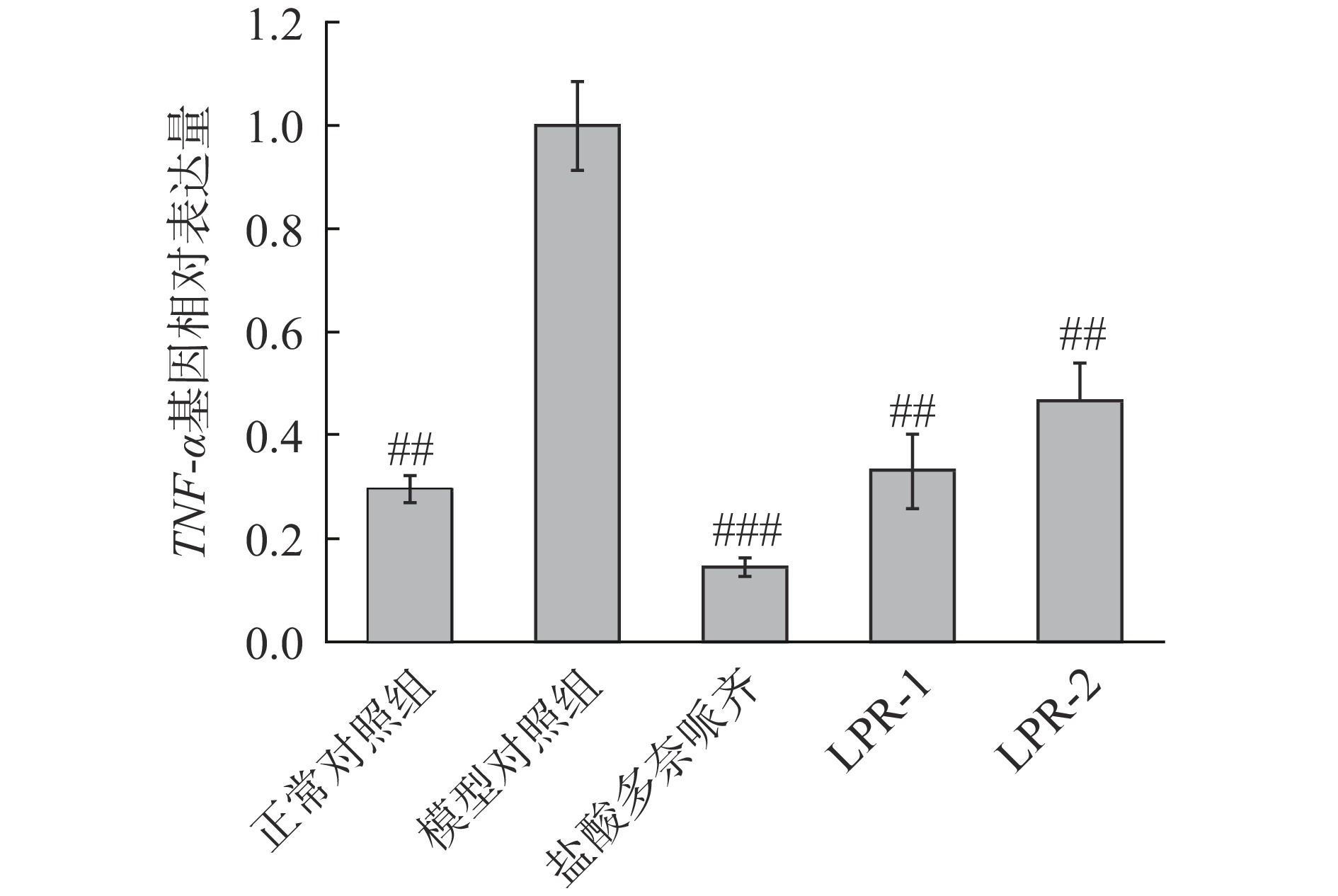
2.6 对相关基因的影响
炎性细胞因子TNF-α与阿尔茨海默病转基因小鼠记忆能力相关[23]。由图8可知,模型组较正常组TNF-α基因相对表达量升高(高度显著,P<0.01),表明造模成功,LPR-1、LPR-2和模型对照组比较,斑马鱼TNF-α基因相对表达量显著降低(P<0.01),分别降低67%、53%,阳性对照盐酸多奈哌齐组降低86%。实验结果表明LPR-1,LPR-2均具有下调TNF-α基因相对表达量功效。
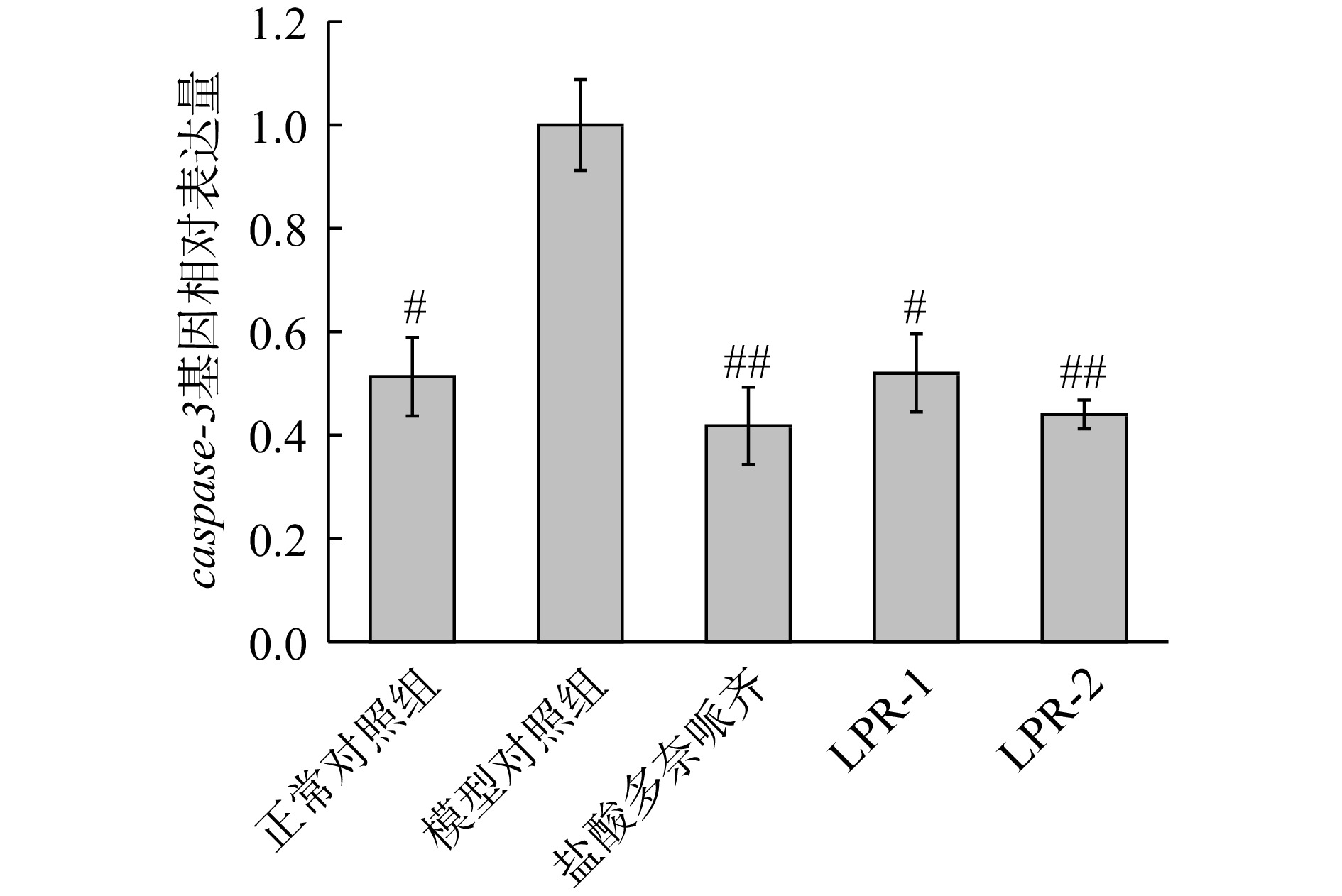
星形胶质细胞增生和caspase-3的激活通常被认为是海马区细胞凋亡的主要标志[24]。由图9可知,模型组较正常组caspase-3基因相对表达量显著升高(P<0.05),表明造模成功,LPR-1,LPR-2和模型对照组比较,斑马鱼caspase-3基因相对表达量分别降低了48%(P<0.05)和56%(高度显著,P<0.01),阳性对照盐酸多奈哌齐组降低58%。实验结果表明LPR-1,LPR-2均具有下调caspase-3基因相对表达量功效。
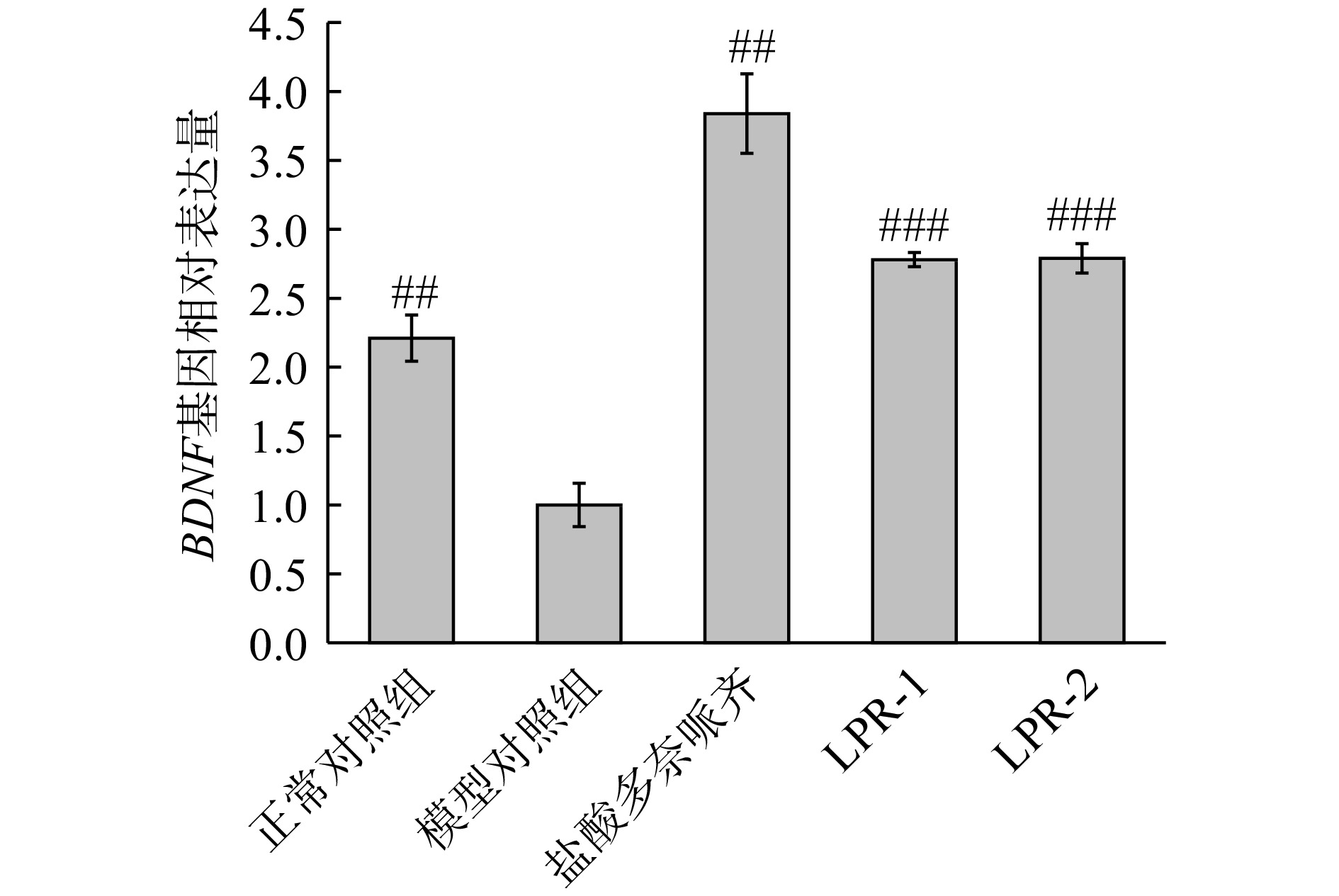
神经营养因子,如脑源性神经营养因子,对神经元的生存和生长是必不可少的。脑源性神经营养因子及其受体启动的信号转导通路是突触可塑性的关键调节因子,在学习记忆形成中起着重要作用。阿尔茨海默病已经发现BDNF水平和信号通路的变化,BDNF水平这些与疾病的症状和病程有关[21]。由图10可知,模型组较正常组BDNF基因相对表达量下降(高度显著,P<0.01)表明造模成功,LPR-1,LPR-2和模型对照组比较,斑马鱼BDNF基因相对表达量极显著升高(P<0.001),均升高1.8倍,阳性对照盐酸多奈哌齐组升高2.8倍。实验结果表明LPR-1,LPR-2均具有上调BDNF基因表达的功效。
3. 结论
不同蛋白酶酶解对肽活性具有一定影响,生物活性肽是对人类健康有积极影响的特定蛋白质片段,通常包括2~20个氨基酸残基,分子量<6000 Da。这些肽在亲本蛋白的序列内是无活性的,通过水解从母体蛋白中释放出来,具有特定的功效和较少的副作用。生物活性肽的功能特性活性取决于其氨基酸序列及其反映的结构特性。不同蛋白酶水解程度不同,酶切位点不同,所得到最终的序列也不同。LPR-1和LPR-2在制备过程中进行了蛋白酶的筛选,考察了五种商业蛋白酶抗氧化活性,实验结果表明,酸性蛋白酶酶解效果最好,其次是碱性蛋白酶和中性蛋白酶,木瓜蛋白酶和菠萝蛋白酶效果较差。
目前用于治疗AD的药物主要有乙酰胆碱酶抑制剂、谷氨酸受体拮抗剂、吡拉西坦及其他一些具有缓解AD症状的药物。乙酰胆碱酶抑制剂如他克林、加兰他敏、利斯的明等都存在消化道不良反应,应谨慎应用;谷氨酸受体拮抗剂如美金刚可以降低神经元的损伤情况但存在一些头晕、头痛的不良反应[25]。蜂王浆属于天然食物,蜂王浆肽具有更高的稳定性、安全性,利用高效、便捷、安全的酶解法和微生物发酵法,经过工艺的合理控制,可以提供特定的生产条件实现产品的一致性,可广泛应用于肽的大量生产。
Sang等[26]表明以斑马鱼模型具有进行探究AD机制的可行性。AD发病机制复杂,现代医学认为,细胞凋亡[27],TNF炎症因子与AD发病密切相关。任擎宇等[18]通过TUNEL染色法探究金盏菊对AD斑马鱼的影响,结果表明造模组凋亡细胞数明显增多,与Hadipour等[28]研究趋势一致,而在经过金盏菊处理后,AD斑马鱼脑区凋亡细胞数目显著减少;细胞凋亡又与Caspase家族[29]密切相关,所以其也与AD患者认知、行为功能障碍异常有关[30],王玥等[31]等表明阿魏酸可通过降低Caspase-3表达水平改善AD小鼠脑内细胞凋亡;Drews等[23]研究表明,TNF炎症因子降低后AD小鼠星形胶质细胞迁移特性显著改善脂质和蛋白质等的过氧化与AD相关,其影响区域主要位于海马区和内嗅皮层。通过蛋白质组分分析AD患者大脑,发现了大量氧化功能丧失的蛋白质,而这些蛋白质在能量代谢,细胞代谢等通路上至关重要。AD患者的临床和动物实验表明,在AD患者早期已经出现了氧化损伤,氧化应激标志物含量明显升高。在轻度认知障碍患者和AD患者中都观察到超氧化物歧化酶和谷胱甘肽还原酶等含量明显降低,脂质过氧化产物MDA含量显著上升。Aβ和金属离子动态平衡紊乱等因素诱导产生的氧化应激是阿尔茨海默病形成的关键因素。本实验研究结果显示,LPR-1,LPR-2蜂王浆肽均具有防治阿尔茨海默症功效,其机制可能与下调caspase-3基因水平,降低TNF-α基因相对表达量,上调BDNF基因表达,抑制脑部细胞凋亡,抑制氧化应激,减轻炎症反应有关。这些发现将为蜂王浆肽防治阿尔茨海默症提供依据。
-
表 2 样品防治阿尔茨海默症功效浓度摸索实验结果(n=30)
Table 2 Concentration of sample for prevention and treatment of AD (n=30)
组别 浓度(μg/mL) 死亡数(尾) 死亡率(%) 表型 正常对照组 − 0 0 未见明显异常 模型对照组 − 0 0 未见明显异常 LPR-1 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 10 33 − LPR-2 125 0 0 与模型对照组状态相似 250 0 0 与模型对照组状态相似 500 0 0 与模型对照组状态相似 1000 0 0 与模型对照组状态相似 2000 30 100 − 表 1 引物序列信息
Table 1 Primer sequence information
基因 引物序列 β-actin Forward 5′-TCGAGCAGGAGATGGGAACC-3′ Reverse 5′-CTCGTGGATACCGCAAGATTC-3′ TNF-α Forward 5′-AGGAGAGTTGCCTTTACCGC-3′ Reverse 5′-AATGGATGGCAGCCTTGGAA-3′ Caspase-3 Forward 5′-GGACATGCGGATACGGAGAC-3′ Reverse 5′-TGCAGATGCCCCATCCTTAC-3′ BDNF Forward 5′-TGGGTAAATCGCGACTGGTT-3′ Reverse 5′-CTGTTGGAACATTTTCCCCTATG-3′ -
[1] DUBOIS B, FELDMAN H H, JACOVA C, et al. Advancing research diagnostic criteria for Alzheimer's disease: The IWG-2 criteria[J]. The Lancet Neurology,2014,13(6):614−629. doi: 10.1016/S1474-4422(14)70090-0
[2] OSSENKOPPELE R, PIJNENBURG Y a L, PERRY D C, et al. The behavioural/dysexecutive variant of Alzheimer's disease: Clinical, neuroimaging and pathological features[J]. Brain,2015,138(9):2732−2749. doi: 10.1093/brain/awv191
[3] JESSEN F, AMARIGLIO R E, VANBOXTEL M, et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer's disease[J]. Alzheimers Dement,2014,10(6):844−52. doi: 10.1016/j.jalz.2014.01.001
[4] SCHELTENS P, BLENNOW K, BRETELER M, et al. Alzheimer's disease[J]. The Lancet,2016,388(10043):505−517. doi: 10.1016/S0140-6736(15)01124-1
[5] ZHANG X X, TIAN Y, WANG Z T, et al. The epidemiology of Alzheimer's disease modifiable risk factors and prevention[J]. J Prev Alzheimers Dis,2021,8(3):313−321.
[6] SELKOE D J, HARDY J. The amyloid hypothesis of Alzheimer's disease at 25 years[J]. EMBO Mol Med,2016,8(6):595−608. doi: 10.15252/emmm.201606210
[7] ALI A M, KUNUGI H. Royal jelly as an intelligent anti-aging agent-a focus on cognitive aging and Alzheimer's disease: A review[J]. Antioxidants (Basel),2020,9(10):937, 2−46.
[8] KAWAHATA I, XU H, TAKAHASHI M, et al. Royal jelly coordinately enhances hippocampal neuronal expression of somatostatin and neprilysin genes conferring neuronal protection against toxic soluble amyloid- β oligomers implicated in Alzheimer's disease pathogenesis[J]. Journal of Functional Foods,2018,51:28−38. doi: 10.1016/j.jff.2018.10.006
[9] PAN Y, XU J, CHEN C, et al. Royal jelly reduces cholesterol levels, ameliorates abeta pathology and enhances neuronal metabolic activities in a rabbit model of Alzheimer's disease[J]. Front Aging Neurosci,2018,10:50. doi: 10.3389/fnagi.2018.00050
[10] YOU M, PAN Y, LIU Y, et al. Royal jelly alleviates cognitive deficits and beta-amyloid accumulation in APP/PS1 mouse model via activation of the cAMP/PKA/CREB/BDNF pathway and Inhibition of neuronal apoptosis[J]. Front Aging Neurosci,2018,10:428.
[11] GUARDIA DE SOUZA E S T, DO VAL DE PAULO M E F, DA SILVA J R M, et al. Oral treatment with royal jelly improves memory and presents neuroprotective effects on icv-STZ rat model of sporadic Alzheimer's disease[J]. Heliyon,2020,6(2):e03281. doi: 10.1016/j.heliyon.2020.e03281
[12] WANG X. Royal jelly promotes DAF-16-mediated proteostasis to tolerate B-amyloid toxicity in C. elegans model of Alzheimer's disease[J]. Oncotarget,2016,7:54183−54193. doi: 10.18632/oncotarget.10857
[13] RIBARIC S. Peptides as potential therapeutics for Alzheimer's disease[J]. Molecules,2018,23(2):283.
[14] SUGIMOTO H. Donepezil hydrochloride: A treatment drug for Alzheimer's disease[J]. The Chemical Record,2001,1(1):63−73. doi: 10.1002/1528-0691(2001)1:1<63::AID-TCR9>3.0.CO;2-J
[15] SUGIMOTO H, OGURA H, ARAI Y, et al. Research and development of donepezil hydrochloride, a new type of acetylcholinesterase inhibitor[J]. Jpn J Pharmacol,2002,89(1):7−20. doi: 10.1254/jjp.89.7
[16] RELKIN N R. Beyond symptomatic therapy: A re-examination of acetylcholinesterase inhibitors in Alzheimer's disease[J]. Expert Review of Neurotherapeutics,2014,7(6):735−748.
[17] ZHANG H Y, YAN H, Tang X C. Non-cholinergic effects of huperzine A: Beyond inhibition of acetylcholinesterase[J]. Cell Mol Neurobiol,2008,28(2):173−183. doi: 10.1007/s10571-007-9163-z
[18] 任擎宇, 靳梦, 商学良, 等. 基于网络药理学和斑马鱼模型的金盏菊缓解阿尔茨海默病症状及作用机制[J]. 中国药理学通报,2022,38(3):429−436 REN Q Y, JIN M, SHANG X L, et al. Study on anti-Alzheimer's disease activity and underlying mechanism of Calendula officinalis L. based on network pharmacology and zebrafish model[J]. Chinese Pharmacological Bulletin,2022,38(3):429−436.
[19] MIAO W, HE L, ZHANG T, et al. Lentinan impairs the early development of zebrafish embryos, possibly by disrupting glucose and lipid metabolism[J]. Processes,2022,10(1):120. doi: 10.3390/pr10010120
[20] NISHIMURA I, UETSUKI T, KUWAKO K, et al. Cell death induced by a caspase-cleaved transmembrane fragment of the Alzheimer amyloid precursor protein[J]. Cell Death and Differentiation,2002,9(2):199−208. doi: 10.1038/sj.cdd.4400931
[21] AZMAN K F, ZAKARIA R. Recent advances on the role of brain-derived neurotrophic factor ( BDNF) in neurodegenerative diseases[J]. Int J Mol Sci,2022,23(12):6827, 2−24.
[22] STEHLY G R, GINGERICH W H. Evaluation of AQUI-STM (efficacy and minimum toxic concentration) as a fish anaesthetic/sedative for public aquaculture in the United States[J]. Aquaculture Research,1999,30(5):365−372. doi: 10.1046/j.1365-2109.1999.00339.x
[23] DREWS H J, KLEIN R, LOURHMATI A, et al. Losartan improves memory, neurogenesis and cell motility in transgenic Alzheimer's mice[J]. Pharmaceuticals (Basel),2021,14(2):166.
[24] GUNTHER A, LUCZAK V, ABEL T, et al. Caspase-3 and GFAP as early markers for apoptosis and astrogliosis in shRNA-induced hippocampal cytotoxicity[J]. J Exp Biol,2017,220(Pt 8):1400−1404.
[25] 董斌. 阿尔兹海默症药物研究进展[J]. 化工设计通讯,2020,46(4):221−222 DONG B. Research progress in Alzheimer's drugs[J]. Chemical Engineering Design Communications,2020,46(4):221−222.
[26] SANG Z, WANG K, SHI J, ET AL. Apigenin-rivastigmine hybrids as multi-target-directed liagnds for the treatment of Alzheimer's disease[J]. Eur J Med Chem,2020,187:111958. doi: 10.1016/j.ejmech.2019.111958
[27] 王昊, 赵振宇, 沈霞, 等. 基于系统药理学研究远志治疗阿尔茨海默病的作用机制[J]. 药学学报,2017,52(10):1554−1561 doi: 10.16438/j.0513-4870.2017-0541 WANG H, ZHAO Z Y, SHEN X, et al. System pharmacology-based study on mechanism of polygala radix in the treatment of Alzheimer's disease[J]. Acta Pharm Sin,2017,52( 10):1554−1561. doi: 10.16438/j.0513-4870.2017-0541
[28] HADIPOUR M, MEFTAHI G H, AFARINESH M R, et al. Crocin attenuates the granular cells damages on the dentate gyrus and pyramidal neurons in the CA3 regions of the hippocampus and frontal cortex in the rat model of Alzheimer's disease[J]. J Chem Neuroanat,2021,113:101837. doi: 10.1016/j.jchemneu.2020.101837
[29] GHAVAMI S, HASHEMI M, ANDE S R, et al. Apoptosis and cancer: Mutations within caspase genes[J]. J Med Genet,2009,46(8):497−510. doi: 10.1136/jmg.2009.066944
[30] ZAFEER M F, FIRDAUS F, ANIS E, et al. Prolong treatment with trans-ferulic acid mitigates bioenergetics loss and restores mitochondrial dynamics in streptozotocin-induced sporadic dementia of Alzheimer's type[J]. Neurotoxicology,2019,73:246−257. doi: 10.1016/j.neuro.2019.04.006
[31] 王玥, 王旭, 于嵩, 等. 阿魏酸对阿尔茨海默病转基因小鼠脑内氧化应激和凋亡相关蛋白的影响[J]. 天然产物研究与开发,2017,29(5):762−766 doi: 10.16333/j.1001-6880.2017.5.007 WANG Y, WANG X, YU S, et al. Effects of ferulic acid on oxidative stress and apoptosis related proteins in Alzheimer's disease trans-genic mice[J]. Nat Prod Res Dev,2017,29(5):762−766. doi: 10.16333/j.1001-6880.2017.5.007
-
期刊类型引用(1)
1. 于心雨,胡云霄,魏琳,王舒悦,李珊珊,胡福良. 2023年国内外蜂王浆研究概况. 中国蜂业. 2024(03): 38-49 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



