Optimization of Soybean Isolated Protein Enzymatic Process and Its Application in Fermented Seasonings
-
摘要: 为了提高大豆分离蛋白的加工附加值,采用单因素实验和响应面试验方法,以水解度和蛋白回收率为评价指标优化大豆分离蛋白的酶解条件,并利用谷氨酸棒杆菌发酵大豆分离蛋白酶解液制备调味料,通过谷氨酸含量和感官评价对调味料进行评估。结果表明,FH17&ZF01双酶酶解体系最佳,最优酶解条件为酶添加量2.0 g/100 g、pH7.0、底物浓度15 g/100 mL、温度54.0 ℃、酶解时间13.0 h,优化后的酶解液水解度(37.1%)和蛋白回收率(70.3%)较优化前分别提高了1.7倍和0.8倍。摇瓶发酵条件下,酶解液发酵的谷氨酸含量(32.1 g/L)较优化前提高了32.1%。20 L罐分批补料条件下,谷氨酸产量为(83.6 g/L)较优化前提高了10.0%。以分批补料发酵制备的调味料的感官评定结果表明,发酵调味料的鲜味显著提高(P<0.05),苦味显著降低(P<0.05),整体滋味更加鲜美,风味更加协调。研究结果大大提高了大豆分离蛋白的利用价值。Abstract: With the aim of improving the processing added value of soybean isolate protein, the single factor and response surface testing method were used to optimize the enzymatic conditions of soybean isolate protein using hydrolysis degree and protein recovery as evaluation indexes. The enzymatic digest of soybean isolate protein fermented by Corynebacterium glutamicum was used to prepare the seasoning, which was evaluated by glutamic acid content and sensory evaluation. The results showed that the optimal enzyme digestion conditions were 2.0 g/100 g of enzyme, pH7.0, 15 g/100 mL of substrate, 54.0 ℃, and 13.0 h. The hydrolysis degree (37.1%) and protein recovery (70.3%) of the optimized enzyme solution were 1.7 times and 0.8 times higher, respectively, than those before the optimization. In the shake flask fermentation conditions, the glutamic acid content of the enzymatic digest fermentation (32.1 g/L) was increased by 32.1% compared to that before optimization. Under the batch replenishment condition of 20 L tank, the glutamic acid yield was (83.6 g/L) 10.0% higher than before optimization. The results of sensory evaluation of the seasonings prepared by fermentation with batch replenishment showed that the freshness of the fermented seasonings was significantly improved (P<0.05), the bitterness was significantly reduced (P<0.05), and the overall taste was more delicious and flavor harmonized. The findings greatly enhance the utilization value of soybean isolate protein.
-
大豆分离蛋白(soybean protein isolate,SPI)是一种廉价、优质的植物蛋白,常以低温脱脂豆粕作为原料,经一系列物理、化学方法制备而成[1]。其蛋白水解物富含游离氨基酸、蛋白质、多肽、矿物质、糖类、维生素等营养物质,广泛应用于生物科技产业及生物发酵中[2]。在我国,大豆分离蛋白的水解物最初利用酸、碱法进行生产,但此类方法制备的大豆分离蛋白水解产物含量低,且易产生有毒有害物质,很快就被简单高效的酶解法取而代之[3]。近年来,大多数研究由单酶酶解倾向于双酶酶解或多酶复配酶解的方式进行。未志胜等[4]采用双酶(风味蛋白酶和碱性蛋白)逐级定向的方式,制备高品质植物蛋白增鲜酶解液,并在美拉德反应下,产物呈现出显著的鲜味和肉味,其整体感官评分为5.0。刘立煜[5]以大豆分离大白为原料,经多酶复配法制备鲜味酶解液,在胰酶、复合蛋白酶、风味蛋白酶和氨肽酶的组合下,蛋白回收率为80.12%,且在电子舌的检测下,该组的酶解产物鲜味最为显著。因此,通过筛选特定的酶组合及对酶解工艺进行优化来提高植物蛋白水解液的附加值具有重要意义。
大豆分离蛋白酶解液作为一种风味前体物质,主要用于调味基料的研究[6]。调味基料的生产一般采用提取、干燥及调香等工序制成,但存在消耗大、成本高、产量低等问题[7]。目前逐渐以微生物发酵技术替代人工调配合成调味料的方法,提高产品的安全性[8]。常见的调味基料(如味精等)主要以高谷氨酸含量为主,但通过发酵制备的富含谷氨酸调味料仅限于谷氨酸所表达的特定鲜味,其鲜味幅窄[9]。此外传统的发酵调味品较为单一,将发酵技术应用到附加值高的原料上,可进一步升级调味料产品。由于大豆分离蛋白酶解液富含呈味肽、氨基酸及核苷酸等鲜味物质[10],可利用发酵技术,将其作为微生物培养基基料制备调味品,能有效提高产品鲜味的丰富度,并实现调味料的天然化生产。这为大豆分离蛋白酶解液应用于食品工业调味基料的生产,提升其产品档次及市场竞争力提供了借鉴。
本研究以大豆分离蛋白酶解液的水解度和蛋白回收率为评价指标,利用单因素和响应面试验确定最佳酶解工艺,再以谷氨酸含量为评价指标,进行摇瓶和分批补料发酵实验,研究酶解液在发酵及制备新型调味料的应用效果,以期开拓大豆分离蛋白酶解液利用的新途径,及丰富发酵调味品的种类。
1. 材料与方法
1.1 材料与仪器
谷氨酸棒杆菌(Corynebacterium glutamicum)P169 保藏于湖北工业大学发酵工程教育部重点实验室;葡萄糖、尿素、琥珀酸、磷酸氢二钾、氯化钠、硫酸镁、硫酸锰、牛血清蛋白、磷酸、甲醛、乙醇、考马斯亮蓝(G-250)、酚酞、氢氧化钠、氨水(均为分析纯) 国药集团化学试剂有限公司;蛋氨酸(纯度≥99%)、生物素(纯度>99%) 赛国生物科技有限公司;维生素B1(纯度≥98%) 源叶生物科技有限公司;中性蛋白酶、木瓜蛋白酶、复合蛋白酶、碱性蛋白酶、风味蛋白酶(均为食品级,酶活性均为2×10−5 U·g−1)和酵母粉(生化试剂) 安琪酵母股份有限公司;大豆分离蛋白(食品级) 临沂山松生物制品有限公司。其他试剂均为国产分析纯。
发酵培养基[11]:尿素10 g/L,葡萄糖30 g/L,酵母粉41 g/L,磷酸氢二钾2.4 g/L,琥珀酸1 g/L,蛋氨酸0.5 g/L,硫酸镁0.4 g/L,生物素3×10−4 g/L,维生素B1 2×10−4 g/L,硫酸锰1×10−2 g/L。发酵培养基pH调至7.0±0.2,115 ℃高压蒸汽灭菌20 min。
S-10型生物传感器分析仪 深圳西尔曼生物科技有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器责任有限公司;TGL-20型台式高速离心机 武汉中科科仪技术发展有限责任公司;FE28型pH计、PL2002电子天平 梅特勒-托利多仪器(上海)有限公司;20 L发酵罐 上海保兴生化设备有限公司;V-1300型可见分光光度计 上海美析仪器有限公司;HH-2数显恒温水浴锅 常州国华电器有限公司。
1.2 实验方法
1.2.1 大豆分离蛋白的酶解工艺
以大豆分离蛋白粉为原料,按照所需料液比准确称取适量原料于烧杯中,搅拌均匀后,用氢氧化钠(0.1 mol/L)调节至所需的pH范围,然后加入适量蛋白酶于恒温水浴锅进行酶解,酶解时间完成后需将水浴锅升温至90 ℃,灭酶15 min,即可获得酶解液,后续对其酶解液进行水解度和蛋白回收率测定。酶解液中pH的测定采用FE28型号酸度计[12]。
1.2.2 大豆分离蛋白酶解工艺优化单因素实验
酶解的基本条件设定为:pH7.0,底物浓度5 g/100 mL,酶解温度50 ℃,酶添加量1 g/100 g和酶解时间6 h。在基本酶解条件的基础上,依次考察单酶种类(中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、复合蛋白酶、风味蛋白酶,酶的编号依次为ZF01、ZF06、ZF07、FH17、FF04)、双酶组合(复合蛋白酶和中性蛋白酶、复合蛋白酶和碱性蛋白酶、复合蛋白酶和木瓜蛋白酶、复合蛋白酶和风味蛋白酶,均按1:1比例进行组合)、pH(6.0、6.5、7.0、7.5、8.0)、底物浓度(5、10、15、20、25 g/100 mL)、酶解温度(45、50、55、60、65 ℃)、酶添加量(0.5、1、1.5、2、2.5 g/100 g)和酶解时间(6、8、10、12、14、16 h)对大豆分离蛋白酶解液水解度和蛋白回收率的影响[13]。
1.2.3 大豆分离蛋白酶解工艺优化响应面试验
在单因素实验的基础上,选取影响较大的酶解温度(A)、酶添加量(B)和酶解时间(C)为考察因素,水解度(Y1)和蛋白回收率(Y2)为响应值,采用Design-Expert 10.0.7软件设计3因素3水平的响应面试验,试验因素与水平见表1。
表 1 大豆分离蛋白酶解工艺优化响应面试验因素与水平Table 1. Test factors and levels of response surface optimization of soybean separation protease hydrolysis process水平 因素 A酶解温度(℃) B酶添加量(g/100 g) C酶解时间(h) −1 45 0.5 10 0 55 1.5 12 1 65 2.5 14 1.2.4 水解度和蛋白回收率的测定
水解度测定:参考Cui等[14]的方法测水解度,采用甲醛滴定法检测大豆分离蛋白酶解液氨基酸态氮含量,参考食品安全国家标准GB 5009.235-2016,采用凯氏定氮法检测原料中总氮含量,参考食品安全国家标准GB 5009.5-2016[15]。
水解度(%)=上清液氨基酸态氮含量原料中总氮含量×100 蛋白回收率测定:将酶解液离心(4000 r/min,10 min)后取上清液,采用考马斯亮蓝法(参照SN/T 3926-2014)检测上清液的蛋白质含量,采用凯氏定氮法检测原料中蛋白质含量,参考食品安全国家标准GB 5009.5-2016[16]。
蛋白回收率(%)=上清液蛋白的含量原料中蛋白质含量×100 1.2.5 添加大豆分离蛋白酶解液发酵对谷氨酸产量的影响
将采用最优工艺制备的大豆分离蛋白酶解液按0%、10%、20%、30%、40%、50%的添加量添加于发酵培养基中,在50 mL摇瓶发酵体系中接入2%(V/V)活化至对数期(OD600 nm≈18)的谷氨酸棒杆菌P169,于32 ℃,200 r/min的摇床条件下发酵培养60 h。以谷氨酸含量和OD600 nm为评价指标,确定促进菌株生长和提高谷氨酸含量的酶解液添加量。在最适酶解液添加量的基础上,比较响应面优化后和未优化的酶解液对谷氨酸合成的影响。
谷氨酸含量测定采用S-10型生物传感器进行检测[17];OD600 nm测定是取1 mL发酵液离心(12000 r/min,5 min)去上清后,稀释至合适倍数,采用可见分光光度计法,波长600 nm下测定吸收光度值[18]。
1.2.6 20 L发酵罐分批补料发酵制备调味料及品质评价
通过三级发酵工艺,经摇瓶活化至对数期(OD600 nm≈18)的谷氨酸棒杆菌P169按2%(V/V)的接种量接入二级种子罐(装液量为200 mL),然后将二级种子罐于摇床32 ℃、200 r/min继续活化12 h至对数期,再以10%(V/V)的接种量从二级种子罐中接入20 L发酵罐(装液量为12 L),发酵周期为56 h。发酵罐分批补料参数控制为:罐压维持0.030~0.035 MPa,初始空气流量1.2~1.3 L/min,初始pH6.5~7.0,补料时通过流加氨水维持pH7.2~7.5,搅拌转速100~500 r/min,溶氧设为20%并与搅拌偶联,温度维持32 ℃,发酵12 h后通过流加500 g/L的葡萄糖维持发酵过程中葡萄糖的终浓度为3.0~8.0 g/L,同时将40%(V/V)的酶解液以每小时200 mL的流速流加。发酵结束前2~3 h停止补料,待残糖耗尽后发酵结束[19]。响应面优化后和未优化的酶解液进行分批补料发酵时,均采用以上工艺进行。在发酵期间每隔4 h取一次样,分别测定OD600 nm、谷氨酸含量和残糖量,后将谷氨酸含量最高的样品,离心(12000 r/min,5 min)取上清液,即为发酵调味料。后续对酶解液优化前后制备的调味料进行描述性感官评价,感官评价小组由12名专业感官评定员(6男6女)组成,主要从苦味、鲜味、咸味、甜味和酸味这5个滋味进行感官评估,评分等级为:0~3分滋味微弱,4~6分滋味中等,7~10分滋味强烈[20-21]。
1.3 数据处理
每组实验做三组平行,采用Origin 2019b和GraphPad Prism 8.0.1软件进行图表绘制,使用SPSS 23软件进行显著性分析,并通过Design-Expert 10.0.7系统软件进行响应面分析,结果用平均值±标准差表示。
2. 结果与分析
2.1 大豆分离蛋白酶解工艺优化单因素实验
2.1.1 酶种类的筛选结果
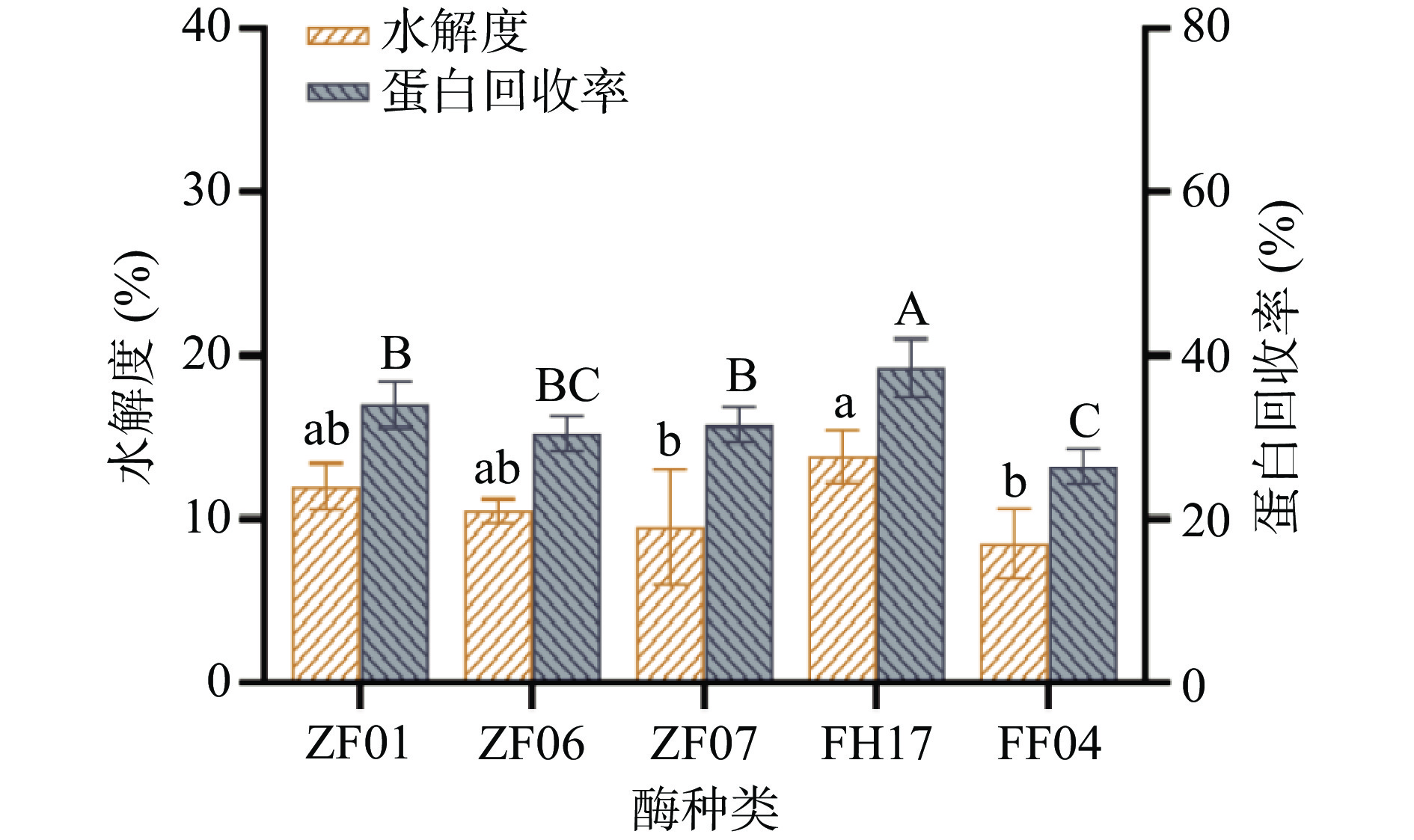
为了提高大豆分离蛋白在菌株发酵中的利用效率和增鲜效果,研究不同蛋白酶对大豆分离蛋白酶解中水解度和蛋白回收率的影响。结果表明,采用不同蛋白酶酶解时,其酶解效果呈现较大差异(图1)。其中复合蛋白酶(FH17)酶解大豆分离蛋白的能力高于其他蛋白酶,水解度和蛋白回收率分别为13.5%和38.8%,其次是中性蛋白酶(ZF01),水解度和蛋白回收率分别为12.0%和34.0%。因此,本实验选择复合蛋白酶(FH17)作为提高大豆分离蛋白水解度和蛋白回收率的主要酶制剂。
2.1.2 双酶组合的确定
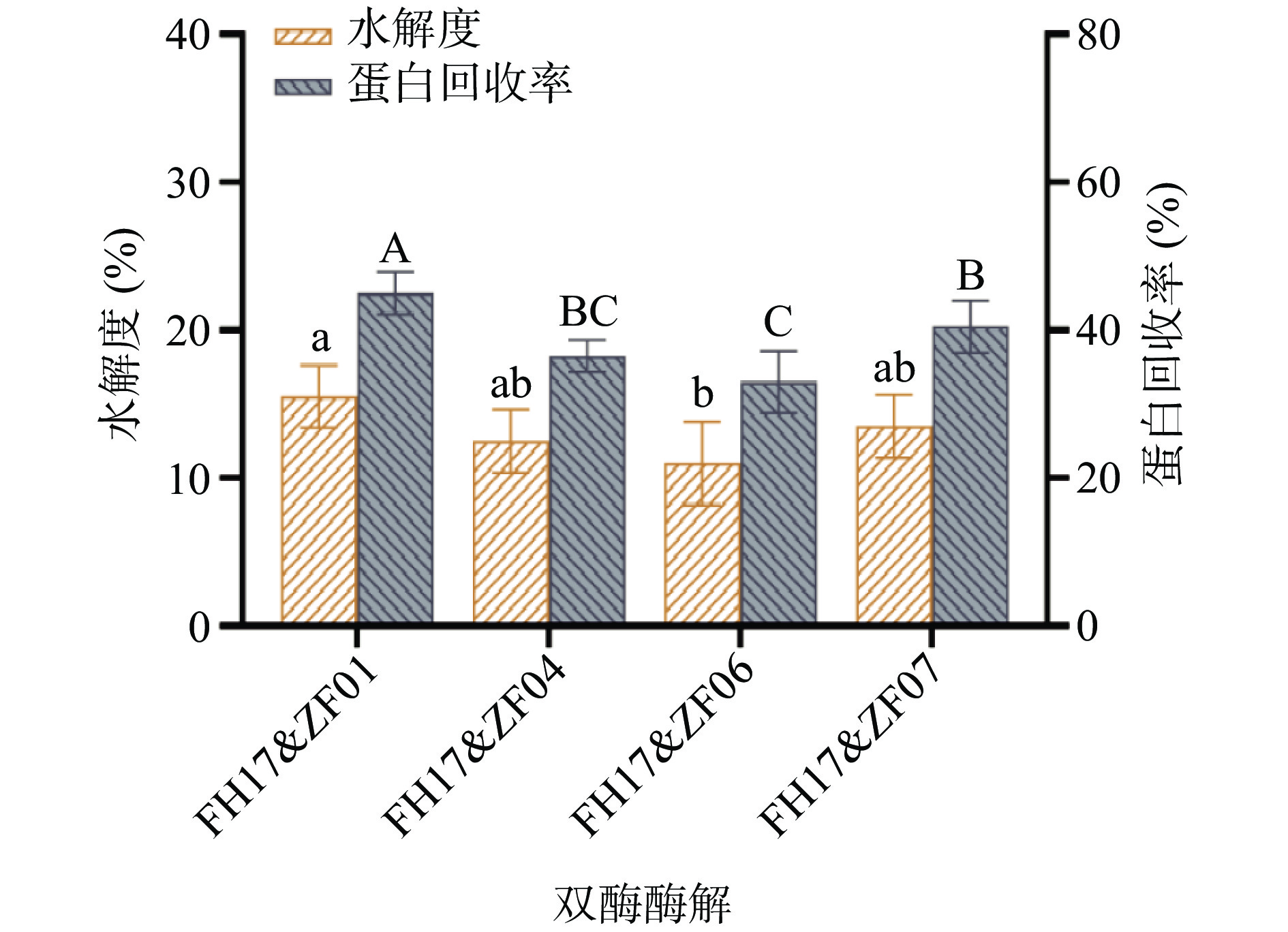
单酶酶解作为最基础的酶解方法,存在酶解效率低、产物种类单一等问题。与单酶法相比,双酶法中蛋白酶具有相互协同作用,能很大程度上提高酶解效率[22-24]。故采用双酶组合的方式探究酶解工艺,以FH17酶为主,分别与其他4种蛋白酶结合进行酶解。结果如图2所示,双酶组合的酶解方式较单酶酶解效率显著提高,其中FH17&ZF01组合的酶解效果最好,水解度和蛋白回收率分别为15.5%和45.0%。相比之下,FH17酶与其他3种蛋白酶组合的水解的效果略差。因此,本研究确定FH17&ZF01为最佳双酶组合。
2.1.3 pH的确定
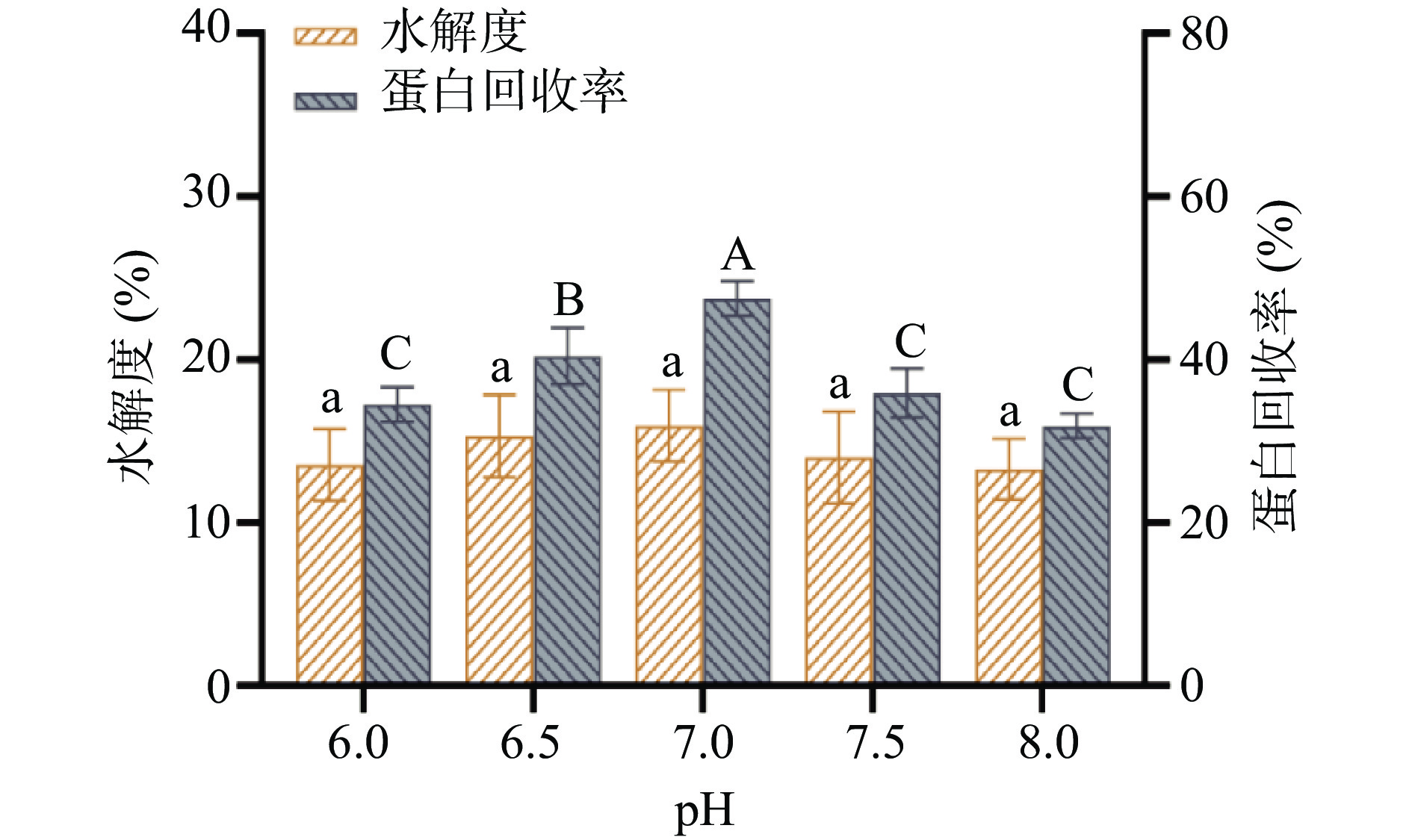
随着pH的增加,水解度和蛋白回收率呈先升高后下降的趋势。当pH为7.0时水解度和蛋白回收率均达最高,分别为15.7%和47.5%(图3),说明7.0为最适酶解pH,此条件下酶活性最高,酶解效果最好[25]。当pH过低或过高时,酶解效果变差,水解度和蛋白回收率有所下降,可能是因为不适的pH实验环境影响了蛋白酶的空间构象,导致酶变性失活[26]。因此,确定最佳pH为7.0。
2.1.4 底物浓度的确定
随着底物浓度的增加,水解度和蛋白回收率呈先升高后下降的趋势。当底物浓度为15 g/100 mL时,水解度和蛋白回收率均达最高,分别为18.5%和50.5%(图4),说明此时的底物能够充分与酶结合,达到最佳酶解效果。当底物浓度<15 g/100 mL时,可能是底物浓度较小,酶未被底物饱和[27],使水解度和蛋白回收率呈上升趋势。当底物浓度>15 g/100 mL时,酶被底物饱和,此时因没有多余的酶参与底物的酶解,反应速率不再增加,同时又因体系内底物和酶的中间产物增加,限制了最终酶解产物的生成,导致水解度和蛋白回收率下降[5]。因此,确定最佳底物浓度为15 g/100 mL。
2.1.5 酶解温度的确定
随着酶解温度的增加,水解度和蛋白回收率呈先升高后下降的趋势。当酶解温度为55 ℃时,水解度和蛋白回收率均达最高,分别为22.0%和54.5%(图5),说明此时的温度能使酶活性达到最佳状态。当酶解温度<55 ℃时,由于起初随温度升高能使反体系内能增加,分子间相互碰撞的频率也随之增加,从而提高水解度和蛋白回收率。当酶解温度>55 ℃时,由于温度过高导致酶逐步变性,水解度和蛋白回收率也逐渐降低[28]。因此,55 ℃是作为响应面试验继续优化温度的选择依据。
2.1.6 酶添加量的确定
随着酶添加量的增加,水解度和蛋白回收率呈上升的趋势。当酶添加量增加至1.5 g/100 g时,水解度和蛋白回收率达最高,分别为25.5%和57.0%(图6),说明在底物浓度不变的情况下,随着酶浓度的增加水解效率也随之升高。当酶添加量>1.5 g/100 g时,水解度和蛋白回收率趋于平稳,可能由于酶添加量与底物接触趋于饱和状态时,继续添加酶时水解度和蛋白回收率仍然处于平稳状态[29]。考虑到成本问题,当酶添加量<1.5 g/100 g时,由于酶用量较低时,酶与底物结合较充分,水解度和蛋白回收率随酶添加量的增加而增加[27]。因此,1.5 g/100 g的酶添加量是作为响应面试验继续优化酶添加量的选择依据。
2.1.7 酶解时间的确定
随着酶解时间的增加,水解度和蛋白回收率呈上升的趋势。当酶解时间为12 h时,水解度和蛋白回收率均达最高,分别为33.0%和67.0%(图7),原因是开始时短时间内酶发生作用是逐渐增强的,水解度和蛋白回收率也随之增加。当酶解时间>12 h时,水解度和蛋白回收率趋于平稳,原因是随酶解时间的延长,底物浓度随之增大,酶解体系变粘稠,不利于酶解反应[30],所以达到一定时间后水解度和蛋白回收率不再增加。因此,12 h是作为响应面试验继续优化时间的选择依据。
2.2 大豆分离蛋白酶解工艺优化响应面试验
2.2.1 响应面试验结果与分析
在单因素实验基础上,由于酶解温度、酶添加量和酶解时间对水解度和蛋白回收率的影响最显著(P<0.05),所以选取影响较大的因素酶解温度(A)、酶添加量(B)和酶解时间(C)为考察对象,以水解度和(Y1)和蛋白回收率(Y2)为响应值,采用Design-Expert 10.0.7软件设计3因素3水平的Box-Benhnken响应面试验,试验设计及结果见表2,方差分析见表3和表4。
表 2 大豆分离蛋白酶解工艺优化响应面试验设计及结果Table 2. Response surface test design and results of soybean protease hydrolysis process optimization试验号 A
酶解温度B
酶添加量C
酶解时间Y1水解度
(%)Y2蛋白回收率
(%)1 −1 0 −1 16.2±1.7 31.3±1.0 2 0 −1 −1 21.6±2.3 36.2±1.7 3 1 1 0 22.5±2.7 57.2±2.1 4 1 0 −1 21.2±1.6 53.4±1.5 5 0 −1 1 27.5±2.5 40.8±0.9 6 0 0 0 35.5±1.5 70.5±1.2 7 −1 −1 0 14.4±2.2 29.2±2.2 8 1 −1 0 21.1±1.7 54.0±2.6 9 −1 1 0 24.1±1.4 46.1±1.0 10 0 1 1 37.1±0.3 68.5±0.6 11 1 0 1 25.8±1.0 57.2±1.1 12 0 0 0 35.7±1.4 67.3±2.1 13 −1 0 1 26.1±1.1 47.2±1.4 14 0 0 0 35.8±1.6 66.1±1.8 15 0 1 −1 26.2±0.8 44.1±2.3 16 0 0 0 35.2±1.0 68.7±2.5 17 0 0 0 35.9±1.9 68.8±1.7 表 3 水解度回归模型方差分析Table 3. Variance analysis of regression model of degree ofhydrolysis方差来源 平方和 自由度 均方 F值 P值 显著性 模型 859.21 9 95.47 254.05 <0.0001 ** A 12.00 1 12.00 31.95 0.0008 ** B 80.01 1 80.01 212.92 <0.0001 ** C 122.46 1 122.46 325.88 <0.0001 ** AB 17.22 1 17.22 45.83 0.0003 ** AC 7.02 1 7.02 18.69 0.0035 ** BC 6.25 1 6.25 16.63 0.0047 ** A2 449.74 1 449.74 1196.79 <0.0001 ** B2 87.55 1 87.55 232.98 <0.0001 ** C2 32.07 1 32.07 85.35 <0.0001 ** 总残差 2.63 7 0.38 失拟项 1.88 3 0.63 3.36 0.1364 不显著 净误差 0.75 4 0.19 总和 861.84 16 注:*表示对结果影响显著(P<0.05);**表示对结果影响极显著(P<0.01);表4同。 表 4 蛋白回收率回归模型方差分析Table 4. Variance analysis of regression model of protein recovery方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3028.46 9 336.50 43.83 <0.0001 ** A 578.00 1 578.00 75.29 <0.0001 ** B 387.81 1 387.81 50.52 0.0002 ** C 296.46 1 296.46 38.62 0.0004 ** AB 46.92 1 46.92 6.11 0.0427 * AC 36.60 1 36.60 4.77 0.0653 BC 98.01 1 98.01 12.77 0.0091 ** A2 499.34 1 499.34 65.05 <0.0001 ** B2 487.94 1 487.94 63.56 <0.0001 ** C2 340.79 1 340.79 56.12 <0.0001 ** 总残差 53.74 7 7.68 失拟项 42.64 3 14.22 5.13 0.0741 不显著 净误差 11.09 4 2.77 总和 3082.20 16 采用Design-Expert 10.0.7软件对试验结果(表2)进行分析,得到水解度和蛋白回收率的多元二次回归方程:水解度Y1=35.42+1.22A+3.16B+3.91C−2.07AB−1.33AC+1.25BC−10.34A2−4.56B2−2.76C2,蛋白回收率Y2=68.28+8.50A+6.96B+6.09C−3.43AB−3.03AC+4.95BC−10.89A2−10.77B2−10.11C2。由表3和表4可知,这两个模型均极显著(P<0.0001),失拟项均不显著(P>0.05),说明两个模型拟合程度好,可靠性高。模型的决定系数R2分别为0.9969和0.9826,说明水解度和蛋白回收率的变化有99.69%和98.26%来源于所选变量。因此,这两个模型的回归方程可用于分析和预测水解度和蛋白回收率。由表3和表4亦可知,对于水解度模型,A(酶解温度)、B(酶添加量)、C(酶解时间)、A2、B2、C2、AB、AC、BC对水解度有极显著影响(P<0.01);对于蛋白回收率模型,A、B、C、A2、B2、C2、BC对蛋白回收率有极显著影响(P<0.01),AB有显著影响(P<0.05),AC无显著影响(P>0.05)。根据F值可知,一次项中,酶添加量和时间对水解度影响最大,温度影响较小,但温度对蛋白回收率的影响最大。由此可知,各个因素对水解度和蛋白质回收率的影响并不是简单的线性关系[28]。
2.2.2 多因素交互作用
利用Design-Expert 10.0.7软件绘制各因素间交互作用对水解度和蛋白回收率影响的响应曲面,结果见图8和图9。相关文献报道,当响应曲面呈凸形,抛物面更陡,底部等高线呈椭圆形时,变量与交互作用显著[12]。实验结果表明,在影响水解度的响应曲面中,酶解温度和酶添加量之间的交互作用最强,酶解温度和酶解时间次之(图8);在影响蛋白回收率的响应曲面中,酶解时间和酶添加量之间的交互作用最强。上述结果与表3和表4的方差分析结果一致。
2.2.3 验证实验
根据软件分析,将酶解液的水解度和蛋白回收率优化目标都设置为maximize最大值,得到水解度和蛋白回收率均最高的酶解条件为:酶解温度53.8 ℃,酶添加量1.9 g/100 g,酶解时间13.4 h,水解度和蛋白回收率的预测值为37.6%和69.3%。为了便于实验操作,将最优酶解条件修正为酶解温度54 ℃,酶添加量2 g/100 g,酶解时间13 h,在此条件下进行4次验证实验,水解度和蛋白回收率分别为37.1%和70.3%,与预测值较为接近,该模型能很好地反映酶解温度、酶添加量和酶解时间对大豆分离蛋白水解度和蛋白回收率的影响,通过该优化模型可有效改善水解度和蛋白回收率。
2.3 大豆分离蛋白酶解液发酵对谷氨酸的影响
大豆分离蛋白酶解物作为一种营养丰富的有机氮源,可将其应用于微生物发酵[31]。为了制备发酵型调味料,在摇瓶条件下,研究了酶解液添加量对谷氨酸棒杆菌发酵谷氨酸的影响。随着酶解液添加量从0%(V/V)增至50%(V/V)时,谷氨酸含量和OD600 nm呈先上升后下降的趋势。当酶解液添加量为40%(V/V),发酵48 h和36 h时,谷氨酸含量和OD600 nm均达最高,分别为30.2 g/L和33.7,比未添加酶解液的对照组(22.8 g/L、24.0)分别提高了32.5%和40.4%(图10),说明添加至发酵培养基中的酶解液营养成分可被菌体吸收利用。当酶解液浓度>40%(V/V)时,谷氨酸含量和OD600 nm有所下降(图10),可能由于酶解液添加量的继续增加,培养基中的矿物质、维生素等营养成分的终浓度过高,可能会影响细胞生长和微生物代谢[31]。因此,确定最佳酶解液添加量为40%(V/V)。
在40%(V/V)酶解液添加量的条件下,比较基本酶解前和响应面优化后获得的酶解液在谷氨酸发酵中的影响。结果显示,发酵48 h时,优化后的实验组谷氨酸含量和OD600 nm分别为32.1 g/L和35.7(图11),较优化前的对照组(24.3 g/L、31.3)分别提高了32.1%和14.1%。其原因可能是优化后,更多的游离氨基酸、蛋白质或肽类等小分子物质被释放出来,在微生物发酵中,这些小分子物质能满足细胞生长和合成代谢产物的营养需求,利于发酵过程中风味物质的形成[32]。说明此次的响应面优化的水解度和蛋白回收率效果显著。
![]() 图 11 酶解液优化前后对谷氨酸棒杆菌产谷氨酸和菌株生长的影响注:不同字母表示同一指标不同发酵时间差异显著(P<0.05);图12同。Figure 11. Effects of enzymolysis solution optimization on glutamate production and strain growth of C. glutamicum
图 11 酶解液优化前后对谷氨酸棒杆菌产谷氨酸和菌株生长的影响注:不同字母表示同一指标不同发酵时间差异显著(P<0.05);图12同。Figure 11. Effects of enzymolysis solution optimization on glutamate production and strain growth of C. glutamicum2.4 发酵调味料的品质评价
为了更好地将大豆分离蛋白酶解液应用于工业化制备调味料,分别以基本酶解前和响应面优化后获得的酶解液为对照组和实验组,采用分批补料的方式发酵生产调味料。菌株发酵的前8 h处于延滞期,谷氨酸含量和OD600 nm较低(图12)。为了使菌株的对数期和稳定期在不同程度上得到延长,在发酵12 h后通过匀速流加500 g/L的葡萄糖维持残糖在3.0~8.0 g/L,同时将大豆酶解液以每小时200 mL的流速流加40%(V/V)。从生长曲线看,12 h后菌株迅速生长,谷氨酸含量也随之增加(图12),说明补料对谷氨酸棒杆菌的生长繁殖有显著的促进作用,同时有利于调味料制备过程中鲜味物质的形成。实验组中,菌株的繁殖速度较对照组快,从谷氨酸水平上看,谷氨酸含量也始终较对照组高,并维持在较高水平,当实验组发酵至52 h时,谷氨酸含量和OD600 nm均达最高,分别为83.6 g/L和87.6,较对照组(76.0 g/L,83.7)分别提高10.0%和4.7%(图12)。结果表明,响应面优化后的大豆分离蛋白酶解液有利于微生物发酵及发酵中多种风味物质的形成,具有工业化的应用潜力。
为了评估响应面优化后的酶解液在谷氨酸发酵制备调味料中的应用效果,将2.4中采用分批补料制得的两组调味料产品进行描述性感官评价。两组样品主要以鲜咸味为主,其中实验组较对照组样品鲜味显著提高(P<0.05),苦味显著降低(P<0.05),且实验组较对照组甜(图13)。可能是由于酶解后的大豆分离蛋白富含的鸟苷酸、肌苷酸、天冬氨酸及谷氨酸等鲜味氨基酸贡献了强烈的鲜味,且酶解液在发酵过程中,谷氨酸等呈味物质的提高也大大增加了产品的鲜味和咸味,并掩盖其苦味的表达[33]。说明将大豆分离蛋白酶解应用于微生物发酵制备调味料时,可提高产品的风味和品质。
3. 结论
本研究采用单因素实验和响应面法,确定了大豆分离蛋白最佳酶解工艺为酶解温度54.0 ℃、酶添加量2.0 g/100 g、酶解时间13.0 h,此条件下得到的水解度和蛋白回收率分别为37.1%和70.3%。酶解液可以显著提高谷氨酸含量和促进菌株生长,摇瓶发酵时,谷氨酸含量和OD600 nm分别为32.1 g/L和35.7,远高于对照组(24.3 g/L、31.3);20 L罐分批补料发酵时,谷氨酸产量和OD600 nm为83.6 g/L和87.6,较对照组分别提高了10.0%和4.7%,且以酶解液为基料制备的新型调味料其鲜味显著增加。研究所得的最佳酶解工艺,能改善酶解液的利用效率,且以分批补料发酵的方式,能使酶解液中的营养成分最大限度地促进菌株生长和谷氨酸等鲜味物质的积累,为以大豆分离蛋白酶解液为基料实现工业化制备高品质调味料奠定良好的基础。
-
图 11 酶解液优化前后对谷氨酸棒杆菌产谷氨酸和菌株生长的影响
注:不同字母表示同一指标不同发酵时间差异显著(P<0.05);图12同。
Figure 11. Effects of enzymolysis solution optimization on glutamate production and strain growth of C. glutamicum
表 1 大豆分离蛋白酶解工艺优化响应面试验因素与水平
Table 1 Test factors and levels of response surface optimization of soybean separation protease hydrolysis process
水平 因素 A酶解温度(℃) B酶添加量(g/100 g) C酶解时间(h) −1 45 0.5 10 0 55 1.5 12 1 65 2.5 14 表 2 大豆分离蛋白酶解工艺优化响应面试验设计及结果
Table 2 Response surface test design and results of soybean protease hydrolysis process optimization
试验号 A
酶解温度B
酶添加量C
酶解时间Y1水解度
(%)Y2蛋白回收率
(%)1 −1 0 −1 16.2±1.7 31.3±1.0 2 0 −1 −1 21.6±2.3 36.2±1.7 3 1 1 0 22.5±2.7 57.2±2.1 4 1 0 −1 21.2±1.6 53.4±1.5 5 0 −1 1 27.5±2.5 40.8±0.9 6 0 0 0 35.5±1.5 70.5±1.2 7 −1 −1 0 14.4±2.2 29.2±2.2 8 1 −1 0 21.1±1.7 54.0±2.6 9 −1 1 0 24.1±1.4 46.1±1.0 10 0 1 1 37.1±0.3 68.5±0.6 11 1 0 1 25.8±1.0 57.2±1.1 12 0 0 0 35.7±1.4 67.3±2.1 13 −1 0 1 26.1±1.1 47.2±1.4 14 0 0 0 35.8±1.6 66.1±1.8 15 0 1 −1 26.2±0.8 44.1±2.3 16 0 0 0 35.2±1.0 68.7±2.5 17 0 0 0 35.9±1.9 68.8±1.7 表 3 水解度回归模型方差分析
Table 3 Variance analysis of regression model of degree ofhydrolysis
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 859.21 9 95.47 254.05 <0.0001 ** A 12.00 1 12.00 31.95 0.0008 ** B 80.01 1 80.01 212.92 <0.0001 ** C 122.46 1 122.46 325.88 <0.0001 ** AB 17.22 1 17.22 45.83 0.0003 ** AC 7.02 1 7.02 18.69 0.0035 ** BC 6.25 1 6.25 16.63 0.0047 ** A2 449.74 1 449.74 1196.79 <0.0001 ** B2 87.55 1 87.55 232.98 <0.0001 ** C2 32.07 1 32.07 85.35 <0.0001 ** 总残差 2.63 7 0.38 失拟项 1.88 3 0.63 3.36 0.1364 不显著 净误差 0.75 4 0.19 总和 861.84 16 注:*表示对结果影响显著(P<0.05);**表示对结果影响极显著(P<0.01);表4同。 表 4 蛋白回收率回归模型方差分析
Table 4 Variance analysis of regression model of protein recovery
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 3028.46 9 336.50 43.83 <0.0001 ** A 578.00 1 578.00 75.29 <0.0001 ** B 387.81 1 387.81 50.52 0.0002 ** C 296.46 1 296.46 38.62 0.0004 ** AB 46.92 1 46.92 6.11 0.0427 * AC 36.60 1 36.60 4.77 0.0653 BC 98.01 1 98.01 12.77 0.0091 ** A2 499.34 1 499.34 65.05 <0.0001 ** B2 487.94 1 487.94 63.56 <0.0001 ** C2 340.79 1 340.79 56.12 <0.0001 ** 总残差 53.74 7 7.68 失拟项 42.64 3 14.22 5.13 0.0741 不显著 净误差 11.09 4 2.77 总和 3082.20 16 -
[1] YAGHOUBI M, MOZANZADEH M T, MARAMMAZI J G, et al. Dietary replacement of fish meal by soy products (soybean meal and isolated soy protein) in silvery-black porgy juveniles (Sparidentex hasta)[J]. Aquaculture,2016,464:50−59. doi: 10.1016/j.aquaculture.2016.06.002
[2] ZHANG Y, YANG R, ZHANG W, et al. Structural characterization and physicochemical properties of protein extracted from soybean meal assisted by steam flash-explosion with dilute acid soaking[J]. Food Chemistry,2017,219:48−53. doi: 10.1016/j.foodchem.2016.09.079
[3] 王海萍. 高固形物浓度大豆分离蛋白酶解特性的研究[D]. 广州: 华南理工大学, 2016 WANG H P, et al. The effect of high solid concentration on characteristics of enzymatic hydrolysis of soy protein isolates[D]. Guangzhou: South China University of Technology, 2016.
[4] 未志胜, 詹萍, 田洪磊, 等. 基于GA-BP神经网络的鹰嘴豆美拉德肽的定向制备[J]. 中国食品学报,2019,19(9):147−153. [ZHU Z S, ZHAN P, TIAN H L, et al. Targeted preparation of maillard peptide from chickpea based on GA-BP neural network[J]. Chinese Journal of Food Science,2019,19(9):147−153. ZHU Z S, ZHAN P, TIAN H L, et al. Targeted preparation of maillard peptide from chickpea based on GA-BP neural network[J]. Chinese Journal of Food Science, 2019, 19(9): 147-153.
[5] 刘立煜. 大豆呈味基料酶法制备过程聚集物研究[D]. 广州: 华南理工大学, 2021 LIU L Y. Study on aggregates in the process enzymatic preparation of soy flavor condiment[D]. Guangzhou: South China University of Technology, 2021.
[6] 于亚辉, 谢昭鹏, 张帆, 等. 大豆蛋白酶解物制备鸡肉风味基料[J]. 食品工业,2020,41(1):195−199. [YU Y H, XIE Z P, ZHANG F, et al. Preparation of chicken flavor base by soy protein hydrolysate[J]. The Food Industry,2020,41(1):195−199. YU Y H, XIE Z P, ZHANG F, et al. Preparation of chicken flavor base by soy protein hydrolysate[J]. The Food Industry, 2020, 41(1): 195-199.
[7] 田红玉, 陈海涛, 孙宝国. 食品香料香精发展趋势[J]. 食品科学技术学报,2018,36(2):1−11. [TAN H Y, CHEN H T, SUN B G. Advances and trends in study on flavors and flavorings[J]. Journal of Food Science and Technology,2018,36(2):1−11. doi: 10.3969/j.issn.2095-6002.2018.02.001 TAN H Y, CHEN H T, SUN B G. Advances and trends in study on flavors and flavorings[J]. Journal of Food Science and Technology, 2018, 36(2): 1-11. doi: 10.3969/j.issn.2095-6002.2018.02.001
[8] 惠靖茹. 茶树菇发酵调味料生产工艺研究及年产1000吨调味料工艺设计[D]. 南昌: 江西农业大学, 2022 HUI J R. Resarch on the production technology of Agrocybe cylinndracea fermented seasoning and the technology design of annual production capacity of 100 tons of seasoning[D]. Nanchang: Jiangxi Agricultural University, 2022.
[9] ALHARBI N S, KADAIKUNNAN S, KHALED J M, et al. Optimization of glutamic acid production by Corynebacterium glutamicum using response surface methodology[J]. Journal of King Saud University. Science,2020,32(2):1403−1408. doi: 10.1016/j.jksus.2019.11.034
[10] 周文斯, 熊犍, 郑雪君, 等. 高浓大豆分离蛋白酶解制备鲜味基料的研究[J]. 中国调味品,2018,43(1):52−56. [ZHOU W S, XIONG J, ZHENG X J, et al. Research on enzymatic preparation of umami flavor base from high-concentration soybean protein isolates[J]. China Condiment,2018,43(1):52−56. ZHOU W S, XIONG J, ZHENG X J, et al. Research on enzymatic preparation of umami flavor base from high-concentration soybean protein isolates[J]. China Condiment, 2018, 43(1): 52-56.
[11] 卢慧芳, 上官玲玲, 夏会丽, 等. 发酵玉米粉酶解液制备天然鲜味料[J]. 食品工业科技,2022,43(17):158−166. [LU H F, SHANGGUAN L L, XIA H L, et al. Enzymolysis of fermented corn flour to prepare natural umami flavoring[J]. Science and Technology of Food Industry,2022,43(17):158−166. LU H F, SHANGGUAN L L, XIA H L, et al. Enzymolysis of fermented corn flour to prepare natural umami flavoring[J]. Science and Technology of Food Industry, 2022, 43(17): 158-166.
[12] FAHIMITABAR A, RAZAVIAN S M H, REZAEI S A. Application of RSM for optimization of glutamic acid production by Corynebacterium glutamicum in bath culture[J]. Heliyon,2021,7(6):e7359.
[13] 李芳浩, 朱广琪, 郭小旬, 等. 风味蛋白酶酶解制备中国对虾调味料风味前体物质工艺优化[J]. 食品工业科技,2018,39(24):164−169. [LI F H, ZHU G Q, GUO X X, et al. Eptimization on the preparation of flavor precursor of penaeus chinensis seasoning by flavour protease hydrplysis technology[J]. Science and Technology of Food Industry,2018,39(24):164−169. LI F H, ZHU G Q, GUO X X, et al. Eptimization on the preparation of flavor precursor of penaeus chinensis seasoning by flavour protease hydrplysis technology[J]. Science and Technology of Food Industry, 2018, 39(24): 164-169.
[14] CUI C, HU Q, REN J, et al. Effect of the structural features of hydrochloric acid-deamidated wheat gluten on its susceptibility to enzymatic hydrolysis[J]. Journal of Agricultural and Food Chemistry,2013,61(24):5706−5714. doi: 10.1021/jf400281v
[15] RUAN L, JU Y, ZHAN C, et al. Improved umami flavor of soy sauce by adding enzymatic hydrolysate of low-value fish in the natural brewing process[J]. LWT,2022,155:112911. doi: 10.1016/j.lwt.2021.112911
[16] 黄可欣. 牡蛎酶解液挥发性风味成分分析及脱腥工艺研究[D]. 广州: 华南理工大学, 2020 WANG K X. Study on analysis of volatile components of oyster enzymatic hydrolystate and its deodorization process[D]. Guangzhou: South China University of Technology, 2020.
[17] HAN X, LI L, BAO J. Microbial extraction of biotin from lignocellulose biomass and its application on glutamic acid production[J]. Bioresource Technology,2019,288:121523. doi: 10.1016/j.biortech.2019.121523
[18] SHI T, FAN X, WU Y, et al. Mutation of genes for cell membrane synthesis in Corynebacterium glutamicum causes temperature-sensitive trait and promotes L-glutamate excretion[J]. Biotechnology, biotechnological equipment,2020,34(1):38−47. doi: 10.1080/13102818.2019.1711186
[19] LV Q, HU M, TIAN L, et al. Enhancing l-glutamine production in Corynebacterium glutamicum by rational metabolic engineering combined with a two-stage pH control strategy[J]. Bioresource Technology,2021,341:125799. doi: 10.1016/j.biortech.2021.125799
[20] FUJIOKA K. Comparison of cheese aroma intensity measured using an electronic nose (E-nose) non-destructively with the aroma intensity scores of a sensory evaluation: A pilot study[J]. Sensors,2021,21(24):8368. doi: 10.3390/s21248368
[21] 谭凤玲, 詹萍, 王鹏, 等. 基于感官评价及GC-MS结合OPLS-DA分析热杀菌对蟠桃汁呈香品质的影响[J]. 中国农业科学,2022,55(12):2425−2435. [TAN F L, ZHAN P, WNAG P, et al. Effects of thermal stenrilization on quality of flat peach juice based on sensory evaluation and GC-MS combined with OPLS-DA[J]. Scientia Agricultura Sinica,2022,55(12):2425−2435. doi: 10.3864/j.issn.0578-1752.2022.12.013 TAN F L, ZHAN P, WNAG P, et al. Effects of thermal stenrilization on quality of flat peach juice based on sensory evaluation and GC-MS combined with OPLS-DA[J]. Scientia Agricultura Sinica, 2022, 55(12): 2425-2435. doi: 10.3864/j.issn.0578-1752.2022.12.013
[22] BERENDS P, APPEL D, EISELE T, et al. Performance of enzymatic wheat gluten hydrolysis in batch and continuous processes using flavourzyme[J]. LWT-Food Science and Technology,2014,58(2):534−540. doi: 10.1016/j.lwt.2014.03.035
[23] BERENDS P, MERZ M, KOCHJOHANN A, et al. Sensory and antigenic properties of enzymatic wheat gluten hydrolysates produced in an enzyme membrane reactor in comparison with batch[J]. European Food Research and Technology,2017,243(5):807−816. doi: 10.1007/s00217-016-2794-x
[24] CUNHA S A, de CASTRO R, COSCUETA E R, et al. Hydrolysate from mussel mytilus galloprovincialis meat: Enzymatic hydrolysis, optimization and bioactive properties[J]. Molecules,2021,26(17):5228. doi: 10.3390/molecules26175228
[25] SANTOS C T, GOMES G M S, NASCIMENTO P A, et al. Protein solubility of jackfruit seed flour: pH and salt concentration influence[J]. Research, Society and Development,2020,9(10):e1010825696.
[26] SOBHANINIA M, NASIRPOUR A, SHAHEDI M, et al. Fabrication of whey proteins aggregates by controlled heat treatment and pH: Factors affecting aggregate size[J]. International Journal of Biological Macromolecules,2018,112:74−82. doi: 10.1016/j.ijbiomac.2018.01.109
[27] 孙小飞, 罗国瑞, 李英美, 等. 仿刺参精酶解工艺的优化及酶解液的抗氧化活性[J]. 中国食品学报,2022,22(4):217−224. [SUN X F, LUO G R, LI Y M, et al. Optimization of enzymatic hydrolysis process and antioxidant activity of the extract of Apostichopus japonicus[J]. Chinese Journal of Food Science,2022,22(4):217−224. SUN X F, LUO G R, LI Y M, et al. Optimization of enzymatic hydrolysis process and antioxidant activity of the extract of Apostichopus japonicus[J]. Chinese Journal of Food Science, 2022, 22(4): 217-224.
[28] 张典, 李龄佳, 崔春, 等. 牡蛎酶解工艺的响应面优化研究[J]. 中国调味品,2019,44(5):12−16. [ZHANG D, LI L J, CUI C, et al. Optimization of oyster enzymatic hydrolysis process by response surface method[J]. China Condiment,2019,44(5):12−16. ZHANG D, LI L J, CUI C, et al. Optimization of oyster enzymatic hydrolysis process by response surface method[J]. China Condiment, 2019, 44(5): 12-16.
[29] GOHI B, DU J, ZENG H, et al. Microwave pretreatment and enzymolysis optimization of the lotus seed protein[J]. Bioengineering,2019,6(2):28. doi: 10.3390/bioengineering6020028
[30] 吴淑华, 张喆浩, 范玉艳, 等. 酶水解豌豆纤维粉制备低聚糖工艺优化[J]. 食品科学,2019,40(18):287−294. [WU S H, ZHANG J H, FAN Y Y, et al. Optimization of preparation of oligosaccharides by enzymatic hydrolysis of pea fiber powder[J]. Food Science,2019,40(18):287−294. doi: 10.7506/spkx1002-6630-20181015-140 WU S H, ZHANG J H, FAN Y Y, et al. Optimization of preparation of oligosaccharides by enzymatic hydrolysis of pea fiber powder[J]. Food Science, 2019, 40(18): 287-294. doi: 10.7506/spkx1002-6630-20181015-140
[31] 郑荣. 大豆蛋白水解物的制备及其在细胞培养中的应用研究[D]. 兰州: 西北民族大学, 2018 ZHENG R. Preparation of protein hydrolysate and its appliccation in cell culture[D]. Lanzhou: Northwest Minzu University, 2018.
[32] 焦雯姝, 关嘉琦, 史佳鹭, 等. 响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基成分及发酵条件[J]. 食品科学,2020,41(6):123−130. [JIAO W S, GUAN J Q, SHI J L, et al. Optimization of medium composition and fermentation condition for folate production by Lactococcus lactis KLDS4.0325 by response surface methodology[J]. Food Science,2020,41(6):123−130. JIAO W S, GUAN J Q, SHI J L, et al. Optimization of medium composition and fermentation condition for folate production by Lactococcus lactis KLDS4.0325 by response surface methodology[J]. Food Science, 2020, 41(6): 123-130.
[33] 高娟, 杜佳馨, 吴限, 等. 羊肚菌酶解液制备美拉德反应肉味调味基料[J]. 食品科学,2020,41(24):242−250. [GAO J, D J X, WU X, et al. Preparation of meaty flavoring base from enzymatic hydrolysate of morel mushroom by maillard reaction[J]. Food Science,2020,41(24):242−250. GAO J, D J X, WU X, et al. Preparation of meaty flavoring base from enzymatic hydrolysate of morel mushroom by maillard reaction[J]. Food Science, 2020, 41(24): 242-250.
-
期刊类型引用(1)
1. 刘丽桃,傅春燕,刘诗薇,周秀娟,谢雨芊,欧阳玉珍,王彪,葛金文. 响应面法优化降脂通脉方多糖的提取工艺研究. 中医药导报. 2024(12): 58-62 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:










 下载:
下载:
