Optimization of Extraction Process, Structure Analysis and Immunological Properties of Polysaccharides from the Fruiting Body of Phellinus igniarius
-
摘要: 以桑黄子实体为原料,优化桑黄子实体多糖的提取条件,对其结构进行解析并评价其免疫调节活性。以提取温度、提取时间、料液比、提取次数为因素,采用单因素实验及正交试验优化桑黄子实体多糖提取条件,利用酶解法和透析法纯化多糖,通过相对分子质量测定、傅里叶红外光谱、单糖组成和甲基化分析其化学结构,并采用RAW-Blue™细胞实验初步研究其免疫活性。结果表明,桑黄子实体多糖提取的最优工艺条件为:料液比为1:40(g/mL),提取温度为100 °C,提取时间为2.0 h,提取次数为3次,该条件下多糖得率为6.71%,总糖纯度为81.69%±0.19%,分子量为10.77 kDa,其主要由(1→4)-Glc组成,并含有少量的(1→6)-Glc和(1→3)-Glc;多糖可以增强RAW-Blue™细胞分泌胚胎碱性磷酸酶的活性,并能增强RAW-Blue™巨噬细胞的吞噬能力。研究结果可为桑黄子实体多糖在食品和药品中的开发与应用提供理论依据。Abstract: In this study, using Phellinus igniarius as raw materials, the extraction conditions of Phellinus igniarius polysaccharides were optimized, the structure and immune regulatory activity were analyzed and evaluated. Using extraction temperature, extraction time, solid-liquid ratio, and extraction frequency as factors, single factor experiments and orthogonal experiments were used to optimize the extraction conditions of polysaccharides from Phellinus igniarius. After purification by enzymolysis and dialysis methods, the structural features of this polysacharide were characterised using HPSEC (Mw), FTIR (functional group), HPAEC (monosaccharide composition) and methylation analysis (linkage patterns), and their immunomodulatory properties were investigated using RAW-Blue™ cell line. Results showed that, the optimal extraction conditions of polysaccharides from the fruiting body of Phellinus were as follows: The solid-liquid ratio was 1:40 (g/mL), the extraction temperature was 100 °C, the extraction time was 2.0 h, and the extraction times were 3. Under these conditions, the extraction yield of polysaccharide was 6.71%, the total sugar content was 81.69%±0.19%, and the Mw was 10.77 kDa. The polysaccharide obtained belong to glucan family constructing mainly by (1→4)-Glc, small percentage of (1→6)-Glc and (1→3)-Glc as side chains. This polysaccharide could enhance the embryonic alkaline phosphatase secretion activity and the phagocytosis ability of RAW-Blue™ macrophages, which would provide a theoretical basis for its application in both food and phamacetical area.
-
随着人民生活水平的不断提高,慢性病已成为严重威胁人类健康、影响国民经济和社会发展的重大公共卫生问题[1-2]。食用菌对糖尿病、心血管疾病和消化系统疾病等慢性疾病具有良好的治疗效果[3]。食用菌中不仅含有如黄酮,多酚和多糖等多种功能成分[4],而且还含有丰富的微量元素、膳食纤维、蛋白质、维生素和矿物质等营养物质[5-6]。因此,食用菌在医药、功能食品等领域有着广泛的应用。
桑黄(Phellinus igniarius),属真菌界,担子菌门,担子菌纲,多孔菌目,多孔菌科,木层孔菌属,是一种珍稀的食药用真菌,主要分布和种植在东亚,特别是中国、日本和韩国[7]。两千年前,汉代的《神农本草经》记载其具有疏通血脉、祛除瘀血、缓解腹痛和治疗慢性腹泻等功效[8]。现代医学研究表明,桑黄具有抗肿瘤、抗氧化、降血糖和免疫调节等多种药理活性[9-10],这些生理活性与桑黄的化学成分密切有关[11]。
多糖是一类主要的生物活性大分子,普遍存在于微生物、植物和动物等自然资源中[12]。桑黄多糖是桑黄中最重要的活性成分之一,其具有抗氧化[7]、抗肿瘤[9]、降血糖[11]和免疫调节[13]等潜在的生物活性。目前,虽然对桑黄多糖的化学结构和生物活性已有大量研究,但因为桑黄种属较多,不同品种的桑黄中多糖的结构及生物活性具有较大差异。本研究采用单因素实验及正交试验优化桑黄子实体多糖的提取工艺条件,采用水提醇沉法提取多糖、经酶解法和透析法对多糖进行除杂纯化,并通过相对分子质量测定、傅里叶红外光谱、单糖组成及甲基化分析其化学结构。然后,采用RAW-Blue™细胞分泌胚胎碱性磷酸酶(SEAP)实验、吞噬实验研究其免疫调节活性,旨在为桑黄的利用和进一步的开发提供科学依据。
1. 材料与方法
1.1 材料与仪器
杨树桑黄(Phellinus igniarius) 天津市园艺工程研究所提供;无水乙醇、甲醇、氨水、二氯甲烷、二甲基亚砜 均为分析纯,天津市江天化工有限公司;浓硫酸、苯酚、硝酸钠 均为分析纯,天津市化学试剂一厂;复合蛋白酶、葡萄糖标准品、单糖标准品、葡聚糖标准品、脂多糖 均为优级纯,美国Sigma公司;氢氧化钠 分析纯,上海生工生物有限公司;冰乙酸、无水硫酸钠 均为分析纯,天津市大茂有限公司;三氟乙酸 分析纯,北京百灵威有限公司;DMEM培养基(生物试剂) 美国Gibco公司;磷酸盐缓冲液 优级纯,上海源培生物科技股份有限公司;胎牛血清(生物试剂) 美国Gemini公司;双抗(生物试剂) 美国Hyclone公司;RAW-Blue™细胞、QUANTI-Blue™显色剂 均为生物试剂,美国Invivogen公司。
X622-ZH型电子天平 奥豪斯中国分公司;RE-2000型旋转蒸发仪 上海亚荣仪器厂;INFINITE 200 PRO型酶标仪 瑞士TECAN公司;6890N型气质联用仪 安捷伦科技有限公司;IS50型傅里叶红外光谱 尼高利公司;Prominence LC-20A型示差高效液相色谱仪 日本岛津公司;ICS-5000+离子色谱仪 美国Dionex公司。
1.2 实验方法
1.2.1 桑黄子实体多糖的提取
1.2.1.1 提取方法
桑黄子实体多糖采用水提醇沉法提取[14]。桑黄子实体经烘干、粉碎过60目筛后,加入蒸馏水(料液比1:40),加热100 ℃,搅拌2 h,离心(6000 r/min,25 ℃,30 min)并收集上清液,重复3次。加入3倍体积的无水乙醇,4 ℃静置48 h。离心(6000 r/min,20 ℃,20 min)后取沉淀烘干得到桑黄水提物(SP-1)。
通过酶解法和透析法对桑黄水提物进行除杂纯化。桑黄水提物经完全溶解后,向其中添加3%复合蛋白酶,在40 ℃、pH7的条件下搅拌2 h去除蛋白,煮沸灭酶。离心(6000 r/min,20 ℃,20 min)后将上清液用透析袋(8000~14000 Da)透析2 d。离心(6000 r/min,20 ℃,20 min)去掉沉淀,将上清液旋蒸浓缩后,加入3倍体积的无水乙醇,4 ℃静置48 h。离心(6000 r/min,4 ℃,20 min)取沉淀,经真空冷冻干燥得到桑黄子实体多糖(SP-2)。
1.2.1.2 总糖纯度及多糖得率的测定
总糖纯度的测定采用苯酚-硫酸法[15]。
标准曲线制备:以2 mL不同浓度的葡萄糖溶液为标准品,分别加入50 μL 80%苯酚和3 mL浓硫酸,混匀,冷却至室温,490 nm处测其吸光度。
样品测定:称取10 mg样品,加入1 mL 72% H2SO4,室温搅拌30 min,使样品完全溶解,稀释至0.2 mg/mL,取2 mL稀释液,加入50 μL 80%苯酚溶液,3 mL浓硫酸,混匀,冷却至室温后测定吸光度,根据下式计算样品中总糖纯度:
总糖纯度(%)=C×Vm×100 式中:C为从标准曲线查得总糖浓度(mg/mL);V为测定时样品的体积(mL);m为样品的质量(mg)。
多糖得率的计算公式如下:
多糖得率(%)=m1×C1m×100 式中:m为样品的质量(mg);m1为提取后多糖的质量(mg);C1为提取后多糖的总糖纯度(%)。
1.2.1.3 单因素实验设计
提取温度:称量5 g样品,在料液比为1:30(g/mL)、提取时间为1.5 h、提取次数为1次、醇沉时加入无水乙醇的倍数为4倍、醇沉时间为静置过夜的条件下,考察不同提取温度(60、70、80、90、100 ℃)对多糖得率的影响。
提取时间:称量5 g样品,在提取温度为80 ℃、料液比为1:30(g/mL)、提取次数为1次、醇沉时加入无水乙醇的倍数为4倍、醇沉时间为静置过夜的条件下,考察不同提取时间(0.5、1.0、1.5、2.0、2.5 h)对多糖得率的影响。
料液比:称量5 g样品,在提取温度为80 ℃、提取时间为1.5 h、提取次数为1次、醇沉时加入无水乙醇的倍数为4倍、醇沉时间为静置过夜的条件下,考察不同料液比(1:10、1:20、1:30、1:40、1:50 g/mL)对多糖得率的影响。
提取次数:称量5 g样品,在提取温度为80 ℃、提取时间为1.5 h、料液比为1:30(g/mL)、醇沉时加入无水乙醇的倍数为4倍、醇沉时间为静置过夜的情况下,考察不同提取次数(1、2、3、4、5次)对多糖得率的影响。
1.2.1.4 正交试验设计
根据文献[16-17]调研及单因素实验确定的条件范围设计正交试验方案,因为提取温度、提取时间以及料液比对实验的影响较大,所以本实验采用以上三者作为实验因素,提取次数选择3次,依据L9(34)正交表开展三因素三水平正交试验,探究桑黄子实体多糖的最优提取条件。正交试验因素水平设计如表1所示。
表 1 正交试验因素水平设计Table 1. Factors and levels of orthogonal test因素 水平 1 2 3 A提取温度(°C) 80 90 100 B提取时间(h) 1.0 1.5 2.0 C料液比(g/mL) 1:20 1:30 1:40 1.2.2 相对分子质量的测定
用高效凝胶排阻色谱法测定桑黄子实体多糖的分子量[18],不同分子量的葡聚糖(10、40、70、500和2000 kDa)为标准品。色谱条件如下:
色谱柱:Ultrahydrogel 7.8×300 mm线性柱和Ultrahydrogel 6×40 mm保护柱;流动相:0.1 mg/mL NaNO3;流速:0.6 mL/min;柱温箱温度:40 ℃。
1.2.3 傅里叶红外光谱的测定
称取1 mg样品和150 mg干燥的KBr。用研钵研磨均匀,压片后进行傅里叶红外光谱扫描[19]。得到波数范围为4000~400 cm−1的傅里叶红外光谱图。
1.2.4 单糖组成的测定
根据文献[20]方法并做适当改进,进行桑黄子实体多糖的单糖组成测定,具体操作方法如下:
样品测定:称取1.5 mg样品于安瓿瓶中,加入1.5 mL 2 mol/L三氟乙酸,封口,120 ℃水解3 h,减压旋干。加入0.5 mL甲醇,减压旋干(重复5次),最后将产物完全溶于1.5 mL超纯水中,使用离子色谱仪鉴定样品单糖组成。
标品测定:称取单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸)1 mg,分别溶于1 mL水中,各取500 μL混合加水稀释至5 mL,使用离子色谱仪鉴定标准品单糖组成。离子色谱条件如下:
色谱柱:Dionex CarboPacTM PA20,3×150 mm;流动相:A相为超纯水,B相为0.2 mol/L NaOH溶液,C相为1 mol/L醋酸钠溶液;流动相体积比例:A相:B相:C相=5:2:1;流速:0.45 mL/min;柱温箱温度:30 ℃。
1.2.5 甲基化分析
参考文献[1]的方法进行多糖的甲基化分析。称取3 mg样品溶于0.5 mL二甲基亚砜中,加入20 mg氢氧化钠和0.5 mL碘甲烷,搅拌2.5 h。加入3~5 mL去离子水,振荡萃取,去掉水层,重复3次。吸取有机相,过无水硫酸钠柱,再用0.5 mL二氯甲烷洗2次柱子,得到的有机相组分进行氮气吹干。再加入0.5 mL 4 mol/L三氟乙酸100 ℃水解6 h,氮气吹干,加入0.3 mL去离子水、50 μL 50 mg/mL氨水和3 mg硼氘化钠,室温搅拌12 h。加入250 μL冰乙酸,再加入0.5 mL含5%醋酸的甲醇,氮气吹干,重复4次,加入0.5 mL乙酸酐,100 ℃加热2 h,冷却后加250 μL无水乙醇,氮气吹干后加入0.5 mL二氯甲烷溶解,过无水硫酸钠柱,用0.5 mL二氯甲烷清洗2次柱子,得到最终产物进行GC-MS检测。检测条件如下:
色谱柱:5%苯基~95%甲基硅氧烷毛细管色谱柱;检测器:火焰离子检测器;色谱柱程序升温:120 ℃保持3 min,以3 ℃/min速度升温至210 ℃,210 ℃再保持4 min;色谱柱流速:10 mL/min;进样口温度:280 ℃;进样体积:2 μL;N2流速:25 mL/min;H2流速:30 mL/min;空气流速:400 mL/min。
1.2.6 桑黄子实体多糖的免疫调节活性测定
1.2.6.1 细胞复苏
在无菌37 ℃水浴锅中,将冻存的RAW-Blue™巨噬细胞迅速融化。将细胞转移至放有9 mL完全培养基(由基础培养基加上10%的胎牛血清和1%由青霉素-链霉素组成的双抗配制而成)的离心管中,1000 r/min离心5 min后弃上清液,加入完全培养基重悬细胞,转移至培养瓶中,再加入适量完全培养基,混匀后放入37 ℃,5% CO2的培养箱中培养。
1.2.6.2 细胞传代
取处于对数生长期的RAW-Blue™细胞进行传代。将培养瓶中的培养基弃去,用磷酸盐缓冲液(PBS)冲洗3次,然后加入适量完全培养基,用细胞刮刀将细胞刮下,制成细胞悬液,吸取部分细胞液转移至新培养瓶中,加入适量完全培养基,吹打均匀,放入37 ℃,5% CO2的培养箱中培养。
1.2.6.3 多糖对RAW-Blue™细胞分泌SEAP的影响
弃去培养瓶中的培养基后用PBS洗2次,加适量完全培养基刮下细胞,吸取细胞计数,配制浓度为5.5×105个/mL的细胞液。在96孔板中每孔加入195 μL配制完成的细胞液,再加入5 μL 50 μg/mL多糖溶液,空白用PBS补全,阳性对照加入5 μL 2 μg/mL的脂多糖(LPS),放入培养箱中培养24 h。将40 μL细胞液转移至新的96孔板中,加入160 μL的QUANTI-Blue™显色剂,放入培养箱中培养2 h,测定620 nm处吸光度。
1.2.6.4 多糖的细胞吞噬能力测定
采用中性红实验分析多糖对RAW-Blue™细胞吞噬能力的影响[21],取对数生长期的巨噬细胞,经PBS清洗、吹打混匀后,取100 μL按5×104个/孔的细胞密度将细胞悬液接种于96孔板中,在培养箱中培养12 h使细胞贴壁完全,弃去完全培养基,加入不同样品,培养24 h,弃上清液,加入100 μL中性红溶液,培养30 min,弃上清,用PBS清洗3次,加入200 μL醋酸-乙醇细胞裂解液,测定540 nm处吸光度,根据下式计算细胞吞噬中性红的能力:
吞噬活性(%)=A实A零×100 式中:A实为实验孔吸光度值;A零为调零孔吸光度值。
1.3 数据处理
采用Excel 2010软件进行数据处理,采用SPSS 26软件做差异显著性分析,其中所有实验均为3次重复,以平均值±标准差表示,采用Origin 2022软件绘图。
2. 结果与分析
2.1 桑黄子实体多糖提取条件的优化
2.1.1 桑黄子实体多糖提取条件的单因素实验
2.1.1.1 提取温度对桑黄子实体多糖得率的影响
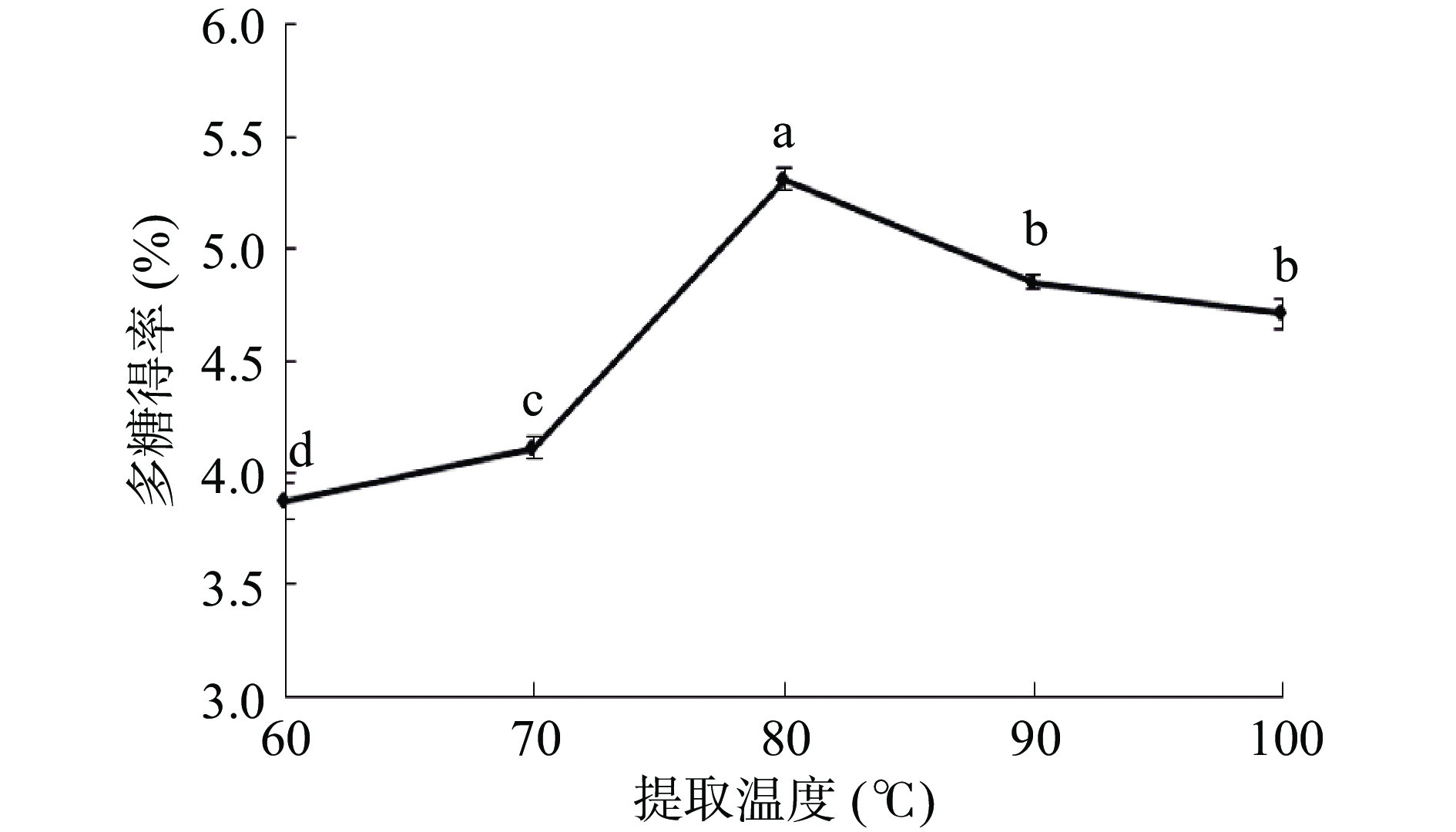
提取温度是影响多糖得率的一个重要因素。如图1所示,随着提取温度增加,多糖得率也增加,当提取温度增至80 ℃时,多糖得率达到最高值为5.31%。随着提取温度的继续增加,多糖得率反而出现下降。这可能是因为加热促进了多糖的浸出,提高了多糖得率,但是过高的温度又引起了多糖的降解[22],从而导致得率下降。因此,提取温度选择80 ℃为宜。
2.1.1.2 提取时间对桑黄子实体多糖得率的影响
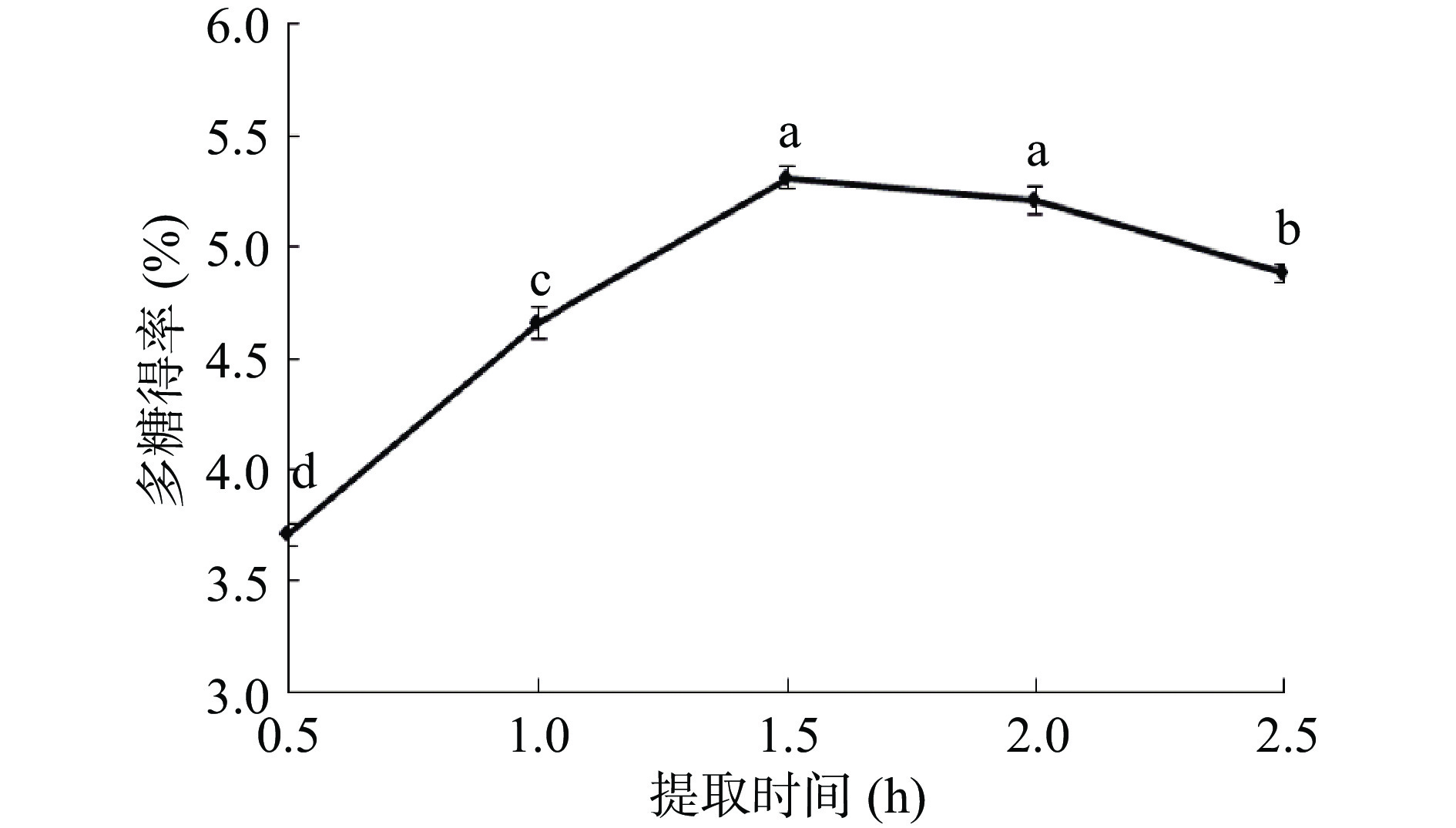
提取时间是多糖提取时的一个重要参数。如图2所示,随着提取时间增加,多糖得率也增加,当提取时间增至1.5 h时,多糖得率达到最高值为5.31%。当提取时间为2.5 h时,多糖得率反而出现下降。这可能是因为继续增加提取时间可能会导致多糖的分解[23]。因此,提取时间选择1.5 h为宜。
2.1.1.3 料液比对桑黄子实体多糖得率的影响
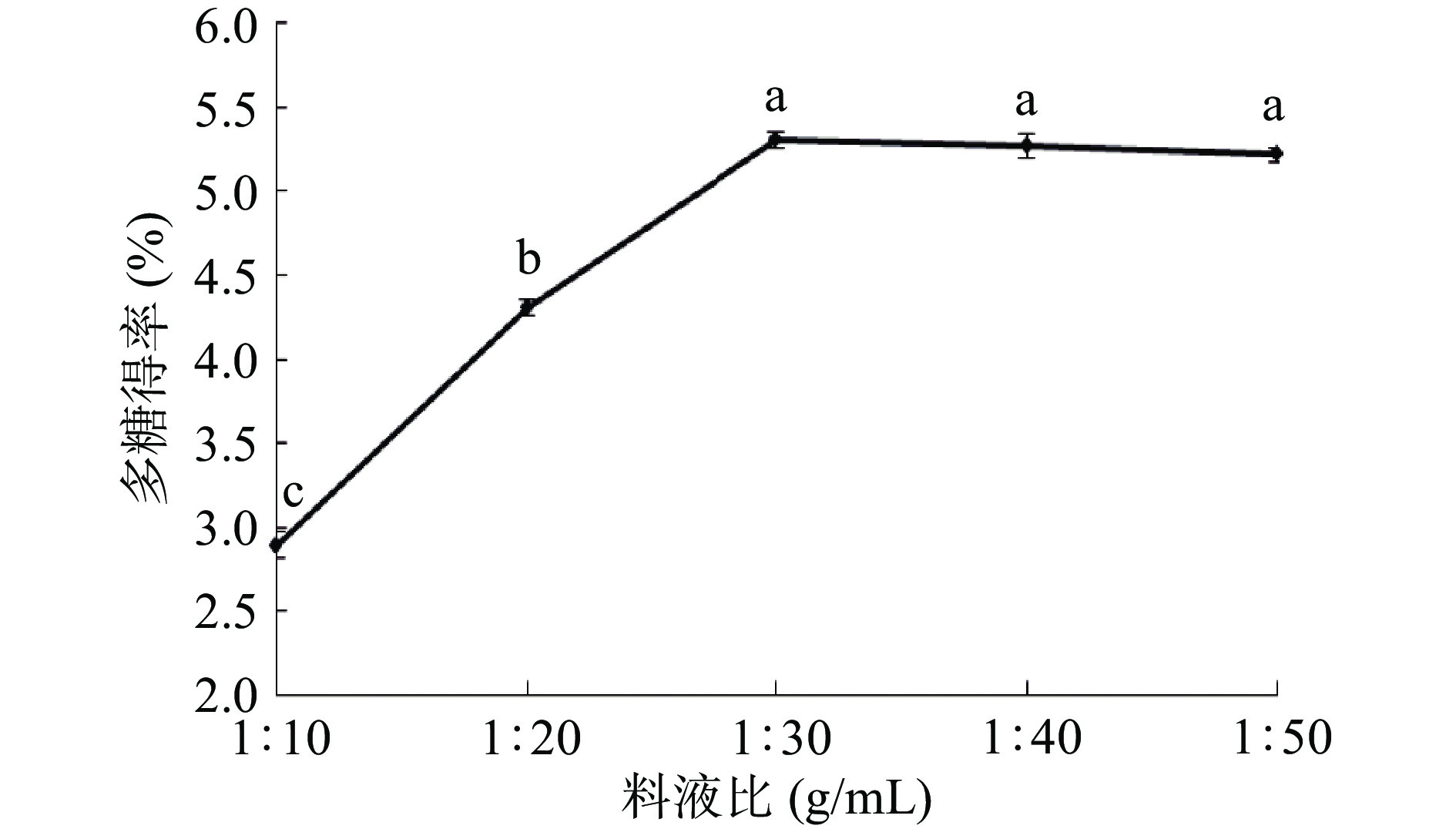
料液比对多糖得率的影响较大。如图3所示,随着料液比增加,多糖得率也增加,当液料比增至1:30(g/mL)时,多糖得率达到最高值为5.31%。继续加大料液比,多糖得率并未出现显著变化。提取过程中增加料液比可以在一定程度上促进原料与提取液充分接触,从而提高得率,当提取液达到饱和,继续增加提取液可能对多糖的浸出没有明显的影响,甚至有时还会增加其他杂质的溶出,导致多糖得率降低[24]。因此,料液比选择1:30(g/mL)为宜。
2.1.1.4 提取次数对桑黄子实体多糖得率的影响
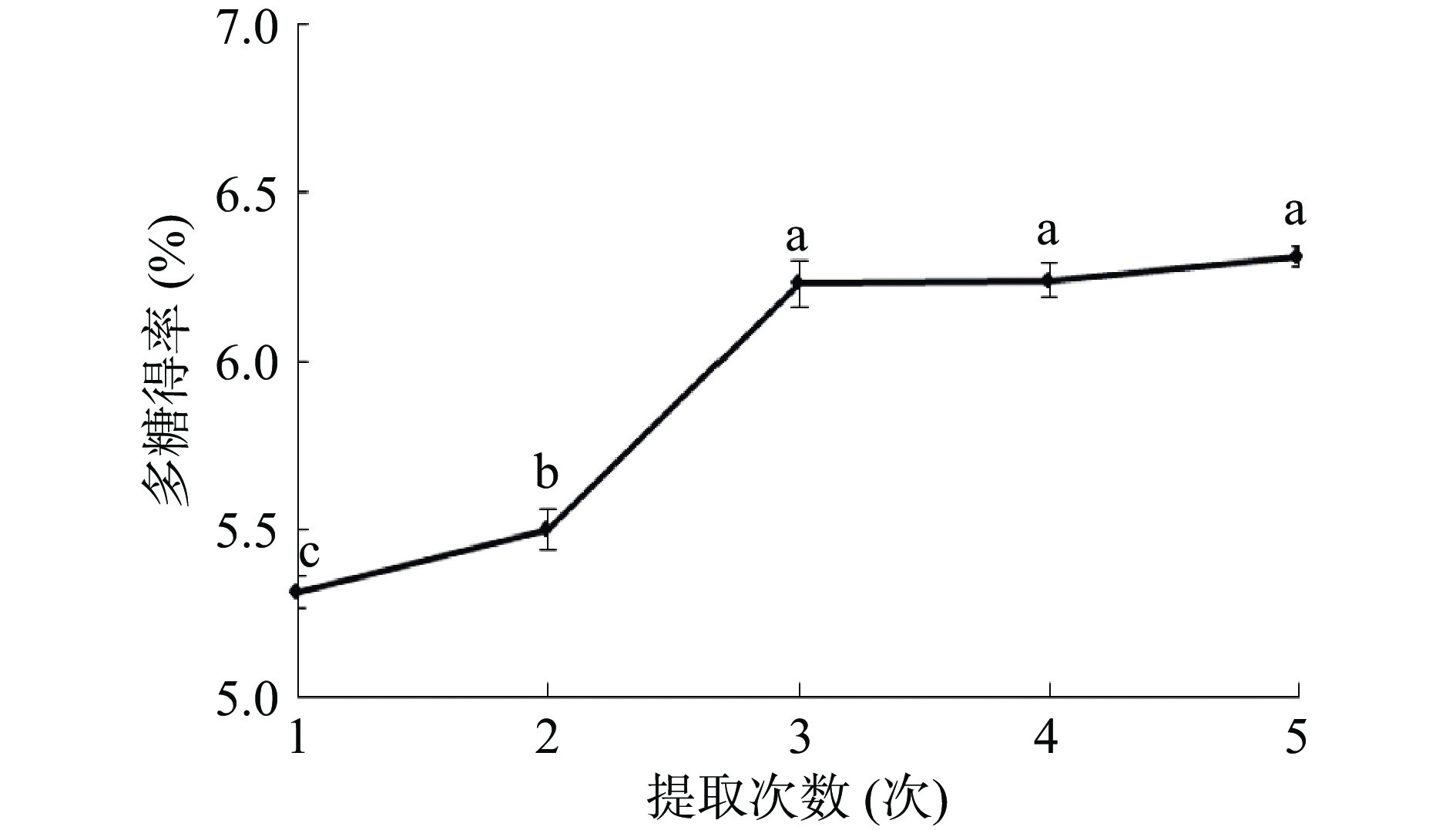
由图4可知,随着提取次数的增加,桑黄子实体多糖得率呈增加趋势。且当提取次数增至3次后,多糖得率未出现显著性增长。考虑经济因素,最终选择提取次数为3次,此条件下的多糖得率为6.23%。
2.1.2 桑黄子实体多糖提取条件的正交试验
上述单因素实验确定了正交试验的因素和水平,以多糖得率为指标,进行L9(34)正交试验。由极差分析结果可知(表2),影响多糖得率的因素主次顺序为提取时间(B)>提取温度(A)>料液比(C),最优水平组合为A3B3C3,即料液比为1:40(g/mL),提取温度为100 ℃,提取时间为2.0 h。由于最优组合A3B3C3未出现在正交表中,因此与正交表中的最高得分组A3B3C2进行验证实验。验证实验结果A3B3C3的多糖得率6.71%显著高于A3B3C2的多糖得率6.53%(P<0.05),证明A3B3C3为最优组合。
表 2 桑黄多糖提取正交试验Table 2. Orthogonal test of extracting polysaccharides from Phellinus igniarius实验号 A
提取温度B
提取时间C
料液比多糖得率 1 1(80) 1(1.0) 1(1:20) 4.32 2 1 2(1.5) 2(1:30) 5.50 3 1 3(2.0) 3(1:40) 6.38 4 2(90) 1 2 5.65 5 2 2 3 6.37 6 2 3 1 6.36 7 3(100) 1 3 6.22 8 3 2 1 6.31 9 3 3 2 6.53 ¯K1 5.40 5.40 5.66 ¯K2 6.13 6.06 5.89 ¯K3 6.35 6.42 6.32 R 0.95 1.02 0.66 2.2 桑黄子实体多糖的总糖纯度及相对分子质量测定
以葡萄糖为标准品,葡萄糖浓度mg/mL为横坐标,OD值(490 nm)为纵坐标,绘制葡萄糖标准曲线:y=11.997x+0.0776,R²=0.9996。经测定得出SP-1的总糖纯度为60.05%±0.11%,SP-2的总糖纯度为81.69%±0.19%。以分子量的对数值为横坐标,保留时间为纵坐标绘制标准曲线:y=−1.7962x+17.918,R2=0.9936。根据分子量标准曲线,可计算出SP-2的分子量约为10.77 kDa。有研究表明[11],桑黄多糖的分子量约为17.7 kDa,与本研究结果略有不同,这可能与实验所采用的提取方法不同有关。
2.3 傅里叶红外光谱分析
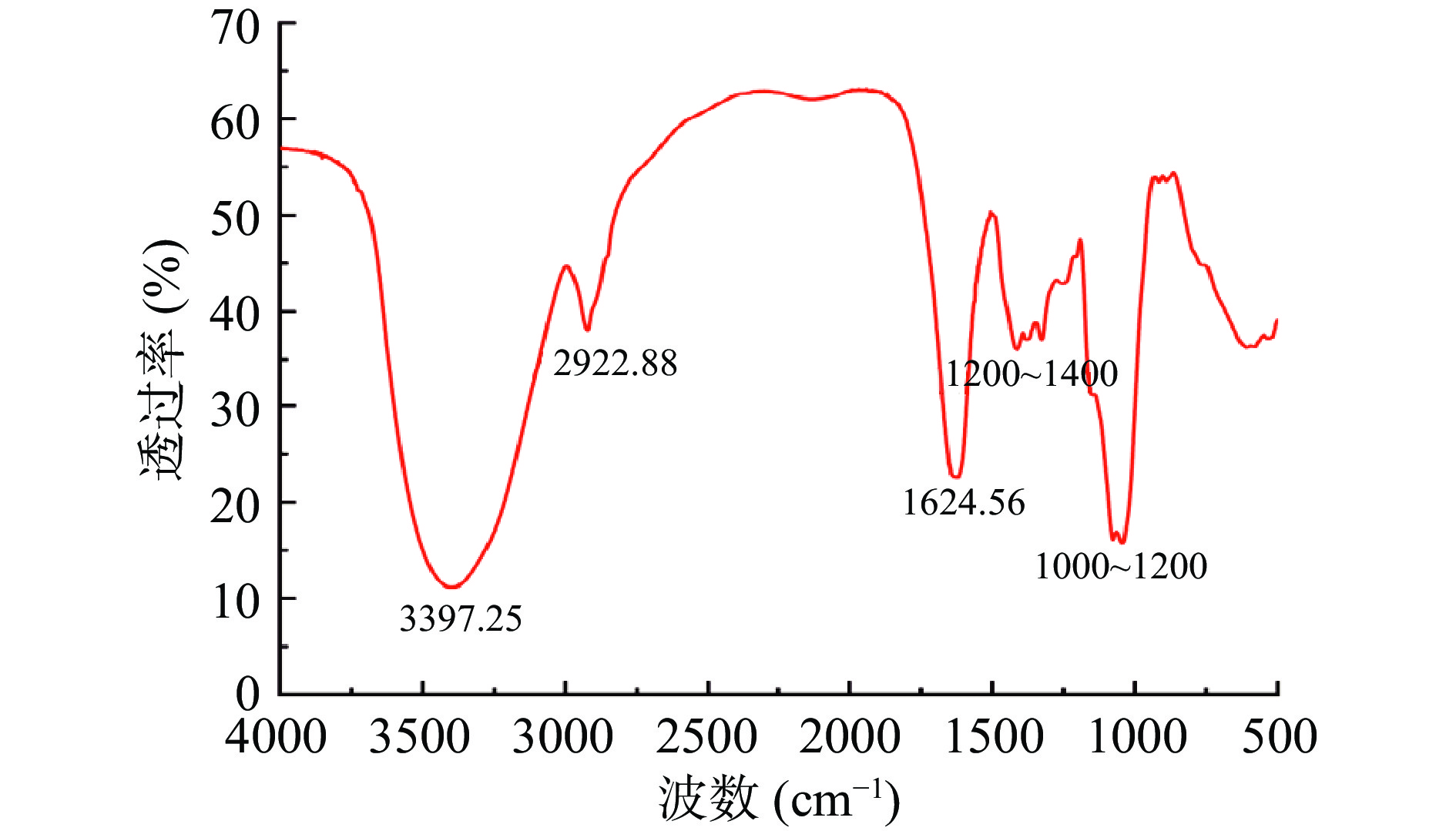
通过傅里叶红外光谱分析,能比较准确地对多糖的官能团进行分析。使用KBr压片法[25]对SP-2进行傅里叶红外光谱扫描,其结果如图5所示。SP-2具有糖类物质的特征吸收峰。其中,3397.25 cm−1处出现一个吸收强度较大的峰,是桑黄多糖分子中O-H的伸缩振动所形成的;2922.88 cm−1处的峰,是C-H的伸缩振动所形成的;1624.56 cm−1处为C=O的伸缩振动峰;1200~1400 cm−1处的3个峰,是C-H的弯曲振动所形成的;1000~1200 cm−1处的2个峰,是C-O-R的伸缩振动峰。综上所述,该物质是一种糖类化合物。
2.4 单糖组成测定
用离子色谱法对SP-2进行单糖组分分析。离子色谱法是单糖组成分析的常用方法,根据单糖标准品的保留时间确定样品中单糖的种类,利用不同浓度单糖标准品的峰面积绘制标准曲线,根据样品峰面积确定单糖含量[26]。对照标准品的离子色谱图图6可看出,SP-2的单糖组分比较简单,主要为葡萄糖,几乎不含有其他单糖,所以可以推测SP-2是一种葡聚糖。有研究表明[27],桑黄多糖的主链由葡萄糖组成,支链由甘露糖组成,与本研究结果略有不同,可能与桑黄的品种、提取方法及条件等不同有关。
2.5 甲基化分析
甲基化分析是一种测定多糖中糖苷键类型的常用方法。采用GC-MS对SP-2进行甲基化分析,通过对色谱峰的保留时间及质谱信息进行对比,如表3所示,SP-2主要由(1→4)-Glc、T-Glc、(1→4,6)-Glc、(1→3,4)-Glc、(1→6)-Glc构成,其摩尔百分比为61.36:19.51:8.90:5.58:4.64。根据单糖组成和甲基化分析的结果,推测SP-2的主要由(1→4)-Glc组成,并含有少量的(1→6)-Glc和(1→3)-Glc。
表 3 桑黄子实体多糖的单糖连接方式Table 3. Monosaccharide linkage mode of polysaccharides from Phellinus igniarius连接方式 摩尔百分比 (1→4)-Glc 61.36 T-Glc 19.51 (1→4,6)-Glc 8.90 (1→3,4)-Glc 5.58 (1→6)-Glc 4.64 2.6 桑黄子实体多糖的免疫调节活性分析
2.6.1 多糖对RAW-Blue™细胞分泌SEAP的影响
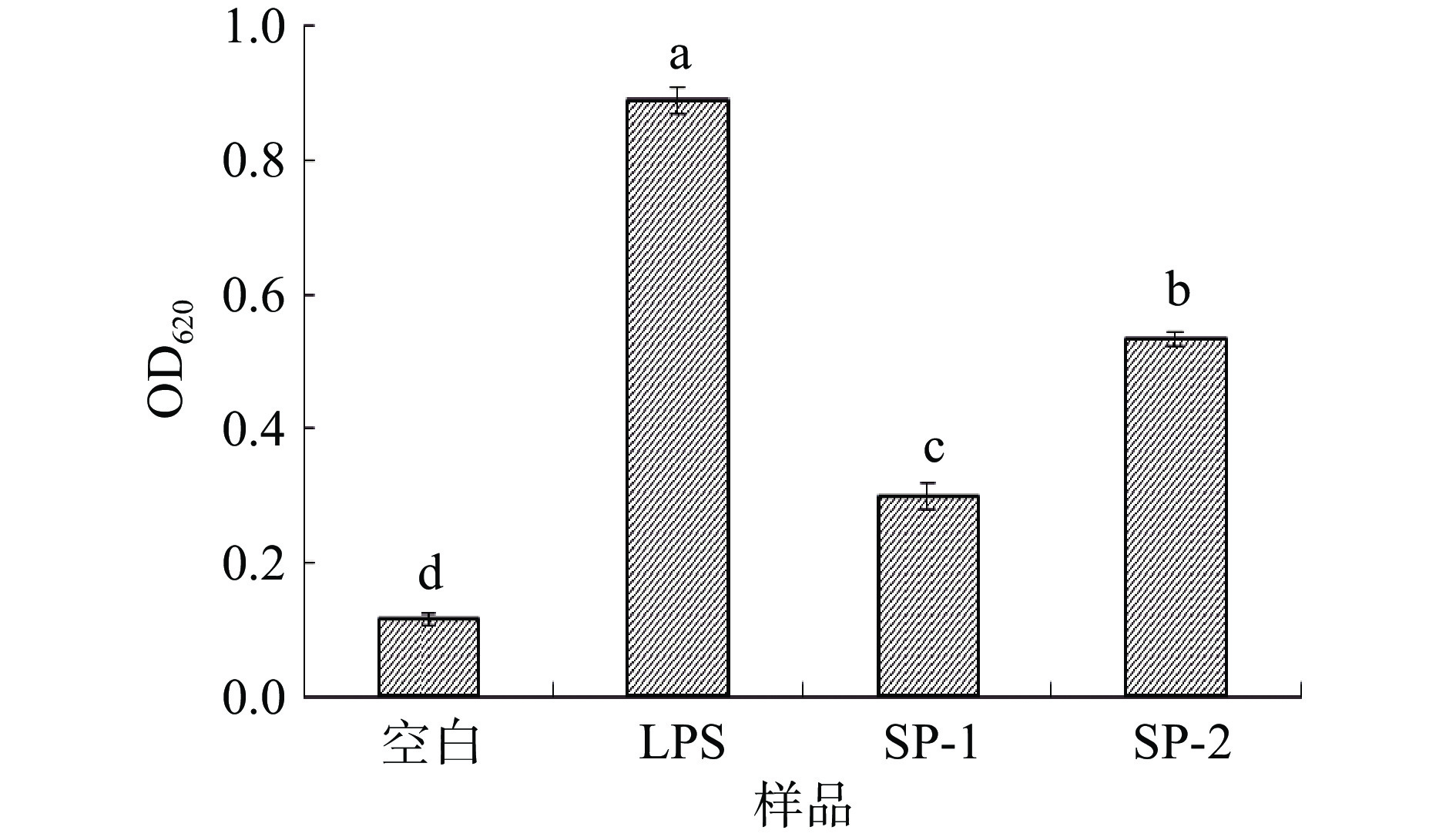
采用比色法测定多糖对RAW-Blue™细胞分泌SEAP的影响[28],RAW-Blue™细胞来源于RAW 264.7巨噬细胞。它们能稳定表达NF-κB和AP-1转录因子诱导的SEAP基因。在细胞上的受体作用下RAW-Blue™细胞能够激活NF-κB和/或AP-1,导致SEAP分泌,当使用QUANTI-Blue™ SEAP检测介质时,即可观察到SEAP的分泌量[29]。实验结果如图7所示,LPS阳性对照组能显著 (P<0.05) 增强RAW-Blue™细胞分泌SEAP的活性,与空白对照组相比,桑黄子实体多糖均能够影响RAW-Blue™细胞分泌SEAP的活性,且均显著(P<0.05) 高于空白对照组,说明桑黄子实体多糖促进了RAW-Blue™细胞分泌SEAP的活性。SP-2能够显著 (P<0.05) 增强RAW-Blue™细胞分泌SEAP的活性,然而,与SP-2相比,SP-1对RAW-Blue™细胞分泌SEAP活性促进作用较小。
2.6.2 多糖对细胞吞噬能力的影响
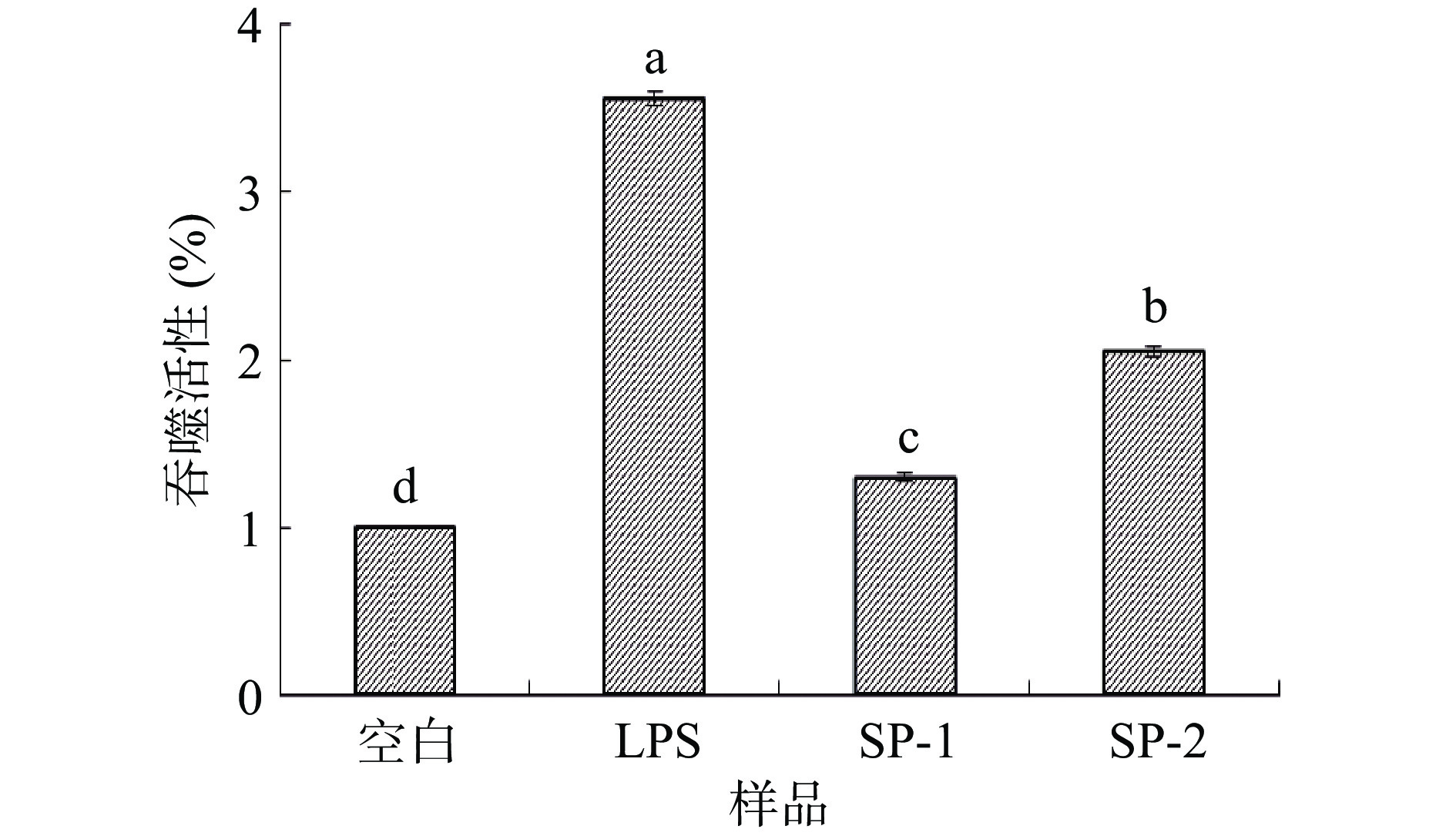
吞噬作用是巨噬细胞活化的主要指标之一,所以可以通过测定巨噬细胞的吞噬能力来研究其免疫调节活性[30],采用中性红法测定多糖对巨噬细胞吞噬能力的影响。RAW-Blue™巨噬细胞的吞噬能力实验结果如图8所示,LPS阳性对照组能显著 (P<0.05) 促进巨噬细胞的中性红吞噬能力,实验组中,SP-2能够显著 (P<0.05) 增强RAW-Blue™巨噬细胞的吞噬活性。然而,与SP-2相比,SP-1对RAW-Blue™巨噬细胞吞噬活性促进作用较小,这可能和多糖的含量差异有关。Liu等[31]研究发现,桑黄多糖能促进RAW 264.7细胞增殖,增强其吞噬能力,促进其分泌IL-6和TNF-α细胞因子,并增强细胞周期中的S期,显示出明显的免疫调节活性,这与本实验的结果相似。
3. 结论
本研究采用水提醇沉法提取桑黄子实体多糖、经酶解法和透析法对桑黄子实体多糖进行除杂纯化,通过单因素实验及正交试验确定了多糖提取的最优工艺条件为料液比为1:40(g/mL),提取温度为100 ℃,提取时间为2.0 h,提取次数为3次,该条件下多糖得率为6.71%;总糖纯度为81.69%±0.19%,分子量为10.77 kDa,其主要由(1→4)-Glc组成,并含有少量的(1→6)-Glc和(1→3)-Glc。免疫调节活性实验表明,桑黄子实体多糖可以增强RAW-Blue™细胞分泌SEAP的活性,并能增强RAW-Blue™巨噬细胞的吞噬能力,故其具有较好的免疫调节活性。本研究为桑黄的推广应用和深度开发提供了技术支持和理论依据。但是,本研究对桑黄子实体多糖的研究尚处于初级阶段,对其活性研究还不够完全,对其化学结构和在体内的作用机制尚不完全清楚,对桑黄子实体多糖的深层次的结构及构效关系还有待于进一步的研究。
-
表 1 正交试验因素水平设计
Table 1 Factors and levels of orthogonal test
因素 水平 1 2 3 A提取温度(°C) 80 90 100 B提取时间(h) 1.0 1.5 2.0 C料液比(g/mL) 1:20 1:30 1:40 表 2 桑黄多糖提取正交试验
Table 2 Orthogonal test of extracting polysaccharides from Phellinus igniarius
实验号 A
提取温度B
提取时间C
料液比多糖得率 1 1(80) 1(1.0) 1(1:20) 4.32 2 1 2(1.5) 2(1:30) 5.50 3 1 3(2.0) 3(1:40) 6.38 4 2(90) 1 2 5.65 5 2 2 3 6.37 6 2 3 1 6.36 7 3(100) 1 3 6.22 8 3 2 1 6.31 9 3 3 2 6.53 ¯K1 5.40 5.40 5.66 ¯K2 6.13 6.06 5.89 ¯K3 6.35 6.42 6.32 R 0.95 1.02 0.66 表 3 桑黄子实体多糖的单糖连接方式
Table 3 Monosaccharide linkage mode of polysaccharides from Phellinus igniarius
连接方式 摩尔百分比 (1→4)-Glc 61.36 T-Glc 19.51 (1→4,6)-Glc 8.90 (1→3,4)-Glc 5.58 (1→6)-Glc 4.64 -
[1] 刘静, 唐传红, 师小凡, 等. 不同灵芝菌株子实体多糖的特征分析及免疫活性评价[J]. 食用菌学报,2022,29(5):90−100. [LIU J, TANG C H, SHI X F, et al. Characterization and immunostimulatory activity of polysaccharides from Fruiting Bodies of Different Ganoderma lucidum Strains[J]. Acta Edulis Fungi,2022,29(5):90−100. doi: 10.16488/j.cnki.1005-9873.2022.05.010 LIU J, TANG C H, SHI X F, et al. Characterization and immunostimulatory activity of polysaccharides from Fruiting Bodies of Different Ganoderma lucidum Strains[J]. Acta Edulis Fungi, 2022, 29(05): 90-100. doi: 10.16488/j.cnki.1005-9873.2022.05.010
[2] 应学兵, 陆娜, 林佳瑶. 降温刺激下双孢蘑菇胞外酶活性、多糖含量及单糖组成的变化规律[J]. 中国食用菌,2022,41(9):48−59. [YING X B, LU N, LIN J Y. Changes of extracellular enzymes activities, polysaccharides content and monosaccharide composition in Agaricus bisporus under cold stimulation[J]. Edible Fungi of China,2022,41(9):48−59. doi: 10.13629/j.cnki.53-1054.2022.09.009 YING X B, LU N, LIN J Y. Changes of extracellular enzymes activities, polysaccharides content and monosaccharide composition in Agaricus bisporus under cold stimulation[J]. Edible Fungi of China, 2022, 41(9): 48-59. doi: 10.13629/j.cnki.53-1054.2022.09.009
[3] HE X Q, RONG P X, LIU H Y, et al. Co-fermentation of edible mushroom by-products with soybeans enhances nutritional values, isoflavone aglycones, and antioxidant capacity of douchi koji[J]. Foods,2022,11(19):2943−2944. doi: 10.3390/foods11192943
[4] YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: A review[J]. Carbohydrate Polymers,2018,183(1):91−101.
[5] LI H P, LIU J J, HOU Z Q, et al. Activation of mycelial defense mechanisms in the oyster mushroom Pleurotus ostreatus induced by Tyrophagus putrescentiae[J]. Food Research International,2022,160(1):111708−111709.
[6] BELKAID Y, HARRISON O J. Homeostatic immunity and the microbiota[J]. Immunity,2017,46(4):562. doi: 10.1016/j.immuni.2017.04.008
[7] 向瑞琪, 谢锋, 谭红, 等. 三种食用菌多糖的基本结构与抗氧化活性研究[J]. 食品工业科技,2022,43(14):69−76. [XIANG R Q, XIE F, TAN H, et al. Study on basic structure and antioxidant activity of polysaccharides from three edible fungi[J]. Science and Technology of Food Industry,2022,43(14):69−76. doi: 10.13386/j.issn1002-0306.2021100170 XIANG R Q, XIE F, TAN H, et al. Study on basic structure and antioxidant activity of polysaccharides from three edible fungi[J]. Science and Technology of Food Industry, 2022, 43(14): 69-76. doi: 10.13386/j.issn1002-0306.2021100170
[8] 张菊, 贾东升, 赵士豪, 等. 菌菇复合多糖对秀丽线虫氧化胁迫抗性的影响[J]. 中国食品学报,2022,22(2):150−159. [ZHANG J, JIA D S, ZHAO S H, et al. The effect of mushroom complex polysaccharide on resisting to oxidative stress of Caenorhabditis elegans[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(2):150−159. doi: 10.16429/j.1009-7848.2022.02.017 ZHANG J, JIA D S, ZHAO S H, et al. The effect of mushroom complex polysaccharide on resisting to oxidative stress of Caenorhabditis elegans[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(2): 150-159. doi: 10.16429/j.1009-7848.2022.02.017
[9] QIN L, CHEN S, XIE L M, et al. Recent advances in mung bean polysaccharides: extraction, physicochemical properties and biological activities[J]. Process Biochemistry,2022,121(1):248−256.
[10] 赵立磊. 桑黄多糖在对乙酰氨基酚诱导急性肝损伤中的保护作用研究[D]. 长春: 吉林大学, 2022 ZHAO L L. The protect effects of Phellinus linteus polysaccharides in acetaminophen-induced acute liver injury[D]. Changchun: Jilin University, 2022.
[11] 李雨鸿, 殷朝敏, 范秀芝, 等. 桑黄提取物的体外抗氧化、降血糖及降尿酸活性[J]. 现代食品科技,2022,38(5):71−80. [LI Y H, YIN C M, FAN X Z, et al. In vitro anti-oxidant, hypoglycemic, and hypouricemic activities of Sanghuangporus vaninii extracts[J]. Modern Food Science and Technology,2022,38(5):71−80. doi: 10.13982/j.mfst.1673-9078.2022.5.0956 LI Y H, YIN C M, FAN X Z, et al. In vitro anti-oxidant, hypoglycemic, and hypouricemic activities of Sanghuangporus vaninii extracts[J]. Modern Food Science and Technology, 2022, 38(5): 71-80. doi: 10.13982/j.mfst.1673-9078.2022.5.0956
[12] XIAO M, JIA X, WANG N F, et al. Therapeutic potential of non-starch polysaccharides on type 2 diabetes: From hypoglycemic mechanism to clinical trials[J]. Critical Reviews in Food Science and Nutrition,2022,1(1):31−34.
[13] GUO Q B, XIAO X Y, LU L F, et al. Polyphenol-polysaccharide complex: preparation, characterization and potential utilization in food and health.[J]. Annual Review of Food Science and Technology,2022,13(1):59−87. doi: 10.1146/annurev-food-052720-010354
[14] 杨莉, 陈文宁, 郑娟霞, 等. 海藻多糖的提取、分离纯化及其在食品工业的应用[J]. 食品工业科技,2021,42(9):365−372. [YANG L, CHEN W N, ZHENG J X, et al. Extraction, isolation and purification of seaweed polysaccharide and its application in food industry[J]. Science and Technology of Food Industry,2021,42(9):365−372. doi: 10.13386/j.issn1002-0306.2019110241 YANG L, CHEN W N, ZHENG J X, et al. Extraction, isolation and purification of seaweed polysaccharide and its application in food industry[J]. Science and Technology of Food Industry, 2021, 42(9): 365-372. doi: 10.13386/j.issn1002-0306.2019110241
[15] 赵娇娇, 司茜媛, 张琨霖, 等. 燕麦β-葡聚糖-槲皮素复合物的制备及其对秀丽隐杆线虫寿命的影响[J]. 食品科学技术学报,2022,40(3):34−42,55. [ZHAO J J, SI X Y, ZHANG K L, et al. Preparation of complex of oats β-glucan and quercetin and its effect on lifespan of Caenorhabditis elegans[J]. Journal of Food Science and Technology,2022,40(3):34−42,55. doi: 10.12301/spxb202100903 ZHAO J J, SI X Y, ZHANG K L, et al. Preparation of complex of oats β-glucan and quercetin and its effect on lifespan of Caenorhabditis elegans[J]. Journal of Food Science and Technology, 2022, 40(3): 34-42+55. doi: 10.12301/spxb202100903
[16] 鲁斌, 张凤明, 蔡正达, 等. 梨园块菌多糖提取工艺优化及其单糖组成分析[J]. 食品工业科技,2022,43(13):218−224. [LU B, ZHANG F M, CAI Z D, et al. Optimization of polysaccharide extraction process from Tuber liyuanum and analysis of its monosaccharide composition[J]. Science and Technology of Food Industry,2022,43(13):218−224. doi: 10.13386/j.issn1002-0306.2021100234 LU B, ZHANG F M, CAI Z D, et al. Optimization of polysaccharide extraction process from Tuber liyuanum and analysis of its monosaccharide composition[J]. Science and Technology of Food Industry, 2022, 43(13): 218-224. doi: 10.13386/j.issn1002-0306.2021100234
[17] 安星亮, 赵永亮, 王欢, 等. 银耳多糖提取工艺的响应面法优化及抗氧化和保湿性研究[J]. 食品研究与开发,2022,43(15):123−130. [AN X L, ZHAO Y L, WANG H, et al. Optimization of extraction process for Tremella fuciformis polysaccharides by response surface methodology and its antioxidant and moisturizing properties[J]. Food Research and Development,2022,43(15):123−130. AN X L, ZHAO Y L, WANG H, et al. Optimization of extraction process for Tremella fuciformis polysaccharides by response surface methodology and its antioxidant and moisturizing properties[J]. Food Research and Development, 2022, 43(15): 123-130.
[18] LIANG J, ZENG Y J, WANG H F, et al. Extraction, purification and antioxidant activity of novel polysaccharides from Dendrobium officinale by deep eutectic solvents[J]. Natural Product Research,2019,33(22):3248−3253. doi: 10.1080/14786419.2018.1471480
[19] 刘晓庆, 刘会平, 赵范, 等. 沙枣多糖结构的初步研究[J]. 食品工业科技,2015,36(13):138−142,149. [LIU X Q, LIU H P, ZHAO F, et al. Purification and preliminary analysis of Elaeagnusangustifolia L. polysaccharide-1a[J]. Science and Technology of Food Industry,2015,36(13):138−142,149. doi: 10.13386/j.issn1002-0306.2015.13.020 LIU X Q, LIU H P, ZHAO F, et al. Purification and preliminary analysis of Elaeagnusangustifolia L. polysaccharide-1a[J]. Science and Technology of Food Industry, 2015, 36(13): 138-142+149. doi: 10.13386/j.issn1002-0306.2015.13.020
[20] HUA Y F, ZHANG M, FU C X, et al. Structural characterization of a 2-Oacetylglucomannan from Dendrobium officinale stem[J]. Carbohydrate Research,2004,339(13):2219−2224. doi: 10.1016/j.carres.2004.05.034
[21] 马高兴, 王晗, 杨文建, 等. 不同提取工艺对杏鲍菇多糖结构特征及免疫活性的影响[J]. 食品科学,2022,43(17):42−49. [MA G X, WANG H, YANG W J, et al. Effects of different extraction processes on structural characteristic and immunomodulatory activity of Pleurotus eryngii polysaccharide[J]. Food Science,2022,43(17):42−49. doi: 10.7506/spkx1002-6630-20220316-196 MA G X, WANG H, YANG W J, et al. Effects of different extraction processes on structural characteristic and immunomodulatory activity of Pleurotus eryngii polysaccharide[J]. Food Science, 2022, 43(17): 42-49. doi: 10.7506/spkx1002-6630-20220316-196
[22] 侯笛. 杏鲍菇子实体多糖对壬基酚诱导的小鼠肝脾损伤的修复作用[D]. 泰安: 山东农业大学, 2022 HOU D. Repair effect of Pleurotus eryngii fruiting body polysaccharides on liver and spleen damage of mice induced by nonylphenol[D]. Taian: Shandong Agricultural University, 2022.
[23] 操丽丽, 周俊, 郑峰, 等. 高压热水提取灵芝多糖及对其抗氧化活性的影响[J]. 食品科学技术学报,2018,36(2):58−62,77. [CAO L L, ZHOU J, ZHENG F, et al. Study on extraction of polysaccharides from Ganoderma lucidum by hot compressed water and its antioxidant activities[J]. Journal of Food Science and Technology,2018,36(2):58−62,77. doi: 10.3969/j.issn.2095-6002.2018.02.008 CAO L L, ZHOU J, ZHENG F, et al. Study on extraction of polysaccharides from Ganoderma lucidum by hot compressed water and its antioxidant activities[J]. Journal of Food Science and Technology, 2018, 36(02): 58-62, 77. doi: 10.3969/j.issn.2095-6002.2018.02.008
[24] 米佳, 杨雪莲, 禄璐, 等. 枸杞蜂花粉多糖超声波提取工艺优化及抗氧化活性分析[J]. 食品科学技术学报,2020,38(1):97−103. [MI J, YANG X L, LU L, et al. Ultrasound-assisted extraction optimization and analysis of antioxidant activities of polysaccharides from bee pollen of wolfberry[J]. Journal of Food Science and Technology,2020,38(1):97−103. doi: 10.3969/j.issn.2095-6002.2020.01.013 MI J, YANG X L, LU L, et al. Ultrasound-assisted extraction optimization and analysis of antioxidant activities of polysaccharides from bee pollen of wolfberry[J]. Journal of Food Science and Technology, 2020, 38(01): 97-103. doi: 10.3969/j.issn.2095-6002.2020.01.013
[25] 施洋, 熊善强, 胡晓波, 等. 苍耳子多糖的理化性质与生物学活性研究[J]. 合肥工业大学学报 (自然科学版),2022,45(7):978−983. [SHI Y, XIONG S Q, HU X B, et al. Study on physicochemical properties and biological activities of polysaccharides from Fructus Xanthii[J]. Journal of Hefei University of Technology (Natural Science),2022,45(7):978−983. SHI Y, XIONG S Q, HU X B, et al. Study on physicochemical properties and biological activities of polysaccharides from Fructus Xanthii[J]. Journal of Hefei University of Technology (Natural Science), 2022, 45(7): 978-983.
[26] 张玲, 胡紫艳, 金鑫. 枸杞多糖特性和单糖组成及木糖醇含量的分析[J]. 中国食品卫生杂志,2022,34(4):657−662. [ZHANG L, HU Z Y, JIN X. Analysis of polysaccharides characteristic, monosaccharide composition and xylitol content of Lycium barbarum[J]. Chinese Journal of Food Hygiene,2022,34(4):657−662. doi: 10.13590/j.cjfh.2022.04.004 ZHANG L, HU Z Y, JIN X. Analysis of polysaccharides characteristic, monosaccharide composition and xylitol content of Lycium barbarum[J]. Chinese Journal of Food Hygiene, 2022, 34(4): 657-662. doi: 10.13590/j.cjfh.2022.04.004
[27] 陈婷怡, 付立忠, 王伟科. 桑黄孔菌属多糖结构特征和药理作用研究进展[J]. 食用菌,2022,44(5):1−5. [CHEN T Y, FU L Z, WANG W K. Research progress in structural characteristics and pharmacological effects of polysaccharides from Sanghuangporus[J]. Edible Fungi,2022,44(5):1−5. doi: 10.3969/j.issn.1000-8357.2022.05.001 CHEN T Y, FU L Z, WANG W K. Research progress in structural characteristics and pharmacological effects of polysaccharides from Sanghuangporus[J]. Edible Fungi, 2022, 44(5): 1-5. doi: 10.3969/j.issn.1000-8357.2022.05.001
[28] 周绮纯, 彭求贤, 林汝堃, 等. 尖尾芋多糖的提取纯化及其免疫活性研究[J]. 中国临床药理学杂志,2022,38(17):2064−2069. [ZHOU Q C, PENG Q X, LIN R K, et al. Extraction and purification of polysaccharides from Alocasia cucullata and the study of its immunological activity[J]. The Chinese Journal of Clinical Pharmacology,2022,38(17):2064−2069. doi: 10.13699/j.cnki.1001-6821.2022.17.018 ZHOU Q C, PENG Q X, LIN R K, et al. Extraction and purification of polysaccharides from Alocasia cucullata and the study of its immunological activity[J]. The Chinese Journal of Clinical Pharmacology, 2022, 38(17): 2064-2069. doi: 10.13699/j.cnki.1001-6821.2022.17.018
[29] HAN R X, ALVAREZ A J H, MAYCOCK J, et al. Differential effects of oilseed protein hydrolysates in attenuating inflammation in murine macrophages[J]. Food Bioscience,2022,10(49):1−10.
[30] 石和元, 桑红灵, 谭爱华, 等. 山茱萸多糖对免疫抑制小鼠免疫功能的影响[J]. 现代免疫学,2022,42(6):482−488. [SHI H Y, SANG H L, TAN A H, et al. Regulation of polysaccharide of fructus corni on the immune function of immunosuppressive mice[J]. Current Immunology,2022,42(6):482−488. SHI H Y, SANG H L, TAN A H, et al. Regulation of polysaccharide of fructus corni on the immune function of immunosuppressive mice[J]. Current Immunology, 2022, 42(6): 482-488.
[31] LIU M M, ZENG P, LI X T, et al. Anti-tumor and immunomodulation activities of polysaccharide from Phellinus baumii[J]. International Journal of Biolog ical Macromolecules,2016,91:1199−1205.





 下载:
下载:

 下载:
下载:



