Structural Characteristics of Rice Bran Insoluble Dietary Fiber Bound Phenolic and Its Effect on Gut Microbiota
-
摘要: 米糠是谷物酚类物质的重要来源,其中多酚主要与膳食纤维结合,以结合态形式存在。本研究通过顺序酶法制备米糠不溶性膳食纤维结合酚(Insoluble Dietary Fiber-Bound Phenolic,IDF-BP),采用激光共聚焦显微镜、红外光谱、扫描电镜和X-射线衍射来表征IDF-BP结构变化,并对IDF-BP进行体外模拟胃肠消化和结肠发酵实验,随后对发酵物进行16S rRNA高通量测序的短链脂肪酸测定。结果表明,从米糠中制备得米糠IDF-BP得率为23.73%±0.008%,结合酚(Bound Phenolic,BP)含量为6.11±0.085 mg GAE/g DW,其中以阿魏酸含量最高为1.41±0.013 mg/g DW,其是典型的纤维素晶型,具有纤维素和半纤维素特征基团、酯键特征峰,以酯键形式与膳食纤维结合。肠道菌群多样性和菌群丰度结果显示,IDF-BP可通过降低肠道菌群多样性,下调肠道有害菌如拟杆菌属、考拉菌属,上调肠道有益菌如双歧杆菌属和艾克曼菌属,从而达到调节肠道菌群平衡的目的。同时也能促进短链脂肪酸(主要是乙酸、丙酸和丁酸)的产生以调节肠道pH。米糠IDF-BP兼具膳食纤维和多酚的特性,二者对肠道微生物和短链脂肪酸有较好的协同作用,有助于改善机体肠道环境,促进机体健康。
-
关键词:
- 米糠 /
- 不溶性膳食纤维结合酚 /
- 结构性质 /
- 结肠发酵 /
- 肠道菌群
Abstract: Rice bran is a major source of phenolic substances in cereals, in which phenolics mainly bound with dietary fiber in the form of conjugated state. In this study, rice bran insoluble dietary fiber-bound phenolic (IDF-BP) was prepared by sequential enzymatic method. The structure of IDF-BP was characterized by confocal laser scanning microscope (CLSM), Fourier transform infrared spectrometer (FT-IR), scanning electron microscope (SEM) and X-ray diffraction. The IDF-BP was subjected to simulated gastrointestinal digestion and colon fermentation in vitro, followed by 16S rRNA high-throughput sequencing of short-chain fatty acids. The results showed that the yield of rice bran IDF-BP was 23.73%±0.008%, the content of BP was 6.11±0.085 mg GAE/g DW, and the content of ferulic acid was the highest (1.41±0.013 mg/g DW). The IDF-BP was a typical cellulose crystal form of cellulose, which had both cellulose and hemicellulose characteristic groups and ester bond characteristic peaks, indicating that bound phenolic were bound to dietary fiber in the form of ester bond. The results of intestinal flora diversity and flora abundance showed that IDF-BP could regulate the balance of intestinal flora by reducing the diversity of intestinal flora, down-regulating intestinal harmful bacteria such as Bacteroides and Phascolarctobacterium, and increase intestinal beneficial bacteria such as Bifidobacterium and Akkermansia to achieve the goal of regulating the balance of gut microbiota. Additionally, it also had the ability to boost the production of short chain fatty acids (mainly acetic acid, propionic acid and butyric acid) to adjust intestinal pH. Rice bran IDF-BP had both the characteristics of dietary fiber and phenolics, and the two had a good synergistic effect on intestinal flora and short chain fatty acids, which would indicate that rice bran IDF-BP has the potential to improve the intestinal environment, thus achieving health benefits. -
米糠(Rice bran,RB)是大米加工的主要副产品之一,主要由果皮、种皮、珠心层、糊粉层及少量胚芽组成[1]。米糠富含膳食纤维、蛋白质等多种营养成分,其中膳食纤维含量约占30%[1],以不溶性膳食纤维为主。研究发现米糠所含的酚类物质总量占稻米籽粒的50%,可见米糠是稻米酚类物质重要来源[2]。米糠中酚类物质以游离态和结合态两种形式存在,且以结合态为主,前者能够在常规的有机溶剂浸提过程中被提取出来,而后者通过酯键、醚键等共价键与细胞壁大分子成分如膳食纤维、蛋白质等共价结合,溶剂浸提过程中无法提取[3-4]。Zhang等[5]研究表明米糠中90%左右的酚类物质与膳食纤维结合。研究表明大多数的游离态酚在通过小肠的时候就会被破坏,导致其不能发挥应有的作用价值。这时膳食纤维能够对结合酚起载体和保护的作用[6],人体摄入与膳食纤维结合酚,结合态多酚无法通过口腔的咀嚼作用、胃部的酸性条件和消化酶的作用显著释放,而是随着大分子物质到达结肠,被结肠微生物发酵。在膳食纤维的保护下大部分结合在膳食纤维的酚类物质都能够达到小肠,这样结合酚就能够在到达肠道后再被释放出来发挥修复肠道,调节肠道菌群的作用,增强健康效益[6]。
酚类物质被机体吸收利用是其发挥生物活性的前提,结合态酚(Bound phenolic,BP)由于共价键的束缚,在上消化道中难以从食物基质中释放出来被人体吸收利用。研究发现,在粪便菌群酵解作用下,米糠中与膳食纤维共价结合的结合态酚类物质中约20%能够在微生物的作用下被释放出来。这些经粪便菌群酵解释放的酚类物质除了具有抗氧化、抑制α-葡萄糖苷酶活性等作用外,还能够增加粪便菌群中艾克曼菌属(Akkermansia)、普拉梭菌属(Faecalibacterium)等与糖代谢关系密切的益生菌含量[5]。肠道菌群和结合酚相互作用,肠道菌群能代谢多酚产生短链脂肪酸等有益代谢产物,同时,结合酚能够调节肠道微生物,改善肠道环境[7]。
由于米糠结合酚不易制备,当前对米糠膳食纤维或米糠游离酚的研究较多,对膳食纤维结合酚研究较少,本研究从米糠不溶性膳食纤维结合酚(Insoluble Dietary Fiber-Bound Phenolic,IDF-BP)出发,测定IDF-BP结构特性,鉴定结合酚的种类,采用体外模拟结肠发酵研究IDF-BP对肠道菌群和短链脂肪酸的影响,探索米糠IDF-BP对肠道健康的影响,为米糠IDF-BP改善人体肠道健康提供理论依据。
1. 材料与方法
1.1 材料与仪器
米糠 远望富硒品牌提供;耐高温α-淀粉酶、碱性蛋白酶、糖化酶、福林酚试剂、阿魏酸、对香豆酸、丁香酸(纯度99%) 上海阿拉丁试剂有限公司;猪α-淀粉酶、胃蛋白酶、胰酶 Sigma-aldrich有限公司;GAM培养基、氯化血红素、维生素K1 青岛海博生物科技有限公司;甲醇、乙腈 色谱纯,德国Meker公司;氯化钠、无水乙醇、乙酸乙酯等其他试剂 均为分析纯。
FW100高速万能粉碎机 天津泰斯特仪器有限公司;Coulter J6高速冷冻离心机 美国Beekman公司;RE212旋转蒸发仪 山东博科有限公司;数显恒温水浴锅 国华(常州)仪器制造有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝冻干设备股份有限公司;TENSOR27傅里叶红外光谱仪 德国Bruker公司;TM3000扫描电镜 日本株式会社日立那珂;TCS SP8激光共聚焦显微镜 德国Leica;GI54DP立式自动压力蒸汽灭菌器 致微(厦门)仪器有限公司;GNP9160型隔水式恒温培养箱 上海精宏实验设备有限公司;SpectraMax M2e多功能酶标仪 美国Molecular Devices公司;X’TRA型X射线衍射仪 瑞士ARL公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;1260液相色谱仪、6890气相色谱仪 安捷伦科技有限公司。
1.2 实验方法
1.2.1 米糠不溶性膳食纤维-多酚的制备
参考Dong等[8]的方法,用顺序酶法制备米糠不溶性膳食纤维结合酚(Insoluble Dietary Fiber-Bound Phenolic,IDF-BP)。准确称取60.0 g脱脂米糠,按1:10比例溶解,95 ℃水浴加热10 min;调整pH为6.0,加入0.3%耐高温α-淀粉酶(2100 U/g),95 ℃水浴加热20 min;调整pH为7.5,加入0.5%碱性蛋白酶(2.4 U/g),60 ℃水浴加热60 min;调整pH为4.5,加入0.2%糖化酶(100000 U/mL),60 ℃加热30 min。8000 r/min 4 ℃离心20 min,离心后的沉淀用乙醇和水反复洗涤,冷冻干燥得IDF-BP,保存于-20 ℃备用。按下列公式计算IDF-BP得率:
得率(%)=制备所得IDF−BP的质量(g)脱脂米糠的质量(g)×100 1.2.2 米糠结合酚的提取和鉴定
1.2.2.1 米糠结合酚的提取
准确称取1.0 g IDF-BP冻干粉末,加入20 mL 2 mol/L NaOH溶液在室温下避光水解4 h,充氮气保护。水解结束后用6 mol/L HCl调节pH为1.5,8000 r/min离心10 min,收集上清液,用乙酸乙酯萃取,有机相于45 ℃旋蒸至干,10 mL甲醇复溶,即得米糠结合酚(Bound Phenolic,BP)[8]。反复水洗沉淀残渣冻干得脱酚后不溶性膳食纤维(JIDF)。
1.2.2.2 结合酚总酚含量测定
米糠结合酚总酚含量的测定使用Folin-Ciocalten法[9],并稍作修改。将250 μL结合酚溶液与250 μL 10倍稀释的福林酚试剂混合均匀,室温下避光反应10 min,加入500 μL 7.5% Na2CO3溶液,避光反应30 min,在765 nm处测定吸光度。以没食子酸为标准品测定标准曲线(y=15.142x+0.0546,R2=0.999),结果用没食子酸当量表示,即mg GAE/g DW(Gallic acid equivalent,GAE)。
1.2.2.3 多酚种类的鉴定
参考徐灼辉[10]的方法,使用HPLC-DAD法测定结合酚的种类。待测米糠结合酚用甲醇稀释过0.45 μm滤膜并超声,测定参数设置如下:柱温为35 ℃,流速为1.0 mL/min,进样量为20 μL,流动相A(0.4%醋酸水溶液)和流动相B(乙腈),梯度洗脱程序:0~40 min,95%~75% A;40~45 min,75%~65% A;45~55 min,60%~50% A,在280 nm处收集数据。甲醇配制对香豆酸、丁香酸、阿魏酸等标准品溶液用于标准曲线测定,根据标准品的出峰时间和峰面积确定米糠结合酚种类并计算含量。
1.2.3 米糠IDF-BP和JIDF结构表征测定
1.2.3.1 激光共聚焦扫描显微镜观察
采用激光共聚焦显微镜(Confocal laser scanning microscope,CLSM)观察米糠IDF-BP和JIDF微观结构和酚类物质的分布变化,酚类化合物具有天然荧光,通过CLSM可以观察结合酚的分布情况。用刚果红溶液配制1 mg/mL样品溶液,避光染色60 min,在405 nm氩激光源下测定,发射波长为440~470 nm,在20倍物镜下观察,在明场和荧光场中分别收集同一视角和倍数下的图像,叠加明场和荧光场的图像观察结合酚的分布情况[11]。
1.2.3.2 傅里叶红外光谱(FT-IR)测定
取1 mg干燥样品(IDF-BP和JIDF)与溴化钾粉沫按1:100混合,研磨压片,扫描400~4000 cm−1的红外光谱,采集分辨率为4 cm−1,扫描次数64次[12]。
1.2.3.3 扫描电镜(SEM)测定微观结构
取脱酚前后的IDF-BP于导电胶上,固定喷金。用加速电压为5 kV的电子束对样品进行扫描拍摄,放大倍数为800倍[12]。
1.2.3.4 X-射线衍射(XRD)测定
将样品粉沫研磨至无颗粒感用于测定分析,使用波长为1.5406 Å的单色Cu靶,Kα射线,工作电压40 kV,电流40 mA,扫描范围4°≤2θ≤70°,扫描速率4 °/min,步长0.02°[13]。
1.2.4 体外模拟胃肠消化和结肠发酵
体外模拟胃肠消化:参考Minekus等[14]的方法,进行体外模拟胃肠消化,模拟口腔、胃、肠消化液配制见表1。准确称取1.0 g 样品(IDF-BP、JIDF)置于锥形瓶中,加入4 mL蒸馏水和3.5 mL模拟唾液消化液(Simulated Salivary Fluid,SSF),调节pH为7.0,加入0.5 mL α-淀粉酶溶液和25 μL 0.3 mol/L CaCl2溶液,加水补足10 mL,37 ℃水浴加热2 min。10 mL口腔消化产物加入7.5 mL模拟胃液消化液(Simulated Gastric Fluid,SGF),调节pH为3.0,加入1.6 mL胃蛋白酶溶液和5 μL 0.3 mol/L CaCl2溶液,加水补足20 mL,37 ℃避光震荡消化2 h。20 mL胃消化产物加入11 mL模拟肠液(Simulated Intestinal Fluid,SIF)和2.5 mL新鲜胆汁盐溶液,调节pH为7.0,加入7 mL胰酶溶液和40 μL 0.3 mol/L CaCl2溶液,37 ℃避光震荡消化2.5 h。
表 1 模拟胃肠消化液配制Table 1. Preparation of stock solutions of simulated digestion fluids试剂 SSF(pH7) SGF(pH3) SIF(pH7) KCl(mmol/L) 15.1 6.9 6.8 KH2PO4(mmol/L) 3.7 0.9 0.8 NaHCO3(mmol/L) 13.6 25 85 NaCl(mmol/L) − 47.2 38.4 MgCl2(H2O)(mmol/L) 0.15 0.1 0.33 (NH4)2CO3(mmol/L) 0.06 0.5 − 体外模拟结肠发酵:参照顿倩[15]的方法并进行适当调整。称取49.0 g GAM培养基溶解于1 L蒸馏水中,121 ℃高温灭菌15 min,冷却至50 ℃,加入1 mL无菌0.1%维生素K1和1 mL氯化血红素(5 mg/mL)溶液混合均匀备用。
收集三个健康成年人的粪便(半年内未服用抗生素且无肠道疾病),将采集的粪便混合,用10% PBS缓冲溶液稀释,均质后得到10%粪便浆液,用纱布过滤得到粪便菌悬液。采集的粪便在1 h内处理完毕。
结肠发酵体系共20 mL,其中9 mL培养基,9 mL样品,2 mL粪便菌悬液。设置IDF-BP组、JIDF组、阿魏酸(Ferulic acid,FA)组和空白组(Blank)于37 ℃下进行厌氧发酵,在发酵时间为0、6、12、24、30、48 h时分别取样,收集发酵液,并测定pH。发酵液离心分别收集沉淀和上清液,储存于−80 ℃备用。
1.2.5 微生物16S rRNA高通量测序
取空白组、IDF-BP组、JIDF组、FA组6个时间点的发酵物进行高通量测序。利用OMEGA试剂盒E.Z.N.A™ Mag-Bind Soil DNA Kit提取DNA,对16S rRNA的V3~V4区域进行扩增,利用Illumina平台进行高通量测序来研究空白组、IDF-BP组、JIDF组、FA组的肠道微生物多样性、群落组成及丰度差异等信息。
1.2.6 短链脂肪酸测定
取空白组、IDF-BP组、JIDF组、FA组不同发酵时间的发酵上清液测定短链脂肪酸(Short chain fatty acids,SCFAs)含量[16],取400 μL上清液中加入50%硫酸,充分混合均匀,置于4 ℃酸化1 h。酸化结束加入400 μL乙酸乙酯,混合均匀,4 ℃下充分萃取15 min。萃取结束后8000 r/min冷冻离心5 min,保留上层有机相过0.22 μm滤膜,−20 ℃保存待分析,在24 h内完成上机测定。用乙酸乙酯配制乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸混合标准品,并梯度稀释,滤膜过滤,用于标准曲线的测定。
使用气相色谱仪测定SCFAs,上样量为1 μL,分流比为1:10,设置进样口温度200 ℃,FID检测器温度为250 ℃。梯度升温条件为:初始温度105 ℃,保持3 min;以10 ℃/min的速率升温,加热至170 ℃,保留0.5 min;以70 ℃/min的速率升温,加热至240 ℃,保持2 min[16]。对照标准曲线计算各组不同发酵时间下发酵液中短链脂肪酸的含量变化。
1.3 数据处理
实验所得到的数据均以平均值±标准偏差表示,使用Origin 2022b对数据进行分析和作图。数据使用SPSS中的单因素方差进行分析,数据显著性利用Tukey test(P<0.05)检验。
2. 结果与分析
2.1 米糠IDF-BP中结合酚含量分析和种类鉴定
以米糠为原料,通过酶法制备不溶性膳食纤维结合酚(IDF-BP)得率为23.73%±0.008%,福林酚法测得总酚含量为6.11±0.085 mg GAE/g DW。
利用高效液相色谱测定IDF-BP中结合态酚类物质的组成,以标准品的保留时间确定米糠结合酚种类,结果图1所示,米糠结合酚主要有丁香酸、对香豆酸和阿魏酸,根据标准曲线(表2)计算其含量:丁香酸0.046±0.004 mg/g DW,对香豆酸0.97±0.004 mg/g DW,阿魏酸1.41±0.013 mg/g DW,表明米糠结合酚中阿魏酸含量最高,对香豆酸次之。这与Zhang等[5]研究结果相似,米糠膳食纤维结合酚总酚含量为742.16 mg GAE/100 g DW,其中阿魏酸含量为5124.22±37.63 μg/g,对香豆酸含量为1651.68±6.90 μg/g,分别占总酚含量的65.85%和20.86%,是米糠膳食纤维结合酚中最主要的两种酚酸。已有研究表明稻米中的酚酸主要有阿魏酸、香草酸、对香豆酸、芥子酸和咖啡酸等,且酚酸在水稻不同部位的分布不同,稻壳中酚酸含量最高,在米糠中阿魏酸含量最高[17]。
表 2 酚酸标准曲线Table 2. Standard curves of phenolic acid标准品名称 出峰时间(min) 标准曲线方程 丁香酸 18.509 y=64462x+46.473,R2=0.999 对香豆酸 24.051 y=67089x−45.209,R2=0.999 阿魏酸 27.437 y=16719x−120.76,R2=0.999 2.2 IDF-BP结构表征分析
2.2.1 IDF-BP中结合酚分布情况分析
CLSM观察米糠不溶性膳食纤维结合酚(IDF-BP)和脱酚后不可溶膳食纤维(JIDF)的结合酚分布情况如图2所示,图2为样品相同视野、相同放大倍数下,在明场和荧光场的叠加图。多酚具有自发荧光的特性,尤其是阿魏酸,能在405 nm激发波长下显示明亮的绿色[18]。
如图2a所示,绿色亮点区域即为阿魏酸的在激光照射下产生的自发荧光,绿色荧光在IDF-BP中分布广泛且明亮,这表明酚类物质与米糠不溶性膳食纤维相结合且阿魏酸是最主要的结合酚。由图2b可知,绿色荧光范围缩小,荧光强度降低,这也表明结合酚在碱解过程中被释放导致自发荧光降低[5]。
2.2.2 IDF-BP的红外光谱分析
米糠IDF-BP碱解脱酚前后红外光谱如图3所示。由图3可知,IDF-BP和JIDF的红外谱图相似,峰形无明显变化,这表明JIDF与IDF-BP结构相似,没有大规模的官能团变化。这与徐灼辉[10]、刘帅[19]的研究结果一致,碱水解胡萝卜膳食纤维和荔枝干果肉膳食纤维能释放结合酚,但膳食纤维没有大规模的官能团变化。纤维素和半纤维素分子中羟基基团含量较高,3410 cm−1左右出现的宽峰是O-H的伸缩振动,也是碳水化合物的特征吸收峰[10]。2922.01、2852.39 cm−1处为碳水化合物亚甲基上C-H的伸缩振动,1200~1400 cm−1不太尖的宽吸收峰是C-H的变角振动所致,这些区域的吸收峰都为糖类的特征吸收峰[20]。1160.42 cm−1是半纤维素和纤维素C-O-C基团的特征峰,1060.64 cm−1处的吸收峰是由糖环中C-O-C的C-O伸缩振动所引起的[21]。而1736.49 cm−1处吸收峰在脱酚后消失了,这是由酯基中C=O伸缩振动引起的,该峰的消失表明酚类物质与膳食纤维之间的酯键遭到破坏;1246.92 cm−1处的峰是苯环中C-O的特征峰,碱解处理后该峰消失,这意味着碱处理改变IDF-BP结构,使得结合酚水解释放[19]。综上,碱法处理IDF-BP能较好地保持膳食纤维官能团的完整性,同时也能破坏BP和IDF间的官能团如酯键,释放结合酚。
2.2.3 IDF-BP的微观结构特征
米糠IDF-BP和JIDF微观结构如图4所示。米糠IDF-BP呈片状结构,表面纤维条理清晰,整体结构完整,JIDF仍呈片状结构,结构保持完整,纤维条理依旧存在。而在相同放大倍数下JIDF结构更加松散,表面空洞增加,这说明与IDF-BP表面结合酚被水解释放。对比IDF-BP和JIDF可以发现IDF-BP结构在碱处理前后未发生剧烈变化,JIDF表面多空洞,这表明BP有助于维持IDF-BP结构稳定[10]。
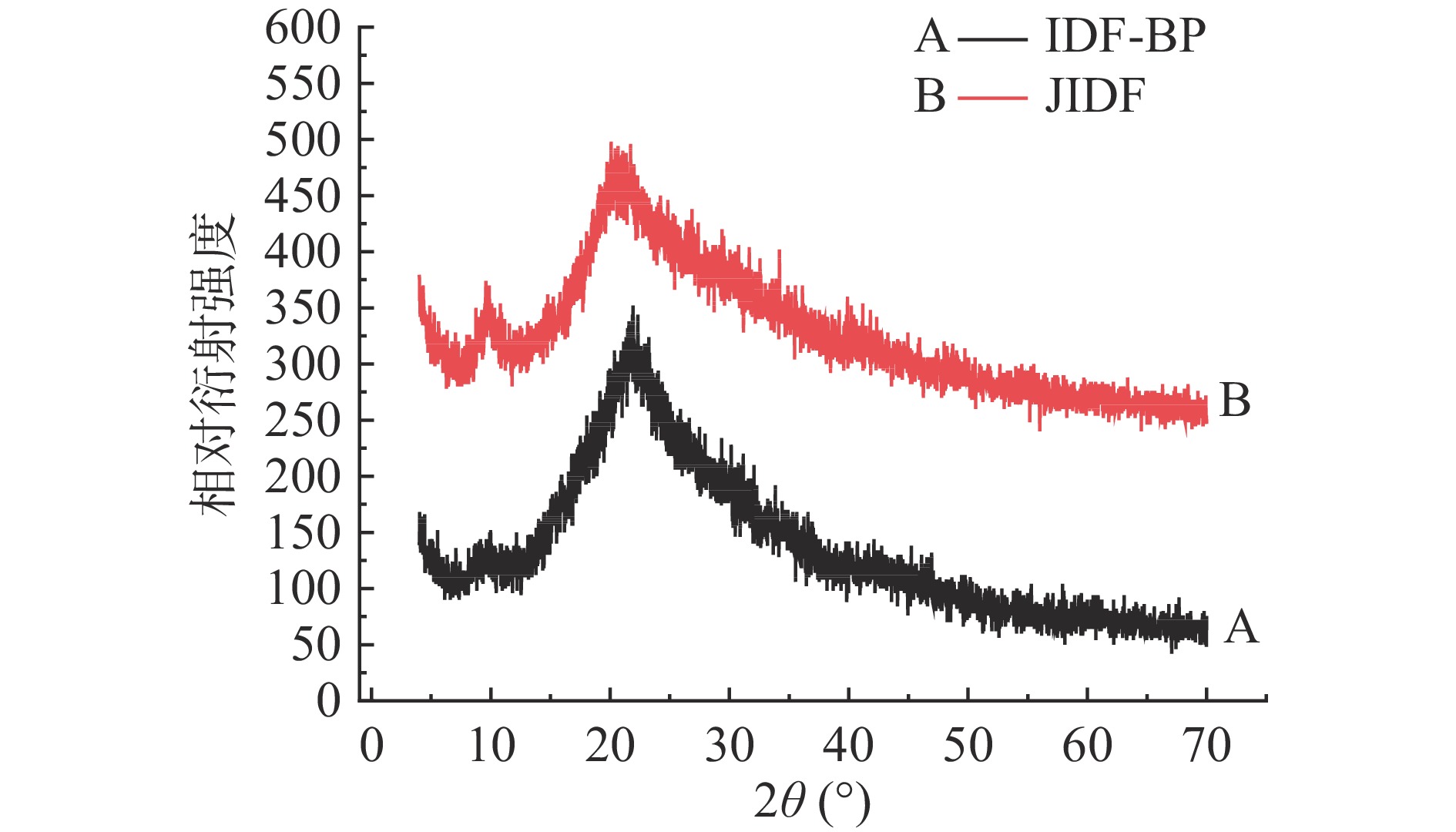
2.2.4 IDF-BP的X射线衍射分析
植物膳食纤维中由于纤维素的存在,通常含有大部分晶体区域,但由于非晶体纤维素、半纤维素和木质素等其他物质的存在,也含有无定形区域,即结晶区与无定形区共存是纤维素晶型的特征[22]。脱酚前后IDF-BP晶型变化如图5所示,从图5中可以发现IDF-BP在9.935°处有弱衍射峰,在19.871°处有强衍射峰;JIDF在9.643°处有弱衍射峰,在20.052°有强衍射峰,这表明IDF-BP和JIDF的晶体结构没有明显变化均具有膳食纤维I型的曲线特征[23]。IDF-BP结晶度为15.62%,脱酚后JDF结晶度增加为24.39%,表明IDF-BP表面结构发生改变,可能是释放了部分结合酚,导致纤维素结晶区暴露。
由IDF-BP和JIDF的CLSM图、红外光谱图、微观结构图和X-射线衍射图可知碱处理能释放IDF-BP中大部分结合酚,同时保持IDF结构基本不变。这与Huang等[24]研究结果相似,茶渣中的膳食纤维-结合酚经碱处理后释放多酚但仍保持膳食纤维基本结构不变。
2.3 IDF-BP对肠道菌群影响
2.3.1 IDF-BP肠道微生物多样性
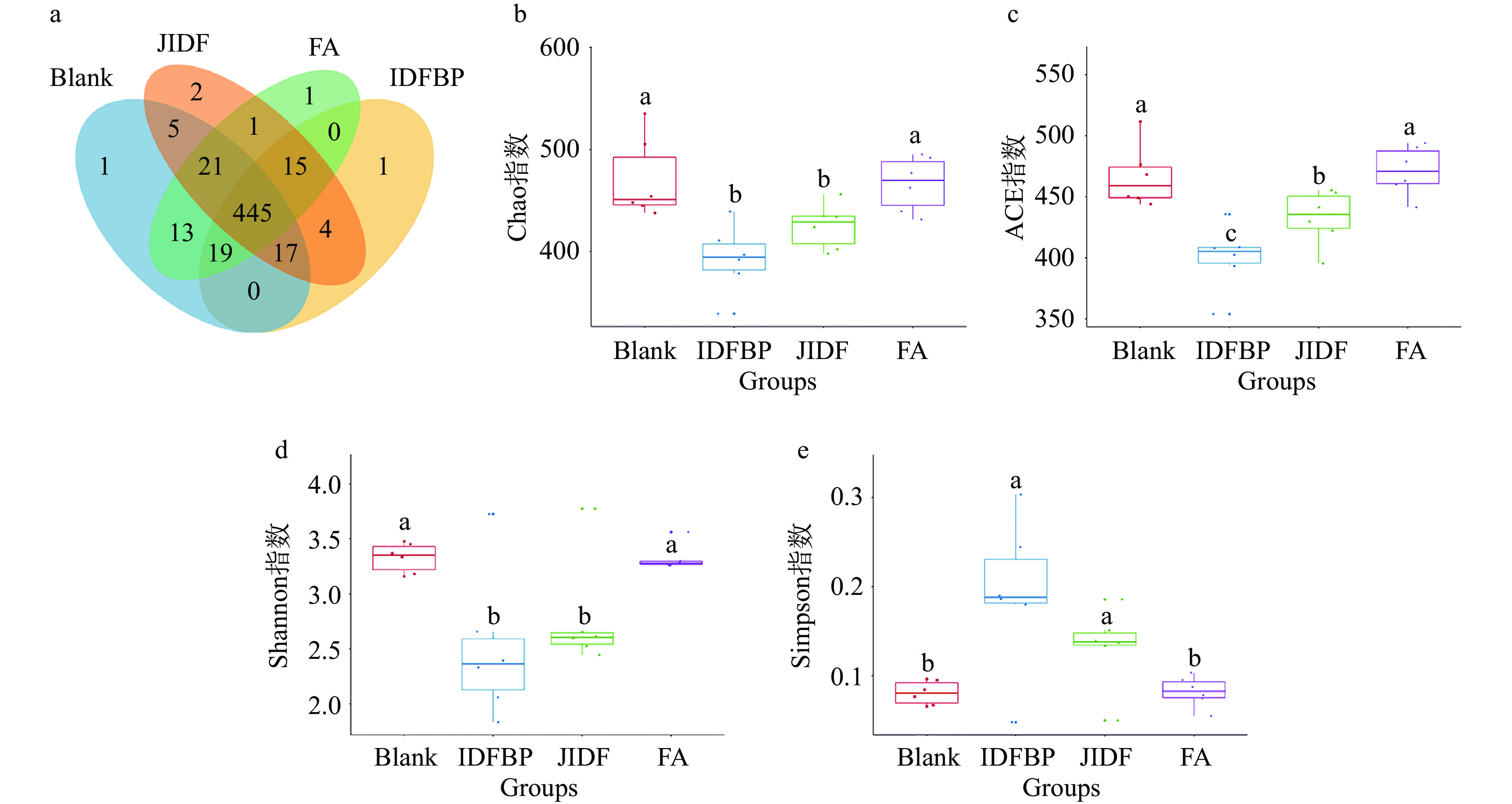
韦恩图能够展示不同组之间共有和特有的OTU,如图6a所示,图中不同色的圈代表不同的组,重叠部分中的数字代表组间共有OTU的个数,未重叠部分中的数字代表该组的特有OTU个数。图6a表明,四组样本共含有545个OTU,其中空白组含有524个OTU, 独有1个OTU;JIDF组含有510个OTU,独有2个OTU;FA组含有515个OTU独有1个OTU;IDF-BP组含有501个OTU,独有1个OTU,即IDF-BP组<JIDF组<FA组<空白组,其中IDF-BP组OTU个数最少。说明摄入膳食纤维和酚酸均能降低肠道菌群多样性,但二者协同作用能更有效降低肠道菌群的多样性。研究表明米糠膳食纤维多酚对肠道微生物的调节作用优于单一多酚,膳食纤维多酚能够降低肠道微生物丰度和多样性[25]。
肠道微生物多样性可通过4个指数即Ace指数、Chao指数、Shannon指数和Simpson指数来进行表征,以此来反映微生物群落的丰度和多样性。IDF-BP、JIDF、FA和空白组的α-多样性指数变化如图6b~图6e所示,由图6b~图6c可以看出,与空白组相比,样品组IDF-BP、JIDF的Chao和ACE指数显著降低(P<0.05),且IDF-BP组的ACE指数比JIDF小,这表明样品的添加抑制了肠道微生物的生长,使菌落丰度降低。Shannon和Simpson指数可以表征微生物群落多样性的变化,其中Shannon指数与群落多样性变化呈正相关,Simpson指数则相反。由图6d~图6e可知,IDF-BP、JIDF组的Shannon指数显著低于空白组(P<0.05),Simpson指数显著大于空白组(P<0.05),且IDF-BP组Simpson指数最大,这表明IDF-BP和JIDF的添加都使肠道菌群的多样性降低,而膳食纤维和结合酚协同作用对微生物多样性的影响最大。
2.3.2 不同分类水平的肠道优势菌群分布
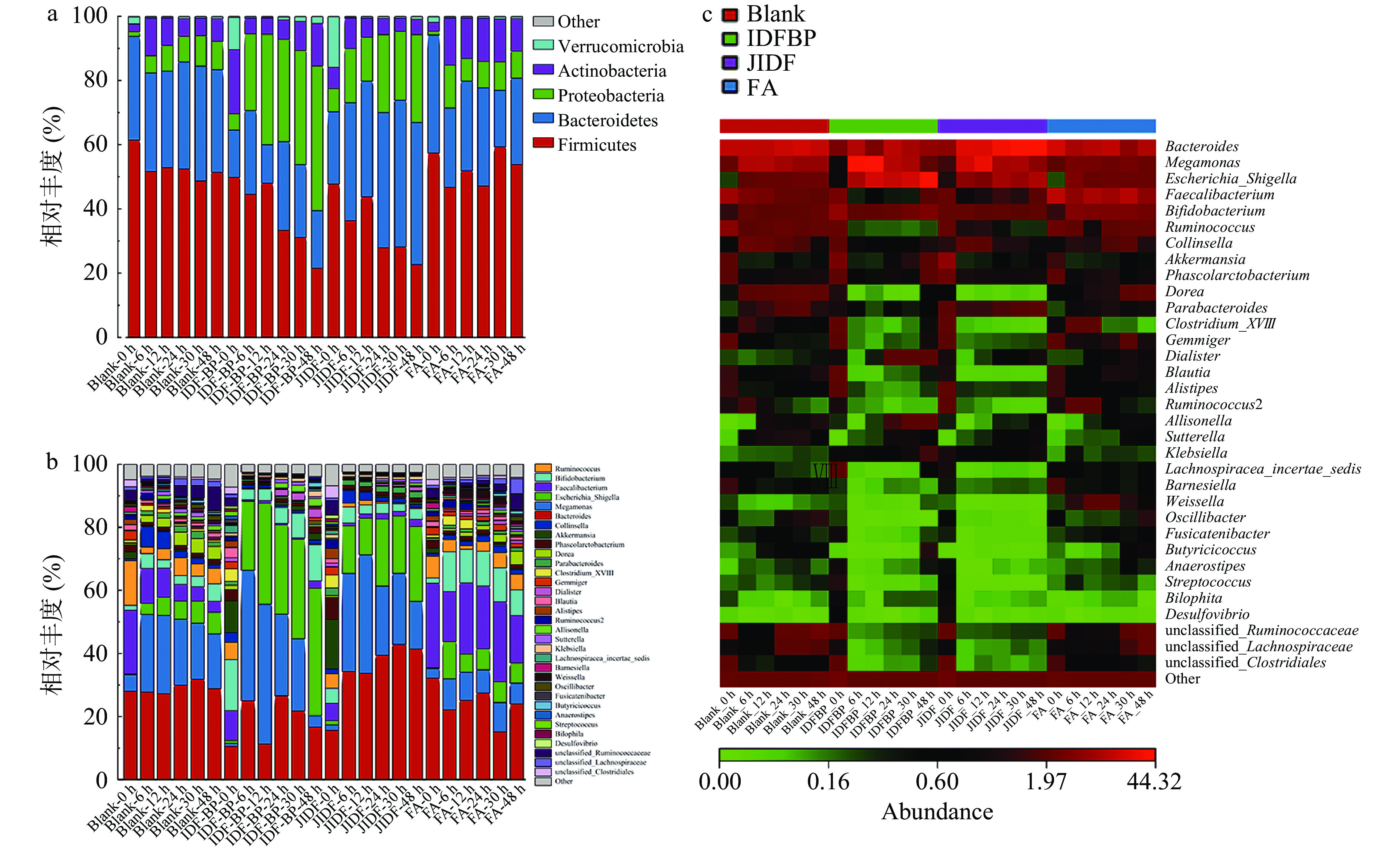
图7展示了不同分类学水平上肠道菌群优势物种的相对丰度变化,由图7a可知,在门水平上,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)是肠道菌群的优势菌群。其中厚壁菌门和拟杆菌门是最主要的两个优势菌门[26]。拟杆菌门的共同门类以多酚的摄取和代谢为主,因此这可能是多酚起作用的原因[27]。研究表明多酚及其代谢产物能抑制厚壁菌门的生长[28],Aura等[29]的研究表明多酚的摄入能够抑制拟杆菌的生长,从而降低患结肠癌的风险。厚壁菌门的相对丰度随着发酵的进行逐渐降低,IDF-BP组<JIDF组<FA组<Blank组;拟菌杆门的相对丰度先降低后升高,发酵结束后IDF-BP组最低,这表明米糠不溶性膳食纤维和多酚协同作用能够有效抑制厚壁菌门和拟杆菌门的生长。厚壁菌门和拟杆菌门的比值(F/B)反映了机体肠道的健康状态,与机体肠道炎症水平和体重正相关[30]。IDF-BP组F/B值最低,表明米糠不溶性膳食纤维多酚的协同作用优于单个多酚和膳食纤维,能够调节宿主健康。
从图7b可以发现,在属水平上,拟杆菌属(Bacteroides)、巨单孢菌属(Megamonas)、大肠杆菌(Escherichia)、普拉梭菌(Faecalibacterium)、双歧杆菌属(Bifidobacterium)、瘤胃球菌属(Ruminococcus)是肠道菌群的优势菌属。巨单孢菌属和小杆菌属是促进短链脂肪酸产生的有益菌,巨单孢菌属能够促进乙酸、丙酸和丁酸的分泌对宿主健康产生有益影响,小杆菌属具有刺激产生丙酸盐的能力,这两种菌属的增加有利于发酵过程中短链脂肪酸的生成[31]。双歧杆菌属具有抗发炎等作用而被认为是有益菌的,双歧杆菌属丰度明显增加表明结合酚的摄入能够促进双歧杆菌的生长,改善肠道环境[32];艾克曼菌属(Akkermansia)是抗癌细菌,在增加癌症免疫治疗效果上有非常显著的作用,其丰度与几种疾病状态呈负相关,如炎症性肠病、急性阑尾炎等[33]。图7c通过热力条颜色的变化清晰地展示了不同菌群的相对丰度的变化,菌群丰度从低(绿色)到高(红色)逐渐递增。结合图8b~图8c发现发酵过程中IDF-BP促进了肠道有益菌的生长,如巨单孢菌属、双歧杆菌属、艾克曼菌属、小杆菌属(Dialister)丰度增加。结肠发酵过程中IDF-BP组巨单孢菌属、双歧杆菌属和艾克曼菌属相对丰度比JIDF组高,表明米糠不可溶膳食纤维和多酚及其代谢物能够上调部分有益微生物的生长,且对微生物的协同调节作用优于单一膳食纤维[34]。此外,IDF-BP组拟杆菌属、普拉梭菌属、考拉菌属(Phascolarctobacterium)和多拉菌属(Dorea)的相对丰度在发酵过程中降低,低于JIDF组,这表明膳食纤维和结合酚能抑制部分有害菌的生长,且二者协同作用比单一膳食纤维更优。米糠中不溶性膳食纤维和结合酚能上调部分肠道有益菌的生长,同时下调肠道有害菌的生长,且膳食纤维和多酚对微生物的协同调节作用优于单一多酚和膳食纤维[34]。
2.4 结肠发酵液的pH变化分析
发酵体系的pH是动态变化,如表3所示,发酵开始6 h后体系的pH显著下降(P<0.05),呈酸性;随着发酵时间的延长,pH略有上升并趋于稳定,整体表现为酸性。pH的变化与发酵过程中产生的短链脂肪酸密切相关[35],发酵初期IDF-BP、JIDF和FA等样品含量丰富,肠道菌群利用营养基质快速生长,发酵过程中产生的SCFAs是导致pH快速降低的原因,后期脂肪酸含量趋于稳定则pH也保持稳定。pH会反向影响肠道微生物的生长情况,当肠道环境偏酸性(pH<5.0)时,拟杆菌的生长就会受到抑制[31],这也是拟杆菌门丰度在发酵前期降低的原因。
表 3 结肠发酵过程中pH变化Table 3. pH value during the fermentation样品 0 h 6 h 12 h 24 h 30 h 48 h Blank 6.85±0.035Ba 5.13±0.005Ae 5.47±0.007Ad 5.79±0.042Ac 5.86±0.014Ab 5.92±0.035Ab IDF-BP 6.90±0.042Ba 4.70±0.071Be 4.82±0.042Bd 4.86±0.035Cd 5.08±0.049Cc 5.47±0.014Cb JIDF 7.02±0.042Aa 4.70±0.021Bc 4.70±0.021Cc 4.75±0.035Dc 4.76±0.035Dc 4.85±0.028Db FA 6.45±0.014Ca 4.76±0.071Be 4.76±0.071BCe 5.34±0.0141Bd 5.56±0.021Bc 5.79±0.028Bb 注:不同小写字母表示组内差异显著(P<0.05),不同大写字母表示组间差异显著(P<0.05)。 2.5 结肠发酵液中短链脂肪酸的变化
短链脂肪酸(Short chain fatty acids,SCFAs)是结肠菌群发酵的主要代谢产物,能为结肠黏膜提供主要能量,维护肠上皮细胞完整性。未被上消化道吸收的膳食纤维及多酚,可以在结肠中被肠道微生物群发酵,得到终产物SCFAs,包括乙酸、丙酸、丁酸、戊酸和异戊酸等,其中以乙酸、丙酸、丁酸为主,通常乙酸是肠道中含量最高的SCFAs[36]。
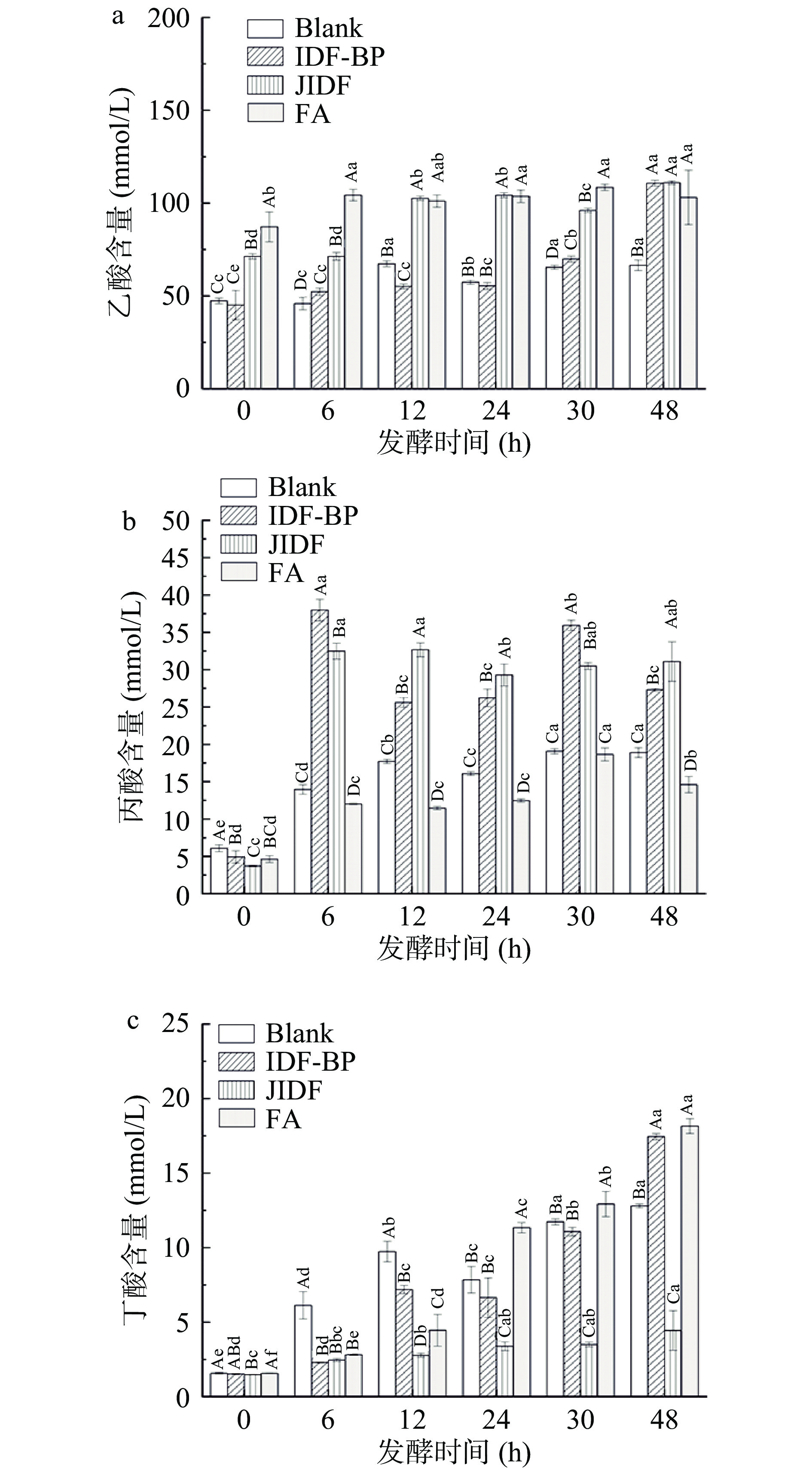
IDF-BP、JIDF、FA组发酵后乙酸、丙酸、丁酸含量变化如图8所示。随着发酵的进行,SCFAs总含量显著增加(P<0.05),尤其是乙酸的含量要高于丙酸和丁酸。乙酸含量在发酵6 h时升高,后逐渐保持不变,发酵48 h后样品组乙酸含量均显著高于空白组(P<0.05),这与pH变化趋势一致,表明乙酸是导致pH变化的主要原因。研究表明乙酸是有效抑制肠道病原体的重要介质[31],发酵过程中乙酸的产生表明膳食纤维和多酚能够调节肠道健康。IDF-BP组的丙酸和丁酸含量增加,丙酸、丁酸有助于维持结肠细胞的必要功能,如细胞分裂和分化[37];且丁酸有助于调节肠道炎症,能够和发酵过程中释放的多酚协同作用发挥抗炎作用[36]。
肠道菌群变化与乙酸、丙酸、丁酸的含量密切相关,拟杆菌门作为优势菌门能够促进乙酸的产生,巨单孢菌属和小杆菌属的增加也能促进SCFAs含量的增加。而SCFAs能为厌氧菌提供能量,促进肠道有益菌生长,还可以降低肠道环境pH,抑制有害菌的生长,调节肠道微生物平衡,从而改善肠道紊乱[38]。总之,IDF-BP、JIDF、FA均有助于改善肠道代谢环境,且以膳食纤维和多酚的协同作用更优。
3. 结论
米糠中酚类物质多以结合酚形式存在,与不溶性膳食纤维结合。本研究结果表明米糠结合酚主要有丁香酸、对香豆酸和阿魏酸,其中阿魏酸含量最高,对香豆酸次之。借助红外光谱、扫描电镜、X-射线衍射等方法发现IDF-BP既有典型的纤维结构,如具有半纤维素和纤维素C-O-C基团,也有苯环特征峰和酯键特征峰。米糠不溶性膳食纤维和结合酚协同作用能更有效地调节肠道菌群,且优于单独多酚和单独膳食纤维作用。IDF-BP能够促进肠道有益菌的生长如双歧杆菌属和艾克曼菌属,抑制有害菌的生长如拟杆菌属和考拉菌属,从而改善肠道环境,维持肠道健康。此外,IDF-BP能够促进SCFAs如乙酸、丙酸、丁酸的产生来调节肠道环境,而短链脂肪酸又能反过来促进肠道微生物生长,二者相互影响。这表明米糠中不溶性膳食纤维和结合酚协同作用能从多方面调节肠道菌群,改善宿主肠道健康。本研究为米糠促进机体健康提供科学依据,也为开发米糠功能食品提供了新方向。
-
表 1 模拟胃肠消化液配制
Table 1 Preparation of stock solutions of simulated digestion fluids
试剂 SSF(pH7) SGF(pH3) SIF(pH7) KCl(mmol/L) 15.1 6.9 6.8 KH2PO4(mmol/L) 3.7 0.9 0.8 NaHCO3(mmol/L) 13.6 25 85 NaCl(mmol/L) − 47.2 38.4 MgCl2(H2O)(mmol/L) 0.15 0.1 0.33 (NH4)2CO3(mmol/L) 0.06 0.5 − 表 2 酚酸标准曲线
Table 2 Standard curves of phenolic acid
标准品名称 出峰时间(min) 标准曲线方程 丁香酸 18.509 y=64462x+46.473,R2=0.999 对香豆酸 24.051 y=67089x−45.209,R2=0.999 阿魏酸 27.437 y=16719x−120.76,R2=0.999 表 3 结肠发酵过程中pH变化
Table 3 pH value during the fermentation
样品 0 h 6 h 12 h 24 h 30 h 48 h Blank 6.85±0.035Ba 5.13±0.005Ae 5.47±0.007Ad 5.79±0.042Ac 5.86±0.014Ab 5.92±0.035Ab IDF-BP 6.90±0.042Ba 4.70±0.071Be 4.82±0.042Bd 4.86±0.035Cd 5.08±0.049Cc 5.47±0.014Cb JIDF 7.02±0.042Aa 4.70±0.021Bc 4.70±0.021Cc 4.75±0.035Dc 4.76±0.035Dc 4.85±0.028Db FA 6.45±0.014Ca 4.76±0.071Be 4.76±0.071BCe 5.34±0.0141Bd 5.56±0.021Bc 5.79±0.028Bb 注:不同小写字母表示组内差异显著(P<0.05),不同大写字母表示组间差异显著(P<0.05)。 -
[1] 陈甜妹. 米糠固态发酵工艺优化及其对米糠营养功能特性的影响[D]. 佛山: 佛山科学技术学院, 2020 CHEN T M. Technology optimization for rice bran solid state fermentation and its effects on the nutritional and functional properties of rice bran[D]. Foshan: Foshan University, 2020.
[2] BUTSAT S, SIRIAMORNPUN S. Antioxidant capacities and phenolic compounds of the husk, bran and endosperm of Thai rice[J]. Food Chemistry,2010,119(2):606−613. doi: 10.1016/j.foodchem.2009.07.001
[3] DE MIRA N V M, MASSARETTO I L, PASCUAL C S C I, et al. Comparative study of phenolic compounds in different Brazilian rice (Oryza sativa L.) genotypes[J]. Journal of Food Composition and Analysis,2009,22(5):405−409. doi: 10.1016/j.jfca.2008.06.012
[4] ACOSTA-ESTRADA B A, GUTIÉRREZ-URIBE J A, SERNA-SALDÍVAR S O. Bound phenolics in foods, a review[J]. Food Chemistry,2014,152:46−55. doi: 10.1016/j.foodchem.2013.11.093
[5] ZHANG X, ZHANG M, DONG L, et al. Phytochemical profile, bioactivity, and prebiotic potential of bound phenolics released from rice bran dietary fiber during in vitro gastrointestinal digestion and colonic fermentation[J]. Journal of Agricultural and Food Chemistry,2019,67(46):12796−12805. doi: 10.1021/acs.jafc.9b06477
[6] PALAFOX-CARLOS H, AYALA-ZAVALA J F, GONZÁLEZ-AGUILAR G A. The role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants[J]. Journal of Food Science,2011,76(1):R6−R15. doi: 10.1111/j.1750-3841.2010.01957.x
[7] 武锦春. 正常人肠道菌群对酸枣仁总黄酮的体外代谢研究[D]. 太原: 山西大学, 2021 WU J C. Study on the in vitro metabolism of total flavonoids in Ziziphi Spinosae Semen by normal human intestinal flora[D]. Taiyuan: Shanxi University, 2021.
[8] DONG R, YU Q, LIAO W, et al. Composition of bound polyphenols from carrot dietary fiber and its in vivo and in vitro antioxidant activity[J]. Food Chemistry,2021,339:127879. doi: 10.1016/j.foodchem.2020.127879
[9] 李文婷. 六种豆类中不同结合态多酚组成、胃肠道生物可接受率及其抗氧化活性研究[D]. 南昌: 南昌大学, 2018 LI W T. The composition of free, conjugated and bound phenolics in six legumes, and their bioacessibility of gastrointestinal tract and antioxidant activity[D]. Nanchang: Nanchang University, 2018.
[10] 徐灼辉. 荔枝干果肉膳食纤维—结合酚加合物结构表征及其润肠通便作用机制[D]. 广州: 广州大学, 2020 XU Z H. Structural characterization of dietary fiber-bound phenolic adducts in dried lychee pulp and its mechanism of moistening intestine and laxative effect[D]. Guangzhou: Guangzhou University, 2020.
[11] LI Y, LI M, WANG L, et al. Effect of particle size on the release behavior and functional properties of wheat bran phenolic compounds during in vitro gastrointestinal digestion[J]. Food Chemistry,2022,367:130751. doi: 10.1016/j.foodchem.2021.130751
[12] 任明非. 米糠不溶性膳食纤维与Cd2+结合特性的研究[D]. 无锡: 江南大学, 2020 REN M F. Study on the binding characteristics of rice bran insoluble dietary fiber with Cd2+[D]. Wuxi: Jiangnan University, 2020.
[13] 王洪欣. 铜藻膳食纤维的提取、性质及可食用膜的制备[D]. 杭州: 浙江工商大学, 2020 WANG H X. Extraction, properties and preparation of edible film of dietary fiber from Sargassum horneri[D]. Hangzhou: Zhejiang Gongshang University, 2020.
[14] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food-an international consensus[J]. Food & Function,2014,5(6):1113−1124.
[15] 顿倩. 黑豆膳食纤维结合的多酚构成和微生物代谢规律的研究[D]. 南昌: 南昌大学, 2019 DUN Q. Study on composition and microbial metabolism of bound phenolics binding to dietary fiber of black bean[D]. Nanchang: Nanchang University, 2019.
[16] 程玉鑫. 干酪乳杆菌发酵蓝莓果渣对高脂膳食小鼠肠道屏障功能的调节作用及机制[D]. 武汉: 华中农业大学, 2020 CHENG Y X. Lactobacillus casei fermented blueberry pomace regulates the intestinal barrier function of high fat diet mice and the underlying mechanisms[D]. Wuhan: Huazhong Agricultural University, 2020.
[17] 赵珊, 仲伶俐, 周虹, 等. 超高效液相色谱-串联质谱法鉴定和分析稻米中酚酸类化合物的组成及分布[J]. 中国农业科学,2020,53(3):612−631. [ZHAO S, ZHONG L L, ZHOU H, et al. Identification and analysis of phenolic acids in rice using ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Scientia Agricultura Sinica,2020,53(3):612−631. [18] XU Z, XIONG X, ZENG Q, et al. Alterations in structural and functional properties of insoluble dietary fibers-bound phenolic complexes derived from lychee pulp by alkaline hydrolysis treatment[J]. LWT,2020,127:109335. doi: 10.1016/j.lwt.2020.109335
[19] 刘帅. 基于微生物发酵研究胡萝卜膳食纤维与结合多酚之间酵解特性的相互影响[D]. 南昌: 南昌大学, 2020 LIU S. Study on the interaction between carrot dietary fibers and bound polyphenols based on microbial fermentation[D]. Nanchang: Nanchang University, 2020.
[20] 黄冬云. 米糠膳食纤维的酶法改性及功能性质研究[D]. 无锡: 江南大学, 2014 HUANG D Y. Enzymatic modification and functional properties of rice bran dietary fiber[D]. Wuxi: Jiangnan University, 2014.
[21] 郭天时. 米糖膳食纤维的微粉—酶法改性及其理化功能性质的变化研究[D]. 哈尔滨: 哈尔滨商业大学, 2017 GUO T S. Micronized-enzymatic modification of rice bran dietary fiber and changes of its physicochemical and functional properties[D]. Harbin: Harbin University of Commerce, 2017.
[22] 祁静. 高吸附性米糠纤维的制备及其吸附特性的研究[D]. 无锡: 江南大学, 2016 QI J. The research on the preparation and adsorption properties of rice bran fiber with high adsorption capacities[D]. Wuxi: Jiangnan University, 2016.
[23] 曹龙奎, 康丽君, 寇芳, 等. 改性前后小米糠膳食纤维结构分析及体外抑制α-葡萄糖苷酶活性[J]. 食品科学,2018,39(11):46−52. [CAO L K, KANG L J, KOU F, et al. Structural analysis and in vitro inhibitory effect on α-glucosidase activity of millet bran dietary fiber before and after modification[J]. Food Science,2018,39(11):46−52. doi: 10.7506/spkx1002-6630-201811008 [24] HUANG H, CHEN J, HU X, et al. Elucidation of the interaction effect between dietary fiber and bound polyphenol components on the anti-hyperglycemic activity of tea residue dietary fiber[J]. Food & Function,2022,13(5):2710−2728.
[25] 刘倩, 范誉川, 刘素诗, 等. 米糠粕不溶性膳食纤维理化性质及对高脂大鼠肠道菌群的影响[J]. 食品科学,2021,42(15):174−179. [LIU Q, FAN Y C, LIU S S, et al. Physicochemical properties of insoluble dietary fiber from defatted rice bran and its effect on intestinal microbiota of high-fat diet fed rats[J]. Food Science,2021,42(15):174−179. doi: 10.7506/spkx1002-6630-20200730-395 [26] LIU S, YU Q, HUANG H, et al. The effect of bound polyphenols on the fermentation and antioxidant properties of carrot dietary fiber in vivo and in vitro[J]. Food & Function,2020,11(1):748−758.
[27] 董瑞红. 胡萝卜膳食纤维中结合多酚的体外消化酵解规律和营养功能特性及其在酸奶中的应用[D]. 南昌: 南昌大学, 2021 DONG R H. The release and nutritional functional properties of bound polyphenols from carrot dietary fiber during in vitro digestion and colonic fermentation and its application in yogurt[D]. Nanchang: Nanchang University, 2021.
[28] RASTMANESH R. High polyphenol, low probiotic diet for weight loss because of intestinal microbiota interaction[J]. Chemico-Biological Interactions,2011,189(1−2):1−8. doi: 10.1016/j.cbi.2010.10.002
[29] AURA A M. Microbial metabolism of dietary phenolic compounds in the colon[J]. Phytochemistry Reviews,2008,7(3):407−429. doi: 10.1007/s11101-008-9095-3
[30] 韩飞, 韩阳阳, 赵建新, 等. 4种杂粮对大鼠肠道菌群组成及短链脂肪酸的影响[J]. 食品科学,2022,43(13):101−108. [HAN F, HANY Y, ZHAO J X, et al. Effects of four cereals on composition of gut microbiota and short-chain fatty acids in rats[J]. Food Science,2022,43(13):101−108. doi: 10.7506/spkx1002-6630-20210430-422 [31] 张文易. 绣球菌多糖结构表征及其对阿尔茨海默症小鼠的干预作用[D]. 无锡: 江南大学, 2022 ZHANG W Y. Structural characterization and the intervention of Sparassis crispa polysaccharides on the Alzheimer's disease mice[D]. Wuxi: Jiangnan University, 2022.
[32] DONG R, LIU S, XIE J, et al. The recovery, catabolism and potential bioactivity of polyphenols from carrot subjected to in vitro simulated digestion and colonic fermentation[J]. Food Research International,2021,143:110263. doi: 10.1016/j.foodres.2021.110263
[33] 谢甜, 孙琳, 范伟, 等. 番石榴结合态多酚对小鼠肠道菌群结构及多样性的影响研究[J]. 核农学报,2021,35(11):2589−2597. [XIE T, SUN L, FAN W, et al. Effects of bound polyphenols in psidium guajava on mice intestinal flora structure and diversity[J]. Journal of Nuclear Agriclutural Sciences,2021,35(11):2589−2597. doi: 10.11869/j.issn.100-8551.2021.11.2589 [34] 单琴. 油茶籽粕多糖的降血脂功效及其对肠道菌群的影响[D]. 合肥: 合肥工业大学, 2021 SHAN Q. The hypolipidemic effect of Camellia seed meal polysaccharide and its influence on intestinal flora[D]. Hefei: Hefei University of Technology, 2021.
[35] 罗珍. 核桃壳多糖的分离鉴定及消化代谢特性研究[D]. 秦皇岛: 燕山大学, 2021 LUO Z. Isolation and identification of poly saccharide from juglans regial and its digestion and metabolism characteristics[D]. Qinhuangdao: Yanshan University, 2021.
[36] ZHENG S, ZHANG H, LIU R, et al. Do short chain fatty acids and phenolic metabolites of the gut have synergistic anti-inflammatory effects?–New insights from a TNF-α-induced Caco-2 cell model[J]. Food Research International,2021,139:109833. doi: 10.1016/j.foodres.2020.109833
[37] 张瑞麟. 英国红芸豆多糖提取、结构鉴定及对T2DM小鼠改善作用研究[D]. 大庆: 黑龙江八一农垦大学, 2022 ZHANG R L. Study on extraction, structure identification and improvement effect of British red kidney bean polysaccharides on T2DM mice[D]. Daqing: Heilongjiang Bayi Agricultural University, 2022.
[38] 鲁朝凤, 黄佳琦, 黄勇桦, 等. 青稞膳食纤维和多酚对肠道微生物的协同调节作用[J]. 食品与发酵工业,2021,47(8):6−13. [LU C F, HUANG J Q, HUANG Y H, et al. Synergetic regulation of gut microbiota by dietary fiber and phenolic compounds in hulless barley[J]. Food and Fermentation Industries,2021,47(8):6−13. -
期刊类型引用(4)
1. 任菲菲,张静,张艳红,郑艳青. UPLC-MS/MS测定僵蚕中多种兽药残留. 食品与药品. 2025(01): 46-51 .  百度学术
百度学术
2. 孙梅梅,吴银良. 固相萃取-液相色谱-串联质谱法快速测定猪肉中27种兽药及代谢物残留量. 食品安全质量检测学报. 2024(17): 30-38 .  百度学术
百度学术
3. 管益涛,陈明华,谷翠梅,马淑青. QuEChERS结合GC-MS/MS检测果蔬中13种农药残留. 食品安全导刊. 2024(27): 63-67 .  百度学术
百度学术
4. 罗登武,张帅,胡中海,胡惠茗,王飞,罗炽增. SinChERS净化结合UPLC-MS/MS法测定茶叶中农药多残留的基质效应研究. 食品安全导刊. 2023(32): 65-72 .  百度学术
百度学术
其他类型引用(0)






 下载:
下载:




 下载:
下载:



