Bone Density Improvement Function and Safety Evaluation of the Malugu Capsule
-
摘要: 为了测定马鹿骨胶囊增加骨密度的性能及其安全性,本试验将大鼠分为假手术组、模型对照组(卵巢切除模型)、高剂量碳酸钙组以及马鹿骨胶囊不同剂量的三个组(200、400和1200 mg/kg·bw)连续灌胃90 d,试验后测定大鼠左股骨骨密度和右股骨骨钙含量,以评价马鹿骨胶囊增加骨密度的性能。其次,以15 g/kg·bw剂量的马鹿骨胶囊进行大鼠急性毒性试验,并开展遗传毒性试验和大鼠4周喂养试验以测定马鹿骨胶囊的安全性。试验结果显示,马鹿骨胶囊三个剂量组的体重与模型对照组无显著性差异(P>0.05)。马鹿骨胶囊三个剂量组的左股骨骨密度分别为0.6651、0.6560、0.6605 g/cm3,显著高于模型对照组0.6307 g/cm3(P<0.05)。安全性评价结果表明,马鹿骨胶囊对大鼠的急性经口MTD大于15 g/kg·bw,判定为无毒级别。遗传毒性试验均为阴性结果。大鼠4周喂养试验中,健康状况、生化和血液学指标及器官组织形态均未见异常变化。综上所述,马鹿骨胶囊具有增加骨密度的功能且安全性良好。Abstract: In order to evaluate the bone density improvement function and safety of the Malugu capsule, rats were divided into sham surgery group, model control group (oophorectomy model), high-dose calcium carbonate group (positive control), and groups with different doses of Malugu capsule (200, 400 and 1200 mg/kg·bw) by 90 days of gavage administration. The bone mineral density of the left femur and the calcium content of the right femur was measured to evaluate the performance of the Malugu capsule in increasing bone density. The acute toxicity test of the Malugu capsule at the dose of 15 g/kg·bw was carried out. Moreover, the genotoxicity test and 4-week feeding test of rats were also performed to evaluate the safety of the Malugu capsule. The results showed that there was no significant difference in body weight of rats among the groups of Malugu capsule treatment compared with the model control group (P>0.05). The bone mineral density of the left femur in the three doses of Malugu capsule groups were 0.6651, 0.6560 and 0.6605 g/cm3, respectively, which was significantly higher than that of 0.6307 g/cm3 (P<0.05) in the model control group. The safety evaluation results showed that the acute oral MTD of the Malugu capsule for rats was higher than 15 g/kg·bw, which could be classified as non-toxic. Moreover, the result of the genotoxicity test of the Malugu capsule was negative. Finally, no abnormal changes in health status, biochemical, hematological indicators, and organ tissue morphology of rats were observed in the 4-week feeding tests. In conclusion, the Malugu capsule has the function of increasing bone mineral density without safety issues.
-
近年来骨关节炎(Osteoarthritis,OA)的发病率随着老年群体及肥胖人群的不断增加而随之攀升。由于被广泛应用于治疗骨关节炎的镇痛药和非甾体抗炎药长期使用会给人体带来一定副作用[1],因此,从动物软骨及结缔组织中分离得到的硫酸软骨素由于具有抗炎[2−3]、抗凝血[4−5]、抗氧化[6]、抑制角质形成细胞增殖[7]、促进骨缺损愈合[8−9]等优良特性获得了极大的关注。硫酸软骨素是一种硫酸化糖胺聚糖,主要由N-乙酰-D-氨基半乳糖和葡糖醛酸重复连接而成[10],能够诱导细胞分化,使其可用于成软骨和成骨构建体[9],目前已被广泛用于治疗骨关节炎的营养保健品和药品中。
鹿骨是鹿科的骨架,作为一种中药成分,其富含大量蛋白质、胶原蛋白、软骨素、磷脂等成分,有助于促进胶原蛋白的合成、体内软骨成骨[11],能够强健肌腱,缓解老年患者的关节疼痛、关节炎等症状[12]。郭晓琳等[13]研究发现了梅花鹿骨粉可以明显改善骨质疏松症;王旭东等[14]研究发现鹿骨可以改善骨质疏松症,明显增加骨小梁成分;有研究表明,鹿骨提取物可以改善小鼠绝经后的骨质疏松症症状,同时对小鼠肠道菌群也有促进作用[15]。
目前保健品的需求随着人们对自身健康的关注不断增加,功能性食品的安全性也逐渐成为人们关注的热点。目前对于硫酸软骨素和马鹿骨治疗骨关节炎等关节问题的作用已有报道,但二者复合使用的安全性及效果却鲜少阐明[12]。本试验根据《保健食品功能检验与评价方法(2022年版)征求意见稿》[16],研究以硫酸软骨素、马鹿骨、盐酸氨基葡萄糖为主要成分的马鹿骨胶囊对增加骨密度性能的影响及安全性评价,以期为增加骨密度相关的保健品及药品安全应用提供理论参考。
1. 材料与方法
1.1 材料与仪器
马鹿骨胶囊 自制,标志性成分及含量为:盐酸氨基葡萄糖(12 g/100 g)、硫酸软骨素(6 g/100 g);胶囊的主要原料为盐酸氨基葡萄糖、马鹿骨、硫酸软骨素钠;用于细菌回复突变的菌株TA97、TA98、TA100、TA102 均购自上海北诺生物科技有限公司;叠氮化钠(NaN3)、1,8-二羟基蒽醌(Dan)、2-氨基芴(2-AF) FIuka公司;丝裂霉素C 浙江海正药业股份有限公司;碳酸钙 天津市致远化学试剂有限公司;实验样品均采用纯水配制和稀释。
SPF 级成年雌性 SD 大鼠 130 只,雄性 SD 大鼠30只 四川省中医药科学院实验动物中心提供,许可证号:SCXK(川)2013-19;200只昆明种小鼠雌雄各半 北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0011,饲养于屏障级动物房,条件为温度20~26 ℃,湿度40%~70%。
AU480全自动生化分析仪 Beckmen Coulter实验系统有限公司;Medonic M-series TD全自动血液细胞分析仪 布尔医疗设备(北京)有限公司;小动物全自动高分辨率X光机 Bruker In-Vivo DXS Pro公司。
1.2 实验方法
1.2.1 实验样品制备
洗净检验合格的马鹿骨首先进行脱脂处理,用3~6倍量水煎煮2~5次,每隔2 h换水一次,之后在55~60 ℃下进行干燥,粉碎后过100目筛得到马鹿骨粉。将马鹿骨粉、盐酸氨基葡萄糖和硫酸软骨素钠混合30 min得到混合粉,用70%乙醇制软材,16目制粒,之后在55~60 ℃下进行干燥,14目整粒获得颗粒和粉末,装入0号明胶空心胶囊,0.4 g/粒,检验包装即得。
1.2.2 增加骨密度试验
大鼠随机分为六组:假手术组、模型对照组(卵巢切除模型)、高剂量碳酸钙组、马鹿骨胶囊三个剂量组,每组12只。假手术组手术:腹腔麻醉后切除小肠系膜;模型对照组和马鹿骨胶囊三个剂量组手术:麻醉方法同上,摘除双侧卵巢后止血缝合。术后四天,假手术组和模型对照组用纯水灌胃;高剂量碳酸钙组口服192 mg/kg·bw的碳酸钙(该剂量相当于马鹿骨胶囊高剂量组钙水平,马鹿骨胶囊样品中碳酸钙含量为6.4 g钙/100 g样品,高剂量组1200 mg/kg·bw中,含钙为76.8 mg/kg·bw,换算成碳酸钙:192 mg/kg·bw)。马鹿骨胶囊分为三个剂量组,即200、400和1200 mg/kg·bw组(分别相当于马鹿骨胶囊人体摄入量40 mg/kg·bw的5、10和30倍)。所有动物均以10 mL/kg·bw进行灌胃,持续90 d,每周根据体重调整灌胃量。实验结束后,取右侧股骨,于105 ℃烤至恒重后称量骨重。用小动物全自动高分辨率X光机测定大鼠左股骨样品的骨密度(测定条件—exposure time:1 min;binning:none;KVP:45;X-RAY Fliter:0.8 mm;f-stop:2.51;FOV:120 mm; Focal Plane:20 mm)。采用原子吸收分光光度法测定右股骨骨钙含量[17]。
1.2.3 安全性毒理学评价试验
1.2.3.1 急性毒性试验
称取马鹿骨胶囊90 g,加纯水至240 mL,间隔4 h按2 mL/100 g·bw空腹灌胃2次。根据大鼠最大耐受量判断马鹿骨胶囊的急性毒性[18]。
1.2.3.2 遗传毒性试验Ames试验
用TA97、TA98、TA100和TA102菌株进行有无大鼠肝S9的标准平皿掺入法试验。设五个马鹿骨胶囊剂量:8、40、200、1000和5000 μg/皿,设自发对照、溶剂对照(纯水100 μL/皿)和阳性对照。不加S9试验的阳性对照为0.2 μg/皿的2,4,7-三硝基-9-芴酮(TA97、TA98),1.5 μg/皿的叠氮化钠(TA100),0.5 μg/皿的丝裂霉素C(TA102);加S9试验的阳性对照为10 μg/皿的2-氨基芴(TA97、TA98、TA100)和50 μg/皿的1,8-二羟基蒽醌(TA102)。每个剂量平行三次[18]。
1.2.3.3 小鼠骨髓嗜多染红细胞微核试验
昆明种小鼠(体重25~30 g)随机分为5组,每组10只,雌雄各半,设2.5、5.0和10.0 g/kg·bw三个马鹿骨胶囊试验组,另设阴性对照(纯水)、阳性对照(环磷酰胺40 mg/kg·bw)组。灌胃后24小时再次经口灌胃,6小时处死动物制片。计数一千个嗜多染红细胞(PCE)和两百个红细胞中PCE和成熟红细胞(NCE)所占数目,并计算比值[18]。
1.2.3.4 小鼠精子畸形试验
设2.5、5.0和10.0 g/kg·bw三个马鹿骨胶囊试验组,另设阴性对照和阳性对照组。按2 mL/100 g·bw经口灌胃5 d。30 d后取双侧附睾制片,记录不同类型畸形精子数[18]。
1.2.3.5 大鼠4周喂养试验
设对照组(基础饲料)和1.2、2.8和4.0 g/kg·bw三个马鹿骨胶囊剂量组。大鼠4周自由进食和饮水,每天灌胃一次,每周测定大鼠体重、两次给食量和剩食量以及摄食量,4周后处死动物(处死前禁食16 h),进行血清生化学及组织病理学检查[18]。
1.3 数据处理
使用PEMS 3.1统计软件包,各组数据以“平均值±标准差”表示,使用SPSS 21.0进行分析,试验均数比较使用方差分析,方差不齐采用秩和检验,骨密度实验中模型组和假手术组间的差异比较使用t检验。
2. 结果与分析
2.1 马鹿骨胶囊增加骨密度评价结果
2.1.1 马鹿骨胶囊对大鼠体重的影响
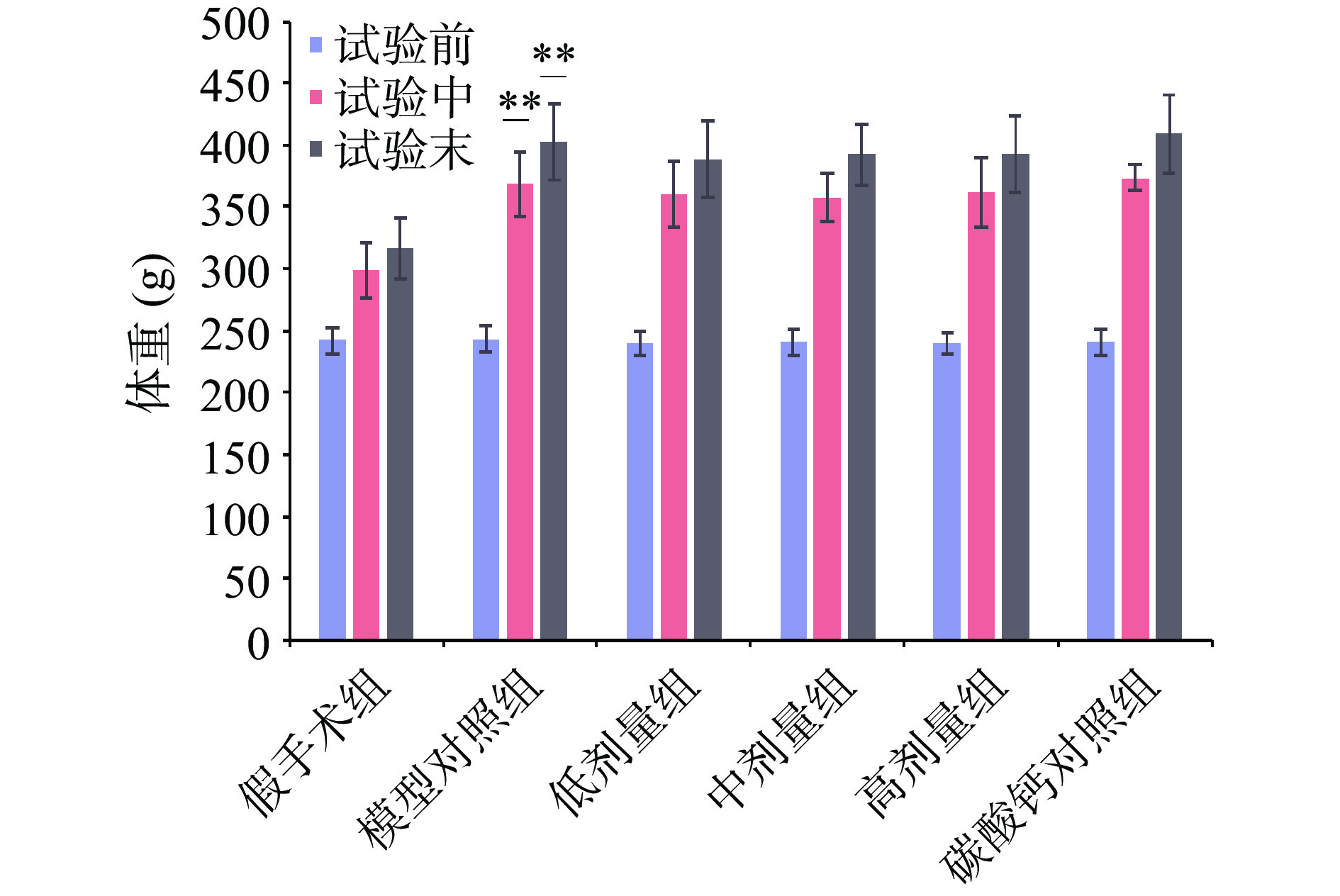
对六组小鼠持续灌胃90 d,试验前(第1 d)、试验中(第45 d)、试验末(第90 d)各组小鼠体重如图1所示,试验之前各组小鼠的体重无显著差异(P>0.05);试验中期和试验后期,模型对照组体重均极显著高于假手术组(P<0.01),说明卵巢切除模型建立成功。马鹿骨胶囊三个剂量组的体重在试验第1 d开始至试验90 d结束与模型对照组比较均无显著性差异(P>0.05),说明连续饲喂马鹿骨胶囊不会对小鼠体重产生显著影响。
2.1.2 马鹿骨胶囊对大鼠骨密度含量的影响
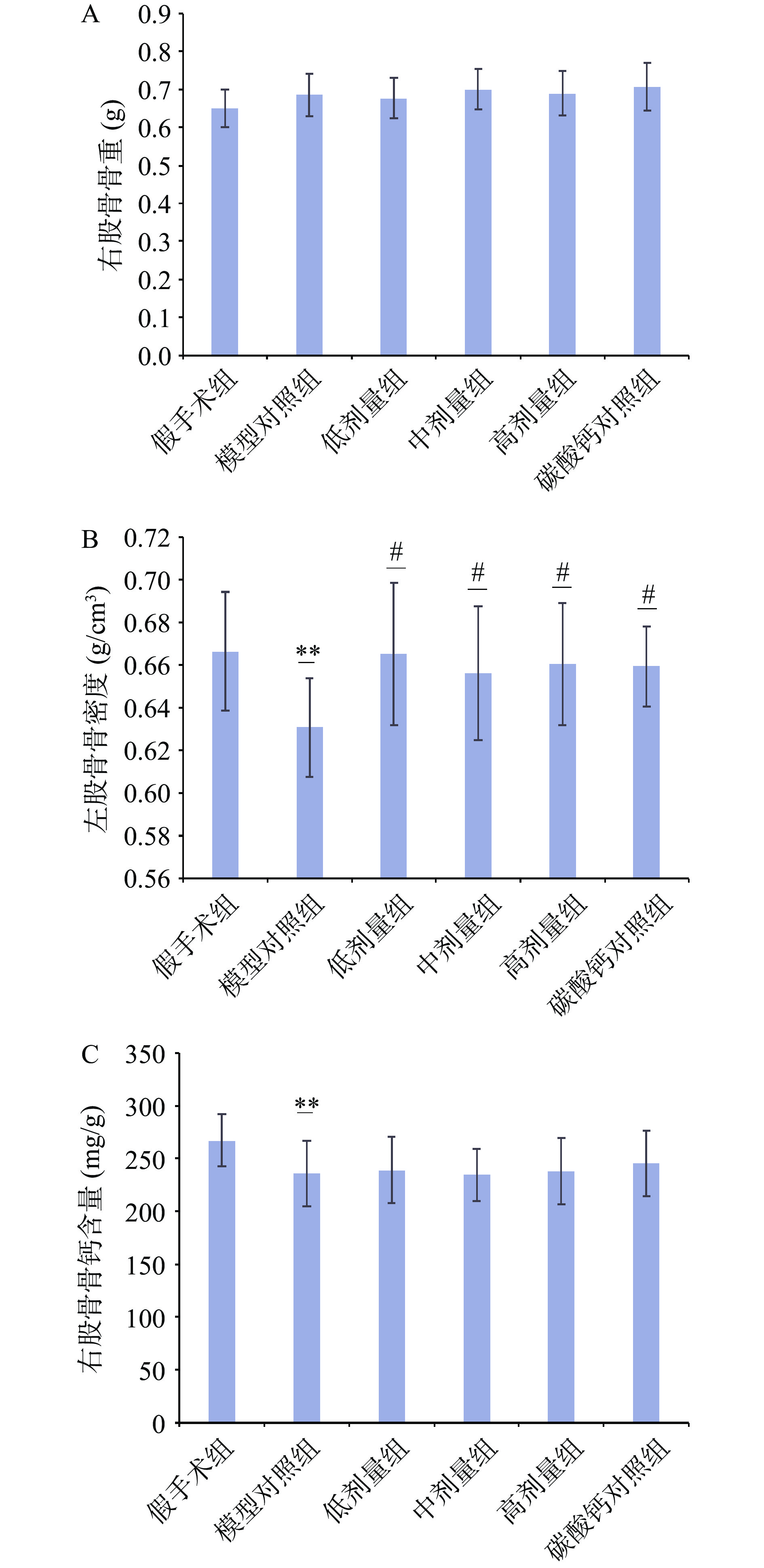
连续灌胃90 d后分别测定各组小鼠的右股骨骨重、左股骨骨密度和右股骨骨钙含量。由图2可见,模型对照组的骨密度为0.6307 g/cm3,骨钙含量为236.073 mg/g,极显著低于假手术组骨密度0.6663 g/cm3,骨钙含量267.113 mg/g(P<0.01)。马鹿骨胶囊三个剂量组的骨重与骨钙含量与模型对照组比较无显著差异(P>0.05),马鹿骨胶囊三个剂量组的左股骨骨密度分别为0.6651 、0.6560、0.6605 g/cm3显著高于模型对照组0.6307 g/cm3(P<0.05),这与苏辉等[19]的研究结果一致。高剂量组与碳酸钙组比较无显著性差异(P>0.05)。马鹿骨胶囊三个剂量组的骨重、骨密度和骨钙含量之间却没有显著差异,可能是由于三个剂量组之间剂量差异过大导致。
2.2 马鹿骨胶囊安全性评价结果
2.2.1 大鼠急性毒性试验结果
15 g/kg·bw剂量的马鹿骨胶囊灌胃后,14 d内大鼠生长正常,行为敏捷,无死亡或不良反应,结果见表1。说明马鹿骨胶囊应属无毒级产品。
表 1 大鼠急性毒性试验结果Table 1. Results of acute toxicity test in rats动物品系 性别 动物数
(只)初始体重
(g)末期体重
(g)剂量
(g/kg·bw)死亡数
(只)MTD
(g/kg·bw)结论 SD
大鼠雄性 10 204.8±9.0 294.6±29.2 15 0 >15 无毒 雌性 10 205.1±10.7 237.6±13.4 15 0 >15 无毒 2.2.2 遗传毒性试验
Ames试验结果如表2和表3所示,2次测试中,无论体系是否存在S9试验,自发对照组的回变菌落数均为正常值,而阳性对照组数值远高于自发对照组,呈阳性反应。马鹿骨胶囊各组的数值均小于2倍数量的自发对照组的数值,呈阴性,表明S9添加与否,马鹿骨胶囊均不会诱发菌株突变。
表 2 第一次Ames试验结果Table 2. Results of the first Ames test剂量
(μg/皿)TA97 TA98 TA100 TA102 -S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 8 120.3±5.5 137.0±14.1 36.7±3.1 37.0±3.6 155.3±2.9 157.7±2.3 253.7±6.4 260.3±9.0 40 114.3±1.5 135.3±10.3 35.7±2.5 37.7±1.5 150.7±2.1 155.7±4.2 249.3±8.4 261.7±9.7 200 116.0±6.2 135.0±11.0 36.0±3.6 39.3±2.1 149.3±4.5 158.0±7.2 255.0±7.9 257.7±8.3 1000 114.7±7.1 136.0±5.0 36.0±1.7 36.0±1.7 150.3±4.2 165.3±4.0 253.0±6.2 266.3±5.5 5000 116.3±8.1 133.7±9.0 36.0±5.0 40.3±4.0 150.0±4.6 159.3±7.5 251.3±4.7 261.0±7.2 自发对照 117.0±4.4 137.0±6.2 37.0±4.6 38.0±5.0 151.3±5.0 165.7±1.5 255.3±7.2 259.7±4.0 溶剂对照 114.3±2.1 131.0±4.6 37.0±5.3 40.0±3.0 150.3±0.6 164.3±1.2 250.3±2.5 262.0±6.1 阳性对照 1130.0±115.3 1373.3±94.5 1963.3±160.4 1990.0±131.1 1330.0±85.4 1353.3±110.6 1430.0±108.2 1063.3±102.6 表 3 第二次Ames试验结果Table 3. Results of the second Ames test剂量
(μg/皿)TA97 TA98 TA100 TA102 −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 8 117.3±7.0 135.7±10.8 37.3±2.1 38.3±4.0 149.3±3.8 156.3±4.5 249.7±4.5 260.3±5.9 40 114.3±3.1 138.0±9.2 36.7±2.5 38.0±4.6 154.0±3.0 157.0±8.9 252.0±1.7 262.7±10.1 200 116.7±4.9 135.0±8.9 36.0±2.6 41.0±2.6 150.3±5.5 155.7±3.8 250.3±4.2 257.0±7.0 1000 117.3±8.3 137.0±7.0 36.7±4.9 39.3±3.2 152.0±5.2 157.3±1.5 254.0±7.2 259.7±9.1 5000 118.3±4.9 133.7±6.5 36.3±2.5 39.0±3.5 149.0±1.7 158.7±7.5 256.0±6.6 265.7±4.5 自发对照 116.0±5.6 133.3±3.1 34.7±3.8 40.0±4.6 152.0±6.6 162.0±6.2 252.3±4.9 265.0±5.0 溶剂对照 118.0±4.6 140.3±5.7 34.7±2.1 38.3±5.0 151.3±5.9 164.7±4.0 255.0±8.7 266.7±5.9 阳性对照 1353.3±113.7 1400.0±95.4 1973.3±121.0 2013.3±145.7 1356.7±100.2 1366.7±111.5 1426.7±112.4 1063.3±94.5 小鼠骨髓细胞微核试验结果如表4所示,雄鼠和雌鼠的PCE/NCE比值与阴性对照组比较均无显著性差异(P>0.05)。阳性对照组雌、雄动物的微核率分别为21.4%和21.0%,显著高于阴性对照组0.8%(P<0.05),试验各组的微核率相比阴性对照无明显差异(P>0.05),说明马鹿骨胶囊不会造成小鼠骨髓细胞的突变。
表 4 小鼠骨髓细胞微核试验结果Table 4. Result of micronucleus test in mouse bone marrow cell性别 剂量
(g/kg·bw)动物数
(只)细胞数
(个)微核细胞数(个) 微核率(‰) PCE/NCE 雄 0.0 5 5000 4 0.8±0.8 1.01±0.11 2.5 5 5000 3 0.6±0.5 1.01±0.07 5.0 5 5000 5 1.0±0.7 1.01±0.15 10.0 5 5000 4 0.8±0.8 0.99±0.19 环磷酰胺 5 5000 105 21.0±4.1* 0.93±0.14 雌 0.0 5 5000 4 0.8±0.8 1.01±0.16 2.5 5 5000 4 0.8±1.3 1.04±0.16 5.0 5 5000 5 1.0±0.7 1.00±0.06 10.0 5 5000 7 1.4±0.9 0.99±0.14 环磷酰胺 5 5000 107 21.4±3.6* 0.94±0.09 注:剂量“0.0”为阴性对照,与阴性对照组比较,*表示差异显著(P<0.05);表5同。 小鼠精子畸形试验如表5所示,阳性对照组的精子畸形率为5.52%,阴性对照为2.22%,有明显差异(P<0.05),马鹿骨胶囊各组的精子畸形率分别为2.22%、2.06%、2.28%,相对阴性对照无显著性差异(P>0.05),表明马鹿骨胶囊对小鼠精子无致畸性作用。
表 5 小鼠精子畸形试验结果Table 5. Results of sperm malformation test in mice剂量
(g/kg·bw)动物数
(只)畸形精子类型及数目 精子畸形率(%) 无定形 香蕉形 无钩头 胖头 双头 针形头 尾折叠 双尾 无尾 其他 总数 0.0 5 64 17 25 0 0 1 4 0 0 0 111 2.22±0.47 2.5 5 52 27 24 1 1 3 3 0 0 0 111 2.22±0.36 5.0 5 48 26 18 1 0 5 5 0 0 0 103 2.06±0.42 10.0 5 53 29 20 1 1 5 5 0 0 0 114 2.28±0.16 环磷酰胺 5 209 29 20 4 2 6 6 0 0 0 276 5.52±0.29* 2.2.3 大鼠4周喂养试验
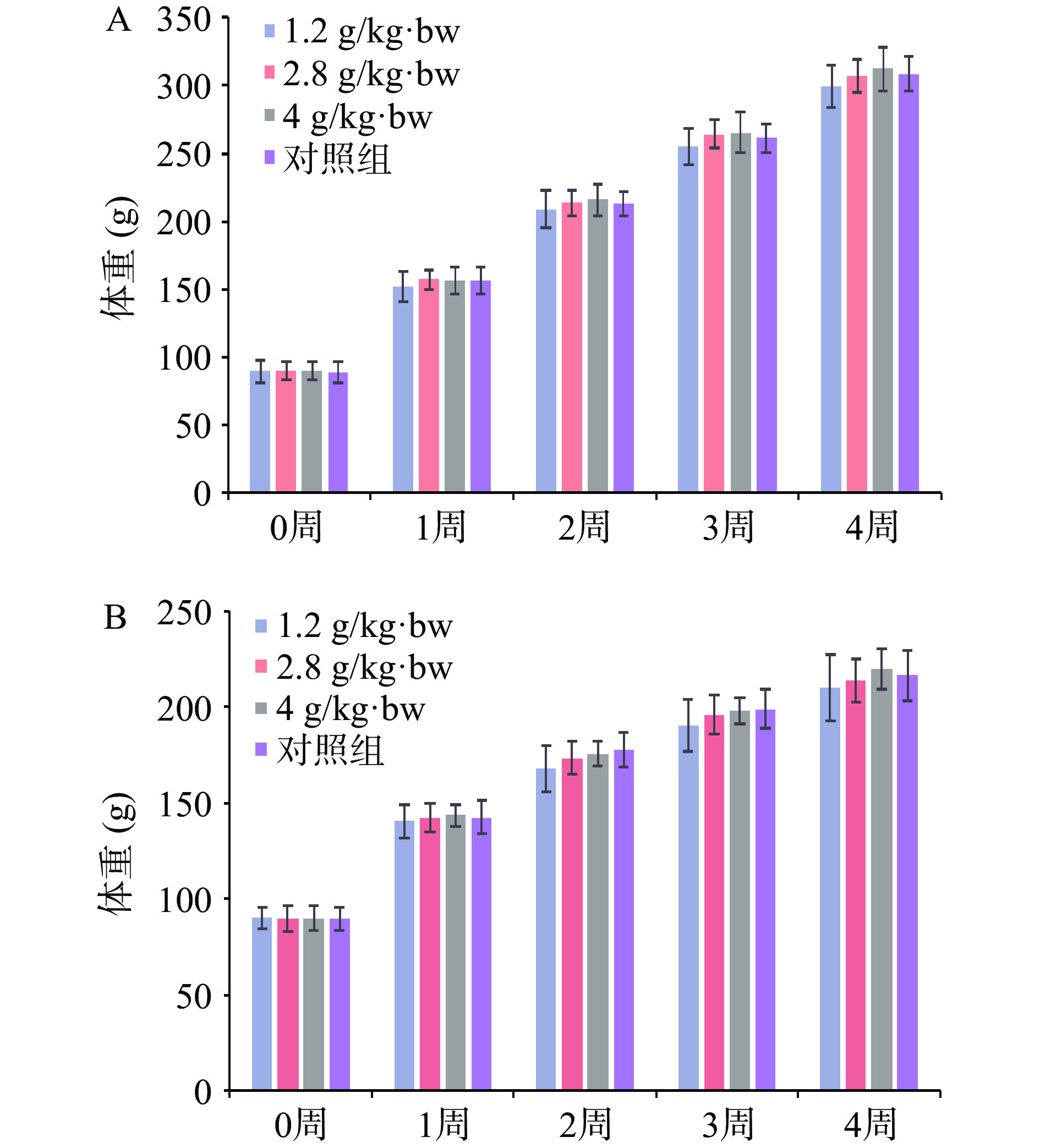
30 d喂养期间,大鼠健康状况良好,无中毒及非正常表现。当马鹿骨胶囊剂量为人体推荐摄入量100倍时,没有对大鼠组织形态、器官等指标造成显著影响,表明马鹿骨胶囊的最大无作用剂量大于4.0 g/kg·bw。
马鹿骨胶囊对大鼠体重的影响如图3所示,各剂量组的动物周体重与对照组比较均无显著性差异(P>0.05)。表明马鹿骨胶囊不会影响大鼠体重及食物利用率。综上所述,马鹿骨胶囊不会导致受试物身体的损害性改变。
3. 讨论与结论
本研究对马鹿骨胶囊的增加骨密度性能进行了评价。在成功建立切除卵巢模型的基础上,试验组的实验中期和末期体重与模型对照组比较均无显著性差异。试验各组的左股骨骨密度显著高于对照组。按照评价标准:马鹿骨胶囊具有增加骨密度功能。本研究同时对马鹿骨胶囊的安全性进行了评价。马鹿骨胶囊经急性经口毒性试验属无毒级别;遗传毒性试验表明马鹿骨胶囊不会导致骨髓细胞突变,不影响精子畸形率;连续30 d喂养马鹿骨胶囊不会导致动物身体的异常变化。
马鹿骨胶囊所用原料盐酸氨基葡萄糖、马鹿骨、硫酸软骨素钠的安全性在长期研究中得到验证。盐酸氨基葡萄糖可以提高软骨细胞的修复能力,从而改善关节活动度,缓解疼痛[20]、提高免疫[21]。目前已有很多学者研究对于治疗骨关节疾病的药物复配的治疗情况,有研究表示骨痨愈康丸联合盐酸氨基葡萄糖能有效抑制炎性因子[22];补肾壮筋汤联合盐酸氨基葡萄糖能够促进软骨细胞中胶原蛋白的表达,降低软骨细胞的凋亡水平[23]。颜晨燕等[24]将鲨鱼软骨的硫酸软骨素和胶原蛋白复配,发现了该配方能改善骨关节炎,恢复关节软骨中流失的胶原蛋白。
近年来硫酸软骨素和盐酸氨基葡萄糖用以改善骨关节性能的研究十分广泛[25−28],但对于硫酸软骨素和盐酸氨基葡萄糖与马鹿骨的复配研究却非常少。马鹿骨作为一种中药药材,传统上常将其用于防治各种骨关节疾病,认为其具有生髓、补髓,减缓骨髓老化,恢复骨髓年轻态的功效[29]。目前大多数马鹿骨研究集中在其成分分析和制备方法上,对其详细的功能和安全性评价的研究较少。研究表明,马鹿骨含有大量的人体所需的营养保健物质以及磷脂质、糖蛋白、维生素,多种矿物质元素如钙、镁、铁、锌、钾、铜等,鹿骨的软骨中还富含大量的酸性粘多糖及其衍生物,具有重要的生理功能和多种药理活性[30]。鹿骨中的胶原蛋白含量也较高,可作为功能性食品开发的重要原料[31]。马鹿骨胶能明显增强小鼠耐缺氧、抗疲劳、耐寒及耐高温能力,能增强正常和免疫抑制小鼠网状内皮系统的吞噬功能[32]。
鹿骨粉在临床上能够治疗继发性骨质疏松症,缓解患者临床骨痛的症状,提高患者的骨密度[33]。有报道显示,梅花鹿骨粉对去卵巢骨质疏松大鼠也表现出良好的治疗作用[13]。然而,以鹿骨粉与其它成分复配进行相关产品开发、功能测定和安全性评价的研究较少,曾有学者用鹿骨以及补骨脂等为主要成分研制了一种壮骨泡腾片,但是对其骨密度增强效果及安全性未做系统评价[34]。
本试验将具有预防和改善骨关节性能的盐酸氨基葡萄糖、马鹿骨、硫酸软骨素钠进行复配,研究其是否具有增加骨密度的作用,结果发现其对于增加大鼠骨密度具有良好作用,且安全性良好,无有毒或不良反应产生,本试验为马鹿骨作为保健品原料提供一定的理论依据,但马鹿骨和硫酸软骨素复配作用的具体机制还需要进一步研究论证。
-
表 1 大鼠急性毒性试验结果
Table 1 Results of acute toxicity test in rats
动物品系 性别 动物数
(只)初始体重
(g)末期体重
(g)剂量
(g/kg·bw)死亡数
(只)MTD
(g/kg·bw)结论 SD
大鼠雄性 10 204.8±9.0 294.6±29.2 15 0 >15 无毒 雌性 10 205.1±10.7 237.6±13.4 15 0 >15 无毒 表 2 第一次Ames试验结果
Table 2 Results of the first Ames test
剂量
(μg/皿)TA97 TA98 TA100 TA102 -S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 8 120.3±5.5 137.0±14.1 36.7±3.1 37.0±3.6 155.3±2.9 157.7±2.3 253.7±6.4 260.3±9.0 40 114.3±1.5 135.3±10.3 35.7±2.5 37.7±1.5 150.7±2.1 155.7±4.2 249.3±8.4 261.7±9.7 200 116.0±6.2 135.0±11.0 36.0±3.6 39.3±2.1 149.3±4.5 158.0±7.2 255.0±7.9 257.7±8.3 1000 114.7±7.1 136.0±5.0 36.0±1.7 36.0±1.7 150.3±4.2 165.3±4.0 253.0±6.2 266.3±5.5 5000 116.3±8.1 133.7±9.0 36.0±5.0 40.3±4.0 150.0±4.6 159.3±7.5 251.3±4.7 261.0±7.2 自发对照 117.0±4.4 137.0±6.2 37.0±4.6 38.0±5.0 151.3±5.0 165.7±1.5 255.3±7.2 259.7±4.0 溶剂对照 114.3±2.1 131.0±4.6 37.0±5.3 40.0±3.0 150.3±0.6 164.3±1.2 250.3±2.5 262.0±6.1 阳性对照 1130.0±115.3 1373.3±94.5 1963.3±160.4 1990.0±131.1 1330.0±85.4 1353.3±110.6 1430.0±108.2 1063.3±102.6 表 3 第二次Ames试验结果
Table 3 Results of the second Ames test
剂量
(μg/皿)TA97 TA98 TA100 TA102 −S9 +S9 −S9 +S9 −S9 +S9 −S9 +S9 8 117.3±7.0 135.7±10.8 37.3±2.1 38.3±4.0 149.3±3.8 156.3±4.5 249.7±4.5 260.3±5.9 40 114.3±3.1 138.0±9.2 36.7±2.5 38.0±4.6 154.0±3.0 157.0±8.9 252.0±1.7 262.7±10.1 200 116.7±4.9 135.0±8.9 36.0±2.6 41.0±2.6 150.3±5.5 155.7±3.8 250.3±4.2 257.0±7.0 1000 117.3±8.3 137.0±7.0 36.7±4.9 39.3±3.2 152.0±5.2 157.3±1.5 254.0±7.2 259.7±9.1 5000 118.3±4.9 133.7±6.5 36.3±2.5 39.0±3.5 149.0±1.7 158.7±7.5 256.0±6.6 265.7±4.5 自发对照 116.0±5.6 133.3±3.1 34.7±3.8 40.0±4.6 152.0±6.6 162.0±6.2 252.3±4.9 265.0±5.0 溶剂对照 118.0±4.6 140.3±5.7 34.7±2.1 38.3±5.0 151.3±5.9 164.7±4.0 255.0±8.7 266.7±5.9 阳性对照 1353.3±113.7 1400.0±95.4 1973.3±121.0 2013.3±145.7 1356.7±100.2 1366.7±111.5 1426.7±112.4 1063.3±94.5 表 4 小鼠骨髓细胞微核试验结果
Table 4 Result of micronucleus test in mouse bone marrow cell
性别 剂量
(g/kg·bw)动物数
(只)细胞数
(个)微核细胞数(个) 微核率(‰) PCE/NCE 雄 0.0 5 5000 4 0.8±0.8 1.01±0.11 2.5 5 5000 3 0.6±0.5 1.01±0.07 5.0 5 5000 5 1.0±0.7 1.01±0.15 10.0 5 5000 4 0.8±0.8 0.99±0.19 环磷酰胺 5 5000 105 21.0±4.1* 0.93±0.14 雌 0.0 5 5000 4 0.8±0.8 1.01±0.16 2.5 5 5000 4 0.8±1.3 1.04±0.16 5.0 5 5000 5 1.0±0.7 1.00±0.06 10.0 5 5000 7 1.4±0.9 0.99±0.14 环磷酰胺 5 5000 107 21.4±3.6* 0.94±0.09 注:剂量“0.0”为阴性对照,与阴性对照组比较,*表示差异显著(P<0.05);表5同。 表 5 小鼠精子畸形试验结果
Table 5 Results of sperm malformation test in mice
剂量
(g/kg·bw)动物数
(只)畸形精子类型及数目 精子畸形率(%) 无定形 香蕉形 无钩头 胖头 双头 针形头 尾折叠 双尾 无尾 其他 总数 0.0 5 64 17 25 0 0 1 4 0 0 0 111 2.22±0.47 2.5 5 52 27 24 1 1 3 3 0 0 0 111 2.22±0.36 5.0 5 48 26 18 1 0 5 5 0 0 0 103 2.06±0.42 10.0 5 53 29 20 1 1 5 5 0 0 0 114 2.28±0.16 环磷酰胺 5 209 29 20 4 2 6 6 0 0 0 276 5.52±0.29* -
[1] LUBIS A M T, SIAGIAN C, WONGGOKUSUMA E, et al. Comparison of glucosamine-chondroitin sulfate with and without methylsulfonylmethane in grade I-II knee osteoarthritis: A double blind randomized controlled trial[J]. Acta Medica Indonesiana,2017,49(2):105−111.
[2] REIJMERS R M, TROEBERG L, LORD M S, et al. Editorial: Proteoglycans and glycosaminoglycan modification in immune regulation and inflammation[J]. Frontiers in Immunology,2020,11:595867. doi: 10.3389/fimmu.2020.595867
[3] STELLAVATO A, RESTAINO O F, VASSALLO V, et al. Chondroitin sulfate in usa dietary supplements in comparison to pharma grade products: Analytical fingerprint and potential anti-inflammatory effect on human osteoartritic chondrocytes and synoviocytes[J]. Pharmaceutics,2021,13(5):737. doi: 10.3390/pharmaceutics13050737
[4] BOUGATEF H, GHLISSI Z, KALLEL R, et al. Chondroitin/dermatan sulfate purified from corb ( Sciaena umbra) skin and bone: In vivo assessment of anticoagulant activity[J]. International Journal of Biological Macromolecules,2020,164:131−139. doi: 10.1016/j.ijbiomac.2020.07.096
[5] ZHANG X, LIU H, LIN L, et al. Synthesis of fucosylated chondroitin sulfate nonasaccharide as a novel anticoagulant targeting intrinsic factor xase complex[J]. Angewandte Chemie,2018,130(39):13062−13067. doi: 10.1002/ange.201807546
[6] QI S S, SHAO M L, SUN Z, et al. Chondroitin sulfate alleviates diabetic osteoporosis and repairs bone microstructure via anti-oxidation, anti-inflammation, and regulating bone metabolism[J]. Frontiers in Endocrinology,2021,12:759843. doi: 10.3389/fendo.2021.759843
[7] KITAZAWA K, NADANAKA S, KADOMATSU K, et al. Chondroitin 6-sulfate represses keratinocyte proliferation in mouse skin, which is associated with psoriasis[J]. Commun Biol,2021,4(1):114. doi: 10.1038/s42003-020-01618-5
[8] FENBO M, SIJING L, RUIZ-ORTEGA L I, et al. Effects of alginate/chondroitin sulfate-based hydrogels on bone defects healing[J]. Mater Sci Eng C Mater Biol Appl,2020,116:111217. doi: 10.1016/j.msec.2020.111217
[9] SODHI H, PANITCH A. Glycosaminoglycans in tissue engineering: A review[J]. Biomolecules,2021,11(1):29.
[10] 高洁, 赵玲, 马丽曼, 等. 鱼源硫酸软骨素的研究进展[J]. 食品安全质量检测学报,2020,11(22):8166−8172. [GAO J, ZHAO L, MA L M, et al. Research progress of fish-derived chondroitin sulfate[J]. Journal of Food Safety & Quality,2020,11(22):8166−8172. doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.22.005 GAO J, ZHAO L, MA L M, et al . Research progress of fish-derived chondroitin sulfate[J]. Journal of Food Safety & Quality,2020 ,11 (22 ):8166 −8172 . doi: 10.19812/j.cnki.jfsq11-5956/ts.2020.22.005[11] REN C, GONG W, LI F, et al. Pilose antler aqueous extract promotes the proliferation and osteogenic differentiation of bone marrow mesenchymal stem cells by stimulating the BMP-2/Smad1, 5/Runx2 signaling pathway[J]. Chin J Nat Med,2019,17(10):756−767.
[12] LI Y, TAN Z, ZHANG J, et al. Physical and chemical properties, biosafety evaluation, and effects of nano natural deer bone meal on bone marrow mesenchymal stem cells[J]. Frontiers in Bioengineering and Biotechnology,2022,10:891765. doi: 10.3389/fbioe.2022.891765
[13] 郭晓琳, 苏凤艳, 胡薇, 等. 梅花鹿骨粉营养成分和抗骨质疏松活性研究[J]. 经济动物学报,2017,21(3):150−154 doi: 10.13326/j.jea.2017.1179 GUO X L, SU F Y, HU W, et al. Nutritional composition and anti osteoporosis activity of sika deer bone meal[J]. Journal of Economic Animal,2017,21(3):150−154. doi: 10.13326/j.jea.2017.1179
[14] 王旭东, 赵宏宇, 邸琳, 等. 淫羊藿骨碎补联合骨营养补剂对骨质疏松大鼠的影响[J]. 食品工业科技,2021,42(13):338−344 doi: 10.13386/j.issn1002-0306.2020080004 WANG X D, ZHAO H Y, DI L, et al. Effects of epimedium rhizoma drynariae combined with bone nutritional tonic on rats with osteoporosis[J]. Science and Technology of Food Industry,2021,42(13):338−344. doi: 10.13386/j.issn1002-0306.2020080004
[15] XUE C, PAN W, LU X, et al. Effects of compound deer bone extract on osteoporosis model mice and intestinal microflora[J]. Journal of Food Biochemistry,2021,45(6):e13740.
[16] 国家市场监督管理总局. 保健食品功能评价方法(2020年版)[EB/OL]. (2020-11-24). https://www.samr. gov.cn/hd/zjdc/202011/t20201124_323851.html State administration for market regulation. Methods for functional evaluation of health food (2020 edition) [EB/OL]. (2020-11-24). https://www.samr. gov.cn/hd/zjdc/202011/t202 01124_323851.html.
[17] 肖登, 杨霖, 雷中杰, 等. 不同强度脉冲电磁场对去卵巢大鼠股骨骨密度的影响[J]. 激光杂志,2011,32(5):61−62 doi: 10.3969/j.issn.0253-2743.2011.05.037 XIAO D, YANG L, LEI Z J, et al. Effect of pulsed electromagnetic fields of different intensity on bone mineral density of femur in ovariectomized rats[J]. Laser Journal,2011,32(5):61−62. doi: 10.3969/j.issn.0253-2743.2011.05.037
[18] 国家市场监督管理总局. 保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)[EB/OL]. (2020-10-31).https://gkml.samr.gov.cn/nsjg/tssps/202010/t20201031_322810.html State administration for market regulation. Technical guidelines for toxicological testing and evaluation of health food and its raw materials safety (2020 Edition) [EB/OL]. (2020-11-24). https://gkml.samr.gov.cn/nsjg/tssps/202010/t20201031 _322810.html.
[19] 苏辉, 闫炳翰, 王若冲, 等. 补肾壮骨方干预去卵巢骨质疏松模型大 鼠骨代谢及骨密度的变化[J]. 中国组织工程研究,2023,27(28):4507−4512 doi: 10.12307/2023.538 SU H, YAN B H, WANG R C, et al. Effect of Bushen Zhuanggu Fang on bone metabolism and bone mineral density in rats with ovariectomized osteoporosis[J]. Chinese Journal of Tissue Engineering Research,2023,27(28):4507−4512. doi: 10.12307/2023.538
[20] 何胜利, 杨宁, 常东军. 仙灵骨葆胶囊联合盐酸氨基葡萄糖治疗膝骨关节炎临床研究[J]. 中国药业,2022,31(19):84−87 doi: 10.3969/j.issn.1006-4931.2022.19.018 HE S L, YANG N, CHANG D J. Clinical study of xianling gubao capsules combined with glucosamine hydrochloride in the treatment of knee osteoarthritis[J]. China Pharmaceuticals,2022,31(19):84−87. doi: 10.3969/j.issn.1006-4931.2022.19.018
[21] LIN E C, CHEN S, CHEN L, et al. Glucosamine interferes with myelopoiesis and enhances the immunosuppressive activity of myeloid-derived suppressor cells[J]. Frontiers in Nutrition,2021,8:762363. doi: 10.3389/fnut.2021.762363
[22] 马鹏程, 王钢, 李平顺. 骨痨愈康丸联合盐酸氨基葡萄糖片治疗寒湿痹阻型膝骨关节炎临床观察[J]. 中华中医药杂志,2020,35(11):5902−5904 MA P C, WANG G, LI P S. Clinical observation on the Gulao Yukang pills combined with glucosamine hydrochloride tablets in treating knee osteoarthritis with cold-dampness arthralgia[J]. China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(11):5902−5904.
[23] 李宇, 王伟, 邱裕佳. 补肾壮筋汤联合盐酸氨基葡萄糖对大鼠膝软骨细胞增殖及凋亡影响的研究[J]. 中国骨质疏松杂志,2020,26(1):25−30 doi: 10.3969/j.issn.1006-7108.2020.01.007 LI Y, WANG W, QIU Y J. Effect of the reinforcing kidney and strengthening tendon decoction combined with glucosamine hydrochloride on the proliferation and apoptosis of knee chondrocytes in rats[J]. Chinese Journal of Osteoporosis,2020,26(1):25−30. doi: 10.3969/j.issn.1006-7108.2020.01.007
[24] 颜晨燕, 王梨萍, 屈鑫, 等. 鲨鱼硫酸软骨素及胶原蛋白复方改善小鼠骨关节炎作用研究[J]. 海洋渔业,2020,42(6):740−750 doi: 10.3969/j.issn.1004-2490.2020.06.010 YAN C Y, WANG L P, QU X, et al. Shark chondroitin sulfate and collagen compound study on improving osteoarthritis in mice[J]. Marine Fisheries,2020,42(6):740−750. doi: 10.3969/j.issn.1004-2490.2020.06.010
[25] FANG L, LIN L, LV Y, et al. The mechanism of aerobic exercise combined with glucosamine therapy and circUNK in improving knee osteoarthritis in rabbits[J]. Life Sciences,2021,275:119375. doi: 10.1016/j.lfs.2021.119375
[26] HE Y, SUN M, WANG J, et al. Chondroitin sulfate microspheres anchored with drug-loaded liposomes play a dual antioxidant role in the treatment of osteoarthritis[J]. Acta Biomaterialia,2022,151:512−527. doi: 10.1016/j.actbio.2022.07.052
[27] WU G, MA F, XUE Y, et al. Chondroitin sulfate zinc with antibacterial properties and anti-inflammatory effects for skin wound healing[J]. Carbohydrate Polymers,2022,278:118996. doi: 10.1016/j.carbpol.2021.118996
[28] XU L, MA F, LEUNG F K L, et al. Chitosan-strontium chondroitin sulfate scaffolds for reconstruction of bone defects in aged rats[J]. Carbohydrate Polymers,2021,273:118532. doi: 10.1016/j.carbpol.2021.118532
[29] 于浩, 张海悦, 李震, 等. 鹿骨双酶法酶解工艺的研究[J]. 食品研究与开发,2016,37(9):82−86 doi: 10.3969/j.issn.1005-6521.2016.09.019 YU H, ZANG H Y, LI Z, et al. The research of the enzymolysis of deer bone meal using double-enzyme hydrolysis[J]. Food Research And Development,2016,37(9):82−86. doi: 10.3969/j.issn.1005-6521.2016.09.019
[30] 庞广昌, 陈庆森, 杨晓宁. 动物骨头的利用研究[J]. 食品科学,1998(4):34−36 doi: 10.3321/j.issn:1002-6630.1998.04.013 PANG G C, CHEN Q S, YANG X N. Study on utilization of animal bones[J]. Food Science,1998(4):34−36. doi: 10.3321/j.issn:1002-6630.1998.04.013
[31] 赵玉红, 高天. 鹿骨胶原蛋白特性的研究[J]. 食品科学,2008(7):43−46 doi: 10.3321/j.issn:1002-6630.2008.07.003 ZHAO Y H, GAO T. Characteristics of collagen from deer bone[J]. Food Science,2008(7):43−46. doi: 10.3321/j.issn:1002-6630.2008.07.003
[32] 雷晓利, 于晓风, 曲绍春, 等. 鹿骨胶的初步药理研究[J]. 人参研究,2001, (2):31−33 doi: 10.3969/j.issn.1671-1521.2001.02.010 LEI X L, YU X F, QU S C, et al. Preliminary pharmacological study of deer bone glue[J]. Ginseng Research,2001, (2):31−33. doi: 10.3969/j.issn.1671-1521.2001.02.010
[33] 李玲. 鹿骨钙在治疗继发性骨质疏松中的应用[J]. 医药前言,2015,5(11):36−37 LI L. Deer bone calcium application in the treatment of secondary osteoporosis[J]. Medical Frontier,2015,5(11):36−37.
[34] 张朝阳. 鹿骨壮骨泡腾片的研制[J]. 现代养生,2015(6):240 ZANG C Y. Development of deer bone effervescent tablets[J]. Health Protection and Promotion,2015(6):240.





 下载:
下载:
 下载:
下载:



