Electrochemical Study on the Detection of Capsaicin in Red Oil by Modified Carbon Electrode with Different Activation Methods
-
摘要: 研究酸、碱、盐活化方法对不同碳电极检测辣椒素类物质含量的影响,制备活化碳电极传感器,用于检测红油中辣椒素类物质的含量,并探究其检测机理。以盐酸、氢氧化钠、磷酸盐溶液为活化液,分别对玻碳电极和石墨电极进行活化,以活化电极作为电化学传感器检测红油中辣椒素含量,对比不同活化条件对检测效果的影响。通过电化学实验、扫描电镜和拉曼光谱探究辣椒素的电化学检测机理。结果表明,活化能够显著增强电极对辣椒素的检测灵敏度。其中,磷酸盐活化法为最佳活化方法,活化后的石墨电极对辣椒素类物质的检测性能最佳。制备磷酸盐活化石墨电极的最优条件为:磷酸盐浓度0.2 mol/L、pH5.0、电位范围−2.0~2.2 V、扫描段数20。在此条件下,辣椒素的响应电流比活化前提高了11.2倍,反应过程为受扩散控制的氧化还原反应。此外,活化后的石墨电极表面氧元素含量从0.8%增加至34.9%。其检测机理为辣椒素得失电子产生电信号,并通过磷酸盐活化增加电极表面含氧基团提高检测灵敏度。基于磷酸盐活化石墨电极的传感器得到的红油中辣椒素含量的线性范围为5~80 μmol/L,检测限为2.30 μmol/L,加标回收率为98.23%~112.60%,结果与液质联用检测红油中辣椒素含量相比误差小于10%,并具有良好的抗干扰能力与稳定性。利用磷酸盐活化石墨电极构建传感器对红油中辣椒素含量进行检测具有简单、经济、有效的特点,该方法可以为生产实践提供一定参考。Abstract: To study the effects of acid, alkali and salt activation methods on the detection of capsaicin by different carbon electrodes, and prepare activated carbon electrode sensors to detect the content of capsaicin in red oil and explore the mechanism. In this work, the glassy carbon electrode and graphite electrode were activated by hydrochloric acid, sodium hydroxide, and phosphate solution respectively. Then, the activated electrodes were used as electrochemical sensors to detect the content of capsaicin in red oil, and the effect of activation conditions on detection performance was studied. Subsequently, the electrochemical detection mechanism of capsaicin was investigated by electrochemical experiments, scanning electron microscopy and Raman spectroscopy. According to the results, activation can significantly enhance the detection sensitivity of the electrode to capsaicin. Among them, phosphate activation method was the best activation method, and the activated graphite electrode showed the best detection performance for capsaicin. The optimum preparation conditions of phosphate activated graphite electrode were as follows: the phosphate concentration was 0.2 mol/L, the pH was 5.0, the potential range was −2.0~2.2 V, and the number of scanning segments was 20. Under this condition, the response current of capsaicin was 11.2 times higher than that before activation, and the reaction process was a redox reaction controlled by diffusion. Additionally, the surface oxygen content of activated graphite electrode increased from 0.8% to 34.9%. The detection mechanism was that capsaicin gains and loses electrons to generate electrical signals, and increases the oxygen containing groups on the electrode surface through phosphate activation to improve the detection sensitivity. The linear range of capsaicin content in red oil obtained by phosphate activated graphite electrode was 5~80 μmol/L, detection limit was 2.30 μmol/L, the recovery rate of spiking was 98.23%~112.60%, the error was less than 10% compared with LC-MS, and the sensor had good anti-interference ability and stability. Using phosphate activated graphite electrode to detect capsaicin content in red oil is simple, economical, and effective, and this method can provide some reference for production practice.
-
Keywords:
- activation method /
- electrochemical sensor /
- graphite electrode /
- capsaicin /
- detection mechanism /
- red oil
-
辣椒素类物质(Capsaicinoids)是辣椒碱类化合物的总称,是从辣椒植物果实中得到的活性成分,其特点为辛辣[1-2],因具有感官刺激性,常作为一种非常重要的食品添加剂在世界各地广受欢迎[3]。其中辣椒素是其主要活性成分,具有调味、清除自由基、抗氧化、抗癌等活性[4-8],在食品与医药领域被广泛关注。在我国,因独特的食辣文化,辣椒在川菜等菜品中广泛应用,其中红油作为一种为食品提供色,香,味的重要辣椒制品,广泛应用于酱卤肉制品、小吃、火锅等领域,成为人们饮食生活中的重要组成部分,而辣椒素的含量常被用于描述辣椒、红油等辣味产品的辛辣程度[9-10]。
辣椒素含量常用的测定方法有比色法[11]、高效液相色谱法[10]以及液相色谱质谱联用法[12]等。比色法操作繁琐、费时,准确度和灵敏度不高。高效液相色谱法和液相色谱质谱联用法则具有检测稳定、准确性高的特点,常作为判定方法使用,但缺点是仪器昂贵,操作专业性强,检测周期长[13-14],不适合工厂在线检测。电化学分析方法是一种根据待测物质的电化学活性及其变化规律,建立以电流、电位及电量等物理量与待测物的计量关系,从而对组分进行定性或定量的仪器分析方法[15],因其经济易行、灵敏度高、实用性强等特点,成为研究的热门领域之一。Yang等[16]采用金磁微粒(GMP)修饰丝网印刷电极,利用Au-S共价结合力在电极表面通过牛血清白蛋白富集检测克伦特罗,其检测限可达 0.22 ng/mL。Patricia等[17]等用羧基化单壁碳纳米管(SWNT-COOH)、CeO2以及十六烷基吡啶溴化物(CPB)修饰的玻碳电极(GCE)传感器用于辣椒素含量检测,检测限可以达到0.028 μmol/L。这些传感器的特点是检测限低、灵敏度高,但传感器制备工艺较复杂,需要通过大量实验筛选合适的传感器材料,具有一定技术难度,且成本取决于所用材料的价格高低,不利于实际应用,因此研究简单易制备的传感器具有一定价值。
本研究采用不同规格玻碳电极、石墨电极等碳基电极作为检测材料,研究酸、碱、盐活化方法对不同碳电极检测辣椒素类物质含量的影响,制备活化碳电极传感器,用于检测红油中辣椒素类物质的含量,比传统电化学传感器制备简单,在辣椒素检测领域尚无相关研究报道。并利用扫描电镜、拉曼光谱等手段表征其活化过程微观结构变化,从微观结构角度解析活化电极检测辣椒素原理机制,相关研究内容尚未有报道出现。通过该方法构建的电化学传感器具有简单、快速、低成本的特点,可用于红油中辣椒素物质含量的快速检测,为红油类产品辣度评价、产品稳定提供可行性方案参考。
1. 材料与方法
1.1 材料与仪器
蜀香红油 将天鹰椒与小米辣2种辣椒炒制后打磨成粉(50目),按1:1比例取20 g辣椒粉,加入150 ℃烧热的大豆油180 g,边加边搅拌至温度降至60 ℃以下,常温下密封静置20 h后待用;辣椒素标品 纯度≥98%,成都曼思特生物科技有限公司;二氢辣椒素标品、N -壬酸香草酰胺 纯度≥95%,均采购自阿拉丁试剂(上海)有限公司;盐酸、硫酸、磷酸氢二钾、磷酸二氢钠、无水甲醇、铁氰化钾、亚铁氰化钾、氯化钾、氯化钠、硫酸镁、氢氧化钠 均为分析纯,采购自国药集团;实验室用水 均为超纯水(18.2 MΩ·cm);实验中使用溶液均为实验前现配。
CHI660D型电化学工作站 海辰华仪器有限公司;三电极系统 上海仙仁仪器有限公司:石墨电极(Φ=2 mm )、玻碳电极(Φ=2 mm和3 mm)为工作电极,铂盘电极为辅助电极,饱和甘汞电极为参比电极;MPLK-701型数显控温磁力搅拌器 常州市金坛大地自动化仪器厂;ME55电子天平 梅特勒-托利多仪器(上海)有限公司;FiveEasy Plus pH 计 梅特勒-托利多仪器(上海)有限公司;VELOCITY14R型高速冷冻离心机 南京茜美生物技术有限公司;DZF-6050AB型真空干燥箱 上海力辰邦西仪器科技有限公司;KQ3200DA型数控超声波清洗器 昆山市超声仪器有限公司;UPT-II-10T超纯水机 四川优普超纯科技有限公司;GeminiSEM 560扫描电子显微镜 德国卡尔蔡司股份有限公司;Sigma300 X射线能谱仪 德国卡尔蔡司股份有限公司;LCMS-5500液质联用仪 沃特世科技(上海)有限公司;LabRAM HR800拉曼光谱仪 法国HORIBA Jobin Yvon公司。
1.2 实验方法
1.2.1 活化电极的制备
采用三种不同的电化学方法,对打磨后的石墨电极(Φ=2 mm),玻碳电极(Φ=2 mm,3 mm)进行活化处理:
酸活化[18-19]:以0.5 mol/L的硫酸溶液为电解液,采用循环伏安法(CV)对以上电极进行酸活化,活化条件为电位范围−0.3~2.0 V,扫描速度0.1 V/s,扫描圈数20段;
碱活化[20-21]:以1 mol/L的NaOH溶液为电解液,采用循环伏安法对以上电极进行碱活化,活化条件为电位范围−0.5~1.2 V,扫描速度0.1 V/s,扫描圈数20段;
磷酸盐活化[22-23]:以0.2 mol/L的磷酸盐溶液为电解液,采用循环伏安法对以上电极进行磷酸盐活化,活化条件为电位范围−2.0~2.2 V,扫描速度0.1 V/s,扫描圈数20段,pH5.0。
1.2.2 活化电极检测辣椒素效果比较
选择石墨电极(Φ=2 mm),玻碳电极(Φ=2 mm,3 mm)作为工作电极,采用循环伏安脉冲法和溶出伏安脉冲法(DP-AdSV)检测含有26.20 μmol/L辣椒素的0.1 mol/L盐酸电解液,研究了辣椒素在活化电极上的电化学行为。CV的初始参数:电位范围为0~1 V,扫描速率为0.1 V/s,灵敏度1.0×10−4 A/V。DP-AdSV的初始参数:沉积时间120 s,沉积电压0.1 V,电位范围为0.2~0.9 V,脉冲振幅为0.05 V,脉冲宽度为0.2 s,脉冲周期为0.4 s,平衡时间为2 s[24]。
1.2.3 活化条件对检测辣椒素含量的影响
以石墨电极为工作电极、辣椒素检测电流值为指标,研究磷酸盐活化条件对石墨电极检测辣椒素含量的影响,设置参数为:在pH6,电位条件−1.0~2.2 V,活化时间10段条件下,考察磷酸盐溶液浓度(0.05、0.1、0.2、0.3、0.4、0.5 mol/L)的影响;在电解质溶液浓度为0.2 mol/L,电位条件−1.0~2.2 V,活化时间10段条件下,考察pH(3、4、5、6、7、8)的影响;在电解质溶液浓度为0.2 mol/L,pH5,活化时间10段条件下,考察活化电位(−1.5~2.2,−1~2.2,−2~2.2,−2~1.6,−2~1.0 V)的影响;在电解质溶液浓度为0.2 mol/L,pH5,电位条件−2~2.2 V,考察活化时间(5、10、20、30、40段圈数)的影响,检测辣椒素的电解液为0.1 mol/L,pH为1的盐酸溶液。
1.2.4 活化电极检测辣椒素电化学机制研究
0.1 mol/L,pH为1的盐酸溶液作为电解液,采用不同的扫描速率(25、50、100、200和300 mV/s)对5 mmol/L铁氰化钾溶液进行CV表征,CV扫描条件为电位范围为-0.2~0.6 V,扫描速率为0.1 V/s,灵敏度1.0×10−4 A/V。对含26.20 μmol/L辣椒素的盐酸溶液进行CV扫描,参数条件为电位范围为0~1 V,扫描速率为0.1 V/s,灵敏度1.0×10−4 A/V[24]。
用0.10 mol/L的盐酸溶液作为pH1的支持电解液,用PBS溶液用于pH3~7的支持电解液,使用CV法在不同的pH(1、3、4、5、6、7)条件下对含49.12 μmol/L辣椒素的盐酸溶液进行CV扫描。扫描参数条件的电位范围为0~1 V,扫描速率为0.1 V/s,灵敏度1.0×10−4 A/V。
1.2.5 电极活化结构表征
在最优条件下磷酸盐活化石墨电极,活化后的电极在50 ℃下真空干燥至表面干燥无水分,采用扫描电子显微镜搭配X射线能谱仪研究磷酸盐活化石墨电极前后的微形貌及碳,氧,磷元素变化,仪器设置参数:加速电压(EHT)为10 KV、测试倍数(mag)为10000倍、工作距离(WD)为10.6 mm,积分时间10 s。采用拉曼光谱仪检测磷酸盐活化前后石墨电极表面的材料晶体缺陷特征情况,设置拉曼位移为500~2500 cm−1。
1.2.6 加标回收率检测
标准曲线制备:使用活化电极为工作电极,铂电极为辅助电极,饱和甘汞电极为参比电极,组成三电极体系检测不同辣椒素浓度(5、10、20、40、80 μmol/L),每个样本检测3次以上取平均值,检测方法使用溶出伏安脉冲法,DP-AdSV的参数条件[24]:沉积时间120 s,沉积电压0.1 V,电位范围为0.2~0.9 V,脉冲振幅为0.05 V,脉冲宽度为0.2 s,脉冲周期为0.4 s,平衡时间为2 s。根据IUPAC提供的方法计算出活化电极对辣椒素的检测限[25]。
加标回收率检测:取2~5 g红油入大烧杯中,向烧杯中加入15 mL无水甲醇,在60 ℃条件下超声(100 W)30 min后,采用10000 r/min离心10 min,收集上清液。沉淀重复提取两次,并将所有滤液一起收集,用无水甲醇溶液将提取液定容至50 mL备用。提取液用0.22 μm有机滤膜进行过滤后,加入不同浓度(5、20、40 μmol/L)的辣椒素标准溶液,每个浓度制备3个平行样品,采用DP-AdSV法检测3次。将测得的响应电流值代入标准曲线中,计算得出辣椒素含量及加标回收率。
国标法对比:上述提取液经0.22 μm有机膜过滤,参考国标法[12]采用液相色谱-质谱法(LC-MS)检测红油中辣椒素含量并进行加标回收率计算。LCMS测试条件为:扫描方式:正离子模式;检测方式:多反应监测(MRM);干燥气温度:350 ℃;雾化气压力:207 kPa(30 psi);干燥气流量:9 L/min;毛细管电压:4000 V。
1.2.7 抗干扰性及稳定性检测
将味精(80.20 μmol/L),蔗糖(43.82 μmol/L)和无机盐离子(256.41 μmol/L Mg2+,K+,Na+,Cl−和SO42−)分别添加到终浓度49.12 μmol/L辣椒素溶液中,采用DP-AdSV检测掺杂辣椒素溶液考察活化电极的抗干扰性能。将石墨电极活化后抽真空密封并存放在4 ℃条件下,在0,1,2 d分别检测20 μmol/L辣椒素电解质溶液,评价其稳定性。
1.3 数据处理
以上实验均测定三次,结果以平均值±标准差表示,运用SPSS 18.0软件进行数据统计分析,采用单因素方差分析进行显著性差异分析,P<0.05认为具有显著性,实验数据图利用 Origin 2018软件绘制。
2. 结果与分析
2.1 不同活化电极对辣椒素检测的影响
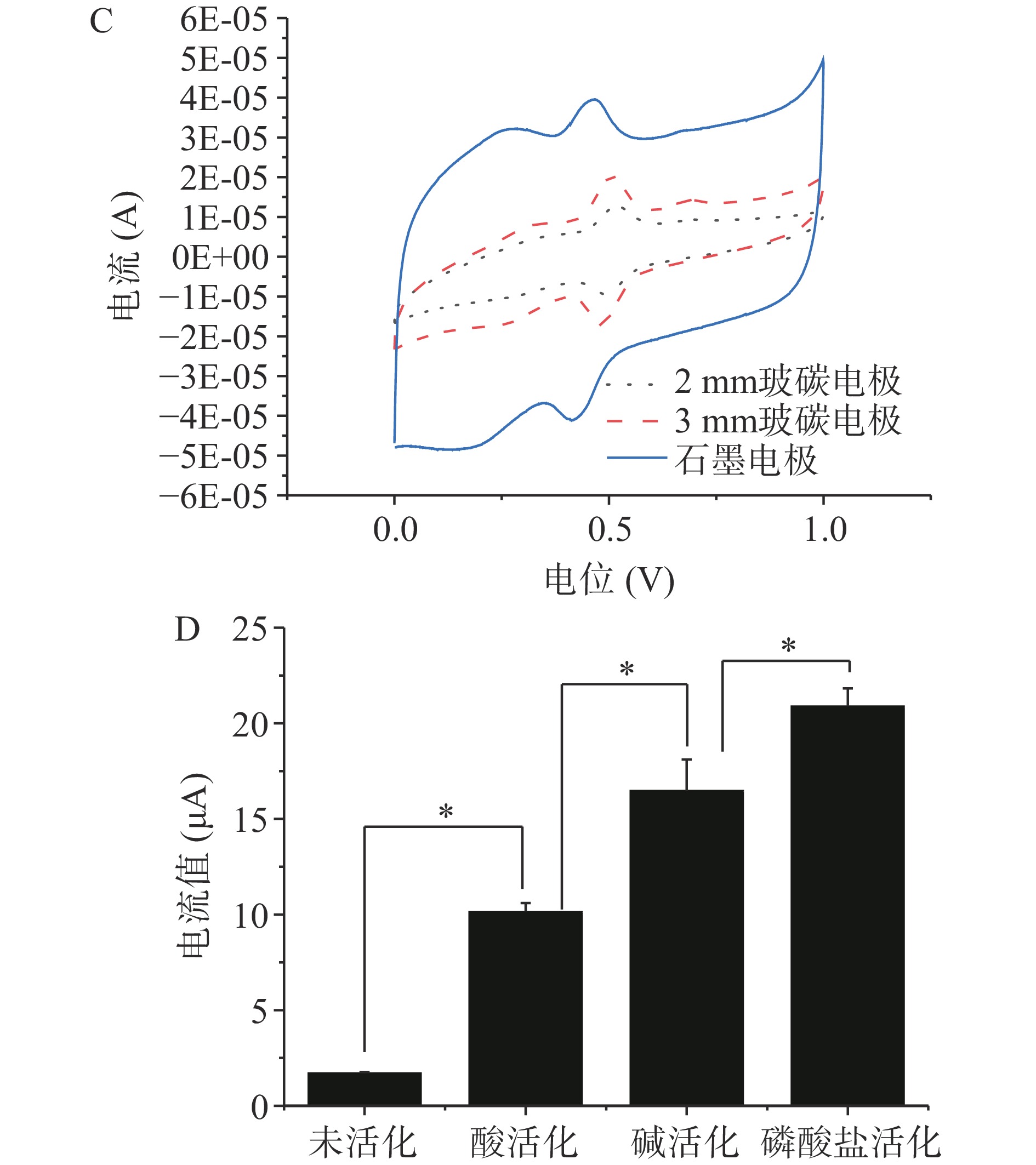
选择石墨电极(Φ=3 mm),玻碳电极(Φ=2 mm,3 mm)作为工作电极,采用循环伏安法检测含有26.20 μmol/L辣椒素的0.1 mol/L盐酸电解液,考察不同活化方式对检测辣椒素效果的影响。结果如图1所示,在磷酸盐活化(A)、碱活化(B)和酸活化(C)中,石墨电极检测辣椒素的电流值均最大,其次为Φ=3 mm玻碳电极,Φ=2 mm玻碳电极电流值最小,因此选择检测响应最高的石墨电极作为传感器碳材料。图1D是酸、碱、盐活化后的石墨电极检测辣椒素的效果比较,结果显示活化后的检测数值显著增大,推测是电极经活化后表面引入了含氧基团,形成分子间氢键,提高了电极性能,使得辣椒素大量在电极表面被催化氧化,电子传递能力增强[23]。三种活化方式中,磷酸盐的活化效果最好,辣椒素检测数值最高,其次是碱活化方式,酸活化方式响应值最小,故选择磷酸盐活化作为检测辣椒素的最佳活化方式。
2.2 磷酸盐活化条件对检测辣椒素含量的影响
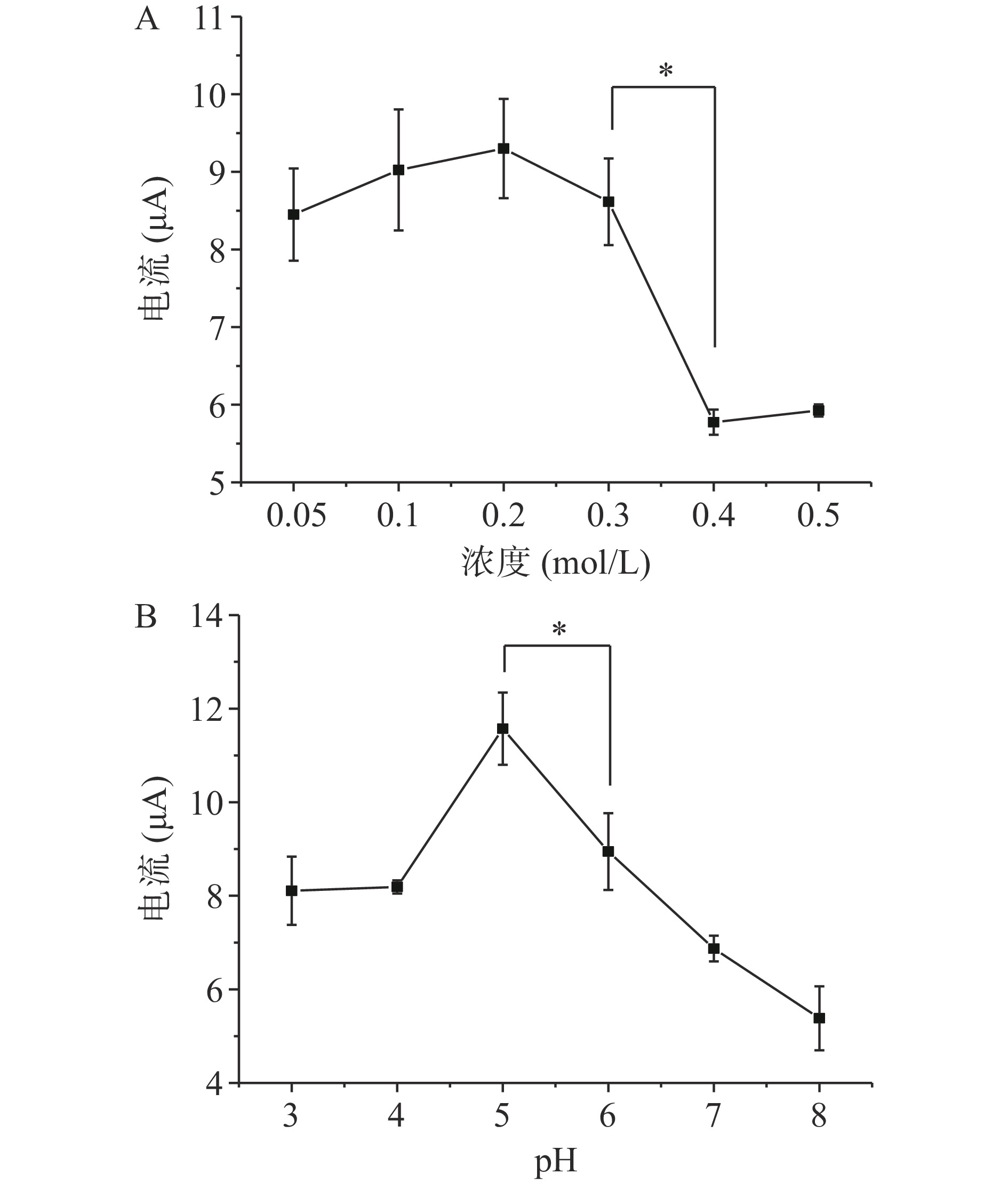
图2A~图2D分别为磷酸盐浓度、pH、活化电位和活化时间(圈数)对石墨电极检测辣椒素含量的影响,结果显示在一定范围内,随磷酸盐浓度增加、pH增大,电流值均为先增加后降低,磷酸盐浓度在0.05~0.3 mol/L范围内无显著性差异,而浓度为0.4 mol/L时活化效果显著降低(P<0.05),当pH为碱性时活化效果明显下降,这与王长芹等[26]、李金金等[27]、马榕等[28]学者报道的趋势一致,也与课题组前期研究结果相近,均是在碱性条件下效果逐渐下降[24],最优pH5.0,最佳磷酸盐浓度为0.2 mol/L。电位结果显示磷酸盐的活化对检测影响显著,最佳活化电位为−2.0~2.2 V,其余电位均会导致检测值显著下降。当活化时间超过20段后磷酸盐活化石墨电极检测辣椒素的数值无显著变化,采用活化20段作为最优活化时间。综上最优活化条件为磷酸盐浓度0.2 mol/L、pH5.0、电位范围−2.0~2.2 V、扫描段数20。
2.3 扫描速度对磷酸盐活化石墨电极检测辣椒素的影响
为了获得参与电化学反应的电子数,在不同的CV扫描速率下分别扫描5 mmol/L铁氰化钾溶液和26.20 μmol/L辣椒素溶液。图3A~图3B为不同扫速条件下活化电极在铁氰化钾中的电化学行为,从图中可得随着扫速的增加铁氰化钾峰电流逐渐增大,且氧化峰电流与扫速的平方根成正比,还原峰的峰电流与扫速的平方根成反比。图3C~图3D为不同扫速条件下活化电极在辣椒素中的CV表征,结果显示,随着扫速的增加辣椒素检测峰电流逐渐增大,氧化还原峰的峰电流与扫速的平方根成线性关系,表明辣椒素在活化电极表面的催化反应主要受扩散控制,根据巴特勒-沃尔默方程[29],经计算磷酸盐活化石墨电极检测辣椒素参与电化学反应的电子数为2。
2.4 pH对活化石墨电极检测辣椒素的影响
为了获得参与电化学反应的质子数,使用CV法在不同的pH(1、3、4、5、6、7)下扫描49.12 μmol/L辣椒素溶液。如图4所示,随着pH的增大,活化电极检测辣椒素的响应值逐渐减小,电解液pH7时,辣椒素响应值几乎为零,检测辣椒素最佳支持电解液pH1。且结果显示检测峰电位与pH成线性反比关系,曲线斜率为46 mV/pH,参考文献[29]方法经计算,活化电极检测辣椒素过程中参与电化学反应的质子数为1。
2.5 磷酸盐活化石墨电极结构表征
磷酸盐活化石墨电极的电镜扫描结果如图5所示,图5A~图5B和图5C~图5D分别为SEM表征下1 和10 μm扫描图,由图可知,磷酸盐活化石墨电极对电极表面微观结构未产生明显改变(图5A~图5B),仅有部分磷酸盐会电沉积在石墨电极表面形成白色结晶(图5C~图5D)。为进一步考察磷酸盐活化石墨电极前后表面元素含量的变化,实验采用能谱仪( EDS) 进行了测试,结果如图5E和图5F所示。与磷酸盐活化前相比,活化后的石墨电极表面的碳元素质量百分比从99.2%减少至57%,而氧含量从约0.8%增加至 34.9%,磷元素由0%增加至8.1%。通过结果对比推测这种变化是由于石墨电极表面在磷酸盐溶液中电化学活化所致,由此可推测磷酸盐活化后的石墨电极检测辣椒素电流值增大是因为活化后增加了电极表面的含氧活性元素含量。
图6 为磷酸盐活化石墨电极前后的拉曼图,其中D-峰代表的是C原子晶的缺陷,G-峰代表的是C原子sp2杂化的面内伸缩振动,活化前复合物的 ID/IG(0.90)值高于活化后 ID/IG(0.72),说明活化前比活化后有更多的缺陷位点,也进一步证实了石墨电极经磷酸盐电化学活化后发生了氧化还原反应,表面基团被氧化,含氧活性基团增多[26]。
2.6 加标回收率检测
如图7所示,活化石墨电极检测辣椒素的线性方程为Ipa(μA)=0.5804C(μmol/L)-1.307,R2值为0.9996,检测限为2.30 μmol/L。利用国标法[12]《GB/T 40348-2021》提取蜀香红油中的辣椒素含量,同时采用磷酸盐活化的石墨电极及LCMS检测辣椒素含量,得出红油样品中辣椒素含量分别为118.10 mg/kg与107.62 mg/kg,误差9.7%在可接受范围内。如表1所示,电化学方法加标回收率为98.23%~112.60%,LC-MS方法加标回收率为92.45%~100.77%,磷酸盐活化石墨电极检测红油中辣椒素含量具有方法可行性。
表 1 红油中不同辣椒素浓度加标回收率检测比较Table 1. Comparison of standard addition recovery experiments of different capsaicin content in red oil加标终浓度(μmol/L) 磷酸盐活化石墨电极 LC-MS 检测值(μmol/L) 加标回收率
(%)检测值(μmol/L) 加标回收率
(%)5.00 5.63±0.49 112.60% 4.63±0.36 92.45 20.00 21.71±2.10 108.56% 19.56±1.40 97.80 40.00 39.29±2.76 98.23% 40.31±2.11 100.77 2.7 抗干扰性和稳定性
通过向辣椒素溶液中添加产品中常见的蔗糖,无机盐离子,味精等干扰物考察活化电极检测辣椒素的抗干扰性,结果如图8A所示,添加干扰物对辣椒素的响应值影响相对于空白组在±5%以内,表明产品中常见的干扰物对活化电极无显著影响,磷酸盐活化石墨电极检测红油中辣椒素含量具有较好的抗干扰性。如图8B所示,磷酸盐活化石墨电极存放2 d后检测辣椒素的电流值显著(P<0.05)下降,但存放1 d后检测辣椒素的数值仅下降4.3%,表明磷酸盐活化电极短时间内具有一定的稳定性。
3. 讨论
电化学检测方法具有灵敏度高、实用性强等优势,但其传感器制备非常依赖材料的选择,选择工艺成熟、成本低廉的材料作为传感器具有一定实用价值。通过分析发现,适合作辣椒素电化学检测的传感器主要由碳纳米管、石墨等碳材料经过修饰改性而来[24, 29-31],如Xu[24]利用碳纳米管与环糊精修饰的玻碳电极检测酱卤肉制品中辣椒素含量,检测限达到0.29 μmol/L,加标回收率为83.2%~136.26%,具有较强的抗干扰性、重现性和稳定性。本文研究结果也证实采用磷酸盐活化石墨电极构建传感器可以用于检测红油中辣椒素含量,检测限2.30 μmol/L,加标回收率为98.23%~112.60%,虽然检测限相比较已有碳材料传感器[24]未能显著提高,但制备成本及稳定性优势显著。
常规裸电极材料检测辣椒素的数值较小,达不到检测效果[7],但进行电化学活化后可以显著提高检测数值,本研究中采用酸、碱、盐活化前后的数值分别增大4.9、8.6、11.2倍,活化效果显著,与金赛燕等[22]利用氨基甲酸铵和磷酸盐缓冲液(PBS)复合活化裸玻碳电极检测尿液中的多巴胺和尿酸提升效果相近。通过结果可见磷酸盐浓度与活化效果并不是绝对的正比关系,当磷酸盐浓度过高时(≥0.4 mol/L)活化效果反而显著下降,通过扫描电镜观察到电极表面会存在磷酸盐附着现象(图5D),由此推测磷酸盐浓度过高时会在电极表面附着大量磷酸盐使电极活性位点无法暴露出来,从而使活化效果下降。
前期研究表明,以碳材料为主的传感器检测辣椒素的机制为扩散控制的准可逆氧化还原反应,通过捕获辣椒素氧化还原反应过程产生的转移电子达到检测目的[24-25]。通过研究磷酸盐活化的石墨电极检测辣椒素的电化学行为,该传感器检测辣椒素的电化学行为与前期研究一致,表明碳材料在检测辣椒素过程中具有相同或相似的反应过程和原理。反应过程有电子和质子参与,其中电子数为2、质子数为1,结合辣椒素本身属于酰胺类化合物的结构,反应路径可能为酸性条件下的辣椒素氧化成邻苯醌,邻苯醌和儿茶酚之间发生可逆的还原氧化反应[32-33]。进一步研究显示,电极表面在活化前后发生了显著变化,含氧基团含量显著提升,表明磷酸盐活化引入的含氧基团,是电极活性提升、检测效果增强的微观原因。
本文与前期研究显示辣椒素的检测特征峰均出现在0.4~0.5 V的位置,具有一定特征性,研究发现其主要与碳材料及盐酸电解液有关[24-25,34]。采用该方法检测红油中辣椒素含量,与液质联用检测结果相近,具有方法可行性。但相比较其他碳材料传感器[17,24-25,34],该方法的检测限明显偏高,表明该方法具有一定局限性,不适用于辣椒素含量过低的产品,但对于红油等富含辣椒素物质的产品具备实用性。
4. 结论
综上所述,构建磷酸盐活化的石墨电极传感器可用于红油中辣椒素含量的准确、快速检测,在0.2 mol/L磷酸盐浓度、pH5.0、电位−2.0~2.2 V、活化时间20段的最优条件下,活化前后检测数值提升11.2倍,检测结果与液质联用相比误差小于10%,具有良好的抗干扰能力与稳定性。通过微观结构研究,磷酸盐活化使石墨电极含氧基团含量增加,增加了电极活性,提高了检测辣椒素的灵敏度。虽然与其他碳电极比较存在检测限较高的局限,但方法简单可靠、成本较低,便于后期推广应用,可以作为检测红油中辣椒素含量的一种有效检测手段,如何运用该方法用于红油生产过程的在线检测将是下一步研究方向之一。
-
表 1 红油中不同辣椒素浓度加标回收率检测比较
Table 1 Comparison of standard addition recovery experiments of different capsaicin content in red oil
加标终浓度(μmol/L) 磷酸盐活化石墨电极 LC-MS 检测值(μmol/L) 加标回收率
(%)检测值(μmol/L) 加标回收率
(%)5.00 5.63±0.49 112.60% 4.63±0.36 92.45 20.00 21.71±2.10 108.56% 19.56±1.40 97.80 40.00 39.29±2.76 98.23% 40.31±2.11 100.77 -
[1] BARBERO G F, LIAZID A, PALMA M, et al. Ultrasound-assisted extraction of capsaicinoids from peppers[J]. Talanta,2008,75(5):1332−1337. doi: 10.1016/j.talanta.2008.01.046
[2] ORNELAS-PAZ J D, MARTÍNEZ-BURROLA J M, RUIZ-CRUZ S, et al. Effect of cooking on the capsaicinoids and phenolics contents of Mexican peppers[J]. Food Chem,2010,119(4):1619−1625. doi: 10.1016/j.foodchem.2009.09.054
[3] CISNEROS-PINEDA O, TORRES-TAPIA L W, GUTIÉRREZ-PACHECO L C, et al. Capsaicinoids quantification in chili peppers cultivated in the state of Yucatan, Mexico[J]. Food Chem,2007,104(4):1755−1760. doi: 10.1016/j.foodchem.2006.10.076
[4] SINISGALLI C, VEZZA T, DIEZ-ECHAVE P, et al. The beneficial effects of red sun-dried Capsicum annuum L. cv senise extract with antioxidant properties in experimental obesity are associated with modulation of the intestinal microbiota[J]. Molecular Nutrition & Food Research,2021,65(3):2000812.
[5] I C E. Quantitative viscosity determination in irradiated major spices (black pepper, cardamom, cinnamon, ginger, and turmeric) by using a vibro viscometer for long-term storage[J]. Food Control,2022,133:108679. doi: 10.1016/j.foodcont.2021.108679
[6] 杜坚, 暴天超, 李垠青, 等. 大蒜油和辣椒油对童鸽生长性能、免疫器官指数、血清生化与抗氧化指标的影响[J]. 中国家禽, 2021, 43(4): 54−59. DU J, BAO T C, LI Y Q, et al. Effects of garlic oil and chili oil on growth performance, immune organ index, serum biochemical and antioxidant indexes of squeaker[J]. China Poultry, 2021, 43(4): 54−59. [7] 萨仁高娃, 胡文忠, 姜爱丽. 辣椒营养保健功能及辣椒食品的研究进展[J]. 食品工业科技,2012,33(15):371−375. [SA R G W, HU W Z, JIANG A L. Research process in pharmacological function and products of chilli[J]. Science and Technology of Food Industry,2012,33(15):371−375. SA R G W, HU W Z, JIANG A L. Research process in pharmacological function and products of chilli[J]. Science and Technology of Food Industry, 2012, 33(15): 371-375.
[8] MENDES N D, SANTOS M C P, SANTOS M C B, et al. Characterization of pepper (Capsicum baccatum)-A potential functional ingredient[J]. LWT,2019,112:108209. doi: 10.1016/j.lwt.2019.05.107
[9] 牟心泰. 不同品类辣椒对菜肴色, 香, 味等形成的影响研究[D]. 哈尔滨: 哈尔滨商业大学, 2021 MOU X. Research on the influence of different categories of pepper on the color, aroma and flavor of dishes[D]. Harbin: Harbin University of Commerce, 2021.
[10] 中国国家标准化管理委员会. GB/T 21266-2007 辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法[S]. 长沙: 湖南省质量技术监督局, 2007 Standardization Administration of China. GB/T 21266-2007 Determination of capsaicin in chili pepper and chili products and expression of chiliiness[S]. Changsha: Hunan Provincial Bureau of Quality and Technical Supervision, 2007.
[11] 中国国家标准化管理委员会. GB/T 30389-2013 辣椒及其油树脂 总辣椒碱含量的测定 分光光度法[S]. 北京: 中华全国供销合作总社, 2013. Standardization Administration of China. GB/T 30389-2013 The determination of the total capsaicin content of chili pepper and its oleoresins by spectrophotometry[S]. Beijing: The All-China General Supply and Marketing Cooperative Association, 2013.
[12] 中国国家标准化管理委员会. GB/T 40348-2021 植物源产品中辣椒素类物质的测定 液相色谱-质谱/质谱法[S]. 北京: 全国生化检测标准化技术委员会, 2021 Standardization Administration of China. GB/T 40348-2021 The determination of capsaicin species in plant-derived products by liquid chromatography-mass spectrometry/mass spectrometry method[S]. Beijing: National Technical Committee for Standardization of Biochemical Testing, 2021.
[13] 常晓轲, 张强, 韩娅楠, 等. 不同类型辣椒中辣椒素含量测定及辣度分析[J]. 中国瓜菜,2019,32(9):30−33. [CHANG X K, ZHANG Q, HAN Y N, et al. Analysis of capsaicin in different types of pepper[J]. Chinese Melon and Vegetables,2019,32(9):30−33. CHANG X K, ZHANG Q, HAN Y N, et al. Analysis of capsaicin in different types of pepper [J]. Chinese Melon and Vegetables, 2019, 32(9): 30-33.
[14] 胡海, 陈季旺, 莫加利, 等. 酱卤鸭制品辣度HPLC测定法的前处理条件优化[J]. 武汉轻工大学学报,2018,37(4):1−7. [HU H, CHEN J W, MOGALI, et al. Optimization of pretreatment conditions for HPLC determination of pickled duck products[J]. Journal of Wuhan University of Light Industry,2018,37(4):1−7. doi: 10.3969/j.issn.2095-7386.2018.04.001 HU H, CHEN J W, MOGALI, et al. Optimization of pretreatment conditions for HPLC determination of pickled duck products [J]. Journal of Wuhan University of Light Industry, 2018, 37(4): 1-7. doi: 10.3969/j.issn.2095-7386.2018.04.001
[15] 张鉴清. 电化学测试技术[M]. 北京: 化学工业出版社, 2010: 12-13 ZHANG J Q. Electrochemical testing technique[M]. Beijing: Chemical Industry Press, 2010: 12-13.
[16] YANG X, WU F, CHEN D, et al. An electrochemical immunosensor for rapid determination of clenbuterol by using magnetic nanocomposites to modify screen printed carbon electrode based on competitive immunoassay mode[J]. Sens Actuator B-Chem,2014,192:525−539.
[17] PATRICIA B D, ORLANDO F F, FABIANA A, et al, Electrochemical determination of capsaicin in pepper samples using sustainable paper-based screen-printed bulk modified with carbon black[J]. Electrochimica Acta, 2020, 354: 136628.
[18] 赵鹏程, 高丽娟, 苏英杰, 等. 硼酸活化酚醛树脂保温板制备电极活性炭的工艺优化[J]. 化学工程与装备,2021(11):7−10. [ZHAO P C, GAO L J, SU Y J, et al. Process optimization of electrode activated carbon prepared by boric acid-activated phenolic resin insulation board[J]. Chemical Engineering and Equipment,2021(11):7−10. ZHAO P C, GAO L J, SU Y J, et al. Process optimization of electrode activated carbon prepared by boric acid-activated phenolic resin insulation board [J]. Chemical Engineering and Equipment, 2021(11): 7-10.
[19] 吕宗泽. 碳电极材料定点活化制备及其结构与电化学性能研究[D]. 哈尔滨: 东北林业大学, 2020 LÜ Z Z. Preparation of carbon electrode materials and their structure and electrochemical properties[D]. Harbin: Northeastern Forestry University, 2020.
[20] 张洵. 熔融混合盐/碱活化法制备分级多孔碳及其储电性能[D]. 马鞍山: 安徽工业大学, 2020 ZHANG X. Preparation of graded porous carbon and their electrical storage properties by molten mixed salt/alkali activation method[D]. Maanshan: Anhui University of Technology, 2020.
[21] 余欢欢. 双碱活化法制备超级电容器用多孔炭材料[D]. 马鞍山: 安徽工业大学, 2016 YU H H. Porous carbon material for preparing super capacitors by double alkali activation method[D]. Maanshan: Anhui University of Technology, 2016.
[22] 金赛燕, 顾春川, 李小平. 复合活化修饰电极示差脉冲伏安法同时测定尿液中的多巴胺和尿酸[J]. 中国卫生检验杂志,2021,31(7):836−840. [JIN S Y, GU C C, LI X P. Dopamine and uric acid in urine were measured by composite activation-modified electrode[J]. Chinese Journal of Health Inspection,2021,31(7):836−840. JIN S Y, GU C C, LI X P. Dopamine and uric acid in urine were measured by composite activation-modified electrode [J]. Chinese Journal of Health Inspection, 2021, 31 (7): 836-840.
[23] 郑霄, 陈苏靖, 李芳芳, 等. 基于活化铅笔芯电极的扑热息痛电化学传感器[J]. 分析科学学报,2020,36(1):13−18. [ZHENG X, CHEN S J, LI F F, et al. Paracetamol electrochemical sensor based on an activated pencil-lead electrode[J]. Journal of Analytical Sciences,2020,36(1):13−18. ZHENG X, CHEN S J, LI F F, et al. Paracetamol electrochemical sensor based on an activated pencil-lead electrode[J]. Journal of Analytical Sciences, 2020, 36(1): 13-18.
[24] XU B. Electrochemical determination of capsaicinoids content in soy sauce and pot-roast meat products based on glassy carbon electrode modified with β-cyclodextrin/carboxylated multi-wall carbon nanotubes[J]. Foods,2021,10:1743. doi: 10.3390/foods10081743
[25] GU Q H, CHEN X G, LU C Q, et al. Electrochemical determination of capsaicinoids content in soy sauce and pot-roast meat products by glassy carbon electrode modified with MXene/PDDA-carbon nanotubes/β-cyclodextrin[J]. Food Control,2022,138:109022. doi: 10.1016/j.foodcont.2022.109022
[26] 王长芹, 徐海红, 吴守国. 活化玻碳电极直接测定注射液多巴胺的含量[J]. 药物分析杂志,2007(7):968−972. [WANG C Q, XU H H, WU S G. The content of injection dopamine was directly measured by an activated glass carbon electrode[J]. Journal of Drug Analysis,2007(7):968−972. WANG C Q, XU H H, WU S G. The content of injection dopamine was directly measured by an activated glass carbon electrode[J]. Journal of Drug Analysis, 2007(7): 968-972.
[27] 李金金, 王学亮, 郭宪厚, 等. 磷酸盐活化玻碳电极应用于肾上腺素的伏安测定[J]. 理化检验(化学分册),2012,48(7):766−769. [LI J J, WANG X L, GUO X H, et al. Phosphate-activated glass carbon electrodes were used for voltammetry of adrenaline[J]. Physical and Chemical Test (Chemical Book),2012,48(7):766−769. LI J J, WANG X L, GUO X H, et al. Phosphate-activated glass carbon electrodes were used for voltammetry of adrenaline[J]. Physical and Chemical Test (Chemical Book), 2012, 48(7): 766-769.
[28] 马榕, 张文坤, 乔雅雪, 等. 微波法合成的ZnS/RGO纳米材料对核黄素的电化学检测[J/OL]. 山西大学学报(自然科学版): 1−8[2022-06-06]. http://kns.cnki.net/kcms/detail/14.1105.N.20220511.2228.003.html. MA R, ZHANG W K, QIAO Y X, et al. Electrochemical detection of riboflavin by ZnS/RGO nanomaterials synthesized by microwave method[J/OL]. Journal of Shanxi University (Natural Science Edition): 1−8 [2022-06-06]. http://kns.cnki.net/kcms/detail/14.1105.N.20220511.2228.003.html
[29] ELENA D L Z, LUZ M T R, ANTONIO M R, et al. Study of electrochemical determination of capsaicin and dihydrocapsaicin at carbon paste electrodes modified by β-cyclodextrin[J]. Journal of Electroanalytical Chemistry,2018,814:174−183. doi: 10.1016/j.jelechem.2018.02.055
[30] GUZEL Z, ENDZHE Z, ALIYA S, et al. Voltammetric determination of capsaicin using CeO2-surfactant/SWNT-modified electrode[J]. Arabian Journal of Chemistry, 2020, 13(1): 1624−1632.
[31] KORBUA C, CHRISTOPHER B M, STANISLAV V S, et al. Optimising carbon electrode materials for adsorptive stripping voltammetry[J]. Applied Materials Today,2017,7:60−66. doi: 10.1016/j.apmt.2017.02.003
[32] 吕文静. 辣椒素类物质的电化学检测新方法研究及应用[D]. 重庆: 重庆医科大学, 2019 LÜ W J. Research and application of a new method for electrochemical detection of capsaicin substances[D]. Chongqing: Chongqing Medical University, 2019.
[33] DA SILVA ANTONIO A, WIEDEMANN L S M, DA VEIGA JUNIOR V F, Food pungency: The evolution of methods for capsaicinoid analysis[J]. Food Anal Methods, 2019, 12: 1327−1345.
[34] YUN N, LU C Q, SUN T, et al. High sensitivity detection of capsaicin in red pepper oil based on reduced graphene oxide enhanced by β-cyclodextrin[J]. Food Analytical Methods,2022,16:318−329.






 下载:
下载:









 下载:
下载:



