Optimization of Ultrasonic Extraction Combined with Ultrafiltration for Purification of Mulberry Leaf Protein and Its Nutritional Evaluation
-
摘要: 以桑叶为原料研究了超声提取联合超滤法制备桑叶蛋白营养成分的工艺。采用响应面试验对超声辅助提取桑叶蛋白制备桑叶蛋白粗提液的工艺条件进行优化,桑叶蛋白粗提液通过超滤纯化、浓缩桑叶蛋白成分,并利用正交试验优化超滤工艺中膜通量。参考GB 5009.124-2016食品安全国家标准食品中方法测定超声提取联合超滤法制备固体粗蛋白的氨基酸组成成分,并进一步进行营养价值分析。结果表明,液料比为29:1 mL/g,360 W超声15 min,42 ℃水浴加热34 min为最适宜的提取条件,蛋白得率可达5.56%;采用超滤膜超滤处理桑叶蛋白粗提液,最优纯化条件为操作压力:0.6 MPa,粗提液稀释1倍,浓缩比4:1,在此条件下,膜通量为21.40 L/m2·h,所得固体蛋白纯度可达35%以上;超声提取联合超滤技术制备的固体桑叶蛋白总氨基酸含量为22.22 g/100 g,且必需氨基酸占总氨基酸的比值、必需氨基酸占非必需氨基酸的比值均高于粮农组织/世界卫生组织成人模式数值。超声提取联合超滤法可有效提取、纯化桑叶中的蛋白成分,所制取的桑叶蛋白具备良好的营养价值,可满足成人营养需求。Abstract: This paper discussed the preparation of protein nutrients from mulberry leaves by ultrasonic extraction combined with ultrafiltration technology. In order to obtain the optimal conditions for ultrasonic assisted extraction of mulberry leaf protein, we used response surface methodology to optimize the preparation of crude extract of mulberry leaf protein. In addition, we used ultrafiltration technology to purify and concentrate the protein components in the crude protein extract of mulberry leaves, and optimized the ultrafiltration membrane flux by orthogonal test. The amino acid components of solid crude protein prepared by ultrasonic extraction coupled with ultrafiltration technology were determined by referring to the method in GB 5009.124-2016 National Standard for Food Safety and further analyzed its nutritional value. The results showed that the optimal extraction conditions were as follows: The ratio of liquid-material ratio was 29:1 mL/g, ultrasonic extraction at 360 W for 15 min, and heating in water bath at 42 ℃ for 34 min, and the protein yield was up to 5.56%. Using the ultrafiltration technology to purify and concentrate the protein components in the crude protein extract, the optimal purification conditions were as follows: Operating pressure 0.6 MPa, diluting the crude extract by 1 time, and concentration ratio: 4:1. Under these conditions, the membrane flux was 21.40 L/m2·h, and the purity of solid protein was over 35%. The total amino acid content of solid mulberry leaf protein prepared by ultrasonic extraction coupled with ultrafiltration technology was 22.22 g/100 g, and the ratio of essential amino acids to total amino acids and the ratio of essential amino acids to non-essential amino acids were higher than the FAO/WHO adult model values. It could effectively extract and purify protein components from mulberry leaves by ultrasonic extraction combined with ultrafiltration technology. The prepared mulberry leaf proteins have good nutritional value and might meet the nutritional requirements of adults.
-
Keywords:
- mulberry leaf /
- protein /
- ultrasonic extraction /
- ultrafiltration /
- purification
-
我国桑叶资源丰富且种类多样,但利用率低下,造成大量浪费[1]。据《本草纲目》中记载:桑叶除了具有明目、增发的效果,还能治疗咳嗽[2]。桑叶作为药食同源的天然植物[3],含有多种天然活性成分,如蛋白、黄酮、多糖、生物碱等[4]。桑叶蛋白作为“绿色植物蛋白”浓缩物,与动物肌肉所含蛋白不同,不含胆固醇,是一种绿色可再生蛋白资源之一。不仅如此,桑叶蛋白含有丰富氨基酸,且氨基酸组成比例合理[5],具有较高的营养价值,可添加到食品工业中[6]。研究开发利用桑叶蛋白并研发出产品有利于提高该资源的附加值。探索桑叶蛋白的高效生产加工方法,可推动提升桑叶蛋白品质,进而使桑叶蛋白应用更广泛。因此,研究制备较高纯度且具有较高营养价值的桑叶蛋白具有良好的应用前景。
已报道的植物叶蛋白提取方法有水溶液提取法[7-8]、有机溶剂提取法[9]、超声提取法[10]和酶法[11]等。其中,超声提取法是指采用超声技术打破植物细胞壁使细胞壁内蛋白溶出,该法具有绿色环保、高效提取和操作简单等优势。纯化植物叶蛋白方法以酸沉、酸热和盐析等方法为主[12]。酸沉和酸热法沉淀蛋白不仅在操作过程中pH难把控,而且使用大量酸对环境有害;盐析法纯化蛋白的工艺要脱盐处理使工艺变得繁琐[13]。而使用膜分离纯化工艺可以避免了引入酸、碱或无机盐等化学试剂,而且工艺操作简单不需要高温[14]。此外,膜分离技术还具有便于与其他工艺联用、易于放大、可实现水循环利用等优点[15-16]。膜分离技术现已广泛应用于食品行业、天然产物分离、药物纯化浓缩等领域[17-19]。有研究发现,采用超声提取联合膜分离技术纯化甘草酸[20]和水苏糖[21]等天然产物,工艺具有高效简单且成本较低的优势。可见,以超声提取联合膜分离技术应用于制备桑叶蛋白,有望得到高纯度且营养价值较高的产品。
本研究以桑叶为原料,采用超声提取制备桑叶蛋白粗提液,桑叶蛋白粗提液经过超滤膜纯化后得到固体粗蛋白。采用响应面优化绿色环保的超声水提法的工艺条件,进一步采用正交试验优化超滤纯化桑叶蛋白工艺,研究液料比、加热温度和加热时间等因素对桑叶蛋白得率的影响,并在保证产品纯度基础上,探究采用不同操作压力、粗提液稀释倍数和浓缩比在超滤过程中最高通量。本研究有助于推动合理高效地利用过剩的桑叶资源,提高桑叶资源产品附加值,以期用绿色环保的方法为制备优质植物蛋白提供技术指导。
1. 材料与方法
1.1 材料与仪器
新鲜桑叶 购于2021年4月,立即晾干备用,产自北京市;盐酸、硫酸铵 均为分析纯,北京蓝弋化工产品有限责任公司;考马斯亮蓝试剂盒 南京建成生物研究所;聚丙烯腈(PAN)超滤膜 杭州九龄科技有限公司;去离子水 实验室自制。
超滤杯 杭州九龄科技有限公司;TG16离心机 易德诚天地科技有限公司;ATX124电子天平 日本岛津公司;SHJ-1A水浴恒温磁力搅拌器 金坛市美特仪器制造有限公司;UV759CRT紫外可见分光光度计 上海佑科仪器仪表有限公司;KQ-300E超声波清洗器 昆山超声仪器有限公司;FW-100破碎机 天津市泰斯特仪器有限公司;FD-1A-50冷冻干燥 上海比朗仪器制造有限公司:L8900氨基酸分析仪 英国百康公司。
1.2 实验方法
1.2.1 桑叶蛋白提取方法
新鲜桑叶经漂洗,自然晾干,粉碎后过60目筛备用。称取1 g桑叶粉,按液料比15:1~35:1 mL/g加入去离子水,超声处理0~30 min后,在30~50 ℃水浴加热10~60 min。离心分离混合物,收集粗提液。采用考马斯亮蓝法测定溶液中蛋白浓度[22],并按公式(1)计算桑叶蛋白得率。
桑叶蛋白得率(%)=C1V1M桑叶×100 (1) 式中,C1指粗提液桑叶蛋白浓度,mg/mL;V1指粗提液体积,mL;M桑叶指称取桑叶粉的质量,mg。
1.2.2 桑叶蛋白提取工艺单因素实验
1.2.2.1 液料比对蛋白得率的影响
液料比分别为15:1、20:1、25:1、30:1和35:1 mL/g时,在超声处理15 min、40 ℃加热40 min,冷却至室温后5000 r/min离心10 min,得到桑叶蛋白粗提液。
1.2.2.2 加热温度对蛋白得率的影响
液料比30:1 mL/g,超声15 min,分别加热不同温度30、35、40、45和50 ℃加热40 min,冷却至室温后5000 r/min离心10 min,得到桑叶蛋白粗提液。
1.2.2.3 加热时间对蛋白得率的影响
液料比30:1 mL/g,超声15 min,40 ℃加热不同时间10、20、30、40、50和60 min,冷却至室温后5000 r/min离心10 min,得到桑叶蛋白粗提液。
1.2.2.4 超声时间对蛋白得率的影响
液料比30:1 mL/g,不同超声时间0、10、15、20和30 min,40 ℃加热40 min,冷却至室温后5000 r/min离心10 min,得到桑叶蛋白粗提液。
1.2.2.5 响应面设计试验
基于单因素实验结果,优选液料比(A)、加热温度(B)和加热时间(C)为自变量,桑叶蛋白得率(Y)作为响应值。响应面试验因素设计与水平见表1。
表 1 响应面试验因素与水平设计Table 1. Response surface experimental factors and level design水平 因素 液料比A(mL/g) 加热温度B(℃) 加热时间C(min) −1 25:1 35 30 0 30:1 40 40 1 35:1 45 50 1.2.3 桑叶蛋白纯化方法
1.2.3.1 桑叶蛋白纯化方法的筛选
超滤法:利用超滤杯在操作压力:0.55 MPa的条件下,超滤处理30 mL粗提液(不稀释)。浓缩比为5:1,收集透过液和截留液。记录超滤时间t和透过液体积V2,根据公式(2)计算膜通量。截留液为桑叶蛋白浓缩液,截留液冷干处理得到固体粗蛋白,根据公式(3)计算蛋白纯度。
膜通量(L/m2⋅h)=LAt×100 (2) 蛋白纯度(%)=C1V1−C2V2M冷干×100 (3) 式中,C1指粗提液桑叶蛋白浓度,mg/mL;C2指纯化后透过液或上清液中桑叶蛋白浓度,mg/mL;V1指未经过处理的粗提液体积,mL;V2指纯化后透过液或上清液体积,mL;M冷干指称取冷干后粗蛋白的质量,mg;L指透过液体积,L;A指膜的有效面积,m2;t指超滤时间,h。
酸沉法:量取30 mL粗提液逐滴加入稀盐酸调至pH3.5,离心并收集上清液,离心后的沉淀经冷干处理得到固体粗蛋白[23]。
酸热法:量取30 mL粗提液在75 ℃下水浴处理15 min,再逐滴加入稀盐酸至pH3,静置后离心。离心并收集上清液,离心后的沉淀经冷干处理得到固体粗蛋白[23]。
盐析法:量取30 mL粗提液调整溶液饱和度至65%,低温静置过夜,离心,收集好上清液,离心后的沉淀透析后的样品冷干处理得到固体桑叶蛋白[23]。对上述不同纯化方法,分别以公式(3)和(4)计算蛋白纯度和蛋白保留率,同一纯化方法至少重复三次并计算蛋白纯度和蛋白保留率平均值,其中蛋白保留率计算公式如下:
蛋白保留率(%)=C1V1−C2V2C1V1×100 (4) 式中,C1指粗提液桑叶蛋白浓度,mg/mL;C2指纯化后透过液或上清液中桑叶蛋白浓度,mg/mL;V1指未经过处理的粗提液体积,mL;V2指纯化后透过液或上清液体积,mL。
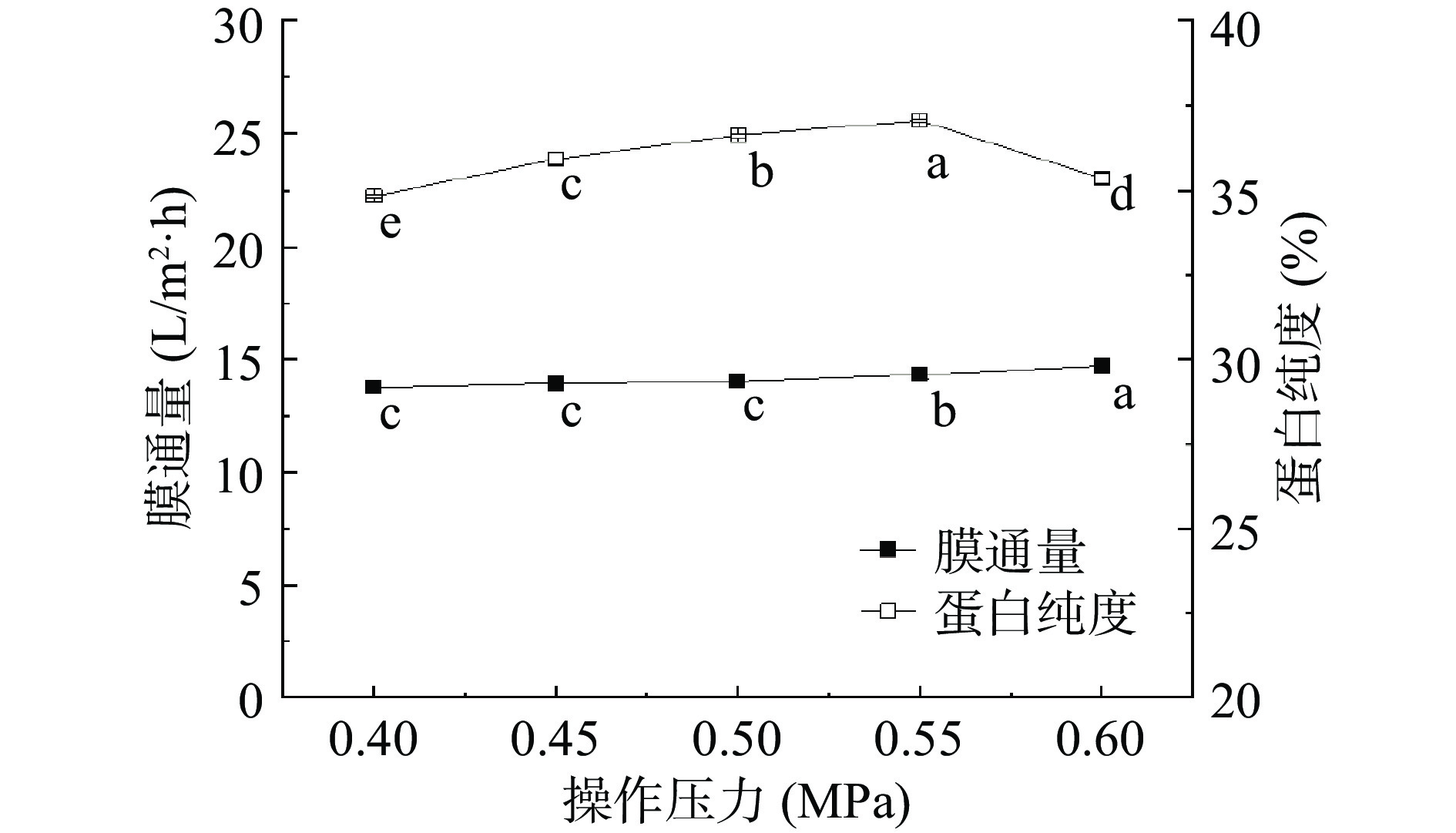
1.2.3.2 操作压力对膜通量和蛋白纯度的影响
取30 mL粗提液,设置不同的操作压力0.40、0.45、0.50、0.55和0.60 MPa,粗提液稀释0.5倍,浓缩比5:1。收集透过液和截留液,截留液冷干处理得到固体桑叶蛋白。
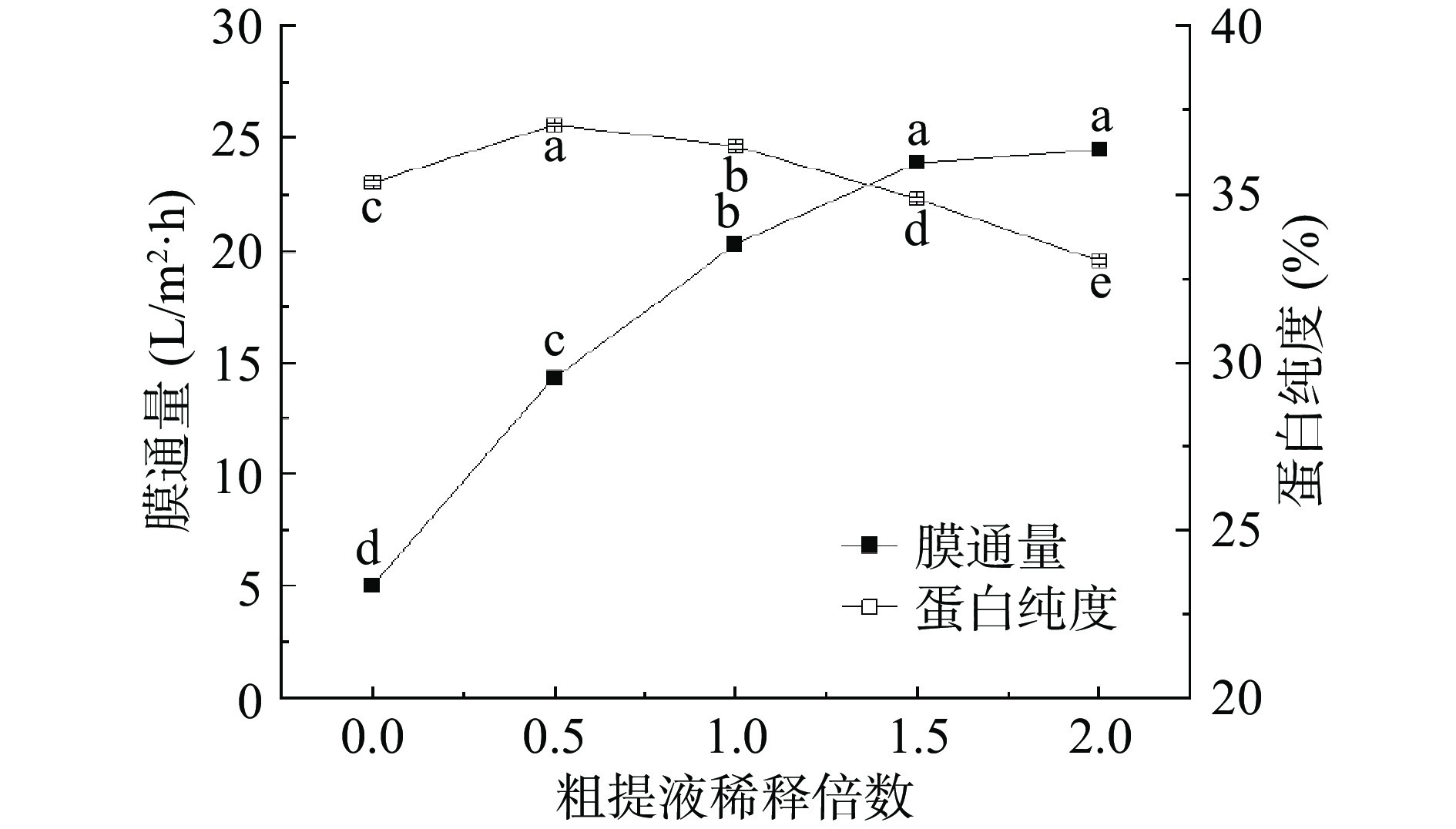
1.2.3.3 粗提液稀释倍数对膜通量和蛋白纯度的影响
粗提液稀释倍数解释:以100 mL为例,稀释倍数0、0.5、1、1.5、2倍是指粗提液加水0、50、100、150和200 mL。取30 mL粗提液,设置超滤操作压力0.55 MPa,粗提液稀释0、0.5、1、1.5和2倍,浓缩比5:1。收集透过液和截留液,截留液冷干处理得到固体桑叶蛋白。
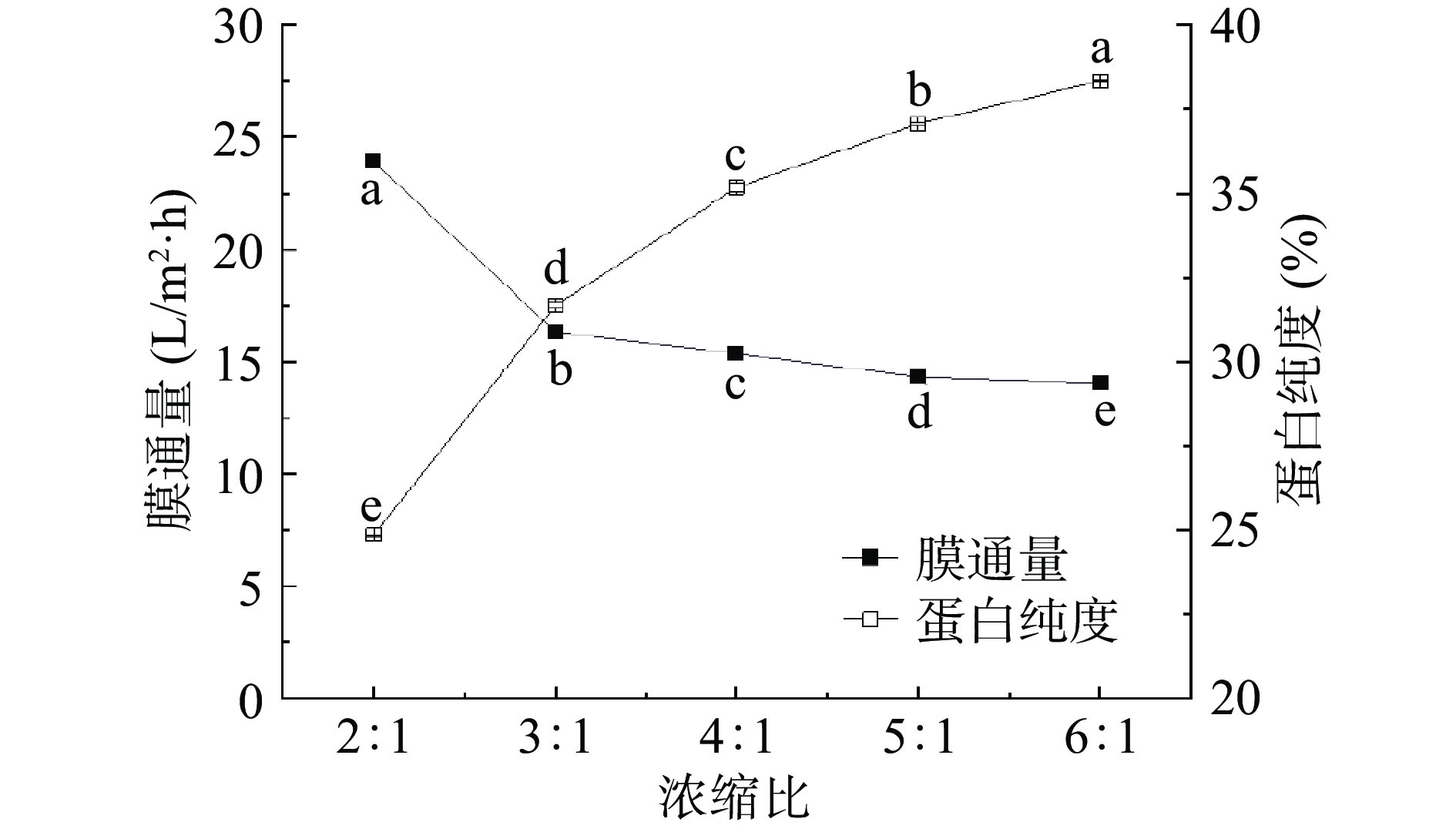
1.2.3.4 浓缩比对膜通量和蛋白纯度的影响
浓缩比:是指粗提液与截留液的体积比,以粗提液100 mL为例,浓缩比2:1、3:1、4:1、5:1、6:1是指超滤得到的截留液体积分别为:50、33、25、20和17 mL。取30 mL粗提液,设置超滤操作压力0.55 MPa,粗提液稀释0.5倍,浓缩比2:1、3:1、4:1、5:1和6:1。收集透过液和截留液,截留液冷干处理得到固体桑叶蛋白。
1.2.3.5 正交试验
在超滤纯化桑叶蛋白单因素的基础上,以保证蛋白纯度35%以上为前提,以操作压力、粗提液稀释倍数和浓缩比为因素,膜通量为考察指标,进行L9(34)正交试验,正交试验因素水平如表2所示。
表 2 正交试验因素与水平Table 2. Factors and levels of orthogonal experiment水平 因素 A操作压力(MPa) B粗提液稀释倍数 C浓缩比 −1 0.5 0 4:1 0 0.55 0.5 5:1 1 0.6 1 6:1 1.2.4 氨基酸含量的测定
参考GB 5009.124-2016食品安全国家标准食品中方法测定桑叶粗蛋白中的17种蛋白氨基酸含量(g/100 g)。氨基酸比值(ratio of amino acid,RAA)、氨基酸比值系数(ratio coefficient,RC)以及氨基酸比值系数分(score of ratio coefficient,SRC)计算公式如下:
RAA=待测蛋白质某必需氨基酸含量WHO/FAO模式中相应的必需氨基酸含量 (5) RC=RAA¯RC (6) SRC=100×(1−CV) (7) CV=√∑ni=1(RCi−¯RC)2n−1¯RC (8) 式中,CV(coefficient of variation),是RC的变异系数;RCi表示所测9种必需氨基酸中某一必需氨基酸的RC值;各氨基酸量均以g/100 g。
1.3 数据处理
桑叶蛋白提取和纯化实验均重复3次,数据利用平均值的形式表示,桑叶蛋白提取和纯化单因素实验数据采用Excel 2016和Origin 2021软件分析并制图,单因素差异性分析结果由IBM SPSS Statistics 25.0软件处理。Design-Expert 8.0.6软件设计分析提取桑叶蛋白实验的响应面,进一步采用Origin 2021制图,桑叶蛋白纯化正交试验数据采用IBM SPSS Statistics 25.0软件处理。
2. 结果与分析
2.1 桑叶蛋白提取单因素实验结果
2.1.1 液料比对桑叶蛋白得率的影响
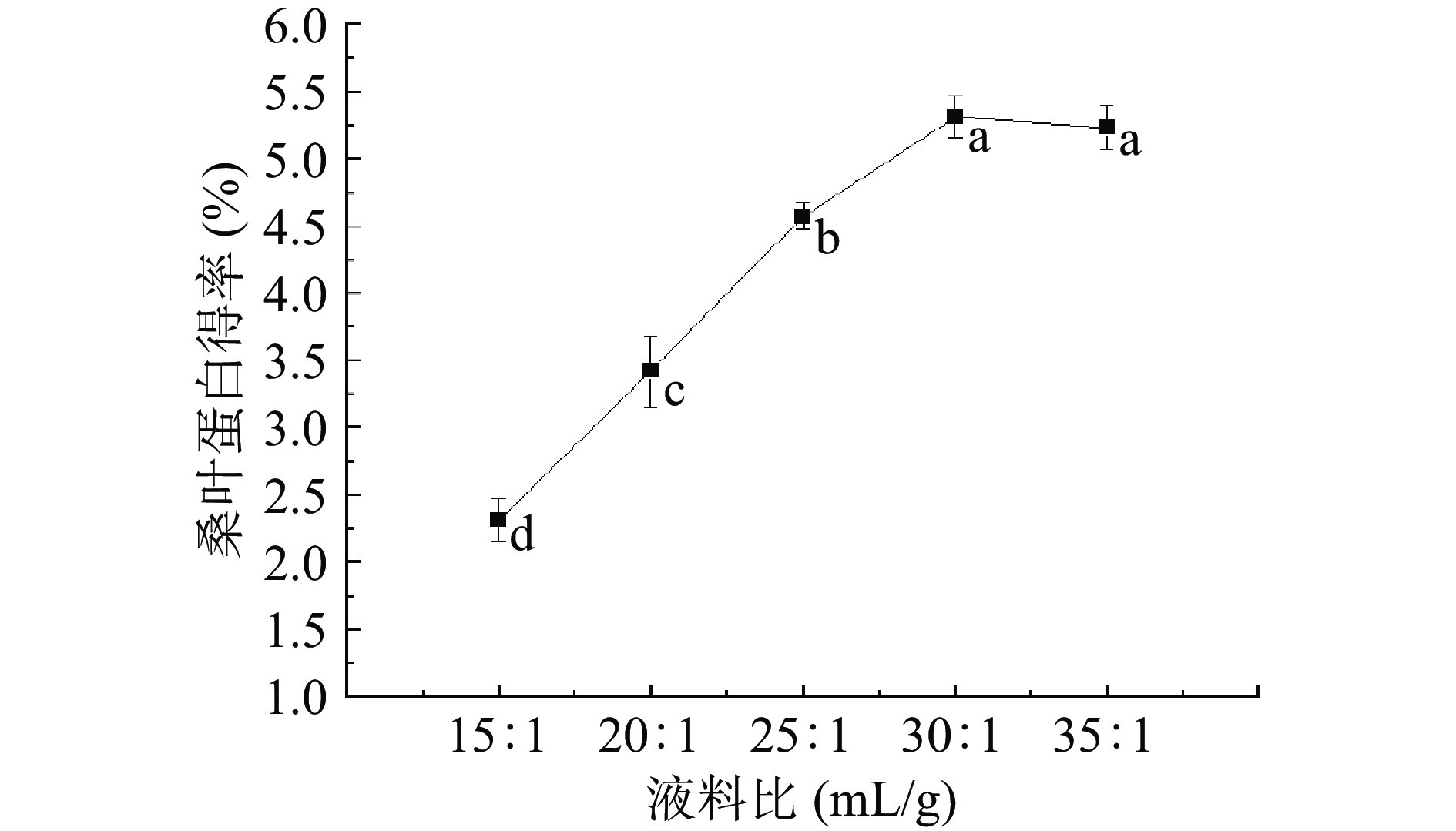
桑叶蛋白得率如图1所示,液料比15:1~30:1 mL/g时,桑叶蛋白得率由2.31%上升到5.31%,液料比为30:1 mL/g时达到最好提取效果。可能液料比的增加,有助于更多蛋白与水充分接触,利于蛋白溶出,提高桑叶蛋白得率。当液料比为30:1 mL/g时,为5.31%;当液料比增加到35:1 mL/g时,桑叶蛋白得率稍有下降。桑叶蛋白得率在液料比30:1 mL/g时达到最好的提取效果,继续增加液料比也没有对桑叶蛋白得率有显著提高[24]。对于液料比单因素实验结果经过SPSS处理可知P<0.05,发现液料比的变化对桑叶蛋白得率存在极显著差异,因此选取液料比25:1、30:1和35:1 mL/g作为进一步响应面试验优化的条件。
2.1.2 加热温度对桑叶蛋白得率的影响
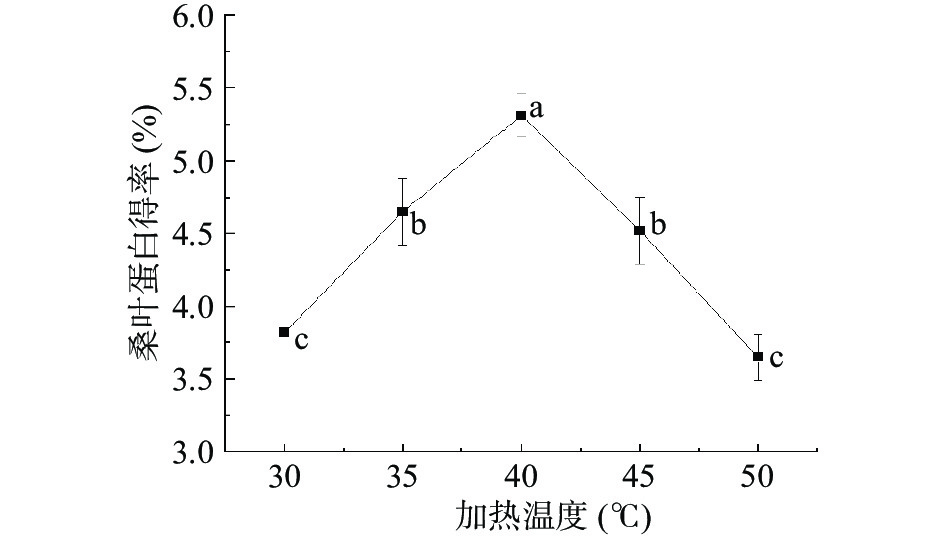
桑叶蛋白得率见图2。在30~50 ℃范围内,升高温度,桑叶蛋白的得率呈现出先升高后降低的趋势。当加热温度范围在30~40 ℃时,桑叶蛋白得率不断升高,且加热温度40 ℃时桑叶蛋白得率达到最高,为5.31%,加热温度超过40 ℃,桑叶蛋白得率开始下降,50 ℃时桑叶蛋白得率相较于40 ℃时下降了1.66%。结果表明,适当的升高温度有助于提高桑叶蛋白的溶解度,桑叶蛋白得率升高;但温度过高会导致部分蛋白失活,继而降低了桑叶蛋白得率。相关研究人员在探究提取桑叶蛋白的最优加热温度时,也得到了类似的结论[25-26]。对于加热温度单因素实验结果经过SPSS处理可知P<0.05,发现加热温度的变化对桑叶蛋白得率影响存在极显著差异,因此选取加热温度35、40和45 ℃作为进一步响应面试验优化的条件。
2.1.3 加热时间对桑叶蛋白得率的影响
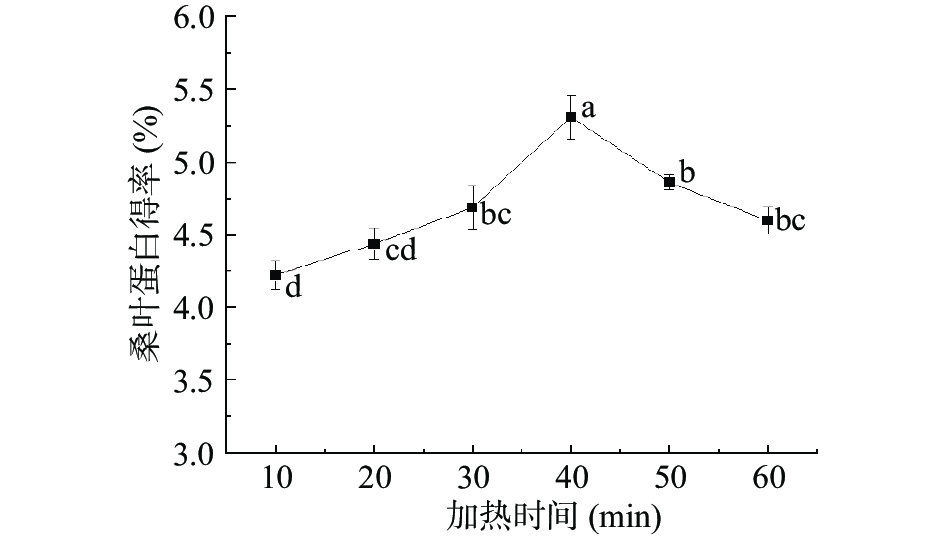
桑叶蛋白得率如图3所示,加热时间在10~60 min范围内,桑叶蛋白得率呈现出先升高后下降的变化趋势。加热时间为10~40 min时,桑叶蛋白得率随加热时间的延长而升高,桑叶蛋白得率由4.22%升到5.31%,水浴40 min时,桑叶蛋白得率达到最高,为5.31%。可能是加热时间太短,蛋白质溶解不充分。继续加热提取,桑叶蛋白得率又出现呈现下降的趋势,桑叶蛋白得率由5.31%降到4.60%。相关研究证实,加热时间由9 min延长到11 min,柱花草叶蛋白得率降低了2.32%[27]。加热时间太长可能导致桑叶中其他杂质也被提取出来,增加蛋白与非蛋白成分共沉机会。对于加热时间单因素实验结果经过SPSS处理可知P<0.05,发现加热时间的延长对桑叶蛋白得率存在极显著差异,因此选取加热时间30、40和50 min作为进一步响应面试验优化的条件。
2.1.4 超声时间对桑叶蛋白得率的影响
桑叶蛋白得率如图4所示,在超声时间0~15 min(0 min表示没有超声处理)桑叶蛋白得率均随超声时间延长而增大,桑叶蛋白得率由4.59%升到5.31%。继续超声到20~30 min有发现略微下降。在一定范围内增加超声时间,有利于蛋白分子溶胀充分,从而使桑叶蛋白得率增加。有研究发现,桑叶蛋白得率在超声处理22 min时比超声处理18 min时降低了约0.4%,这可能是由于超声辅助法提取桑叶蛋白时,超声时间过长对蛋白的内部结构有一定的破坏作用[28]。对于超声时间0~30 min单因素实验,SPSS处理得到P<0.05,即超声时间的变化对于桑叶蛋白得率存在极显著差异,进一步分析图4中超声时间10、15和20 min这三个数据点,结果发现P>0.05,说明超声时间在10~20 min内的变化对于桑叶蛋白得率影响不显著。对比液料比、加热温度和加热时间单因素实验结果,超声时间对于桑叶蛋白得率的影响不大。因此选取液料比、加热温度和加热时间这三个因素通过响应面试验进一步优化。
2.2 响应面优化提取桑叶蛋白试验
2.2.1 响应面设计试验
响应面优化提取桑叶蛋白实验结果如表3所示,得出液料比(A)、加热温度(B)和加热时间(C)对桑叶蛋白得率(Y)的影响经过拟合建立二次响应面回归模型为:Y=+5.44−0.23A+0.11B−0.36C+0.093AB+0.42AC−0.52BC−0.90A2−0.50B2−0.57C2。该模型R2为97.27%,R2Adj为93.76%,说明该方程模型拟合性良好,该模型的P值<0.0001且F值=27.73,该模型拟合达到极显著差异水平。R2Pred=0.8700,说明可以采用这个模型预测和分析桑叶蛋白得率实验结果。根据表4方差分析可知,液料比、加热温度和加热时间的F值分别为10.95、2.48和26.34,影响桑叶蛋白得率的显著性大小:加热时间(C)>液料比(A)>加热温度(B)。各因素中A、C和交互项中AC、BC、以及二次项A2、B2、C2均对桑叶蛋白得率影响达到显著或以上水平,仅有B项和交互项AB不显著。
表 3 响应面试验结果Table 3. Response surface experimental results实验号 A液料比
(mL/g)B加热温度
(℃)C加热时间
(min)Y桑叶蛋白得率
(%)1 30:1 40 40 5.50±0.21 2 30:1 40 40 5.33±0.23 3 30:1 45 30 5.30±0.18 4 35:1 40 30 3.62±0.12 5 25:1 45 40 4.34±0.09 6 30:1 40 40 5.10±0.20 7 35:1 45 40 4.12±0.16 8 30:1 45 50 3.50±0.07 9 35:1 35 40 3.56±0.11 10 30:1 40 40 5.67±0.13 11 25:1 35 40 4.15±0.14 12 30:1 35 30 4.22±0.03 13 30:1 35 50 4.45±0.12 14 25:1 40 30 4.97±0.09 15 25:1 40 50 3.49±0.21 16 30:1 40 40 5.60±0.12 17 35:1 40 50 3.80±0.11 表 4 回归方程的方差分析Table 4. Analysis of variance of regression equation来源 平方和 自由度 均方 F值 P值 模型 9.75 9 1.08 27.73 0.0001** A 0.43 1 0.43 10.95 0.0130* B 0.097 1 0.097 2.48 0.1595 C 1.03 1 1.03 26.34 0.0013** AB 0.034 1 0.034 0.88 0.3805 AC 0.69 1 0.69 17.63 0.0040** BC 1.03 1 1.03 26.36 0.0013** A2 3.39 1 3.39 86.78 <0.0001** B2 1.05 1 1.05 26.93 0.0013** C2 1.38 1 1.38 35.31 0.0006** 残差 0.27 7 0.039 失拟项 0.064 3 0.021 0.41 0.7580 纯误差 0.21 4 0.052 总误差 10.03 16 注:*差异显著,P<0.05;**差异极显著,P<0.01. 2.2.2 各因素交互作用分析
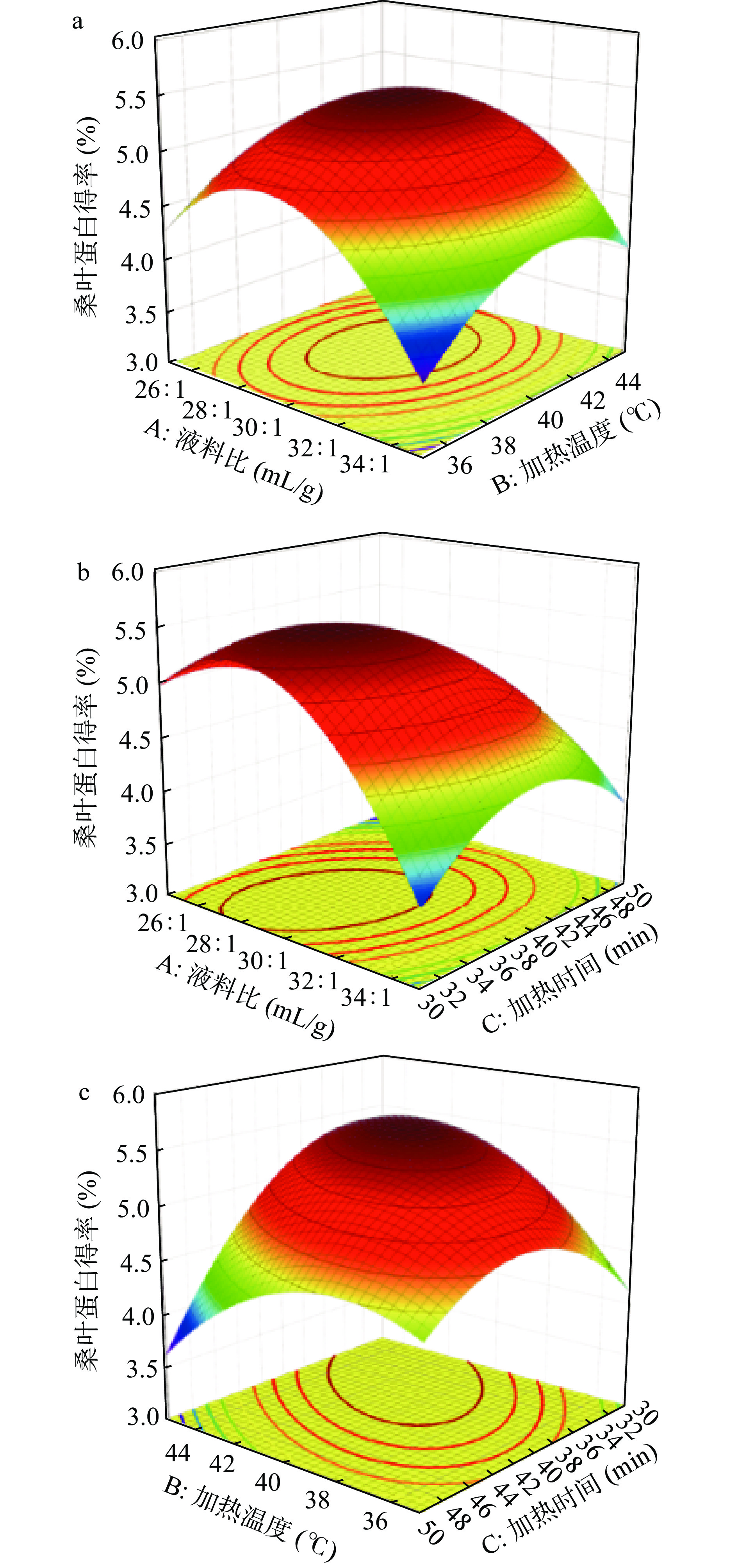
如图5所示,可以看到液料比(A)、加热温度(B)和加热时间(C)各因素对桑叶蛋白得率影响的响应面曲线图。根据曲线坡度的陡峭程度分析两个因素间交互影响大小。由图5c可以看出,响应面中加热温度和加热时间(BC)曲线坡度最陡;由图5a可以看出,响应面中液料比和加热温度(AB)曲线坡度较平缓。综上所述,加热温度和加热时间(BC)之间对桑叶蛋白得率的交互影响最大,液料比和加热时间(AC)交互作用次之,液料比和加热温度(AB)之间交互作用最小。
2.2.3 验证性实验
桑叶蛋白得率最优工艺条件通过Design Expert 8.0.6预测可得:液料比28.78:1 mL/g、加热温度41.99 ℃和加热时间34.12 min,在此条件下,桑叶蛋白得率为5.60%。为了实验方便,将实际实验条件调整为液料比29:1 mL/g、加热温度42 ℃和加热时间34 min。对最佳实验工艺条件进行验证,重复三次实验,得到桑叶蛋白得率平均值为5.56%±0.06%,与预测值误差0.714%,说明该模型可以较准确的预测桑叶蛋白实际得率。
2.3 桑叶蛋白纯化单因素实验
根据曲面响应法优化后的最优蛋白提取条件制备桑叶粗提液,以蛋白粗提液为原料对桑叶蛋白纯化工艺进行优化。
2.3.1 不同纯化方法的对桑叶蛋白纯化效果
对桑叶粗提液采用酸沉法、酸热法、盐析法和超滤法纯化除杂。根据公式(3)和(4)分别计算不同纯化方法制备的桑叶蛋白纯度和蛋白保留率。如表5所示,酸沉法、酸热法和盐析法、超滤法四个蛋白样品的纯度分别为24.53%、30.32%、33.94%和35.35%,且超滤法与酸沉法和酸热法制备得到蛋白纯度具有显著差异(P<0.05),超滤法可以不引入其他酸、碱以及无机盐的试剂,不会有试剂残留的风险,所以超滤法制备的桑叶蛋白纯度高于酸沉法和盐析法等其他方法制备的桑叶蛋白。蛋白保留率分别为83.60%、54.03%、54.85%和95.42%。与酸热和盐析法相比,超滤法制备桑叶的蛋白保留率最高,蛋白保留率具有显著性差异(P<0.05)。说明粗提液中绝大部分的桑叶蛋白浓缩在超滤膜的一侧,工艺中蛋白流失很少。而酸热和盐析法有接近一半的蛋白还在溶液中没有被沉淀出来,蛋白流失严重。此外,酸沉和酸热法沉淀蛋白在操作过程中pH难把控,而且使用大量酸对环境有害,盐析法纯化蛋白的工艺要脱盐处理使工艺变得繁琐。而超滤法纯化蛋白一方面避免了引入酸、碱或无机盐等化学试剂,另一方面工艺操作简单不需要高温。综上所述,选择超滤法制备的桑叶蛋白进行后续优化研究。
表 5 不同纯化方法纯化桑叶蛋白结果Table 5. Results of different protein purification method除杂方法 蛋白纯度(%) 蛋白保留率(%) 酸沉法 24.53±0.33c 83.60±1.85b 酸热法 30.32±0.79b 54.03±0.32c 盐析法 33.94±2.18ab 54.85±1.26c 超滤法 35.35±0.07a 95.42±0.44a 注:同一指标中标有不同字母表示具有显著性差异(P<0.05)。 2.3.2 操作压力对膜通量和蛋白纯度的影响
如图6所示,操作压力在0.4~0.6 MPa范围内,膜通量不断增大,操作压力0.4 MPa时,膜通量最低,为13.76 L/m2·h;操作压力0.6 MPa时,膜通量最高,为14.72 L/m2·h。这可能是因为超滤过程中操作压力的增加,促进推动膜分离过程,从而膜通量不断增大。随着增加操作压力,桑叶蛋白纯度呈现先上升后下降的趋势,当操作压力为0.4~0.55 MPa时,蛋白纯度随着操作压力的提高而增大,蛋白纯度由34.82%上升到37.06%,且0.55 MPa时达到最大值37.06%,这可能是因为适当的增加操作压力有利于小分子杂质[29]如生物碱和低聚糖等透过膜,使蛋白纯度提高;但当压力为0.6 MPa时,蛋白纯度开始下降,这可能由于操作压力过大,对膜孔径内部结构有一定的破坏作用,大于膜孔径的溶质可以透过膜,造成蛋白纯度下降[30]。对于操作压力的单因素实验结果经过SPSS处理发现P值均小于0.01,操作压力对于膜通量和蛋白纯度的影响存在极显著差异。综合考虑产品纯度和超滤过程膜通量,所以选择操作压力0.55 MPa左右进行进一步正交优化膜通量。
2.3.3 粗提液稀释倍数对膜通量和蛋白纯度的影响
如图7所示,随着粗提液稀释倍数增加,膜通量呈现出先上升较快后趋于平缓的趋势,这可能是因为蛋白浓度不断稀释,引起的浓差极化减少,膜通量上升[31]。粗提液稀释倍数0倍(粗提液不稀释)时,膜通量最低,仅5.04 L/m2·h;粗提液稀释倍数2倍时,膜通量最高,达24.48 L/m2·h。而蛋白纯度随着粗提液稀释倍数呈现先增加后降低,粗提液稀释倍数0.5倍时,蛋白纯度处于最大,达37.06%,粗提液稀释倍数0倍时的蛋白纯度低于粗提液稀释倍数0.5时的蛋白纯度,可能是未稀释的粗提液中蛋白浓度高,溶液粘度大,不能进行有效的分离,蛋白纯度降低;继续增加稀释倍数蛋白纯度降低,可能是因为蛋白浓度越来越低,虽然小分子杂质更容易透过膜,小分子蛋白也容易透过膜,导致蛋白纯度变低[32]。对于粗提液稀释倍数的单因素实验结果数据经过SPSS处理发现P值均小于0.01,粗提液稀释不同倍数对于膜通量和蛋白纯度的影响存在极显著差异。仅有粗提液稀释倍数0、0.5和1倍,蛋白纯度达到35%以上,在确保产品质量基础上,考虑优化超滤膜通量。所以选择粗提液稀释倍数0、0.5和1对超滤膜通量进行正交优化。
2.3.4 浓缩比对膜通量和蛋白纯度的影响
如图8所示,随着浓缩比的加大,膜通量先降低较快后下降平缓,浓缩比2:1时,膜通量最高,为23.89 L/m2·h;浓缩比6:1时,膜通量最低14.05 L/m2·h。随着超滤的进行,蛋白大分子被截留,浓度越来越大,溶液粘度增加,膜阻力增加导致通量随之降低[33]。而蛋白纯度随浓缩比的增加而增加,浓缩比2:1时蛋白纯度最低,仅24.86%,浓缩比6:1时蛋白纯度最高,为38.33%。对于浓缩比的单因素实验结果经过SPSS处理发现P值均小于0.05,浓缩比对于膜通量和蛋白纯度的影响存在极显著差异。且仅有浓缩比4:1、5:1和6:1时蛋白纯度达到35%及以上。为确保超滤过程即满足产品纯度35%以上,又能实现较高的通量。所以采用浓缩比4:1、5:1和6:1进一步优化膜通量。
2.4 桑叶蛋白纯化正交试验
在超滤纯化桑叶蛋白单因素的基础上,以保证蛋白纯度35%以上为前提,以操作压力、粗提液稀释倍数和浓缩比为因素,膜通量为考察指标,进行L9(34)正交试验。由表6可知,根据极差R值大小,影响对膜通量的各因素主次顺序:粗提液稀释倍数(B)>浓缩比(C)>液料比(A),最优组合为A3B3C1,即操作压力0.6 MPa,粗提液稀释倍数1倍,浓缩比4:1。在最佳条件下,进行3次平行实验,膜通量平均值为21.40 L/m2·h,蛋白纯度平均值为35.64%,蛋白保留率平均值为95.72%。
表 6 正交试验结果Table 6. Orthogonal results序号 操作压力(A) 粗提液稀释倍数(B) 浓缩比(C) 膜通量
(L/m2·h)1 −1 −1 −1 10.01 2 −1 0 0 14.03 3 −1 1 1 18.58 4 0 −1 1 4.88 5 0 0 −1 16.29 6 0 1 0 20.28 7 1 −1 0 9.60 8 1 0 1 14.45 9 1 1 −1 21.40 k1 14.207 8.163 15.900 k2 13.817 14.923 14.637 k3 15.150 20.087 12.637 R 1.333 11.924 3.263 2.5 超滤法制备桑叶蛋白的氨基酸组成以及平衡性分析
2.5.1 氨基酸组成分析
对上述纯化后纯度为35.64%的样品,进一步进行氨基酸组成分析。测得桑叶蛋白中总氨基酸(TAA)含量22.22 g/100 g,从表7可以看到,桑叶蛋白均含有被检测的17种氨基酸,其中包括7种必需氨基酸和10种非必需氨基酸。桑蛋白氨基酸组成分布均匀,每种氨基酸含量之间差异性较小,但与FAO/WHO成人模式各氨基酸含量较接近。其中苏氨酸、缬氨酸和苯丙+铬氨酸含量均达到甚至高于FAO/WHO成人模式中要求的苏氨酸、缬氨酸和苯丙+铬氨酸含量。其中EAA/TAA为0.41,高于FAO/WHO成人模式EAA/TAA(0.40);EAA/NEAA为0.70,高于FAO/WHO成人模式EAA/NEAA(0.60)。非必需氨基酸中脯氨酸、天冬氨酸和谷氨酸含量较高,分别达到了3.06、2.90和2.50 g/100 g。天冬氨酸和谷氨酸等属于风味蛋白,可应用于食品工业。超滤法制备桑叶蛋白尚不能达到FAO/WHO儿童模式的氨基酸含量标准,还需进一步改善纯化工艺提升桑叶蛋白中的必需氨基酸含量。
表 7 超滤法制备桑叶蛋白的氨基酸组成(g/100 g)Table 7. Amino acid composition of mulberry leaf protein prepared by ultrafiltration (g/100 g)2.5.2 氨基酸含量的平衡性分析
基于氨基酸组成分析结果,将该样品进行氨基酸平衡性分析,并计算桑叶蛋白的SRC值。桑叶蛋白氨基酸含量越接近FAO/WHO氨基酸模式要求,说明该蛋白氨基酸配越平衡,越能够满足人体营养需求[34]。经计算可得,超滤法制备的桑叶蛋白RAA、RC、CV以及SRC(表8)。苏氨酸、缬氨酸、苯丙+酪氨酸的RC值>1,说明苏氨酸、缬氨酸、苯丙+酪氨酸含量相对过剩;亮氨酸、异亮氨酸、赖氨酸和蛋+胱氨酸的RC值<1,则说明亮氨酸、异亮氨酸、赖氨酸和蛋+胱氨酸含量相对缺乏[35],蛋+胱氨酸的RC值最小为0.64,说明蛋+胱氨酸是桑叶蛋白粉的第一限制性氨基酸。SRC常常被用来作为评价氨基酸的营养价值的高低,其值越接近100,说明制备出的蛋白营养价值越高[36]。如表8所示,经计算,超滤法制备桑叶蛋白的SRC值为69.68,具有较高的营养价值。
表 8 超滤法制备桑叶蛋白的氨基酸比值系数Table 8. Amino acid ratio coefficient of mulberry leaf protein prepared by ultrafiltrationFAO/WHO推荐必需氨基酸组成 蛋白质特征值 SRC RAA RC 异亮氨酸 0.87 0.98 69.68 亮氨酸 0.77 0.87 赖氨酸 0.70 0.79 蛋+胱氨酸 0.57 0.64 苯丙+酪氨酸 0.99 1.12 苏氨酸 1.09 1.23 缬氨酸 1.22 1.38 综上所述,超滤法制备桑叶蛋白无论是从氨基酸组成还是氨基酸平衡性分析都表现出较好的优势。
3. 结论
采用超声提取联合超滤纯化桑叶蛋白,首先通过单因素实验初步得出液料比、超声时间、加热温度和加热时间的最适条件。在此基础上,优选液料比、加热温度和加热时间进行响应面试验优化,桑叶蛋白的最佳提取工艺条件是液料比29:1 mL/g,超声时间15 min,42 ℃水浴34 min,在此条件下,桑叶蛋白得率5.56%。进一步采用正交试验优化超滤纯化桑叶蛋白粗提液,得到纯化蛋白的最优工艺为:操作压力0.6 MPa,粗提液稀释倍数1倍,浓缩比4:1,制备的桑叶蛋白固体纯度为35.64%,蛋白保留率可达95.72%,膜通量可达21.40 L/m2·h。采用环保无毒害的超声联合超滤工艺对桑叶蛋白进行提取分离纯化,超声提取联合超滤技术制备的桑叶蛋白固体中总氨基酸含量为22.22 g/100 g,必需氨基酸含量占总氨基酸含量的0.41,EAA/NAA值为0.70,超过FAO/WHO标准规定的必需氨基酸含量(0.40)和EAA/NAA值(0.60),该制备的桑叶蛋白第一限制氨基酸为蛋氨酸+胱氨酸,SRC为69.68,营养价值较高。该工艺从桑叶中提取分离桑叶蛋白,不需要引入大量酸、碱和盐等化学试剂,实现绿色生产,可为桑叶蛋白提取和分离纯化工艺提供新思路。
-
表 1 响应面试验因素与水平设计
Table 1 Response surface experimental factors and level design
水平 因素 液料比A(mL/g) 加热温度B(℃) 加热时间C(min) −1 25:1 35 30 0 30:1 40 40 1 35:1 45 50 表 2 正交试验因素与水平
Table 2 Factors and levels of orthogonal experiment
水平 因素 A操作压力(MPa) B粗提液稀释倍数 C浓缩比 −1 0.5 0 4:1 0 0.55 0.5 5:1 1 0.6 1 6:1 表 3 响应面试验结果
Table 3 Response surface experimental results
实验号 A液料比
(mL/g)B加热温度
(℃)C加热时间
(min)Y桑叶蛋白得率
(%)1 30:1 40 40 5.50±0.21 2 30:1 40 40 5.33±0.23 3 30:1 45 30 5.30±0.18 4 35:1 40 30 3.62±0.12 5 25:1 45 40 4.34±0.09 6 30:1 40 40 5.10±0.20 7 35:1 45 40 4.12±0.16 8 30:1 45 50 3.50±0.07 9 35:1 35 40 3.56±0.11 10 30:1 40 40 5.67±0.13 11 25:1 35 40 4.15±0.14 12 30:1 35 30 4.22±0.03 13 30:1 35 50 4.45±0.12 14 25:1 40 30 4.97±0.09 15 25:1 40 50 3.49±0.21 16 30:1 40 40 5.60±0.12 17 35:1 40 50 3.80±0.11 表 4 回归方程的方差分析
Table 4 Analysis of variance of regression equation
来源 平方和 自由度 均方 F值 P值 模型 9.75 9 1.08 27.73 0.0001** A 0.43 1 0.43 10.95 0.0130* B 0.097 1 0.097 2.48 0.1595 C 1.03 1 1.03 26.34 0.0013** AB 0.034 1 0.034 0.88 0.3805 AC 0.69 1 0.69 17.63 0.0040** BC 1.03 1 1.03 26.36 0.0013** A2 3.39 1 3.39 86.78 <0.0001** B2 1.05 1 1.05 26.93 0.0013** C2 1.38 1 1.38 35.31 0.0006** 残差 0.27 7 0.039 失拟项 0.064 3 0.021 0.41 0.7580 纯误差 0.21 4 0.052 总误差 10.03 16 注:*差异显著,P<0.05;**差异极显著,P<0.01. 表 5 不同纯化方法纯化桑叶蛋白结果
Table 5 Results of different protein purification method
除杂方法 蛋白纯度(%) 蛋白保留率(%) 酸沉法 24.53±0.33c 83.60±1.85b 酸热法 30.32±0.79b 54.03±0.32c 盐析法 33.94±2.18ab 54.85±1.26c 超滤法 35.35±0.07a 95.42±0.44a 注:同一指标中标有不同字母表示具有显著性差异(P<0.05)。 表 6 正交试验结果
Table 6 Orthogonal results
序号 操作压力(A) 粗提液稀释倍数(B) 浓缩比(C) 膜通量
(L/m2·h)1 −1 −1 −1 10.01 2 −1 0 0 14.03 3 −1 1 1 18.58 4 0 −1 1 4.88 5 0 0 −1 16.29 6 0 1 0 20.28 7 1 −1 0 9.60 8 1 0 1 14.45 9 1 1 −1 21.40 k1 14.207 8.163 15.900 k2 13.817 14.923 14.637 k3 15.150 20.087 12.637 R 1.333 11.924 3.263 表 7 超滤法制备桑叶蛋白的氨基酸组成(g/100 g)
Table 7 Amino acid composition of mulberry leaf protein prepared by ultrafiltration (g/100 g)
表 8 超滤法制备桑叶蛋白的氨基酸比值系数
Table 8 Amino acid ratio coefficient of mulberry leaf protein prepared by ultrafiltration
FAO/WHO推荐必需氨基酸组成 蛋白质特征值 SRC RAA RC 异亮氨酸 0.87 0.98 69.68 亮氨酸 0.77 0.87 赖氨酸 0.70 0.79 蛋+胱氨酸 0.57 0.64 苯丙+酪氨酸 0.99 1.12 苏氨酸 1.09 1.23 缬氨酸 1.22 1.38 -
[1] 孙波, 周洪英, 吴洪丽. 桑叶和桑枝综合利用概况[J]. 北方蚕业,2015,36(2):1−3. [SUN B, ZHOU H Y, WU H L. Overview of comprehensive utilization of mulberry leaves and branches[J]. Northern Sericulture,2015,36(2):1−3. doi: 10.3969/j.issn.1673-9922.2015.02.001 SUN B, ZHOU H Y, WU H L. Overview of comprehensive utilization of mulberry leaves and branches[J]. Northern Sericulture, 2015, 36(2): 1-3. doi: 10.3969/j.issn.1673-9922.2015.02.001
[2] 肖霞, 李书渊. 桑的药用历史和功效[J]. 四川蚕业,2007(2):56−59. [Xiao X, LI S Y. Medicinal history and efficacy of mulberry[J]. Sichuan Sericulture,2007(2):56−59. Xiao X, LI S Y. Medicinal history and efficacy of mulberry [J]. Sichuan Sericulture. 2007(2): 56-59.
[3] 黄山. 谈谈唐一泰的药物组分-桑叶的作用[J]. 糖尿病新世界,2010(1):23. [HUANG S. Talking about the role of mulberry leaves, the drug component of Tang Yitai[J]. New World of Diabetes,2010(1):23. doi: 10.16658/j.cnki.1672-4062.2010.01.008 HUANG S. Talking about the role of mulberry leaves, the drug component of Tang Yitai [J]. New World of Diabetes. 2010(1): 23. doi: 10.16658/j.cnki.1672-4062.2010.01.008
[4] 张倩, 张立华. 桑叶的化学成分及开发利用进展[J]. 湖北农业科学,2020,59(15):16−19. [ZHANG Q, ZHANG L H. Chemical composition and progress of development and utilization of mulberry leaves[J]. Hubei Agricultural Science,2020,59(15):16−19. ZHANG Q, ZHANG L H. Chemical composition and progress of development and utilization of mulberry leaves [J]. Hubei Agricultural Science, 2020, 59(15): 16-19.
[5] SUN C Z, WU W J, MA, Y R et al. Physicochemical, functional properties, and antioxidant activities of protein fractions obtained from mulberry (Morus atropurpurea Roxb.) leaf[J]. International Journal of Food Properties,2018,20(3):3311−3325.
[6] Shan Y W, SUN C Z, LI J S et al. Characterization of purified mulberry leaf glycoprotein and its immunoregulatory effect on cyclophosphamide-treated mice[J]. Foods,2022,11(14):2034. doi: 10.3390/foods11142034
[7] 齐娟, 金青, 李然, 等. 响应面优化济生散蛋白水提工艺及氨基酸测定[J]. 食品科技,2017,42(11):163−167. [QI J, JIN Q, LI R, et al. Optimization of water extraction process and amino acid determination of Jisheng San protein by response surface methodology[J]. Food Science and Technology,2017,42(11):163−167. QI J, JIN Q, LI R, et al. Optimization of water extraction process and amino acid determination of Jisheng San protein by response surface methodology [J]. Food Science and Technology, 2017, 42(11): 163-167.
[8] 张兆云, 周启萍, 巩起福, 等. “陇藜1号”藜麦籽实清蛋白提取工艺优化及抗氧化性测定[J]. 食品与发酵工业,2021,47(2):212−219. [ZHANG Z Y, ZHOU Q P, GONG Q F, et al. "Longli No.1" Quinoa seed albumin extraction process optimization and antioxidant activity determination[J]. Food and Fermentation Industry,2021,47(2):212−219. ZHANG Z Y, ZHOU Q P, GONG Q F, et al. "Longli No. 1" Quinoa seed albumin extraction process optimization and antioxidant activity determination [J]. Food and Fermentation Industry, 2021, 47(2): 212-219.
[9] 俞萍, 岳煜贤, 张宇, 等. 响应面法优化人参糖蛋白制备工艺[J]. 食品与机械,2021,37(7):194−199. [YU P, YUE Y X, ZHANG Y, et al. Optimization of preparation technology of ginseng glycoprotein by response surface methodology[J]. Food and Machinery,2021,37(7):194−199. YU P, YUE Y X, ZHANG Y, et al. Optimization of preparation technology of ginseng glycoprotein by response surface methodology [J]. Food and Machinery, 2021, 37(7): 194-199.
[10] LV S, TAHA A, HU H, et al. Effects of ultrasonic-assisted extraction on the physicochemical properties of different walnut proteins[J]. Molecules,2019,24(23):4260. doi: 10.3390/molecules24234260
[11] PANL W. B, ADAM C. A comparison in protein extraction from four major crop residues in Europe using chemical and enzymatic processes-a review[J]. Innovative Food Science and Emerging Technologies,2020,59(C):102239.
[12] 许亚平, 林俊岳. 蛋白质提纯研究进展[J]. 天津化工,2006,20(4):9−11. [XU Y P, LIN J Y. Research progress on purification of protein[J]. Tianjin Chemical Industry,2006,20(4):9−11. doi: 10.3969/j.issn.1008-1267.2006.04.004 XU Y P, LIN J Y. Research progress on purification of protein [J]. Tianjin Chemical Industry, 2006, 20(4): 9-11. doi: 10.3969/j.issn.1008-1267.2006.04.004
[13] 张敏娟, 杨晶, 苏维磊, 等. 不同的蛋白沉淀和干燥工艺对桑叶蛋白粉营养价值的影响分析[J]. 北方蚕业,2016,37(1):7−10. [ZHANG M J, YANG J, SU W L, et al. Analysis of the effects of different protein precipitation and drying processes on the nutritional value of mulberry leaf protein powder[J]. Northern Sericulture,2016,37(1):7−10. doi: 10.3969/j.issn.1673-9922.2016.01.003 ZHANG M J, YANG J, SU W L, et al. Analysis of the effects of different protein precipitation and drying processes on the nutritional value of mulberry leaf protein powder[J]. Northern Sericulture. 2016, 37(1): 7-10. doi: 10.3969/j.issn.1673-9922.2016.01.003
[14] HE S D, LOU Q Y, SHI J, et al. Water extraction of anthocyanins from black rice and purification using membrane separation and resin adsorption[J]. Journal of Food Processing and Preservation,2017,41(4):1745−4549.
[15] 孙久义. 我国膜分离技术综述[J]. 当代化工研究,2019(2):27−28. [SUN J Y. A review of membrane separation technology in China[J]. Contemporary Chemical Research,2019(2):27−28. SUN J Y. A review of membrane separation technology in China[J]. Contemporary Chemical Research, 2019(2): 27-28.
[16] LIU J, ZHANG W, LI P, et al. Isolation of peanut protein aggregates using aqueous extraction processing combined with membrane separation[J]. International Journal of Food Science & Technology,2020,55(9):3203−3214.
[17] WANG Y, YU J. Membrane separation processes for enrichment of bovine and caprine milk oligosaccharides from dairy byproducts[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3667−3689. doi: 10.1111/1541-4337.12758
[18] ZHANG H, LUO J, LIU L, et al. Green production of sugar by membrane technology: How far is it from industrialization?[J]. Green Chemical Engineering,2021,2(1):27−43. doi: 10.1016/j.gce.2020.11.006
[19] LOGINOV M, BOUSSETTA N, LEBOVKA N, et al. Separation of polyphenols and proteins from flaxseed hull extracts by coagulation and ultrafiltration[J]. Journal of Membrane Science,2013,442:177−186. doi: 10.1016/j.memsci.2013.04.036
[20] 李爱勤. 超声提取联合膜分离技术纯化甘草酸的工艺[J]. 化工设计通讯,2020,46(7):73,77. [LI A Q. Purification of glycyrrhizic acid by ultrasonic extraction combined with membrane separation technology[J]. Chemical Engineering Design Communication,2020,46(7):73,77. LI A Q. Purification of glycyrrhizic acid by ultrasonic extraction combined with membrane separation technology [J]. Chemical Engineering Design Communication, 2020, 46 (7): 73, 77
[21] 张敏, 史宝利. 膜分离技术在水苏糖提取中的应用[J]. 食品工业,2019,40(10):102−106. [ZHANG M, SHI B L. Application of membrane separation technology in stachyose extraction[J]. Food Industry,2019,40(10):102−106. ZHANG M, SHI B L. Application of membrane separation technology in stachyose extraction [J]. Food Industry, 2019, 40 (10): 102-106.
[22] 胡卓逸. 考马斯亮兰G-250染料测定蛋白质方法的改进[J]. 中国医科大学学报,1987,2(18):130−136. [HU, Z Y. Improvement of the method for protein determination by Karmas Brilliant Blue G-250 dye[J]. Journal of China Medical University,1987,2(18):130−136. HU, Z Y. Improvement of the method for protein determination by Karmas Brilliant Blue G-250 dye[J]. Journal of China Medical University. 1987, 2(18): 130-136.
[23] 孙崇臻, 武文佳, 闵甜, 等. 不同制备方法桑叶蛋白功能性质的比较[J]. 现代食品科技,2015,31(12):242−249. [SUN C Z, WU W J, MIM T, et al. Comparison of the functional properties of mulberry leaf proteins by different preparation methods[J]. Modern Food Science and Technology,2015,31(12):242−249. doi: 10.13982/j.mfst.1673-9078.2015.12.036 SUN C Z, WU W J, MIM T, et al. Comparison of the functional properties of mulberry leaf proteins by different preparation methods[J]. Modern Food Science and Technology, 2015, 31(12): 242-249. doi: 10.13982/j.mfst.1673-9078.2015.12.036
[24] 魏雅静, 杨宇, 祝开阳. 平欧榛子分离蛋白提取条件优化[J]. 食品安全导刊,2022(11):70−72. [WEI Y J, YANG Y, ZHU K Y. Optimization of extraction conditions of hazelnut protein isolate in Pingou[J]. Journal of Food Safety,2022(11):70−72. doi: 10.3969/j.issn.1674-0270.2022.11.spaqdk202211032 WEI Y J, YANG Y, ZHU K Y. Optimization of extraction conditions of hazelnut protein isolate in Pingou [J]. Journal of Food Safety. 2022(11), 70-72. doi: 10.3969/j.issn.1674-0270.2022.11.spaqdk202211032
[25] 刘苗苗, 史锐, 吴鹏, 等. 正交试验优化桑叶中蛋白提取工艺[J]. 亚太传统医药,2020,16(12):63−66. [LIU M M, SHI R, WU P, et al. Optimization of protein extraction process in mulberry leaves by orthogonal experiment[J]. Asia-Pacific Traditional Medicine,2020,16(12):63−66. LIU M M, SHI R, WU P, et al. Optimization of protein extraction process in mulberry leaves by orthogonal experiment[J]. Asia-Pacific Traditional Medicine. 2020, 16(12): 63-66.
[26] 刘信宝, 吴淼, 耿奇, 等. 饲料桑叶蛋白提取工艺的优化[J]. 畜牧与兽医,2015,46(6):56−58. [LIU X B, WU M, GENG Q, et al. Optimization of extraction process of feed mulberry leaf protein[J]. Animal Husbandry and Veterinary Medicine,2015,46(6):56−58. LIU X B, WU M, GENG Q, et al. Optimization of extraction process of feed mulberry leaf protein[J]. Animal Husbandry and Veterinary Medicine, 2015, 46(6): 56-58.
[27] 李雪枫, 王坚, 罗瑛, 等. 柱花草叶蛋白提取工艺研究[J]. 安徽农业科学,2008(26):11282−11284. [LI X F, WANG J, YING L, et al. Study on extraction technology of protein from Stylosanthes guianensis leaves[J]. Anhui Agricultural Sciences,2008(26):11282−11284. doi: 10.3969/j.issn.0517-6611.2008.26.053 LI X F, WANG J, YING L, et al. Study on extraction technology of protein from Stylosanthes guianensis leaves [J]. Anhui Agricultural Sciences, 2008(26): 11282-11284. doi: 10.3969/j.issn.0517-6611.2008.26.053
[28] 李刚凤, 何智军, 杨天友, 等. 超声波辅助提取桑叶蛋白工艺优化[J]. 食品工业,2019,40(10):15−18. [LI G F, HE Z J, YANG T Y, et al. Optimization of ultrasonic-assisted extraction of mulberry leaf protein[J]. Food Industry,2019,40(10):15−18. LI G F, HE Z J, YANG T Y, et al. Optimization of ultrasonic-assisted extraction of mulberry leaf protein [J]. Food Industry. 2019, 40(10): 15-18.
[29] 刘国艳, 徐鑫, 叶群. 超滤与纳滤膜技术应用于桑叶中1-脱氧野尻霉素分离浓缩的效果观察[J]. 扬州大学烹饪学报,2013(4):55−60. [LIU G Y, XU X, YE Q. Observation on the effect of ultrafiltration and nanofiltration membrane technology applied to the separation and concentration of 1-deoxynojirimycin in mulberry leaves[J]. Journal of Cookery of Yangzhou University,2013(4):55−60. LIU G Y, XU X, YE Q. Observation on the effect of ultrafiltration and nanofiltration membrane technology applied to the separation and concentration of 1-deoxynojirimycin in mulberry leaves [J] Journal of Cookery of Yangzhou University 2013 (4): 55-60
[30] 黄双霞, 刘丽娅, 陈华磊, 等. 两级膜超滤纯化右旋糖酐的工艺研究[J]. 广西糖业,2018(2):25−32. [HUANG S X, LIU L Y, CHEN H L, et al. Purification of dextran by two-stage ultrafiltration[J]. Guangxi Sugar Industry,2018(2):25−32. HUANG S X, LIU L Y, CHEN H L, et al Purification of dextran by two-stage ultrafiltration [J] Guangxi Sugar Industry, 2018 (2): 25-32
[31] 王博, 斯聪聪, 程国才. 响应面优化超滤膜分离灵芝多糖工艺[J]. 食品工业,2015,36(12):1−4. [WANG B, SI C C, CHENG G C. Response surface optimization of ultrafiltration membrane separation of Ganoderma lucidum polysaccharides[J]. Food Industry,2015,36(12):1−4. WANG B, SI C C, CHENG G C. Response surface optimization of ultrafiltration membrane separation of Ganoderma lucidum polysaccharides [J]. Food Industry, 2015, 36 (12): 1-4.
[32] SHAO W, ZHANG H, DUAN R, et al. A rapid and scalable integrated membrane separation process for purification of polysaccharides from Enteromorpha prolifera[J]. Nat Prod Res,2019,33(21):3109−3119. doi: 10.1080/14786419.2018.1519823
[33] 薛艳芳. 大豆乳清低聚糖的超滤提取及纯化研究[D]. 哈尔滨: 东北农业大学, 2014. XUE Y F. Study on ultrafiltration extraction and purification of soybean whey oligosaccharide[D]. Harbin: Northeast Agricultural University, 2014.
[34] AlKAHTANI S N, TAHA E, KHAN K A, et al. Effect of harvest season on the nutritional value of bee pollen protein[J]. PLoS One,2020,15(12):1−11.
[35] CHAO H, WEI L F, JING X et al. Impact of drying method on the nutritional value of the edible insect protein from black soldier fly (Hermetia illucens L.) larvae: amino acid composition, nutritional value evaluation, in vitro digestibility, and thermal properties[J]. European Food Research and Technology,2019,245(1):11. doi: 10.1007/s00217-018-3136-y
[36] 邓文亚, 徐婧婷, 郭顺堂, 等. 火麻仁蛋白与大豆蛋白的营养评价及比较[J]. 食品工业科技,2021,42(23):273−279. [DENG W Y, XU J T, GUO S T, et al. Nutritional evaluation and comparison of hemp seed protein and soybean protein[J]. Food Industry Science and Technology,2021,42(23):273−279. doi: 10.13386/j.issn1002-0306.2021030019 DENG W Y, XU J T, GUO S T, et al. Nutritional evaluation and comparison of hemp seed protein and soybean protein [J]. Food Industry Science and Technology, 2021, 42(23): 273-279. doi: 10.13386/j.issn1002-0306.2021030019





 下载:
下载:

 下载:
下载:
