Isolation and Characterization of a Pueraria lobata Protein and Its Self-assembled Nanoparticles Properties
-
摘要: 目的:纯化并表征一种葛根水溶性蛋白,将该蛋白通过热诱导的方式构建为蛋白纳米颗粒载体。方法:采用阴离子交换色谱High Q纯化获得葛根蛋白,通过SDS-PAGE和蛋白质N端测序方法鉴定蛋白的分子量和氨基酸序列。采用激光粒度分析仪对蛋白纳米颗粒的粒径、光散射强度和Zeta电位进行研究,采用高效液相色谱法测定纳米载体对药物的装载效率。结果:从葛根中抽提并分离纯化获得一种主要的水溶性蛋白,命名为PP。N-端氨基酸序列测得为DFVYDMCGNVLNGGTYYIL,通过NCBI数据库比对和蛋白酶活性测定确定PP为一种新的胰蛋白酶抑制剂,且PP在pH2~10的环境中及20~50 ℃的温度范围内均具有较好的稳定性。PP溶液(0.1 mg/mL,pH6.0)在100 ℃下加热60 min可以形成分布均匀的纳米颗粒PP-NPs,测定其平均粒径为172.78 nm,Zeta电位为−25.40 mV。PP-NPs能有效装载葛根素及小檗碱,测得的药物装载率分别为33.83%和24.61%。结论:从葛根中纯化获得的主要水溶性蛋白PP能通过热诱导构建蛋白纳米颗粒,该颗粒具有成为药物载体的潜力。Abstract: Objective: To purify and characterize a water-soluble protein from Pueraria lobata and to fabricate its nanoparticles by heating-induced assembly. Methods: Pueraria lobata protein was purified by anion exchange chromatography High Q, and its molecular weight and amino acid sequence were determined by SDS-PAGE and N-terminal sequencing. The particle size, optical dispersion intensity and Zeta potential of protein nanoparticles were measured by laser-scattering particle analyzer. The drug loading efficiency of the nanocarrier was determined by chromatography. Results: A major water-soluble protein, named PP, was purified from Pueraria lobata and sequenced with a N-terminal amino acid sequence of DFVYDMCGNVLNGGTYYIL. PP was identified as a novel trypsin inhibitor by NCBI database searching and rypsin inhibitory assay. PP was also well-stabilized in the pH2~10 and 20~50 °C ranges. After heating PP solution (0.1 mg/mL, pH6.0) for 60 minutes at 100 ℃, homogenous nanoparticles (PP-NPs) were harvested. These PP-NPs had a particle size of 172.78 nm and a Zeta potential of −25.40 mV. The puerarin and berberine were effectively loaded onto PP-NPs, with loading efficiency of 33.83% and 24.61%, respectively. Conclusion: The major water-soluble Pueraria lobata protein PP can be fabricated into protein nanoparticles by heating-induced assembly, indicating a potential as drug carriers.
-
Keywords:
- Pueraria lobata /
- nanoparticles /
- self-assembly /
- trypsin inhibitor
-
葛根为豆科植物野葛(Pueraria lobata (Wild.) Ohwi)或甘葛藤(Pueraria thomsonii Benth)的干燥块根,始载于我国汉代的《神农本草经》,在中国有着悠久的“药食两用”历史[1]。传统医药中,葛根常作为葛根芩连汤、升麻葛根汤等中药复方的“君药”发挥重要疗效[2]。现代药理学研究表明葛根具有降血糖[3]、降血脂[4]、降血压[5]、抗氧化[6]和抗肿瘤[7]等多种生物活性效用。近年来,以葛根为原材料的食品产品日益丰富,主要包括初级加工的葛根粉、葛根茶,发酵制品葛根乳饮料、葛根果醋,以及预包装食品葛根饼干、葛根软糖等[8-9]。此外,因具有诸多生物学功效,葛根在开发新型保健食品方面也拥有良好潜力[10]。
葛根中含有丰富的营养物质和生物活性成分,但目前对葛根的生物活性研究主要集中于(异)黄酮类化合物,如葛根素、大豆苷、大染料木素等[11],而这类化合物大多难溶于水,肠道吸收率较低,生物利用率不高[12],限制了葛根营养功能和食用价值的发挥和利用。葛根在炮制中药汤剂及生产包装食品时要经过加热处理,这个过程中原料所含的生物大分子,特别是蛋白质,普遍存在着热诱导自组装成为纳米颗粒的现象[13-14]。前期研究表明,蛋白纳米颗粒可以与消化道黏膜免疫细胞直接作用,改善黏膜免疫[15]。此外,纳米颗粒特殊的结构可以作为非水溶性成分的载体,例如甘草纯化蛋白在100 ℃下经过热诱导自组装形成了74 nm的纳米颗粒,并成功负载黄芪甲苷[16]。葛根含有丰富的蛋白质,最高提取率可达83.2%[17],前期研究结果显示葛根蛋白热诱导自组装行为或许可以为葛根活性成分的鉴定提供新的研究方向,并且为开发天然蛋白质纳米载体提供新的材料。本研究调查了葛根中的水溶性蛋白成分,纯化得到一种主要的水溶性蛋白,并鉴定蛋白的相对分子量、N-端氨基酸序列和蛋白酶活性。通过热诱导构建蛋白纳米载体,测定载体的粒径分布、光散射强度和Zeta电位等性质,并考察载体对葛根素、小檗碱等活性成分的装载能力。
1. 材料与方法
1.1 材料与仪器
葛根饮片(批号:1109066) 北京燕京饮片厂;蛋白标准样 Amersham公司;胰蛋白酶(≥2500 U/mg) 美国Sigma-Aldrich公司;葛根素、小檗碱标准品 国家标准物质中心;N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐 美国Amresco公司;甲醇(色谱纯),其余所用试剂均为分析纯 国药集团化学试剂有限公司。
High Q离子交换色谱(3.9×300 mm) 美国Bio-red公司;Zip Tip C4微量层析柱 美国Millipore公司;DFT-250高速粉碎机 浙江琳达机械有限公司;RET Basic 磁力搅拌器 德国IKA公司;U-1900紫外分光光度计 日本HITACHI;DYY-5恒压恒流电泳仪 北京市六一仪器厂;FE20 pH计 梅特勒-托利多仪器有限公司;Nano-ZS90激光粒度分析仪 英国Malvern公司;L-2000高效液相色谱仪 日立高科技公司;4800 plus MALDI-TOF/TOF质谱仪 加拿大AB SCIEX公司;PPSQ-33A自动蛋白/多肽测序仪 日本SHIMADZU公司;JEM-1230透射电镜 日本JEOL公司。
1.2 实验方法
1.2.1 葛根蛋白粗提液的制备
葛根蛋白提取采用水溶液提取结合乙醇沉淀法[18],详细步骤为:准确称取葛根饮片100 g,置于高速粉碎机充分碾磨,粉末在500 mL Tris-HCl缓冲液(0.01 mol/L、pH8.1)中充分浸润,置于磁力搅拌器上(4 ℃、500 r/min)浸提24 h。葛根抽提液经纱布过滤除渣,滤液于10000×g、4 ℃下离心20 min,弃沉淀。在上清中缓慢加入20%、40%、60%、80%于−80 ℃预冷的无水乙醇进行蛋白沉淀,分别将混合液于10000×g、4 ℃条件下离心20 min,弃上清,沉淀经Tris-HCl缓冲液(0.01 mol/L、pH8.1)重新溶解,即为葛根蛋白粗提液。
1.2.2 葛根蛋白纯化
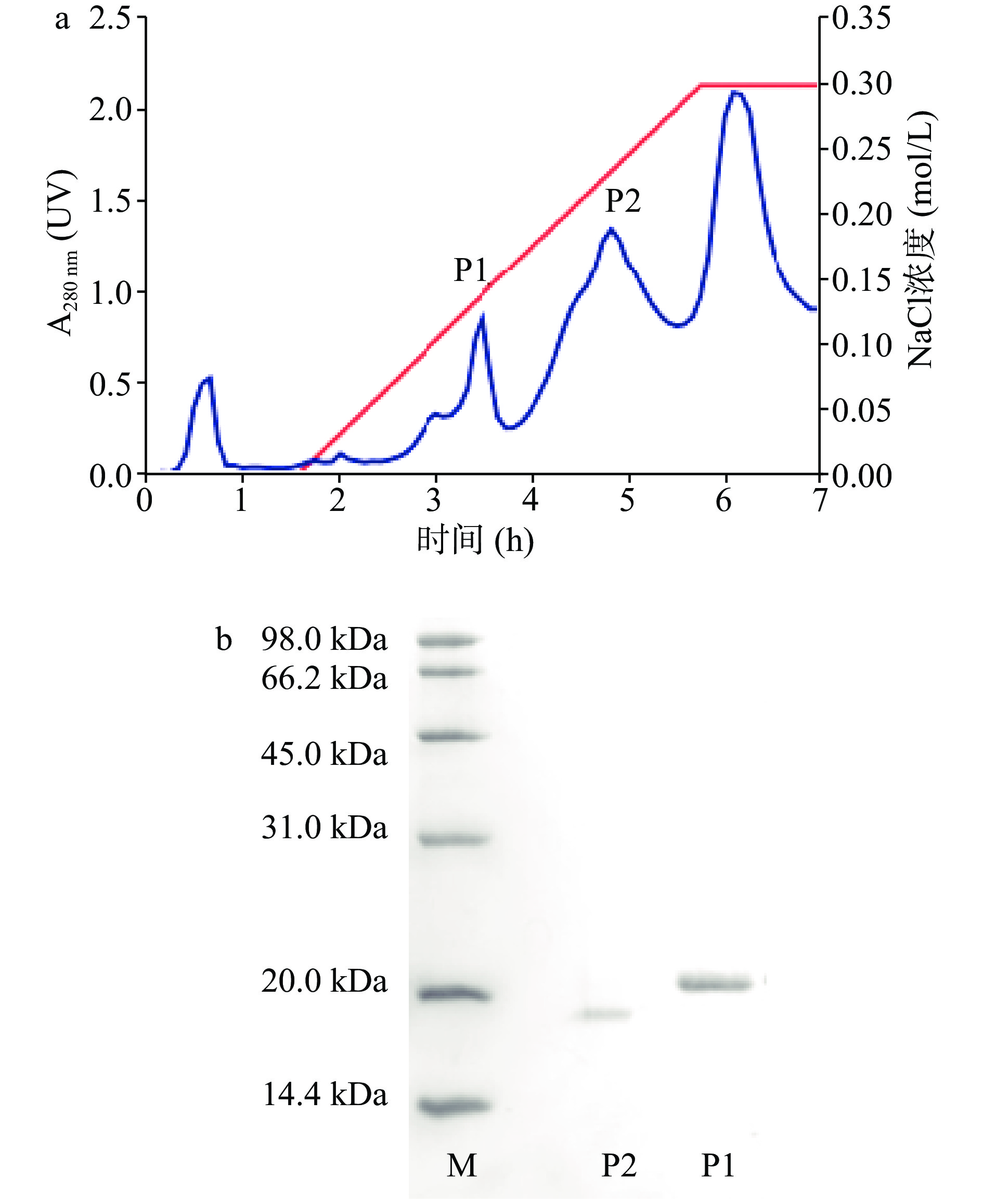
葛根蛋白分离使用自装阴离子交换色谱,色谱填料为High Q,装柱体积10 mm×150 mm。色谱柱于Tris-HCl缓冲液(0.02 mol/L,pH8.1)预平衡10倍柱体积,流动上样30 mL,0~0.3 mol/L NaCl阶段梯度洗脱,洗脱液总体积200 mL,洗脱时间流速0.8 mL/min,检测波长280 nm,按色谱峰收集样品。采用十二烷基硫酸钠-丙烯酰胺凝胶电泳法(SDS-PAGE)鉴定纯化效果[19],收集样品经非还原处理液处理,浓缩胶浓度4%,分离胶浓度12.5%。
1.2.3 葛根蛋白性质表征
1.2.3.1 分子量测定
用MALDI-TOF质谱仪测定蛋白样品分子量。经Zip Tip C4微量层析柱脱盐处理后取1 μL蛋白样品点至样品靶上,自然干燥后,再取0.6 μL基质溶液点至对应靶位上并自然干燥,用相同方法在样品靶位相邻位置点标准品。
1.2.3.2 N端序列测定
样品经还原SDS-PAGE和电印迹后,采用自动蛋白/多肽测序仪测定葛根蛋白氨基酸序列[20]。取40 μL甲醇到Prosorb装置的聚偏二氟乙烯(PVDF)膜上,分别加入两次600 μL 0.1% 三氟乙酸滤过。将Prosorb放入已预热至50 ℃的加热器中烘干,切下PVDF膜后上样。
1.2.4 胰蛋白酶抑制剂活性测定
以N-苯甲酰-DL-精氨酸对硝基苯酰胺盐酸盐(40 mg溶于1 mL二甲基亚砜)为底物测定胰蛋白酶抑制剂活性,于410 nm测定吸光值。反应前后所增加0.01光密度为一个胰蛋白酶单位(AU),胰蛋白酶抑制剂活力用胰蛋白酶抑制剂单位(TLU)表示[21],按照公式(1)计算胰蛋白酶抑制率。活性测定均在20 ℃下进行,所有样品的反应时长均一致。
抑制率(%)=胰蛋白酶抑制剂活力单位胰蛋白酶活力单位×100 (1) 1.2.4.1 浓度对抑制剂活性的影响
分别配制葛根蛋白与胰蛋白酶摩尔比例为0.1、0.2、0.25、0.3、0.5、0.75、0.8、1.0的混合溶液,测定蛋白样品残留的抑制率。
1.2.4.2 pH对抑制剂活性的影响
用1 mol/L的HCl与1 mol/L的NaOH将蛋白样品分别调至pH2、4、6、8、10,测定蛋白样品残留的抑制率。
1.2.4.3 温度对抑制剂活性的影响
将蛋白样品分别在30、40、50、60、70、80、90、100 ℃水浴锅中处理30 min,反应结束后迅速冷却至20 ℃,测定蛋白样品残留的抑制率。
1.2.5 葛根蛋白纳米颗粒的构建
采用激光粒度分析仪测定纳米颗粒的平均粒径与Zeta电位[22],取1 mL样品置于检测皿,测试温度25 ℃,散射角173°,准备时间120 s,循环扫描3次。
1.2.5.1 pH响应
在相应缓冲体系中配制0.1 mg/mL葛根蛋白溶液,用稀释后的0.1 mol/L盐酸及0.1 mol/L的NaOH将体系的pH分别调至2、3、4、5、6、7、8、9、10,于100 ℃中加热60 min,统一冷却至20 ℃后测定颗粒粒径分布、光散射强度与Zeta电位。
1.2.5.2 加热时间响应
将葛根蛋白溶解于PBS缓冲液(0.1 mol/L,pH6.0)中,于100 ℃下分别加热20、40、60、80、100、120 min,冷却后测定颗粒粒径分布、光散射强度与Zeta电位。
1.2.5.3 加热温度响应
将葛根蛋白溶解于PBS缓冲液(0.1 mol/L,pH6.0)中,置于40、60、80、100 ℃分别加热60 min,冷却后测定颗粒粒径分布、光散射强度与Zeta电位。
1.2.6 纳米颗粒形态表征
采用透射电镜观察纳米颗粒形态,将样品滴加至薄膜的铜网,多余的样品经滤纸吸干,待样品干燥后在其上方滴加醋酸双氧铀(1%,w/v),染色时长为30 s,之后将多余的醋酸双氧铀吸干,待染色液干燥后进行观察,操作电压为120 kV。
1.2.7 颗粒装载实验
在PBS缓冲液(0.1 mol/L,pH6.0)中配制0.1 mg/mL葛根蛋白溶液,分别加入20 μL浓度为1 μg/μL的葛根素或小檗碱标准品,其中葛根素溶于纯甲醇,小檗碱溶于60 ℃热水,混合样品置于100 ℃加热60 min后立即冷却,观察其粒径分布和Zeta电位。纳米颗粒包埋率的计算参照文献方法[23],选用截留分子量为10 kDa的超滤离心管,于8000×g下超滤15 min分离蛋白颗粒与分子量小于10 kDa的葛根素、小檗碱。采用高效液相色谱仪分别测定葛根素和小檗碱含量,葛根素检测参数:A液(甲醇):B液(水)=25:75,检测波长280 nm;小檗碱检测参数:A液(乙腈):B液(0.033 mol/L磷酸二氢钾)=25:75,检测波长265 nm[24-25]。流动相平衡至基线水平后上样,标准品和待测样品分别进样20 μL,按照公式(2)计算纳米颗粒的装载率。
装载率(%)=(标准品峰面积−包埋后残留样品峰面积)标准品峰面积×100 (2) 1.3 数据处理
本文数据以平均值±方差表示,数据重复3次,采用GraphPad Prism 8.0.1软件计算方差并绘制图形,采用SPSS 20.0软件对多组样本进行组间差异显著性分析,P<0.05表示差异具有统计学意义。
2. 结果与分析
2.1 葛根蛋白分离与纯化
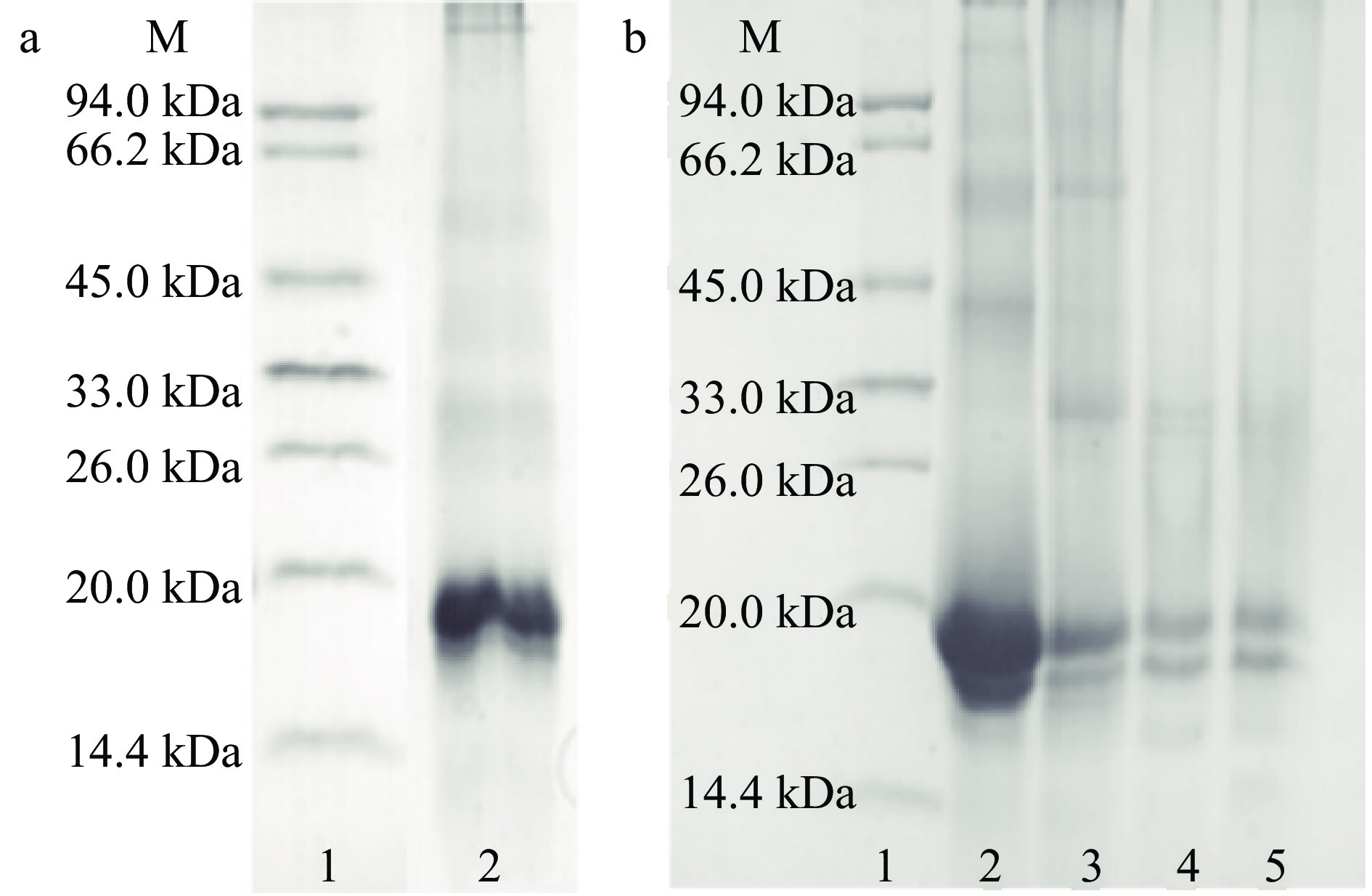
如图1所示,SDS-PAGE的结果显示葛根粗提液含有多种水溶性蛋白组分,蛋白质分子量分布范围在10~100 kDa之间,其中含量最高的两个主要蛋白质分子量分别约 18 与 20 kDa。如图1b 和图2 所示,经20%乙醇沉降和High Q色谱柱分离后,洗脱峰 P1 组分的 SDS-PAGE 结果显示,分子量约为 20 kDa的葛根蛋白得到了有效的纯化,达到了电泳纯,该P1组分中含有的蛋白被命名为PP,作为后续热诱导自组装的研究对象。
2.2 葛根蛋白鉴定
如表1所示,经质谱分析获得的PP分子量为20.73 kDa,该分子量与已报道的大豆Kunitz型胰蛋白酶抑制剂(20~25 kDa)及马铃薯胰蛋白酶抑制剂-Ⅱ家族(20.7 kDa)相近[26-27]。对PP进行N末端氨基酸序列测定,获得了19个氨基酸序列。通过NCBI蛋白数据库的检索,发现PP与大豆Kunitz型胰蛋白酶抑制剂STI的N端序列具有高度同源性,但在第4、6、7、10、11个氨基酸位点有所不同。
表 1 葛根蛋白分子量及N端氨基酸序列比对Table 1. Molecular weight and N-terminal amino acid sequence alignment of PP名称 分子量(kDa) N端氨基酸序列 葛根蛋白(PP) 20.73 1 DFVYDMCGNVLNGGTYYIL 19 大豆胰蛋白酶
抑制剂(STI)~20 1 DFVLDNEGNPLENGGTYYIL 20 2.3 胰蛋白酶抑制活性测定
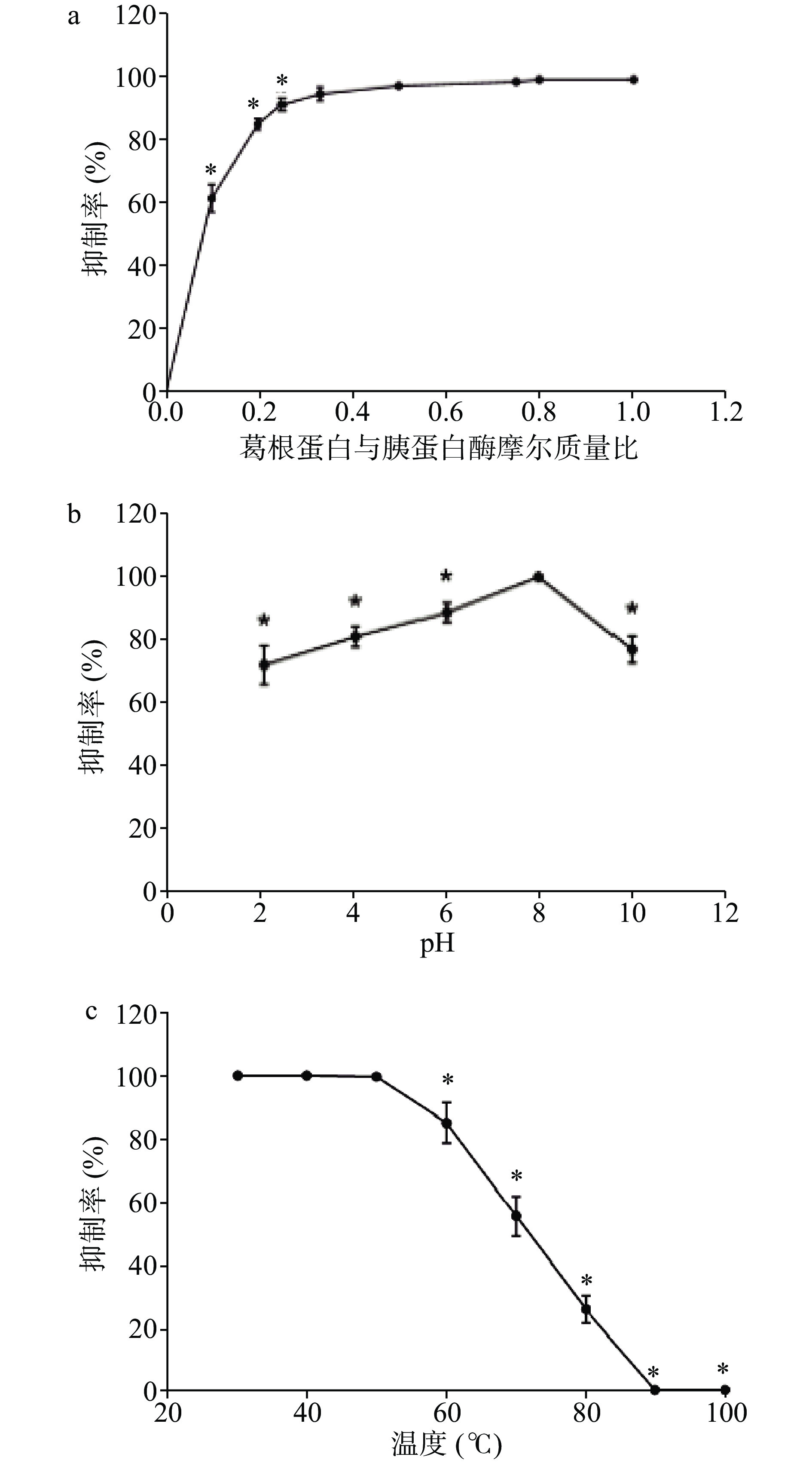
作为一种尚未被报导的蛋白质,PP的N端氨基酸序列与胰蛋白酶抑制剂表现出高度同源性,但它是否是一种新的胰蛋白酶抑制剂还需要通过胰蛋白酶抑制活性来进一步确定。如图3所示,PP表现出了明显的胰蛋白酶抑制活性,当PP与胰蛋白酶摩尔比为1/10时,PP对胰蛋白酶的抑制率达到63.3%,当摩尔比达到1/2及以上时,PP造成胰蛋白酶完全失活(图3a)。此外,酸碱对PP的抑制活性有显著影响(P<0.05),但在pH2~10范围内PP的抑制活性并未完全失去,当pH为8时,PP的抑制活性最大,表明PP抑制胰蛋白酶的最适pH为8(图3b)。温度同样对PP的胰蛋白酶抑制活性具有影响,在10~50 ℃范围内,其抑制活性较为稳定,50至90 ℃范围内,随着温度的升高,PP活性急剧下降,90 ℃时完全失去抑制活性(图3c)。以上结果表明PP为一类尚未报道的胰蛋白酶抑制剂,其在pH2~10环境中具有较好稳定性,在20~50 ℃温度范围内具有稳定性,但更高温度会造成失活,这些特性与大豆Kunitz型胰蛋白酶抑制剂较为相似[28]。
2.4 热诱导葛根蛋白纳米颗粒的构建与形态表征
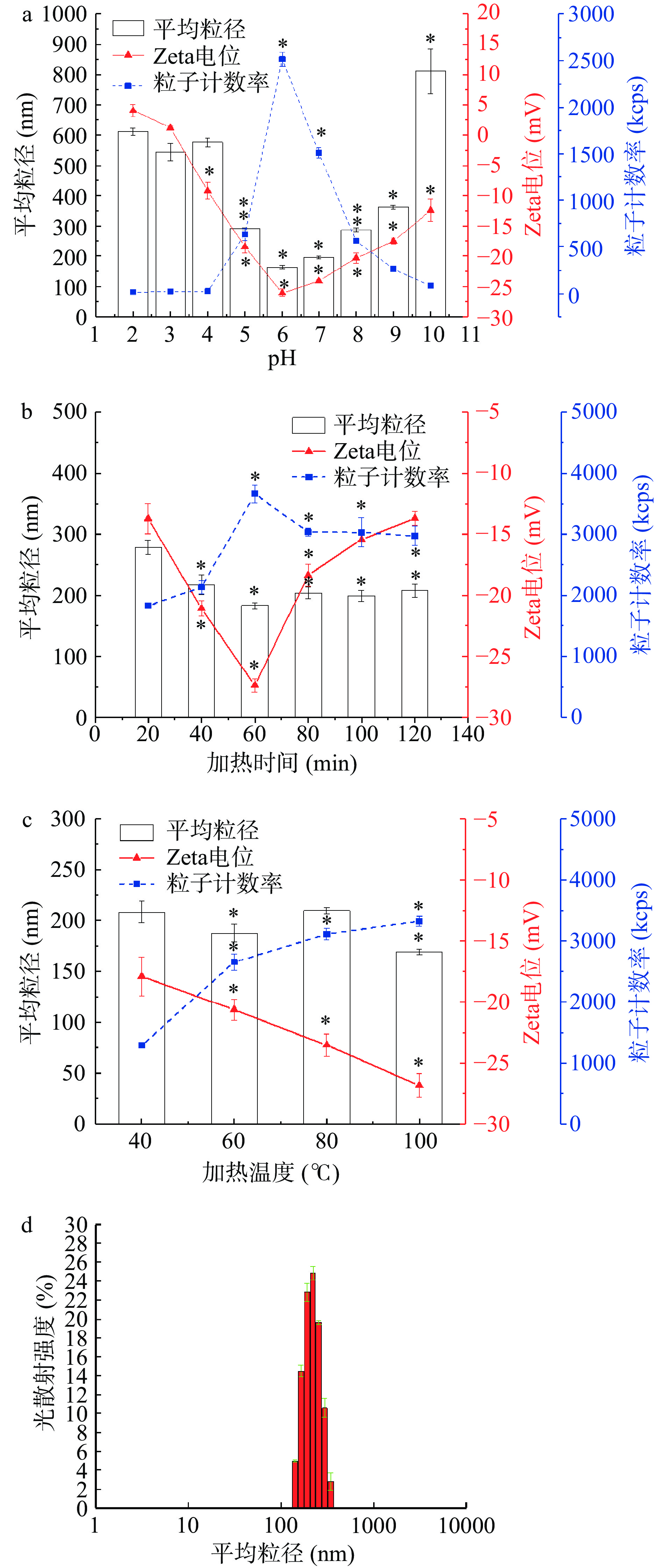
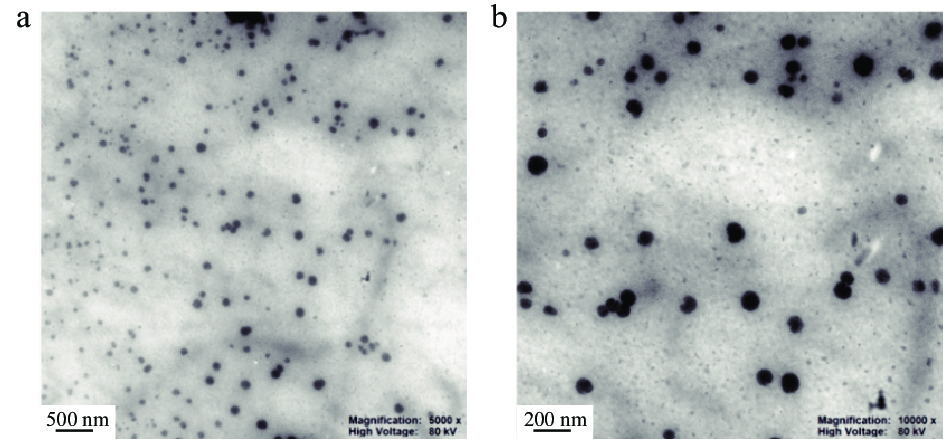
在PBS缓冲体系(0.1 mol/L,pH6.0)中配制0.1 mg/mL PP 溶液,置于 100 ℃ 加热 60 min,经热诱导后可观测到PP蛋白形成了平均粒径约为170 nm的纳米颗粒。为了提高载体的生物利用度,纳米颗粒应满足数量多、尺寸小、单位体积内表面积大的特点[29],因此,粒子计数率高、平均粒径小、Zeta电位绝对值大成为PP-NPs载体构建的条件筛选指标。在不同pH环境下的热诱导制备纳米颗粒的结果显示,pH6下获得的蛋白纳米颗粒为平均粒径最小,Zeta电位绝对值为最大,粒子计数率最高,而随着pH向酸、碱调节,获得的颗粒平均粒径均不同程度增大,且粒子计数率与Zeta电位绝对值显著(P<0.05)减小(图4a)。加热时间对蛋白纳米颗粒的性质同样具有影响,加热时间不同获得的颗粒粒径、粒子计数率和Zeta电位均有不同,其中以加热60 min时平均粒径为最小,粒子计数率最高,Zeta电位绝对值为最大(图4b)。图4c为热诱导温度对形成蛋白纳米颗粒性质的影响,在100 ℃热诱导获得的纳米颗粒性质为最佳。最终,形成葛根蛋白纳米颗粒(PP-NPs)最佳条件为:PP浓度0.1 mg/mL、pH6.0、温度100 ℃,加热60 min,此条件下形成的PP-NPs粒径为172.78 nm,粒子计数率为3018.17 kcps,分布呈正态性(图4d)表明颗粒分布均匀,透射电子显微镜结果显示,PP-NPs为规则的圆形(图5)。
2.5 纳米颗粒包埋实验
如表2所示,与PP-NPs相比,PP-NPs包埋葛根素后平均粒径由172.78 nm增至491.33 nm,粒子计数率显著下降,且Zeta电位绝对值显著减小,差异均具有统计学意义(P<0.05)。同样,PP-NPs包埋小檗碱之后,平均粒径较PP-NPs显著增大,粒子计数率显著(P<0.05)下降,Zeta电位绝对值显著减小,差异均具有统计学意义(P<0.05)。上述结果表明,包埋了葛根素或小檗碱后,纳米颗粒的尺寸及表面电荷均受到影响。葛根素为疏水活性成分,纳米颗粒在热诱导自组装过程中将这些活性成分包裹于分子内部,实现对疏水性成分的装载[30],而对于水溶性的活性成分,纳米颗粒可以将活性成分包裹在内部或连接在载体表面的方式实现装载[31]。经反相色谱测定,PP-NPs对葛根素的包埋率为33.83%,对小檗碱的包埋率为24.61%,表明PP-NPs可以分别装载结构不同,溶解性不同的两类活性物质,具备构建天然蛋白质纳米载体的潜力,为进一步研究活性成分释放与靶向递送提供基础。
表 2 葛根蛋白纳米颗粒装载效果Table 2. Loading effect of PP-NPs样品 平均粒径
(d.nm)粒子计数率
(kcps)Zeta电位
(mV)包埋率
(%)PP-NPs 172.78±3.89 3018.17±107.33 −25.40±0.71 − PP-NPs包
埋葛根素491.33±17.8* 2546.13±56.04* −18.67±0.55* 33.83±2.71 PP-NPs包
埋小檗碱205.24±4.87* 2423.33±85.47* −14.70±0.87* 24.61±2.19 注:*表示与PP-NPs组比较,差异有统计学意义(P<0.05)。 3. 结论
本研究通过分离纯化获得一种尚未被报导的葛根胰蛋白酶抑制剂PP,经鉴定,PP的N端氨基酸序列与胰蛋白酶抑制剂具有高度同源性,且表现出明显的胰蛋白酶抑制活性,在pH2~10的环境中具有较好稳定性,在20~50 ℃温度范围内具有稳定性。该胰蛋白酶抑制剂具有热诱导自组装为蛋白纳米颗粒的能力,其最佳条件为:PP浓度0.1 mg/mL、pH6.0、温度100 ℃,加热60 min。此条件下形成的PP-NPs粒径为172.78 nm,颗粒大小呈正态分布,Zeta电位值为−25.40 mV,表明体系较稳定且颗粒表面带有大量负电荷,透射电子显微镜结果显示PP-NPs为规则的圆形且大小均匀。包埋实验结果表明PP-NPs对疏水性的葛根素及(热)水溶性的小檗碱均具有装载能力,装载率分别为33.83%与24.61%。该葛根蛋白在加热过程中自组装形成纳米颗粒的研究,不仅为开发天然蛋白质纳米载体提供了新的研究素材,还可以从一个新的角度认识加热过程中分子间相互作用及其对药效的影响。
-
表 1 葛根蛋白分子量及N端氨基酸序列比对
Table 1 Molecular weight and N-terminal amino acid sequence alignment of PP
名称 分子量(kDa) N端氨基酸序列 葛根蛋白(PP) 20.73 1 DFVYDMCGNVLNGGTYYIL 19 大豆胰蛋白酶
抑制剂(STI)~20 1 DFVLDNEGNPLENGGTYYIL 20 表 2 葛根蛋白纳米颗粒装载效果
Table 2 Loading effect of PP-NPs
样品 平均粒径
(d.nm)粒子计数率
(kcps)Zeta电位
(mV)包埋率
(%)PP-NPs 172.78±3.89 3018.17±107.33 −25.40±0.71 − PP-NPs包
埋葛根素491.33±17.8* 2546.13±56.04* −18.67±0.55* 33.83±2.71 PP-NPs包
埋小檗碱205.24±4.87* 2423.33±85.47* −14.70±0.87* 24.61±2.19 注:*表示与PP-NPs组比较,差异有统计学意义(P<0.05)。 -
[1] 黄再强. 几种川产葛根类药材的品质评价研究[D]. 成都: 成都中医药大学, 2017: 13. HUANG Zaiqiang. Study on quality evaluation several varieties of Puerariae Radix from Sichuan Province[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2017: 13.
[2] 程博琳, 苗明三. 葛根现代研究及应用特点分析[J]. 中医学报,2014,7(29):1014−1015. [CHEN Bolin, MIAO Mingsan. Modern research and application characteristics of gegen[J]. China Journal of Chinese Medicine,2014,7(29):1014−1015. doi: 10.16368/j.issn.1674-8999.2014.07.002 [3] YANG Lihong, CHEN Jing, LU Huanyu, et al. Pueraria lobata for diabetes mellitus: Past, present and future[J]. The American Journal of Chinese Medicine,2019,47(7):1419−1444. doi: 10.1142/S0192415X19500733
[4] WANG Shengguang, ZHANG Shiming, WANG Shaoping, et al. A comprehensive review on Pueraria: Insights on its chemistry and medicinal value[J]. Biomedicine & Pharmacotherapy,2020,131:110734.
[5] WANG Song, YAO Wei, ZHU Xudong, et al. Exploring the mechanism of the antithrombotic effects of Pueraria lobata and Pueraria lobata var.thomsonii based on network pharmacology[J]. Journal of Ethnopharmacology,2022,30(10):115701.
[6] JIANG Bo, YANG Wenhui, CHEN Lei, et al. In vitro effects of Pueraria extract on ethanol-exposed microglia and neurons[J]. Biomedicine & Pharmacotherapy,2020,127:110163.
[7] CAI Gaofeng, WU Caihong, MAO Ningning, et al. Isolation, purification and characterization of Pueraria lobata polysaccharide and its effects on intestinal function in cyclophosphamide-treated mice[J]. International Journal of Biological Macromolecules,2022,218:356−367. doi: 10.1016/j.ijbiomac.2022.07.153
[8] 王梦琪, 陈文婷, 程金生, 等. 葛根袋泡茶研制及风味成分分析[J]. 食品研究与开发,2022,43(18):114−121. [WANG Mengqi, CHEN Wenting, CHENG Jinsheng, et al. Development of Puerariae Lobatae Radix tea bag and analysis of the flavor components[J]. Food Research and Development,2022,43(18):114−121. doi: 10.12161/j.issn.1005-6521.2022.18.016 [9] 韩亚飞, 董笑笑. 葛根饮料的开发及抗氧化研究[J]. 饮料工业,2022,25(4):51−57. [HAN Yafei, DONG Xiaoxiao. Development and antioxidant research of Pueraria beverage[J]. Beverage industry,2022,25(4):51−57. doi: 10.3969/j.issn.1007-7871.2022.04.015 [10] 付旭冉, 叶永丽, 赵晓联, 等. 葛根功效活性及其在食品中的应用进展[J]. 食品研究与开发,2021,42(13):197−205. [FU Xuran, YE Yongli, ZHAO Xiaolian, et al. Research progress into multiple uses for Puerariae lobatae and its application in food[J]. Food research and Development,2021,42(13):197−205. doi: 10.12161/j.issn.1005-6521.2021.13.029 [11] 楚纪明, 马树运, 李海峰, 等. 葛根有效成分及其药理作用研究进展[J]. 食品与药品,2015,17(2):142−145. [CHU Jiming, MA Shuyun, LI Haifeng, et al. Progress in effective components and pharmacological effects of Puerariae Lobatae Radix[J]. Food and Drug,2015,17(2):142−145. doi: 10.3969/j.issn.1672-979X.2015.02.020 [12] LABDHI S, KAREN M B, STEPHEN A K, et al. Development of a self-assembling protein nanoparticle vaccine targeting plasmodium falciparum circumsporozoite protein delivered in three army liposome formulation adjuvants[J]. Vaccine,2017,35(41):5448−5454. doi: 10.1016/j.vaccine.2017.02.040
[13] ZHOU Jianwu, GAO Guanzhen, CHU Qiuping, et al. Chromatographic isolation of nanoparticles from Ma-Xing-Shi-Gan-Tang decoction and their characterization[J]. Journal of Ethnopharmacology,2014,151:1116−1123. doi: 10.1016/j.jep.2013.12.029
[14] YU Zhaoshuo, GAO Guanzhen, WANG Huiqin, et al. Identification of protein-polysaccharide nanoparticles carrying hepatoprotective bioactives in freshwater clam (Corbicula fluminea Muller) soup[J]. International Journal of Biological Macromolecules,2020,151:781−786. doi: 10.1016/j.ijbiomac.2020.02.105
[15] WANG Huiqin, GAO Guanzhen, KE Lijing, et al. Isolation of colloidal particles from porcine bone soup and their interaction with murine peritoneal macrophage[J]. Journal of Functional Foods,2019,54:403−411. doi: 10.1016/j.jff.2019.01.021
[16] ZHOU Jianwu, ZHANG Jian, GAO Guanzhen, et al. Boiling licorice produces self-assembled protein nanoparticles: A novel source of bioactive nanomaterials[J]. Journal of Agricultural and Food Chemistry,2019,67:9354−9361. doi: 10.1021/acs.jafc.9b03208
[17] 唐婷范, 杨杰, 黄芳丽, 等. 不同产地葛根蛋白质提取工艺及其功能性研究[J]. 食品研究与开发,2020,41(9):32−37. [TANG Tingfan, YANG Jie, HUANG Fangli, et al. Study of extraction technology and function of Pueraria lobata protein from different habitats[J]. Food Research and Development,2020,41(9):32−37. doi: 10.12161/j.issn.1005-6521.2020.09.006 [18] 颜真, 张英起. 蛋白质研究技术[M]. 西安: 第四军医大学出版社, 2007: 152-153. YAN Zhen, ZHANG Yingqi. Protein research technology[M]. Xi'an: Fourth Military Medical University Press, 2007: 152-153.
[19] NIKOLIC Z. Legumes seed storage proteins characterization by SDS-PAGE and Lab-on-a-Chip electrophoresis[J]. Journal of Food Composition and Analysis,2012,28(2):75−80. doi: 10.1016/j.jfca.2012.08.005
[20] WOLF W J. Gel-electrophoresis and amino-acid-analysis of the nonprotein nitrogen fractions of defatted soybean and almond meals[J]. Cereal Chemistry,1995,72(1):115−121.
[21] SAPPASITH K, SOOTTAWAT B. Effect of trypsin inhibitor in adzuki bean (Vigna angularis) on proteolysis and gel properties of threadfin bream (Nemipterus bleekeri)[J]. Food Science and Technology,2015,63:906−911.
[22] NICOLAI T. Formation and functionality of self-assembled whey protein microgels[J]. Colloids and Surfaces B: Biointerfaces,2016,137:32−38. doi: 10.1016/j.colsurfb.2015.05.055
[23] BAPI G, HIRA C, MANISHA P. Paclitaxel loaded vitamin E-TPGS nanoparticles for cancer therapy[J]. Materials Science & Engineering C,2018,91:868−880.
[24] LYU YongQin, TAN Tianwei, WANG Manyi, et al. One-step rapid determination and purification of puerarin from Radix puerariae by n-octylamine-modified poly (methacrylate-co-ethylene dimethacrylate) monolith[J]. Journal of Chromatography B,2008,871(1):1−6. doi: 10.1016/j.jchromb.2008.06.010
[25] LI Yi, XU Xu. Study on the precipitation reaction between baicalin and berberine by HPLC[J]. Journal of Chromatography B,2004,810(1):165−168. doi: 10.1016/S1570-0232(04)00579-3
[26] 苏子健. 豆类胰蛋白酶抑制剂对鱼类MBSP的作用机理研究[D]. 厦门: 集美大学, 2019. SU Zijian. Effect of legume trypsin inhibitor on MBSP in fish[D]. Xiamen: Jimei University, 2019.
[27] 刘垚彤. 马铃薯源蛋白酶抑制剂PPIs的抗氧化及抗肿瘤作用[D]. 沈阳: 沈阳农业大学, 2020. LIU Yaotong. Antioxidant and anti-tumor effects of potato derived protease inhibitor PPIs[D]. Shenyang: Shenyang Agricultural University, 2020.
[28] LIA Zongwei, CHAO Zhaoa, LIA Zhuoyu, et al. Reconstructed mung bean trypsin inhibitor targeting cell surface GRP78 induces apoptosis and inhibits tumor growth in colorectal cancer[J]. The International Journal of Biochemistry and Cell Biology,2014,47:68−75. doi: 10.1016/j.biocel.2013.11.022
[29] PARVEEN, ROMANA, SHAMSI, et al. Nanoparticles-protein interaction: Role in protein aggregation and clinical implications[J]. International Journal of Biological Macromolecules,2017,94:386−395. doi: 10.1016/j.ijbiomac.2016.10.024
[30] LIN Dai, LIN Wei, GAO Guanzhen, et al. Purification and characterization of the major protein isolated from Semen Armeniacae Amarum and the properties of its thermally induced nanoparticles[J]. International Journal of Biological Macromolecules,2020,159:850−858. doi: 10.1016/j.ijbiomac.2020.05.070
[31] MOHAMAD T B, HELENE G G, ABDELHAMID E, et al. Protein-based nanoparticles: From preparation to encapsulation of active molecules[J]. International Journal of Pharmaceutics,2017,522:172−197. doi: 10.1016/j.ijpharm.2017.01.067







 下载:
下载:
 下载:
下载:



