Antifungal and Mechanism of Perilla Essential Oil against Candida tropicalis and Pichia kluyveri
-
摘要: 控制泡菜发酵过程中的”生花”现象一直是发酵蔬菜产业迫切需要解决的重要问题。紫苏精油因含有天然的生物活性化合物而具有广谱抑菌性,在食品防腐中应用广泛。本研究测定了紫苏精油中的主要成分并分析其对发酵蔬菜-四川泡菜中产膜璞微生物热带假丝酵母和克鲁维尔毕赤酵母的抗菌活性。通过观察细胞形态、细胞膜完整性、胞内蛋白质的泄露、细胞膜电位的变化来探究了紫苏精油的抑菌机理,同时还测定了其对四川泡菜风味的影响。结果表明:紫苏精油不仅能抑制四川泡菜产膜璞微生物的生长,更能赋予发酵蔬菜风味。紫苏精油对产膜璞Candida tropicalis SH1和Pichia kluyveri SH2均有较强的抑制活性,MIC均为0.4 μL/mL,MFC分别为1.6和0.8 μL/mL。在最小抑菌浓度MIC和最小杀菌浓度MFC紫苏精油作用下,可明显改变Candida tropicalis SH1和Pichia kluyveri SH2细胞的形态,破坏膜的完整性,使膜电位与细胞内蛋白质浓度明显降低。该研究结果为构建及优化发酵蔬菜防腐方法提供科学依据和理论指导。Abstract: The inhibiting the pellicle formation has always been an important problem that urgently needs to solve the fermented vegetable industry. Perilla essential oil (PEO) has broad-spectrum antimicrobial properties because of its natural bioactive compounds and is widely used in food products. At present study, the main components of PEO were analyzed to explore the antifungal activity of PEO against the film-forming microorganisms Candida tropicalis SH1 and Pichia kluyveri SH2 in fermented vegetables-Sichuan pickle. The antifungal mechanism of PEO was explored by observing cell morphology, cell membrane integrity, intracellular protein leakage and mitochondrial membrane potential changes, and the influence of PEO on the flavor of Sichuan pickle was also measured. The results showed that PEO could not only inhibit the growth of Candida tropicalis and Pichia kluyveri, but also endow fermented vegetables with flavor. The minimum inhibitory concentration (MIC) of PEO against C. tropicalis and Pichia kluyveri were 0.4 μL/mL, and minimum fungicidal concentration (MFC) were 1.6 and 0.8 μL/mL, respectively. After MIC and MFC treatment with PEO, the cell morphology and cell membrane of the strains were changed, the protein concentration increased, and the membrane potential decreased significantly. These results would provide scientific basis and theoretical guidance for the construction and optimization of the preservative method of fermented vegetables.
-
蔬菜发酵是蔬菜加工的一种重要方式,通常以附着在蔬菜表面和发酵环境中的复杂微生物为媒介,在相对封闭的池或坛中自然发酵而成[1–2]。四川泡菜是中国发酵蔬菜的典型代表,因其独特的风味和丰富的营养价值而深受广大消费者喜爱,被誉为“川菜之骨”。自然发酵和无二次灭菌的特点使得发酵蔬菜中腐败微生物的存在无法避免。已有研究报道克鲁维尔毕赤酵母(Pichia kluyveri)和热带假丝酵母(Candida tropicalis)在酸性条件下生长,并产生白色膜醭(俗称“生花”)[3–4],打破了原有微生物生态平衡并大量繁殖,进而导致发酵蔬菜腐败,对发酵蔬菜行业造成巨大的经济损失。因此,控制泡菜发酵过程中的“生花”现象一直是发酵蔬菜产业迫切需要解决的重要问题。
植物精油含有丰富的天然生物碱、黄酮类化合物及单萜类物质,具有优异的生物活性,在食品工业中被广泛用作天然防腐剂,大量研究证明大多数植物精油通常被认为是安全的(GRAS)[5]。紫苏(Perilla frutescens)是唇形科一年生的药食同源草本植物,通常作为“生花”抑制剂用于传统泡菜生产[6]。紫苏精油(Perilla essential oil,PEO)是从紫苏叶中提取的一种复杂混合物,性质温和、无毒,具有良好的抗氧化和抗菌活性[7]。研究发现紫苏精油的抑菌功能主要是因为其含有生物活性次级代谢产物,如醛[8]、醇[9]、萜烯[10]等,抑菌对象主要集中在常见条件致病细菌如大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌[11]和粪肠球菌[12]等,此外,也有将紫苏精油渗入壳聚糖膜中形成一种可生物降解且环保的生物复合薄膜,极大增强其抗菌性能[13]。但目前为止,关于紫苏精油对抑制泡菜产膜璞微生物热带假丝酵母和克鲁维尔毕赤酵母的研究鲜有报道,对其抑菌机制也尚不明确。
基于此,本文以从传统发酵蔬菜——四川泡菜膜璞中分离的克鲁维尔毕赤酵母和热带假丝酵母为供试菌,探究紫苏精油对其成膜微生物的抑制作用,并分析其主要的活性成分,通过观察菌体的细胞形态、细胞膜的完整性、蛋白质含量及膜电位的变化揭示紫苏精油具体的抑制机理,同时分析紫苏精油作为“白色膜璞”抑菌剂对发酵过程中泡菜风味的影响,以期为开发高效低毒的天然提取物抑菌剂提供一定的理论基础与科学依据。
1. 材料与方法
1.1 材料与仪器
新鲜蔬菜、泡菜辅料 成都某农贸市场;干紫苏叶 毫州市鑫荣堂有限公司;克鲁维尔毕赤酵母C. tropicalis SH1、热带假丝酵母P. kluyveri SH2 分离自传统蔬菜泡菜的白色膜璞;马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)(g/L):马铃薯200.0、葡萄糖20.0、琼脂20.0;马铃薯葡萄糖培养基(Potato dextrose broth,PDB)(g/L):马铃薯200.0、葡萄糖20.0;正己烷、碘化丙啶(Propidium iodide,PI)、荧光探针5(6)-羧基荧光素二酸酯(5(6)-carboxyfluorescein diacetate,cFDA) 成都市科隆化学品有限公司;罗丹明123、BCA(bicinchoninic acid assay)蛋白质试剂盒 北京市索莱宝科技有限公司;Taq DNA polymerase、10×PCR Reaction Buffer(Mg2+ free)、dNTP TaKaRa公司;其他分析纯 购自成都市科隆化工试剂厂;50/30 μm DVB/CAR/PDMS萃取头 美国Supelco公司。
M1000 PRO多功能酶标仪 瑞士Tecan公司;DSY 5 000X倒置荧光显微镜 重庆重光实业有限公司;994低温超高速离心机 Thermo Scientific 公司;Scientz-IID超声波细胞粉碎仪 宁波新芝生物科技股份有限公司;6890 N气相色谱-质谱联用仪 美国Agilent公司;T-1 Thermoblock PCR自动扩增仪 美国Biometra Tgradient公司;720 BR电泳凝胶成像分析仪 美国BIP-RAD公司。
1.2 实验方法
1.2.1 紫苏精油的提取
根据《中国药典》中挥发油提取法[14]。将干紫苏叶粉碎,采用水蒸气蒸馏法得到淡黄色透明的紫苏精油,棕色瓶密封,4 ℃冰箱保存。
1.2.2 紫苏精油中成分的测定
紫苏精油中重要挥发性成分通过GC-MS法进行鉴定[7]。取3 mL的样品于顶空萃取瓶中,置于60 ℃水浴平衡15 min,随后插入萃取头吸附30 min后,从GC-MS进样口进样解析5 min后取出萃取头,色谱条件:Rtx-5MS色谱柱,载气为高纯度氦气,柱箱温度55 ℃,进样口温度220 ℃,分流比50:1,总流量67.4 mL/min,柱流量为1.00 mL/min,压力为119.8 kPa。升温程序:从55 ℃开始,保持4 min后,以10 ℃/min升至130 ℃,保持3 min,再以6 ℃/min升至240 ℃,保持15 min,检测器温度为240 ℃。质谱条件:离子化EI源,电离电源70 eV,离子源温度280 ℃,接口温度240 ℃,溶剂延迟时间2 min。
1.2.3 紫苏精油最小抑菌浓度(MIC)和最小杀菌浓度(MFC)的测定
采用Han等[15]方法测定PEO对C. tropicalis和P. kluyveri的MIC和MFC。PEO用0.1%吐温-20配制成6.4 μL/mL的母液,以二倍稀释法将精油稀释为终浓度为0.1~6.4 μL/mL的工作液。每个样本加入2% C. tropicalis和P. kluyveri(1.0×106 CFU/mL)30 ℃下静置培养24 h。以添加0.1%吐温-20的PDB作为阴性对照,每个浓度设置3个平行检测其600 nm处吸光值。紫苏精油的最小抑菌浓度(MIC)为实验菌株未能生长的最小浓度,同时取100 μL 96孔板中的菌悬液(其中紫苏精油浓度≥MIC)涂布于PDA培养基上,30 ℃静置孵育36 h,以肉眼不可见真菌菌落的最小浓度为紫苏精油对菌株的最小杀菌浓度(Minimum fungicidal concentration,MFC)。
1.2.4 紫苏精油抑菌机理研究
1.2.4.1 紫苏精油对细胞形态的影响
根据Xiang等[16]的方法适当调整,采用扫描电镜(Scanning electron microscope,SEM)观察紫苏精油对C. tropicalis SH1和 P. kluyveri SH2细胞外部形态的影响。将培养16 h至对数期的菌悬液调整至约1.0×106 CFU/mL,加入MIC和MFC的紫苏精油,以无菌PBS(pH7.4)为对照组,均放置于30 ℃,150 r/min摇床中培养3 h后,以4000 r/min低温离心5 min收集菌体,用无菌PBS(pH7.4)洗涤3次,冲洗完成后用2.5%(v/v)戊二醛固定5 h,再将载玻片上的细胞依次在20%、40%、60%、80%和100%乙醇中脱水数次。裹上保鲜膜扎孔置于-20 ℃预冻12 h,完成预冻后置于冷冻干燥机中-45 ℃干燥36 h,最后将带有细胞的载玻片粘贴在载物台上溅射镀金后镜检拍照。
1.2.4.2 紫苏精油对细胞膜完整性的影响
采用荧光倒置显微镜观察菌体细胞膜的完整性,使用cFDA和PI对实验菌株进行染色。cFDA荧光产物能在具有完整细胞膜的细胞中积累发射绿色荧光,而PI只能进入破损的细胞,与DNA结合发射出红色荧光[17]。将菌株在PDB中30 ℃培养16 h到对数期,调整菌液浓度至1.0×106 CFU/mL,再使用不同浓度的紫苏精油(0、MIC、MFC)处理3 h,以4000 r/min离心5 min收集菌沉淀,用等体积的PBS溶液(pH7.4)洗涤3次并重悬,加入荧光探针cFDA使得浓度为2.5 μmol/L,并于20 ℃避光下孵育5 min,随后加入PI染料至终浓度为0.5 μmol/L,并避光培养10 min,最后取200 μL菌悬液置于黑色的96孔板中在荧光倒置显微镜下观察并拍照记录,每个浓度设置3个复孔。
1.2.4.3 紫苏精油对细胞内蛋白质浓度的影响
将菌株在PDB中于30 ℃培养16 h至对数生长期,将不同浓度的紫苏精油(0、MIC、MFC)添加到菌悬液中,并在30 ℃分别孵育0、2.0和8.0 h,再取10 mL细胞悬浮液以4000 r/min离心5 min收集弃去上清,在PBS(pH7.4)溶液中完全洗涤,并重悬于10 mL PBS(pH7.4)中后,在冰浴中以450 W通过间歇性超声波以10 s的间隔破碎细胞25 min,未经紫苏精油处理的细胞用作空白对照,最后通过BCA蛋白质试剂盒测定细胞中的蛋白质含量。
1.2.4.4 紫苏精油对线粒体膜电位的影响
采用JC-1荧光染色法测定线粒体膜电位,根据Comas等[18]的方法做适当调整。将对数期的菌悬液调整至约1.0×106 CFU/mL,再分别加入不同浓度的紫苏精油(0、MIC、MFC)摇床中培养3 h,以4000 r/min离心5 min弃掉上清再用PBS(pH7.4)冲洗3次,将JC-1探针在避光下加入各组菌悬液至其终浓度为10 μg/mL,混合均匀后在恒温摇床中继续培养16 min,使样品中细胞与JC-1探针充分混合。最后使用等体积的PBS溶液(pH7.4)洗涤3次并重悬。将每组混匀的菌液各取100 μL于96孔板中,每个浓度设置3个复孔。使用酶标仪测定红色荧光值(激发波长550 nm,发射波长600 nm)和绿色荧光值(激发波长485 nm,发射波长535 nm),线粒体膜电位由红色荧光与绿色荧光强度比值(FI)表示。
1.2.5 紫苏精油对膜璞的抑制及泡菜风味的影响
采用四川泡菜的传统方法制备泡菜[19],常温下进行自然发酵(每天进行开盖5 min)。以添加紫苏精油至终浓度为5.0 mg/L为实验组(PEO);以添加无菌水为空白组(CON)。取第1、2、3、5、7 d发酵液于20 mL的顶空萃取瓶中,加入0.5 g氯化钠,15 μL二甲基三庚酮(200 μg/L)作为内标,混合均匀。采用顶空固相微萃取方法处理样品,密封后置于40 ℃恒温槽中水浴加热保温10 min,然后插入50/30 μm DVB/CAR/PDMS萃取头顶空萃取30 min后,将萃取头插入GC进样口,250 ℃解吸5 min。
色谱条件:气相色谱柱:DB-5石英毛细管柱(30 m×0.25 mm,0.25 μm)弹性石英纤维毛细管柱;升温程序:50 ℃保持5 min,以5 ℃/min升至160 ℃,保持5 min,再以13 ℃/min升至250 ℃,保持5 min;载气(He)流速为1.20 mL/min,压力为 100 kPa;进样方式:不分流。质谱条件:接口温度250 ℃,离子源温度230 ℃,以电子轰击(EI)为离子源,电子能量为70 eV;使用全扫描模式,扫描范围:30~400 m/z。
1.3 数据处理
采用SPSS 21.0(IBM公司)和GraphPad Prism 8.0软件(GraphPad Software公司)进行数据处理分析,所有的分析重复3次,结果以平均值±标准差表示。用Tukey多重比较方法进行显著性分析。利用Origin 2020软件绘制挥发性风味物质含量变化热图;利用SIMCA 16软件分析挥发性风味物质差异性。
2. 结果与分析
2.1 紫苏精油的主要成分
运用GC-MS分析紫苏精油中主要的挥发性成分,其中将含量前22种成分呈现在表1中,总质量分数为95.38%。其中芳樟醇(55.87%)、柠檬烯(11.74%)、紫苏酮(5.02%)、桉叶油醇(4.73%)、反,反-2,4-庚二烯醛(3.90%)。成分分析表明,紫苏精油中主要成分为单萜类化合物及其氧化物,如柠檬烯、芳樟醇、月桂烯等。Ito等[20]发现柠檬烯和芳樟醇是紫苏精油的主要成分,这与本研究的结果一致。有研究表明:柠檬烯与芳樟醇对一些食源性病原菌有较强的抑菌作用[21],可作为天然的防腐保鲜剂,但也有学者表明紫苏精油中紫苏酮和紫苏醛也是主要的抑菌成分[8,10],本研究GC-MS的分析结果中并未检测出紫苏醛,这可能是由于紫苏的品种,生长时期与生长环境不同,导致精油组成成分的种类与比例发生改变,造成抑菌成分的差异[22]。当然,精油中存在的微量成分对抑菌活性的影响可能比精油中的主要成分更为重要,其主要成分可能与其他活性成分产生协同作用从而发挥更大的抗菌活性[23]。
表 1 紫苏精油中主要挥发性成分Table 1. Major volatile component of PEO序号 保留时间
(min)化合物 化学式 相对含量
(%)1 3.29 4-辛酮 C8H16O 0.15 2 3.74 2,4-二甲基-1-庚烯 C9H18 0.65 3 3.79 氰乙酰腈 C9H13ClN6 0.16 4 5.93 (1R)-(+)-α-蒎烯 C10H16 1.88 5 5.96 2,4,6-三甲基辛烷 C11H24 2.44 6 6.17 2-壬烯-1-醇 C9H18O 0.26 7 6.22 莰烯 C10H16 0.18 8 6.28 桧烯 C10H16 0.32 9 6.33 1-甲基-2-(3-甲基戊基)环丙烷 C10H20 0.25 10 6.56 3-异丙基-6-亚甲基-1-环己烯 C10H16 0.74 11 7.02 左旋-β-蒎烯 C10H16 1.65 12 7.24 月桂烯 C10H16 1.92 13 7.44 反,反-2,4-庚二烯醛 C7H10O 3.90 14 7.89 甲基庚烯酮 C8H14O 0.26 15 8.23 桉叶油醇 C10H18O 4.73 16 8.93 邻-异丙基苯 C10H14 1.27 17 9.10 柠檬烯 C10H16 11.74 18 9.13 萜品油烯 C10H16 0.68 19 9.21 紫苏酮 C19H24O3 5.02 20 9.82 芳樟醇 C10H18O 55.87 21 10.34 丁香烯 C15H24 0.23 22 11.23 4-萜烯醇 C10H18O 1.08 − − 总计 − 95.38 2.2 紫苏精油最小抑菌浓度(MIC)和最小杀菌浓度(MFC)的测定
MIC和MFC是衡量物质抑菌能力的重要指标之一[24]。通过二倍稀释法得到紫苏精油对C. tropicalis SH1的MIC值为0.4 μL/mL,MFC值为1.6 μL/mL。对P. kluyveri SH2的MIC值为0.4 μL/mL,MFC值为0.8 μL/mL(表2)。相较于菌株C. tropicalis SH1,紫苏精油对P. kluyveri SH2的MIC值更小,推测P. kluyveri SH2在紫苏精油处理下更加敏感。这与Hu等[5]报道的紫苏精油对黄曲霉的抑菌活性存在一定的差异,这种差异的存在可能是由于其供试菌株的特异性造成的。
表 2 紫苏精油对C. tropicalis SH1和 P. kluyveri SH2 的MIC和MFC测定Table 2. Determination of concentration MIC and MBC of C. tropicalis SH1 and P. kluyveri SH2 by PEO菌株 MIC(μL/mL) MFC(μL/mL) C. tropicalis SH1 0.4 1.6 P. kluyveri SH2 0.4 0.8 2.3 紫苏精油对细胞形态的影响
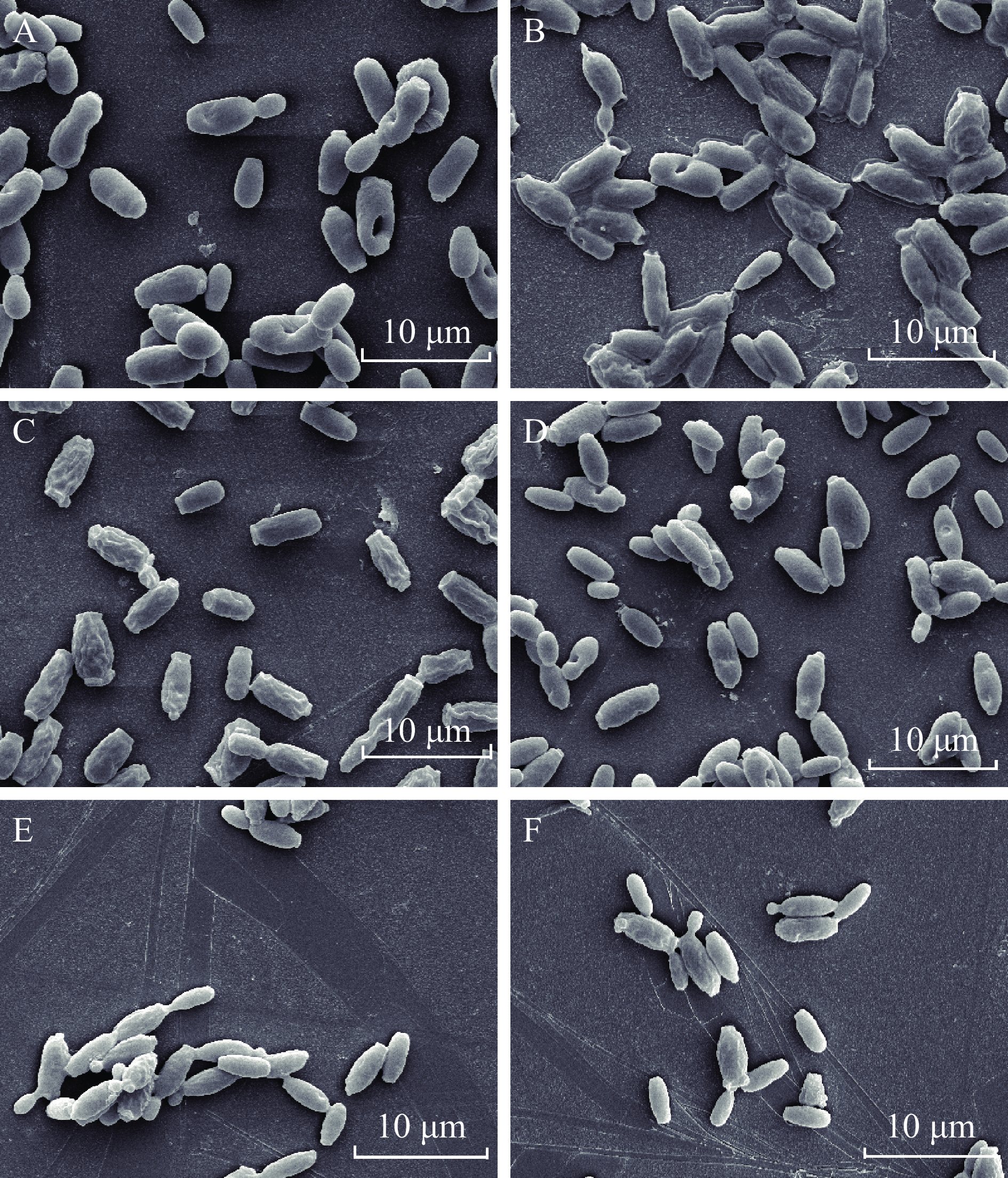
通过扫描电镜观察紫苏精油对C. tropicalis SH1和P. kluyveri SH2细胞形态的影响,探讨紫苏精油的抑菌机理。如图1所示,未经处理的C. tropicalis SH1与P. kluyveri SH2具有正常的结构形态,细胞表面光滑完整,未出现细胞破损(图1A、图1D)。而经MIC紫苏精油处理的细胞均受到明显的形态学损伤,表面出现皱褶和不规则的纹路,细胞之间发生堆积并粘附聚集(图1B、图1E),此外相互交联的C. tropicalis SH1被一层透明的膜包裹(图1B)。经MFC的紫苏精油处理时,C. tropicalis SH1表现出更明显的皱缩(图1C、图1F)。结果表明紫苏精油能够改变C. tropicalis SH1和P. kluyveri SH2正常的细胞形态。
![]() 图 1 紫苏精油对 C. tropicalis SH1和 P. kluyveri SH2细胞形态的影响注:A:未经处理的C. tropicalis;B:MIC紫苏精油处理的C. tropicalis;C:MFC紫苏精油处理的C. tropicalis;D:未经处理的P. kluyveri;E:MIC紫苏精油处理的P. kluyveri;F:MFC紫苏精油处理的P. kluyveri;图2同。Figure 1. Effects of PEO treatment on morphology of C. tropicalis SH1 and P. kluyveri SH2
图 1 紫苏精油对 C. tropicalis SH1和 P. kluyveri SH2细胞形态的影响注:A:未经处理的C. tropicalis;B:MIC紫苏精油处理的C. tropicalis;C:MFC紫苏精油处理的C. tropicalis;D:未经处理的P. kluyveri;E:MIC紫苏精油处理的P. kluyveri;F:MFC紫苏精油处理的P. kluyveri;图2同。Figure 1. Effects of PEO treatment on morphology of C. tropicalis SH1 and P. kluyveri SH22.4 紫苏精油对细胞膜完整性的影响
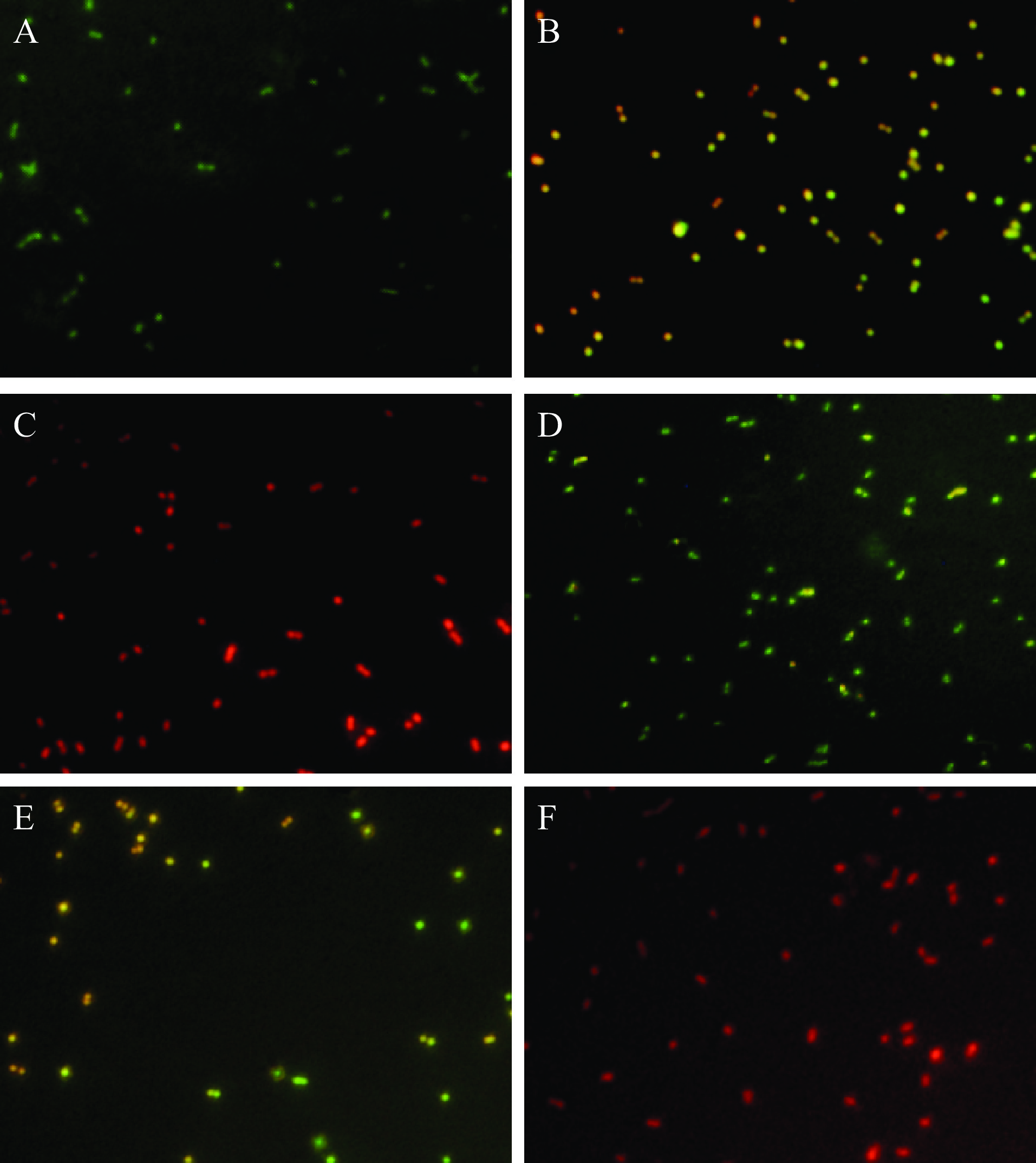
细胞膜的完整性可通过核酸荧光探针cFDA和PI判定[17],并在荧光倒置显微镜下进行观察。结果如图2所示,未经处理的细胞发射出明亮的绿色荧光(图2A、图2D),表明细胞膜形态完整。而MIC紫苏精油处理后,红色荧光强度增强,绿色荧光开始减弱(图2B、图2E),说明紫苏精油在一定程度上破坏了C. tropicalis SH1和P. kluyveri SH2的细胞膜完整性。随着紫苏精油浓度增加,红色荧光显著增加,视野中几乎无绿色荧光(图2C、图2F),说明高浓度的紫苏精油对细胞膜破坏程度更大。Liu等[25]也证实了芳樟醇可以穿过细胞膜,改变膜组成,增加膜的流动性,最终破坏细胞膜的完整性,而在本实验中发现紫苏精油中的芳樟醇含量最高,因此,紫苏精油破坏细胞膜作用其很可能由精油中的芳樟醇贡献。
2.5 紫苏精油对细胞内蛋白质浓度的影响
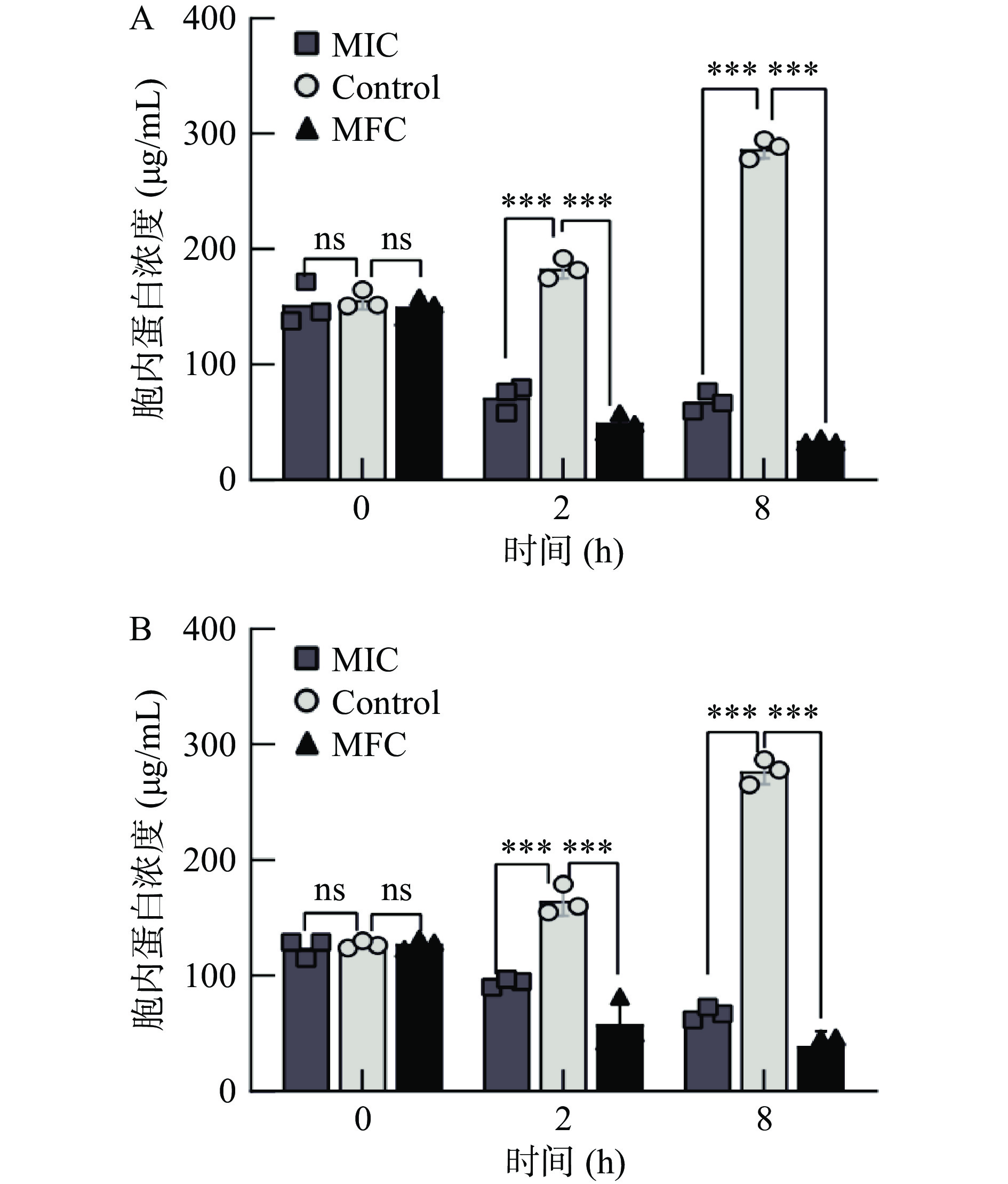
紫苏精油对细胞内蛋白质浓度的影响如图3所示。对照组蛋白质含量在8 h内呈上升趋势。与对照组相比,MIC紫苏精油处理2 h后,C. tropicalis SH1和P. kluyveri SH2细胞内蛋白质的浓度分别降低了60.93%、42.95%,MFC紫苏精油处理后蛋白浓度下降了72.92%和64.58%。表明紫苏精油可影响细胞膜的完整性,导致蛋白质浓度显著下降(P<0.001)。此外,其胞内蛋白质泄露量与精油的处理浓度、处理时间呈正相关。当处理时间为8 h时,蛋白质下降程度更为明显。研究结果表明:紫苏精油能够破坏菌体细胞膜,增加其通透性,造成胞内大分子物质流出,从而导致菌体死亡。Yu等[26]证实了柠檬烯能破坏热带假丝酵母的细胞膜,从而使得胞内的大分子物质通过细胞膜渗漏至胞外,而在本研究中发现紫苏精油中含有11.74%的柠檬烯,与结果较为符合。
2.6 紫苏精油对线粒体膜电位的影响
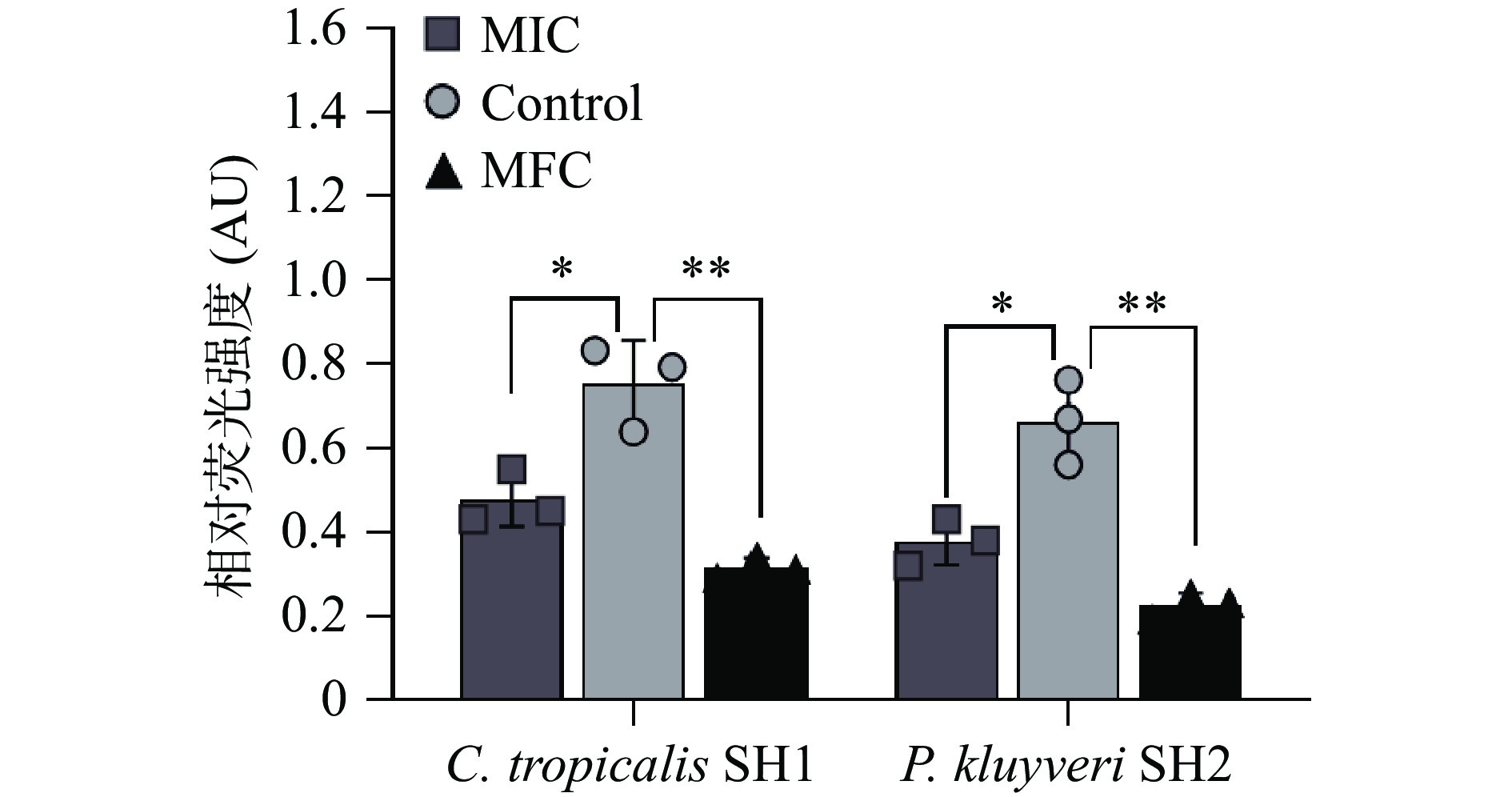
线粒体膜电位(Mitochondrial membrane potential,MMP,△Ψm)是线粒体发挥功能的必要前提,当△Ψm下降通常被认为是在细胞形态学改变前普遍出现的现象。JC-1荧光探针在△Ψm正常时聚集在线粒体基质中并激发出红色荧光。相反,发生去极化时,△Ψm降低,JC-1荧光探针从线粒体内释放,逆转为激发出绿色荧光的单体。通过检测细胞红色荧光值可测定菌株的线粒体膜电位[24]。经MIC、MFC的紫苏精油处理后C. tropicalis SH1和P. kluyveri SH2的△Ψm均显著下降(P<0.05)(图4),且表现出浓度依赖性。Yang等[27]研究者报道了植物精油能够通过破坏线粒体的膜电位来诱导Penicillium italicum细胞的凋亡,造成不可逆的损伤。
2.7 发酵过程中紫苏精油对膜璞的抑制及对挥发性物质的影响
2.7.1 紫苏精油对膜璞的抑制作用
随着泡菜发酵的进行,在第3 d空白组液面开始出现零星膜状物质,到第7 d泡菜液表面出现一层厚实的褶皱膜璞,汁液变浑浊,蔬菜发生褐变等腐败现象。而加入紫苏精油的泡菜发酵5 d,汁液仍清亮透明,蔬菜颜色鲜亮,从腌制7 d开始,液面才浮现一层薄薄的膜璞(图5),因此紫苏精油可有效改善泡菜的“生花”腐败现象。
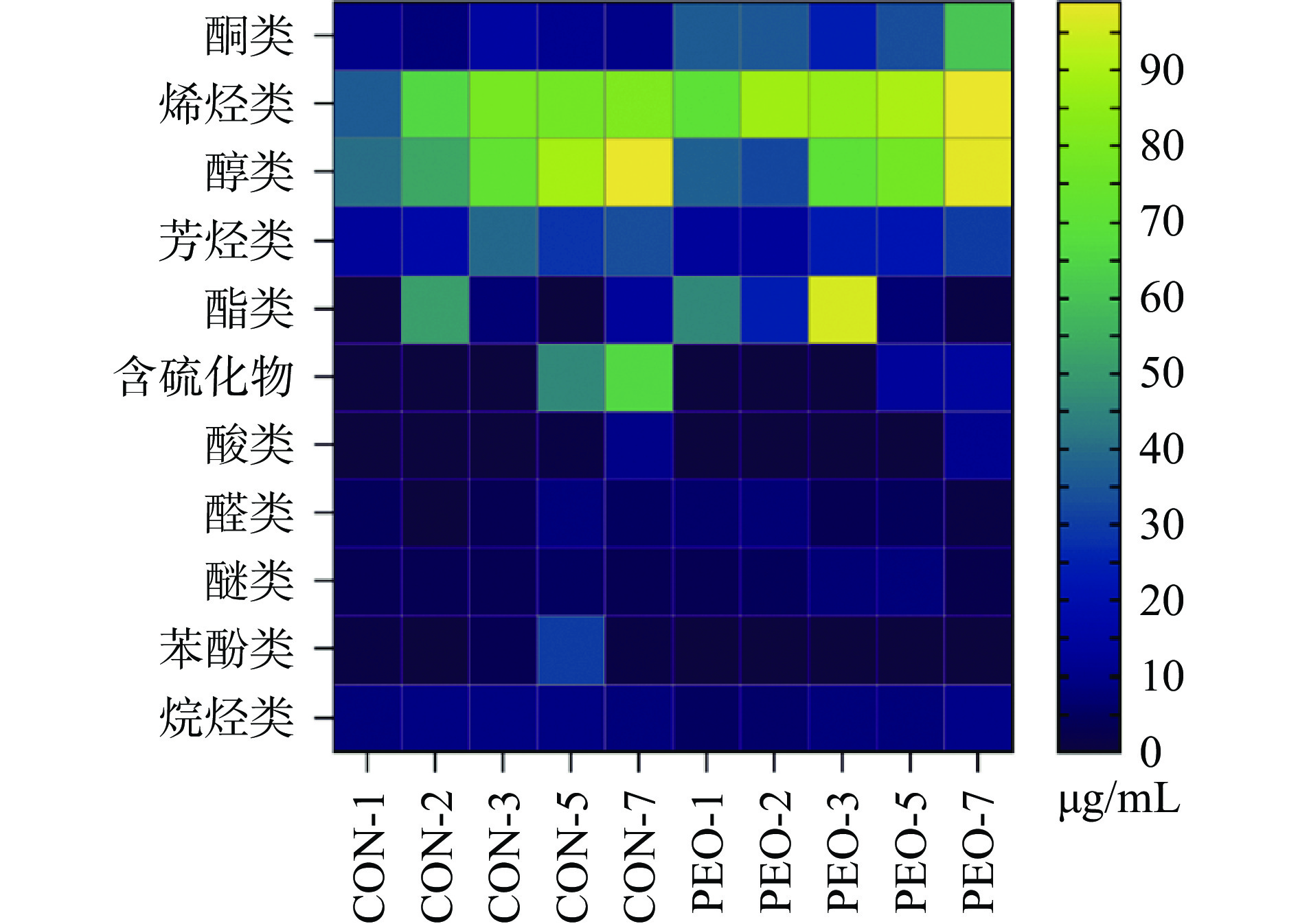
2.7.2 挥发性风味物质的热图及聚类分析
利用SPME-GC/MS(solid-phase microextraction gas chromatography-mass spectrometry)在CON和PEO组发酵液中共检测到99种挥发风味物质(Volatile flavor compounds,VOCs),可归类为酮类、烯烃类、醇类、芳香族化合物、酯类、酸类、含硫化合物、醛类、醚类、酚类、烷烃类(图6)。在蔬菜的自然发酵过程中,紫苏精油引起酮类、酯类和含硫化合物含量发生明显变化,在整个发酵过程中,与CON组相比,PEO组的酮类物质含量更高且种类更加丰富,此外,PEO组的含硫化合物较CON组有所减少。与酮类物质相似,PEO组中的酯类物质较CON组高,CON组在发酵第2 d酯类物质总量最高,而PEO组则是有所延迟,在发酵第3 d其含量达到最高112.35 μg/L。
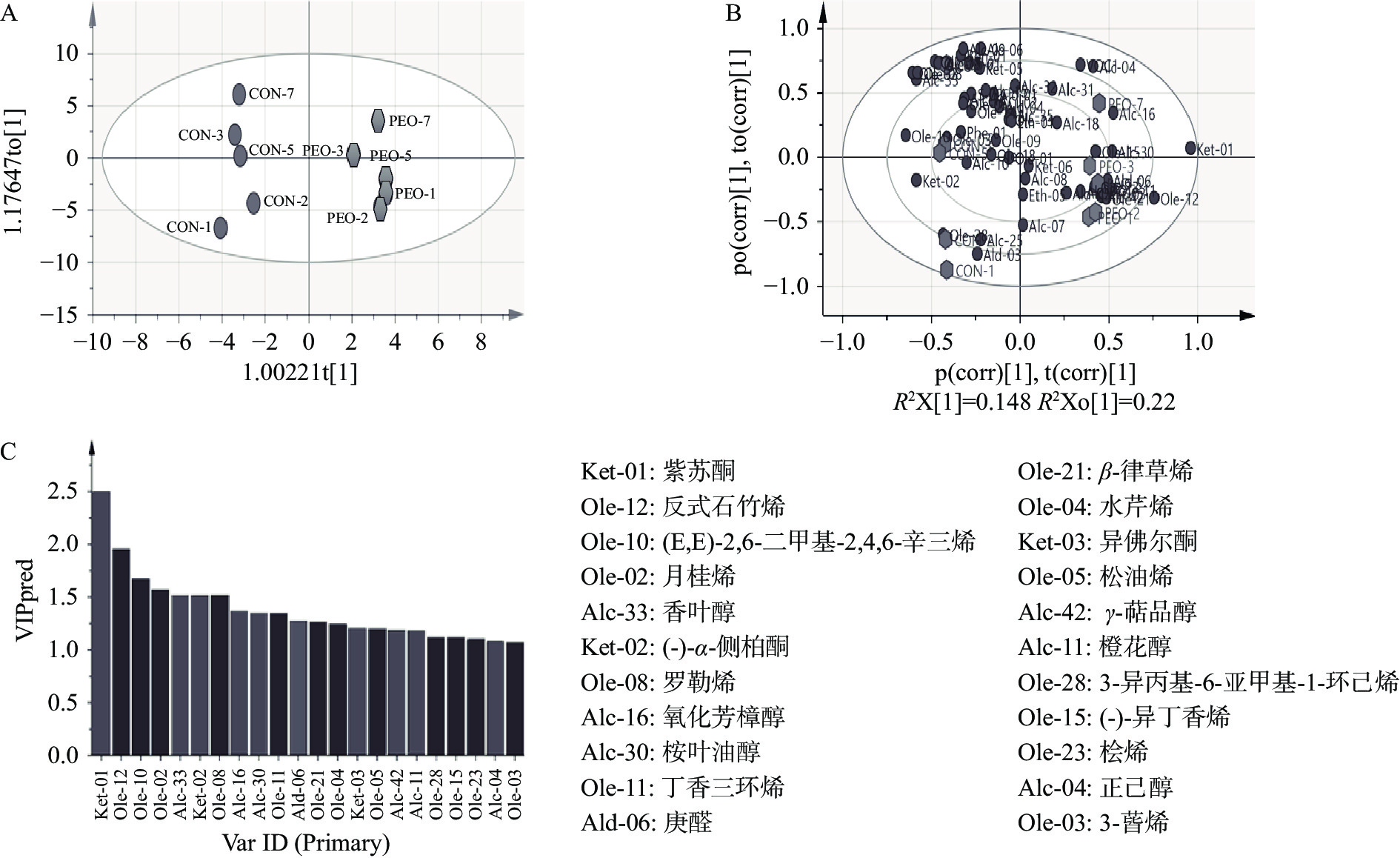
2.7.3 挥发性风味物质的OPLS-DA分析
挥发性成分是传统发酵食品最重要的特征之一,也是决定其食品质量的主要因素[28]。利用SIMCA 16.0软件对CON和PEO发酵过程中的挥发性风味物质进行正交偏最小二乘判别(OPLS-DA)分析处理,其结果如图7。OPLS-DA模型通过将X轴矩阵信息分解成与Y相关和不相关的两类信息,能够过滤掉与分组不相关的变量,结合差异性变量的重要性投影值(variable importance in the projection,VIP),从而使获得的差异性代谢物更加可靠[29]。通过OPLS-DA模型快速准确地筛选出紫苏精油对发酵蔬菜的差异挥发性风味物质,探究紫苏精油对发酵蔬菜挥发性风味物质形成的影响。
图7A表示CON和PEO两组中总挥发性物质的分布情况,图7B表示所有挥发性物质对两组发酵样品的差异贡献情况。结果表明采用偏最小二乘法判别分析方法,对于CON和PEO两组样本具有良好的分离性(图7A),区分显著,并都处于95%置信区间内。图7B表示不同挥发性化合物与两组发酵样品的差异相关性,化合物离坐标中心点越远,代表化合物对样品之间的差异性越大,结合图7C,共有22种挥发性风味物质的贡献值(VIP)值均大于1,说明这些挥发性风味物质的两组间含量存在显著性差异。其中,丁香三环烯、石竹烯、(-)-异丁香烯、桧烯、庚醛、紫苏酮、顺-Α,Α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇仅在PEO组中检出,香叶醇仅在CON中检测到,醇类与烯烃类物质是导致两组样品区分开的重要因素。在发酵第5~7 d在CON组检测到硫化物,二甲基二硫和二甲基三硫是许多发酵产物中的微量成分,给样品带来典型的臭味,对发酵风味有显著的负面影响。Ao等[30]报道二甲基硫化物是变质四川泡菜的主要刺激性气味,PEO组的二甲基硫化物含量显著低于CON组,研究表明紫苏精油的加入显著降低了异味,提高了泡菜的整体可接受度。
3. 结论
本研究通过GC-MS分析鉴定了紫苏精油中的主要成分,其中含量相对较高的化合物依次是芳樟醇(55.87%)、柠檬烯(11.74%)、紫苏酮(5.02%)、桉叶油醇(4.73%)、反,反-2,4-庚二烯醛(3.90%)。紫苏精油可以有效抑制四川泡菜中产膜璞微生物C. tropicalis和P. kluyveri的生长,对两株菌的MIC值均为0.4 μL/mL,对C. tropicalis MFC值为1.6 μL/mL,P. kluyveri MFC值为0.8 μL/mL。紫苏精油对C. tropicalis和P. kluyveri的抑制作用主要通过破坏细胞膜,增大其通透性,破坏线粒体膜电位,导致胞内蛋白质泄露,引起细胞代谢紊乱发挥抑菌效果。同时,紫苏精油作为抑菌剂添加到四川泡菜中,可以赋予其一定的风味。后续研究将采用组学方法,从分子层面上进一步探究紫苏精油的抑菌机制,为构建及优化泡菜防腐的方法提供理论依据,对评估紫苏精油及其生物活性化合物在食品加工与保存中的开发利用具有重要指导意义。
-
图 1 紫苏精油对 C. tropicalis SH1和 P. kluyveri SH2细胞形态的影响
注:A:未经处理的C. tropicalis;B:MIC紫苏精油处理的C. tropicalis;C:MFC紫苏精油处理的C. tropicalis;D:未经处理的P. kluyveri;E:MIC紫苏精油处理的P. kluyveri;F:MFC紫苏精油处理的P. kluyveri;图2同。
Figure 1. Effects of PEO treatment on morphology of C. tropicalis SH1 and P. kluyveri SH2
表 1 紫苏精油中主要挥发性成分
Table 1 Major volatile component of PEO
序号 保留时间
(min)化合物 化学式 相对含量
(%)1 3.29 4-辛酮 C8H16O 0.15 2 3.74 2,4-二甲基-1-庚烯 C9H18 0.65 3 3.79 氰乙酰腈 C9H13ClN6 0.16 4 5.93 (1R)-(+)-α-蒎烯 C10H16 1.88 5 5.96 2,4,6-三甲基辛烷 C11H24 2.44 6 6.17 2-壬烯-1-醇 C9H18O 0.26 7 6.22 莰烯 C10H16 0.18 8 6.28 桧烯 C10H16 0.32 9 6.33 1-甲基-2-(3-甲基戊基)环丙烷 C10H20 0.25 10 6.56 3-异丙基-6-亚甲基-1-环己烯 C10H16 0.74 11 7.02 左旋-β-蒎烯 C10H16 1.65 12 7.24 月桂烯 C10H16 1.92 13 7.44 反,反-2,4-庚二烯醛 C7H10O 3.90 14 7.89 甲基庚烯酮 C8H14O 0.26 15 8.23 桉叶油醇 C10H18O 4.73 16 8.93 邻-异丙基苯 C10H14 1.27 17 9.10 柠檬烯 C10H16 11.74 18 9.13 萜品油烯 C10H16 0.68 19 9.21 紫苏酮 C19H24O3 5.02 20 9.82 芳樟醇 C10H18O 55.87 21 10.34 丁香烯 C15H24 0.23 22 11.23 4-萜烯醇 C10H18O 1.08 − − 总计 − 95.38 表 2 紫苏精油对C. tropicalis SH1和 P. kluyveri SH2 的MIC和MFC测定
Table 2 Determination of concentration MIC and MBC of C. tropicalis SH1 and P. kluyveri SH2 by PEO
菌株 MIC(μL/mL) MFC(μL/mL) C. tropicalis SH1 0.4 1.6 P. kluyveri SH2 0.4 0.8 -
[1] XIANG W L, ZHAO Q H, LU Y, et al. Tetracycline residues alters profile of lactic acid bacterial communities and metabolites of ginger pickle during spontaneous[J]. Food Research International,2022,155:111109. doi: 10.1016/j.foodres.2022.111109
[2] LIU L, SHE X, QIAN Y, et al. Effect of different fermenting containers on the deterioration of Sichuan pickle[J]. LWT - Food Science and Technology,2019,111:829−836. doi: 10.1016/j.lwt.2019.05.024
[3] 王猛, 蒋云露, 杨建涛, 等. 不同盐质量浓度四川泡菜腐败前后微生物的分析比较研究[J]. 食品科学,2015,36(13):184−189. [WANG M, JIANG Y L, YANG J T, et al. Comparative analysis of microflora profile in spoilage Sichuan pickle with different salt concentrations before and after spoilage[J]. Food Science,2015,36(13):184−189. WANG M, JIANG Y L, YANG J T, et al. Comparative analysis of microflora profile in spoilage Sichuan Pickle with different salt concentrations before and after spoilage [J]. Food Science, 2015, 36(13): 184−189.
[4] 敖晓琳, 蒲彪, 蔡义民, 等. 能抑制引起泡菜“生花”腐败菌的乳酸菌的筛选[J]. 食品工业科技,2014,35(14):234−236. [AO X L, PU B, CAI Y M, et al. Screening Lactobacillus to inhibit spoilage microorganism isolated from film-forming pickle[J]. Science and Technology of Food Industry,2014,35(14):234−236. doi: 10.13386/j.issn1002-0306.2014.14.043 AO X L, PU B, CAI Y M, et al. Screening Lactobacillus to inhibit spoilage microorganism isolated from film-forming pickle [J]. Science and Technology of Food Industry, 2014, 35(14): 234−236. doi: 10.13386/j.issn1002-0306.2014.14.043
[5] HU Z Y, YUAN K, ZHOU Q, et al. Mechanism of antifungal activity of Perilla frutescens essential oil against Aspergillus flavus by transcriptomic analysis[J]. Food Control,2021,123:107703. doi: 10.1016/j.foodcont.2020.107703
[6] HOU T Y, NETALA V R, ZHANG H J, et al. Perilla frutescens: A rich source of pharmacological active compounds[J]. Molecules,2022,27(11):3578. doi: 10.3390/molecules27113578
[7] ZHOU Q, HU Z Y, DU L H, et al. Inhibition of Enterococcus faecalis growth and cell membrane integrity by Perilla frutescens essential oil[J]. Foodborne Pathogens and Disease,2020,17(9):547−554. doi: 10.1089/fpd.2019.2771
[8] ERHUNMWUNSEE F, PAN C, YANG K L, et al. Recent development in biological activities and safety concerns of perillaldehyde from Perilla plants: A review[J]. Critical Reviews in Food Science and Nutrition,2022,4:1−13.
[9] THOMAS C, CLOVIS O, DANIEL D, et al. The monoterpenoid perillyl alcohol: Anticancer agent and medium to overcome biological barriers[J]. Pharmaceutics,2021,13(12):2167. doi: 10.3390/pharmaceutics13122167
[10] AHMED H M, TAVASZI-SAROSI S. Identification and quantification of essential oil content and composition, total polyphenols and antioxidant capacity of Perilla frutescens (L.) Britt[J]. Food Chemistry,2019,275:730−738. doi: 10.1016/j.foodchem.2018.09.155
[11] KONG H Y, ZHOU B, HU X Q, et al. Protective effect of Perilla (Perilla frutescens) leaf essential oil on the quality of a surimi-based food[J]. Journal of Food Processing and Preservation,2017,21:e13540.
[12] ZHOU Q, HU Z Y, DU L H, et al. Inhibition of Enterococcus faecalis growth and cell membrane integrity by Perilla frutescens essential oil[J]. Foodborne Pathogens and Disease,2020,17(9):1−8.
[13] ZHANG Z J, LI N, LI H Z, et al. Preparation and characterization of biocomposite chitosan film containing Perilla frutescens (L.) Britt. essential oil[J]. Industrial Crops and Products,2018,112:660−667. doi: 10.1016/j.indcrop.2017.12.073
[14] TENG H, LEE W Y. Antibacterial and antioxidant activities and chemical compositions of volatile oils extracted from Schisandra chinensis Baill. seeds using simultaneous distillation extraction method, and comparison with Soxhlet and microwave-assisted extraction[J]. Bioscience, Biotechnology, and Biochemistry,2014,78(1):79−85. doi: 10.1080/09168451.2014.877815
[15] HAN Y J, SUN Z C, CHEN W X. Antimicrobial susceptibility and antibacterial mechanism of limonene against Listeria monocytogenes[J]. Molecules,2019,25(1):33. doi: 10.3390/molecules25010033
[16] XIANG W L, LIANG H Z, LIU S, et al. Isolation and performance evaluation of halotolerant phosphate solubilizing bacteria from the rhizospheric soils of historic Dagong brine well in China[J]. World Journal of Microbiology and Biotechnology,2011,27(11):2629−2637. doi: 10.1007/s11274-011-0736-0
[17] ZHANG Y B, LIU X Y, WANG Y F, et al. Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J]. Food Control,2016,59:282−289. doi: 10.1016/j.foodcont.2015.05.032
[18] COMAS J, VIVES-REGO J. Assessment of the effects of gramicidin, formaldehyde, and surfactants on Escherichia coli by flow cytometry using nucleic acid and membrane potential dyes[J]. Cytometry,1997,29(1):58−64. doi: 10.1002/(SICI)1097-0320(19970901)29:1<58::AID-CYTO6>3.0.CO;2-9
[19] RAO Y, QIAN Y, TAO Y F, et al. Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J]. Food Control,2020,113:107174. doi: 10.1016/j.foodcont.2020.107174
[20] ITO M, TOYODA M, KAMAKURA S, et al. A new type of essential oil from Perilla frutescens from Thailand[J]. Journal of Essential Oil Research,2002,14(6):416−419. doi: 10.1080/10412905.2002.9699907
[21] LU H Y, XU C X, ZHANG X, et al. Antibacterial effect of limonene on food-borne pathogens[J]. Journal of Zhejiang University (Agriculture and Life Sciences),2016,42(3):306−312.
[22] ROSA A, NIEDDU M, PETRETTO G L, et al. Chemical composition andin vitro bioactivity of essential oil obtained from the flavedo of ‘pompia’, an ancient Sardinian fruit[J]. Journal of Essential Oil Research,2019,31(5):1−10.
[23] FEI L, LIANG H, LI C F, et al. In vitro antimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms[J]. Food Research International,2011,44(9):3057−3064. doi: 10.1016/j.foodres.2011.07.030
[24] HWANG I, LEE J Y, HWANG J H, et al. Silver nanoparticles induce apoptotic cell death in Candida albicans through the increase of hydroxyl radicals[J]. The FEBS Journal,2012,279(7):1327−1338. doi: 10.1111/j.1742-4658.2012.08527.x
[25] LIU X, CAI J, CHEN H, et al. Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J]. Microbial Pathogenesis,2020,141:103980. doi: 10.1016/j.micpath.2020.103980
[26] YU H, LIN Z X, XIANG W L, et al. Antifungal activity and mechanism of D-limonene against foodborne opportunistic pathogen Candida tropicalis[J]. LWT - Food Science and Technology,2022,159:113144. doi: 10.1016/j.lwt.2022.113144
[27] YANG F W, MI J Q, HUANG F, et al. Trans-cinnamaldehyde inhibits Penicillium italicum by damaging mitochondria and inducing apoptosis mechanisms[J]. Food Science and Human Wellness,2022,11(4):975−981. doi: 10.1016/j.fshw.2022.03.022
[28] XIANG W L, ZHANG N D, LU Y, et al. Effect of Weissella cibaria co-inoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J]. LWT-Food Science and Technology,2020,121:108975. doi: 10.1016/j.lwt.2019.108975
[29] ESTEVES C S M, de REDROJO E M, GARCIA J L, et al. Combining FTIR-ATR and OPLS-DA methods for magic mushrooms discrimination[J]. Forensic Chemistry,2022,29:100421. doi: 10.1016/j.forc.2022.100421
[30] AO X, YAN J, CHEN C, et al. Isolation and identification of the spoilage microorganisms in Sichuan homemade Paocai and their impact on quality and safety[J]. Food Science & Nutrition,2019,7:2939−2947.
-
期刊类型引用(1)
1. 于心雨,胡云霄,魏琳,王舒悦,李珊珊,胡福良. 2023年国内外蜂王浆研究概况. 中国蜂业. 2024(03): 38-49 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



