Comparison of Physicochemical Properties of White Hypsizygus marmoreu Protein Extracted by Two Methods
-
摘要: 白玉菇风味与营养俱佳,蛋白含量丰富。为充分开发利用白玉菇蛋白资源,本研究采用传统碱法和超声辅助两种方式提取蛋白质,并对其吸油性、持水性、溶解性、起泡性、乳化性等理化特性进行分析。结果表明,超声辅助提取使蛋白的提取率上升到31.4%,比传统碱法提高8%。热学实验表明,超声提取蛋白最大失重速率温度为311.4 ℃,传统碱法提取蛋白为334.8 ℃。傅里叶变换红外分析发现,传统碱法提取使白玉菇蛋白的α螺旋减少,无规则卷曲增加。以大豆分离蛋白为参照,展开理化性能实验,发现在非中性或盐离子浓度0.5 mol/L时,两种提取工艺的白玉菇蛋白乳化性和乳化稳定性与大豆分离蛋白差异不显著,pH相同时,两种提取工艺的白玉菇蛋白持水性、乳化稳定性差异不显著。在相同NaCl浓度下,两种提取工艺的白玉菇蛋白溶解性、起泡稳定性和乳化稳定性差异不显著。在25~65 ℃区间内,不同提取方法的白玉菇蛋白的吸油性与大豆分离蛋白差异不显著。在此区间内,不同提取方法的白玉菇蛋白溶解性和起泡性均随温度的变化呈先增长后降低的趋势。Abstract: The white Hypsizygus marmoreu has good flavor and nutrition, and is rich in protein. To fully develop the white Hypsizygus marmoreu protein resources, protein was extracted by traditional alkali method and ultrasonic assisted method. The protein’s physicochemical properties such as oil absorption, water holding, solubility, foamability, emulsification were analyzed. The results showed that ultrasound-assisted extraction increased the extraction rate of protein to 31.4%, which was 8% higher than the traditional alkaline method. Thermal experiments showed that the maximum weight loss rate of protein extracted by ultrasound was 311.4 ℃, and that of protein extracted by traditional alkali was 334.8 ℃. Fourier transform infrared analysis showed that the α-spiral structure decreased while the irregular curly structure increased for the protein extracted by traditional alkali method. Compared with the soybean protein isolate (SPI), at non neutral pH or the salt ion concentration of 0.5 mol/L, there was no significant difference for the emulsifying ability and stability between white Hypsizygus marmoreu protein and SPI. At the same pH, there was no significant difference in water retention and emulsification stability between the two extraction processes. At the same NaCl concentration, no significant difference was observed between the solubility, foam stability and emulsification stability. Within 25~65 ℃, the oil absorption and foaming stability of white Hypsizygus marmoreu protein showed no significant difference between that of SPI. In this range, the solubility and foamability of white Hypsizygus marmoreu protein increased firstly and then decreased with the change of temperature.
-
白玉菇,又名白色蟹味菇、白色海鲜菇等[1],是真姬菇的白色品系,野生资源分布于欧洲、北美各国和日本[2]。上世纪80年代,我国从日本引入此菌种后,经过杂交选育开始商品化种植。由于其价格低廉,市场发展较快,目前日产量已达1000吨[3]。它的蛋白质含量丰富,氨基酸种类齐全,是一种优质蛋白[4]。
近年来,国内外植物蛋白的研究热度持续攀升,食用菌资源在各领域的开发利用不断扩大,而对于白玉菇的研究主要集中在多糖的提取分离[5],干燥特性[6],酸性酶的性质研究[7],传统碱法提取[8],鲜味肽分离纯化等方面[3]。蛋白的持水性、溶解性、起泡性、乳化性等理化性与其在食品加工的应用场景密切相关,不同的提取方式会对蛋白的提取率和理化性质产生一定程度的影响,张艳荣等[9]对白灵菇蛋白和汪正兴等[10]对核桃粕蛋白的研究结论也说明了这一点,但是不同提取方式对白玉菇蛋白提取率和理化性能影响方面的探索不多。
本研究以大豆蛋白作为参照物,分析了pH浓度、离子强度、温度等对白玉菇蛋白质理化功能特性的影响,该研究对开发食用菌蛋白资源,提升食用菌产业附加值有一定的参考意义。
1. 材料与方法
1.1 材料与仪器
白玉菇 山东农发菌业集团有限公司生产,购自陕西省西安市农贸批发市场;牛血清蛋白(96%)、甲基红指示剂、大豆分离蛋白 上海麦克林生化科技有限公司;考马斯亮蓝250 上海源叶生物科技有限公司;氢氧化钠、溴甲酚绿指示剂、硫酸铜 天津市科密欧化学试剂有限公司;浓硫酸(98%)、盐酸(36%)、磷酸 国药集团化学试剂有限公司;硫酸钾、碳酸钠 天津市北联精细化学品有限公司;95%乙醇 天津市富宇精细化工有限公司;有机溶剂 均为国产分析纯。
JA2003N分析天平 上海佑科仪器仪表有限公司;WGL-230B电热鼓风干燥箱 河北菲斯福仪器有限公司;WGL-230B高速冷冻离心机 湖南安君研仪器有限公司;XO-SM100超声微波工作站 南京先欧仪器制造有限公司;HJ-4A多头磁力加热搅拌器 常州国华仪器制造有限公司;LGJ-10E真空冷冻干燥机 北京四环福瑞科技发展有限公司;FW-100D高速万能粉碎机 天津鑫博得仪器有限公司;P901 pH计 上海佑科仪器仪表有限公司;HH-S6L电热恒温水浴锅 北京科伟永兴仪器有限公司;Vertex-80傅立叶变换红外光谱仪 德国Bruker公司;DSC Q2000差示扫描量热分析仪、Discovery TGA热重分析仪 美国TA仪器公司。
1.2 实验方法
1.2.1 样品预处理
取适量白玉菇,自然风干至恒重,粉碎制粉过筛,装入自封袋于干燥器中储存备用。
1.2.2 氨基酸组成的测定实验
参照GB/T 5009.124-2016《食品安全国家标准食品中氨基酸的测定》法,称取白玉菇菌粉300 mg,将蛋白质经盐酸水解成游离氨基酸,利用氨基酸分析仪对白玉菇氨基酸组成进行分析。数值统一保留一位小数。
氨基酸评分(AAS)=样品蛋白质氨基酸含量(%)WHO/FAO标准模式相应氨基酸含量(%)×100 (AAS) 1.2.3 白玉菇蛋白的提取工艺
1.2.3.1 白玉菇蛋白的传统碱法提取
参照刘静等[11]和彭玮[12]的蛋白提取方法并略作改动。预制不同浓度的碱液,按料液比加入白玉菇粉,1000 r/min磁力搅拌3 min,依提取时间水浴后9000 r/min离心10 min,取上清液测定蛋白含量,调pH至最佳沉淀点后静置6 h,10000 r/min离心弃上清,将沉淀进行冷冻干燥得到蛋白质提取物。
1.2.3.2 白玉菇蛋白的超声波辅助提取
参照1.2.3.1的提取步骤,在传统碱法最优提取条件的基础上,参考林洋[13]超声辅助黑木耳蛋白提取方法,固定超声功率500 W,超声时间1 h,依次考察超声功率(200、300、400、500、600 W),超声时间(10、20、30、40、50、60 min)两个因素对提取率的影响。
1.2.3.3 白玉菇蛋白提取率的测定
依照行业标准 SN/T 3926-2014分别制备500 mL、0.1 mg/mL的蛋白标准溶液,1 L的考马斯亮蓝G-250溶液,装入棕色容量瓶后,放入4 ℃冰箱内备用。用移液枪分别吸取0.06、0.12、0.24、0.48、0.72、0.84 mL的牛血清标准蛋白溶液于6根具塞试管,分别加入蒸馏水补足至1 mL,接着各加入考马斯亮蓝G-250溶液5 mL ,盖上塞子,振荡混匀,室温下静置2 min后于595 nm测定吸光值。
以牛血清蛋白含量(mg/mL)为横坐标,吸光值为纵坐标,得回归方程:y=3.6695x+0.3744,决定系数R2=0.9985,相关性较好。
菌粉中粗蛋白含量测定采用凯氏定氮法(GB/T15673-2009);提取液中蛋白含量的测定采用Bradford(考马斯亮蓝)法[7]。
蛋白提取率(%)=提取液中蛋白质量菌粉中粗蛋白质量×100 1.2.4 白玉菇蛋白的热重分析
称取3 mg样品,装入铝坩埚中,压样机封样,放入热重分析仪(TGA)中测试样品质量发生变化时的温度。以空盒为空白对照,温度扫描范围:0~600 ℃;升温速率:10 ℃/min;氮气流速:50 mL/min。
1.2.5 白玉菇蛋白质二级结构分析
分别称取2.0 mg蛋白样品、200.0 mg光谱醇KBr,倒入玛瑙研钵中,磨至细粉末状,取适量样品,用压片模具和压片机,制成薄片,放入光谱仪中做全波长扫描。测试完成后,借助Peakfit软件,对测试结果进行高斯拟合求二级结构比例。
1.2.6 白玉菇蛋白溶解性和持水性的测定
50 mL离心管称重,加入200 mg前期提取的白玉菇蛋白,对应所测影响因素,用移液枪添加10 mL不同pH(3、5、7、9、11、13)或NaCl浓度(0.5%、1%、1.5%、2%、2.5%)的溶液,静置15 min,10000 r/min离心,取上清液,考马斯亮蓝法测蛋白含量,计算溶解性。用滤纸吸去蛋白沉淀管内壁的多余溶液,带管称重后计算持水性。
研究温度对这两种功能特性的影响时,添加不同温度(25、35、45、55、65 ℃)的蒸馏水后在不同的温度梯度下水浴15 min,其余同法操作。
溶解性(%)=上清液蛋白含量样品总蛋白含量×100 持水性(g/g)=样品吸水后质量−样品质量样品质量 1.2.7 白玉菇蛋白起泡性和起泡稳定性的测定
重复1.2.6所述步骤至加入蛋白静置15 min,在转速10000~15000 r/min区间内从低到高调整均质机,分三次打发,每次匀浆10 s,间隔10 s,打发后测起泡性,静置30 min后测稳定性。
起泡性(%)=匀浆后的溶液体积−匀浆前的溶液体积匀浆前的溶液体积×100 起泡稳定性(%)=静置30min后的匀浆溶液体积匀浆后的溶液体积×100 1.2.8 白玉菇蛋白乳化性和乳化稳定性的测定
参照乔璐[14]的方法,略加修改。加200 mg前期提取的白玉菇蛋白至50 mL烧杯中,按1.2.6中的溶液梯度所对应的pH强度、NaCl浓度、温度等影响因素,先用移液枪分别吸取10 mL的不同梯度溶液或不同温度的蒸馏水,接着用移液枪添加10 mL大豆油,静置5 min,在转速10000~15000 r/min区间内从低到高调整均质机,分三次搅匀,每次匀浆10 s,间隔10 s,形成乳状液。倒入10 mL离心管中,测量液面高度,以1000 r/min离心10 min,取出后测量上层乳化层的高度。室温静置30 min后,测量乳化层的高度。
乳化性(%)=离心管中乳化层高度离心管中液体总高度×100 乳化稳定性(%)=30min后离心管中乳化层高度离心管中液体总高度×100 1.2.9 白玉菇蛋白吸油性的测定
参照史瑞婕[15]的方法,略加修改。50 mL离心管称重,加入200 mg前期提取的白玉菇蛋白,移液枪添加10 mL大豆油,在不同温度(25、35、45、55、65 ℃)下水浴15 min,10000 r/min离心弃油,滤纸吸去管内壁的多余油液,带管称重后计算吸油性。
吸油性(g/g)=样品吸油后质量−样品质量样品质量 1.3 数据处理
实验做三个水平计算均值和标准差。用Origin 2021绘图求热处理数据一阶导数,Ominic、Peakfit进行二级结构分析,SPSS Statistics 25进行单因素方差分析(ANOVA),P<0.05为显著性差异。
2. 结果与分析
2.1 白玉菇氨基酸组成分析
有研究表明,富硒平菇中门冬氨酸、精氨酸与酪氨酸氨酸的含量相对丰富[12];斑玉蕈品系中总游离氨基酸和必需氨基酸的含量高于杏鲍菇和金针菇[1]。为了研究白玉菇的氨基酸成分,本实验采用酸性水解氨基酸检测法,故表1中无色氨酸测定结果。国际参考模式(FAO/WHO)提出,理想蛋白中人体必需氨基酸应占40%[16],由表1可知,白玉菇氨基酸种类齐全,人体必需氨基酸占氨基酸总量的35.77%,是一种优良的食用菌蛋白。依据氨基酸评分可知,蛋氨酸为白玉菇蛋白的第一限制氨基酸,这在实际生产时可与其他蛋白互补使用,提高营养价值。异亮氨酸评分最高,苏氨酸和缬氨酸次之。苏氨酸在食品风味中,与甜味相关[17]。异亮氨酸和缬氨酸属于支链氨基酸,主要参与骨骼肌代谢,同骨骼肌的合成关系密切[18]。还有研究表明,支链氨基酸可改善运动后骨骼肌线粒体功能,改善运动性疲劳,提高大鼠的运动耐力[19]。因此,白玉菇蛋白在食品加工领域有着广阔的应用场景。
表 1 白玉菇蛋白氨基酸组成及评价Table 1. Amino acid composition and evaluation of white Hypsizygus marmoreu protein序号 英文
缩写中文名 分子量 WHO/FAO
模式氨基酸
评分白玉菇粉
氨基酸含量(%)1 Asp 天冬氨酸 133.1 5.7 2 Thr* 苏氨酸 119.1 4.0 119.3 4.8 3 Ser 丝氨酸 105.1 5.4 4 Glu 谷氨酸 147.1 13.8 5 Gly 甘氨酸 75.1 7.4 6 Ala 丙氨酸 89.1 8.7 7 Cys 半胱氨酸 121.2 0.4 8 Val* 缬氨酸 117.1 5.0 114.8 5.7 9 Met* 蛋氨酸 149.2 3.5 13.7 0.5 10 Ile* 异亮氨酸 131.2 4.0 135.4 5.4 11 Leu* 亮氨酸 131.2 7.0 87.7 6.1 12 Tyr 酪氨酸 181.2 4.4 13 Phe* 苯丙氨酸 165.2 6.0 67.8 4.1 14 Lys* 赖氨酸 146.2 5.5 87.4 4.8 15 His 组氨酸 155.2 2.5 16 Arg 精氨酸 174.2 4.2 17 Pro 脯氨酸 115.1 3.8 注:*表示必需氨基酸。 2.2 两种提取工艺对白玉菇蛋白提取率的影响
根据预实验的结果,考虑到生产实际中大量工业废水对环境的不利影响,以及时间成本等原因,最终选定传统碱法的最适提取工艺为:碱液浓度0.15 mol/L,料液比1:30,在55 ℃下,提取1.5 h。
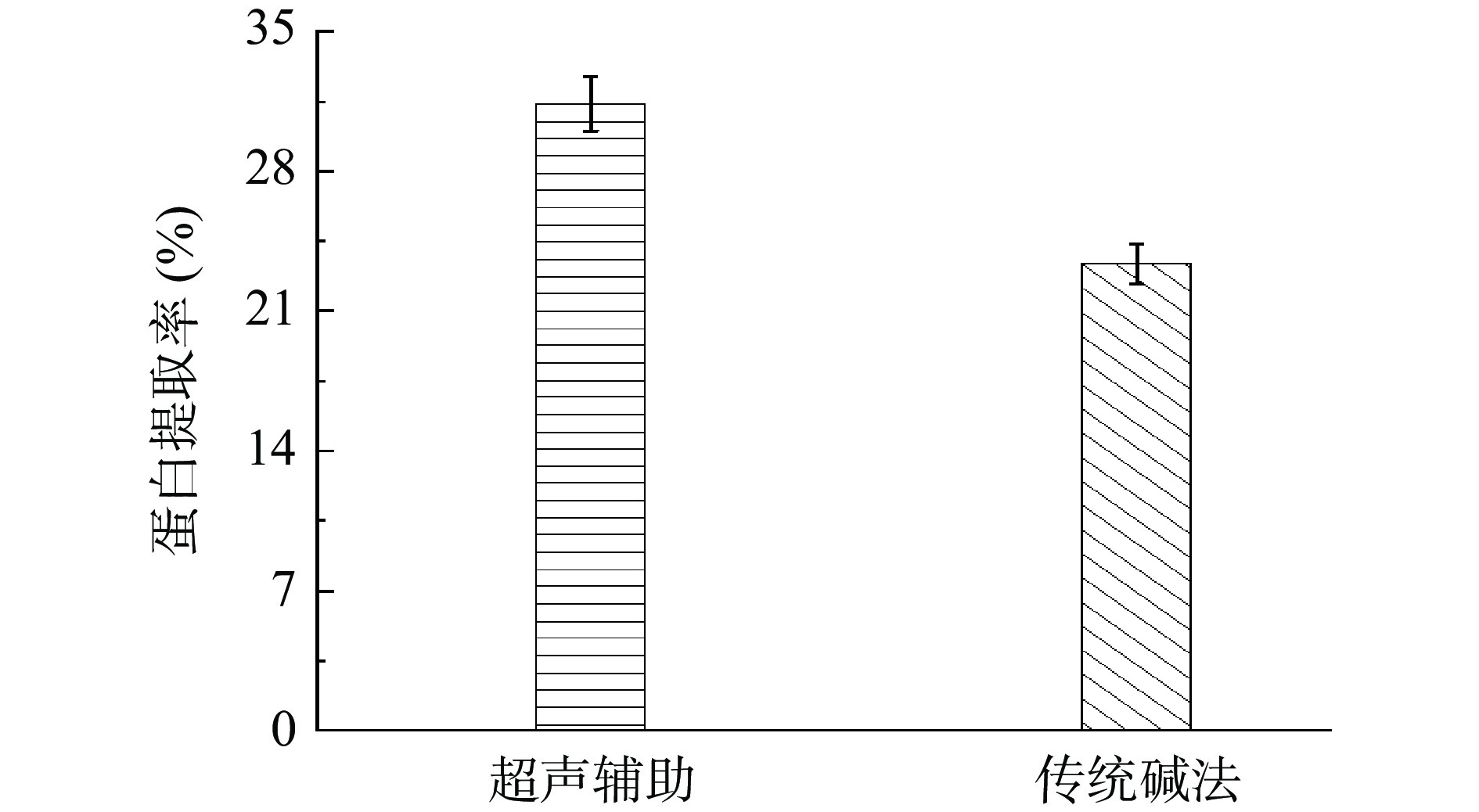
按传统碱法优化后的最适工艺,在水浴的同时开始超声辅助,进行蛋白提取。重复实验,发现随着超声功率的加大,蛋白提取率逐渐提高,在500 W后提取率变化趋于平缓,这可能是超声功率小时,超声波对细胞壁发挥的破碎力度和传质作用不强[20],蛋白溶出较少。随着提取时间延长至50 min后,提取率变化不显著,这可能是超声波产生的空化、振动、粉碎、搅拌等综合效应促进了蛋白质的溶出[21];综上,最终选定超声功率为500 W,超声时间1 h。按此重复实验,如图1,超声辅助下蛋白的提取率由23.4%上升到31.4%,比传统碱法提高8%。
2.3 白玉菇蛋白结构特性性质分析
2.3.1 白玉菇蛋白热学性质分析
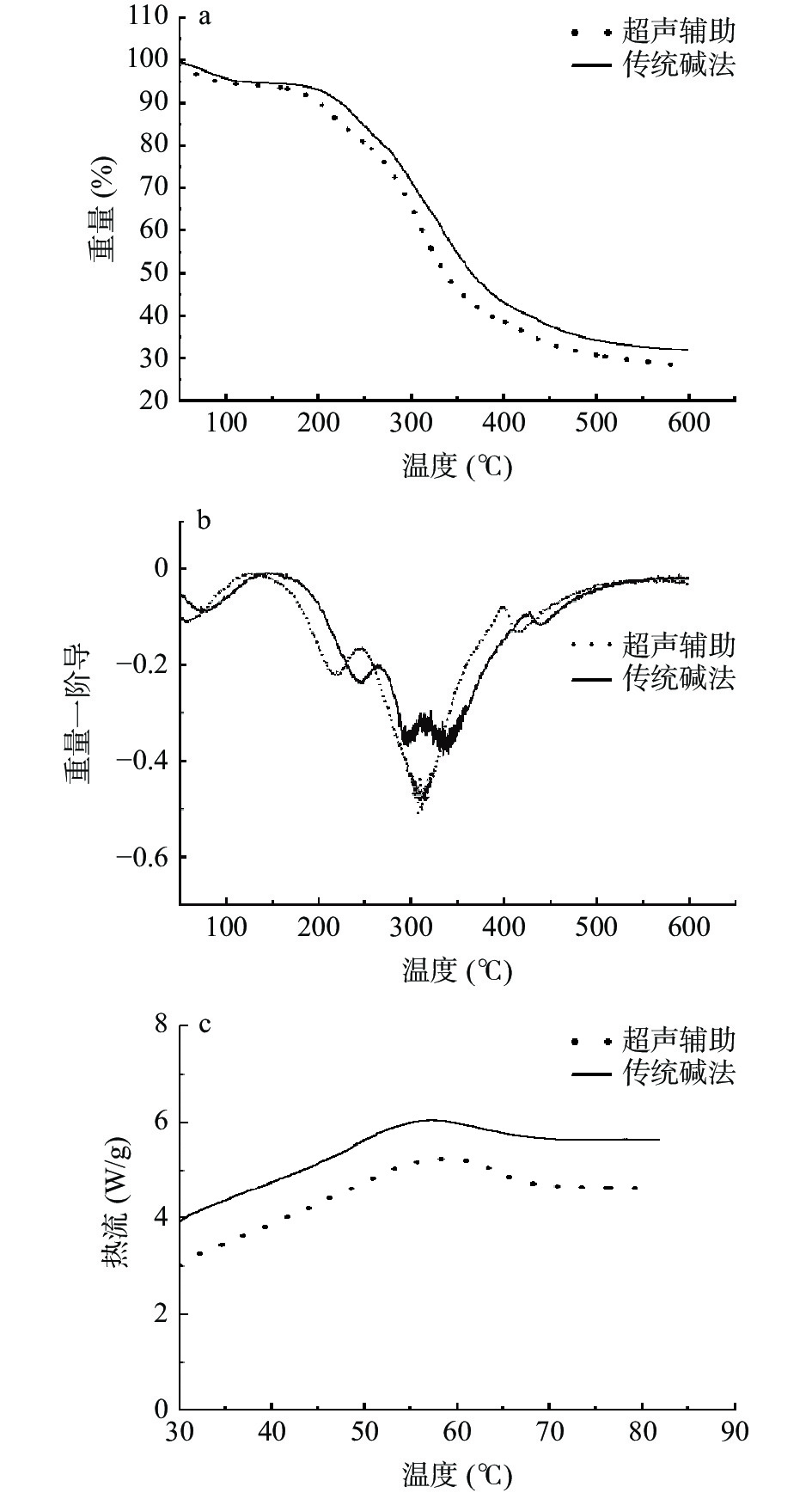
食品加工中,蛋白质会随着加工条件的变化,而发生性质改变,这会对功能特性产生一定的影响,故有必要测定蛋白质的变性温度。从图2可知,传统碱法提取的蛋白热性能参数比超声辅助法提取略高。这可能是因为传统碱法提取的蛋白水分含量略高所致[22]。两种方法提取的蛋白有两个失重台阶(图2a),第一次发生分解的温度在50~100 ℃之间,这可能是由于样品水分的蒸发引起。在100~250 ℃之间变化趋于平缓,250 ℃之后开始第二次快速分解,这可能是因为蛋白质和多糖等有机成分开始降解[23]。由图2b可知,超声提取蛋白最大失重速率温度为311.4 ℃,传统提取蛋白为334.8 ℃。由图2c可知,两种蛋白在60 ℃附近热流发生了变化,这可能是蛋白质发生了一定程度的变性或聚集所致[24]。
2.3.2 傅里叶红外光谱分析
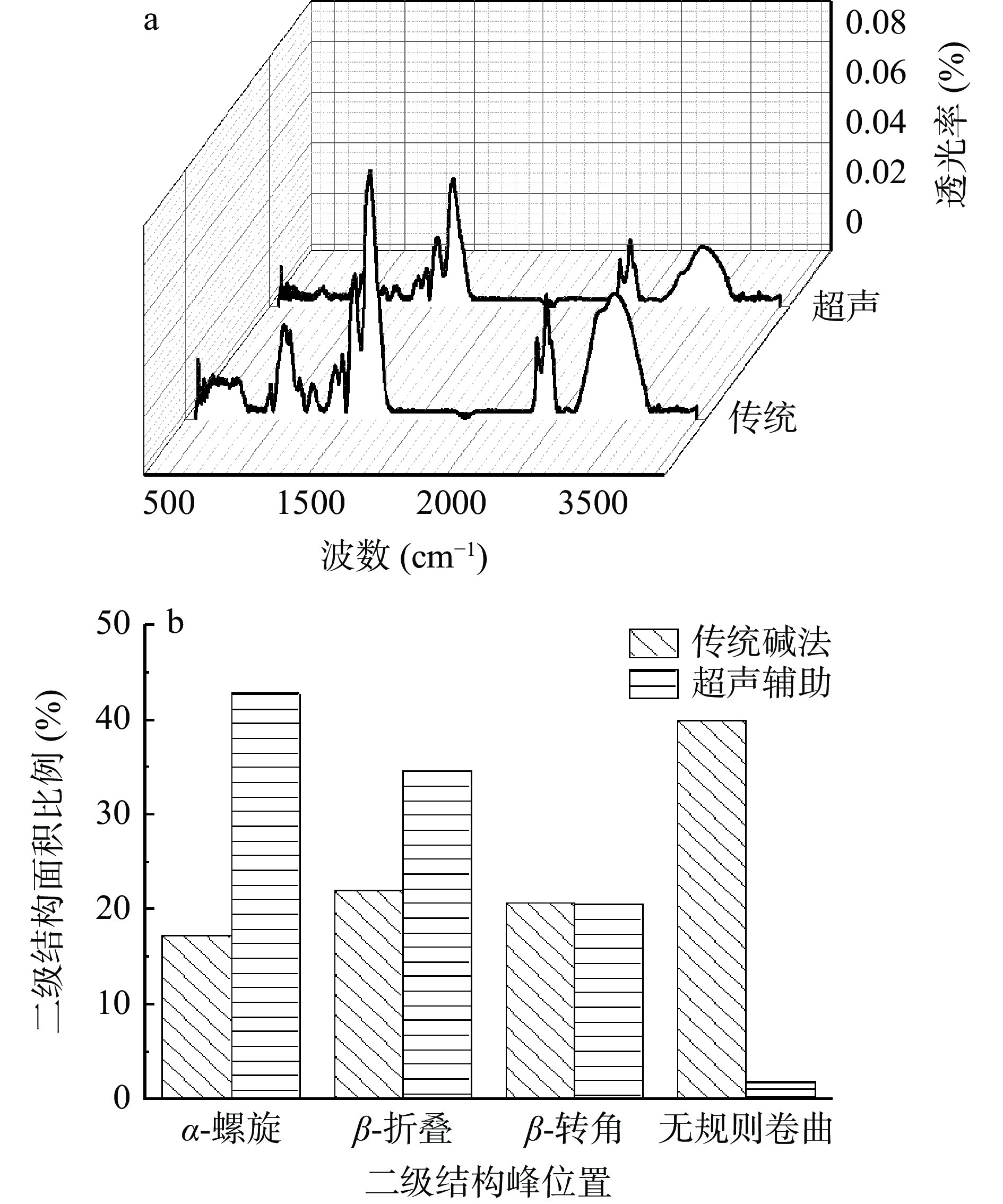
蛋白质二级结构的基本类型包括α螺旋、β折叠、β转角、无规则卷曲等,它与其功能性质和营养价值有一定关系[25]。酰胺Ⅰ带、Ⅱ带的伸缩振动在红外光谱图谱上表现为特征性的吸收峰,故可通过红外吸收光谱对部分蛋白结构特性进行研究[26]。
如图3a,两种提取方法的蛋白在1200~1300 cm−1处酰胺Ⅲ带的区别,说明超声辅助提取使蛋白内部氢键的结合发生了巨大变化[27],引起1500~1700 cm−1处的酰胺Ⅰ带和Ⅱ带的N-H出现弯曲振动,传统碱法使C=O和C-N(肽键)发生伸缩振动[28]。对比两种提取方法在3200~3300 cm−1处二向色性的变化,可知传统碱法提取蛋白由平行二向色性向垂直二向色性快速过渡,超声辅助提取的蛋白过渡缓慢[29]。如图3b,两种提取方法蛋白的α螺旋、β折叠和无规则卷曲变化明显。传统碱法破坏了白玉菇蛋白质分子中的氢键[30],分子间的静电斥力增加,使α螺旋结构减少,无规则卷曲结构大量增加,超声辅助对这两个参数的影响则与此相反。β折叠不如α螺旋的变化明显,可能是因为蛋白提取时溶液中的粘度起了作用[31]。显然,两种提取方法对β转角的影响不显著(P>0.05)。
2.4 白玉菇蛋白的理化特性分析
大豆分离蛋白属于全价蛋白[32],营养丰富,研究课题多样化且深入,食品加工领域应用广泛。本研究选其作为参照标准,将两种工艺提取的白玉菇蛋白在理化性质上与其作对比,展开分析。
2.4.1 不同pH对白玉菇蛋白理化性的影响
从图4可知,两种方法提取的白玉菇蛋白和大豆分离蛋白的乳化稳定性随着pH的改变,变化不显著(P>0.05)。相同的pH对两种提取工艺的白玉菇蛋白持水性、乳化稳定性影响不显著。pH为5时,处在白玉菇蛋白的等电点附近,因此除了它的稳定特性之外,其余理化性均在此时最差。远离等电点后,这些性质都得到了明显改善。
蛋白质在不同pH下的溶解性非常重要,它与蛋白质的其他功能特性,如乳化性、起泡性等直接相关[33]。从图4a可知,随着酸性或碱性值变大,两种方法提取的白玉菇蛋白的溶解性与大豆分离蛋白之间的差距在逐渐缩小。仅当pH为9时,两种提取方法的白玉菇蛋白溶解性差异显著(P<0.05),其余梯度值时二者之间差异不显著(P>0.05)。但是,不同提取方法的白玉菇蛋白各自在不同的pH梯度值之间的溶解性差异显著(P<0.05)。
从图4b可知,白玉菇蛋白的持水性不如大豆分离蛋白,这可能是由于白玉菇蛋白分子表面的疏水基团比大豆分离蛋白多。传统碱法提取蛋白的持水性略好于超声辅助提取的蛋白,但并不显著(P>0.05)。这可能是因为蛋白分子表面的极性基团在超声过程中发生了变化,而蛋白持水性与分子极性基团的数目成正比关系[34]。传统碱法提取的蛋白持水性在pH3与9时,差异不显著(P>0.05),其余pH梯度值之间差异显著(P<0.05),超声辅助提取的蛋白随pH梯度值变化的持水差异显著性亦如此。
图4b中持水性数值的变化趋势,pH为5时,蛋白在等电点附近,持水性却最大。这是因为按本研究中的方法测试持水性时,蛋白溶解越少,舍弃上清后,蛋白秤量值越大,持水性的计算值也就越大。
在食品行业,蛋白质的起泡性和泡沫稳定性通常用来改善烘焙类食品加工特性[35],可用于糕点的装饰,维持食物的松软组织结构和舒适的口感等方面。如图4c,白玉菇蛋白的起泡性在碱性条件下,得到了更好的改善,pH为11和13时,超声辅助提取的白玉菇蛋白的起泡性显著好于大豆蛋白(P<0.05)。这可能由于随着pH的变化,蛋白质溶解度发生了变化,增加了静电荷,从而削弱了自身的疏水互作,使得蛋白质分子在空气和水的界面能快速舒展,加大了和空气的接触面积,也更易形成泡沫[36]。超声辅助提取的白玉菇蛋白起泡性仅在这两个梯度之间的差异显著(P<0.05),其余pH梯度值之间差异均不显著(P>0.05)。传统碱法提取的蛋白在pH为3、7和9时,差异不显著(P>0.05),其余三个梯度之间差异显著(P<0.05)。在pH偏碱性后,相同pH下,两种提取方式的蛋白之间差异显著(P<0.05)。
如图4d,pH为3和13时,不同提取方法的白玉菇蛋白与大豆的起泡稳定性差异显著(P<0.05),其余梯度值时它们之间差异不显著(P>0.05),这可能是由于偏酸性条件下不易形成泡沫。仅当pH为13时,两种提取方法的白玉菇蛋白起泡稳定性差异显著(P<0.05),其余梯度值时二者之间差异不显著(P>0.05)。
蛋白质的乳化性是指蛋白与水、油按一定比例互作后,形成乳状液的能力。乳化活性与溶解度呈正相关[37],这是因为溶解度大的蛋白质,其分子向水油界面的扩散速度更快,利于分散体系的快速形成[38]。pH的变化对三种蛋白的乳化性及稳定性的影响如图4e和图4f,在等电点两侧,乳化性开始增加。白玉菇蛋白在偏碱性条件下的乳化性得到显著提高,仅在pH为中性时,大豆蛋白与两种提取方法的白玉菇蛋白的乳化性和乳化稳定性差异显著(P<0.05),其余pH梯度值时,差异不显著(P>0.05)。不同提取方式白玉菇蛋白乳化性之间的差异,也仅在pH为中性时显著(P<0.05)。传统碱法提取的蛋白乳化性在pH11与13时,差异不显著(P>0.05),其余pH梯度值之间差异显著(P<0.05),超声辅助提取的蛋白随pH梯度值变化的乳化差异显著性亦如此。这是因为酸性环境下减弱了乳化液滴间的相互结合,当pH逐渐变大趋于碱性环境时,相邻液滴的库仑斥力逐渐变大,带电蛋白的分子水化也相应变大,使得界面能量降低,乳化液滴产生更好的结合[39]。
2.4.2 NaCl浓度对白玉菇蛋白理化性质的影响
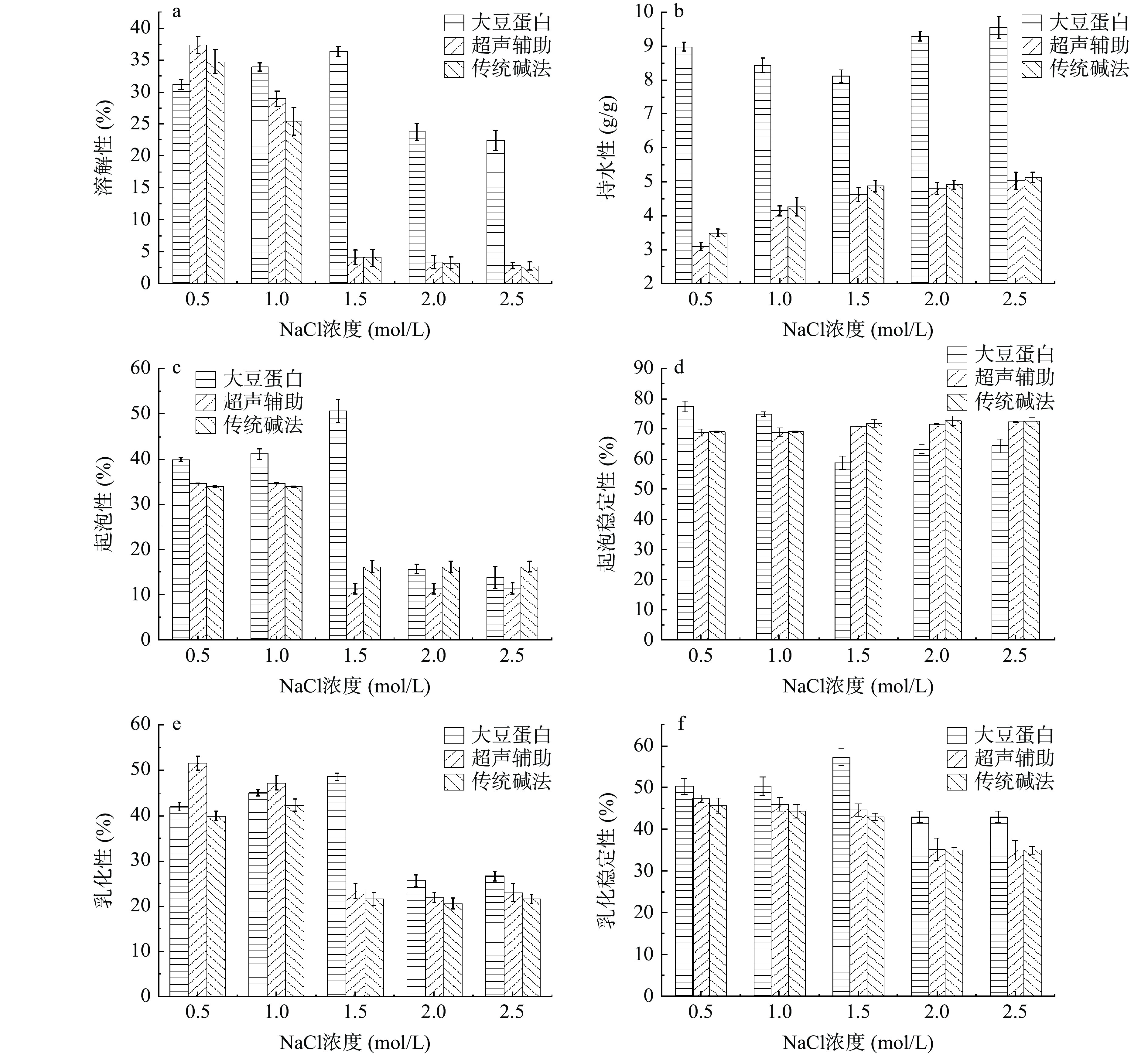
由图5a可知,NaCl浓度在0.5 mol/L附近时,两种提取法的白玉菇蛋白溶解性显著大于大豆蛋白(P<0.05)。在相同NaCl浓度时,两种提取法的白玉菇蛋白之间的溶解性差异均不显著(P>0.05)。NaCl浓度在0.5和1 mol/L时,不同提取方法的白玉菇蛋白各自之间的溶解性差异显著(P<0.05),在NaCl浓度达到1.5 mol/L后,两种提取法蛋白各自之间的溶解性差异不显著(P>0.05)。这是因为随着NaCl浓度的加大,蛋白溶解性逐渐减弱并开始呈“盐析”现象。
由图5b可知,因为“盐溶”和“盐析”随着NaCl浓度的增加开始转化,两种方法提取的白玉菇蛋白和大豆蛋白的持水性均不断增加,至NaCl浓度达到1.5 mol/L时,蛋白基本出,随后变化微弱。大豆分离蛋白持水性的下降是在1.5 mol/L附近。NaCl浓度在0.5mol/L时,不同提取方法的白玉菇蛋白之间的持水性差异显著(P<0.05)。NaCl浓度达到1 mol/L后,蛋白各自之间的持水性开始缓慢降低,差异趋于不显著(P>0.05)。
从图5c和图5d中可知,NaCl浓度在0.5~1 mol/L时,大豆蛋白的起泡性均好于不同提取工艺的白玉菇蛋白。蛋白质要具备良好的发泡特性,必须能够在空气和水的界面迁移、展开重新排列[40]。随着NaCl浓度的增加,“盐析”出现,弱化了蛋白的空间重排,三种蛋白的起泡现象均不断减弱,泡沫可变化的空间体积随之减少,稳定性变化不大。不同提取方法的白玉菇蛋白,起泡性在NaCl浓度0.5~1 mol/L时,变化不显著(P>0.05),起泡稳定性在不同NaCl浓度梯度下变化不显著(P>0.05)。
由图5e和图5f可知,NaCl浓度在0.5~1 mol/L时,两种提取方式的白玉菇蛋白之间,乳化性差异显著(P<0.05),其余浓度下差异不显著(P>0.05)。不同提取方法的白玉菇蛋白,乳化稳定性在相同NaCl浓度梯度下差异不显著(P>0.05)。NaCl浓度在0.5 mol/L时,超声辅助提取的白玉菇蛋白在乳化性上已经强于大豆分离蛋白(P<0.05),乳化稳定性上与大豆蛋白的差异不显著(P>0.05)。这主要是因为盐离子通过静电屏蔽减少了液滴间的斥力,同时高浓度的电解质,使水分子的组织结构发生了变化[41],并在脂肪层的周围形成静电层,引发相互斥力或者在界面物质周围形成水化层,从而降低了界面能量,延缓液滴的结合[42],对乳化性和乳化稳定性产生了一定影响。
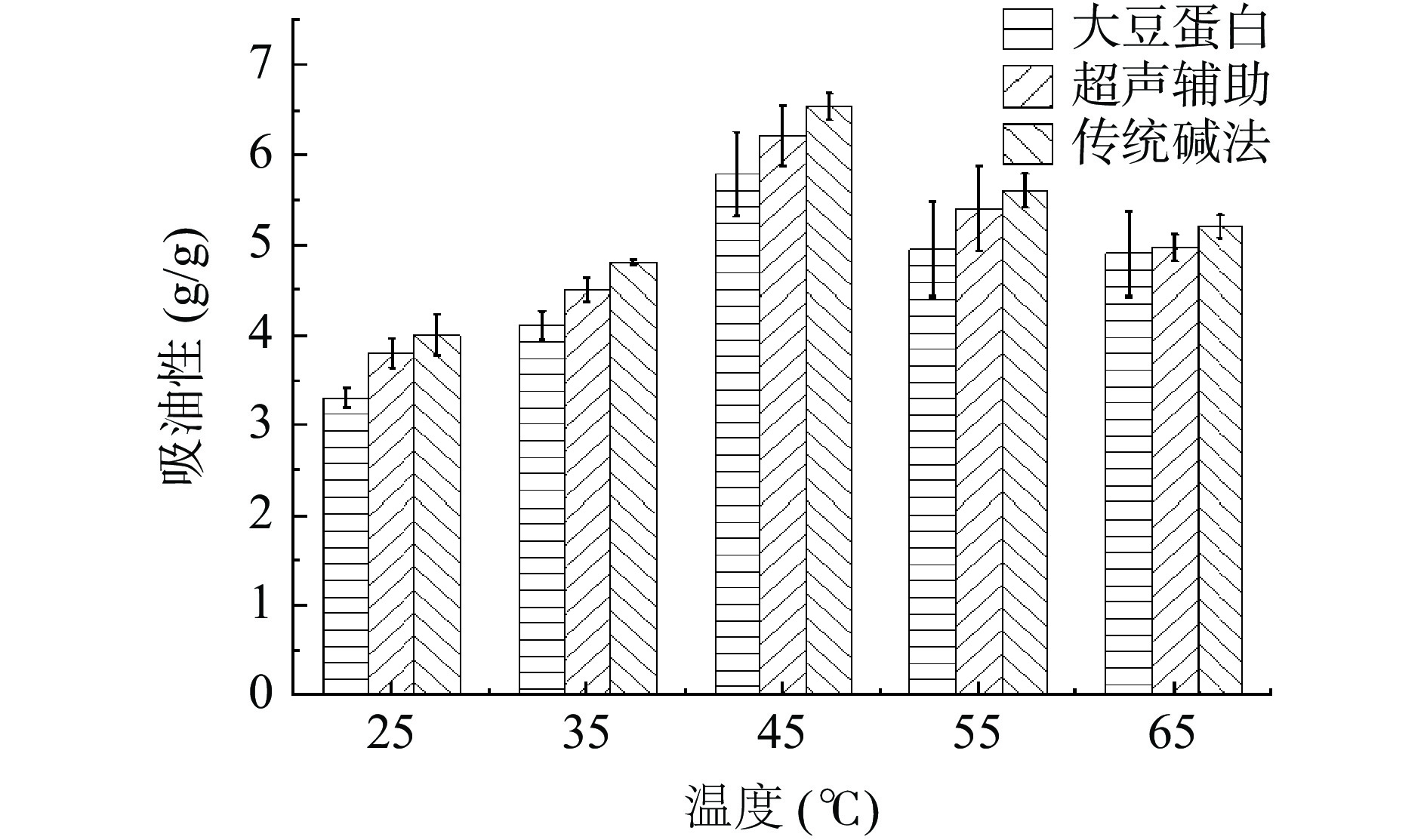
2.4.3 温度对白玉菇蛋白理化性质的影响
由图6可知,传统提取方式的白玉菇蛋白的吸油性略好,两种提取工艺蛋白的这一特性都与大豆分离蛋白差异不显著(P>0.05)。随着温度的变化,此特性先呈现升高趋势,但在45 ℃后开始呈下降趋势。这可能是因为随着温度的继续升高,油的黏性开始降低,流动性增大,与蛋白样品间相互吸附作用减弱[43],使蛋白吸油能力下降。白玉菇蛋白良好的吸油性,对其替代肉类产品的应用非常重要,因为它能保留风味并增进口感[44]。有研究发现,蛋白与油的结合能力和其乳化性能呈正相关,这是其作为脂肪的替代品在食品加工中应用的关键[45]。
由图7可知,在本实验选定的温度范围内,两种方式提取的蛋白在溶解性、持水性、起泡性、乳化性和乳化稳定性都不如大豆分离蛋白,这可能与蛋白自身结构以及提取时的工艺条件等原因有关。
由图7a可知,温度在25~45 ℃区间内,两种提取法的白玉菇蛋白之间溶解性的差异均不显著(P>0.05),在55~65 ℃区间内,溶解性差异显著(P<0.05)。溶解性随着温度的增加出现先增长后平缓的趋势。这可能是因为蛋白随着温度的不断升高先溶解,接着发生聚集所致[46]。温度从25~65 ℃区间内,两种提取法的白玉菇蛋白之间持水性的差异均不显著(P>0.05)。图7b中持水性的计算值在25 ℃时最大,这与2.4.1中测试pH对持水性影响时的分析同理。
由图7c可知,35~45 ℃区间内超声辅助提取的蛋白,其发泡性较好,与传统碱法提取玉菇蛋白之间的差异显著(P<0.05),在25~35 ℃,55~65 ℃区间内,二者起泡性差异不显著(P>0.05)。随着温度的升高,两种方式提取的蛋白和大豆分离蛋白的发泡性都呈现出先增长后降低的现象,这与它们在不同温度下的溶解性趋势一致。这可能是因为,随着蛋白在水中的溶解度减小,未能溶于水的蛋白质粒子聚集在界面膜上,使膜的流动性变差,弹性降低,难以修复局部膜的薄化[40]。由图7d可知,55~65 ℃区间内,超声辅助提取蛋白的起泡稳定性好于大豆蛋白(P<0.05)。在本实验选定的相同温度下,不同提取方法的白玉菇蛋白之间,起泡稳定性差异显著(P<0.05)。
由图7e和图7f可知,在本实验选定的相同温度下,超声辅助提取蛋白的乳化性好于传统提取蛋白(P<0.05),但二者之间的乳化稳定性差异不显著(P>0.05)。随着温度的升高,两种方式提取的蛋白和大豆分离蛋白的乳化性先升高后下降,这可能是由于适当的温度使蛋白质分子伸展度增大,利于其吸附于油水界面[47],但继续升温又另乳化颗粒运动加剧,降低了吸附在油水界面上蛋白质凝胶作用,减弱了膜黏度和硬度[48]。
3. 结论
本研究首先对白玉菇的氨基酸组成进行分析,发现人体必需氨基酸含量占其氨基酸总量的35.77%,其中与运动相关的支链氨基酸含量最多。通过超声辅助提取实验,使蛋白的提取率提高8%,达到31.4%。进一步对热力学特性数据分析发现超声提取蛋白最大失重速率温度为311.4 ℃,传统提取蛋白为334.8 ℃。分析傅里叶红外数据得出传统碱法提取使白玉菇蛋白的α螺旋结构减少,无规则卷曲结构大量增加。最后以大豆分离蛋白为参照,发现白玉菇蛋白的吸油性与其相当,在pH非中性或盐离子浓度0.5 mol/L时,白玉菇蛋白的乳化性和乳化稳定性与其差异不显著。在相同NaCl浓度下,两种提取工艺的白玉菇蛋白溶解性、起泡稳定性和乳化稳定性差异不显著。在25~65 ℃区间内,不同提取方法的白玉菇蛋白在吸油性方面与大豆分离蛋白差异不显著;在此区间内,不同提取方法的白玉菇蛋白溶解性和起泡性均随温度的变化呈先增长后降低的趋势,起泡稳定性差异显著(P<0.05)。上述结论说明,白玉菇蛋白具有良好的加工适应性。然而本研究对白玉菇蛋白热力学特性、二级结构与理化功能性之间的相关性探讨不深,有待进一步查阅文献,展开实验深入探索,以期揭示这些特性、结构与功能之间的关联。综上,本研究为白玉菇蛋白资源在食品领域的市场化开发利用提供了一定的实验借鉴和理论依据。
-
表 1 白玉菇蛋白氨基酸组成及评价
Table 1 Amino acid composition and evaluation of white Hypsizygus marmoreu protein
序号 英文
缩写中文名 分子量 WHO/FAO
模式氨基酸
评分白玉菇粉
氨基酸含量(%)1 Asp 天冬氨酸 133.1 5.7 2 Thr* 苏氨酸 119.1 4.0 119.3 4.8 3 Ser 丝氨酸 105.1 5.4 4 Glu 谷氨酸 147.1 13.8 5 Gly 甘氨酸 75.1 7.4 6 Ala 丙氨酸 89.1 8.7 7 Cys 半胱氨酸 121.2 0.4 8 Val* 缬氨酸 117.1 5.0 114.8 5.7 9 Met* 蛋氨酸 149.2 3.5 13.7 0.5 10 Ile* 异亮氨酸 131.2 4.0 135.4 5.4 11 Leu* 亮氨酸 131.2 7.0 87.7 6.1 12 Tyr 酪氨酸 181.2 4.4 13 Phe* 苯丙氨酸 165.2 6.0 67.8 4.1 14 Lys* 赖氨酸 146.2 5.5 87.4 4.8 15 His 组氨酸 155.2 2.5 16 Arg 精氨酸 174.2 4.2 17 Pro 脯氨酸 115.1 3.8 注:*表示必需氨基酸。 -
[1] 吴莹莹, 鲍大鹏, 李燕, 等. 蟹味菇和白玉菇的蛋白质及氨基酸营养评价与分析[J]. 上海农业学报,2021,37(1):13−21. [WU Y Y, BAO D P, L Y, et al. Nutritional evaluation and analysis of protein and amino acid of Pleurotus crabus and Shimeji mushroom[J]. Acta Agriculturae Shanghai,2021,37(1):13−21. WU Y Y, BAO D P, L Y, et al. Nutritional evaluation and analysis of protein and amino acid of Pleurotus crabus and Shimeji mushroom[J]. Acta Agriculturae Shanghai, 2021, 37(1): 13-21.
[2] 李挺, 宋斌, 林群英, 等. 白玉菇的研究进展[J]. 贵州科学,2011,29(2):48−52. [LI T, SONG B, LIN Q Y, et al. Study on White Hypsizygus marmoreus[J]. Guizhou Science,2011,29(2):48−52. LI T, SONG B, LIN Q Y, et al. Study on White Hypsizygus marmoreus[J]. Guizhou Science, 2011, 29(2): 48-52.
[3] 李晓明. 白玉菇中鲜味肽的分离纯化及呈味特性研究[D]. 南昌: 江西农业大学, 2021: 1−65. LI X M. The separation and purification of umami peptides from White Hypsizygus marmoreu and the study of its taste characteristic[D]. Nanchang: Jiangxi Agricultural University, 2021: 1−65.
[4] 王耀松, 邢增涛, 白冰, 等. 白玉蕈营养成分的测定[J]. 西北农业学报,2006,5(5):222−224,228. [WANG Y S, XING Z T, BAI B, et al. Determination of nutrient composition of Shimeji mushroom[J]. Journal of Northwest Agriculture,2006,5(5):222−224,228. WANG Y S, XING Z T, BAI B, et al. Determination of nutrient composition of Shimeji mushroom[J]. Journal of Northwest Agriculture, 2006, 5: 222-224, 228.
[5] 霍宗庆, 徐婉晴, 刘言娟. 响应面法优化白玉菇多糖的提取工艺[J]. 食品工业科技,2017,38(22):145−149. [HUO Z Q, XU W Q, LIU Y J. Response surface method was used to optimize the extraction process of Shimeji mushroom[J]. Science and Technology of Food Industry,2017,38(22):145−149. HUO Z Q, XU W Q, LIU Y J. Response surface method was used to optimize the extraction process of Shimeji mushroom[J]. Science and Technology of Food Industry, 2017, 38(22): 145-149.
[6] 麦馨允, 黄斌, 黄娇丽, 等. 白玉菇远红外干燥工艺优化及其对品质的影响[J]. 食品与发酵工业,2019,45(14):150−157. [MAI X Y, HUANG B, HUANG J L, et al. Optimization of far infrared drying process and its effect on quality of shimeji mushroom[J]. Food and Fermentation Industry,2019,45(14):150−157. MAI X Y, HUANG B, HUANG J L, et al. Optimization of far infrared drying process and its effect on quality of Shimeji mushroom[J]. Food and Fermentation Industry, 2019, 45(14): 150-157.
[7] 张蕾, 张航. 白玉菇酸性磷酸酯酶的分离纯化及酶学性质研究[J]. 安徽农业科学,2021,49(10):4−7. [ZHANG L, ZHANG H. Purification and enzymatic properties of acid phosphatase from Edodes velutipes[J]. Journal of Anhui Agricultural Sciences,2021,49(10):4−7. ZHANG L, ZHANG H. Purification and enzymatic properties of acid phosphatase from Edodes velutipes[J]. Journal of Anhui Agricultural Sciences , 2021, 49(10): 4-7.
[8] 李晓明, 陈凯, 黄占旺, 等. 白玉菇蛋白提取工艺优化及其功能特性研究[J]. 食品与发酵工业,2020,46(4):239−246. [LI X M, CHEN K, HUANG Z W, et al. Study on optimization of extraction process and functional properties of White Hypsizygus marmoreu protein[J]. Food and Fermentation Industries,2020,46(4):239−246. LI X M, CHEN K, HUANG Z W, et al. Study on optimization of extraction process and functional properties of White Hypsizygus marmoreu protein[J]. Food and Fermentation Industries , 2020, 46(4): 239-246.
[9] 张艳荣, 高宇航, 刘婷婷, 等. 白灵菇蛋白提取及功能特性和结构分析[J]. 食品科学,2018,39(14):42−50. [ZHANG Y R, GAO Y H, LIU T T, et al. Extraction and functional and structural characteristics of protein from Pleurotus nebrodensis[J]. Food Science,2018,39(14):42−50. ZHANG Y R, GAO Y H, LIU T T, et al. Extraction and functional and structural characteristics of protein from Pleurotus nebrodensis[J]. Food Science, 2018, 39(14): 42-50.
[10] 汪正兴, 韩强, 郜海燕, 等. 响应面试验优化亚临界水提取核桃粕蛋白工艺及其氨基酸分析[J]. 食品科学,2017,38(20):191−196. [WANG Z X, HAN Q, GAO H Y, et al. Optimization of extraction technology and amino acid analysis of walnut meal protein with subcritical water by response surface methodology[J]. Food Science,2017,38(20):191−196. WANG Z X, HAN Q, GAO H Y, et al. Optimization of extraction technology and amino acid analysis of walnut meal protein with subcritical water by response surface methodology[J]. Food Science, 2017, 38(20): 191-196.
[11] 刘静, 李湘利, 魏海香, 等. 鸡枞菌粗蛋白超声辅助提取工艺优化及其抗氧化活性[J]. 食品工业科技,2019,40(10):221−226. [LIU J, LI X L, WEI H X, et al. Optimization of ultrasonic assisted extraction of coarse protein from fir fungus and its antioxidant activity[J]. Science and Technology of Food Industry,2019,40(10):221−226. LIU J, LI X L, WEI H X, et al. Optimization of ultrasonic assisted extraction of coarse protein from fir fungus and its antioxidant activity[J]. Science and Technology of Food Industry, 2019, 40(10): 221-226.
[12] 彭炜. 富硒平菇中硒蛋白的提取及特膳食品的开发[D]. 贵阳: 贵州大学, 2016: 1−99. PENG W. Study on extracting technology of selenium-containingprotein from se-enriched Pleurotus ostreatus and development of foods for special dietary users[D]. Guiyang: Guizhou University, 2016: 1−99.
[13] 林洋. 黑木耳蛋白质的提取_分离纯化及特性研究[D]. 哈尔滨: 东北林业大学, 2016: 1−61. LIN Y. Extraction, purification and characterization of protein from Auricularia auriculata[D]. Haerbin: Northeast Forestry University, 2016: 1−61.
[14] 乔璐. 桑叶蛋白的提取与应用研究[D]. 金华: 浙江师范大学, 2014: 1−76. QIAO L. Studies on extracion and application of mulberry leaf protein[D]. Jinhua: Zhejiang Normal University, 2014: 1−76.
[15] 史瑞婕. 杏鲍菇蛋白质结构表征及功能特性研究[D]. 太原: 山西农业大学, 2019: 1−91. SHI R J. Research on structural characterization and functional properties of Pleurotus eryngii protein[D]. Taiyuan: Shanxi Agricultural University, 2019: 1−91.
[16] 朱淑云, 董英, 陈晓东, 等. 水飞蓟粕蛋白氨基酸组成及加工功能特性研究[J]. 中国粮油学报,2011,26(8):71−74,83. [ZHU S Y, DONG Y, CHEN X D, et al. Amino acid composition and functional properties of milk thistle meal protein[J]. Journal of The Chinese Cereals and Oils Association,2011,26(8):71−74,83. ZHU S Y, DONG Y, CHEN X D, et al. Amino acid composition and functional properties of milk thistle meal protein[J]. Journal of The Chinese Cereals and Oils Association, 2011, 26(8): 71-74, 83.
[17] 杨转, 郭桂义, 王乔健, 等. 普洱速溶茶粉的制备工艺优化[J]. 食品工业科技,2016,37(21):243−248,254. [YANG Z, GUO G Y, WANG Q J, et al. Optimization of preparation technology of Pu 'er instant tea powder[J]. Science and Technology of Food Industry,2016,37(21):243−248,254. YANG Z, GUO G Y, WANG Q J, et al. Optimization of preparation technology of Pu 'er instant tea powder[J]. Science and Technology of Food Industry, 2016, 37(21): 243-248, 254.
[18] RYAN C E, PATEL K, MURALIDARAN V, et al. Impact of branched chain amino acid supplementation on muscle lipid accumulation and mitochondrial metabolism[J]. The FASEB Journal, 2022, 36.
[19] MATSUNAGA Y, TAMURA Y TAKAHASHI K, et al. Branched-chain amino acid supplementation suppresses the detraining-induced reduction of mitochondrial content in mouse skeletal muscle[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology,2022,36(12).
[20] ZHANG R, CHEN J, ZHANG X. Extraction of intracellular protein from Chlorella pyrenoidosa using a combination of ethanol soaking, enzyme digest, ultrasonication and homogenization techniques[J]. Bioresour Technol,2018,247:267−272. doi: 10.1016/j.biortech.2017.09.087
[21] 唐鑫媛, 夏延斌, 文新昱, 等. 超声波辅助碱法提取辣椒渣中蛋白质的工艺优化[J]. 食品与机械,2015,31(2):222−226. [TANG X Y, XIA Y B, WEN X Y, et al. Optimization of ultrasonic-assisted alkaline extraction of protein from chili residue[J]. Food and Machinery,2015,31(2):222−226. TANG X Y, XIA Y B, WEN X Y, et al. Optimization of ultrasonic-assisted alkaline extraction of protein from chili residue[J]. Food and Machinery, 2015, 31(2): 222-226.
[22] 宋春芳, 毛志怀, 王曙光, 等. 亚麻籽粉含水率对其蛋白质变性温度的影响[J]. 农业工程学报,2008,1(1):300−302. [SONG C F, MAO Z H, WANG S G, et al. Effect of water content on protein denaturation temperature of flaxseed powder[J]. Transactions of the Chinese Society of Agricultural Engineering,2008,1(1):300−302. SONG C F, MAO Z H, WANG S G, et al. Effect of water content on protein denaturation temperature of flaxseed powder[J]. Transactions of the Chinese Society of Agricultural Engineering, 2008, 1: 300-302.
[23] JONES M, WEILAND K, KUJUNDZIC M, et al. Waste-derived low-cost mycelium nanopapers with tunable mechanical and surface properties[J]. American Chemical Society (ACS),2019(20):3513−3523.
[24] 岳健雄. 脱脂预处理及低共熔溶剂体系组成对燕麦蛋白结构功能和理化性质的影响[D]. 西安: 陕西科技大学, 2021: 1−87. YUE J X. Effects of degreasing pretreatment and composition of low eutectic solvent system on structure, function and physicochemical properties of oat protein[D]. Xi’an: Shaanxi University of Science and Technology, 2021: 1−87.
[25] 孙英杰. 超声波处理对大豆分离蛋白结构和功能性质影响研究[D]. 哈尔滨: 东北农业大学, 2014 SUN Y J. Effect of ultrasonic treatment on structure and functional properties of soybean protein isolate[D]. Haerbin: Northeast Agricultural University, 2014.
[26] 刘燕燕, 曾新安, 陈晓东. FTIR分析脉冲电场和热处理后的大豆分离蛋白结构变化[J]. 光谱学与光谱分析,2010,30(9):2340−2344. [LIU Y Y, ZENG X A, CHEN X D, et al. Structural changes of soybean protein isolate after pulsed electric field and heat treatment were analyzed by FTIR[J]. Spectroscopy and Spectral Analysis,2010,30(9):2340−2344. doi: 10.3964/j.issn.1000-0593(2010)09-2340-05 LIU Y Y, ZENG X A, CHEN X D, et al. Structural changes of soybean protein isolate after pulsed electric field and heat treatment were analyzed by FTIR[J]. Spectroscopy and Spectral Analysis, 2010, 30(9): 2340-2344. doi: 10.3964/j.issn.1000-0593(2010)09-2340-05
[27] OLSSON A-M, SALMÉN L. The association of water to cellulose and hemicellulose in paper examined by FTIR spectroscopy[J]. Carbohydrate Research,2004,339(4):813−818.
[28] KIZIL R, IRUDAYARAJ J, SEETHARAMAN K. Characterization of irradiated starches by using FT-Raman and FTIR spectroscopy[J]. American Chemical Society (ACS),2002,50(14):3912−3918.
[29] 沈子威, 孙克利, 杨钧, 等. 应用傅里叶红外光谱研究强声波作用下植物壁蛋白质二级结构变化[J]. 光子学报,1999(7):25−27. [SHEN Z W, SUN K L, YANG J, et al. Fourier infrared spectroscopy was used to study the secondary structure changes of plant wall proteins under strong sound waves[J]. Acta Photonica Sinica,1999(7):25−27. SHEN Z W, SUN K L, YANG J, et al. Fourier infrared spectroscopy was used to study the secondary structure changes of plant wall proteins under strong sound waves[J]. Acta Photonica Sinica, 1999(7): 25-27.
[30] 毛晓英. 核桃蛋白质的结构表征及其制品的改性研究[D]. 无锡: 江南大学, 2012. MAO X Y. Structural characterization and modification of walnut protein[D]. Wuxi: Jiangnan University, 2012.
[31] DAI Y T, SPRONSEN J V, WITKAMP G J, et al. Natural deep eutectic solvents as new potential media for green technology[J]. Analytica Chimica Acta,2013,766:61−68.
[32] 鲁洋, 史文静, 王文婷, 等. 大豆分离蛋白提取及其植酸脱除的研究[J]. 农产品加工,2020,496(2):31−34,38. [LU Y, SHI W J, WANG W T, et al. Study on extraction and phytic acid removal of soybean protein isolate[J]. Agricultural Product Processing,2020,496(2):31−34,38. LU Y, SHI W J, WANG W T, et al. Study on extraction and phytic acid removal of soybean protein isolate[J]. Agricultural product processing, 2020, 496(2): 31-34, 38.
[33] ORTIZ S E M, WAGNER J R. Hydrolysates of native and modified soy protein isolates: structural characteristics, solubility and foaming properties[J]. Food Research International,2002,35(6):511−518.
[34] CHOU D H, MORR C V. Protein-water interactions and functional properties[J]. Journal of the American Oil Chemists' Society,1979,56(1):A53−A62.
[35] 刘畅, 张东艳, 邓珍菊, 等. 罗汉果籽蛋白的提取及功能特性研究[J]. 河南工业大学学报(自然科学版),2022,43(2):93−102. [LIU C, ZHANG D Y, DENG Z J, et al. Study on extraction and functional characteristics of seed protein from Moxa grosvenor[J]. Journal of Henan University of Technology (Natural Science Edition),2022,43(2):93−102. LIU CH, ZHANG D Y, DENG Z J, et al. Study on extraction and functional characteristics of seed protein from Moxa grosvenor[J]. Journal of Henan University of Technology (Natural Science Edition), 2022, 43(2): 93-102.
[36] LAWAL O S, ADEBOWALE K O, OGUNSANWO B M, et al. On the functional properties of globulin and albumin protein fractions and flours of African locust bean[J]. Food Chemistry,2005,92(4):681−691.
[37] ALUKO R E, YADA R Y. Structure-function relationships of cowpea (Vigna unguiculata) globulin isolate: Influence of pH and NaCl on physicochemical and functional properties[J]. Food Chemistry,1995,53(3):250−265.
[38] ALUKO R-E, MOFOLASAYO O-A, WATTS B-M. Emulsifying and foaming properties of commercial yellow pea seed flours[J]. American Chemical Society (ACS),2009,57(20):9793−9800.
[39] CHAVAN U D, MCKENZIE D B, SHAHIDI F. Functional properties of protein isolates from beach pea (Lathyrus maritimus L.)[J]. Food Chemistry,2001,74(2):177−187.
[40] 赵维高, 刘文营, 黄丽燕, 等. 食品加工中蛋白质起泡性的研究[J]. 农产品加工(学刊),2012,11(11):69−72. [ZHAO W G, LIU W Y, HUANG L Y, et al. Study on foaming properties of protein in food processing[J]. Processing of Agricultural Products (Bulletin),2012,11(11):69−72. ZHAO W G, LIU W Y, HUANG L Y, et al. Study on foaming properties of protein in food processing[J]. Processing of Agricultural Products (Bulletin), 2012, 11: 69-72.
[41] MCCLEMENTS D J. Emulsion stability[M]. London, New York, Washington, DC: CRC Press: Boca Raton, 1999: 185−233.
[42] ALUKO R-E, MCINTOSH T. Polypeptide profile and functional properties of defatted meals and protein isolates of canola seeds[J]. Journal of the Science of Food & Agriculture,2001,81(4):391−396.
[43] 薛蕾, 李大文, 尉芹, 等. 苦杏仁蛋白的功能特性[J]. 食品科学,2013,34(7):70−75. [XUE L, LI D W, YU Q, et al. Functional properties of amygdala protein[J]. Food Science,2013,34(7):70−75. XUE L, LI D W, YU Q, et al. Functional properties of amygdala protein[J]. Food Science, 2013, 34(7): 70-75.
[44] OGUNWOLU S O, HENSHAW F O, MOCK H P, et al. Functional properties of protein concentrates and isolates produced from cashew (Anacardium occidentale L.) nut[J]. Food Chemistry,2009,115(3):852−858.
[45] 赵城彬, 尹欢欢, 刘景圣, 等. 超声-转谷氨酰胺酶改善红豆蛋白功能性质及结构[J]. 食品科学,2019,40(19):120−127. [ZHAO C B, YIN H H, LIU J S, et al. Ultrasound-transglutaminase improves the functional properties and structure of red bean protein[J]. Food Science,2019,40(19):120−127. doi: 10.7506/spkx1002-6630-20181008-052 ZHAO C B, YIN H H, LIU J S, et al. Ultrasound-transglutaminase improves the functional properties and structure of red bean protein[J]. Food Science, 2019, 40(19): 120-127. doi: 10.7506/spkx1002-6630-20181008-052
[46] 郑新雷, 李灵诚, 滕建文, 韦保耀, 黄丽, 夏宁, 覃柳迪. 双孢蘑菇蛋白的提取工艺优化及其功能性质[J]. 食品工业科技,2019,40(16):126−132,139. [ZHENG X L, LI L C, TENG J W, et al. Optimization of extraction process and functional properties of Agaricus bisporus protein[J]. Science and Technology of Food Industry,2019,40(16):126−132,139. ZHENG X L, LI L C, TENG J W, et al. Optimization of extraction process and functional properties of Agaricus bisporus protein[J]. Science and Technology of Food Industry, 2019, 40(16): 126-132, 139.
[47] 夏轩泽. 挤压与磷酸化联合处理对豌豆蛋白乳化性质的影响及其应用研究[D]. 无锡: 江南大学, 2022: 1-69. XIA X Z, Effect of extrusion and phosphorylation on emulsifying properties of pea protein and its application[D]. Wuxi: Jiangnan University, 2022: 1-69.
[48] MAO Xiaoying, HUA Yufei. Composition, structure and functional properties of protein concentrates and isolates produced from walnut (Juglans regia L.)[J]. International Journal of Molecular Science,2012,13(2):1561−1581. doi: 10.3390/ijms13021561
-
期刊类型引用(2)
1. 黄素艳,曹荣,刘楠,孙永,周德庆,王珊珊. 提取方式对微拟球藻蛋白理化性质和功能特性的影响. 食品工业科技. 2025(01): 87-96 .  本站查看
本站查看
2. 陈亭菊,刘远超,蔡曼君,郭慧阳,陈少丹,吴清平,胡惠萍. 食药用菌蛋白质研究现状及应用. 食用菌学报. 2024(02): 113-126 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:


 下载:
下载:



