Ultrasonic-Assisted Deep Eutectic Solvent Extraction of Proanthocyanidins from Korean Pine Bark and Its Kinetics
-
摘要: 目的:对超声辅助低共熔溶剂法提取红松树皮原花青素的工艺条件进行优化,拟合提取动力学方程,旨在对红松树皮中原花青素的资源开发利用提供理论和技术参考。方法:以原花青素得率为指标,筛选最佳低共熔溶剂体系,并进一步通过单因素结合响应面优化超声辅助低共熔溶剂提取红松树皮中原花青素的主要工艺参数。通过提取过程中不同温度和不同时间条件下原花青素得率的变化,拟合出最佳的原花青素提取动力学模型并验证。结果:氯化胆碱、丙三醇和水的摩尔比为1:1:4制备的低共熔溶剂为红松树皮原花青素的最佳提取溶剂;响应面法优化工艺参数条件为:液料比16 mL/g,超声时间50 min,超声温度55 ℃,超声功率480 W时,红松树皮原花青素的提取效果最好,原花青素得率为4.11%;Boltzman模型能够很好地拟合超声辅助低共熔溶剂提取原花青素动力学过程(R2≥0.9768),模型验证值与预测值拟合度较高(R2≥0.9442)。结论:超声辅助低共熔溶剂可以有效地促进红松树皮原花青素的传质,确定Boltzman模型为提取原花青素的最佳动力学模型,该提取工艺也可以为相关天然活性物质提取提供参考。Abstract: Objective: The technological conditions of ultrasonic-assisted deep eutectic solvent extraction of proanthocyanidins from Korean pine bark were optimized, and the extraction kinetics equation was fitted. The purpose was to provide theoretical and technical reference for the development and utilization of proanthocyanidins from Korean pine bark. Method: Taking the yield of procyanidins as the index, the best deep eutectic solvent system was selected. The main technological parameters of ultrasonic-assisted deep eutectic solvent extraction of proanthocyanidins from Korean pine bark were further optimized by single factor combined with response surface methodology. Through the change of the yield of proanthocyanidins under different temperature and time during the extraction process, the best kinetic model of proanthocyanidins extraction was fitted and verified. Result: The results showed that deep eutectic solvent with the molar ratio of choline chloride, glycerol and water of 1:1:4 was the best solvent for extracting proanthocyanidins from Korean pine bark. The best process parameters optimized by response surface methodology were as follows: The ratio of liquid to material was 16 mL/g, ultrasonic time was 50 min, ultrasonic temperature was 55 ℃, and ultrasonic power was 480 W. The extraction effect of proanthocyanidins from Korean pine bark was the best, and the yield of proanthocyanidins was 4.11%. Boltzman model could well fit the kinetic process of ultrasonic-assisted deep eutectic solvent extraction of proanthocyanidins (R2≥0.9768), and the validation value of the model was highly ansistent with the prediction value (R2≥0.9442). Conclusion: Ultrasonic-assisted deep eutectic solvent could effectively promote the mass transfer of proanthocyanidins from Korean pine bark, and Boltzman model was determined to be the best kinetic model for extraction of proanthocyanidins. The extraction process could also provide reference for the extraction of relevant natural active substances.
-
原花青素是一类由不同数量的儿茶素、表儿茶素或没食子酸经C4-C6或C4-C8键缩合而成的聚多酚类物质,结构中大量活性酚羟基的存在使其对活性氧自由基和脂质过氧化自由基具有很强的清除作用,一直是抗氧化研究领域的热点[1]。红松,又名果松,属松科、常绿针叶乔木[2],主要分布在我国东北长白山至小兴安岭地区。红松树皮呈灰褐色长方鳞状块片,含有较丰富的的原花青素类化合物,含量在9%左右,其中利用价值高的低聚体部分占比40%以下,近60%为多聚体的形式存在[3]。
目前,对红松树皮原花青素的提取方法主要有有机溶剂提取法[4]、酶解法[5]及超声波辅助提取法[6]等。Abbott等[7]在2003年首次提出低共熔溶剂(Deep Eutectic Solvent,DES)通常由氢键受体和氢键供体组成。其中,以氯化胆碱作为氢键受体和其它氢键供体组成的低共熔溶剂体系在提取多酚、黄酮和多糖等生物活性物质方面进行了较多研究[8]。Zhang等[9]利用氯化胆碱和1,4-丁二醇形成的DESs提取怀山药中的活性多糖成分,使怀山药多糖的得率大幅度提高。王晓艺等[10]利用超声分别辅助低共熔溶剂和乙醇对玫瑰中的多酚进行提取,发现低共熔体系提取得到的多酚含量比乙醇提取含量高24%。低共熔溶剂因其具有制备简单快捷、安全性高、成本低、可生物降解、无毒、提取率高、可回收利用等优点,所以被作为提取天然产物活性成分的绿色溶剂广泛使用[11],而将超声辅助低共熔溶剂法用于对红松树皮原花青素的提取还未见报道。
红松树皮作为一种森林资源废弃物,没有得到很好的开发利用,目前主要是作为燃料或者提取栲胶。本实验将超声辅助低共熔溶剂法用于对红松树皮原花青素进行提取,优化提取工艺参数,并对提取工艺过程进行动力学模型的建立和验证,旨在对红松树皮中原花青素的提取和开发利用提供理论和技术参考。
1. 材料与方法
1.1 材料与仪器
红松(Pinus koraiensis)树皮 东北林业大学帽儿山实验林场提供;儿茶素标准品 纯度98.0%,上海源叶生物技术有限公司;所用试剂 均为分析纯。
AL-1041C分析天平 METTLER TOLEDO公司;D5A离心机 湖南凯达科学仪器有限公司;SK5200BT超声清洗器 上海科导超声仪器有限公司;TU1900紫外−可见分光光度计 北京普析通用仪器有限责任公司;JP-1000B-2高速多功能粉碎机 永康市永久工贸有限公司。
1.2 实验方法
1.2.1 原料处理
红松树皮40 ℃烘干粉碎,过60目筛,按料液比1:6 g/mL条件,正己烷浸泡,50 ℃下脱脂24 h[12],真空过滤后得红松树皮脱脂粉末。
1.2.2 原花青素得率的计算
采用香草醛-盐酸法[13]进行原花青素含量的测定,得到儿茶素标准曲线方程为:y=0.0022x+0.0146(R2=0.999)。
W(%)=C×V×NM×100 式中:W为原花青素得率(%);C为原花青素质量浓度(mg/mL);V为提取液体积(mL);N为稀释倍数;M为样品质量(g)。
1.2.3 低共熔溶剂的制备
三种低共熔溶剂制备方案如表1,在恒温水浴60 ℃条件下,磁力搅拌50 min,冷却至室温。分别使用三种低共熔溶剂与红松树皮以液料比10 mL/g混合,在320 W,50 ℃的超声条件下超声50 min。以原花青素得率为指标,对不同类型低共熔体系提取原花青素效果进行比较。
表 1 三种低共熔溶剂制备方案Table 1. Three preparation schemes of deep eutectic solvent低共熔溶剂 溶剂体系构成 摩尔比 氢供体 氢受体 水 DES-1 丙三醇 氯化胆碱 水 1:1:4 DES-2 葡萄糖 氯化胆碱 水 1:1:4 DES-3 尿素 氯化胆碱 水 1:1:4 1.2.4 超声辅助低共熔溶剂法提取原花青素的单因素实验
准确称取2.00 g红松树皮粉末于离心管中,DES-1(氯化胆碱:丙三醇:水=1:1:4)作为提取溶剂,分别考察液料比、超声时间、超声温度、超声功率对原花青素得率的影响。
固定超声时间为50 min,超声温度为60 ℃,超声功率为480 W,液料比分别为5、10、15、20、25 mL/g,测定在不同液料比条件下原花青素得率。
固定液料比为15 mL/g,超声温度为60 ℃,超声功率为480 W,超声时间分别为30、40、50、60、70 min,测定在不同超声时间条件下原花青素得率。
固定液料比为15 mL/g,超声时间为50 min,超声功率为480 W,超声温度分别为30、40、50、60、70 ℃,测定在不同超声温度条件下原花青素得率。
固定液料比为15 mL/g,超声时间为50 min,超声温度为60 ℃,超声功率分别为320、400、480、560、640 W,测定在不同超声功率条件下原花青素得率。
1.2.5 响应面优化试验
在单因素实验基础上,采用中心组合Box-Behnken Design设计4因素3水平的响应面工艺优化试验方案(表2),对超声辅助低共熔溶剂提取红松树皮原花青素的工艺参数进行优化。
表 2 响应面试验因素水平设计Table 2. Factors and levels of response surface methodology水平 A液料比
(mL/g)B超声时间
(min)C超声温度
(℃)D超声功率
(W)−1 10 40 50 400 0 15 50 60 480 +1 20 60 70 560 1.2.6 超声辅助低共熔溶剂法提取动力学模型设计
目前国内外对天然产物活性成分提取动力学的研究常选用Fick扩散第一定律、Fick扩散第二定律和Boltzman等模型进行方程拟合并验证。对比国内外提取动力学方程的研究,本文从众多拟合方程中选出三种拟合程度较高的动力学模型进行拟合,即Boltzman模型、Stirling模型、Allomaticl模型。
在超声辅助低共熔溶剂法提取原花青素单因素的基础上,通过对40、50、60、70 ℃四种温度5~50 min超声时间条件下的原花青素得率进行回归拟合,建立超声辅助低共熔溶剂法提取动力学方程[14],选出最佳的提取动力学模型。并在40、50、60、70 ℃四种温度条件下选择两个时间点(18、36 min)测定原花青素得率,对比预测值和实测值进行验证试验。在质量守恒的前提下,采用不同的动力学方程拟合提取过程,建立通用的原花青素提取模型,为红松资源的回收利用提供可行性依据。
1.3 数据处理
所有实验均重复三次,采用Excel 2007、SPSS Statistics 17.0、Design expert 8.0.6软件进行数据处理;运用Origin 2018进行数据图的绘制,其中P<0.05显示具有统计学意义。
2. 结果与分析
2.1 低共熔溶剂类型的选择
三种不同低共熔溶剂提取的红松树皮原花青素得率如表3所示。
表 3 提取溶剂对原花青素得率的影响Table 3. Effect of extraction solvent on the yield of procyanidins低共熔溶剂类型 原花青素得率(%) DES-1(氯化胆碱:丙三醇:水=1:1:4) 3.36c DES-2(氯化胆碱:葡萄糖:水=1:1:4) 1.56a DES-3(氯化胆碱:尿素:水=1:1:4) 2.68b 注:同列数值后不同小写字母表示差异显著(P<0.05)。 如表3可知,不同低共熔溶剂对提取原花青素得率的影响依次为:DES-1>DES-3>DES-2。低共熔体系组分的毒性数据表明其是绿色溶剂,组成成分在生物领域和药学领域均是可以接受的[15]。2021年Azevedo等[16]验证氯化胆碱的低共熔体系是一种可代替离子液体的绿色溶剂。低共熔溶剂中的氢键作用力、溶解性、表面张力、熔点、黏度与极性等物理性质都会对原花青素的提取产生影响[17]。氯化胆碱、丙三醇和水组成的低共熔体系提取的原花青素得率显著高于其他两种低共熔溶剂(P<0.05),对原花青素具有较强的溶解作用,可能是丙三醇中的羟基可以与原花青素类化合物形成分子间氢键,使原花青素的溶解度大幅度增加[18]。Zhao等[19]采用氯化胆碱与三乙二醇组成低共熔溶剂体系对槐花中芦丁进行提取,得到醇类与氨基酸组成的低共熔溶剂体系对黄酮类化合物提取效果最好。因此选择DES-1,即氯化胆碱、丙三醇和水制备的DESs作为红松树皮原花青素提取的最佳溶剂。
2.2 超声辅助低共熔溶剂提取红松树皮原花青素的单因素实验结果
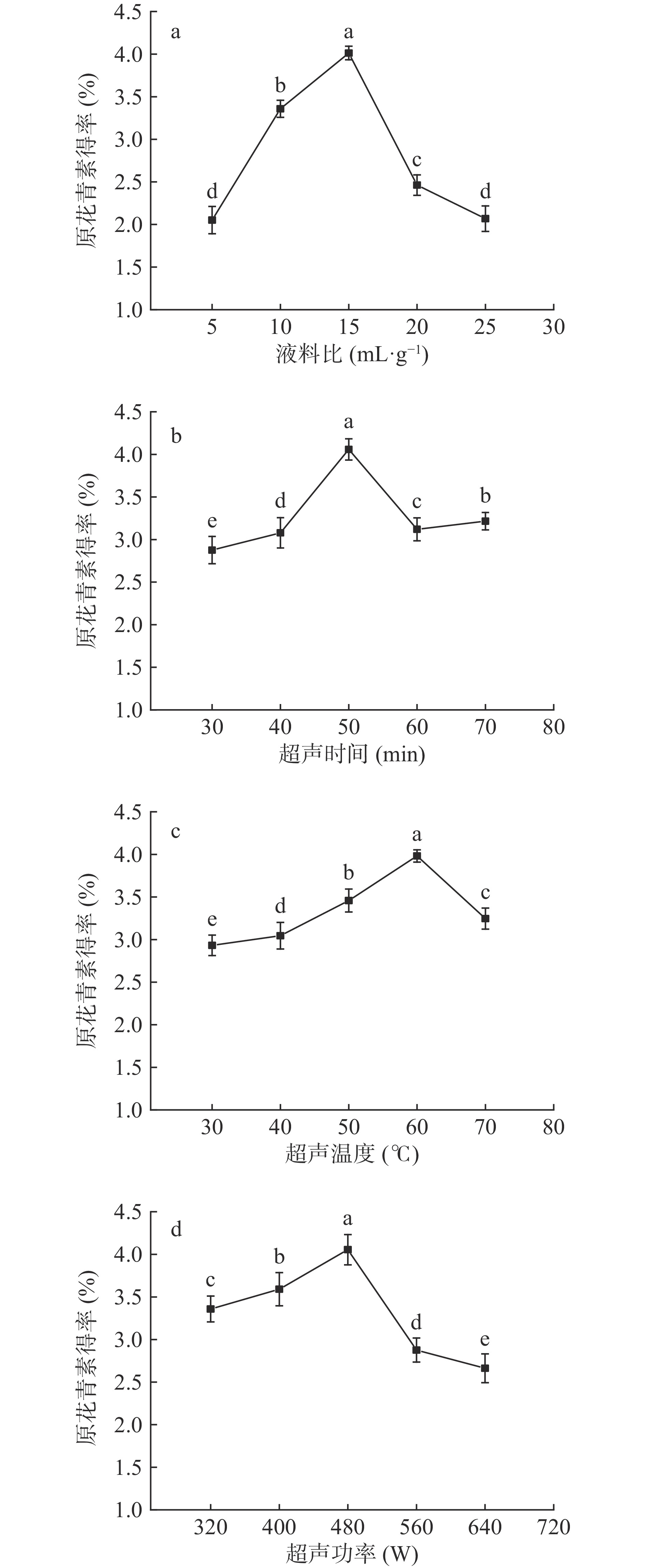
超声辅助低共熔溶剂提取条件下,不同液料比、超声时间、超声温度、超声功率对红松树皮中原花青素得率的影响见图1。
由图1a可知:随着液料比的增加,原花青素得率呈现显著性的增加(P<0.05),当液料比超过15 mL/g后呈显著性下降趋势(P<0.05)。这可能是由于低共熔溶剂体积的增加,使得原花青素与溶剂的接触面积增大,增加原花青素的传质动力,使原花青素得率显著增加。当原花青素在低共熔溶剂中的溶解度达到了饱和,同时提取试剂导致作用于原料的辐射能量减少,以及原料中杂质的溶出均会导致原花青素得率的下降[20]。
由图1b可知:在超声时间逐渐增加的条件下,原花青素得率整体趋势为先上升后下降的变化趋势。超声时间逐渐增加使红松树皮组织的细胞壁被破坏,原花青素得率呈上升趋势,在超声50 min时,原花青素得率达到最大为4.06%(P<0.05)。
由图1c可知:随着温度的上升,低共熔溶剂的黏度逐渐下降,表面张力减小,传质作用增强进而增加原花青素的浸提效果[21],故原花青素得率呈上升趋势;当温度达到60 ℃后,分子运动加快,使氢供体和氢受体间的氢键稳定性下降[22],对原花青素的浸提能力下降,温度高,低共熔溶剂体系的极性下降,降低原花青素得率[23]。
由图1d可知:当超声功率480 W时,原花青素得率最高为4.05%(P<0.05)。超声时间过长或功率过大,组织细胞壁不能进一步破坏,而已析出物质被破坏,影响原花青素的溶解,使原花青素得率呈下降趋势或波动状态[24]。超声功率超过480 W后,随着超声强度增加,就出现“饱和效应”导致DES超分子结构和有效成分结构的破坏[25],同时杂质大量溶出使原花青素成分析出受到遏制,原花青素得率下降。
2.3 超声辅助低共熔溶剂提取红松树皮原花青素的响应面试验结果
根据单因素的实验结果,以原花青素得率为考察响应值,根据响应面分析法中Box-Behnken Design的中心组合试验设计原理,以液料比(A)、提取时间(B)、超声温度(C)、超声功率(D)为自变量,设计四因素三水平共29个试验点的响应面分析,试验设计及结果见表4。
表 4 响应面试验设计结果Table 4. Response surface test design results实验号 A液料比
(mL/g)B超声时间
(min)C超声温度
(℃)D超声功率
(W)原花青素得率
(%)1 20 40 60 480 3.02 2 15 40 70 480 2.31 3 15 40 60 400 2.22 4 10 60 60 480 2.76 5 15 60 60 560 3.51 6 10 50 60 400 2.20 7 15 50 70 400 2.00 8 10 50 70 480 2.24 9 10 40 60 480 2.66 10 15 50 60 480 3.99 11 20 50 50 480 3.72 12 15 60 70 480 2.18 13 15 50 60 480 3.88 14 15 50 70 560 2.36 15 10 50 60 560 3.13 16 20 50 70 480 2.65 17 15 50 50 400 2.62 18 15 50 60 480 3.90 19 15 50 50 560 3.66 20 20 50 60 400 2.52 21 20 50 60 560 3.57 22 15 40 60 560 3.11 23 15 40 50 480 3.07 24 15 50 60 480 4.35 25 20 60 60 480 3.21 26 15 60 50 480 3.72 27 15 60 60 400 2.25 28 10 50 50 480 3.36 29 15 50 60 480 4.02 2.3.1 回归方程模型与方差分析
采用Design-Expert8.0对数据进行回归拟合分析,二次方程模型为Y=4.03+0.20A+0.10B−0.53C+0.46D+0.022AB+0.013AC+0.028AD−0.19BC+0.092BD−0.17CD−0.47A2−0.60B2−0.61C2−0.71D2。
根据表5、表6结果分析,回归模型决定系数R2=0.9784,说明其他因素条件对实验结果影响不大,响应值的变化有97.84%来自于所选因素,矫正后的决定系数R2adj=0.9569,表明该回归模型具有充分性和准确性,可以采用该模型确定原花青素提取的最佳工艺条件。且模型P<0.01,有极显著差异,失拟项为0.8968>0.05,差异不显著,说明该模型稳定性好。模型变量A、C、D、A2、B2、C2、D2均达极显著水平(P<0.01),单因素变量B及相交变量BC、CD均达显著水平(P<0.05),比较F值可知,影响提取原花青素的显著性因素依次是:C(超声温度)>D(超声功率)>A(液料比)>B(超声时间)。
表 5 方差分析结果Table 5. Results of variance analysis方差来源 平方和 自由度 均方 F值 Pr>F 显著性 模型 12.97 14 0.93 45.40 <0.0001 ** A 0.46 1 0.46 22.39 0.0003 ** B 0.13 1 0.13 6.43 0.0238 * C 3.42 1 3.42 167.73 <0.0001 ** D 2.55 1 2.55 124.97 <0.0001 ** AB 1.892×10−3 1 1.892×10−3 0.093 0.7653 AC 6.502×10−4 1 6.502×10−4 0.032 0.8609 AD 3.249×10−3 1 3.249×10−3 0.16 0.6960 BC 0.15 1 0.15 7.30 0.0172 * BD 0.034 1 0.034 1.66 0.2187 CD 0.12 1 0.12 5.71 0.0315 * A2 1.42 1 1.42 69.65 <0.0001 ** B2 2.30 1 2.30 112.71 <0.0001 ** C2 2.43 1 2.43 119.28 <0.0001 ** D2 3.24 1 3.24 158.63 <0.0001 ** 失拟项 0.14 10 0.014 0.39 0.8968 纯误差 0.14 4 0.036 总和 13.26 28 注:*表示差异显著,P<0.05;**表示差异极其显著,P<0.01。 表 6 回归方程可靠性分析结果Table 6. Reliability analysis results of regression equation项目 数值 项目 数值 标准差 0.14 R2 0.9784 平均数 3.05 矫正R2 0.9569 变异系数(%) 4.69 拟合度 0.9217 PRESS 1.04 拟合度 20.863 2.3.2 响应面交互作用分析
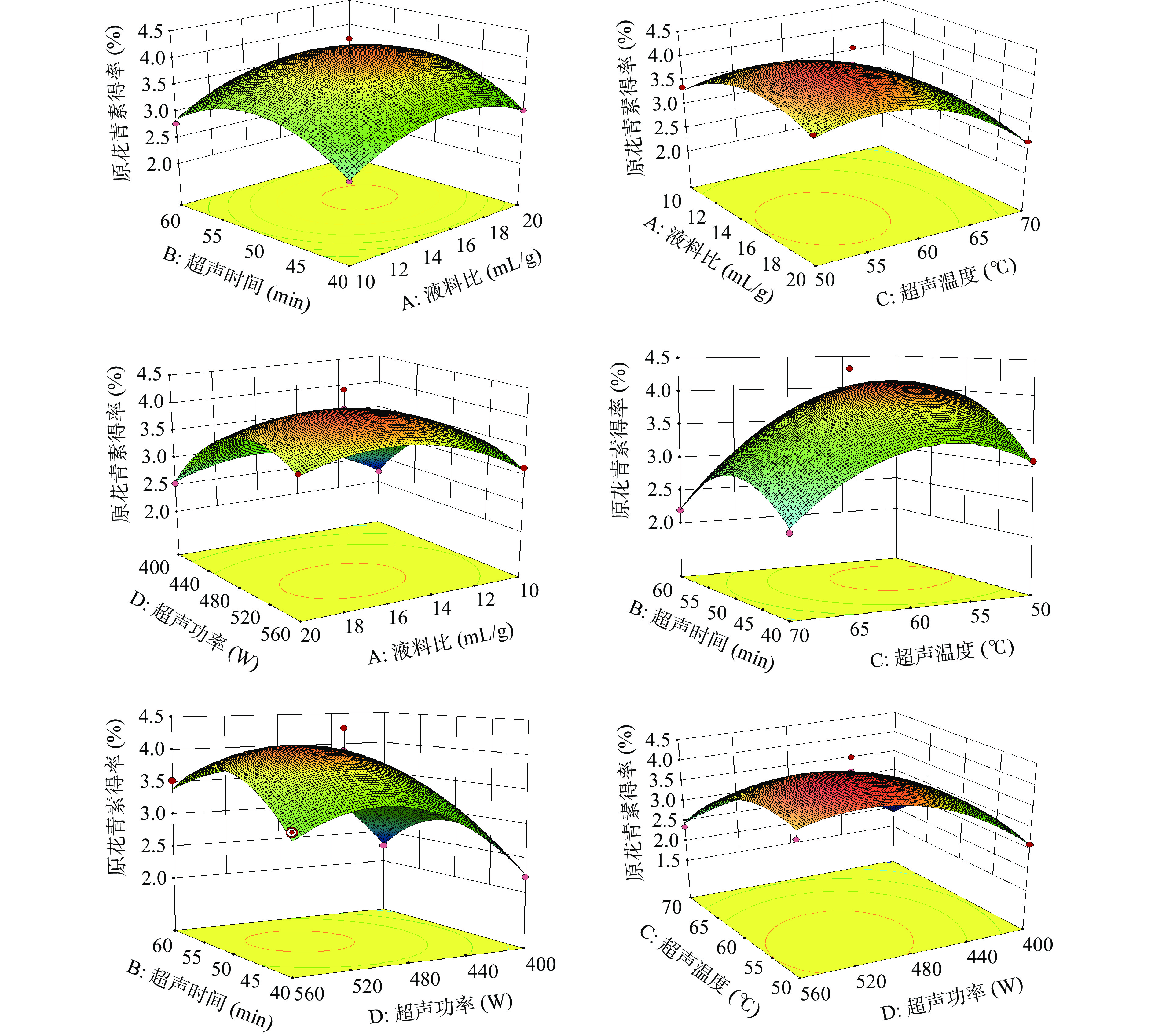
各因素交互作用的响应面图见图2。
3D响应面图的曲线倾斜度越大表明两因素交互作用越显著,等高线越密集则表明因素对响应变量的影响越显著[26]。超声温度和超声时间的响应交互曲面与超声温度和超声功率的响应交互曲面均为椭圆形、有较好的倾斜度、且等高线较为密集,说明两个相交变量均对原花青素提取率的交互作用显著(P<0.05)。随着温度的升高,提取率明显提升,可能由于高温降低了黏度和表面张力,有利于原花青素的溶出[21]。
等高线呈明显的椭圆形和马鞍形时,表明两个因素交互作用显著;呈现圆形时表明因素间交互作用不显著[27]。液料比和超声时间的交互作用不显著(P>0.05),液料比和超声时间的变化曲面均相对平缓,可得液料比和超声时间对原花青素得率均不显著。超声温度的响应曲面比液料比的响应曲面陡峭,说明超声温度对原花青素得率比液料比对原花青素得率更为显著。
2.3.3 响应面模型验证试验
通过响应面分析得到超声辅助低共熔溶剂提取红松树皮中原花青素的最佳工艺条件为:液料比16.097 mL/g,超声时间52.076 min,超声温度54.769 ℃,超声功率512.597 W,预计原花青素得率4.29%,考虑到实际操作和仪器限制,调整最佳工艺为液料比16 mL/g,超声时间50 min,超声温度55 ℃,超声功率480 W。在此条件下进行最优工艺的验证,原花青得率为4.11%,与理论值接近。
2.4 超声辅助低共熔溶剂提取红松树皮原花青素动力学
2.4.1 原花青素提取动力学模型的拟合
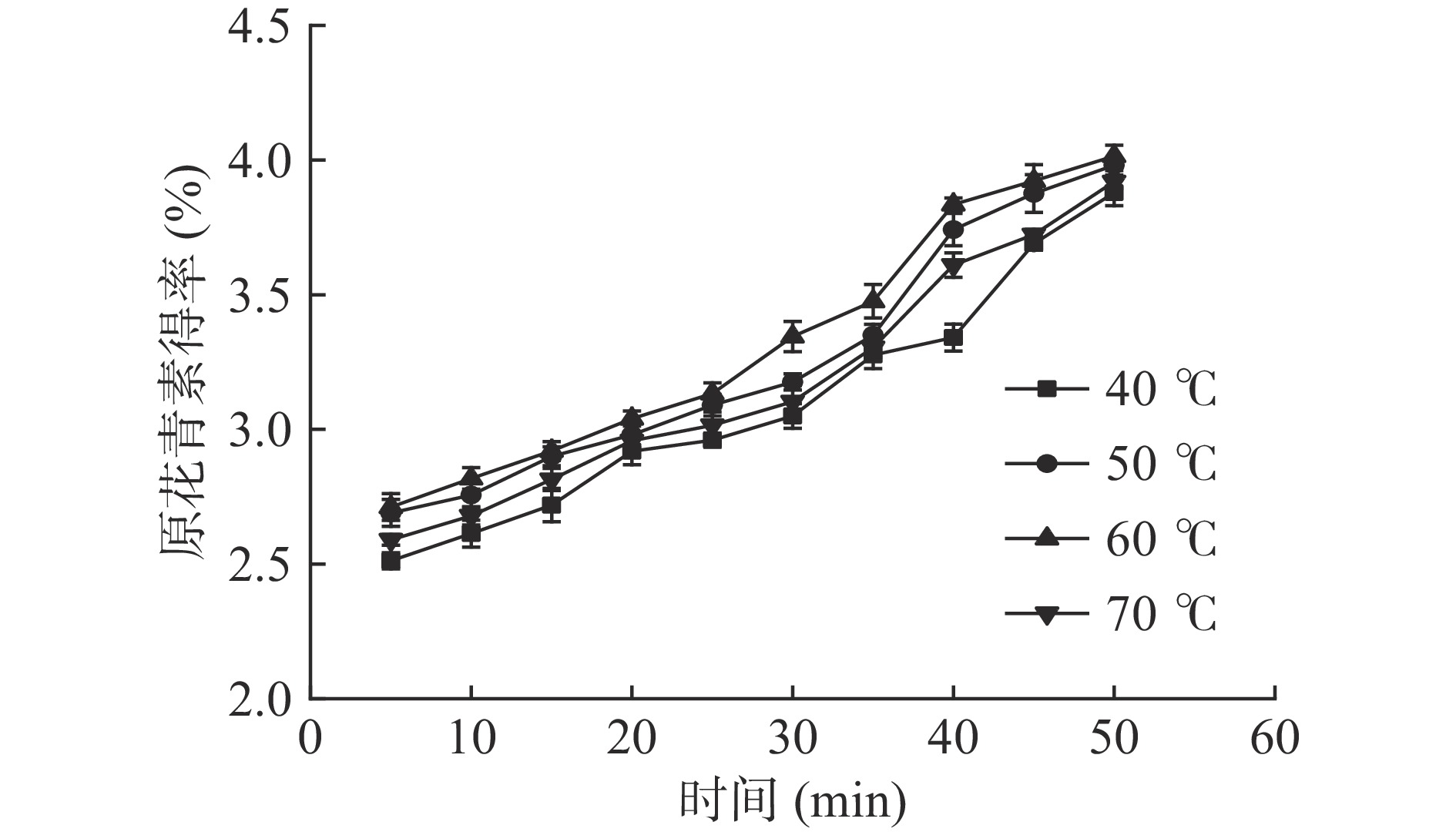
以DES-1为提取溶剂,液料比16 mL/g,超声功率480 W条件下,考察不同温度和时间对原花青素提取的影响,结果如图3所示。
由图3可知,在一定温度条件下,原花青素得率随超声时间延长而上升,在35~40 min时,得率的增加较为明显,可能因为此段时间处于传质的洗涤和扩散状态[28]。当超声温度60 ℃时,提取效果为最佳,原花青素得率最高,提取达到平衡状态所需的时间减少,在初始阶段,提取得率随时间的延长增加迅速,随后提取速率逐渐降低。超声温度40 ℃时,整体提取效果较差,在40~45 min时,提取速率增加。超声温度70 ℃时,原花青素得率整体高于40 ℃时的得率,但低于60 ℃时的原花青素得率。这是因为升高温度可以减弱原花青素和原料基质的物理吸附作用强度,使原花青素易解吸下来,但过高温度会使原花青素发生热降解作用[29]。
采用Origin Pro 8. 0 软件将实验数据与三个模型方程进行拟合,结果如表7。
表 7 不同超声温度条件下提取模型的拟合参数Table 7. Extraction of fitting parameters of the model under different ultrasonic temperatures模型名称和方程 提取温度(℃) 模型拟合参数 R2 A1 A2 x0 dx Boltzman
y=A1−A21+e(x−x0)/dx+A240 19.2477 3174.2577 247.5853 38.8895 0.9814 50 26.4708 44.5809 37.7648 10.7516 0.9768 60 26.5044 43.1672 33.3190 10.2305 0.9859 70 22.3018 62.9790 57.5218 23.0584 0.9846 Stirling
y=a+b(ekx−1k)a b k 40 19.2022 0.3783 0.0255 0.9841 50 19.9991 0.4011 0.0247 0.9736 60 11.7063 0.5576 0.0145 0.9784 70 18.2538 0.4207 0.0224 0.9865 Allomaticl
y=axba b 40 16.4152 0.2002 0.8353 50 17.5664 0.1946 0.8067 60 17.7289 0.1982 0.8505 70 16.9809 0.1972 0.8377 由表7可知,表中决定系数(R2)越大,表示该模型越能准确描述不同超声温度在不同时间下原花青素的提取动力学过程。在对Boltzman模型进行拟合时,在60 ℃下R2最高拟合度为0.9859,在50 ℃下R2最低拟合度为0.9768;在对Stirling模型进行拟合时,在70 ℃下R2最高拟合度为0.9865,在50 ℃下R2最低拟合度为0.9736;在对Allomaticl模型进行拟合时,在60 ℃下R2最高拟合度为0.8505,在50 ℃下R2最低拟合度为0.8067。综合数据分析,在超声温度为40、50、60、70 ℃时,最能反映原花青素得率随超声时间和温度变化的动力学方程为Boltzman模型,对应R2分别为0.9814、0.9768、0.9859、0.9846。
2.4.2 原花青素提取动力学模型的验证
为了进一步验证动力学方程模型的准确性,分别在不同温度的18、36 min,测定原花青素得率,并对比预测值和实测值,结果如表8所示。
表 8 原花青素提取动力学模型的验证Table 8. Verification of extraction kinetic model of procyanidins
时间(min)原花青素得率(%) 40 ℃ 50 ℃ 60 ℃ 70 ℃ 预测值 实测值 拟合程度 预测值 实测值 拟合程度 预测值 实测值 拟合程度 预测值 实测值 拟合
程度18 2.78 2.85 0.9764 2.89 3.06 0.9442 2.95 2.90 0.982
52.85 2.71 0.9511 36 3.28 3.40 0.9654 3.47 3.65 0.9514 3.59 3.62 0.992
53.37 3.26 0.9671 由表8可知,原花青素的预测值和实测值的拟合程度变化范围是是0.9442~0.9925,拟合程度较好,Boltzman模型可以很好地反应提取动力学过程。所以可以通过Boltzman模型来进行探究在不同温度条件下原花青素得率与储藏时间的关系,为预测红松树皮在不同贮藏条件下活性成分的提取提供理论指导。
3. 结论
低共熔溶剂作为一种新型绿色环保溶剂,具有提取效率高、体系制备简单、毒性低、成本低的优点。本实验选用超声辅助低共熔溶剂法提取红松树皮中的原花青素,通过响应面优化出最佳提取工艺为氯化胆碱:丙三醇:水(1:1:4)、液料比16 mL/g、超声时间50 min、超声温度55 ℃、超声功率480 W,此条件下原花青素得率为4.11%。对不同超声温度下原花青素得率随时间的动力学变化进行拟合,发现Boltzman模型的拟合程度较好,决定系数R2≥0.9768。验证实验中实测值与预测值之间拟合度R2≥0.9442,说明此模型拟合程度较好,该模型的建立为以后红松树皮原花青素的提取与利用提供了可行性依据。
-
表 1 三种低共熔溶剂制备方案
Table 1 Three preparation schemes of deep eutectic solvent
低共熔溶剂 溶剂体系构成 摩尔比 氢供体 氢受体 水 DES-1 丙三醇 氯化胆碱 水 1:1:4 DES-2 葡萄糖 氯化胆碱 水 1:1:4 DES-3 尿素 氯化胆碱 水 1:1:4 表 2 响应面试验因素水平设计
Table 2 Factors and levels of response surface methodology
水平 A液料比
(mL/g)B超声时间
(min)C超声温度
(℃)D超声功率
(W)−1 10 40 50 400 0 15 50 60 480 +1 20 60 70 560 表 3 提取溶剂对原花青素得率的影响
Table 3 Effect of extraction solvent on the yield of procyanidins
低共熔溶剂类型 原花青素得率(%) DES-1(氯化胆碱:丙三醇:水=1:1:4) 3.36c DES-2(氯化胆碱:葡萄糖:水=1:1:4) 1.56a DES-3(氯化胆碱:尿素:水=1:1:4) 2.68b 注:同列数值后不同小写字母表示差异显著(P<0.05)。 表 4 响应面试验设计结果
Table 4 Response surface test design results
实验号 A液料比
(mL/g)B超声时间
(min)C超声温度
(℃)D超声功率
(W)原花青素得率
(%)1 20 40 60 480 3.02 2 15 40 70 480 2.31 3 15 40 60 400 2.22 4 10 60 60 480 2.76 5 15 60 60 560 3.51 6 10 50 60 400 2.20 7 15 50 70 400 2.00 8 10 50 70 480 2.24 9 10 40 60 480 2.66 10 15 50 60 480 3.99 11 20 50 50 480 3.72 12 15 60 70 480 2.18 13 15 50 60 480 3.88 14 15 50 70 560 2.36 15 10 50 60 560 3.13 16 20 50 70 480 2.65 17 15 50 50 400 2.62 18 15 50 60 480 3.90 19 15 50 50 560 3.66 20 20 50 60 400 2.52 21 20 50 60 560 3.57 22 15 40 60 560 3.11 23 15 40 50 480 3.07 24 15 50 60 480 4.35 25 20 60 60 480 3.21 26 15 60 50 480 3.72 27 15 60 60 400 2.25 28 10 50 50 480 3.36 29 15 50 60 480 4.02 表 5 方差分析结果
Table 5 Results of variance analysis
方差来源 平方和 自由度 均方 F值 Pr>F 显著性 模型 12.97 14 0.93 45.40 <0.0001 ** A 0.46 1 0.46 22.39 0.0003 ** B 0.13 1 0.13 6.43 0.0238 * C 3.42 1 3.42 167.73 <0.0001 ** D 2.55 1 2.55 124.97 <0.0001 ** AB 1.892×10−3 1 1.892×10−3 0.093 0.7653 AC 6.502×10−4 1 6.502×10−4 0.032 0.8609 AD 3.249×10−3 1 3.249×10−3 0.16 0.6960 BC 0.15 1 0.15 7.30 0.0172 * BD 0.034 1 0.034 1.66 0.2187 CD 0.12 1 0.12 5.71 0.0315 * A2 1.42 1 1.42 69.65 <0.0001 ** B2 2.30 1 2.30 112.71 <0.0001 ** C2 2.43 1 2.43 119.28 <0.0001 ** D2 3.24 1 3.24 158.63 <0.0001 ** 失拟项 0.14 10 0.014 0.39 0.8968 纯误差 0.14 4 0.036 总和 13.26 28 注:*表示差异显著,P<0.05;**表示差异极其显著,P<0.01。 表 6 回归方程可靠性分析结果
Table 6 Reliability analysis results of regression equation
项目 数值 项目 数值 标准差 0.14 R2 0.9784 平均数 3.05 矫正R2 0.9569 变异系数(%) 4.69 拟合度 0.9217 PRESS 1.04 拟合度 20.863 表 7 不同超声温度条件下提取模型的拟合参数
Table 7 Extraction of fitting parameters of the model under different ultrasonic temperatures
模型名称和方程 提取温度(℃) 模型拟合参数 R2 A1 A2 x0 dx Boltzman
y=A1−A21+e(x−x0)/dx+A240 19.2477 3174.2577 247.5853 38.8895 0.9814 50 26.4708 44.5809 37.7648 10.7516 0.9768 60 26.5044 43.1672 33.3190 10.2305 0.9859 70 22.3018 62.9790 57.5218 23.0584 0.9846 Stirling
y=a+b(ekx−1k)a b k 40 19.2022 0.3783 0.0255 0.9841 50 19.9991 0.4011 0.0247 0.9736 60 11.7063 0.5576 0.0145 0.9784 70 18.2538 0.4207 0.0224 0.9865 Allomaticl
y=axba b 40 16.4152 0.2002 0.8353 50 17.5664 0.1946 0.8067 60 17.7289 0.1982 0.8505 70 16.9809 0.1972 0.8377 表 8 原花青素提取动力学模型的验证
Table 8 Verification of extraction kinetic model of procyanidins
时间(min)原花青素得率(%) 40 ℃ 50 ℃ 60 ℃ 70 ℃ 预测值 实测值 拟合程度 预测值 实测值 拟合程度 预测值 实测值 拟合程度 预测值 实测值 拟合
程度18 2.78 2.85 0.9764 2.89 3.06 0.9442 2.95 2.90 0.982
52.85 2.71 0.9511 36 3.28 3.40 0.9654 3.47 3.65 0.9514 3.59 3.62 0.992
53.37 3.26 0.9671 -
[1] 苏晓雨, 王振宇. 红松种子壳多酚物质的提取及抗氧化特性[J]. 农业工程学报,2009,25(S1):198−203. [SU X Y, WANG Z Y. Polyphenol extraction from Pinus koraiensis seed putamina and its antioxidant activities[J]. Transactions of the Chinese Society of Agricultural Engineering,2009,25(S1):198−203. SU X Y, WANG Z Y. Polyphenol extraction from Pinus koraiensis seed putamina and its antioxidant activities[J]. Transactions of the Chinese Society of Agricultural Engineering, 2009, 25(S1): 198-203.
[2] 贠可力. 红松抗氧化成分分析及对60Co射线诱导损伤防护作用[D]. 哈尔滨: 哈尔滨工业大学, 2017. YUN K L. Antioxidant composition analysis and radioprotective effect of Pinus koraiensis extract on damage induced by 60Co ray[D]. Harbin: Harbin Institute of Technology, 2017.
[3] ZHANG S T, ZHANG L G, WANG L, et al. Total phenols, flavonoids, and procyanidins levels and total antioxidant activity of different korean pine (Pinus koraiensis) varieties[J]. Journal of Forestry Research,2019,30(5):1743−1754. doi: 10.1007/s11676-018-0744-0
[4] 祖元刚, 胡艳, 姜守刚. 红松多酚物质的提取工艺及其抗炎活性初步研究[J]. 植物研究,2016,36(4):634−640. [ZU Y G, HU Y, JIANG S Y. Extraction and anti-inflammatory of korean pine polyphenol[J]. Bulletin of Botanical Research,2016,36(4):634−640. ZU Y G, HU Y, JIANG S Y. Extraction and anti-inflammatory of korean pine polyphenol[J]. Bulletin of Botanical Research, 2016, 36(4): 634-640.
[5] 黄雨洋. 红松多酚分离鉴定及抗氧化抗癌功能研究[D]. 哈尔滨: 东北林业大学, 2014. HUANG Y Y. The separation, isolation and identification of polyphenol structures in korean pine bark and evaluation of its antioxidant and anticancer activity[D]. Harbin: Northeast Forestry University, 2014.
[6] 包怡红, 王硕, 王文琼, 等. 超声波酶法提取红松树皮中多酚类化合物的研究[J]. 食品工业科技,2013,34(3):232−236. [BAO Y H, WANG S, WANG W Q, et al. Study on ultrasonic-enzymatic extraction of polyphenolic compounds in korean pine bark[J]. Science and Technology of Food Industry,2013,34(3):232−236. BAO Y H, WANG S, WANG W Q, et al. Study on ultrasonic-enzymatic extraction of polyphenolic compounds in korean pine bark[J]. Science and Technology of Food Industry, 2013, 34(3): 232-236.
[7] ABBOTT A P, CAPPER G, DAVIES D L, et al. Novel solvent properties of choline chloride/urea mixtures[J]. Chemical Communications (Cambridge, England),2003,9(1):70−71.
[8] JIANG H, XU Y, SUN C Y, et al. Physicochemical properties and antidiabetic effects of a polysaccharide obtained from polygonatum odoratum[J]. International Journal of Food Science & Technology,2018,53(12):2810−2822.
[9] ZHANG L J, WANG M S. Optimization of deep eutectic solvent-based ultrasound-assisted extraction of polysaccharides from Dioscorea opposita thunb[J]. International Journal of Biological Macromolecules,2017,95:75−681.
[10] 王晓艺, 李培坤, 李锦红, 等. 超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性[J]. 食品研究与开发,2022,43(8):98−105. [WANG X Y, LI P K, LI J H, et al. Ultrasonic-assisted extraction of rose polyphenols by deep eutectic solvent and antioxidant activity[J]. Food Research and Development,2022,43(8):98−105. WANG X Y, LI P K, LI J H, et al. Ultrasonic-assisted extraction of rose polyphenols by deep eutectic solvent and antioxidant activity[J]. Food Research and Development, 2022, 43(8): 98-105.
[11] 刘金铭, 王辉, 张欢, 等. 超声辅助低共熔溶剂萃取法在活性成分提取与食品分析预处理中应用的研究进展[J]. 食品工业科技,2021,42(7):399−407. [LIU J M, WANG H, ZHANG H, et al. Research progress on extraction of active ingredients and pretreatment of food analysis by ultrasound-assisted deep eutectic solvent method[J]. Science and Technology of Food Industry,2021,42(7):399−407. LIU J M, WANG H, ZHANG H, et al. Research progress on extraction of active ingredients and pretreatment of food analysis by ultrasound-assisted deep eutectic solvent method[J]. Science and Technology of Food Industry, 2021, 42(7): 399-407.
[12] 张小丽. 落叶松树皮原花青素的抗氧化性及结构的研究[D]. 北京: 北京林业大学, 2013. ZHANG X L. Studies on antioxidant properties and structure of proanthocyanidins from larch bark[D]. Beijing: Beijing Forestry University, 2013.
[13] PRIOR R L, FAN E, JI H P, et al. Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders[J]. Journal of the Science of Food & Agriculture,2010,90(9):1473−1478.
[14] 王伯初, 苏辉, 杨宪, 等. 天然药物提取过程的传质动力学模型[J]. 中成药,2012,34(12):2309−2312. [WANG B C, SU H, YANG X, et al. Kinetic models for extraction process of natural products[J]. Chinese Traditional Patent Medicine,2012,34(12):2309−2312. WANG B C, SU H, YANG X, et al. Kinetic models for extraction process of natural products[J]. Chinese Traditional Patent Medicine, 2012, 34(12): 2309-2312.
[15] TANG B K, ZHANG H, ROW K H. Application of deep eutectic solvents in the extraction and separation of target compounds from various samples[J]. Journal of Separation Science,2015,38(6):1053−1064. doi: 10.1002/jssc.201401347
[16] AZEVEDO A M O, VILARANDA A G, NEVES A, et al. Development of an automated yeast-based spectrophotometric method for toxicity screening: Application to ionic liquids, GUMBOS, and deep eutectic solvents[J]. Chemosphere,2021(277):130227.
[17] 郑茜. 超声辅助低共熔溶剂提取枳椇子中的黄酮[D]. 十堰: 湖北医药学院, 2021. ZHENG Q. Ultrasonic assisted deep eutectic solvent extraction of flavonoids from Hovenia dulcis thumb[D]. Shiyan: Hubei University of Medicine Master Thesis, 2021.
[18] LU C, CAO J, WANG N, et al. Significantly improving the solubility of non-steroidal anti-inflammatory drugs in deep eutectic solvents for potential non-aqueous liquid administration[J]. MedChemComm,2016,7(5):955−959. doi: 10.1039/C5MD00551E
[19] ZHAO B Y, XU P, YANG F X. Biocompatible deep eutectic solvents based on choline chloride: characterization and application to the extraction of rutin from Sophora japonica[J]. ACS Sustainable Chemistry & Engineering,2015,3(11):2746−2755.
[20] 孔方, 李莉, 刘言娟. 超声辅助低共熔溶剂提取苹果叶中的总黄酮[J]. 食品工业科技,2020,41(14):134−139,147. [KONG F, LI L, LIU Y J. Ultrasonic-assisted deep eutectic solvents extraction of total flavonoids from apple leaves[J]. Science and Technology of Food Industry,2020,41(14):134−139,147. KONG F, LI L, LIU Y J. Ultrasonic-assisted deep eutectic solvents extraction of total flavonoids from apple leaves[J]. Science and Technology of Food Industry, 2020, 41(14): 134-139, 147.
[21] 黎莉, 杨景淇, 于德涵, 等. 超声辅助低共熔溶剂法提取玉米芯总黄酮工艺优化研究[J]. 食品工业科技,2022,43(10):223−230. [LI L, YANG J Q, YU D H, et al. Optimization of ultrasonic-assisted deep eutectic solvent extraction of total flavonoids from corncob[J]. Science and Technology of Food Industry,2022,43(10):223−230. LI L, YANG J Q, YU D H, et al. Optimization of ultrasonic-assisted deep eutectic solvent extraction of total flavonoids from corncob[J]. Science and Technology of Food Industry, 2022, 43(10): 223-230.
[22] ZHAO R M, ZHAO J, DUAN H X, et al. Green and efficient extraction of four bioactive flavonoids from pollen typhae by ultrasound-assisted deep eutectic solvents extraction[J]. Journal of Pharmaceutical and Biomedical Analysis,2018,161:246−253. doi: 10.1016/j.jpba.2018.08.048
[23] ZENG J, DOU Y Q, YAN N, et al. Optimizing ultrasound-assisted deep eutectic solvent extraction of bioactive compounds from Chinese wild rice[J]. Molecules,2019,24(15):2718. doi: 10.3390/molecules24152718
[24] 傅钰, 史璇, 张道明, 等. 低共熔溶剂提取马尾松松针抗氧化成分的研究[J]. 北京林业大学学报,2021,43(7):149−158. [FU J, SHI X, ZHANG D M, et al. Antioxidant activities in extracts from Pinus massoniana needles by deep eutectic solvents[J]. Journal of Beijing Forestry University,2021,43(7):149−158. FU J, SHI X, ZHANG D M, et al. Antioxidant activities in extracts from Pinus massoniana needles by deep eutectic solvents[J]. Journal of Beijing Forestry University, 2021, 43(7): 149-158.
[25] 李艳艳, 王俊青, 刘王文, 等. 响应面法优化超声辅助提取大果青扦叶总黄酮及其抗氧化性研究[J]. 食品研究与开发,2020,41(22):30−36. [LI Y Y, WANG J Q, LIU W W, et al. Study on optimization of ultrasonic assisted extracting process of total flavonoids from Picea neoveitchii leaves by response surface methodology and its antioxidant activity[J]. Food Research and Development,2020,41(22):30−36. LI Y Y, WANG J Q, LIU W W, et al. Study on optimization of ultrasonic assisted extracting process of total flavonoids from Picea neoveitchii leaves by response surface methodology and its antioxidant activity[J]. Food Research and Development, 2020, 41(22): 30-36.
[26] 董嘉琪, 张晓松, 彭晓婷, 等. 响应面法优化红芪多糖的提取工艺[J]. 动物医学进展,2021,42(4):64−71. [DONG J Q, ZHANG X S, PENG X T, et al. Optimization of extraction process of Radix hedysari polysaccharide by response surface methodology[J]. Progress in Veterinary Medicine,2021,42(4):64−71. DONG J Q, ZHANG X S, PENG X T, et al. Optimization of extraction process of Radix hedysari polysaccharide by response surface methodology[J]. Progress in Veterinary Medicine, 2021, 42(4): 64-71.
[27] 符群, 李卉, 王振宇, 等. 减压-超声辅助醇法提取薇菜黄酮及其对抗氧化活性的影响[J]. 现代食品科技,2018,34(3):113−120,130. [FU Q, LI H, WANG Z Y, et al. The effect of decompression-ultrasonic assisted alcoholic extraction on the flavonoids from Osmunda japonica thumb and its antioxidant activity[J]. Modern Food Science and Technology,2018,34(3):113−120,130. FU Q, LI H, WANG Z Y, et al. The effect of decompression-ultrasonic assisted alcoholic extraction on the flavonoids from Osmunda japonica thumb and its antioxidant activity[J]. Modern Food Science and Technology, 2018, 34(3): 113-120, 130.
[28] GEORGE C S, DOUGLAS G. Macdonald. Kinetics of oil extraction from canola (rapeseed)[J]. The Canadian Journal of Chemical Engineering,1986,64(1):80−86. doi: 10.1002/cjce.5450640112
[29] ALI R A. Review on extraction of phenolic compounds from natural sources using green deep eutectic solvents[J]. Journal of Agricultural and Food Chemistry,2021,69(3):878−912. doi: 10.1021/acs.jafc.0c06641
-
期刊类型引用(7)
1. 武玫怡,焦文娟,赵甜甜,刘俊,周芳,刘伟峰,张业辉,南海军,陈晓瑛,黄利华. 高静水压与水煮处理对热带海参品质的影响. 肉类研究. 2025(01): 25-33 .  百度学术
百度学术
2. 王素梅,孟少华,赵建生,赵琳,单吉祥,徐俊涛. 肉制品低钠策略及问题分析. 食品与发酵工业. 2025(07): 405-412 .  百度学术
百度学术
3. 赵宇,丁甜,牛力源,沈默斐,孙宇豪,廖新浴. 自热食品品质提升与安全控制的研究进展. 包装工程. 2024(11): 118-127 .  百度学术
百度学术
4. 周琪,张佳敏,王博,王卫,刘云鹤,钟正国. 肉制品风味形成机制及加工方式对风味影响的研究进展. 西华大学学报(自然科学版). 2024(04): 74-84 .  百度学术
百度学术
5. 陶琦,钟飞,王志文,郑豪. 纳米材料在食品生产和保鲜中的应用. 包装学报. 2024(04): 89-100 .  百度学术
百度学术
6. 郭湘蕾,陈凌利,陈慧,于传龙,王文君. 预制菜生产过程关键加工技术研究进展. 食品科技. 2024(08): 64-71 .  百度学术
百度学术
7. 张顺君,王东亮,陈宏柱,汪雨晗,李新福. 超高压杀菌对酱卤肉制品贮藏期品质的影响. 肉类研究. 2023(12): 54-60 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:
 下载:
下载:



