Effect of Polymethoxy Flavones from Citrus Peels on Antibacterial and Fresh-Keeping of Red Grape
-
摘要: 以柑橘皮多甲氧基黄酮提取物(Polymethexylated flavones,PMFs)为抑菌剂和保鲜剂,以7种菌和新鲜红提葡萄为实验对象,通过测定抑菌圈直径、最低抑菌浓度(Minimal inhibitory concentration,MIC)、果实硬度、呼吸强度和多酚氧化酶(Polyphenol oxidase,PPO)等指标,研究其抑菌效应和对红提葡萄的保鲜作用。抑菌结果表明柑橘皮PMFs对7种菌均具有较强的抑制作用,且呈浓度依赖性;贮藏实验结果表明柑橘皮PMFs对红提有较好的保鲜效果,以4.0 mg/mL柑橘皮PMFs效果最好。贮藏第12 d时,与对照组相比,经4.0 mg/mL柑橘皮PMFs处理后果实中可溶性固形物和硬度无明显变化,VC损失量小,腐烂率和落粒率降低,同时可滴定酸下降缓慢,而呼吸强度、MDA和PPO活性上升缓慢。总之,柑橘皮PMFs显示了较强的抑菌效应和对红提葡萄较好的保鲜效果,表明柑橘皮PMFs具有开发作为天然食品保鲜剂的潜力。
-
关键词:
- 柑橘皮多甲氧基黄酮提取物 /
- 抑菌效应 /
- 红提葡萄 /
- 贮藏品质 /
- 天然保鲜剂
Abstract: The antibacterial effect and protective role of polymethoxy flavones from Citrus peels on storage quality of red grape were investigated in the experiment. The antibacterial effect was studied by measuring the antibacterial circle diameter and MIC. The influence on red grape in the storage process was studied by measuring the fruit firmness, respiration intensity, activity of polyphenol oxidase (PPO) and other indicators. The results of antibacteial experiments showed that PMFs inhibited the growth of bacteria. And the data showed the dose-dependent. The results of storage showed that different concentrations of PMFs had good fresh-keeping effect on the red grapes, as compared with control group. And 4.0 mg/mL PMFs had the best effect. Compared with the control group, the soluble solids and hardness had no change after 4.0 mg/mL PMFs treatment at the 12th day, while VC loss, decay rate and shattering rate were decreased. Respiratory rate, MDA content and PPO activity increased slowly compared with control group, while TA content decreased slowly. The results indicated that PMFs from Citrus peels could improve the storage quality of red grapes as compared with control group. In conclusion, the data showed that PMFs from Citrus peels could act the good fresh-keeping effect on red grape and have the potential to be a kind of natural food preservative. -
红提(Vitis vinifera ‘Red Globe’),又名红地球、晚红等,具有味甘酸、性平的特点,经常食用红提葡萄还可以起到清除体内自由基、阻止血小板凝聚、防止人体低密度脂蛋白氧化以及抗肿瘤的作用[1]。由于红提葡萄果皮薄、含糖量较高、呼吸强度大、极易受到机械损伤以及微生物污染,在贮藏过程中容易出现腐烂、干梗等现象,因此红提葡萄采后的贮藏保鲜是当前亟待解决的问题之一。目前,关于红提葡萄的保鲜方法主要可以分为物理、化学、生物三个方面。
天然提取物保鲜技术属于生物保鲜领域,是利用植物源提取物中的活性物质的天然抑菌性,抑制果蔬表面微生物的活性以及果蔬中相关酶的活力,从而延长果蔬货架期,如肉桂精油、连翘多酚等[2-3]。目前,柑橘主要用于罐头、果汁等的生产加工,而约占果实重量20%的柑橘果皮,除了用于加工为陈皮外,绝大部分被废弃或填埋,造成资源的浪费。多甲氧基黄酮(Polymethoxy flavones,PMFs)是存在于柑橘属果皮中的一类黄酮类化合物,包含大于等于2个甲氧基[4]。黄酮类化合物已被证实具有多种生物活性功能,包括抗菌、抗炎、抗癌、保护心血管、改善认知障碍、提高免疫力等,已被广泛应用于食品、医疗等领域[5-8]。相关研究表明,黄酮类化合物主要通过破坏细胞壁和细胞膜体系、抑制核酸合成及能量代谢、抑制致病菌的呼吸作用等,从而达到防腐保鲜的效果[9-10]。而柑橘皮PMFs,与一般的黄酮类化合物相比,其抗氧化性和抗菌等生物活性更强[11-13],且呈脂溶性,具有更易亲近渗透细胞膜的优势,例如已有研究证实PMFs可通过抑制冷却肉腐败菌的生长和繁殖,延长冷却肉的保质期[14]。
本文探究了柑橘皮PMFs提取物对5种常见食源性细菌和2种红提葡萄易感染真菌的抗菌效应及对红提葡萄贮藏品质的影响,以期为柑橘皮PMFs提取物作为天然保鲜剂提供科学理论依据,不仅可提高柑橘果皮的附加价值,同时也丰富了食品添加剂市场。
1. 材料与方法
1.1 材料与仪器
红提葡萄 订购自辽宁省辽阳市果蔬基地,采收后立即运回实验室,选择果形整齐、大小均匀、无病虫害和机械损伤、色泽及成熟度一致的果实进行实验;柑橘皮多甲氧基黄酮 食品级,购自西安圣青科技有限公司(多甲氧基黄酮,>65%);大肠杆菌、金黄色葡萄球菌、蜡样芽孢杆菌、枯草芽孢杆菌、铜绿假单胞杆菌、灰葡萄孢菌和青霉菌 购自中国微生物菌种保藏中心;脑心浸液肉汤培养基(BHI)、营养琼脂培养基 购自上海泽叶生物科技有限公司;丙二醛(MDA)测试盒(A003-3-1)、多酚氧化酶(PPO)测试盒(A136) 购自南京建成生物工程研究所;其他化学试剂 均为分析纯,购自天津光复化学试剂有限公司。
BSC-1100IIA2生物安全柜 北京东联哈尔仪器制造有限公司;MLS-3750高压蒸汽灭菌锅 日本三洋电器股份有限公司;BJPX-H54恒温培养箱 山东博科生物产业有限公司;ZDP-250台式恒温振荡培养箱 上海五九自动化设备有限公司;牛津杯(内径6 mm,外径8 mm,高10 mm) 上海精密仪器仪表有限公司;WGZ-2XJ浊度测定仪 上海昕瑞仪器仪表有限公司;5428型离心机 德国艾本德公司;721型紫外可见分光光度计 上海佑科仪器仪表有限公司;GY-3型果实硬度计 杭州托普仪器有限公司;PAL-1型手持折光仪 上海精密仪器仪表有限公司;HH-4型数显恒温搅拌水浴锅 常州赛普实验仪器厂。
1.2 实验方法
1.2.1 柑橘皮PMFs、链霉素和制霉菌素配制
取10 mg柑橘皮PMFs粉末溶于1 mL蒸馏水中,置于超声破碎仪中室温超声(功率250 W,频率40 kHz)30 min,配制成10 mg/mL的混悬液母液。而后用蒸馏水将母液分别稀释相应倍数,制得浓度为0.0625、0.125、0.25、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的工作液,备用;取0.5 mg链霉素或制霉菌素溶于1 mL生理盐水中,配制为0.5 mg/mL工作液,作为阳性对照,待用。
1.2.2 抑菌效应检测
1.2.2.1 冻存菌种活化
接种环挑取斜面保藏菌种,放入3 mL BHI液体培养基中,置于恒温振荡培养箱中,细菌于37 ℃培养过夜,真菌于30 ℃培养48 h。取100 μL活化菌液,用涂布器在营养琼脂平板培养基上均匀涂抹,细菌置于恒温培养箱中37 ℃培养过夜,真菌置于恒温培养箱30 ℃培养48 h,待用。
1.2.2.2 牛津杯法测定抑菌圈
参照夏俊芳等[15]研究方法,牛津杯经灭菌处理后,垂直放置于已涂布菌液的平板培养基上,分别加入200 μL不同浓度的PMFs、生理盐水(作为阴性对照)及链霉素(作为细菌的阳性对照)或制霉菌素(作为真菌的阳性对照),细菌置于37 ℃培养24 h,真菌置于30 ℃培养48 h,测量抑菌圈,并记录数据。
1.2.2.3 最低抑菌浓度(MIC)测定
参照Andrews等[16]研究方法,将稀释菌悬液为105~106 CFU/mL,取100 μL菌悬液、2 mL不同浓度的PMFs和15 mL BHI液体培养基共同置于锥形瓶中,37 ℃振荡培养24 h或30 ℃培养48 h后,取100 μL培养液,于517 nm处测定光吸收值(OD值),以OD为0的培养液(首先将培养液OD值调0)中加入的PMFs浓度为MIC。
1.2.3 红提葡萄贮藏实验
将选取的红提葡萄分为五组,实验组分别以2.0、4.0、6.0、8.0 mg/mL的柑橘皮PMFs提取液浸泡5 min,分别记为A、B、C、D四组,对照组使用蒸馏水浸泡相同时间,记为CK组,果实浸泡完毕后取出,自然晾干后用葡萄专用PE保鲜袋进行包装(不扎口),在室温(22±2 ℃)下贮藏,每2 d测定一次数据。
1.2.4 指标测定方法
1.2.4.1 可溶性固形物的测定
每组在每簇果实中随机选取3粒果实,研磨成匀浆,过滤后取汁液,使用手持折光仪进行测定。
1.2.4.2 抗坏血酸(VC)含量的测定
参考曹建康等[17]的方法。利用草酸滴定,绘制标准曲线,得到回归线性方程Y=0.07936X+0.0148。每组在每簇红提葡萄随机选取3粒果实,与草酸混合后,测定吸光值,代入标准曲线,计算VC含量。
1.2.4.3 腐烂率、落粒率的测定
腐烂率的测定:出现病斑的果记为烂果,计算公式为:
腐烂率(%)=腐烂果重总果重×100 落粒率的测定:用手抓住红提葡萄果穗顶部,自然拿起,果实从果穗上自然脱落的记为落果,计算公式为:
落粒率(%)=落粒果重总果重×100 1.2.4.4 果实硬度的测定
参考曹建康等[17]的方法,每组在每簇红提葡萄随机选取3粒果实,围绕果实赤道部位,间隔等距离的三个位置,用小刀去除部分果皮,使用GY-3硬度计测定果实硬度,结果取平均值。
1.2.4.5 可滴定酸的测定
参考曹建康等[17]的方法,每组在每簇果实中随机选取3粒果实,通过氢氧化钠滴定法进行测定,计算公式为:
可滴定酸度(%)=C×V1×K×5M×100 式中:C为氢氧化钠浓度(0.1 mol/L);V1为滴定时消耗的氢氧化钠的毫升数(mL);M为称取葡萄的重量(g);K为葡萄折算系数,酒石酸0.075。
1.2.4.6 呼吸强度的测定
参考曹建康等[17]的方法,每组在每簇果实中随机选取3粒果实,采用静置法测定红提葡萄的呼吸强度,计算公式为:
呼吸强度[mg\;CO2/(kg⋅h)]=(V1−V2)×c×22m×t 式中:V1为空白滴定中草酸溶液消耗量(mL);V2为测定滴定中草酸溶液消耗量(mL);c为草酸溶液浓度(mol/L);m为红提果实质量(kg);t为测定时间(h)。
1.2.4.7 多酚氧化酶活性的测定
每组在每簇果实中随机选取3粒果实,按照试剂盒说明书进行测定,计算公式为:
PPO(U/g鲜重)=60×ΔAW 式中:W为样本质量(g);ΔA=A测定-A对照。
1.2.4.8 丙二醛含量测定
每组在每簇果实中随机选取3粒果实,按照试剂盒说明书进行测定,计算公式为:
MDA(nmol/g)=A测定−A空白A标准−A空白×C标准×V提W 式中:C标准为标准品浓度,10 nmol/mL;W为样本重量(g);V提为所加提取液的总量(mL)。
1.3 数据处理
所有数据均以平均值±标准误表示,每项实验至少重复3次,经Graphpad Prism9软件统计数据,并进行差异分析。多组数据采用单因素方差分析差异,且当P<0.05认定为有统计学差异,并制图。
2. 结果与分析
2.1 柑橘皮PMFs提取物的抑菌效果
2.1.1 牛津杯法测定抑菌圈直径
利用牛津杯法检测柑橘皮PMFs提取物的抑菌效应,测定抑菌圈直径,记录数据,见表1。结果所示,0.5和1.0 mg/mL柑橘皮PMFs对7种菌都具有抑制效应,以灰葡萄孢菌为例,0.5 mg/mL柑橘皮PMFs作用后,产生的抑菌圈直径为9.75±0.88 mm,与阳性对照作用后产生的抑菌圈(直径为11.49±0.97 mm)相比,较弱,具有统计学差异(P<0.05),但1.0 mg/mL柑橘皮PMFs作用后,产生的抑菌圈直径为10.67±1.02 mm,与阳性对照相比,无统计学差异。柑橘皮PMFs对7种菌的抑制作用,强弱依次为青霉菌>灰葡萄孢菌>金黄色葡萄球菌>大肠杆菌>蜡样芽孢杆菌>枯草芽孢杆菌>铜绿假单胞杆菌,且呈浓度依赖性。橘黄酮已被证实可抑制金黄色葡萄球菌、大肠杆菌和黑曲霉菌等的生长[18],PMFs为存在于橘总黄酮中的多甲氧基黄酮成分,其中包含的川陈皮素和橘皮素等也已被证实具有抑菌作用[19-20],是柑橘皮PMFs产生抑菌效应的重要成分。
表 1 牛津杯法测定柑橘皮PMFs提取物的抑菌效果Table 1. The antibacterial effects of PMFs extract from Citrus peels determined by Oxford cup method测试菌 抑菌圈直径(mm) PMFs
(0.5 mg/mL)PMFs
(1.0 mg/mL)阳性对照
(0.5 mg/mL)生理盐水 大肠杆菌 8.99±1.02* 10.04±0.67 10.83±1.14 - 金黄色葡萄球菌 9.35±0.57* 10.24±1.27 10.71±2.10 - 蜡样芽胞杆菌 9.18±1.53* 12.21±1.29 12.86±1.34 - 枯草芽孢杆菌 8.51±1.03* 9.46±0.97 9.94±1.86 - 铜绿假单胞杆菌 8.72±1.25* 9.28±1.43 9.49±1.13 - 灰葡萄孢菌 9.75±0.88* 10.67±1.02 11.49±0.97 - 青霉菌 9.93±1.11* 11.24±1.35 13.25±1.59 - 注:“-”代表无抑菌圈产生;*代表对同一种菌的抑制作用与阳性对照相比,有统计学差异,P<0.05。 2.1.2 最小抑菌浓度(MIC)测定
不同浓度梯度的柑橘皮PMFs与7种测试菌共同培养,测定OD值,结果见表2。如表所示,灰葡萄孢菌、青霉菌、大肠杆菌和金黄色葡萄球菌的MIC为0.0625 mg/mL,蜡样芽孢杆菌和枯草芽孢杆菌的MIC为0.125 mg/mL,铜绿假单胞杆菌的MIC为0.25 mg/mL。由此可见,柑橘皮PMFs对灰葡萄孢菌、青霉菌、大肠杆菌和金黄色葡萄球菌的抑制作用最强,对蜡样芽胞杆菌和枯草芽孢杆菌的抑制作用次之,而对铜绿假单胞杆菌的抑制作用最弱。李煜等[21]证实了红豆越橘中总黄酮对大肠杆菌、枯草芽孢杆菌和白色葡萄球菌具有明显的抑制作用,对大肠杆菌和枯草芽孢杆菌的MIC均为2.5 mg/mL,大于本文的0.0625 mg/mL和0.125 mg/mL,因其研究对象为总黄酮,而本文为PMFs,PMFs含有多个甲氧基,其生物活性更强。另外所对应柑橘种类不一样,可能也导致抑菌效应的差异。
表 2 柑橘皮PMFs提取物的MICTable 2. The MIC of PMFs extract from Citrus peels测试菌 柑橘皮PMFs浓度(mg/mL) 2.0 1.0 0.5 0.25 0.125 0.0625 大肠杆菌 - - - - - + 金黄色葡萄球菌 - - - - - + 蜡样芽胞杆菌 - - - - + ++ 枯草芽孢杆菌 - - - - + +++ 铜绿假单胞杆菌 - - - + ++ +++ 灰葡萄孢菌 - - - - - + 青霉菌 - - - - - + 注:“-”代表无菌生长;“+”代表有菌生长,并呈正相关。 2.2 柑橘皮PMFs提取物对红提葡萄贮藏品质的影响
2.2.1 不同浓度柑橘皮PMFs提取物对红提葡萄可溶性固形物和VC含量的影响
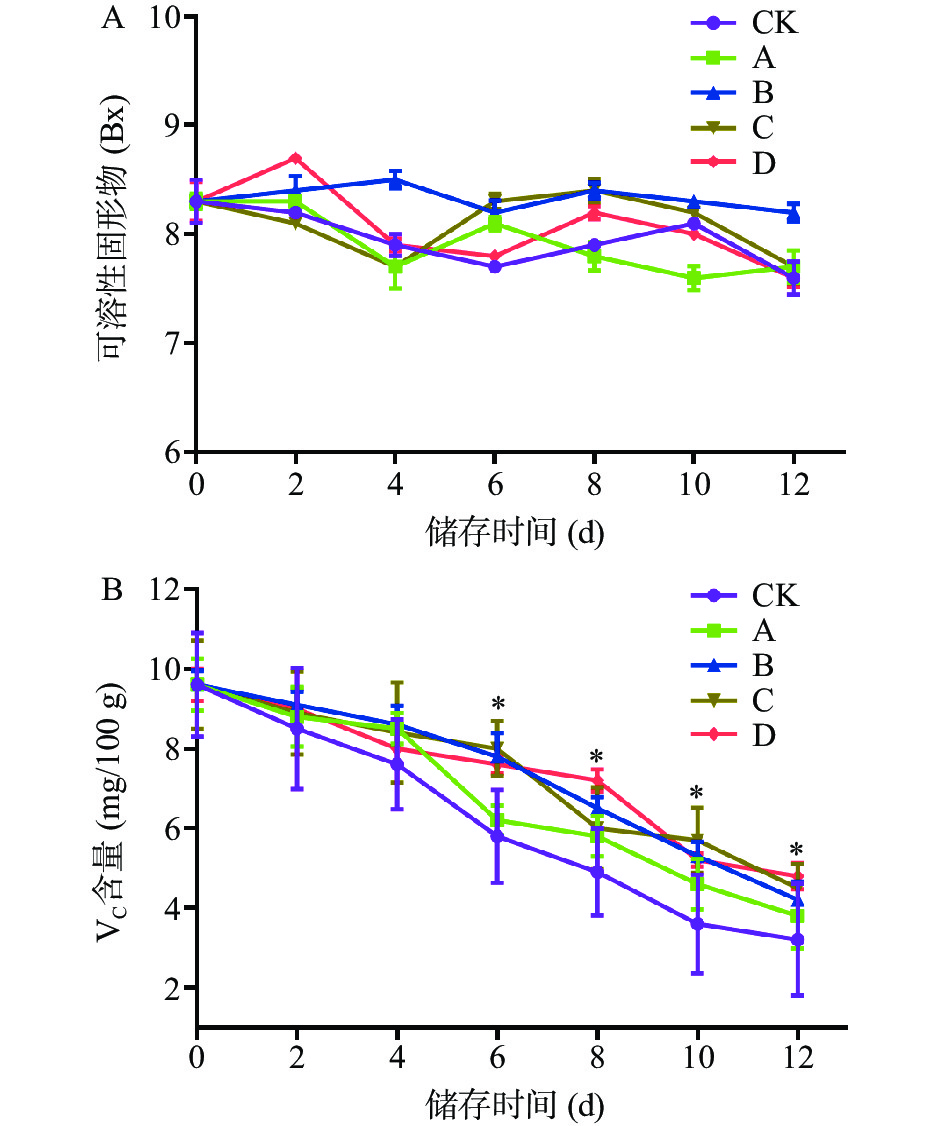
可溶性固形物(Soluble solid)是指果蔬中能溶于水的糖、矿物质等可溶性物质的含量,是影响果实风味的重要因素之一,同时也可直接反映果蔬的成熟程度和品质状况[22]。由图1A可知,经4.0 mg/mL柑橘皮PMFs提取物处理8 d后红提中可溶性固形物含量为8.64 Bx,高于CK组(为7.85 Bx),但无统计学差异,且随着贮藏时间的延长,红提葡萄可溶性固形物含量总体变化平缓,其他各组之间差异不明显,含量均在7.6~8.3 Bx之间。
VC含量是果蔬中重要营养物质之一,且随着贮藏时间的延长,果实中VC的含量会逐渐减少[23]。由图1B可知,CK、A组在第4 d时VC含量急速下降,分别为7.43 mg/100 g和8.61 mg/100 g,这可能是由于红提的自身氧化分解而造成的;但A组比CK组VC含量下降缓慢,说明柑橘皮PMFS提取物对A组中红提葡萄的VC含量有一定的影响;B、C、D组VC含量在贮藏期间均有缓慢下降的趋势,这可能是由于有保鲜剂的保护,不至于在短期间出现VC的迅速消耗。贮藏第12 d时,CK组VC含量为3.26 mg/100 g,损失量为67.59%;B、C、D组在第12 d时分别为4.25、4.33、4.49 mg/100 g,保鲜效果比较相近,损失量在55%左右,与CK组相比,VC含量下降较为缓慢,损失量小,具有统计学意义(P<0.05)。以上结果说明柑橘皮PMFs提取物对红提葡萄中的可溶性固形物和VC含量均有较好的保持效应。
2.2.2 不同浓度柑橘皮PMFs提取物对红提葡萄腐烂率、落粒率和硬度的影响
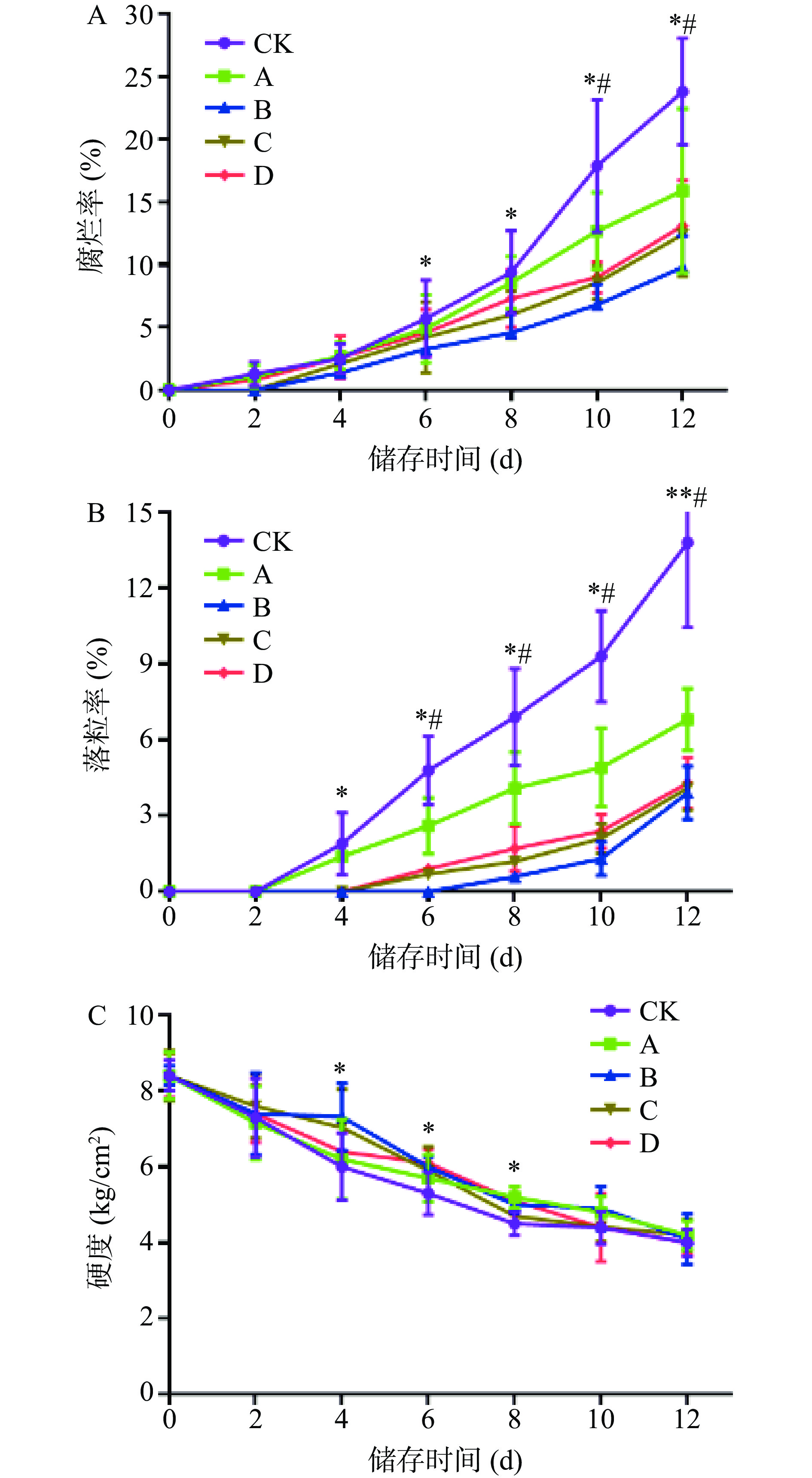
果实的腐烂主要由于细菌、真菌感染而引起,腐烂率越低,保鲜效果越好,贮藏时间也较长[24]。由图2A可以看出,随着贮藏时间的增加,红提腐烂率呈上升趋势。总体来看,用柑橘皮PMFs提取物处理的红提腐烂率的上升趋势低于CK组,其中经4.0 mg/mL处理的红提腐烂率上升趋势最低,对红提腐烂率抑制效果最好,其次为浓度6.0 mg/mL的柑橘皮PMFs提取物。以贮藏12 d时为例,CK组腐烂率为23.64%,与CK组相比,A组腐烂率下降了6.42%,B组下降13.47%,C组下降11.19%,D组下降10.34%,B、C和D组与CK组相比具有统计学差异(P<0.05),以上数据综合表明4 mg/mL柑橘皮PMFs提取物缓解红提腐烂效果最佳。
由于葡萄果梗与果粒连接处易受真菌侵染,且在贮藏期间该部位由于呼吸作用引起失水,造成葡萄落粒的发生[25]。由图2B可以看出,随着贮藏时间的延长,红提葡萄的落粒率呈上升趋势。总体来看,经柑橘皮PMFs提取物处理的红提各个时期的落粒率均低于CK组,且落粒率较CK组上升趋势缓慢,其中经4.0 mg/mL处理的葡萄落粒率上升的最为缓慢。当贮藏至12 d时,CK组红提落粒率达到13.82%,与CK组相比,A组落粒率减少了6.99%,B组减少了9.91%,C组减少了9.57%,D组减少了9.39%,有统计学差异(P<0.05),由此可见4.0 mg/mL柑橘皮PMFs提取物对红提落粒率抑制效果最佳。
果实的硬度影响着果实的口感和品质,与果实的成熟度和衰败程度有关,也是评价果实外观品质的重要指标之一[26]。图2C显示,随着贮藏时间的增加,红提果实硬度呈逐渐下降的趋势。总体来看,用柑橘皮PMFs提取物处理的红提果实硬度下降的趋势低于CK组,且贮藏前6 d中,CK组硬度为4.91 kg/cm2,与CK组相比,B组硬度提高19.1%,C组提高16.5%,D组提高13.2%,有统计学差异(P<0.05);当贮藏至12 d时,柑橘皮PMFs提取物处理的红提果实硬度与CK组无明显变化,因此对于前期贮藏的红提,柑橘皮PMFs提取物对果实硬度的下降具有一定的抑制效果。
以上结果揭示柑橘皮PMFs提取物处理可明显降低红提葡萄贮藏期内的脱粒率和腐烂率,这可能与其可抑制灰葡萄孢菌和青霉菌这两种红提葡萄易感染真菌的生长有关,并且还一定程度上减缓红提果实硬度下降,由此柑橘皮PMFs提取物作用后可明显提高红提葡萄的贮藏品质。
2.2.3 不同浓度柑橘皮PMFs提取物对红提葡萄可滴定酸含量和呼吸强度的影响
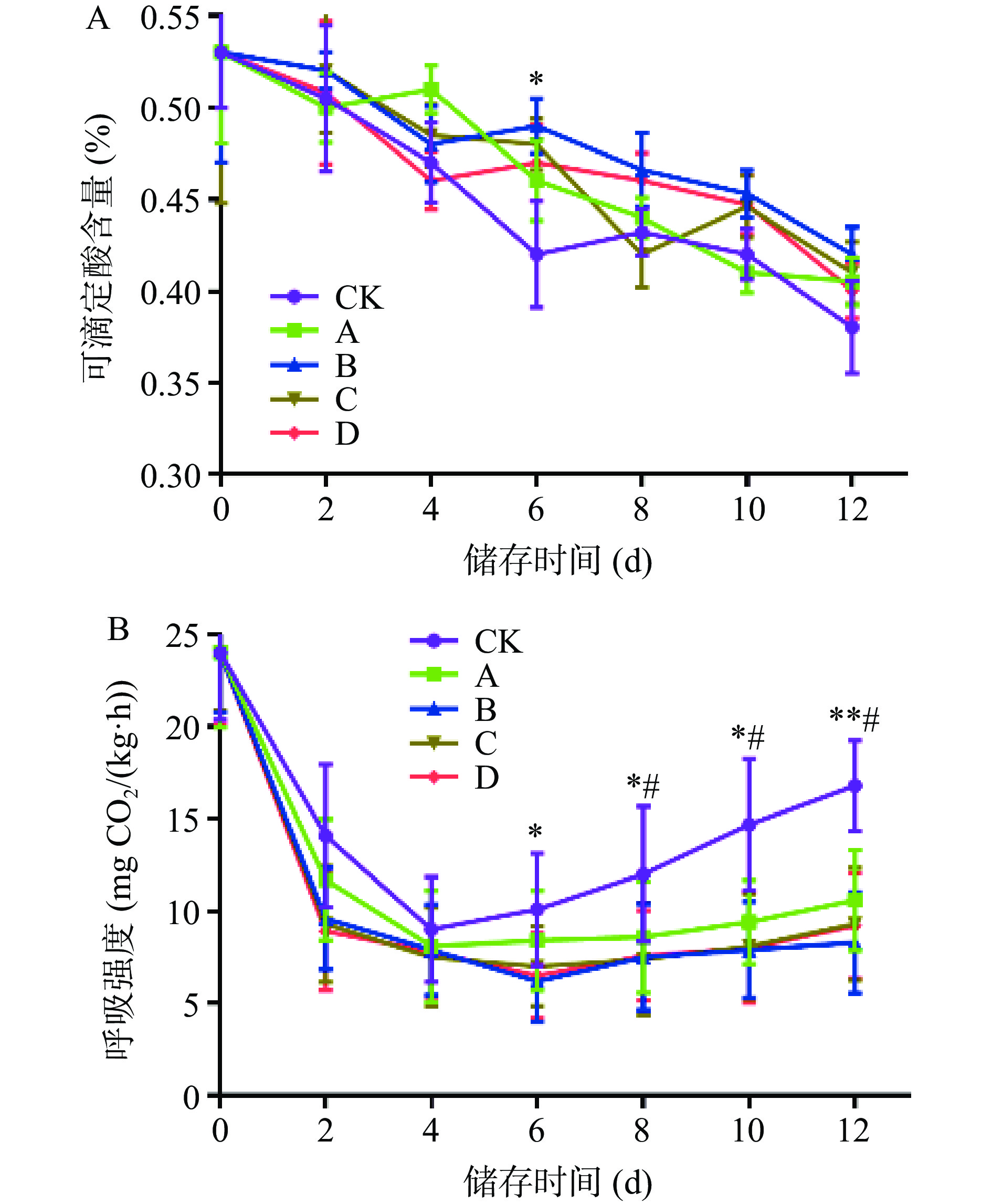
果蔬中含有苹果酸、柠檬酸、酒石酸等多种有机酸,可滴定酸(TA)含量对果蔬风味、贮藏性、加工性均有影响,且果蔬的可滴定酸含量随着果蔬的成熟度而不断变化,酸度降低,果蔬品质也会有所下降[27]。由图3A可知,随着贮藏时间的延长,红提中可滴定酸含量呈现逐渐减少的总趋势。CK组在第2 d时可滴定酸含量开始快速下降,为0.51%,A组在4 d后迅速减少,这与红提的呼吸作用有很大的关联,红提的呼吸消耗影响可滴定酸的某些成分,造成可滴定酸含量的迅速下降。B、C、D组在第4 d时下降较快,到第6 d时,三组的可滴定酸度与CK组的可滴定酸度相比,呈现统计学差异(P<0.05);自第6 d后,直至到达第12 d时,CK组的可滴定酸度为0.38%,A、B、C和D组,与CK组相比,略有波动,但无统计学差异,综合以上数据4.0 mg/mL柑橘皮PMFs提取物可以一定程度上保持红提中可滴定酸含量。
呼吸强度与果蔬贮藏期间的能量消耗密切相关,呼吸强度越高,能量消耗越大,果实衰老速率越快[28]。由图3B可以看出,随着贮藏时间的增加,红提的呼吸强度呈现先下降后上升的趋势。总体来看,用柑橘皮PMFs提取物处理过的红提呼吸强度的下降趋势高于CK组,贮藏至第4 d时,CK组达到最低值,为9.34 mg CO2/kg·h,而处理组在第6 d出现呼吸低峰,随后呼吸强度呈现上升的趋势,且用柑橘皮PMFs提取物浸泡的红提呼吸强度上升的趋势明显低于CK组。以第12 d为例,CK组红提呼吸强度为16.82 mg CO2/kg·h,与其相比,A组降低25.4%,B组降低54.5%,C组降低45.4%,D组降低45.2%,有统计学差异(P<0.05,P<0.01),可知柑橘皮PMFs提取物能有效降低果实的呼吸强度,减慢果实腐败衰老进程,且柑橘皮PMFs提取物浓度以4.0 mg/mL为宜。以上结果揭示柑橘皮PMFs提取物可有效缓解红提葡萄中可滴定酸含量下降和呼吸强度上升。
2.2.4 不同浓度柑橘皮PMFs提取物对红提葡萄中多酚氧化酶活性和丙二醛含量的影响
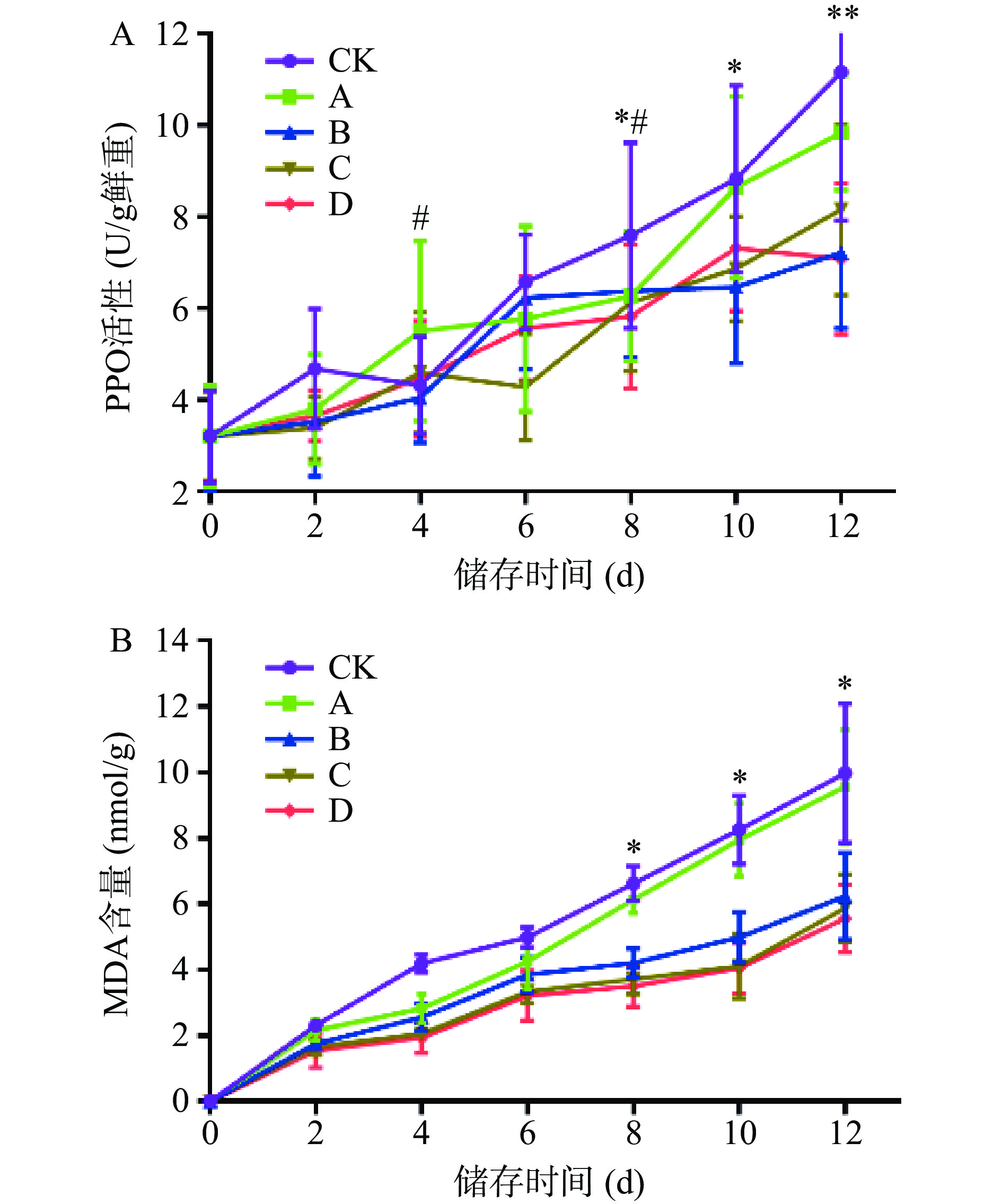
多酚氧化酶(PPO)能催化多酚类物质氧化,参与花色苷的降解,产生褐色副产物,从而引起果蔬褐变,因此测定PPO酶活性可以反映果蔬的褐变程度,评判果蔬的贮藏品质[29]。由图4A可知,随着时间的延长,红提中PPO酶活力呈现逐渐上升的总趋势。CK组在4 d后开始出现迅速上升,A组在8 d后快速上升,说明之前受到保鲜剂的抑制作用,到第8 d抑制效果降低,从而快速升高。在第8 d时,CK与B组之间已经表现出明显差别,CK组PPO酶活力为7.59 U/g鲜重,上升量为137.56%,与其相比,B组PPO酶活力下降16.1%,有统计学差异(P<0.05),而后随时间延长,B、C、D组PPO酶活性缓慢上升,可知不同浓度的柑橘皮PMFs提取物可以延缓红提果实中PPO酶活性的增加速度,从而起到保鲜效果,且浓度以4.0 mg/mL为宜。
丙二醛(MDA)可反映果实内脂质过氧化的程度,间接反映果实的损伤程度[30]。由图4B可知,随着时间的延长,红提中MDA含量呈现逐渐上升的总趋势。CK组和A组在4 d后开始出现迅速上升,其余各组上升缓慢。在第8 d时,CK组MDA含量为6.62 nmol/g,与之相比,A组无明显差异,B组下降了36.4%,C组下降了43.9%,D组下降了46.9%,有统计学差异(P<0.05),可知4.0、6.0和8.0 mg/mL柑橘皮PMFs提取物均可有效减缓随贮藏时间的延长红提葡萄的损伤程度。
3. 结论
本文探究了柑橘皮PMFs提取物的抑菌及对红提葡萄贮藏品质的作用。抑菌结果显示柑橘皮PMFs提取物对5种常见食源性细菌和2种红提葡萄易感染真菌均具有较强的抑菌作用;保鲜结果显示在贮藏期内,相对于对照组,不同浓度的柑橘皮PMFs提取物对红提葡萄果实均具有较好的保鲜效果,可以一定程度上抑制果实硬度的下降,降低果实腐烂率、落粒率,这与柑橘皮PMFs可抑制灰霉菌和青霉菌的生长密切相关,同时还可抑制VC和可滴定酸含量的降低,延缓呼吸强度、MDA和PPO的上升,但不同浓度的柑橘皮PMFs提取物对红提葡萄贮藏品质的影响并不随着浓度的增加而增强,浓度不当反而会增加果实的损耗。综合考虑4.0 mg/mL的柑橘皮PMFs提取物对红提葡萄的贮藏效果最佳。
虽然植物源防腐剂具有较强的抑菌性,但部分从植物中提取出来的混合物会呈现一定的颜色和气味,当应用于食品当中时对食品的风味和外观可能会产生一定的影响,因此关于植物源保鲜剂的关键成分、量效关系、提取工艺还需要进一步明确。而且红提葡萄采收后,果实内部仍然进行着复杂的生理生化变化,导致红提葡萄的成熟和衰老,因此还需不断研究果实内部的变化以及相应的外部变化,从而更好地调控红提葡萄的贮藏条件,为以后柑橘皮PMFs提取物用于红提葡萄的贮藏保鲜提供科学理论依据。
-
表 1 牛津杯法测定柑橘皮PMFs提取物的抑菌效果
Table 1 The antibacterial effects of PMFs extract from Citrus peels determined by Oxford cup method
测试菌 抑菌圈直径(mm) PMFs
(0.5 mg/mL)PMFs
(1.0 mg/mL)阳性对照
(0.5 mg/mL)生理盐水 大肠杆菌 8.99±1.02* 10.04±0.67 10.83±1.14 - 金黄色葡萄球菌 9.35±0.57* 10.24±1.27 10.71±2.10 - 蜡样芽胞杆菌 9.18±1.53* 12.21±1.29 12.86±1.34 - 枯草芽孢杆菌 8.51±1.03* 9.46±0.97 9.94±1.86 - 铜绿假单胞杆菌 8.72±1.25* 9.28±1.43 9.49±1.13 - 灰葡萄孢菌 9.75±0.88* 10.67±1.02 11.49±0.97 - 青霉菌 9.93±1.11* 11.24±1.35 13.25±1.59 - 注:“-”代表无抑菌圈产生;*代表对同一种菌的抑制作用与阳性对照相比,有统计学差异,P<0.05。 表 2 柑橘皮PMFs提取物的MIC
Table 2 The MIC of PMFs extract from Citrus peels
测试菌 柑橘皮PMFs浓度(mg/mL) 2.0 1.0 0.5 0.25 0.125 0.0625 大肠杆菌 - - - - - + 金黄色葡萄球菌 - - - - - + 蜡样芽胞杆菌 - - - - + ++ 枯草芽孢杆菌 - - - - + +++ 铜绿假单胞杆菌 - - - + ++ +++ 灰葡萄孢菌 - - - - - + 青霉菌 - - - - - + 注:“-”代表无菌生长;“+”代表有菌生长,并呈正相关。 -
[1] 叶林林. 复合发酵红提葡萄酒工艺优化及其香气的研究[D]. 杭州: 浙江农林大学, 2019. YE L L. Research on complex fermentation process of red globe grape wine and analysis of aroma components[D]. Hangzhou: Zhejiang Agriculture and Forestry University, 2019.
[2] 吕明珠, 于爽, 朱恩俊. 肉桂精油对红提葡萄保鲜效果的影响[J]. 食品科学,2016,37(6):272−277. [LYU M Z, YU S ZHU E J. Efficacy of cinnamon essential oil for preservation of red globe table grapes[J]. Food Science,2016,37(6):272−277. doi: 10.7506/spkx1002-6630-201606049 LYU M Z, YU S ZHU E J. Efficacy of cinnamon essential oil for preservation of red globe table grapes[J]. Food Science, 2016, 37(6): 272-277. doi: 10.7506/spkx1002-6630-201606049
[3] 张晓虎, 李倩, 魏夏夏. 连翘果实多酚提取及其复合涂膜保鲜剂在葡萄保鲜中的应用[J]. 中国农学通报,2020,36(4):135−141. [ZHANG X H, LI Q, WEI X X. Polyphenol extration from Forsythia suspensa fruit and application of compound coating preservative in grape freshness preservation[J]. Chinese Agricultural Science Bulletin,2020,36(4):135−141. doi: 10.11924/j.issn.1000-6850.casb18100113 ZHANG X H, LI Q, WEI X X. Polyphenol extration from Forsythia suspensa fruit and application of compound coating preservative in grape freshness preservation[J]. Chinese Agricultural Science Bulletin, 2020, 36(4): 135-141. doi: 10.11924/j.issn.1000-6850.casb18100113
[4] SHAKOUR Z T A, FAYEK N M, FARAG M A. How do biocatalysis and biotransformation affect Citrus dietary flavonoids chemistry and bioactivity? A review[J]. Crit Rev Biotechnol,2020,40(5):689−714. doi: 10.1080/07388551.2020.1753648
[5] 郎宇曦, 马岩, 李斌, 等. 黄酮类化合物与其他化合物相互作用的研究进展[J]. 食品科学,2018,39(9):258−264. [LANG Y X, MA Y, LI B, et al. Advances in understanding the interaction between flavonoids and other compounds[J]. Food Science,2018,39(9):258−264. doi: 10.7506/spkx1002-6630-201809039 LANG Y X, MA Y , LI B , et al. Advances in understanding the interaction between flavonoids and other compounds[J]. Food Science, 2018, 39(9): 258-264. doi: 10.7506/spkx1002-6630-201809039
[6] CHOI B K, KIM T W, LEE D R, et al. A polymethoxy flavonoids-rich Citrus aurantium extract ameliorates ethanol-induced liver injury through modulation of AMPK and Nrf2-related signals in a binge drinking mouse model[J]. Phytother Research:PTR,2015,29(10):1577−1584. doi: 10.1002/ptr.5415
[7] NAIR S A, SR R K, NAIR A S, ET AL. Citrus peels prevent cancer[J]. Phytomedicine:International Journal of Phytotherapy and Phytopharmacology,2018,50:231−237. doi: 10.1016/j.phymed.2017.08.011
[8] FATIMA A, RAHUL, SIDDIQUE Y H. Role of tangeritin against cognitive impairments in transgenic Drosophila model of Parkinson's disease[J]. Neurosci Letters,2019,705:112−117. doi: 10.1016/j.neulet.2019.04.047
[9] FARHADI F, KHAMENEH B, IRANSHAHI M, et al. Antibacterial activity of flavonoids and their structure-activity relationship: An update review[J]. Phytother Research:PTR,2019,33(1):13−40. doi: 10.1002/ptr.6208
[10] XIE Y, YANG W, TANG F, et al. Antibacterial activities of flavonoids: Structure-activity relationship and mechanism[J]. Current Medical Chemistry,2015,22(1):132−149.
[11] DUAN L, DOU L L, YU K Y, et al. Polymethoxyflavones in peel of Citrus reticulata 'Chachi' and their biological activities[J]. Food Chemistry,2017,1(234):254−261.
[12] CIMAGLIA P, VIECELI F, VITALI F, et al. Effectiveness of a novel nutraceutical compound containing red yeast rice, polymethoxyflavones and antioxidants in the modulation of cholesterol levels in subjects with hypercholesterolemia and low-moderate cardiovascular risk: The nirvana study[J]. Front Physiology,2019,11(10):217−317.
[13] UCKOO R M, JAYAPRAKASHA G K, VIKRAM A, et al. Polymethoxyflavones isolated from the peel of Miaray Mandarin (Citrus miaray) have biofilm inhibitory activity in Vibrio harveyi[J]. J Agric Food Chem,2015,63(32):7180−7189. doi: 10.1021/acs.jafc.5b02445
[14] 姚晓琳, 潘思轶, 张晓维, 等. 多甲氧基黄酮提取物对冷却肉保鲜效果的影响[J]. 食品科学,2009,30(24):460−463. [YAO X L, PAN S Y, ZHANG X W, et al. Preservation of chilled meat coated with polymethoxyl flavonoid extract[J]. Food Science,2009,30(24):460−463. doi: 10.3321/j.issn:1002-6630.2009.24.106 YAO X L, PAN S Y, ZHANG X W, et al. Preservation of chilled meat coated with polymethoxyl flavonoid extract[J]. Food Science, 2009, 30(24): 460-463. doi: 10.3321/j.issn:1002-6630.2009.24.106
[15] 夏俊芳, 郑素慧, 翟少华, 等. 一株拮抗酿酒葡萄灰霉病的枯草芽孢杆菌T3筛选、鉴定及抑菌分析[J]. 食品工业科技,2020,41(23):99−105, 113. [XIA J F, ZHENG S H, ZHAI S H, et al. Screening and identification of antagonistic Bacillus subtilis T3 against wine grape gray mold and analysis of its antimicrobial activity[J]. Scince and Technology of Food Industry,2020,41(23):99−105, 113. doi: 10.13386/j.issn1002-0306.2020030200 XIA J F, ZHENG S H, ZHAI S H, et al. Screening and identification of antagonistic Bacillus subtilis T3 against wine grape gray mold and analysis of its antimicrobial activity[J]. Scince and technology of food industry, 2020, 41(23): 99-105, 113. doi: 10.13386/j.issn1002-0306.2020030200
[16] ANDREWS J M. Determination of minimum inhibitory concentrations[J]. Antimicrob Chemother, 2001, suppl 1: 5−16.
[17] 曹建康, 姜微波. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社 CAO J K, JIANG W B. Guidance of postharvest physiological and biochemical experiment of fruits and vegetables[M]. Beijing: China Light Industry Press Ltd.
[18] 赵悦, 孙庆元, 孙琦. 橘黄酮的提取及其抑菌特性[J]. 化工进展,2016,35(8):2528−2532. [ZHAO Y, SUN Q Y, SUN Q. Extraction of flavonoids from Citrus reticulate and their antimicrobial characteristics[J]. Chemical Industry and Engineering Progress,2016,35(8):2528−2532. doi: 10.16085/j.issn.1000-6613.2016.08.35 ZHAO Y, SUN Q Y, SUN Q. Extraction of flavonoids from Citrus reticulate and their antimicrobial characteristics[J]. Chemical industry and engineering progress, 2016, 35(8): 2528-2532, doi: 10.16085/j.issn.1000-6613.2016.08.35
[19] 张相飞, 杜春华, 郝双红, 等. 陈皮石油醚相中抗苹果腐烂病菌活性物质研究[J]. 湖北农业科学,2015,54(13):3150−3152, 3156. [ZHANG X F, DU C H, HAO S H, et al. Research of active material in petroleum ether extraction from tangerine peel for in vitro control of Valsa mali[J]. Hubei Agricultural Sciences,2015,54(13):3150−3152, 3156. doi: 10.14088/j.cnki.issn0439-8114.2015.13.020 ZHANG X F, DU C H, HAO S H, et al. Research of active material in petroleum ether extraction from tangerine peel for in vitro control of Valsa mali[J]. Hubei agricultural sciences, 2015, 54(13): 3150-3152, 3156. doi: 10.14088/j.cnki.issn0439-8114.2015.13.020
[20] 陈少华. 川陈皮素的提取及其复合保鲜剂应用研究[D]. 哈尔滨: 东北农业大学, 2017. CHEN S H. Research on extraction of nobiletin and compound preservative application[D]. Harbin: Northeast Agricultural University, 2017.
[21] 李煜, 韩春然, 黄赫雁, 等. 红豆越橘中总黄酮的提取剂抑菌性质研究[J]. 食品研究与开发,2017,38(13):69−74. [LI Y, HAN C R, HUANG H Y, et al. Optimuzation of extraction process of total flaonoids from Lingonberry and evaluation of its antibacterial activities[J]. Food Research and Development,2017,38(13):69−74. doi: 10.3969/j.issn.1005-6521.2017.13.015 LI Y, HAN C R, HUANG H Y et al. Optimuzation of extraction process of total flaonoids from Lingonberry and evaluation of its antibacterial activities[J]. Food research and development, 2017, 38(13): 69-74. doi: 10.3969/j.issn.1005-6521.2017.13.015
[22] LIN Y, LI N, LIN H, et al. Effects of chitosan treatment on the storability and quality properties of longan fruit during storage[J]. Food Chemistry,2020,306:125627. doi: 10.1016/j.foodchem.2019.125627
[23] MA Y, LI S, YIN X, et al. Effect of controlled atmosphere on the storage quality and aroma lemon fruits using the designed automatic control apparatus[J]. Biomed Research International,2019,2019:6917147.
[24] 张群利, 崔琳琳, 郑权, 等. 纤维素复合抗菌保鲜膜包覆对采后蓝莓的保鲜效果[J]. 食品工业科技,2019,40(19):261−265. [ZHANG Q L, CUI L L, ZHENG Q, et al. Fresh-keeping effect of cellulose composite antibacterial preservative film on postharvest blueberry[J]. Scince and Technology of Food Industry,2019,40(19):261−265. doi: 10.13386/j.issn1002-0306.2019.19.045 ZHANG Q L, CUI L L, ZHENG Q, et al. Fresh-keeping effect of cellulose composite antibacterial preservative film on postharvest blueberry[J]. Scince and Technology of Food Industry, 2019, 40(19): 261-265. doi: 10.13386/j.issn1002-0306.2019.19.045
[25] 邓冰, 韩云云, 张玉凤, 等. 1-MCP结合CT复合保鲜剂对木纳格葡萄保鲜效果的研究[J]. 保鲜与加工,2018,18(1):8−13. [DENG B, HAN Y Y, ZHANG Y F, et al. Effect of 1-MCP fumigation combined with CT compound preservatives on stage of Munake grape[J]. Storage & Process,2018,18(1):8−13. doi: 10.3969/j.issn.1009-6221.2018.01.002 DENG B, HAN Y Y, ZHANG Y F, et al. Effect of 1-MCP fumigation combined with CT compound preservatives on stage of Munake grape[J]. Storage & process, 2018, 18(1): 8-13. doi: 10.3969/j.issn.1009-6221.2018.01.002
[26] FRANCESCA P, SANDRA P, MARIA L A, et al. Effect of harvest time on table grape quality during on-vine storage[J]. Journal of the Science of Food and Agriculture,2016,96(1):131−139. doi: 10.1002/jsfa.7072
[27] KHALIQ G, RAMZAN M, BALOCH A H. Effect of Aloe vera gel coating enriched with Fagonia indica plant extract on physicochemical and antioxidant activity of sapodilla fruit during postharvest storage[J]. Food Chemistry,2019,286:346−353. doi: 10.1016/j.foodchem.2019.01.135
[28] GE Y, CHEN Y, LI C, et al. Effect of trisodium phosphate dipping treatment on the quality and energy metabolism of apples[J]. Food Chemistry,2019,274:324−329. doi: 10.1016/j.foodchem.2018.08.142
[29] JING G, HUANG H, YANG B, et al. Effect of pyrogallol on the physiology and biochemistry of litchi fruit during storage[J]. Chemistry Central Journal,2013,7(1):19−30. doi: 10.1186/1752-153X-7-19
[30] 张莉会, 李志航, 廖李, 等. 不同保鲜剂对蓝莓保鲜效果的比较[J]. 现代食品科技,2020,36(11):121−129. [ZHANG L H, LI Z H, LIAO L, et al. Comparison of preservation effects of different preservatives on blueberry[J]. Modern Food Science and Technology,2020,36(11):121−129. doi: 10.13982/j.mfst.1673-9078.2020.11.0457 ZHANG L H, LI Z H, LIAO L, et al. Comparison of preservation effects of different preservatives on blueberry[J]. Modern Food Science and Technology, 2020, 36(11): 121-129. doi: 10.13982/j.mfst.1673-9078.2020.11.0457
-
期刊类型引用(5)
1. 杨亚楠,宋京城,侯萍萍. 柑橘皮渣营养成分及利用现状. 轻工科技. 2025(01): 65-67 .  百度学术
百度学术
2. 白雯钰,刘乃新,韩广源,于清涛,周芹,陈百翠,李承欣. 红甜菜根中类黄酮类差异代谢物的比较分析. 现代食品科技. 2024(04): 264-276 .  百度学术
百度学术
3. 谭雨心,渡部由香,廖明系,周熠,李清明. 柑橘皮油胞层提取物的抗氧化活性与抑菌活性. 食品与机械. 2024(09): 145-152 .  百度学术
百度学术
4. 龙蕥倩,邓雨荷,刘瑞秀,雷芳,何珺. 不同橘皮提取物对S.aureus和E.coli的抑菌活性对比研究及其抗菌机制初探. 应用化工. 2024(12): 2822-2825 .  百度学术
百度学术
5. 王健硕,吕权洲,陈泉瑛,孟宇航,李妍. 中药活性成分抗神经母细胞瘤作用机制的研究进展. 吉林医药学院学报. 2023(05): 376-379 .  百度学术
百度学术
其他类型引用(6)





 下载:
下载:
 下载:
下载:



