Effect of Starch Raw Materials on Pullulan Polysaccharide Biosynthesis and the Underlying Physiological Mechanism
-
摘要: 为了考察不同淀粉质原料对出芽短梗霉生物合成普鲁兰多糖的影响,本文分别选用来源于木薯、玉米、马铃薯、红薯和小麦等作物的淀粉作为碳源发酵生产普鲁兰多糖。结果发现,木薯淀粉有利于普鲁兰多糖的生物合成,最高产量达到23.96 g/L;红薯淀粉则不利于普鲁兰多糖的合成,显著(P<0.05)降低了普鲁兰多糖的产量和分子量。进一步地,对普鲁兰多糖分批发酵动力学参数和生理学指标进行分析比较,发现木薯淀粉提高了普鲁兰多糖合成关键酶活性和胞内前体物质尿苷二磷酸葡萄糖的含量,进而提高了普鲁兰多糖的合成能力和产量;而红薯淀粉则提高了普鲁兰多糖降解酶活性,显著(P<0.05)降低了普鲁兰多糖的分子量。对普鲁兰多糖分批发酵碳源成本进行估算,发现利用木薯淀粉合成普鲁兰多糖的碳源成本只有葡萄糖对照组的56.6%。该研究结果为普鲁兰多糖的廉价高效生产提供了可行的技术参考。Abstract: In order to investigate the effect of different starch raw materials on pullulan biosynthesis by Aureobasidium pullulans, the starch derived from such crops as cassava, corn, potato, sweet potato and wheat was separately used as carbon source for fermentative production of pullulan polysaccharide. The results showed that cassava starch was beneficial to the biosynthesis of pullulan polysaccharide, and the maximum pullulan yield of 23.96 g/L was obtained. Sweet potato starch was not conducive to the biosynthesis of pullulan polysaccharide, and significantly (P<0.05) reduced the yield and molecular weight of pullulan polysaccharide. Moreover, the analysis and comparison of kinetic parameters and physiological indicators involved in batch fermentation of pullulan polysaccharide was carried out. It was found that cassava starch increased the activities of key enzymes for pullulan polysaccharide biosynthesis and intracellular contents of precursor glucose uridine diphosphate, thereby improved the cell biosynthesis capacity and yield of pullulan polysaccharide. However, sweet potato starch increased the activities of pullulan-degrading enzymes and significantly (P<0.05) decreased the molecular weight of pullulan polysaccharide. The cost of carbon source for batch fermentation of pullulan polysaccharide was evaluated. The results showed that the cost of carbon source for the biosynthesis of pullulan polysaccharide from cassava starch was only 56.6% of that from glucose control group. The results presented in this study would provide one feasible technical reference for the cheap and efficient production of pullulan polysaccharide.
-
普鲁兰多糖是一种由出芽短梗霉(Aureobasidium pullulans)好氧发酵合成并分泌至胞外的水溶性微生物多糖[1-2]。普鲁兰多糖无毒无害,具有良好的可食性和被膜性,可用于食品工业中。2006年5月19日,中国国家卫生部发布第8号公告,新增普鲁兰多糖为食品添加剂[3]。此外,普鲁兰多糖也已经广泛应用于轻工、医药、环保和化妆品等诸多领域,且市场需求量日益增长。
在普鲁兰多糖生物合成过程中,出芽短梗霉利用葡萄糖等简单糖类物质,经α-磷酸葡萄糖异构酶(α-phosphoglucose mutase,PGM)和尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGP)催化合成前体物质尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG),再经葡萄糖基转移酶(glucosyltransferase,GTF)作用聚合成普鲁兰多糖[4-5]。如今,限制普鲁兰多糖广泛应用的主要原因是其居高不下的生产成本,其中昂贵的糖类物质占据了较大的比例[6]。为此,有必要选用廉价的原料(如淀粉)进行发酵生产,从而有效降低普鲁兰多糖的生产成本。
我国是淀粉质原料生产大国,既有粮食类淀粉质原料如马铃薯、红薯、玉米、小麦等,也有非粮类淀粉质原料如木薯,这些淀粉质原料具有来源广、价格低等优势[7],可以用于苹果酸[8]、乙醇[9]、氢气[10]等生物基产品的发酵生产中。已有研究表明,淀粉质原料也可以用于普鲁兰多糖的生物合成。An等[11]使用马铃薯淀粉和蔗糖混合糖液发酵生产普鲁兰多糖,在获得54.57 g/L多糖产量的同时还缩短了发酵时间;Wu等[12]利用红薯淀粉发酵生产普鲁兰多糖,多糖最大产量为29.43 g/L,且分子量明显高于利用蔗糖和葡萄糖而获得的多糖。除此之外,鲜见其他淀粉质原料替代蔗糖或葡萄糖合成普鲁兰多糖的相关研究,而淀粉质原料影响普鲁兰多糖生物合成的生理机制更是未见报道。
为此,本文研究不同淀粉质原料在普鲁兰多糖生物合成中的作用,重点从发酵动力学、关键酶活性、中间代谢物水平等角度对淀粉质原料影响普鲁兰多糖产量和分子量的生理机制进行解析,研究结果将为普鲁兰多糖的廉价高效生产提供可行的技术参考。
1. 材料与方法
1.1 材料与仪器
出芽短梗霉(A. pullulans ATCC 201253) −70 ℃超低温冰箱中保藏;木薯淀粉、玉米淀粉、马铃薯淀粉、红薯淀粉和小麦淀粉(淀粉含量均不低于99%),葡萄糖、酵母粉 生工生物工程(上海)股份有限公司;硫酸镁、硫酸铵、磷酸氢二钾、氯化钠 国药集团化学试剂有限公司;PGM、UGP、GTF酶活测定试剂盒 上海凡科维生物科技有限公司;种子培养基:20%(w/v)新鲜土豆汁,葡萄糖20 g/L,自然pH;发酵培养基:葡萄糖50 g/L,硫酸铵0.6 g/L,酵母粉3 g/L,磷酸氢二钾5 g/L,氯化钠1 g/L,硫酸镁0.2 g/L,pH6.5。
BIOTECH-5BGZ发酵罐 上海保兴生物设备工程有限公司;HZ-2010K恒温摇瓶柜 太仓市华利达实验仪器设备有限公司;LD5-2A离心机 北京京立离心机有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;Waters 1525高效液相色谱仪 美国Waters公司;LDZX-50KB灭菌锅 上海申安医疗器械厂。
1.2 实验方法
1.2.1 种子培养
将保藏的1 mL菌种活化后接种至装有50 mL种子培养基中的三角瓶中,在30 ℃和200 r/min的摇床中培养24 h制备种子。
1.2.2 摇瓶发酵
按10%(v/v)的接种量,将种子接种至装有50 mL发酵培养基的三角瓶中,于30 ℃和200 r/min摇床中培养72 h。
1.2.3 分批发酵
按10%(v/v)的接种量,将种子接种至装有3 L发酵培养基的发酵罐中,在30 ℃、400 r/min和通气量3 L/min条件下进行分批发酵。在不同培养时间定时取样,样品经处理后检测细胞生长、普鲁兰多糖合成情况。
1.2.4 普鲁兰多糖合成能力测定
取5 mL发酵液,12000 r/min离心10 min,所得湿细胞重新悬浮于5 mL转化液(5 g/L葡萄糖,0.2 g/L MgSO4,pH6.5)中,于30 ℃、200 r/min摇床中转化3.5 h,检测普鲁兰多糖含量,计算细胞的普鲁兰多糖合成能力[13]。
1.2.5 普鲁兰多糖降解酶活性测定
取5 mL发酵液,4 ℃、12000 r/min离心10 min,取上清液与普鲁兰多糖标准品混合,于50 ℃下反应3 h,测定反应前后上清液中还原糖的增加量。一个单位普鲁兰多糖降解酶活性定义为每分钟释放1 μmol葡萄糖的当量[14]。
1.2.6 普鲁兰多糖合成关键酶活性测定
PGM、UGP、GTF酶活采用试剂盒进行测定,操作方法和步骤参照说明书执行。
1.2.7 细胞干重、普鲁兰多糖产量和分子量测定
取20 mL发酵液,12000 r/min离心20 min,细胞沉淀用蒸馏水洗涤3次后在70 ℃烘干至恒重;上清液中加入2倍体积无水乙醇,4 ℃静置处理12 h,12000 r/min离心10 min,将沉淀于70 ℃烘干至恒重;细胞干重和普鲁兰多糖产量计算方法参见文献[15]。普鲁兰多糖分子量的测定采用黏度法[16]。将10 mL稀释后的普鲁兰多糖水溶液与5 mL硫酸钠溶液(0.15 mol/L)转移至乌氏粘度计,30 ℃下充分混匀,用秒表记录普鲁兰多糖溶液在毛细管内的流动时间,计算普鲁兰多糖的分子量。
1.2.8 胞内UDPG测定
胞内UDPG含量测定采用高效液相色谱(HPLC)法。色谱柱为Supelcosil LC-18-DB(4.6×250 mm,Sigma-Aldrich公司),流动相为40 mmol/L三乙胺-乙酸缓冲溶液(pH6.0),流速1 mL/min,检测波长254 nm,柱温25 ℃[17]。
1.3 数据处理
所有摇瓶实验数据均为3组独立样品的平均值,所有分批发酵实验数据均为两次检测结果的平均值。采用SPSS软件对数据进行统计,数据的可信度采用t-检验进行分析,当P<0.05时认为有显著影响。
2. 结果与分析
2.1 不同淀粉质原料对普鲁兰多糖生物合成的影响
分别以来源于木薯、玉米、马铃薯、红薯和小麦的淀粉代替葡萄糖作为碳源,考察摇瓶条件下不同淀粉质原料在出芽短梗霉生物合成普鲁兰多糖中的作用,结果如表1所示。可以看出,各种淀粉均可用于细胞生长和普鲁兰多糖合成,其中利用红薯淀粉时获得最大细胞干重,而利用木薯淀粉获得最大普鲁兰多糖产量。与利用葡萄糖的对照组相比,出芽短梗霉细胞利用各种淀粉合成普鲁兰多糖的分子量均明显下降,其中利用红薯淀粉合成普鲁兰多糖的分子量只有对照组的37.2%。
表 1 不同淀粉质原料对普鲁兰多糖生物合成的影响Table 1. Effect of different starch raw materials on pullulan biosynthesis碳源 细胞干重
(g/L)普鲁兰多糖产量
(g/L)普鲁兰多糖分子量
(×106 Da)木薯淀粉 10.76±0.39b 22.11±0.72a 1.02±0.07c 玉米淀粉 10.56±0.37b 21.44±0.62a 1.22±0.05b 马铃薯淀粉 9.86±0.25c 18.64±0.32c 1.18±0.09b 红薯淀粉 13.48±0.32a 12.96±0.37d 0.54±0.03d 小麦淀粉 10.28±0.56b 19.28±0.44c 1.09±0.06c 葡萄糖 9.22±0.28d 20.58±0.56b 1.45±0.09a 注:同列中不同小写字母代表差异显著(P<0.05);字母相同代表差异不显著(P>0.05)。 2.2 普鲁兰多糖分批发酵过程与分析
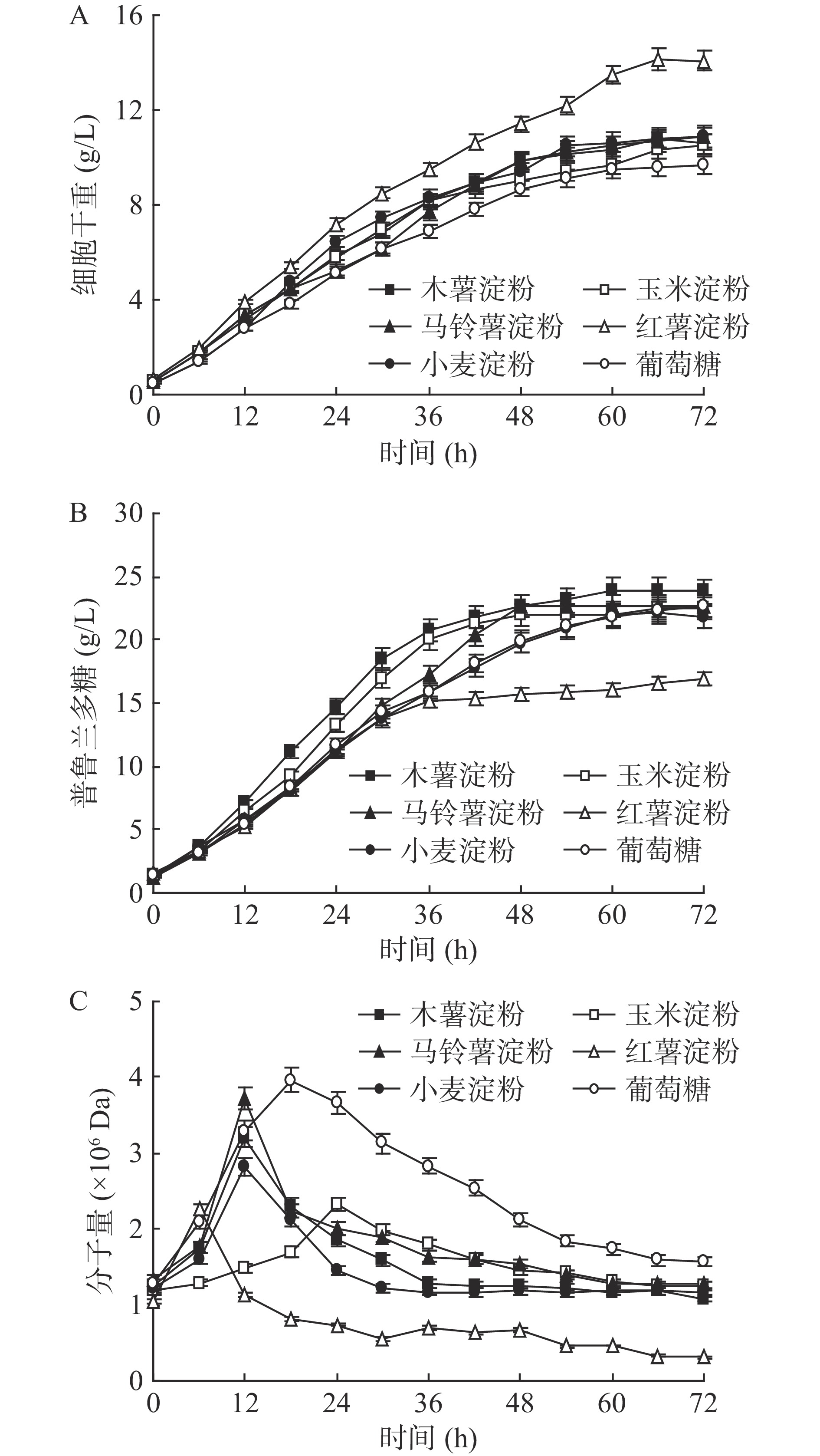
在发酵罐中对出芽短梗霉进行培养,细胞利用不同淀粉质原料合成普鲁兰多糖的分批发酵过程如图1所示,各分批发酵过程参数比较总结于表2。出芽短梗霉利用各种淀粉和葡萄糖时具有类似的生长规律,但在利用红薯淀粉时细胞干重明显增加,最大值(14.14 g/L)比葡萄糖对照组高出46.3%。然而,细胞利用红薯淀粉合成的普鲁兰多糖产量最低(16.85 g/L),比对照组低25.4%。利用木薯淀粉合成普鲁兰多糖的产量最高(23.96 g/L),而利用其他淀粉合成的普鲁兰多糖产量与对照组相比没有明显差异。此外,利用淀粉质原料时,普鲁兰多糖的最高分子量和最终分子量均显著低于对照组,特别地,利用红薯淀粉合成的普鲁兰多糖分子量最小,只有0.33×106 Da。
表 2 利用不同淀粉质原料合成普鲁兰多糖的分批发酵过程参数比较Table 2. Comparison of kinetic parameters involved in batch pullulan polysaccharide production using different starch raw materials过程参数 木薯淀粉 玉米淀粉 马铃薯淀粉 红薯淀粉 小麦淀粉 葡萄糖 最大细胞干重(g/L) 10.77±0.26b 10.53±0.25b 10.87±0.42b 14.14±0.29a 10.81±0.35b 9.66±0.27c 最大普鲁兰多糖产量(g/L) 23.96±0.36a 22.55±0.39b 22.72±0.54b 16.85±0.42c 22.15±0.45b 22.59±0.27b 普鲁兰多糖最大分子量(×106 Da) 3.21±0.13b 2.33±0.15c 3.27±0.17b 2.25±0.48c 2.82±0.36b 3.96±0.28a 普鲁兰多糖最终分子量(×106 Da) 1.19±0.17b 1.25±0.23b 1.27±0.12b 0.33±0.03c 1.19±0.13b 1.59±0.19a 平均比细胞生长速率(h−1) 0.042±0.001b 0.039±0.001b 0.038±0.002b 0.044±0.001a 0.041±0.002b 0.040±0.001b 平均比普鲁兰多糖合成速率(h−1) 0.106±0.001a 0.086±0.001c 0.092±0.002b 0.056±0.001d 0.086±0.001c 0.085±0.001c 细胞得率(g/g) 0.22±0.01b 0.21±0.01b 0.22±0.01b 0.28±0.01a 0.22±0.01b 0.19±0.01b 普鲁兰多糖得率(g/g) 0.48±0.01a 0.45±0.01b 0.45±0.02b 0.34±0.01c 0.44±0.01b 0.45±0.01b 细胞生长效率(g/L·h) 0.16±0.01b 0.15±0.01b 0.15±0.01b 0.21±0.01a 0.16±0.01b 0.13±0.01c 普鲁兰多糖合成效率(g/L·h) 0.40±0.01a 0.33±0.01c 0.38±0.02b 0.22±0.01e 0.33±0.01c 0.30±0.01d 注:同行中不同小写字母代表差异显著(P<0.05);字母相同代表差异不显著(P>0.05)。 结合表2中的普鲁兰多糖分批发酵动力学参数可以看出,出芽短梗霉在利用红薯淀粉时,平均比细胞生长速率最高,显示出较强的生长能力。与此同时,细胞在利用木薯淀粉时,平均比普鲁兰多糖合成速率最高,体现出较强的普鲁兰多糖合成能力;然而,细胞在利用红薯淀粉时,平均比普鲁兰多糖合成速率最低,最终普鲁兰多糖产量最低。综上,红薯淀粉虽然有利于细胞生长,但不利于普鲁兰多糖的合成,而木薯淀粉最有利于普鲁兰多糖合成。因此,不同淀粉质原料对出芽短梗霉细胞生长和普鲁兰多糖合成的影响具有显著差异,以下将从生理机制的角度对这些差异产生的原因进行解释。
2.3 淀粉质原料影响普鲁兰多糖生物合成的生理机制
2.3.1 普鲁兰多糖合成能力和降解酶活性
出芽短梗霉细胞合成普鲁兰多糖的能力与普鲁兰多糖的合成速率和产量高低正相关[18],而普鲁兰多糖降解酶活性决定着普鲁兰多糖分子量的大小,降解酶活性越高,则普鲁兰多糖分子量越低[19-20]。为此,检测了不同培养阶段细胞利用各种淀粉时的普鲁兰多糖合成能力和普鲁兰多糖降解酶活性,结果如图2所示。可以发现,在发酵前期(18 h),细胞利用木薯淀粉、玉米淀粉和马铃薯淀粉合成普鲁兰多糖的能力明显较强;在发酵中期(36 h),细胞利用各种碳源合成普鲁兰多糖的能力均在22 mg/g/h左右,但在利用红薯淀粉时,普鲁兰多糖的合成能力显著下降,最终普鲁兰多糖的产量最低(表2)。与此同时,在发酵的中后期(36和60 h),普鲁兰多糖降解酶活性在细胞利用红薯淀粉时显著高于其他淀粉(P<0.05),导致合成的普鲁兰多糖分子量最低;而细胞在利用葡萄糖时,普鲁兰多糖降解酶活性处于最低水平,最终合成的普鲁兰多糖分子量则最高。张高川等[21]在采用转录组测序分析氯化钠对普鲁兰多糖生物合成的影响时,发现部分多糖水解酶基因表达水平上调与普鲁兰多糖分子量下降具有相关性,这也从侧面为本文中红薯不利于维持普鲁兰多糖分子量提供了理论依据。
2.3.2 普鲁兰多糖合成关键酶活性
研究表明,出芽短梗霉细胞合成普鲁兰多糖能力的大小与普鲁兰多糖生物合成途径中的3个关键酶PGM、UGP和GTF密切相关[22-24]。为此,分别测定了不同发酵阶段的关键酶活性,结果如图3所示。从不同发酵时间来看,细胞在发酵前期(18 h)利用不同底物时的PGM和UGP活性均高于发酵中期(36 h)时的水平,但GTF在这两个阶段的活性差异不大;从不同底物来看,细胞在18 h利用木薯淀粉时的PGM和UGP活性显著高于其他底物,而在36 h利用红薯淀粉时的PGM、UGP和GTF活性显著低于其他底物(P<0.05)。因此,细胞利用木薯淀粉有利于提高普鲁兰多糖合成关键酶活性,进而提高普鲁兰多糖合成能力,促进普鲁兰多糖生产;同时,细胞在利用红薯淀粉时,3个关键酶活性均处于较低水平,降低了普鲁兰多糖生物合成能力,最终普鲁兰多糖产量显著下降。图3中不同底物条件下的普鲁兰多糖合成关键酶活性大小与图2A中普鲁兰多糖合成能力变化趋势基本一致。
2.3.3 胞内UDPG含量
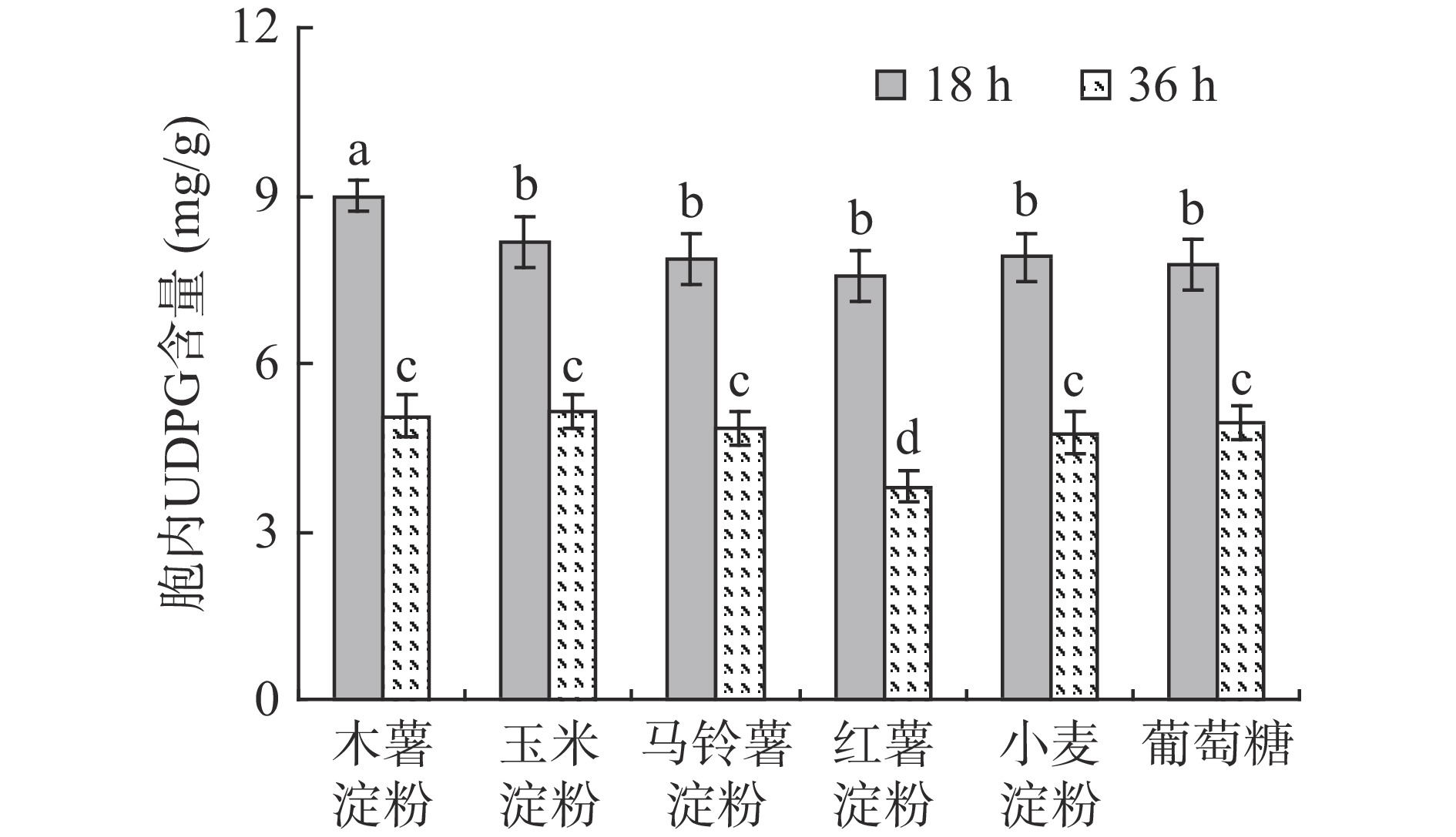
UDPG是普鲁兰多糖合成的前体物质,充足的UDPG供给将有利于普鲁兰多糖产量的提高[25]。为了考察不同淀粉对普鲁兰多糖合成前体物质UDPG含量的影响,测定了分批发酵不同阶段的胞内UDPG水平,结果如图4所示。可见,在发酵前期(18 h),胞内UDPG均维持在较高的水平(>8 mg/g),其中利用木薯淀粉时的胞内UDPG含量最高;在发酵中期(36 h),胞内UDPG含量均显著下降,特别地,利用红薯淀粉时的胞内UDPG含量降至18 h时的50.4%。因此,利用木薯淀粉可以在发酵前期提供更多的UDPG,促进普鲁兰多糖的生物合成;而利用红薯淀粉在发酵中期即出现UDPG供给水平下降,普鲁兰多糖持续合成的内在驱动力不足,最终导致普鲁兰多糖产量明显下降。
2.4 普鲁兰多糖分批发酵碳源成本分析
普鲁兰多糖属于纯多糖,工业发酵生产通常选用葡萄糖作为碳源物质,而这占据了原料成本的很大比重[6]。为此,对利用不同淀粉合成普鲁兰多糖的碳源成本进行估算,结果如表3所示。可以发现,与葡萄糖对照组相比,除了红薯淀粉以外,利用其他淀粉均可以降低普鲁兰多糖合成的碳源成本,其中利用木薯淀粉的成本下降最多,比对照组降低43.4%。由于木薯淀粉是廉价易得的非粮物质[7,26],因此,选用木薯淀粉作为原料,可以有效地降低普鲁兰多糖的生产成本,这对于实现普鲁兰多糖廉价高效生产和应用均具有重要意义。
表 3 普鲁兰多糖分批发酵碳源成本分析Table 3. Cost evaluation of carbon source for batch pullulan polysaccharide production碳源物质 木薯
淀粉玉米
淀粉马铃薯
淀粉红薯
淀粉小麦
淀粉葡萄糖 价格(元/kg)* 2.1 2.0 2.4 2.8 3.2 3.5 碳源(g/L) 50 50 50 50 50 50 普鲁兰多糖(g/L) 23.96 22.55 22.72 16.85 22.15 22.59 碳源成本(元/kg普鲁兰多糖) 4.38 4.43 5.28 8.31 7.22 7.75 成本折算(%) 56.6 57.2 68.2 107.3 93.2 100 注:*表示数据来源于食品商务网www.21food.cn,2022年7月15日查询。 3. 结论
分别在摇瓶和5 L发酵罐水平上考察了不同淀粉质原料对普鲁兰多糖分批发酵的影响,结果发现木薯淀粉有利于提高普鲁兰多糖产量,而利用红薯淀粉同时降低了普鲁兰多糖的产量和分子量。通过对普鲁兰多糖分批发酵动力学参数和生理学指标进行分析,发现利用木薯淀粉提高了普鲁兰多糖合成途径中的关键酶活性和胞内UDPG含量,进而提高了普鲁兰多糖的合成能力和产量;而利用红薯淀粉则提高了普鲁兰多糖降解酶活性,显著降低了普鲁兰多糖的分子量。普鲁兰多糖分批发酵碳源成本分析结果表明,利用木薯淀粉替代葡萄糖合成普鲁兰多糖,可以有效地将普鲁兰多糖生产的碳源成本降低43.4%。研究结果部分解析了不同淀粉质原料影响普鲁兰多糖发酵生产的生理机制,同时也为普鲁兰多糖的廉价高效生产提供了可行的技术参考。
-
表 1 不同淀粉质原料对普鲁兰多糖生物合成的影响
Table 1 Effect of different starch raw materials on pullulan biosynthesis
碳源 细胞干重
(g/L)普鲁兰多糖产量
(g/L)普鲁兰多糖分子量
(×106 Da)木薯淀粉 10.76±0.39b 22.11±0.72a 1.02±0.07c 玉米淀粉 10.56±0.37b 21.44±0.62a 1.22±0.05b 马铃薯淀粉 9.86±0.25c 18.64±0.32c 1.18±0.09b 红薯淀粉 13.48±0.32a 12.96±0.37d 0.54±0.03d 小麦淀粉 10.28±0.56b 19.28±0.44c 1.09±0.06c 葡萄糖 9.22±0.28d 20.58±0.56b 1.45±0.09a 注:同列中不同小写字母代表差异显著(P<0.05);字母相同代表差异不显著(P>0.05)。 表 2 利用不同淀粉质原料合成普鲁兰多糖的分批发酵过程参数比较
Table 2 Comparison of kinetic parameters involved in batch pullulan polysaccharide production using different starch raw materials
过程参数 木薯淀粉 玉米淀粉 马铃薯淀粉 红薯淀粉 小麦淀粉 葡萄糖 最大细胞干重(g/L) 10.77±0.26b 10.53±0.25b 10.87±0.42b 14.14±0.29a 10.81±0.35b 9.66±0.27c 最大普鲁兰多糖产量(g/L) 23.96±0.36a 22.55±0.39b 22.72±0.54b 16.85±0.42c 22.15±0.45b 22.59±0.27b 普鲁兰多糖最大分子量(×106 Da) 3.21±0.13b 2.33±0.15c 3.27±0.17b 2.25±0.48c 2.82±0.36b 3.96±0.28a 普鲁兰多糖最终分子量(×106 Da) 1.19±0.17b 1.25±0.23b 1.27±0.12b 0.33±0.03c 1.19±0.13b 1.59±0.19a 平均比细胞生长速率(h−1) 0.042±0.001b 0.039±0.001b 0.038±0.002b 0.044±0.001a 0.041±0.002b 0.040±0.001b 平均比普鲁兰多糖合成速率(h−1) 0.106±0.001a 0.086±0.001c 0.092±0.002b 0.056±0.001d 0.086±0.001c 0.085±0.001c 细胞得率(g/g) 0.22±0.01b 0.21±0.01b 0.22±0.01b 0.28±0.01a 0.22±0.01b 0.19±0.01b 普鲁兰多糖得率(g/g) 0.48±0.01a 0.45±0.01b 0.45±0.02b 0.34±0.01c 0.44±0.01b 0.45±0.01b 细胞生长效率(g/L·h) 0.16±0.01b 0.15±0.01b 0.15±0.01b 0.21±0.01a 0.16±0.01b 0.13±0.01c 普鲁兰多糖合成效率(g/L·h) 0.40±0.01a 0.33±0.01c 0.38±0.02b 0.22±0.01e 0.33±0.01c 0.30±0.01d 注:同行中不同小写字母代表差异显著(P<0.05);字母相同代表差异不显著(P>0.05)。 表 3 普鲁兰多糖分批发酵碳源成本分析
Table 3 Cost evaluation of carbon source for batch pullulan polysaccharide production
碳源物质 木薯
淀粉玉米
淀粉马铃薯
淀粉红薯
淀粉小麦
淀粉葡萄糖 价格(元/kg)* 2.1 2.0 2.4 2.8 3.2 3.5 碳源(g/L) 50 50 50 50 50 50 普鲁兰多糖(g/L) 23.96 22.55 22.72 16.85 22.15 22.59 碳源成本(元/kg普鲁兰多糖) 4.38 4.43 5.28 8.31 7.22 7.75 成本折算(%) 56.6 57.2 68.2 107.3 93.2 100 注:*表示数据来源于食品商务网www.21food.cn,2022年7月15日查询。 -
[1] SHINGEL K I. Current knowledge on biosynthesis, biological activity, and chemical modification of the exopolysaccharide, pullulan[J]. Carbohydrate Research,2004,339(3):447−460. doi: 10.1016/j.carres.2003.10.034
[2] 马赛箭, 安超, 薛文娇, 等. 有机氮源对出芽短梗霉发酵普鲁兰多糖的影响[J]. 食品工业科技,2016,37(11):169−173. [MA S, AN C, XUE W, et al. Effects of organic nitrogen sources on the fermentation of pullulan by Aureobasidium pullulans[J]. Science and Technology of Food Industry,2016,37(11):169−173. MA S, AN C, XUE W, et al. Effects of organic nitrogen sources on the fermentation of pullulan by Aureobasidium pullulans [J]. Science and Technology of Food Industry, 2016, 37(11): 169-173.
[3] 王大慧, 巨晓敏, 卫功元. 表面活性剂在生物转化法合成普鲁兰中的作用及生理机制[J]. 食品科学,2019,40(22):27−32. [WANG D, JU X, WEI G. Physiological mechanism of the effect of surfactants on pullulan production by bioconversion[J]. Food Science,2019,40(22):27−32. doi: 10.7506/spkx1002-6630-20181030-350 WANG D, JU X, WEI G. Physiological mechanism of the effect of surfactants on pullulan production by bioconversion [J]. Food Science, 2019, 40(22): 27-32. doi: 10.7506/spkx1002-6630-20181030-350
[4] DUAN X, CHI Z, WANG L, et al. Influence of different sugars on pullulan production and activities of α-phosphoglucose mutase, UDPG-pyrophosphorylase and glucosyltransferase involved in pullulan synthesis in Aureobasidium pullulans Y68[J]. Carbohydrate Polymers,2008,73(4):587−593. doi: 10.1016/j.carbpol.2007.12.028
[5] CHENG K, DEMIRCI A, CATCHMARK J M. Pullulan: Biosynthesis, production, and applications[J]. Applied Microbiology and Biotechnology,2011,92(1):29−44. doi: 10.1007/s00253-011-3477-y
[6] 朱灿灿, 陈晨, 王大慧, 等. 普鲁兰生物合成中底物的作用及其生理机制[J]. 食品科学,2019,40(14):63−68. [ZHU C, CHEN C, WANG D, et al. Physiological mechanism underlying the effect of substrates on pullulan biosynthesis[J]. Food Science,2019,40(14):63−68. ZHU C, CHEN C, WANG D, et al. Physiological mechanism underlying the effect of substrates on pullulan biosynthesis[J]. Food Science, 2019, 40(14): 63-68.
[7] 金征宇, 李佳欣, 周星. 冷水可溶淀粉的物理法制备及应用研究进展[J]. 食品科学技术学报,2021,39(1):1−12. [JIN Z, LI J, ZHOU X. Research progress on physical preparation and application of cold-water-soluble starch[J]. Journal of Food Science and Technology,2021,39(1):1−12. JIN Z, LI J, ZHOU X. Research progress on physical preparation and application of cold-water-soluble starch [J]. Journal of Food Science and Technology, 2021, 39(1): 1-12.
[8] ZENG W, ZHANG B, JIANG L, et al. Poly (malic acid) production from liquefied corn starch by simultaneous saccharification and fermentation with a novel isolated Aureobasidium pullulans GXL-1 strain and its techno-economic analysis[J]. Bioresource Technology,2020,304:122990. doi: 10.1016/j.biortech.2020.122990
[9] KRAJANG M, MALAIRUANG K, SUKNA J, et al. Single-step ethanol production from raw cassava starch using a combination of raw starch hydrolysis and fermentation, scale-up from 5-L laboratory and 200-L pilot plant to 3000-L industrial fermenters[J]. Biotechnology for Biofuels,2021,14(1):68. doi: 10.1186/s13068-021-01903-3
[10] PEERAWAT K, PRAWIT K, BUSSAKORN U, et al. Continuous hydrogen production from cassava starch processing wastewater by two-stage thermophilic dark fermentation and microbial electrolysis[J]. International Journal of Hydrogen Energy,2017,42:27584−27592. doi: 10.1016/j.ijhydene.2017.06.145
[11] AN C, MA S J, CHANG F, et al. Efficient production of pullulan by Aureobasidium pullulans grown on mixtures of potato starch hydrolysate and sucrose[J]. Brazilian Journal of Microbiology,2017,48(1):180−185. doi: 10.1016/j.bjm.2016.11.001
[12] WU S J, JIN Z Y, TONG Q Y. Sweet potato: A novel substrate for pullulan production by Aureobasidium pullulans[J]. Carbohydrate Polymers,2009,76(4):645−649. doi: 10.1016/j.carbpol.2008.11.034
[13] JU X, WANG D, ZHANG G, et al. Efficient pullulan production by bioconversion using Aureobasidium pullulans as the whole-cell catalyst[J]. Applied Microbiology and Biotechnology,2015,99(1):211−220. doi: 10.1007/s00253-014-6100-1
[14] CHENG K, DEMIRCI A, CATCHMARK J M, et al. Effects of initial ammonium ion concentration on pullulan production by Aureobasidium pullulans and its modeling[J]. Journal of Food Engineering,2011,103(2):115−122. doi: 10.1016/j.jfoodeng.2010.10.004
[15] 陈世伟, 唐淑贤, 王舸楠, 等. 基于蛋白质组学分析尿嘧啶对出芽短梗霉产普鲁兰多糖的影响[J]. 食品工业科技,2022,43(16):18−25. [CHEN S, TANG S, WANG G, et al. Proteomics analysis of the effect of uracil on pullulan polysaccharide production by Aureobasidium pullulans[J]. Science and Technology of Food Industry,2022,43(16):18−25. CHEN S, TANG S, WANG G, et al. Proteomics analysis of the effect of uracil on pullulan polysaccharide production by Aureobasidium pullulans[J]. Science and Technology of Food Industry, 2022, 43(16): 18-25.
[16] 余小六. 普鲁兰生物合成及其高产策略研究[D]. 苏州: 苏州大学, 2013 YU Xiaoliu. Strategies on the fermentation of Aureobasidium pullulans for enhanced production of pullulan [D]. Suzhou: Soochow University, 2013.
[17] RAMM M, WOLFENDER J, QUEIROZ E F, et al. Rapid analysis of nucleotide-activated sugars by high-performance liquid chromatography coupled with diode-array detection, electrospray ionization mass spectrometry and nuclear magnetic resonance[J]. Journal of Chromatography A,2004,1034(1-2):139−148. doi: 10.1016/j.chroma.2004.02.023
[18] CHEN X, WANG Q, LIU N, et al. A glycosyltransferase gene responsible for pullulan biosynthesis in Aureobasidium melanogenum P16[J]. International Journal of Biological Macromolecules,2017,95:539−549. doi: 10.1016/j.ijbiomac.2016.11.081
[19] WEI X, LIU G L, JIA S L, et al. Pullulan biosynthesis and its regulation in Aureobasidium spp.[J]. Carbohydrate Polymers,2021,251:11707.
[20] WANG D, NI T, JU X, et al. Sodium chloride improves pullulan production by Aureobasidium pullulans but reduces the molecular weight of pullulan[J]. Applied Microbiology and Biotechnoly,2018,102:8921−8930. doi: 10.1007/s00253-018-9292-y
[21] 张高川, 何超永, 王崇龙, 等. 转录组测序分析氯化钠对普鲁兰生物合成的影响[J]. 食品科学,2021,42(18):45−50. [ZHANG G, HE C, WANG C, et al. Understanding the effect of sodium chloride on pullulan biosynthesis by RNA sequencing[J]. Food Science,2021,42(18):45−50. ZHANG G, HE C, WANG C, et al. Understanding the effect of sodium chloride on pullulan biosynthesis by RNA sequencing[J]. Food Science, 2021, 42(18): 45-50.
[22] WANG G, DIN A, QIU Y, et al. Triton X-100 improves co-production of β-1, 3-D-glucan and pullulan by Aureobasidium pullulans[J]. Applied Microbiology and Biotechnology,2020,104:10685−10696. doi: 10.1007/s00253-020-10992-3
[23] SINGH R S, KAUR N, KENNEDY J F. Pullulan production from agro-industrial waste and its applications in food industry: A review[J]. Carbohydrate Polymers,2019,217:46−57. doi: 10.1016/j.carbpol.2019.04.050
[24] WANG D, JU X, ZHANG G, et al. Copper sulfate improves pullulan production by bioconversion using whole cells of Aureobasidium pullulans as the catalyst[J]. Carbohydrate Polymer,2016,150:209−215. doi: 10.1016/j.carbpol.2016.05.035
[25] LEATHERS T D. Biotechnological production and applications of pullulan[J]. Applied Microbiology and Biotechnology,2003,62:468−473. doi: 10.1007/s00253-003-1386-4
[26] 王金梦, 张思维, 赵康云, 等. 不同品种木薯淀粉理化和结构性质的比较[J]. 食品工业科技,2023,44(2):115−122. [WANG J M, ZHANG S W, ZHAO K Y, et al. Comparison of physicochemical and structural properties of different varieties of cassava starch[J]. Science and Technology of Food Industry,2023,44(2):115−122. WANG J M, ZHANG S W, ZHAO K Y, et al. Comparison of physicochemical and structural properties of different varieties of cassava starch [J]. Science and Technology of Food Industry, 2023, 44(2): 115-122.
-
期刊类型引用(1)
1. 罗海澜,马翠云,罗海淑,张群芝,王会娟,赵丽芳,王飞. 可可毛色二孢菌F6胞外多糖在草莓保鲜中的应用. 食品安全质量检测学报. 2023(02): 91-98 .  百度学术
百度学术
其他类型引用(0)





 下载:
下载:

 下载:
下载:



