Extraction, Purification, Structural Characterization and Antioxidant Activity of Polysaccharides from the Fruiting Body of Guanxian Ganoderma lucidum
-
摘要: 以冠县灵芝为研究对象,采用传统浸提法获得水溶性灵芝多糖GLP,经Sevag法去蛋白及活性炭脱色,然后依次采用CaptoTM DEAE离子柱层析和Superdex 6 prep Grad凝胶柱层析进行分离纯化,获得均一多糖GLPS80a,经高效凝胶色谱(HPGPC)法检测,其相对分子量为9024 Da,高效阴离子色谱(HPAEC)、红外光谱(FT-IR)和核磁共振(NMR)图谱分析结果表明,GLPS80a是由岩藻糖(Fuc)、氨基葡萄糖(GlcN)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)和葡萄糖醛酸(GluA)等7种单糖组成,摩尔比为0.06:0.23:0.17:1.00:0.08:0.19:0.23,主要以β-D-(1,6)糖苷键连接的吡喃糖为主要组成且不含三股螺旋的酸性多糖。抗氧化结果表明,GLPS80a具有一定的DPPH自由基、OH自由基和ABTS+自由基的清除能力,它们的EC50分别为7.40、8.74和0.33 mg/mL,还原力RP0.5AU为8.33 mg/mL。本研究将为合理开发冠县灵芝资源和精深加工奠定理论基础。Abstract: Taking Ganoderma lucidum in Guanxian County as the experimental material, the crude polysaccharide GLP was extracted from the fruiting body of G. lucidum by hot water. After deproteinization by Sevag methods and decolorization by activated carbon methods, and then separation and purification by CaptoTM DEAE ion chromatography and Superdex 6 prep Grad gel chromatography, respectively, the homogeneous polysaccharide GLPS80a was obtained. And its average molecular weight was 9024 Da. Its chemical structure was preliminarly characterized by monosaccharide composition analysis, infrared scanning and nuclear magnetic resonance analysis, respectively. The results showed that GLPS80a was composed of fucose, glucosamine, galactose, glucose, xylose, mannose and gluconal, and the molar percentage was 0.06:0.23:0.17:1.00:0.08:0.19:0.23. It was an acid polysaccharide with the main of pyranoid glucose linked by β-D-(1,6) glycosidic bond and did not have a triple helix structure. The antioxidant results indicated that GLPS80a had scavenging ability of DPPH radical, ·OH radical and ABTS+ radical. Their EC50 was 7.40, 8.74 and 0.33 mg/mL, respectively, and the reducing power RP0.5AU was 8.33 mg/mL. This work would lay a theoretical foundation for development of G. lucidum resources in Guanxian County.
-
灵芝(Ganoderma lucidum)隶属担子菌纲,多孔菌科,又名仙草、瑞草。它是我国传统中药中一味著名的中药材,已有2000多年的应用历史。《神农本草经》将灵芝列为上品,为“太上之药”,可养心安神,养肺益气,长期服用可以益寿延年。现代研究表明,灵芝具有很高的药用价值[1],富含多糖[2]、三萜[3]、甾醇类[4]、蛋白质[5]、不饱和脂肪酸[6]、维生素[7]、矿质元素[8]等多种成分。其中,灵芝多糖是其重要的活性成分之一,具有抗氧化[9]、抗肿瘤[10]、抗炎[11]、预防糖尿病[12]、免疫调节[13]等生物功能。因此,灵芝多糖一直是研究的热点。目前对于灵芝多糖的研究已经广泛涉及到各个方面,包括提取优化、分离纯化、结构解析、生理功能和构效关系等,但对于冠县灵芝的研究,目前仅限于本课题组。
冠县,地处山东西部边陲(东经115°16′~115°47′、北纬36°22′~36°42′),是中国重要的灵芝生产基地。2020年种植面积10000亩,灵芝总产量高达8000吨,灵芝孢子粉12000吨,总产量占全国产量50%以上[14]。但是,目前主要还是以灵芝子实体等初级农产品的形式进行销售,如何从灵芝内涵入手,深度挖掘其活性成分多糖的功效,开发高附加值灵芝产品,将是合理开发冠县灵芝、将冠县灵芝产业做大做强的重要努力方向之一。
本研究以冠县灵芝作为研究对象,对其进行提取、去蛋白去色素,然后依次采用阴离子层析和凝胶层析,获得高纯度多糖GLPS80a,采用紫外光谱、傅里叶红外、核磁共振进行结构表征,并进行抗氧化活性试验,旨在为冠县灵芝的精深加工和高附加值提供科学依据。
1. 材料与方法
1.1 材料与仪器
灵芝子实体 购自山东省聊城市冠县种植厂,经聊城大学生命科学学院杜秀菊教授鉴定为赤芝;单糖标准品、葡聚糖标准品 Sigma公司;层析填料CaptoTM DEAE、Superdex 6 prep Grad、Sephcryl S-500 美国GE Healthcare公司;其他试剂 均为国产分析纯。
ÄKTApure层析仪 通用电气医疗集团;示差折光检测器RID-20A,RID-10A 日本岛津;Nicolet iS50傅里叶红外光谱仪 美国Thermo Scientific公司;LC-10A高效液相色谱仪 Shimadzu;色谱柱BRT105-104-102串联凝胶柱 BoRui Saccharide;AVANCE NEO 500核磁共振检测仪 德国布鲁克公司;旋转蒸发仪 上海亚荣生化仪器厂;DC801型冷冻干燥机 重庆雅马拓科技有限公司;Sorvall Stratos型离心机 Thermo Fish公司。
1.2 实验方法
1.2.1 多糖的提取
多糖提取参照田淑雨[15-16]的方法,稍作改动。样品60 ℃干燥,恒重后粉碎,过80目筛。称取50 g,按料液比1:5(m/v)加95%乙醇浸泡24 h,同样方法处理2次,室温干燥后备用。
预处理后的样品粉末按料液比1:10加蒸馏水,90 ℃提取2次,2 h/次,离心(5000 r/min,20 min),两次提取液合并,80 ℃真空减压浓缩至50 mL。加入95%乙醇使提取液乙醇浓度达到80%,4 ℃静置过夜,离心(5000 r/min,30 min),收集沉淀蒸馏水复溶,冷冻干燥,即得GLP。粗多糖提取得率计算公式如下:
提取得率(%)=粗多糖干重样品初始干重×100 (1) 1.2.2 多糖的分离纯化
参考叶立斌[17]的方法,略作改动。将GLP经Sevag法去蛋白及活性炭脱色后[15]配制成20 mg/mL的浓度过CaptoTM DEAE柱,分别用去离子水和0.4、0.8、1.2、1.6、2.0 mol/L NaCl溶液洗脱,洗脱流速2 mL/min,采用苯酚-硫酸法检测洗脱液中每管多糖含量,6 mL/管收集洗脱液,结合紫外吸收曲线,以吸光值(A490)为纵坐标,洗脱管数为横坐标绘制多糖洗脱曲线。然后将洗脱液浓缩、透析、浓缩、冻干即得离子层析多糖GLPW、GLPS20、GLPS40、GLPS60、GLPS80,GLPS100。经优化最终选择GLPS20组分运用Sephcryl S-500凝胶柱,其他组分过Superdex 6 prep Grad凝胶柱,样品浓度10 mg/mL,去离子水洗脱,流速为0.5 mL/min,分别收集洗脱液浓缩冻干得十个多糖样品GLPWa、GLPWb、GLPS40a、GLPS40b、GLPS60a、GLPS80a、GLPS100a和GLPS20a、GLPS20b、GLPS20c。
1.2.3 分子量和纯度测定
多糖分子量测定和纯度检测参照程冬[18]的方法,并稍作修改。具体如下:
采用高效液相凝胶渗透色谱法(high-performance gel-permeation chromatography,HPGPC)。
液相色谱条件:色谱柱为BRT105-104-102串联凝胶柱(8×300 mm);流动相0.05 mol/L NaCl溶液;流速:0.6 mL/min;柱温:40 ℃;进样量:20 μL;检测器:示差检测器RI-10A。
样品及标准品溶液配制:精密称取GLPS80a样品和葡聚糖标准品(分子量分别为:5000、11600、23800、48600、80900、148000、273000、409800、667800 Da),均配制成5 mg/mL溶液,12000 r/min离心10 min,上清液用0.22 μm的微孔滤膜过滤,然后将样品转置于1.8 mL进样小瓶中备用。
1.2.4 单糖组成测定
采用高效离子交换色谱(HPAEC)法进行检测[19],具体方法如下:
样品及标准品处理:称取样品2 mg加入10 mL 3 mol/L三氟乙酸,120 ℃水解6 h,冷却减压蒸干,加3 mL甲醇蒸干,稀释100倍,过0.22 μm的微孔滤膜转移至液相瓶备用。
色谱条件:色谱柱为CarboPac PA20阴离子交换分析柱;因糖类物质在强碱溶液中可以解离成弱酸根离子化状态,所以高pH的淋洗液可使样品以部分或全部阴离子形式存在,可在阴离子分析柱上保留而达到分离检测的目的,故以2 mmol/mL的NaOH为淋洗液;体积流量0.45 mL/min;柱温为30 ℃;进样量25 μL。
1.2.5 傅里叶红外光谱检测
参考吴杨洋[20]的方法,略作改动。称取1 mg GLPS80a多糖样品混入100 mg KBr粉末研磨均匀压片,扫描范围4000~400 cm−1,累积32次。
1.2.6 核磁共振波谱分析
参照王亚涛[21]的方法。称取GLPS80a样品30 mg,溶于0.5 mL的D2O中,冷冻干燥,重复3次,然后将样品溶于0.5 mL D2O中,转移至核磁管,使用Bruker AVANCE NEO 500核磁共振仪进行1H NMR、13C NMR谱测定。
1.2.7 刚果红测定
刚果红测定参考Qiao等[22]的研究方法,稍作改动。取GLPS80a样品5 mg,加入2 mL去离子水和2 mL 80 μmol/L的刚果红试剂,然后逐渐加入1 mol/L的NaOH溶液,使溶液浓度从0 mol/L逐步提高到0.5 mol/L(0、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mol/L),并用酶标仪进行300~600 nm扫描,测定各碱性梯度下溶液最大吸光值对应最大吸收波长的变化。空白组用去离子水代替样品。
1.2.8 抗氧化活性测定
1.2.8.1 DPPH自由基清除能力
根据Shang等的方法[23],略作改动,步骤如下:将62.5、125、250、500、1000、1500、2000 μg/mL的不同浓度GLPS80a样品液和0.2 mmol/L DPPH无水乙醇溶液1:1(v:v)混合均匀,室温下避光30 min,测定517 nm处吸光值,记作Ai。用无水乙醇代替Ai中的DPPH,其余操作同Ai,记作Aj。用无水乙醇代替Ai中的样品液,其余操作同Ai,记作A0。以VC为阳性对照。DPPH自由基清除率的计算方法见公式(2)。
I(%)=A0−Ai+AjA0×100 (2) 1.2.8.2 ·OH自由基清除能力
参照Pan等[24]的方法,略作改动,步骤如下:将30% H2O2溶液1 mL、不同浓度(62.5、125、250、500、1000、1500、2000 μg/mL)样品液1 mL、4 mmol/mL FeSO4溶液1 mL和4 mmol/mL水杨酸无水乙醇溶液1 mL混匀,37 ℃避光反应30 min,4000 r/min离心10 min,取上清510 nm处测吸光值,记作Ai。用1 mL无水乙醇溶液代替Ai中的水杨酸无水乙醇溶液,剩余步骤同Ai,记作Aj。用超纯水代替Aj中的不同浓度样品液,剩余步骤同Aj,记作A0。以VC为阳性对照。·OH自由基清除率的计算方法见公式(3)。
I(%)=A0−Ai+AjA0×100 (3) 1.2.8.3 还原力测定
根据Tang等[25]的方法,稍作改动,具体如下:1 mL不同浓度的样品液(62.5、125、250、500、1000、1500、2000 μg/mL)、2 mL pH6.6 0.2 mol/L PBS缓冲液、2 mL 1%铁氰化钾溶液混合,50 ℃静置20 min;再加入2 mL 10%三氯乙酸溶液,混合均匀,4000 r/min离心10 min,然后取上清液和超纯水各2.5 mL、1 mL 0.1%的三氯化铁溶液,混合,静置10 min,测700 nm处吸光值。
1.2.8.4 ABTS+自由基清除能力
参考代嫚婷等[26]的方法,具体方法为:量取浓度为40 g/L的K2S2O8溶液330 μL,称取77.00 mg ABTS粉末,蒸馏水溶解混合并定容至20 mL,避光反应12 h后即为ABTS母液。将母液用PBS(pH6.6)稀释至734 nm波长处吸光值为0.7±0.02。取50 μL去离子水和150 μL ABTS稀释液于96孔酶标板中暗反应5 min测定734 nm处吸光值记作A0,同样的操作,将A0中的去离子水替换为不同浓度的样品液(62.5~2000 μg/mL)记作Ai,将Ai中的ABTS换作去离子水记作Aj。以VC为阳性对照。计算公式同·OH清除率的计算方公式。
1.2.9 多糖和蛋白含量的测定
参照田淑雨[15]的方法对GLP多糖含量和蛋白含量分别测定。采用苯酚-硫酸法测定总糖含量,以葡萄糖为标准品,得标准曲线为y=9.5667x+0.0103,R2=0.9967;DNS法测定还原糖含量,以葡萄糖为标准品,得标准曲线为y=0.9673x−0.0278,R2=0.9968;多糖含量计算公式见公式(4)。考马斯亮蓝法测定蛋白质含量,以牛血清蛋白为标准品,得标准曲线为y=9.2179x+0.0293,R2=0.991。
多糖含量(%)=总糖含量(%)−还原糖含量(%) (4) 1.3 数据处理
试验数据运用Excel软件整理,SPSS Statistics 19统计软件进行数据分析,每个试验设置三个平行,结果以均值±标准差表示。
2. 结果与分析
2.1 灵芝多糖的提取、分离和纯化
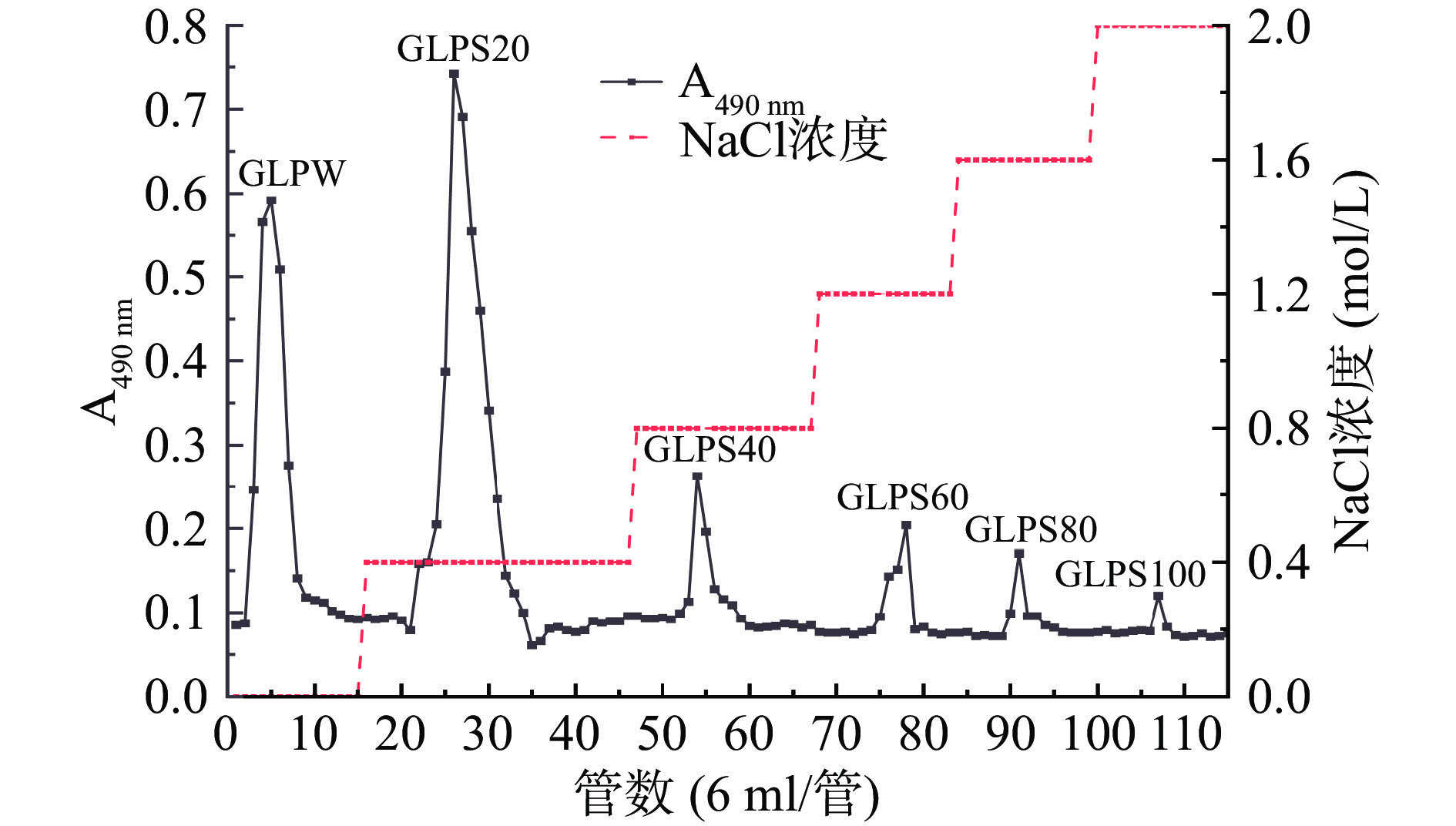
经90 ℃加热提取的灵芝子实体粗多糖GLP,呈浅棕色粉末状,得率为3.03%,多糖含量为32.39%,还原糖和蛋白含量分别为5.50%和0.95%。经CaptoTM DEAE柱分离纯化得到6个组分,分别为:水洗脱组分GLPW,盐洗脱组分GLPS20、GLPS40、GLPS60、GLPS80和GLPS100(如图1),其多糖含量和得率见表1。6个组分的多糖经过浓缩,透析,冷冻干燥测得总糖含量分别为34.40%、57.10%、25.12%、21.30%、19.84%和11.94%;得率分别为6.29%、17.22%、5.40%、5.17%、4.63%和2.08%。
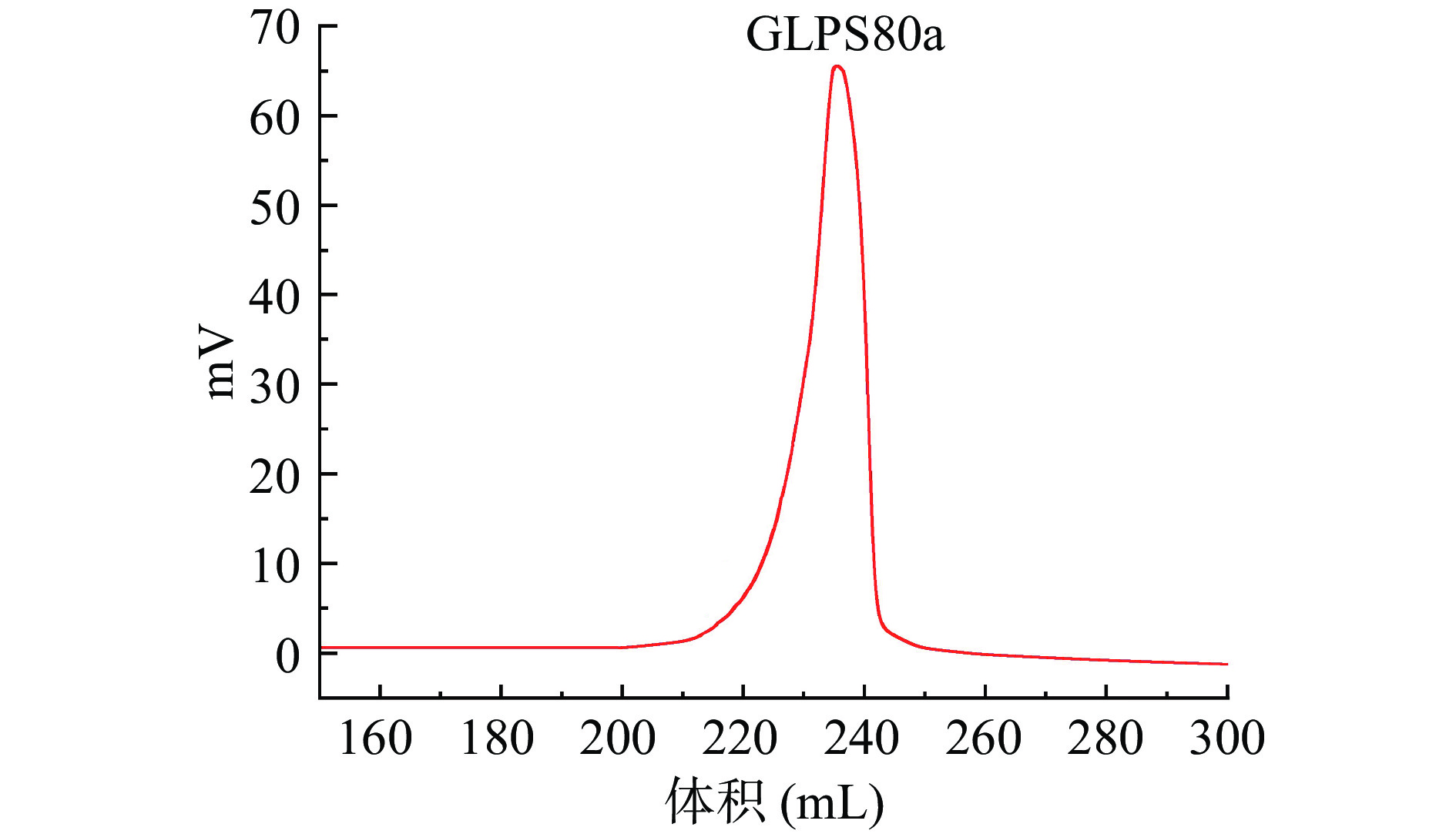
表 1 离子交换柱层析样品糖含量和得率Table 1. Sugar content and yield of ion-exchange column chromatography samples样品 物理性状 总糖含量(%) 还原糖含量(%) 多糖含量(%) 蛋白含量(%) 得率(%) GLPW 白色絮状 34.40±0.72 4.40±0.08 30.00±0.60 0.15±0.01 6.29 GLPS20 红棕色片状 57.10±0.86 2.60±0.03 54.50±0.53 0.29±0.01 17.22 GLPS40 淡黑色粉末 25.12±0.31 0.70±0.01 24.42±0.36 0.25±0.01 5.40 GLPS60 淡黑色粉末 21.30±0.26 0.70±0.01 20.60±0.33 0.16±0.01 5.17 GLPS80 浅咖啡色片状 19.84±0.39 * 19.84±0.69 0.15±0.01 4.63 GLPS100 咖啡色片状 11.94±0.20 * 11.94±0.37 0.16±0.01 2.08 注:*表示未测出。 相较于同课题组田淑雨等[16]的采用超声波协助提取灵芝多糖研究,其提取得率略低(超声波协助提取得率为3.60%),但通过CaptoTM DEAE柱纯化的样品总糖含量普遍高于乙醇沉淀分级所得样品的含量,说明色谱技术对于多糖纯化效果明显。本文首先选取GLPS80继续下一步的工作。GLPS80经Superdex 6 prep Grad凝胶柱层析,如图2所示,洗脱峰为单一对称峰,表明为均一多糖,然后经真空浓缩,冷冻干燥后获得均一多糖(命名为GLPS80a)。
2.2 分子量测定和纯度检测
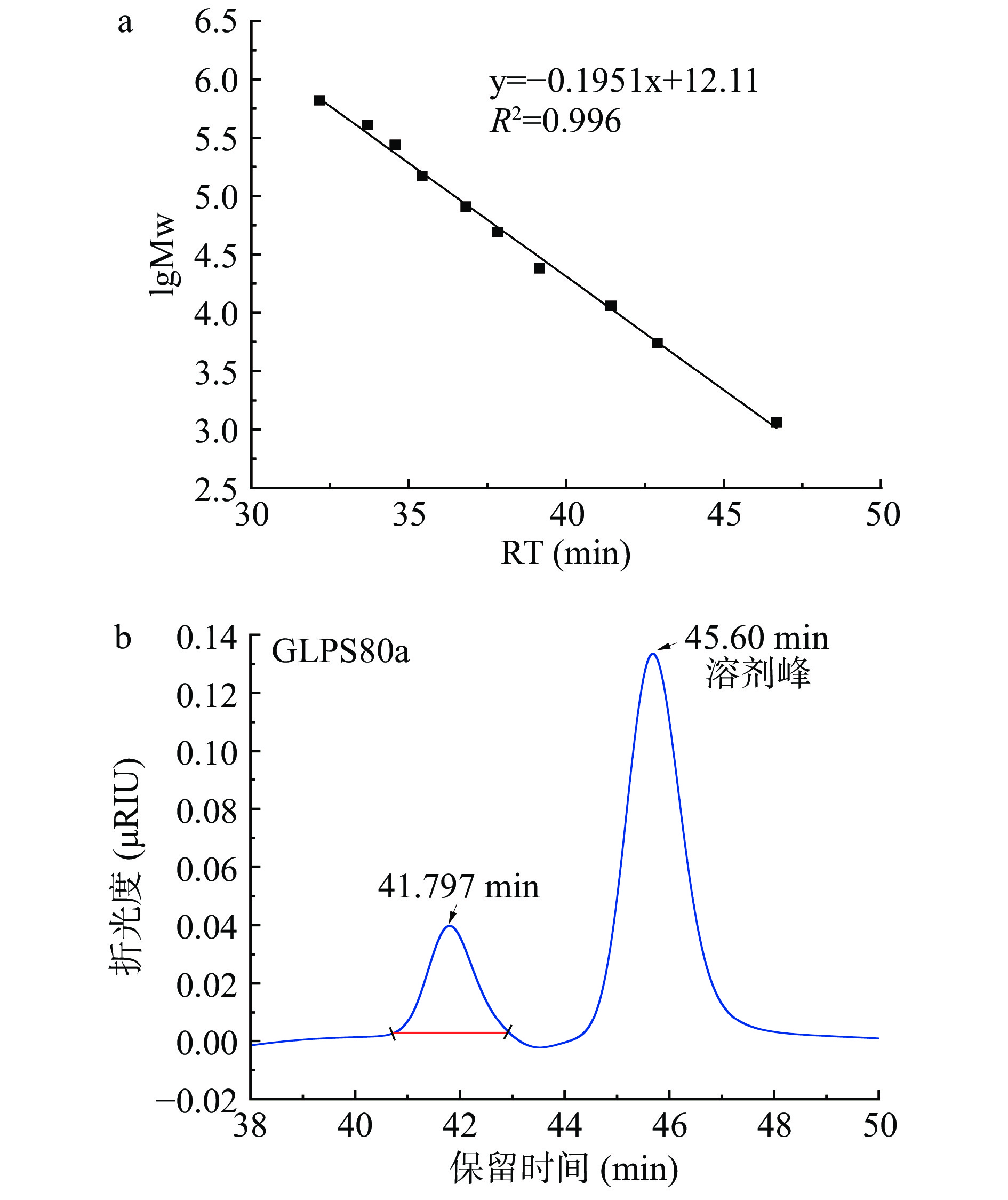
按上述HPGPC色谱条件,用已知葡聚糖标准品分子量的对数(lgMw)和其相应的保留时间(RT),制作lgMw-RT标准曲线(见图3a),得线性回归方程:y=−0.1951x+12.11,R2=0.996。对GLPS80a分子量和纯度测定,结果如图3b,41.797 min时的峰为样品峰,45.60 min为溶剂峰,GLPS80a峰型单一对称,表明GLPS80a为均一组分,由回归方程计算得相对分子质量(Mw)为9024 Da。
2.3 单糖组成分析
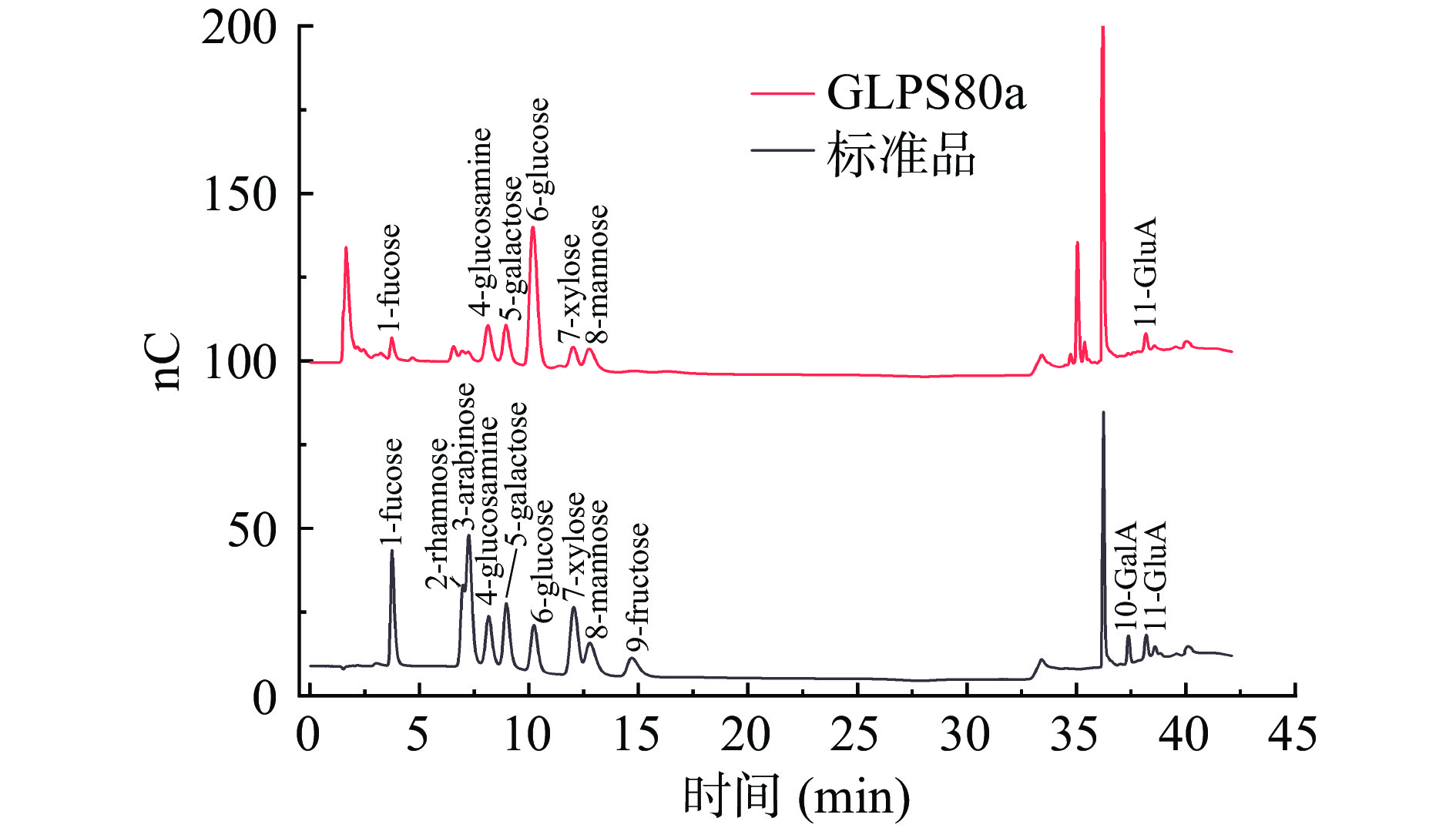
高效离子交换色谱(HPAEC)是目前鉴定多糖的单糖组成及摩尔比常用且有效的一种方法。如图4所示,GLPS80a的单糖组成为:岩藻糖(Fuc)、氨基葡萄糖(GlcN)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、甘露糖(Man)、葡萄糖醛酸(GluA);其摩尔比为:0.06:0.23:0.17:1.00:0.08:0.19:0.23。由单糖组成可知,GLPS80a含有GluA,GlcN等酸性多糖的特征性组成成分[27],所以初步确定其为酸性多糖,这一点与利用色谱分离纯化时选取层析填料为弱阴离子填料CaptoTM DEAE一致。
2.4 红外光谱分析(FT-IR)
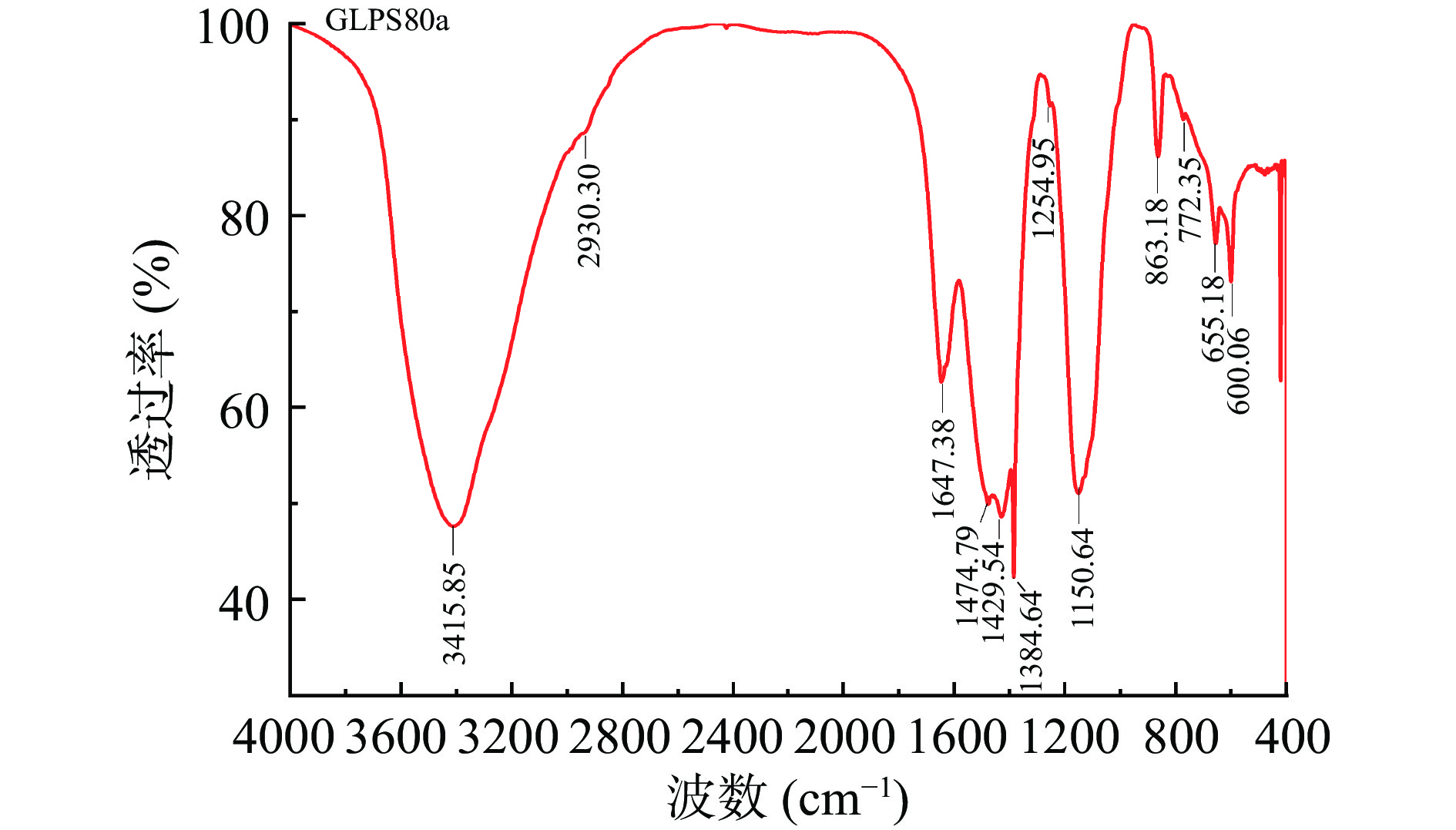
红外光谱法是多糖结构鉴定的常用方法之一,可根据红外光谱的出峰位置、峰形和峰强度判断多糖中的官能团和量的大小[28]。GLPS80a红外光谱分析结果见图5所示,其中3415.85 cm−1处较宽的强吸收峰是-OH伸缩振动引起的;2930.30 cm−1的吸收峰为C-H伸缩振动吸收;在1647.38 cm−1的吸收峰是多糖结合水引起的或者为C=O的伸缩振动峰;1429.54 cm−1处的吸收峰是C-H伸缩振动的结果;以上4000~1400 cm−1范围的吸收峰构成了多糖的特征性吸收[19]。1384.64 cm−1出现的峰是C-H变角振动引起的[29];1254.95 cm−1处的吸收峰表明有糖醛酸存在[30],这与单糖组成分析的结果一致;1150.64 cm−1处的C-O吸收是吡喃环中糖苷键伸缩振动产生的吸收峰[31]。863.18 cm−1处的吸收为β-吡喃糖苷键的吸收峰[19,32];772.35 cm−1为D-吡喃环的对称环伸缩振动峰[33];655.18和600.06 cm−1推测是吡喃糖环作为基本骨架的吸收峰[34]。综上所述,GLPS80a是一种以D-吡喃糖为基本骨架的酸性多糖。
2.5 核磁共振分析
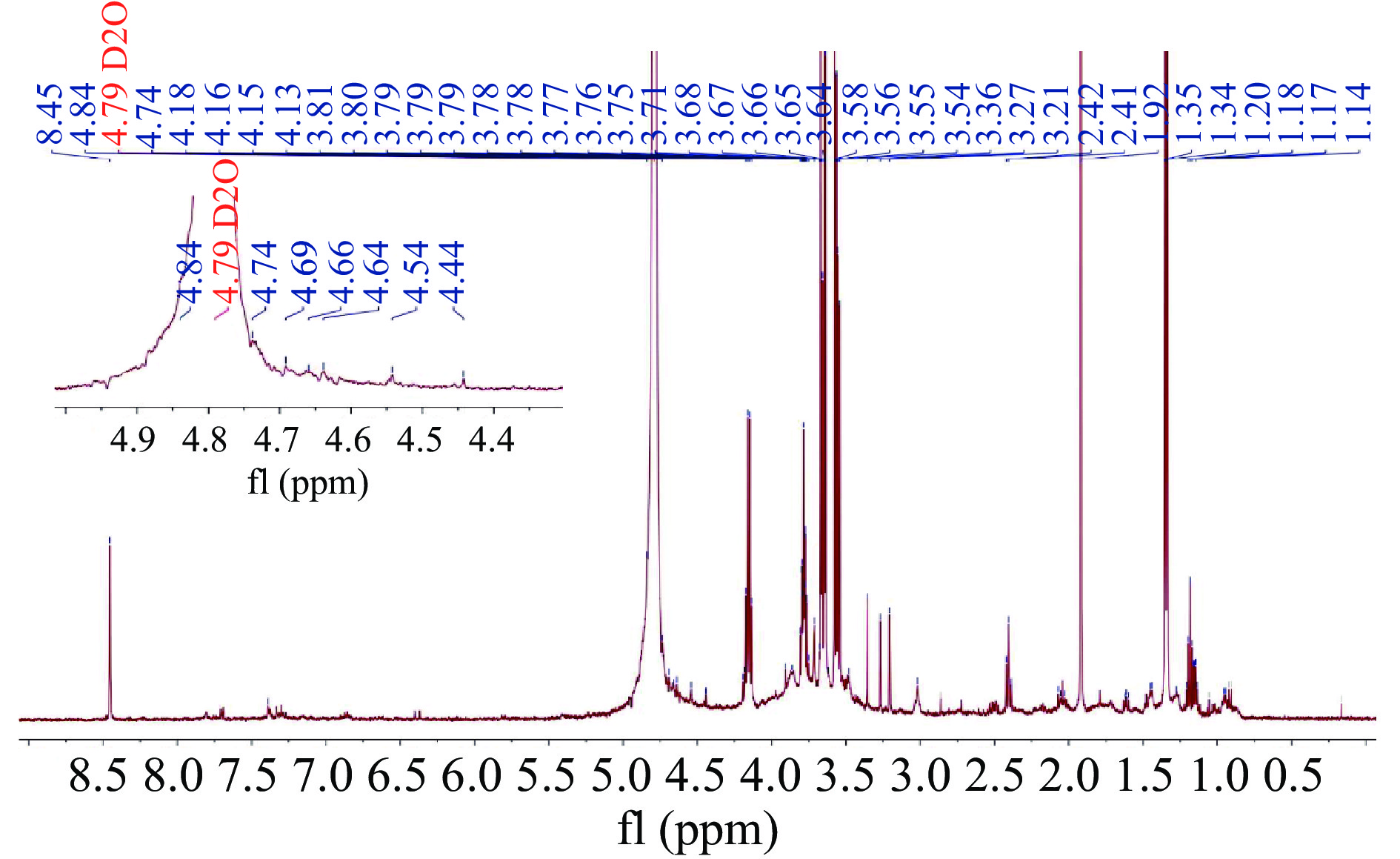
如图6所示。在GLPS80a的1H NMR谱图中,异头质子的共振区域δ 4.2~5.8 ppm[35]只存在7个异头氢的共振峰δ 4.84 ppm、δ 4.74 ppm、δ 4.69 ppm、δ 4.66 ppm、δ 4.64 ppm、δ 4.54 ppm、δ 4.44 ppm,说明GLPS80a由7种糖残基组成,这与单糖组成分析结果一致,其质子化学位移小于4.95 ppm,表明这些糖残基为β型吡喃糖[36],这与GLPS80a的傅里叶变换红外光谱863.18 cm−1处的吸收峰为β-吡喃糖苷键的检测结果一致。
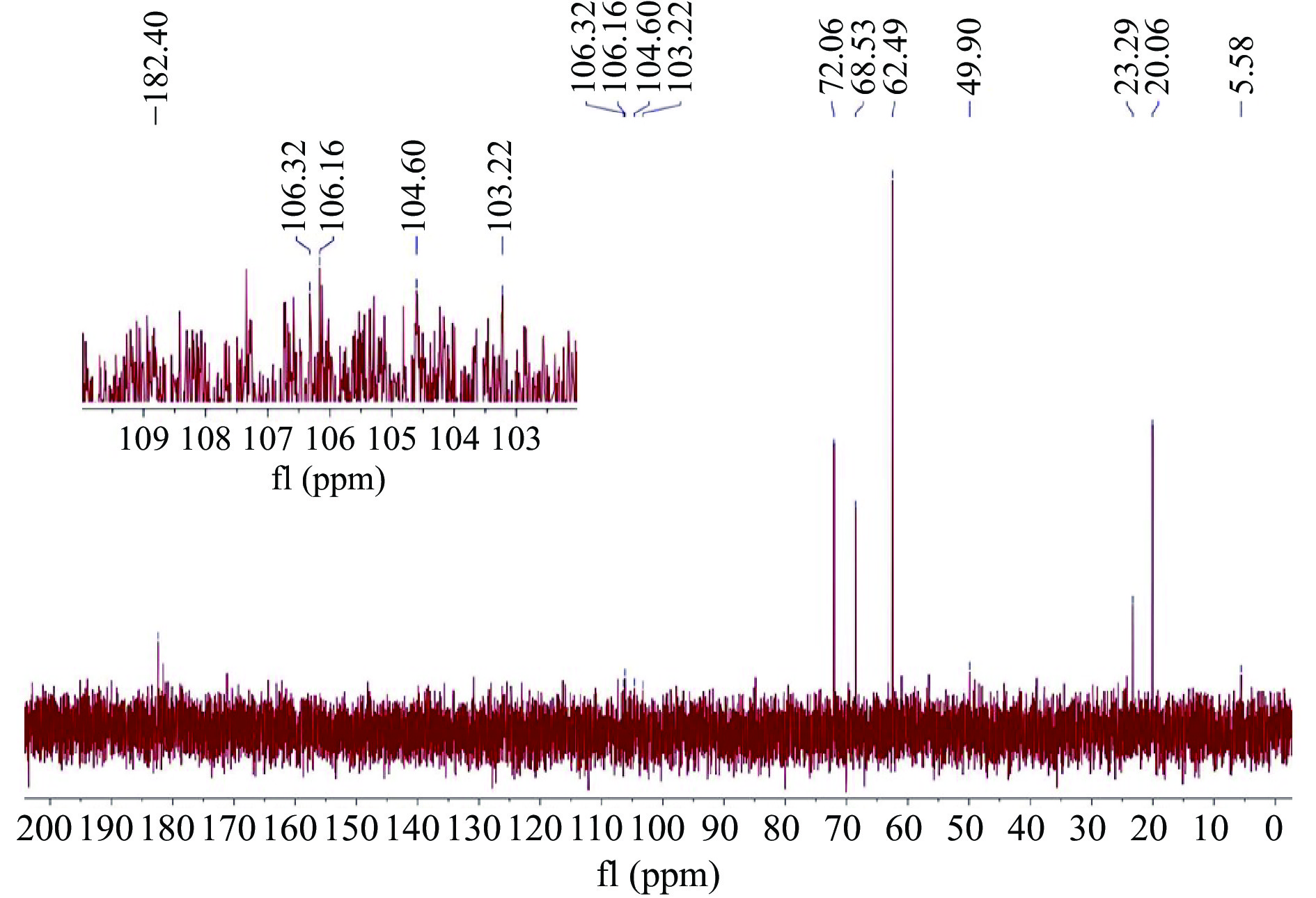
如图7所示,在GLPS80a的13C NMR谱图中,在δ 90 ppm~δ 112 ppm异头碳区有δ 106.32 ppm、δ 106.16 ppm、δ 104.60 ppm、δ 103.22 ppm,由于化学位移大于δ 102 ppm,表明糖残基的构型为β吡喃型[37],这与IR结果一致。除异头碳信号外,在吡喃型糖残基中C2、C3、C4未被取代的碳的共振区为δ 70 ppm~δ 75 ppm,若发生取代则该碳的化学位移向高场移至δ 76 ppm~δ 85 ppm,若C6位被取代则其化学位移从δ 62 ppm移至δ 67 ppm[38];C2、C3、C4、C5取代位置上的碳信号为δ 78 ppm~δ 85 ppm,未被取代的碳信号区域为δ 65~δ 80 ppm,δ 61 ppm为未被取代的C6共振峰,被取代后C6往低场移至δ 69 ppm[39]。故推测13C NMR谱中δ 68.53 ppm和δ 72.06 ppm为C2、C3、C4、C5位置未发生取代信号,δ 68.53 ppm表明糖残基C6位可能发生了取代。δ 182.4 ppm处的化学位移表明有羰基碳的存在。综上所述,GLPS80a一级结构主要是以β→(1,6)糖苷键连接的吡喃糖为主的酸性多糖。
2.6 刚果红结果分析
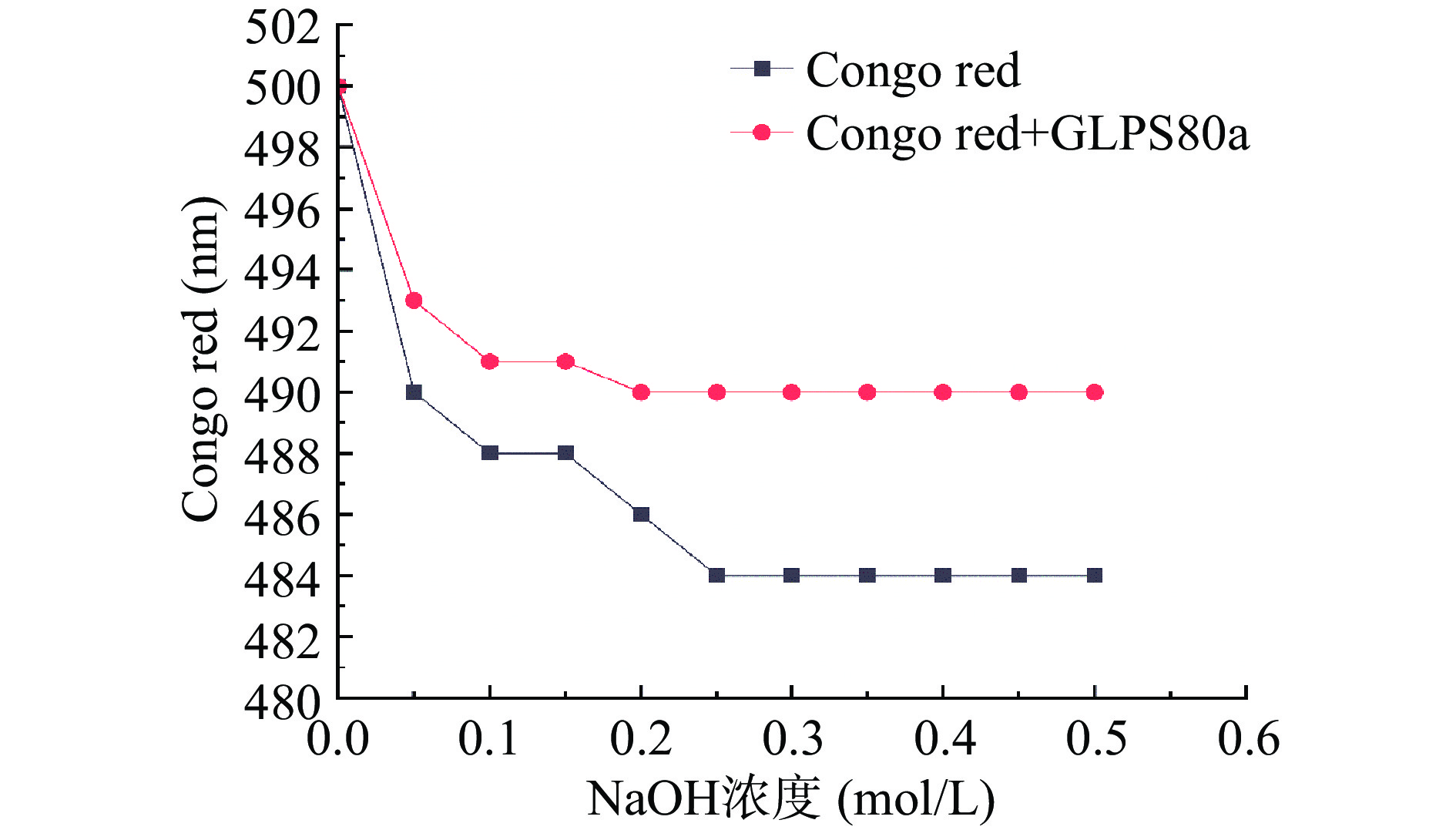
刚果红是一种可溶于水和乙醇的酸性染料,可与具有三股螺旋结构的多糖形成络合物,与单纯刚果红溶液最大吸收波长相比,有三股螺旋结构多糖形成络合物的刚果红混合液最大吸收波长向长波长方向移动,当NaOH浓度在0~0.5 mol/L的浓度范围内变化且存在三股螺旋结构,最大吸收波长发生特征性红移,但当NaOH浓度达到0.3 mol/L左右时,络合物最大吸收波长骤然下降,如果多糖没有三股螺旋构象,则不发生上述现象[40]。GLPS80a的刚果红试验结果如图8,随着氢氧化钠浓度的升高,样液的最大吸收波长没有出现先上升后在NaOH浓度0.3 mol/L急剧下降的变化趋势,说明GLPS80a不具有三股螺旋结构。Zheng等[41]研究表明,只有多糖分子量>9×104 Da才可形成三螺旋结构。本研究也为这一结论提供了有力佐证。
2.7 抗氧化活性
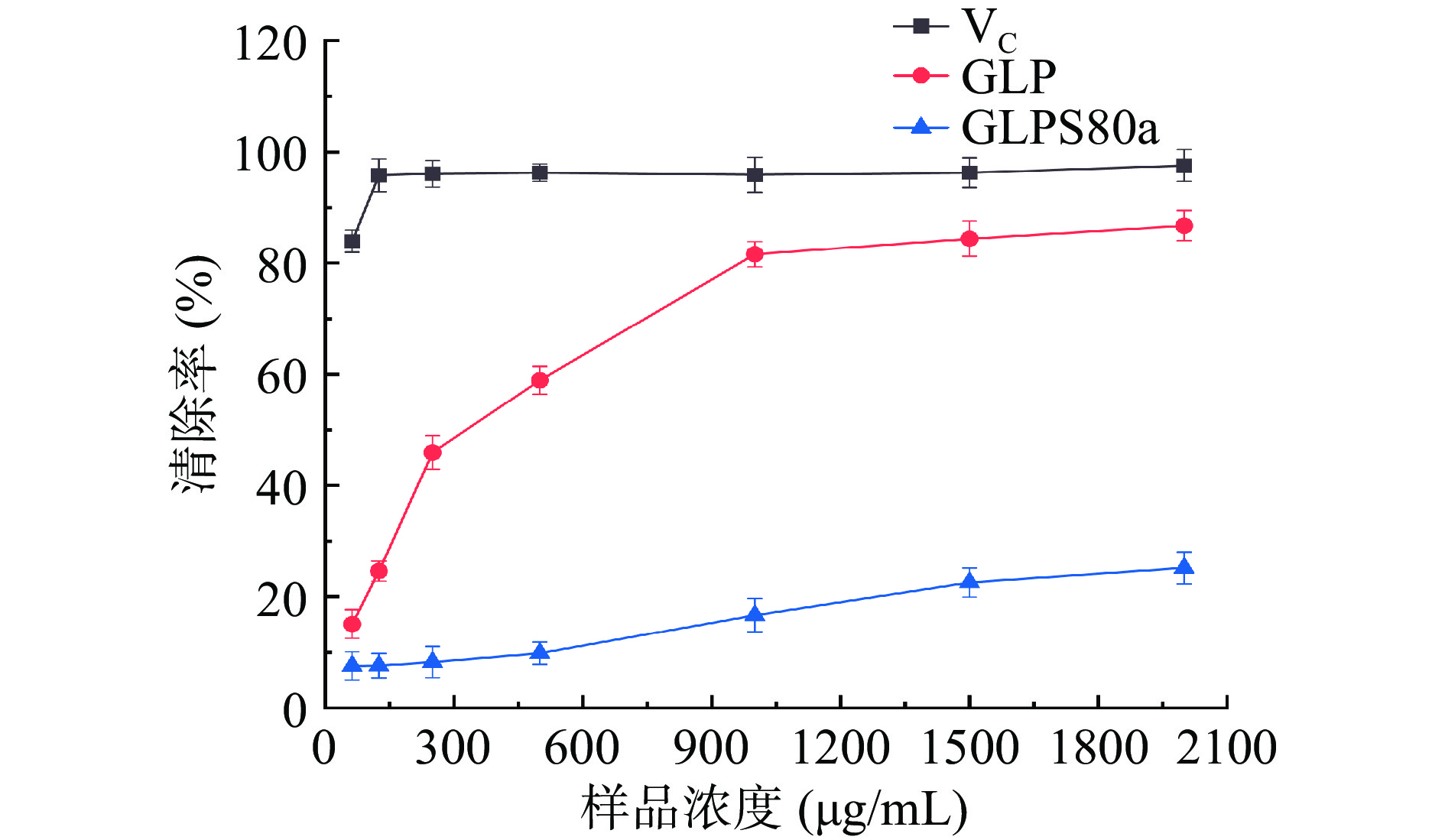
2.7.1 DPPH自由基清除能力
GLPS80a清除DPPH自由基试验结果如图9所示。随着多糖样品浓度的增加,清除率有增高但不明显。EC50值往往用来评价抗氧化剂能力大小的主要依据(EC50值为自由基清除率达到50%时的药物浓度)。VC、GLP和GLPS80a的EC50值分别为0.001、0.31和7.40 mg/mL,它们的DPPH自由基清除活性高低顺序为:GLPS80a<GLP<VC,由此可以看出,均一多糖组分GLPS80a明显低于其前体物GLP,推测可能是在多糖的分离纯化过程中,DPPH自由基活性组分被分离出去了,多糖组分和所含成分逐渐单一化,而活性的发挥是好几种多糖组分或者多种成分(如三萜类,甾醇类等)协同起的作用[42]。
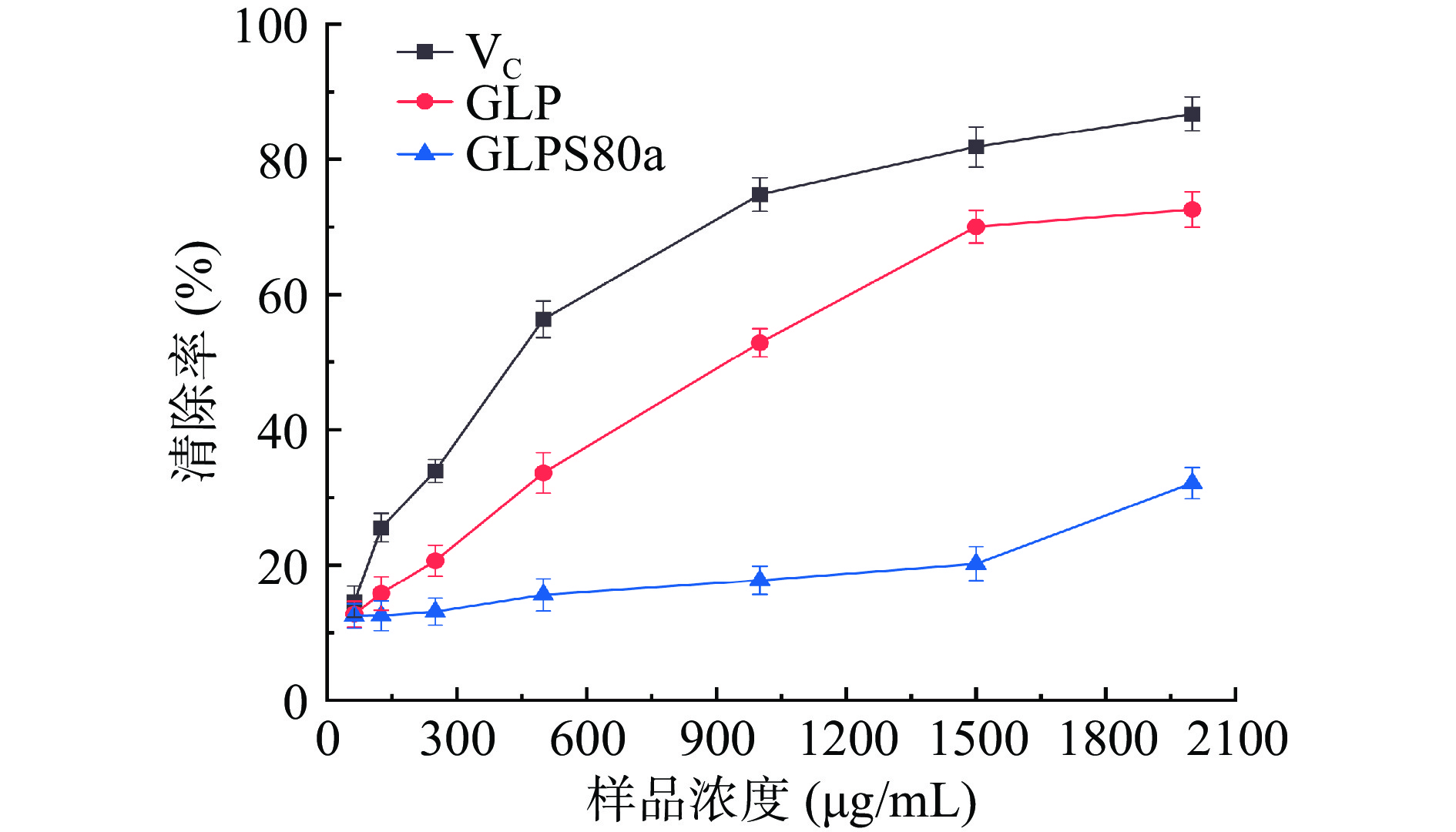
2.7.2 ·OH自由基清除能力
GLPS80a的·OH自由基清除能力见图10。随着GLPS80a的浓度上升,清除率增长缓慢,当浓度达到2000 µg/mL的浓度时,清除率达到32.14%。GLPS80a(EC50为8.74 mg/mL)、GLP(EC50为0.82 mg/mL)和VC(EC50为0.38 mg/mL)的清除能力顺序为:GLPS80a<GLP<VC。据文献报道[43],用超声辅助水提和传统热水浸提得到的多糖GLPUAE和GLPHWE在浓度为0.5 mg/mL时,清除能力分别为11.64%和15.79%,这与GLPS80a在0.5 mg/mL时(15.60%)的清除率几乎一致。
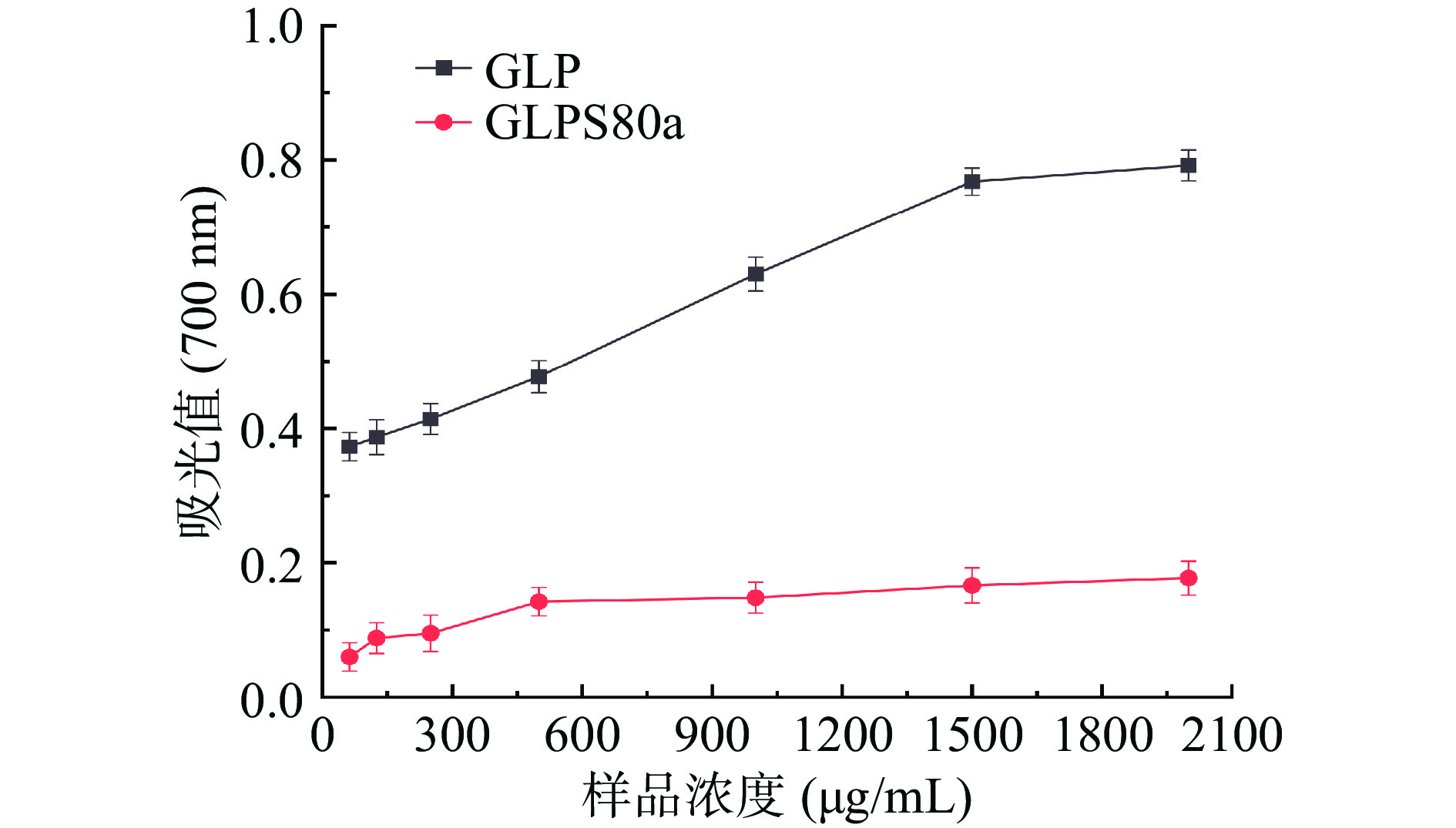
2.7.3 还原力的测定
GLPS80a的还原力如图11所示,当GLPS80a浓度从62.5 µg/mL逐渐增加时,还原力增加明显,当浓度达到500 µg/mL时,还原力增长缓慢,浓度达到2000 µg/mL时,700 nm处的吸光值达到0.177,RP0.5AU为8.33 mg/mL(RP0.5AU指吸光值为0.5时的药物浓度),与其前体物GLP的还原力(RP0.5AU 为0.68 mg/mL)相比较,GLPS80a低于GLP。
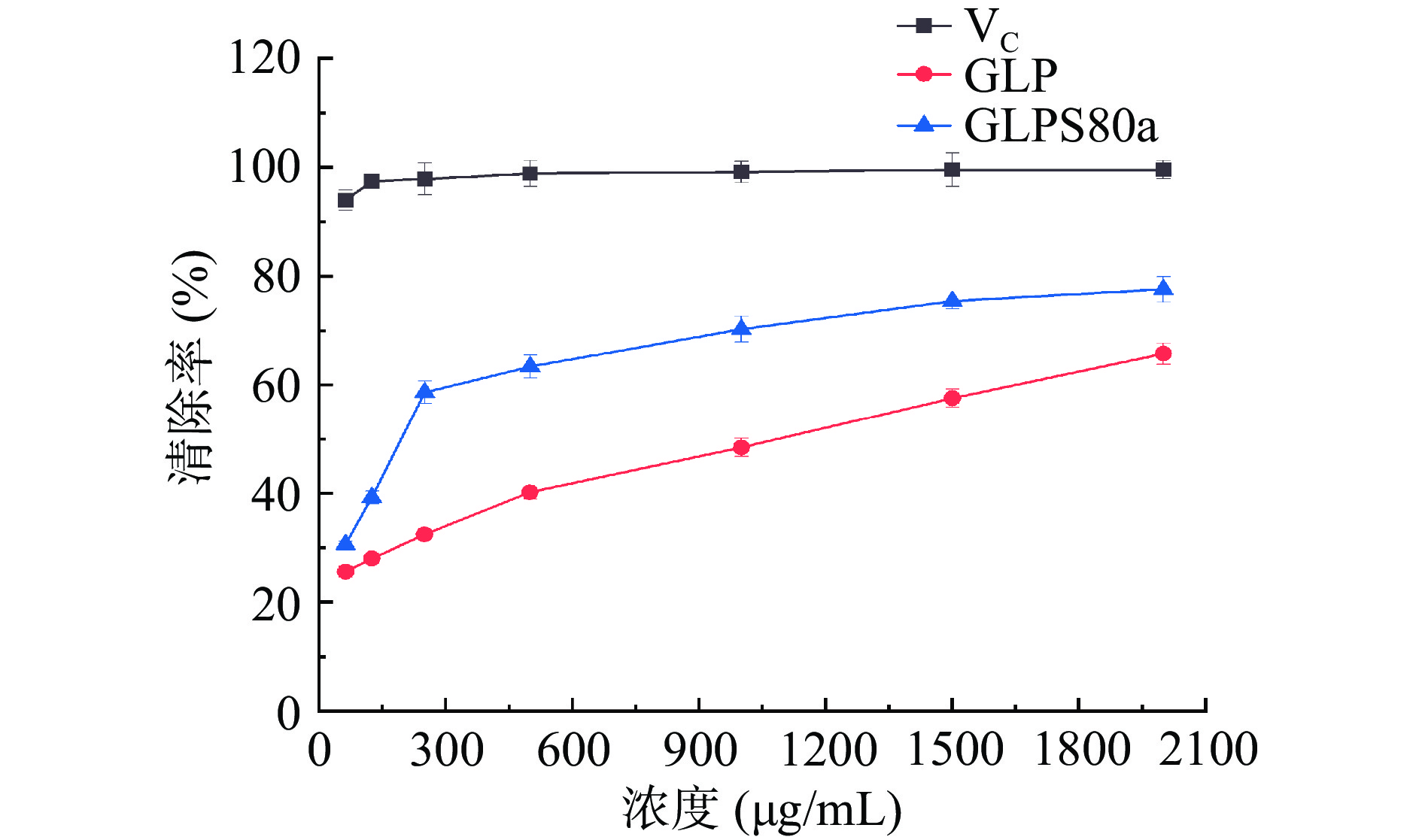
2.7.4 ABTS+自由基清除能力
ABTS+自由基清除能力常用来作为评价抗氧化能力大小的主要指标之一。其测定原理是:无色的ABTS与K2S2O8反应生成蓝绿色的ABTS+自由基,如遇抗氧化剂可被再次氧化为ABTS,并在734 nm处吸光值下降。GLPS80a的ABTS阳离子自由基清除能力如图12所示。当样品浓度从62.5 µg/mL逐渐升高至2000 µg/mL时,其清除能力随浓度增加而增加,具有良好的浓度依赖性,其EC50为0.33 mg/mL。当浓度到2000 µg/mL时清除率达到了77.59%,远高于粗多糖GLP(其清除率为65.75%)。也远远高于郑丹[44]获得的灵芝多糖的ABTS+自由基清除能力(500 µg/mL时,仅为37.60%)。刘宇琪等[45]用DEAE-650离子层析通过水洗脱获得灵芝多糖GLP-1,在1.00 mg/mL的清除率分别为63.16%,也低于同样浓度下的GLPS80a的清除率(70.26%)。综上所述,GLPS80a具有着较强的ABTS+自由基清除能力。
3. 结论
本研究采用热水浸提法,获得灵芝粗多糖GLP,并进行Sevag法除蛋白和脱色处理,采用CaptoTM DEAE离子交换层析和Superdex 6 prep Grad凝胶层析,获得灵芝多糖GLPS80a;HPGPC法测得GLPS80a的峰型单一对称,相对分子质量为9024 Da,GLPS80a是一种由Fuc、GlcN、Gal、Glc、Xyl、Man和GlcA七种单糖组成的酸性多糖,其摩尔比为0.06:0.23:0.17:1.00:0.08:0.19:0.23;FT-IR和1DNMR结果表明,GLPS80a的一级结构主要是以β-D-(1,6)糖苷键连接的吡喃型多糖。抗氧化活性表明,GLPS80a具有一定的自由基清除活性,但对DPPH和·OH自由基清除能力较弱,对ABTS+自由基清除能力最强(EC50为0.33 mg/mL)。研究表明,分子改性可以改变多糖的溶解度并提高其生物活性。在后续研究中,将以均一多糖GLPS80a作为先导化合物,对其进行分子修饰获得活性更强的衍生化多糖,并对其进行构效关系研究,为合理开发灵芝资源提供科学依据。
-
表 1 离子交换柱层析样品糖含量和得率
Table 1 Sugar content and yield of ion-exchange column chromatography samples
样品 物理性状 总糖含量(%) 还原糖含量(%) 多糖含量(%) 蛋白含量(%) 得率(%) GLPW 白色絮状 34.40±0.72 4.40±0.08 30.00±0.60 0.15±0.01 6.29 GLPS20 红棕色片状 57.10±0.86 2.60±0.03 54.50±0.53 0.29±0.01 17.22 GLPS40 淡黑色粉末 25.12±0.31 0.70±0.01 24.42±0.36 0.25±0.01 5.40 GLPS60 淡黑色粉末 21.30±0.26 0.70±0.01 20.60±0.33 0.16±0.01 5.17 GLPS80 浅咖啡色片状 19.84±0.39 * 19.84±0.69 0.15±0.01 4.63 GLPS100 咖啡色片状 11.94±0.20 * 11.94±0.37 0.16±0.01 2.08 注:*表示未测出。 -
[1] BOH B, BEROVIC M, ZHANG J S, et al. Ganoderma lucidum and its pharmaceutically active compounds[J]. Biotechnol Annual Review,2007,13(7):265−301.
[2] 吴杨洋, 周妍汝, 刘春燕, 等. 灵芝多糖提取工艺优化及抗氧化活性的研究[J]. 食品安全质量检测学报,2020,11(14):4636−4642. [WU Yangyang, ZHOU Yanru, LIU Chunyan, et al. Study on the optimization of extraction technology and antioxidant activity of Ganoderma lucidum polysaccharide[J]. Journal of Food Safety and Quality,2020,11(14):4636−4642. WU Yangyang, ZHOU Yanru, LIU Chunyan, et al. Study on the optimization of extraction technology and antioxidant activity of Ganoderma lucidum polysaccharide[J]. Journal of Food Safety and Quality, 2020, 11(14): 4636-4642.
[3] KIMURA Y, TANIGUCHI M, BABA K, et al. Antitu mor and antimetastatic effects on liver of triterpenoid fractions of Ganoderma lucidum[J]. Anticancer Res,2002,22(6A):3309−3318.
[4] 李绍玮, 徐娟, 吴学谦. 灵芝甾醇的影响因素、研究工艺及药理作用研究进展[J]. 现代食品,2020(19):70−72. [LI Shaowei, XU Juan, WU Xueqian. Influencing factors, research technology and pharmacological effects of Ganoderma lucidum sterol[J]. Modern Food,2020(19):70−72. LI Shaowei, XU Juan, WU Xueqian. Influencing factors, research technology and pharmacological effects of Ganoderma lucidum sterol[J]. Modern Food, 2020(19): 70-72.
[5] 李晓凤, 张华琦, 施晓丽, 等. 长白山野生平盖灵芝蛋白质营养价值分析[J]. 食品研究与开发,2018,39(16):170−173. [LI Xiaofeng, ZHANG Huaqi, SHI Xiaoli, et al. Nutritional value of Ganoderma applanatum pat grown in Changbai mountain[J]. Food Research and Development,2018,39(16):170−173. doi: 10.3969/j.issn.1005-6521.2018.16.032 LI Xiaofeng, ZHANG Huaqi, SHI Xiaoli, et al. Nutritional value of Ganoderma applanatum pat grown in Changbai mountain[J]. Food Research and Development, 2018, 39(16): 170-173. doi: 10.3969/j.issn.1005-6521.2018.16.032
[6] 朱晓璐, 张劲松, 周帅, 等. 灵芝液态深层发酵产物中10种不饱和脂肪酸类化合物的鉴定[J]. 菌物学报,2021,40(7):1800−1810. [ZHU Xiaolu, ZHANG Jinsong, ZHOU Shuai, et al. Identification of 10 unsaturated fatty acid compounds in the submerged fermentation products of Ganoderma lingzhi[J]. Mycosystema,2021,40(7):1800−1810. ZHU Xiaolu, ZHANG Jinsong, ZHOU Shuai, et al. Identification of 10 unsaturated fatty acid compounds in the submerged fermentation products of Ganoderma lingzhi[J]. Mycosystema, 2021, 40(7): 1800-1810.
[7] 张能荣, 张秀云. 灵芝孢子粉中维生素和多糖的分析[J]. 中国生化药物杂志,1997(1):37−38. [ZHANG Nangrong, ZHANG Xiuyun. Analysis of vitamins and polysaccharides in Ganoderma spore powder[J]. Chinese Journal of Biochemical and Pharmaceuticals,1997(1):37−38. ZHANG Nangrong, ZHANG Xiuyun. Analysis of vitamins and polysaccharides in Ganoderma spore powder[J]. Chinese Journal of Biochemical and Pharmaceuticals, 1997(1): 37-38.
[8] 唐清, 张致芬, 詹月辰. ICP-AES法同时测定灵芝中9种矿物元素[J]. 化学试剂,2006(12):739−740, 743. [TANG Qing, ZHANG Zhifen, ZHAN Yuechen. Simultaneous determination of 9 mineral elements in Ganoderma lucidum by ICP-AES[J]. Chemical Reagents,2006(12):739−740, 743. doi: 10.3969/j.issn.0258-3283.2006.12.011 TANG Qing, ZHANG Zhifen, ZHAN Yuechen. Simultaneous determination of 9 mineral elements in Ganoderma lucidum by ICP-AES[J]. Chemical Reagents, 2006(12): 739-740, 743. doi: 10.3969/j.issn.0258-3283.2006.12.011
[9] XU Yu, ZHANG Xuan, YAN Xiaohui, et al. Characterization, hypolipidemic and antioxidant activities of degraded polysaccharides from Ganoderma lucidum[J]. International Journal of Biological Macromolecules,2019,135:706−716. doi: 10.1016/j.ijbiomac.2019.05.166
[10] WANG Chunhua, SHI Songsheng, CHEN Quan, et al. Antitumor and immunomodulatory activities of Ganoderma lucidu-m polysaccharides in Glioma-Bearing rats[J]. Integr Cancer Ther,2018,17:674−683. doi: 10.1177/1534735418762537
[11] SKALICKA-WOZNIAK K, SZYPOWSKI J, LOS R, et al. Evaluation of polysaccharides content in fruit bodies and theirantimicrobial activity of four Ganoderma lucidum (W Curt. : Fr. ) P. Karst. strains cultivated on different wood type substrates[J]. Acta Soc Bot Pol,2012,81(1):17−21. doi: 10.5586/asbp.2012.001
[12] ZHAO Xiangmei, WANG Dongying, QIN Lijie, et al. Comparative investigation for hypoglycemic effects of polysaccharides from four substitutes of Lonicera japonica in Chinese medicine[J]. International Journal of Biological Macromolecules,2018,109:12−20. doi: 10.1016/j.ijbiomac.2017.12.073
[13] LU Jiahui, HE Rongjun, SUN Peilong, et al. Molecular mechanisms of bioactive polysaccharides from Ganoderma lucidum (Lingzhi), a review[J]. International Journal of Biological Macromolecules,2020,150:765−774. doi: 10.1016/j.ijbiomac.2020.02.035
[14] 山东电视台. 问政山东[EB/OL]. (2022-07-22)[2022-07-23]. https://sdxw.iqilu.com/w/article/YS0yMS0xMzAxNjQ1Nw.html Shandong Television Station. [EB/OL]. (2022-07-22)[2022-07-23]. https://sdxw.iqilu.com/w/article/YS0yMS0xMzAxNjQ1Nw.html.
[15] 田淑雨. 灵芝活性成分的提取分离纯化及抗氧化活性研究[D]. 聊城: 聊城大学, 2019 TIAN Shuyu. Study on extraction, isolation, and antioxidant activities of active compositions from Ganoderma lucidum[D]. Liaocheng: Liaocheng University, 2019.
[16] 田淑雨, 鹿士峰, 吴杨洋, 等. 超声破碎辅助提取灵芝多糖工艺优化及抗氧化活性研究[J]. 食品研究与开发,2019,40(8):101−107. [TIAN Shuyu, LU Shifeng, WU Yangyang, et al. Study on process optimization and antioxidant activity of polysaccharide from Ganoderma lucidum by ultrasonic-assisted crushing method[J]. Food Research and Development,2019,40(8):101−107. doi: 10.3969/j.issn.1005-6521.2019.08.018 TIAN Shuyu, LU Shifeng, WU Yangyang, et al. Study on process optimization and antioxidant activity of polysaccharide from Ganoderma lucidum by ultrasonic-assisted crushing method[J]. Food Research and Development, 2019, 40(8): 101-107. doi: 10.3969/j.issn.1005-6521.2019.08.018
[17] 叶立斌. 灵芝子实体多糖(缀合物)的纯化、结构鉴定、分子改性和生物活性研究[D]. 南京: 南京农业大学, 2008 YE Libin. Purification, structure identification, molecular modification and bioactivity of polysaccharides (conjugates) from Ganoderma lucidum fruiting bodies[D]. Nanjing: Nanjing Agricultural University, 2008.
[18] 程冬. 色谱柱及标准曲线的选择对HPGPC法测定右旋糖酐分子量及分子量分布的影响[J]. 药物分析杂志,2020,40(2):367−372. [CHENG Dong. Influence of different chromatograph columns and standard curves on molecular mass and molecular mass distribution of dextran by HPGPC[J]. Chinese Journal of Pharmaceutical Analysis,2020,40(2):367−372. CHENG Dong. Influence of different chromatograph columns and standard curves on molecular mass and molecular mass distribution of dextran by HPGPC[J]. Chinese Journal of Pharmaceutical Analysis, 2020, 40(2): 367-372.
[19] 谢苗. 灵芝多糖的提取分离、结构表征及抗氧化活性研究[D]. 聊城: 聊城大学, 2021 XIE Miao. Study on extraction, isolation, structural characterization and antioxidant activities of polysaccharides from Ganoderma lucidum[D]. Liaocheng: Liaocheng University, 2021.
[20] 吴杨洋. 灵芝多糖提取分离、结构表征及其抗氧化活性的比较研究[D]. 聊城: 聊城大学, 2020 WU Yangyang. Study on extraction, isolation, structural characterization and antioxidant activities of polysaccharides from Ganoderma lucidum[D]. Liaocheng: Liaocheng University, 2020.
[21] 王亚涛. 灵芝孢子粉多糖的分离纯化与结构鉴定[D]. 上海: 上海海洋大学, 2017 WANG Yatao. Isolation, purification and structure identification of polysaccharides from the spores of Ganoderma lucidum[D]. Shanghai: Shanghai Ocean University, 2017.
[22] QIAO Deliang, LIU Jun, KE Chunling, et al. Structural characterization of polysaccharides from Hyriopsis cumingii[J]. Carbohydrate Polymers,2010,82(4):1184−1190. doi: 10.1016/j.carbpol.2010.06.048
[23] SHANG Xiaolan, LIU Chunyu, DONG Haiyan, et al. Extraction, purification, structural characterization, and antioxidant activity of polysaccharides from wheat bran[J]. Journal of Molecular Structure, 2021: 1233.
[24] PAN Lichao, ZHU Yongming, ZHU Zhenyuan, et al. Chemical structure and effects of antioxidation and against α-glucosidase of natural polysaccharide from Glycyrrhiza inflata Batalin[J]. International Journal of Biological Macromolecules, 2020: 560−571.
[25] TANG Qilin, HUANG Gangliang, ZHAO Fengying, et al. The antioxidant activities of six (1→3)-β-D-glucan derivatives prepared from yeast cell wall[J]. International Journal of Biological Macromolecules, 2017: 216–221.
[26] 代嫚婷, 宋静, 余潇, 等. 海黄牡丹不同部位的成分分析、体外抗氧化能力及其α-葡萄糖苷酶、α-淀粉酶抑制能力[J/OL]. 食品与发酵工业: 1−11 [2022-10-02]. doi: 10.13995/j.cnki.11-1802/ts.033018 DAI Manting, SONG Jing, YU Xiao, et al. The phytochemical profiling, antioxidant capacity, α-glucosidase and α-amylase inhibition abilities of different parts of Paeonia suffruticosa 'Hai Huang'[J/OL]. Food and Fermentation Industries: 1−11[2022-10-02]. doi: 10.13995/j.cnki.11-1802/ts.033018.
[27] 熊双丽, 李安林. 酸性多糖的最新研究进展[J]. 食品科技,2010,35(5):80−83. [XIONG Shuangli, LI Anlin. Progress in acidic polysaccharide[J]. Food Science and Technology,2010,35(5):80−83. XIONG Shuangli, LI Anlin. Progress in acidic polysaccharide[J]. Food Science and Technology, 2010, 35(5): 80-83.
[28] 孔令义, 陈海生, 邱峰. 波谱解析[M]. 北京: 人民卫生出版社, 2011: 27 KONG Lingyi, CHEN Haisheng, QIU Feng. Spectral analysis[M]. Beijing: People's Medical Publishing House, 2011: 27.
[29] LI Qingyu, YANG Ying, JIA Linfei, et al. Purification, structural analysis and antifatigue assay of polysaccharide from castanea mollissima blume[J]. Journal of Food Science and Biotechnology,2013,31(21):191−194.
[30] 特列克·阿依恒别克, 赛福丁·阿不拉, 萨比热·热夏提, 等. 骆驼刺酸性多糖对小鼠脾脏淋巴细胞免疫增强作用的研究[J/OL]. 南京农业大学学报: 1−11[2022-10-01]. http://kns.cnki.net/kcms/detail/32.1148.s.20220330.0939.002.html TELIEKE A, SAIFUDING A, SABIRE R, et al. Study on the immunological enhancement effect of acidic Alhagi sparsifolia shap polysaccharide on spleen lymphocytes of mice[J/OL]. Journal of Nanjing Agricultural University: 1−11 [2022-10-01]. http://kns.cnki.net/kcms/detail/32.1148.s.20220330.0939.002.html
[31] 黄雅婷. 薄盖灵芝多糖的分离纯化、结构鉴定及抗肿瘤活性研究[D]. 广州: 广东药科大学, 2016 HUANG Yating. Isolation, purification, structural characterization and antitumor activity of polysaccharides from Ganoderma capense[D]. Guangzhou: Guangdong Pharmaceutical University, 2016.
[32] 霍光华, 李来生, 高荫榆. 波谱在多糖结构分析上的应用[J]. 生命的化学,2002(2):194−196. [HUO Guanghua, LI Laisheng, GAO Yinyu. Application of spectroscopy in structure analysis of polysaccharides[J]. Chemistry of Life,2002(2):194−196. doi: 10.3969/j.issn.1000-1336.2002.02.039 HUO Guanghua, LI Laisheng, GAO Yinyu. Application of spectroscopy in structure analysis of polysaccharides[J]. Chemistry of Life, 2002(2): 194-196. doi: 10.3969/j.issn.1000-1336.2002.02.039
[33] 张婷, 吴晖, 赖富饶, 等. 紫芝菌丝体多糖的结构鉴定及免疫活性研究[J]. 现代食品科技,2017,33(4):52−60,228. [ZHANG Ting, WU Hui, LAI Furao, et al. Characterization of the structure and immunomodulatory activities of polysaccharides from Ganoderma lucidum Mycelium[J]. Modern Food Science and Technology,2017,33(4):52−60,228. ZHANG Ting, WU Hui, LAI Furao, et al. Characterization of the structure and immunomodulatory activities of polysaccharides from Ganoderma lucidum Mycelium[J]. Modern Food Science and Technology, 2017, 33(4): 52-60, 228.
[34] LEE J S, SYNYTSYA A, KIM H B, et al. Purification, characterization and immunomodulating activity of a pectic polysaccharide isolated from Korean mulberry fruit oddi[J]. International Immunopharmacology,2013,17(3):858−866. doi: 10.1016/j.intimp.2013.09.019
[35] 颜梦秋. 紫芝胞壁多糖的分离纯化、结构鉴定及其免疫活性研究[D]. 上海: 上海海洋大学, 2019 YAN Mengqiu. Isolation, purification, structure elucidation and immunomodulatory activity of polysaccharides from the cell wall of Ganoderma sinense[D]. Shanghai: Shanghai Ocean University, 2019.
[36] 刘玉红, 王凤山. 核磁共振波谱法在多糖结构分析中的应用[J]. 食品与药品,2007(8):39−43. [LIU Yuhong, WANG Fengshan. Applications of nuclear magnetic resonance spectroscopy in structural analysis of polysaccharides[J]. Food and Drug,2007(8):39−43. LIU Yuhong, WANG Fengshan. Applications of nuclear magnetic resonance spectroscopy in structural analysis of polysaccharides[J]. Food and Drug, 2007(8): 39-43.
[37] 叶立斌, 张劲松, 潘迎捷. 食药用菌多糖结构解析中的核磁共振技术[J]. 食用菌学报,2007(4):68−75. [YE Libin, ZHANG Jinsong, PAN Yingjie. Nuclear magnetic resonance technology in the structure analysis of polysaccharides from edible and medicinal fungi[J]. Acta Edulis Fungi,2007(4):68−75. doi: 10.3969/j.issn.1005-9873.2007.04.014 YE Libin, ZHANG Jinsong, PAN Yingjie. Nuclear magnetic resonance technology in the structure analysis of polysaccharides from edible and medicinal fungi[J]. Acta Edulis Fungi, 2007(4): 68-75. doi: 10.3969/j.issn.1005-9873.2007.04.014
[38] RORT D, MONDAL S, CHAKRABORTY I, et al. Chemical analysis of a new (1→3)-, (1→6)-branched glucan from an edible mushroom, Pleurotus florida[J]. Carbohydr Res,2005,340:2533−2539. doi: 10.1016/j.carres.2005.08.006
[39] WU Mengqi, LI Wei, ZHANG Yilin, et al. Structure characteristics, hypoglycemic and immunomodulatory activities of pectic polysac-charides from Rosa setate x Rosa rugosa waste[J]. Carbohydrate Polymers,2021,53:117190.
[40] 屈咪, 朱雨燕, 周英骏, 等. 黑木耳多糖的消化产物对免疫功能的影响[J]. 食品科技,2021,46(4):149−154. [QU Mi, ZHU Yuyan, ZHOU Yingjun, et al. Effects of digestive products from Auricularia auricula polysaccharides on immune function[J]. Food Science and Technology,2021,46(4):149−154. QU Mi, ZHU Yuyan, ZHOU Yingjun, et al. Effects of digestive products from Auricularia auricula polysaccharides on immune function[J]. Food Science and Technology, 2021, 46(4): 149-154.
[41] ZHENG Tingting, GU Dahai, WANG Xuefeng, et al. Purification, characterization and immunomodulatory activity of polysaccharides from Leccinum crocipodium (Letellier.) Watliag[J]. International Journal of Biological Macromolecules, 2020, 148(C).
[42] 袁琪, 文红梅, 张前程, 等. 苓桂术甘汤中多糖结构组成及其抗氧化活性考察[J]. 中国试验方剂学杂志,2020,26(16):63−70. [YUAN Qi, WEN Hongmei, ZHANG Qiancheng, et al. Characterization and antioxidant activities of polysaccharid isolated from Linggui Zhugan Tang[J]. Chinese Journal of Experimental Traditional Medical Formulae,2020,26(16):63−70. YUAN Qi, WEN Hongmei, ZHANG Qiancheng, et al. Characterization and antioxidant activities of polysaccharid isolated from Linggui Zhugan Tang[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(16): 63-70.
[43] 王波. 灵芝多糖提取、分离纯化、表征及体外抗氧化活性探究[D]. 郑州: 郑州大学, 2016 WANG Bo. Extraction, isolation, purification, characterization and in vitro antioxidant activity of polysaccharide from Ganoderma lucidum[D]. Zhengzhou: Zhengzhou University, 2016.
[44] 郑丹. 灵芝多糖和灵芝几丁质的分离提取及理化性质的研究[D]. 杭州: 浙江工业大学, 2009 ZHENG Dan. Physicochemical properties and extraction study of the polysaccharide and chitin from Ganoderma lucidum[D]. Hangzhou: Zhejiang University of Technology, 2009.
[45] 刘宇琪, 郝利民, 鲁吉珂, 等. 灵芝子实体和孢子粉纯化多糖体外抗氧化活性研究[J]. 食品工业科技,2019,40(16):27−31. [LIU Yuqi, HAO Limin, LU Jike, et al. Antioxidant activities of Ganoderma lucidum fruit body and spore powder polysaccharide in vitro[J]. Science and Technology of Food Industry,2019,40(16):27−31. LIU Yuqi, HAO Limin, LU Jike, et al. Antioxidant activities of Ganoderma lucidum fruit body and spore powder polysaccharide in vitro[J]. Science and Technology of Food Industry, 2019, 40(16): 27-31.
-
期刊类型引用(11)
1. 林烨欣,阎光宇,王雅茹,方华,陈晖,洪专. 蛹虫草可溶性β-葡聚糖的分离纯化、结构表征及降血糖活性. 食品工业科技. 2025(02): 55-63 .  本站查看
本站查看
2. 逄梦玉,隋昕怡,刘丹,刘养山,任洪飞,张景,杜秀菊. 酿酒酵母发酵法制备桑黄多糖工艺优化及其结构表征和抗氧化活性研究. 天然产物研究与开发. 2025(01): 85-94 .  百度学术
百度学术
3. 刘丹,任洪飞,逄梦玉,隋昕怡,杜秀菊. 灵芝多糖的分离纯化、结构表征和抗氧化活性研究. 粮食与油脂. 2025(03): 81-86+101 .  百度学术
百度学术
4. 钱一雯,薛珺瑜,钱诗雨,胡业鸿,方志军. 补气类中药多糖对动物结肠癌细胞作用的研究进展. 中国民族民间医药. 2024(01): 67-72 .  百度学术
百度学术
5. 任洪飞,逄梦玉,隋昕怡,刘丹,杨飞燕,刘养山,张景,杜秀菊. 反复冻融法制备灵芝多糖工艺优化、结构表征及抗氧化活性分析. 食品工业科技. 2024(08): 11-20 .  本站查看
本站查看
6. 赵艺方,张清海,向准. 黔产黑灵芝多糖提取工艺优化及抗氧化活性的研究. 食品科技. 2024(03): 217-225 .  百度学术
百度学术
7. 逄梦玉,隋昕怡,刘丹,任洪飞,刘养山,张景,杜秀菊. 桑黄多糖提取工艺优化、结构表征及抗氧化活性研究. 食品安全质量检测学报. 2024(12): 48-57 .  百度学术
百度学术
8. 余香霖,张赫男,谭贻,刘艳芳,周帅,冯杰,张劲松,唐传红. 高多糖含量灵芝新品种‘沪农灵芝4号’选育. 食用菌学报. 2024(04): 55-63 .  百度学术
百度学术
9. 隋昕怡,逄梦玉,刘丹,任洪飞,杜秀菊. 超声辅助低共熔溶剂法提取蛹虫草多糖工艺优化及其抗氧化活性研究. 粮食与油脂. 2024(09): 92-96+113 .  百度学术
百度学术
10. 梁诗洋,张鹰,曾晓房,许佳木,林海滨,白卫东. 梅卤中多糖的分离纯化及其结构的初步解析. 粮食与油脂. 2023(09): 111-115+122 .  百度学术
百度学术
11. 张宝杰,郑彧,刘美奇,曹媛,娄佳悦,曲扬. 山楂生、炒品果胶结构表征和体外降脂作用研究. 食品安全质量检测学报. 2023(21): 253-262 .  百度学术
百度学术
其他类型引用(4)









 下载:
下载:
 下载:
下载:



