Preparation of Low-molecular-weight Enteromorpha Polysaccharides by Microwave-assisted Degradation with H2O2/VC
-
摘要: 为制备抗氧化活性较强的低分子量多糖,以辽宁营口沿海地区的浒苔为原料,采用微波辅助H2O2/VC降解法制备低分子量浒苔多糖,利用DEAE-52、Sephadex G-100进行层析分离,对比浒苔多糖降解前后的理化性质与抗氧化活性,通过红外光谱法对降解后的浒苔多糖进行结构表征,利用薄层层析、高效液相色谱对分离到的多糖LEPⅢa组分进行单糖组成分析。结果表明,利用微波辅助H2O2/VC降解可在较短时间(15 min)降解得到低分子量的浒苔多糖,经层析分离后,得到3种低分子量浒苔多糖LEPⅠ、LEPⅡ、LEPⅢa,分子量Mw分别为(23.6±0.5)、(24.6±0.6)、(22.9±0.5)kDa。与未降解的浒苔多糖相比,微波辅助H2O2/VC降解得到的低分子量多糖的分子量、粘度均显著降低(P<0.05);抗氧化活性显著增强(P<0.05)。降解产物的分子量均在30 kDa以下,粘度在2 mPa.s以下;8 mg/mL LEPⅢa的总抗氧化能力由降解前的(315.2±10.3)U/mL增加到(661.8±18.3)U/mL,铁离子还原能力由降解前的51.3%±1.0%增加到83.4%±2.2%。LEPⅢa的红外光谱结果表明其为一种硫酸多糖,硫酸基含量14.6%±0.5%;薄层层析结合高效液相色谱分析表明LEPⅢa是一种由葡萄糖、鼠李糖、糖醛酸等组成的含硫酸基团低分子量多糖,D-(+)-甘露糖、L-(+)-鼠李糖、D-葡糖醛酸、D-(+)-葡萄糖的摩尔比为0.97:4.43:3.13:24.8。本研究表明,利用微波辅助H2O2/VC降解制备低分子量浒苔多糖,能够明显改善多糖的理化性质,显著提高其抗氧化能力,制备的多糖可以作为功能性成分用于抗氧化相关的功能食品和保健品的开发。Abstract: In order to prepare low-molecular-weight polysaccharides with high antioxidant activity, low-molecular-weight Enteromorpha polysaccharides were prepared by the method of microwave-assisted H2O2/VC degradation using Entermorpha prolifera from the coastal area of Yingkou, Liaoning Province as raw materials. In the present thesis, DEAE-52 and Sephadex G-100 were used for chromatography separation and physicochemical properties and antioxidant activity of Enteromorpha polysaccharide were compared before and after degradation. Then structural characterization of the degraded Enteromorpha polysaccharide was obtained by infrared spectroscopy, and monosaccharide composition of LEPⅢa (obtained by separation) was analyzed by thin layer chromatography (TLC) and high performance liquid chromatography (HPLC). Results showed that low-molecular-weight Entermorpha polysaccharide could be prepared in a short time (15 min) by microwave-assisted degradation with H2O2/VC and three kinds of low-molecular-weight Entermorpha polysaccharide LEPⅠ, LEPⅡ and LEPⅢa with Mw being (23.6±0.5), (24.6±0.6) and (22.9±0.5) kDa respectively were obtained by chromatographic separation. Compared with untreated Enteromorpha polysaccharide, low-molecular-weight polysaccharide obtained by microwave-assisted H2O2/VC degradation were significantly reduced (P<0.05). The antioxidant activity was significantly enhanced (P<0.05). Molecular weight of the degradation products was lower than 30 kDa, with viscosity lower than 2 mPa·s. The total antioxidant capacity of LEPⅢa with a concentration of 8 mg/mL increased from (315.2±10.3) U/mL to (661.8±18.3) U/mL, and reducing capacity of ferric ion increased from 51.3%±1.0% to 83.4%±2.2% after degradation. Infrared spectroscopy of LEPⅢa showed that LEPⅢa was a kind of sulphated polysaccharide with sulfate accounting for 14.6%±0.5%. TLC and HPLC analysis showed that LEPⅢa was a low-molecular-weight polysaccharide containing sulfuric acid group, composed of glucose, rhamnose, uronic acid, etc., with molar ratio of D-(+)-mannose, L-(+)-rhamnose, D-glucuronic acid and D-(+)-glucose being 0.97:4.43:3.13:24.8. Thus, the present thesis concluded that microwave-assisted degradation with H2O2/VC used to prepare low-molecular-weight Enteromorpha polysaccharides could significantly improve physicochemical properties and antioxidant capacity of polysaccharide, and the prepared Enteromorpha polysaccharides could be used as a functional component in antioxidant-related functional foods and health care products.
-
近年来,我国辽宁营口沿海地区的藻类繁殖活动中经常出现石莼属(Ulva)绿藻[1],被鉴定为浒苔(Enteromorpha prolifera)。浒苔是一类重要的食用和药用经济海藻[2],在本草书中记载其具有清热解毒、利水消肿等功效[3],其富含碳水化合物、矿物质、粗纤维及少量蛋白质和脂肪[4],浒苔多糖(Enteromorpha polysaccharide,EP)是其细胞壁主要活性成分,其主要由硫酸化的鼠李糖、糖醛酸和木糖组成[5]。近年来,已被广泛报道其具有抗癌[6]、抗氧化[7]、降血脂[8]、降血糖[9-10]和免疫调节活性[11],成为国内外藻类多糖研究的热点[12]。
目前,可通过酶水解、酸水解和氧化降解等方法获得低分子量浒苔多糖[13]。酶水解对多糖链中糖苷键的断裂具有很高的特异性,无法用于产业化开发。酸水解和氧化降解,需要较高的浓度或较长的反应时间,导致糖单元结构的改变,破坏必要的生物活性基团[14]。目前,微波辅助提取技术已成功用于海藻多糖生物活性化合物的提取[15]。Le等[16]采用微波辅助技术,对绿藻孔石莼(Ulva pertusa)多糖的提取工艺进行了响应面法优化,并评价了其抗氧化活性。杨君等[17]对微波提取裂片石莼(Ulva fasciata)多糖的工艺进行优化,多糖提取率达到16.37%。
H2O2/VC氧化降解是一种可控性强、环境友好的获得低分子量多糖的方法[18]。H2O2分解产生的羟自由基氧化断裂多糖间糖苷键,低浓度VC的加入可增加自由基的数量,多糖的降解速率明显提高[19]。谭诗敏等[20]采用H2O2/VC体系降解香水莲花多糖,发现降解时间为60 min的低分子量多糖抗氧化活性更高。Wu等[21]利用H2O2/VC对马尾藻科Sargassum crassifolium中的岩藻多糖进行了降解,产物低分子量岩藻多糖显示出较强的人肺癌A-549细胞凋亡作用,提示其具有较强的自由基清除能力。
微波辅助H2O2/VC法降解多糖,操作简便、短时高效、无毒无害、降解效果较好,吸引了越来越多的学者的关注。刘欢[22]利用微波辅助H2O2/VC降解法,探究舌状蜈蚣藻(Grateloupia livida)多糖的最佳工艺条件,评价降解多糖的体外抗氧化能力,得到抗氧化能力较强的降解多糖。目前有关H2O2/VC降解法制备低分子量浒苔多糖(low-molecular-weight Enteromorpha polysaccharide,LEP)鲜有报道。本研究以辽宁营口沿海地区绿藻浒苔为原料,探索了微波辅助H2O2/VC降解法制备LPE的抗氧化能力,分离、表征与组分鉴定方法,以期建立一种快速、节能、环保的海洋藻类低分子量抗氧化活性多糖提取方法,为低分子量浒苔多糖的应用研究提供理论支撑。
1. 材料与方法
1.1 材料与仪器
浒苔(Enteromorpha prolifera) 2021年8月采自辽宁营口鲅鱼圈附近海域。自来水洗净,60 ℃烘干至恒重,高速多功能粉碎机粉碎,过100目筛得浒苔粉;木瓜蛋白酶(8000 U/mg) 索莱宝生物科技有限公司;透析膜(截留分子量5 kDa) Spectrum化学(上海)有限公司;DEAE纤维素52 北京索莱宝科技有限公司;葡聚糖标准品(5、25、50、80、150、410、1500 kDa) 美国Sigma公司;单糖标准品(L-(+)-鼠李糖、D-(+)-木糖、D-(-)-果糖、D-(+)-甘露糖、D-(+)-葡萄糖、D-(+)-半乳糖、D-(+)-半乳糖醛酸、D-葡萄糖醛酸) 美国Sigm-Aldrich有限公司;三氟乙酸(HPLC≥99.5%) Macklin(上海)生化科技有限公司;1-苯基-3-甲基-5-吡唑啉酮 国药集团化学试剂有限公司;总抗氧化能力(T-AOC)检测试剂盒 南京建成生物工程研究所有限公司;其他试剂均为国产分析纯。
特制普通玻璃层析柱(Φ1.6 cm×40 cm) 上海沪西分析仪器厂有限公司;TSK-GEL 4000PWXL凝胶色谱柱(Φ7.8 mm×300 mm) 日本Tosoh公司;LC1260Ⅱ高效液相色谱仪 美国Agilent科技公司;UV-5800PC紫外可见分光光度计 上海元析仪器有限公司;ALPHA 2-4LD冷冻干燥机 德国CHRIST公司;MCR101高级旋转流变仪 德国Anton Paar公司;DZF-6050真空干燥箱 上海一恒科学仪器有限公司;Nicolet Nexus 5DXC FT-IR红外光谱扫描仪 美国Nicolet公司;TG16-WS数显高速离心机 长沙湘仪离心机仪器有限公司; UNIC7200 型可见分光光度计 尤尼柯(上海)仪器有限公司;JA5003电子分析天平 上海舜宇恒平科学仪器有限公司;HH-6型数显恒温水浴锅 常州国华电器有限公司。
1.2 实验方法
1.2.1 低分子量浒苔多糖(LEP)的制备
取一定量磨碎过筛的浒苔粉,加入20倍体积无水乙醇,75 ℃回流萃取2 h,除去脂类、黄酮、多酚等醇溶性杂质,冷却后过滤、干燥得脱脂除杂浒苔粉。取10 g脱脂浒苔粉,加入500 mL去离子水,充分混匀,置于微波反应器密闭容器中,500 W功率80 ℃辅助提取15 min。将提取液离心,减压浓缩至100 mL,加入400 mL 95%乙醇,4 ℃静置过夜。4000 r/min离心10 min,将沉淀溶于200 mL去离子水中,加入3%(W/V)木瓜蛋白酶,调节pH6.5,50 ℃水解1 h除去蛋白杂质,酶解液用4倍体积的95%乙醇沉淀,4000 r/min离心10 min,将沉淀再次溶于100 mL去离子水中,加入20 mL氯仿和4 mL正丁醇进一步去除游离蛋白质,将水相溶液浓缩冻干,得到白色粉末状浒苔粗多糖(EP)。采用文献[22]的方法稍加改动,将提取的EP溶于200 mL去离子水中,分别加入0.2 mL 30% H2O2和2 mL 1 mol/L VC溶液,混匀后,置于微波反应器密闭容器中,使用磁力搅拌器搅拌,500 W功率55 ℃辅助降解15 min,所得溶液去离子水透析过夜、冻干,得到低分子量浒苔多糖(LEP)。根据公式计算多糖得率[23]。以牛血清白蛋白为标准,采用Bradford法[24]测定蛋白质含量。
X (\text{%})=mM×100 式中:X表示多糖得率,%;m表示冻干后多糖质量,g;M表示脱脂浒苔粉质量,g。
1.2.2 LEP的分离纯化
采用文献[25-26]的方法,利用DEAE-52、Sephadex G-100对LEP进行层析分离。将1 g LEP溶于20 mL去离子水,注入经去离子水平衡的DEAE-52层析柱中,上样后,用去离子水洗脱柱,流速6 mL/5 min/管,然后分别用0.1、0.5、1.0 mol/L NaCl溶液逐步洗脱,收集多糖组分,苯酚-硫酸法结合醋酸纤维素薄膜电泳[27]进行检测,将非单一组分浓缩,经Sephadex G-100凝胶层析,以去离子水洗脱进一步分离,将所得各单一组分冻干。
1.2.3 LEP理化性质测定
1.2.3.1 分子量测定
多糖的分子量测定采用文献[28]的高效凝胶渗透色谱法(HPGPC),稍加改动。经0.22 µm滤膜过滤的0.1 mol/L NaNO3为流动相,流速1.0 mL/min,将10 mg样品溶于10 mL去离子水,经0.45 µm微孔过滤,柱温30 ℃,进样量15 µL。用Mw分别为5、25、50、80、150、410、1500 kDa的葡聚糖标准品进行标定,计算LEP各组分的分子量。
1.2.3.2 硫酸根含量测定
硫酸根含量采用Dodgson等[29]的BaCl2-凝胶法进行测定。
1.2.3.3 粘度测定
将分离出的LEP各组分去离子水配成10 mg/mL溶液,利用旋转流变仪测定粘度。
1.2.4 LEP的抗氧化活性测定
1.2.4.1 LEP总抗氧化能力测定
取0.1、0.2、0.4、0.8、1.0 g不同组分的LEP样品与未降解的EP样品,分别加入到100 mL去离子水中,混匀后得不同浓度(1、2、4、8、10 mg/mL)的样品液,以对应浓度的VC为阳性对照。采用T-AOC试剂盒测定各样品液的总抗氧化能力。
1.2.4.2 LEP铁离子还原能力测定
吸取1 mL上述不同组分不同浓度的样品液,加入同体积0.2 mol/L pH6.6的磷酸缓冲液和1%六氰合铁酸钾,50 ℃反应20 min,再加入同样体积的10%三氯乙酸终止反应,取2 mL反应液加入2 mL蒸馏水和0.4 mL 0.1% FeCl3溶液,室温反应10 min,700 nm处测定吸光度。以对应浓度的VC为阳性对照。结果以样品与对应浓度VC的吸光度百分比表示。
1.2.5 LEP紫外光谱和红外光谱分析
配制1 mg/mL的LEP溶液,在190~400 nm波长区间,利用紫外可见分光光度计进行紫外区扫描。2 mg LEP干燥样品与200 mg干燥KBr混合,压片,利用红外光谱仪测定LEP在波数4000~400 cm−1区间的红外吸收光谱。
1.2.6 LEP单糖组成的薄层层析
称取20 mg LEP样品于20 mL西林瓶中,加入2 mL 2 mol/L H2SO4,100 ℃水解6 h,2.5 mol/L NaOH调至pH7.0,去离子水稀释至5 mL作为LEP样品水解液。参照Johansson等[30]的方法,取活化的硅胶G薄板,在据底边1.5 cm水平线上分别点1%的单糖标准品溶液和LEP样品水解液各5 μL,以氯仿/冰乙酸/水(30:35:5,V/V/V)为展层剂,苯胺-二苯胺-磷酸为显色剂,对各种单糖标准品和LEP样品水解液进行显色,比较色斑颜色及Rf值,对LEP样品水解液中的单糖组成进行鉴定。
1.2.7 LEP单糖组成的HPLC分析
5 mg LEP样品加入5 mL三氟乙酸,在121 ℃下密封水解2 h,参照文献[31]的方法,将水解液用1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生处理,反相高效液相色谱法分析其单糖组成。流动相:0.1 mol/L pH6.9磷酸盐缓冲液/乙腈(20:80,V/V),以乳糖作为内标物,检测器为示差折光检测器,柱温25 ℃,进样量为5 μL。利用峰面积计算各单糖组分的摩尔比。单糖标准品甘露糖(Man)、鼠李糖(Rha)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)采用相同的方法进行分析检测。
1.3 数据处理
所有实验均进行三次重复,结果以平均值±标准差表示。利用Excel、SPSS22.0等进行数据的处理和分析,采用Origin 2021绘图。
2. 结果与分析
2.1 LEP的化学成分分析
浒苔粉经过预处理除杂、多糖提取、酶结合Sevag法脱蛋白、微波辅助H2O2/VC降解、透析、浓缩及冷冻干燥后,质地比较膨松,便于后续溶解操作。实验中得白色低分子量浒苔粗多糖1.17±0.05 g,多糖得率为11.7%±0.5%,蛋白质含量为0.65%±0.3%。
2.2 LEP的层析分离纯化
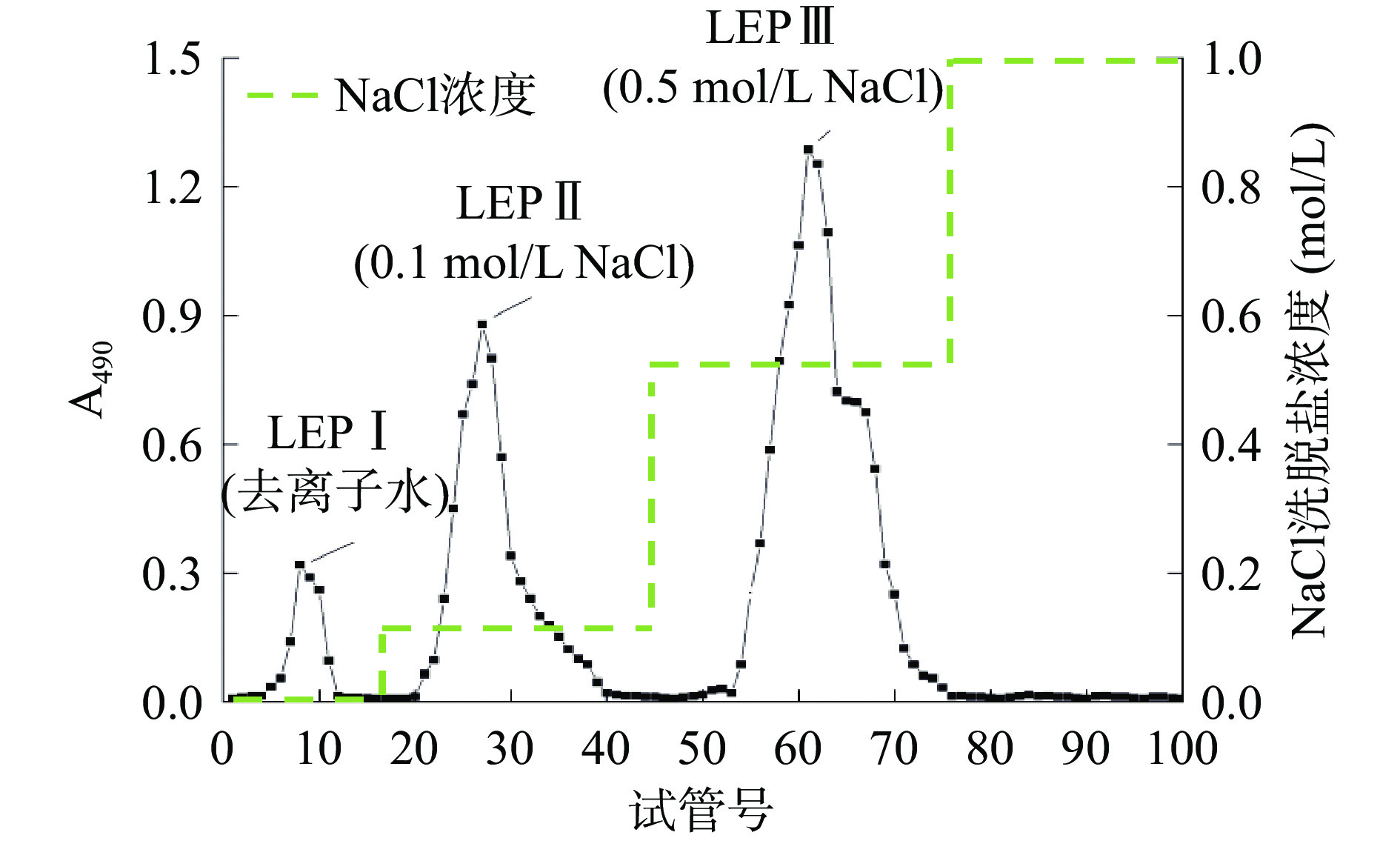
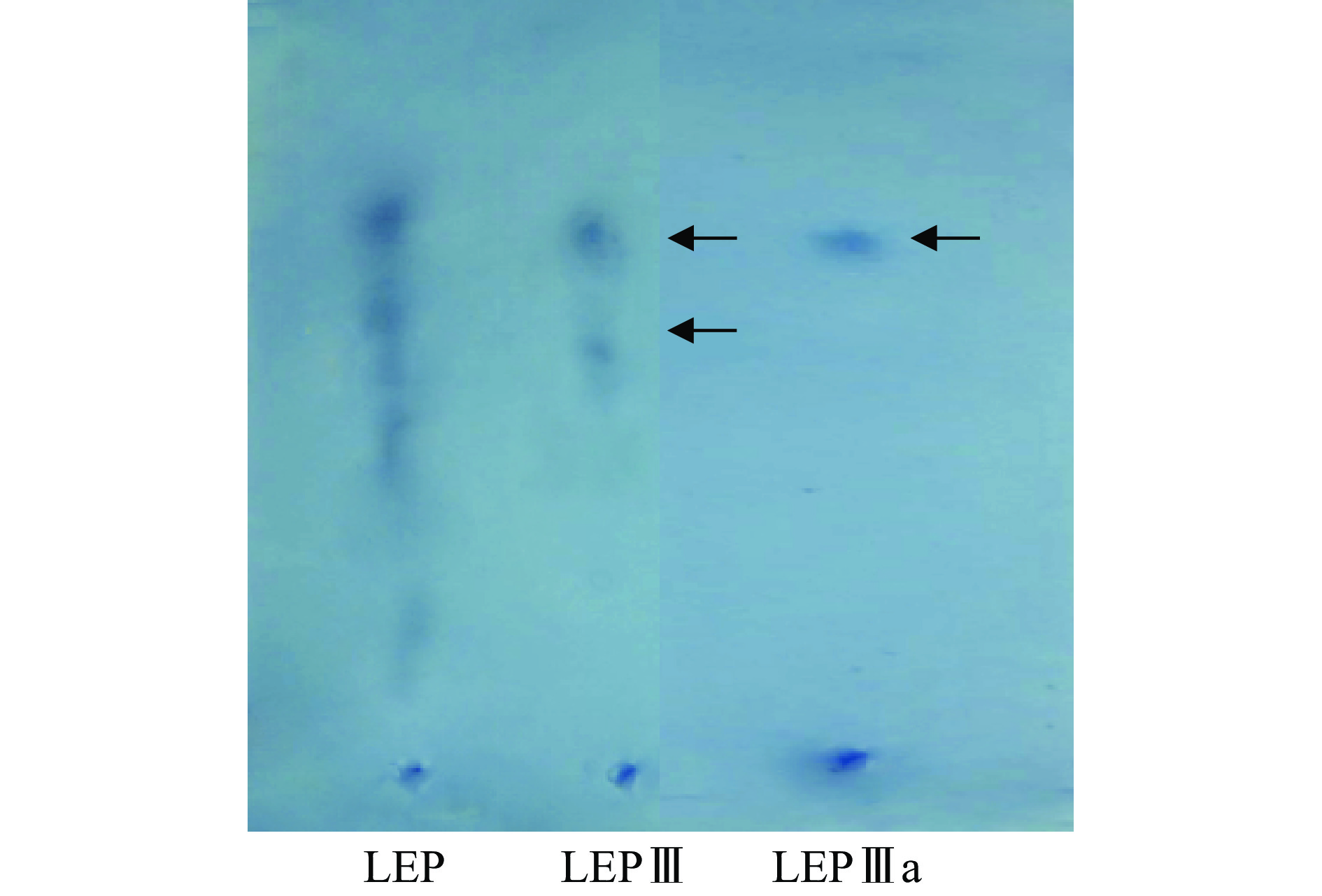
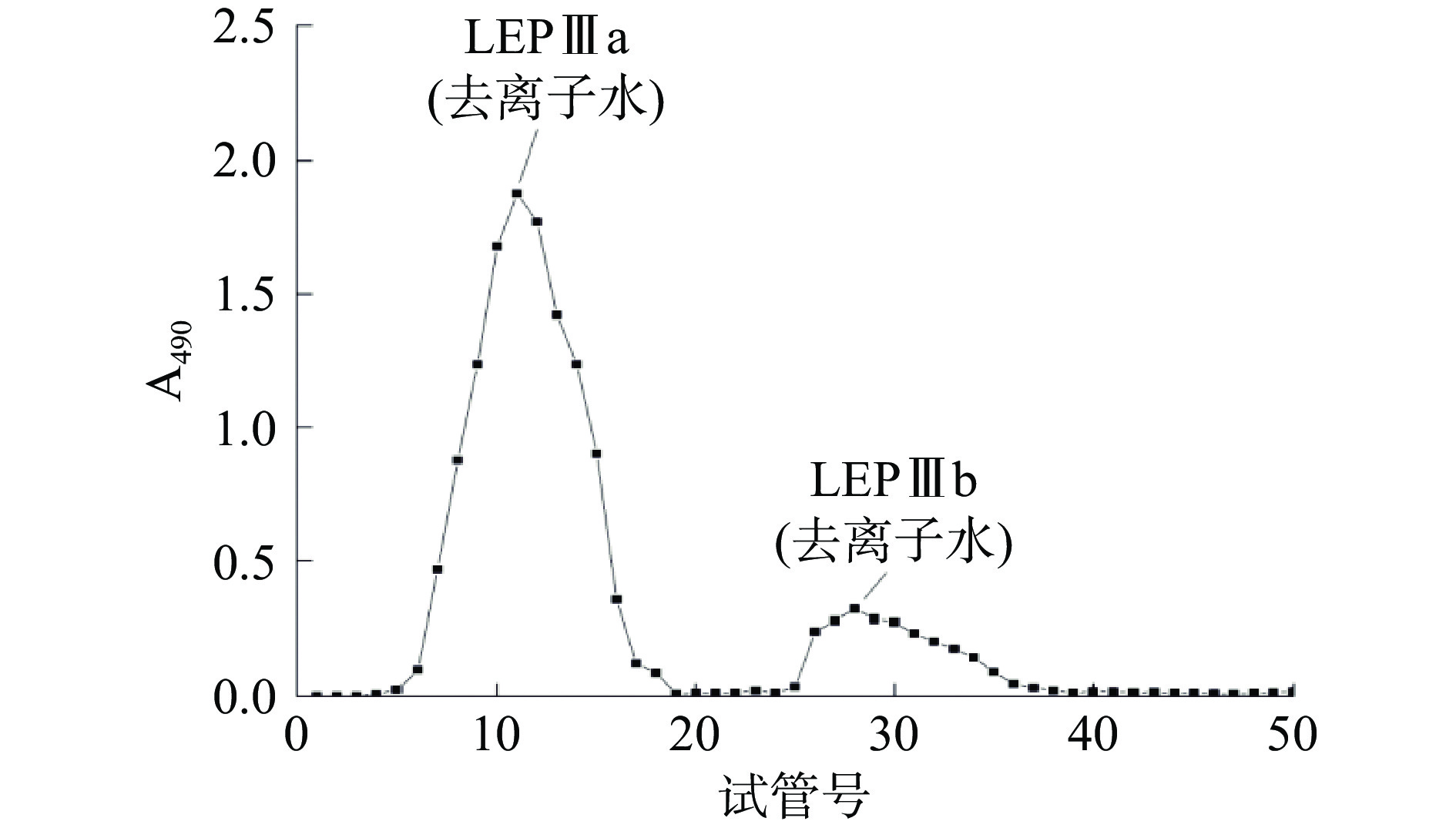
LEP经DEAE-52柱层析的洗脱曲线如图1所示。从图1可知,LEP经不同离子强度的溶液洗脱后,共出现3个洗脱峰,分别编号为LEPⅠ、LEPⅡ、LEPⅢ,对应洗脱液分别为去离子水、0.1 mol/L、0.5 mol/L NaCl,在0.5 mol/L NaCl洗脱阶段出现了多糖含量相对较高的峰(LEPⅢ),收集、浓缩各含糖峰位的组分,测定多糖含量依次为0.095±0.005、0.304±0.003、0.598±0.028 g/g LEP。进一步观察发现LEPⅢ多糖组分的分离效果较差。LEPⅢ经过醋酸纤维素薄膜电泳分析(图2),发现不是单一组分,经Sephadex G-100凝胶柱层析进一步纯化,结果如图3所示。从图3中可以看出:LEPⅢ经过Sephadex G-100凝胶柱层析,利用去离子水洗脱,分离得到了两个峰,即LEPⅢa和LEPⅢb,多糖含量分别为0.542±0.022和0.056±0.002 g/g LEP,由于LEPⅢb含糖量较低,所以未作研究。合并LEPⅢa主峰的洗脱液,浓缩冻干,所得低分子量浒苔多糖LEPⅢa为白色粉末状,经测定多糖得率为6.3%±0.3%。
2.3 LEP理化性质分析
浒苔多糖不同组分的得率、理化性质见表1。随着粗多糖的降解与分离,多糖得率呈降低趋势,通过离子交换、凝胶过滤两步纯化,得到两种主要的得率较高的单糖组分LEPⅡ、LEPⅢa,其中LEPⅢa单一组分多糖得率为6.3%±0.3%。浒苔多糖经降解后,分离到的组分(LEPⅠ、LEPⅡ、LEPⅢa)的Mw、硫酸根含量、粘度相差均不大,分别在22.9~24.6 kDa、13.8%~14.6%、1.5~1.6 mPa·s之间。有文献报道Mw和粘度会影响多糖及其金属离子配合物的生物抗氧化活性,相对较高的分子量会在一定程度上降低其溶解度,从而限制其有效吸收[32]。采用微波辅助H2O2降解法制备得到的产物Mw均在30 kDa以下,粘度在2 mPa·s以下,多糖的粘度与分子量呈现出一定的正相关性。低分子量硫酸多糖更容易通过质子供体作用进入细胞内而发挥其功效,比高分子量的硫酸多糖具有更强的抗氧化活性[33]。
表 1 浒苔多糖不同组分的得率、理化性质Table 1. Yield and physicochemical properties of varied components of Entermorpha polysaccharides样品 多糖得率
(%)重均分子量Mw
(kDa)硫酸根含量
(%)粘度
(mPa·s)EP 13.5±0.5e 1276.4±14.1b 14.2±0.3a 364.5±3.4b LEP 11.7±0.5d 23.8±0.5a 15.1±0.4a 1.8±0.1a LEPⅠ 1.1±0.1a 23.6±0.5a 14.2±0.3a 1.5±0.1a LEPⅡ 3.6±0.1b 24.6±0.6a 13.8±0.3a 1.6±0.1a LEPⅢa 6.3±0.3c 22.9±0.5a 14.6±0.5a 1.5±0.1a 注:同一列中不同字母表示有显著差异(P<0.05)。 2.4 LEP的抗氧化能力分析
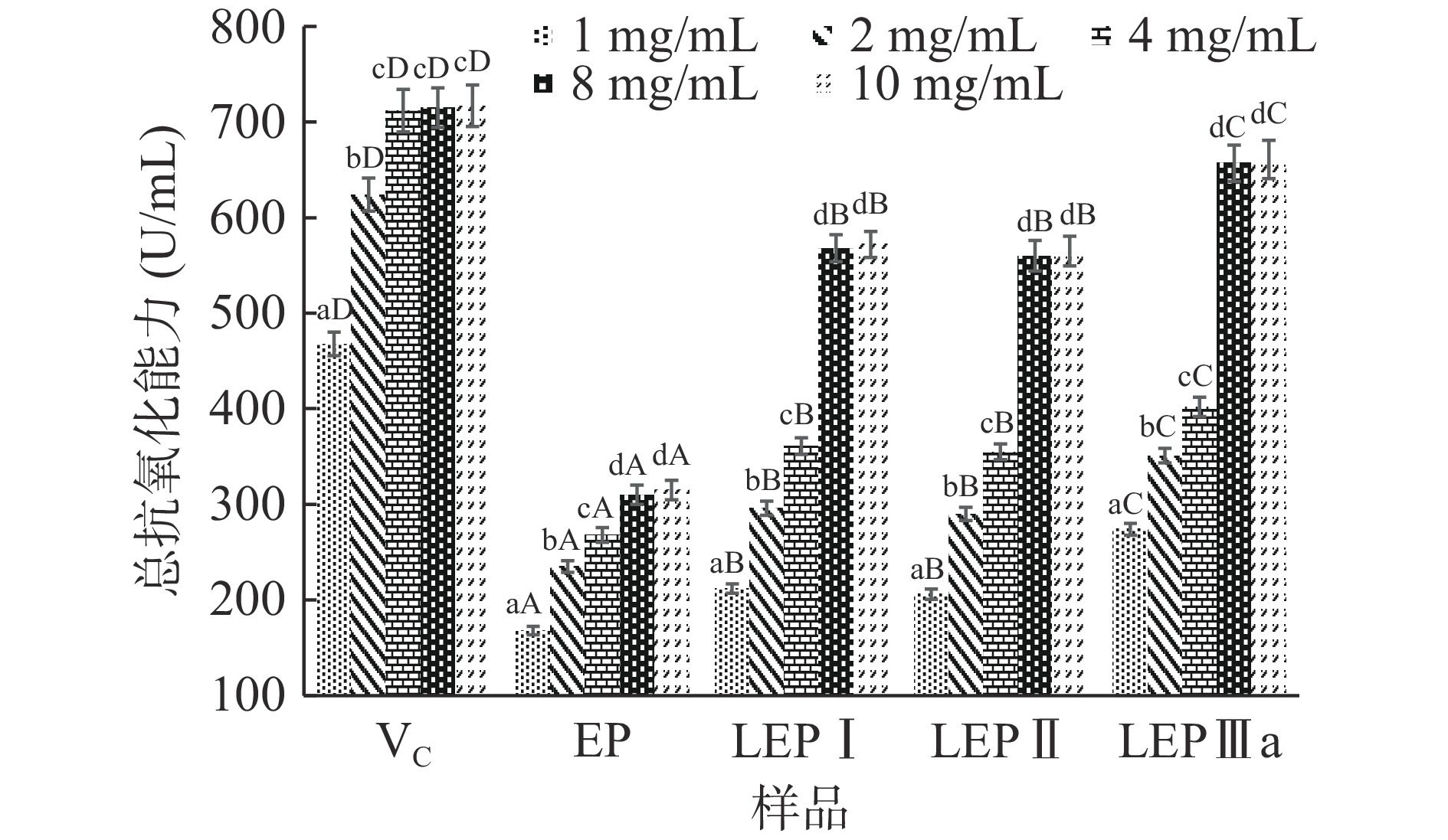
微波辅助H2O2/VC降解法制备的LEP各组分的总抗氧化能力、铁离子还原能力如图4、图5所示。由图可知,在相同的多糖浓度下,EP降解后各组分多糖的总抗氧化能力、铁离子还原能力相比降解前显著增强(P<0.05),同时,LEPⅢa组分显示出相对较高的抗氧化能力,其与LEPⅠ、LEPⅡ两种组分之间存在显著性差异(P<0.05)。同一多糖组分,总抗氧化能力、铁离子还原能力随着浓度的升高而增强,在浓度8 mg/mL以后趋于稳定,此时 LEPⅢa的总抗氧化能力由降解前的(315.2±10.3)U/mL增加到(661.8±18.3)U/mL,高于2 mg/mL VC的总抗氧化能力(624.5±17.3)U/mL。铁离子还原能力由降解前的51.3%±1.0%增加到83.4%±2.2%,与此同时,相同浓度下LEPⅠ与LEPⅡ组分的铁离子还原能力分别为74.2%±1.6%和70.2%±1.3%。LEP的铁离子还原能力表现出与总抗氧化能力相同的趋势。多糖的抗氧化活性受分子量、分支结构以及空间结构的影响很大[34]。结合表1中相关数据,发现EP经H2O2/VC氧化降解后,多糖组分的硫酸根含量几乎未发生变化(P>0.05),说明粗多糖EP含有硫酸根的部分不易被降解,可以得到硫酸根含量稳定的低分子量片段。与此同时,分子量由(1276.4±14.1) kDa下降到30 kDa以下,粘度由(364.5±3.4) mPa·s降至2 mPa.s以下。结合EP降解前后理化性质的变化与抗氧化活性的关系,推测分子量和粘度是影响浒苔多糖抗氧化能力的重要因素。VC具有可解离出氢离子的烯醇式羟基,通过逐级供给电子而转变成半脱氢抗坏血酸和脱氢抗坏血酸以实现清除活性氧自由基达到抗氧化的目的。在EP的H2O2/VC降解体系中,羟基自由基是一种强大的反应物,可与植物细胞壁上多糖的氢发生反应,导致特定糖苷键发生断裂,EP大分子的空间网络结构发生解聚,使其分子结构中暴露出大量的包括羟基在内的供电子活性基团,使多糖水解产物的抗氧化活性增强。这与Khan等[35]报道的江蓠(Gracilaria blodgettii)硫酸多糖的抗氧化活性可以通过水解而增强的结果一致。同时,多糖的粘度随着分子间氢键的破坏与主碳链的降解而迅速降低,消除了高粘度对多糖组分扩散与吸收的不利影响,大大提高了LEP的生物利用率与活性。此外,在分子量、粘度与硫酸根含量无显著差异的情况下,LEPⅢa组分相比LEPⅠ与LEPⅡ表现出更强的抗氧化能力,推测其与糖链的单糖组成有关,因此在后续的色谱分析中,我们对LEPⅢa组分进行了进一步鉴定。
![]() 图 4 微波辅助H2O2/VC降解对EP总抗氧化能力的影响注:图中不同小写字母代表同一组分不同浓度间总抗氧化性差异显著(P<0.05);不同大写字母代表同一浓度不同组分间总抗氧化性差异显著(P<0.05);图5同。Figure 4. Effect of microwave-assisted H2O2/VC degradation on total antioxidant capacity of EP
图 4 微波辅助H2O2/VC降解对EP总抗氧化能力的影响注:图中不同小写字母代表同一组分不同浓度间总抗氧化性差异显著(P<0.05);不同大写字母代表同一浓度不同组分间总抗氧化性差异显著(P<0.05);图5同。Figure 4. Effect of microwave-assisted H2O2/VC degradation on total antioxidant capacity of EP2.5 LEPIIIa光谱分析
对LEPIIIa进行了190~400 nm波长区间紫外光谱扫描,结果见图6。从图6中可以看出,在260~280 nm范围内未发现有吸收峰,说明经过木瓜蛋白酶结合Sevag法复合脱蛋白效果较好。
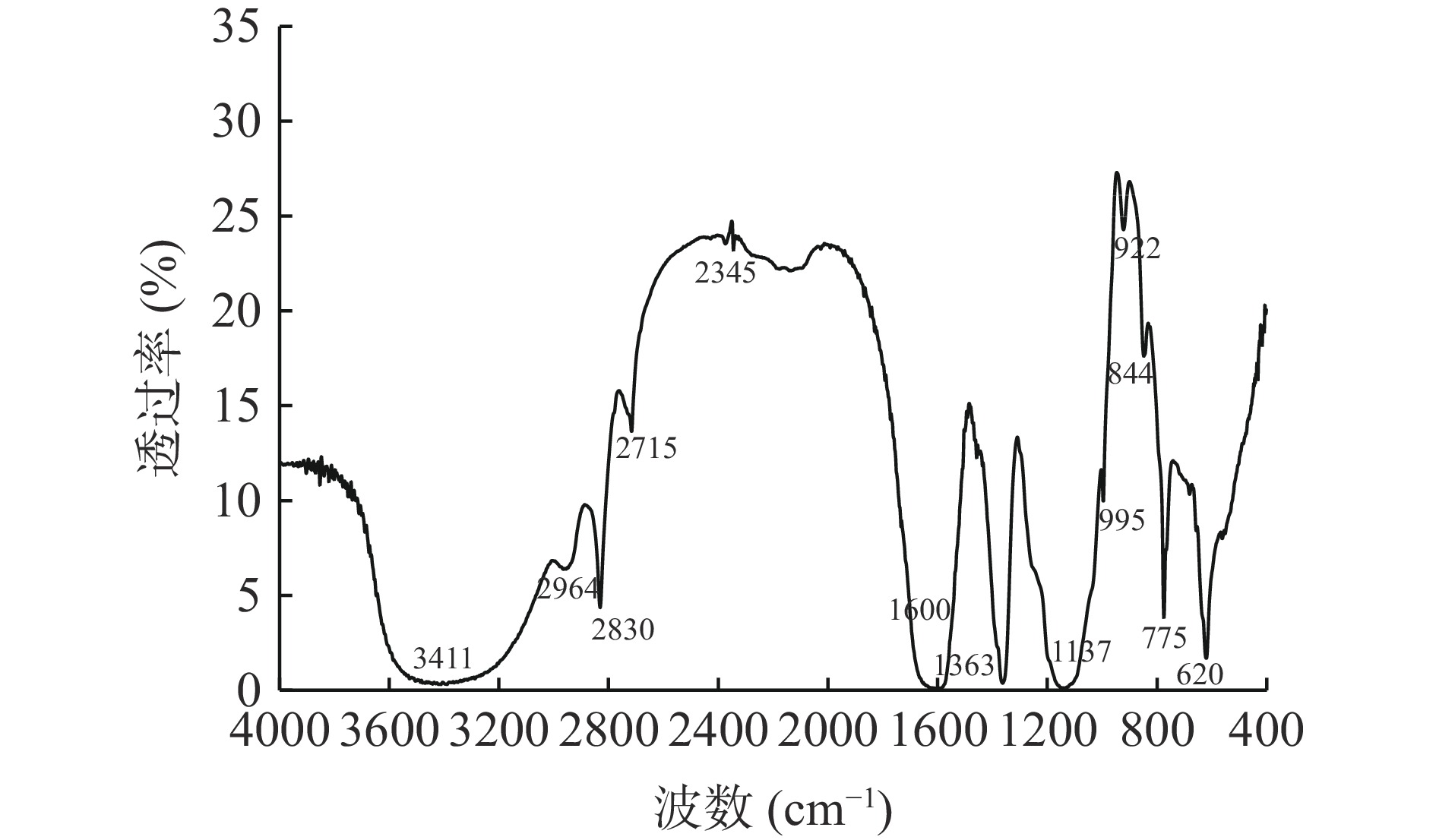
对LEPⅢa进行了红外光谱扫描分析,结果如图7所示。LEPⅢa在大约3411 cm−1处有一个强而宽的吸收峰是O-H特征伸缩振动峰,2964、2830 cm−1处吸收峰是-CH3与-CH2-基团中的C-H伸缩振动,2715 cm−1处存在弱的醛基基团C-H的伸缩振动峰。2345 cm−1处出现的微弱吸收峰与样品吸附CO2的伸缩振动有关[36]。1600 cm−1附近的较宽吸收峰对应羰基C=O的伸缩振动,同时表明结合水的存在,1363 cm−1处的吸收峰是一个羧基的C-O的伸缩振动,这两处吸收峰表明LEPⅢa中含有糖醛酸组分。1137 cm−1处的强烈吸收峰是由S=O的对称伸缩振动引起的,844、620 cm−1处的特征吸收可能对应硫酸基团在轴向位置的弯曲振动,表明LEPⅢa是一种硫酸多糖[37]。775 cm−1处的峰为吡喃糖苷的伸缩振动,900~1000 cm−1区域的弱峰为C-O或糖苷键的伸缩振动,C-OH的弯曲振动[38-39]。红外光谱分析表明LEPⅢa具有多糖的特征吸收峰,是一种含吡喃糖苷的硫酸多糖。
2.6 LEPⅢa单糖组成的薄层色谱分析
单糖标准品及LEPⅢa水解液的薄层层析结果如图8所示。从图8中可以看出,各种单糖标样经层析显色后,显示出不同颜色的斑点。Garfias等[40]利用薄层色谱识别仙人掌(Opuntia ficus)果胶酸水解过程中释放的单糖,报道了包括Rha、Xyl、Man、GalA、Ara、Gal在内的6种单糖标准品的Rf值分别为0.47、0.43、0.4、0.4、0.4、0.39。结合该报道与试验中标准单糖的Rf值,初步表明LEPⅢa多糖水解液中含有Rha、GlcA,可能含有Man、Fuc、Glc,并不能最终确定LEPⅢa单糖的组成。
2.7 LEPⅢa单糖组成的高效液相色谱分析
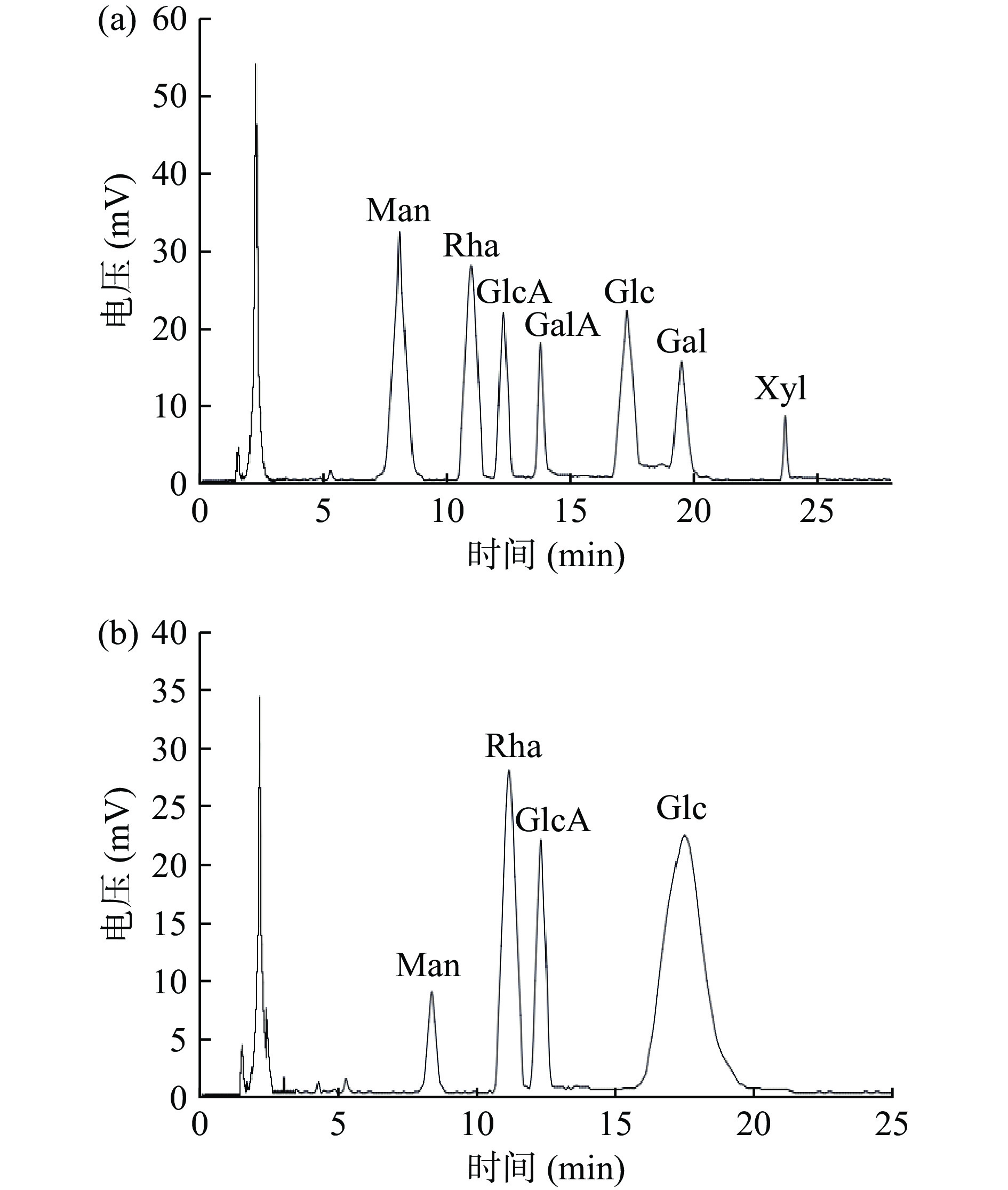
通过高效液相色谱来对LEPⅢa的单糖组成进行了进一步鉴定,结果如图9所示。图9(a)中,7种单糖标品在不同的保留时间分别出现色谱峰。图9(b)中LEPⅢa水解液分别在8.43、11.26、12.31、17.73 min时出现色谱峰,与单糖标品的保留时间对比,提示浒苔多糖LEPⅢa主要由D-(+)-葡萄糖构成,此外还含有少量的L-(+)-鼠李糖、D-葡糖醛酸和微量的D-(+)-甘露糖,根据峰面积确定各单糖在分子组成上的摩尔比为:0.97:4.43:3.13:24.8。Kim等[41]报道甘露糖和硫酸盐含量与抗氧化活性有关。Li等[42]研究表明,富含糖醛酸和硫酸基团的低分子量绿藻石莼多糖表现出较好的抗氧化能力。抗氧化活性对比试验结合红外光谱与高效液相色谱的结果表明,浒苔多糖LEPⅢa是一种具有抗氧化潜力的低分子量海藻多糖。
3. 结论
本研究以辽宁营口鲅鱼圈海域浒苔为原料,利用微波辅助H2O2/VC法对浒苔多糖进行降解,经过木瓜蛋白酶和Sevag法脱蛋白、DEAE-52离子交换层析与Sephadex G-100凝胶柱层析分离,得到3种LPE组分LEPⅠ、LEPⅡ、LEPⅢa。相比未降解前的EP,3种LEP组分的理化性质发生较大变化,Mw分别降至(23.6±0.5、24.6±0.6、22.9±0.5) kDa,粘度分别降至(1.5±0.1、1.6±0.1、1.5±0.1) mPa.s;8 mg/mL LEP各组分的总抗氧化能力由降解前的(315.2±10.3) U/mL增加到(572.3±13.3、565.7±12.5、661.8±18.3) U/mL;铁离子还原能力由降解前的51.3%±1.0%增加到74.2%±1.6%、70.2%±1.3%、83.4%±2.2%。说明采用微波辅助H2O2/VC解法可制备抗氧化活性更强的小分子多糖。利用红外光谱、薄层色谱结合高效液相色谱对LEPⅢa进行了单糖组分分析,LEPⅢa是一种由葡萄糖、鼠李糖、糖醛酸等组成的含硫酸基团的低分子量多糖,硫酸基含量14.6%±0.5%,分子量(22.9±0.5)kDa。
微波辅助H2O2/VC降解制备低分子量浒苔硫酸多糖的方法,不仅提高了多糖的抗氧化能力,还缩短了降解时间(15 min),制备得到的低分子量浒苔多糖可以作为功能性成分用于抗氧化相关的功能食品和保健品的开发,为辽宁营口地区海洋藻类多糖的开发利用及高抗氧化活性多糖的快速降解制备提供实验依据,为更好的开发浒苔资源、深入研究其构效关系奠定了基础。
-
图 4 微波辅助H2O2/VC降解对EP总抗氧化能力的影响
注:图中不同小写字母代表同一组分不同浓度间总抗氧化性差异显著(P<0.05);不同大写字母代表同一浓度不同组分间总抗氧化性差异显著(P<0.05);图5同。
Figure 4. Effect of microwave-assisted H2O2/VC degradation on total antioxidant capacity of EP
表 1 浒苔多糖不同组分的得率、理化性质
Table 1 Yield and physicochemical properties of varied components of Entermorpha polysaccharides
样品 多糖得率
(%)重均分子量Mw
(kDa)硫酸根含量
(%)粘度
(mPa·s)EP 13.5±0.5e 1276.4±14.1b 14.2±0.3a 364.5±3.4b LEP 11.7±0.5d 23.8±0.5a 15.1±0.4a 1.8±0.1a LEPⅠ 1.1±0.1a 23.6±0.5a 14.2±0.3a 1.5±0.1a LEPⅡ 3.6±0.1b 24.6±0.6a 13.8±0.3a 1.6±0.1a LEPⅢa 6.3±0.3c 22.9±0.5a 14.6±0.5a 1.5±0.1a 注:同一列中不同字母表示有显著差异(P<0.05)。 -
[1] 刘欢, 陈胜军, 杨贤庆. 海藻多糖的提取、分离纯化与应用研究进展[J]. 食品工业科技,2018,39(12):341−346. [LIU H, CHEN S J, YANG X Q. Advances of extraction, purification and application of polysaccharides from seaweeds[J]. Science and Technology of Food Industry,2018,39(12):341−346. LIU H, CHEN S J, YANG X Q. Advances of extraction, purification and application of polysaccharides from seaweeds[J]. Science and Technology of Food Industry, 2018, 39(12): 341-346.
[2] SWATHI N, KUMAR A G, PARTHASARATHY V, et al. Isolation of Enteromorpha species and analyzing its crude extract for the determination of in vitro antioxidant and antibacterial activities[J]. Biomass Conversion and Biorefinery,2022,23:1−10.
[3] TANG Z H, GAO H W, WANG S, et al. Hypolipidemic and antioxidant properties of a polysaccharide fraction from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules,2013,58:186−189. doi: 10.1016/j.ijbiomac.2013.03.048
[4] NING L M, YAO Z, ZHU B W. Ulva (Enteromorpha) polysaccharides and oligosaccharides: A potential functional food source from green-tide-forming macroalgae[J]. Marine Drugs,2022,20(3):202. doi: 10.3390/md20030202
[5] KIDGELL J T, MAGNUSSON M, DE NYS R, et al. Ulvan: A systematic review of extraction, composition and function[J]. Algal Research,2019,39:101422. doi: 10.1016/j.algal.2019.101422
[6] JIAO L L, LI X, LI T B, et al. Characterization and anti-tumor activity of alkali-extracted polysaccharide from Enteromorpha intestinalis[J]. International Immunopharmacology,2009,9(3):324−329. doi: 10.1016/j.intimp.2008.12.010
[7] ESSA H L, GUIRGUIS H A, EL-SAYED M M H, et al. Ultrasonically-extracted marine polysaccharides as potential green antioxidant alternatives[J]. Proceedings,2020,67(1):23.
[8] MANLUSOC J K T, HSIEH C L, HSIEH C Y, et al. Pharmacologic application potentials of sulfated polysaccharide from marine algae[J]. Polymers (Basel),2019,11(7):1163. doi: 10.3390/polym11071163
[9] WASSIE T, NIU K M, XIE C Y, et al. Extraction techniques, biological activities and health benefits of marine algae Enteromorpha prolifera polysaccharide[J]. Frontiers in Nutrition,2021,8:747928. doi: 10.3389/fnut.2021.747928
[10] 李霞, 张国柱, 刘志飞, 等. 肠浒苔多糖降血糖活性研究[J]. 食品工业科技,2021,42(15):321−326. [LI X, ZHANG G Z, LIU Z F, et al. Hypoglycemic activity of Enteromorpha intestinalis polysaccharide[J]. Science and Technology of Food Industry,2021,42(15):321−326. LI X, ZHANG G Z, LIU Z F, et al. Hypoglycemic activity of Enteromorpha intestinalis polysaccharide[J]. Science and Technology of Food Industry, 2021, 42(15): 321-326.
[11] HAO H L, HAN Y, YANG L H, et al. Structural characterization and immunostimulatory activity of a novel polysaccharide from green alga Caulerpa racemosa var peltata[J]. International Journal of Biological Macromolecules,2019,134:891−900. doi: 10.1016/j.ijbiomac.2019.05.084
[12] QIU S M, AWEYA J J, LIU X J, et al. Bioactive polysaccharides from red seaweed as potent food supplements: A systematic review of their extraction, purification, and biological activities[J]. Carbohydrate Polymers,2022,275:118696. doi: 10.1016/j.carbpol.2021.118696
[13] 胡馨月, 张维, 赵行, 等. 浒苔低聚糖的制备及抗氧化活性研究[J]. 食品研究与开发,2021,42(12):123−129. [HU X Y, ZHANG W, ZHAO H, et al. Preparation and antioxidant activities of oligosaccharides from Enteromorpha prolifera[J]. Food Research and Development,2021,42(12):123−129. HU X Y, ZHANG W, ZHAO H, et al. Preparation and antioxidant activities of oligosaccharides from Enteromorpha prolifera[J]. Food Research and Development, 2021, 42(12): 123-129.
[14] QIN C Q, DU Y M, XIAO L, et al. Effect of hydrogen peroxide treatment on the molecular weight and structure of chitosan[J]. Polymer Degradation and Stability,2002,76(2):211−218. doi: 10.1016/S0141-3910(02)00016-2
[15] CIKOŠ A M, JOKIĆ S, ŠUBARIĆ D, et al. Overview on the application of modern methods for the extraction of bioactive compounds from marine macroalgae[J]. Marine Drugs,2018,16(10):348. doi: 10.3390/md16100348
[16] LE B, GOLOKHVAST K S, YANG S H, et al. Optimization of microwave-assisted extraction of polysaccharides from Ulva pertusa and evaluation of their antioxidant activity[J]. Antioxidants,2019,8(5):129.
[17] 杨君, 黄芳芳, 秦敏朴, 等. 裂片石莼多糖微波辅助提取工艺优化及其卷烟保润应用[J]. 河南农业大学学报,2015,49(5):688−695. [YANG J, HUANG F F, QIN M P, et al. Microwave-assisted extraction of polysaccharides from Ulva fasciata and its moisture retention[J]. Journal of Henan Agricultural University,2015,49(5):688−695. YANG J, HUANG F F, QIN M P, et al. Microwave-assisted extraction of polysaccharides from Ulva fasciata and its moisture retention[J]. Journal of Henan Agricultural University, 2015, 49(5): 688-695.
[18] CUI J F, LI Y P, YU P, et al. A novel low molecular weight Enteromorpha polysaccharide-iron (III) complex and its effect on rats with iron deficiency anemia (IDA)[J]. International Journal of Biological Macromolecules,2018,108:412−418. doi: 10.1016/j.ijbiomac.2017.12.033
[19] ZHOU M Y, NIE S P, YING J Y, et al. Ascorbic acid induced degradation of polysaccharide from natural products: A review[J]. International Journal of Biological Macromolecules,2020,151:483−491. doi: 10.1016/j.ijbiomac.2020.02.193
[20] 谭诗敏, 罗志刚, 程建华. H2O2-VC降解对香水莲花多糖结构与活性的影响[J]. 食品科学,2021,42(24):48−53. [TAN S M, LUO Z G, CHENG J H. Effect of H2O2-VC Degradation system on the structure and activity of polysaccharides from Nymphaea hybrid[J]. Food Science,2021,42(24):48−53. doi: 10.7506/spkx1002-6630-20201202-036 TAN S M, LUO Z G, CHENG J H. Effect of H2O2-Vc Degradation system on the structure and activity of polysaccharides from Nymphaea hybrid[J]. Food Science, 2021, 42(24): 48-53. doi: 10.7506/spkx1002-6630-20201202-036
[21] WU T C, HONG Y H, TSAI Y H, et al. Degradation of Sargassum crassifolium fucoidan by ascorbic acid and hydrogen peroxide, and compositional, structural, and in vitro anti-lung cancer analyses of the degradation products[J]. Marine Drugs,2020,18(6):334. doi: 10.3390/md18060334
[22] 刘欢. 舌状蜈蚣藻多糖的提取、降解及抗氧化活性研究[D]. 上海: 上海海洋大学, 2019. LIU H. Study on extraction, degradation and antioxidant activity of polysaccharide from Grateloupia livida[D]. Shanghai: Shanghai Ocean University, 2019.
[23] 杜国丰, 陈红漫, 阚国仕, 等. 苦瓜多糖铁的制备及其对小鼠降血糖活性研究[J]. 食品工业科技,2017,38(9):353−356. [DU G F, CHEN H M, KAN G S, et al. Study on preparation of Momordica charantia polysaccharide-iron complex and its hypoglycemic activities in diabetic mice[J]. Science and Technology of Food Industry,2017,38(9):353−356. DU G F, CHEN H M, KAN G S, et al. Study on preparation of Momordica charantia polysaccharide-iron complex and its hypoglycemic activities in diabetic mice[J]. Science and Technology of Food Industry, 2017, 38(9): 353-356.
[24] 张龙翔, 张庭芳, 孔令媛. 生物化学实验方法与技术[M]. 北京: 高等教育出版社, 1997: 136−137. ZHANG L X, ZHANG T F, KONG L Y. Biochemical experimental methods and techniques[M]. Beijing: Higher Education Press, 1997: 136−137.
[25] XU J, XU L L, ZHOU Q W, et al. Isolation, purification, and antioxidant activities of degraded polysaccharides from Enteromorpha prolifera[J]. International Journal of Biological Macromolecules,2015,81:1026−1030. doi: 10.1016/j.ijbiomac.2015.09.055
[26] ZHAO S F, HE Y, WANG C G, et al. Isolation, characterization and bioactive properties of alkali-extracted polysaccharides from Enteromorpha prolifera[J]. Marine Drugs,2020,18(11):552. doi: 10.3390/md18110552
[27] 向维, 丁馨, 张薛磊, 等. 彩虹明樱蛤酸性多糖的提取与纯化[J]. 浙江大学学报(医学版),2012,41(5):569−575. [XIANG W, DING X, ZHANG X L, et al. Extraction and purification of acidic polysaccharide from Moerella iridescens[J]. Journal of Zhejiang University (Medical Sciences),2012,41(5):569−575. XIANG W, DING X, ZHANG X L, et al. Extraction and purification of acidic polysaccharide from Moerella iridescens[J]. Journal of Zhejiang University(Medical Sciences), 2012, 41(5): 569 -575.
[28] WANG Y F, MAO F F, WEI X L. Characterization and antioxidant activities of polysaccharides from leaves, flowers and seeds of green tea[J]. Carbohydrate Polymers,2012,88(1):146−153. doi: 10.1016/j.carbpol.2011.11.083
[29] DODGSON K S, PRICE R G. A note on the determination of the ester sulphate content of sulphated polysaccharides[J]. Biochemical Journal,1962,84:106−110. doi: 10.1042/bj0840106
[30] JOHANSSON A, JASSON P E, WIDMALM G. Structure of the polysaccharide Zanflo elaborated by Erwinia tahitica ATCC 21711[J]. Carbohydrate Research,1994,264(1):129−134. doi: 10.1016/0008-6215(94)00184-7
[31] SUN H H, MAO W J, CHEN Y, et al. Isolation, chemical characteristics and antioxidant properties of the polysaccharides from marine fungus Penicillium sp F23-2[J]. Carbohydrate Polymers,2009,78(1):117−124. doi: 10.1016/j.carbpol.2009.04.017
[32] CHI Y Z, LI Y P, ZHANG G L, et al. Effect of extraction techniques on properties of polysaccharides from Enteromorpha prolifera and their applicability in iron chelation[J]. Carbohydrate Polymers,2018,181:616−623. doi: 10.1016/j.carbpol.2017.11.104
[33] SEEDEVI P, MOOVENDHAN M, VIRAMANI S, et al. Bioactive potential and structural chracterization of sulfated polysaccharide from seaweed (Gracilaria corticata)[J]. Carbohydrate Polymers,2017,155:516−524. doi: 10.1016/j.carbpol.2016.09.011
[34] QI H Y, ZHANG Z P, LIU J Q, et al. Comparisons of isolation methods, structural features, and bioactivities of the polysaccharides from three common panax species: A review of recent progress[J]. Molecules,2021,26(16):4997. doi: 10.3390/molecules26164997
[35] KHAN B M, ZHENG L X, KHAN W, et al. Antioxidant potential of physicochemically characterized Gracilaria blodgettii sulfated polysaccharides[J]. Polymers,2021,13(3):442.
[36] REZAZADEH N H, BUAZAR F, MATROODI S. Synergistic effects of combinatorial chitosan and polyphenol biomolecules on enhanced antibacterial activity of biofunctionalaized silver nanoparticles[J]. Scientific Reports,2020,10(1):19615. doi: 10.1038/s41598-020-76726-7
[37] 崔洁芬, 杜春影, 迟永洲, 等. 浒苔多糖铁的制备工艺优化及其结构表征[J]. 食品工业科技,2018,39(5):161−165,170. [CUI J F, DU C Y, CHI Y Z, et al. Optimization of preparation process of Enteromorpha prolifera polysaccharide-iron and its structure characterization[J]. Science and Technology of Food Industry,2018,39(5):161−165,170. CUI J F, DU C Y, CHI Y Z, et al. Optimization of preparation process of Enteromorpha prolifera polysaccharide-iron and its structure characterization[J]. Science and Technology of Food Industry, 2018, 39(5): 161-165, 170.
[38] 吕海涛, 肖宝石, 高玉杰. 浒苔多糖的酶法提取、纯化及初步结构鉴定[J]. 食品研究与开发,2013,34(8):33−36. [LÜ H T, XIAO B S, GAO Y J. Study on the extraction, purification and structural characterization of polysaccharide from Enteromorpha[J]. Food Research and Development,2013,34(8):33−36. LV H T, XIAO B S, GAO Y J. Study on the extraction, purification and structural characterization of polysaccharide from Enteromorpha[J]. Food Research and Development, 2013, 34(8): 33-36.
[39] CHEN S, SATHUVAN M, ZHANG X, et al. Characterization of polysaccharides from different species of brown seaweed using saccharide mapping and chromatographic analysis[J]. BMC Chemistry,2021,15(1):1. doi: 10.1186/s13065-020-00727-w
[40] GARFIAS SILVA V, CORDOVA AGUILAR M S, ASCANIO G, et al. Acid hydrolysis of pectin and mucilage from Cactus (Opuntia ficus) for identification and quantification of monosaccharides[J]. Molecules,2022,27(18):5830. doi: 10.3390/molecules27185830
[41] KIM S Y, KIM E A, KIM Y S, et al. Protective effects of polysaccharides from Psidium guajava leaves against oxidative stresses[J]. International Journal of Biological Macromolecules,2016,91:804−811. doi: 10.1016/j.ijbiomac.2016.05.111
[42] LI W, JIANG N, LI B, et al. Antioxidant activity of purified ulvan in hyperlipidemic mice[J]. International Journal of Biological Macromolecules,2018,113:971−975. doi: 10.1016/j.ijbiomac.2018.02.104






 下载:
下载:



 下载:
下载:



