Determination of 36 Veterinary Drug Residues in Cooked Meat by Ultra Performance Liquid Chromatography-tandem Mass Spectrometry
-
摘要: 建立了卤肉中金刚烷胺、磺胺类、喹诺酮类及氯霉素类等36种兽药残留的检测方法。卤肉样品通过乙腈-水溶液(V:V=8:2)提取,PRiME HLB固相萃取柱净化,配有电喷雾离子源(ESI±)的超高效液相色谱-串联质谱(UPLC-MS/MS),在正负离子多反应监测(MRM)模式下同时测定,基质匹配标准曲线定量。结果表明,所研究的36种兽药在0.5~20.0 ng/mL浓度范围内均呈良好线性关系(R2>0.999)。本方法中36种药物的检出限均为0.10 μg/kg,定量限均为0.33 μg/kg,在高中低3个不同浓度(0.5,1.0和5.0 μg/kg)36种兽药的添加回收率为70.8%~106.9%,相对标准偏差(RSD, n=6)0.2%~6.2%。该研究建立的方法操作简单、准确性高、回收率和重现性好,可同时对卤肉中的36种兽药残留进行测定。
-
关键词:
- 超高效液相色谱-串联质谱法 /
- 卤肉 /
- PRiME HLB固相萃取 /
- 兽药残留
Abstract: A method was developed for the determination of amantadine sulfonamides, quinolones and chloramphenicols in cooked meat. The samples were extracted with acetonitrile-water mixtures (V:V=8:2), purified with PRiME HLB solid phase extraction column. 36 veterinary drugs were determined by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) with an electrospray ion source (ESI±) in positive and negative ion switching scanning mode. The results showed that the 36 veterinary drugs showed a good linear relationship in the concentration range of 0.5~20.0 ng/mL (R2>0.999). The limits of detection were 0.10 μg/kg and the limits of quantitation were 0.33 μg/kg. The average recovery was 70.8%~106.9% in the range of high, medium and low concentrations (0.5, 1.0 and 5.0 μg/kg). The relative standard deviations (RSD, n=6) was 0.2%~6.2%. The method is simple, sensitive and accurate, and could be used for the determination of 36 veterinary drug residues in cooked meat. -
兽药残留是指畜禽动物在用药后,经动物体内新陈代谢,未代谢完全而富集在动物本体内或其副产品中药物本身或其代谢产物,包括与兽药有关的杂质的残留[1-3]。在畜禽动物生长过程中使用频繁且较容易引起兽药残留量的兽药种类主要有抗生素类药物(氯霉素类、四环素类)、抗菌类药物(磺胺类、喹诺酮类)、激素类药物(β-兴奋剂类、皮质激素类)等[4]。畜禽动物在经常反复食用某一种兽药后,其体内的耐药细菌对该药产生抑制作用,使得该药药效降低甚至丧失并大量富集于畜禽及其副产品中[5-6]。由于消费者经常食用含兽药残留的畜禽及其副产品,残留兽药也随着食物一起进入人体内,药物残留会使人体内的菌株产生耐药抗性,扰乱人体内代谢平衡,使人体产生过敏反应和激素障碍变态反应等[7-8]。卤肉作为人们经常食用的熟肉制品,含有大量的蛋白质、脂肪、碳水化合物和微量元素等人类所需要的营养成分[9-10]。然而生产商为了提高卤肉的口感,在制作工艺上会增加一些香料和食品添加剂,这些香料和食品添加剂在提高卤肉口感的同时,也会掩盖畜禽产品的健康状况,兽药残留也随着卤肉进入人体,严重影响人的健康[11],所以卤肉的安全隐患也逐渐增多。在这种情况下,建立卤肉中兽药残留的检测方法是十分必要的,因此本实验采用最常见的猪肉卤肉制品作为研究对象,来建立卤肉制品中兽药残留的检测方法。
近年来,国内外对兽药残留的测定方法研究主要有酶联免疫法检测牛奶和猪尿中的喹诺酮类、氯霉素类和四环素类药物[12-14];液相色谱法检测肉制品和奶制品中磺胺类、氟喹诺酮类和四环素类药物[15-16];气相色谱法检测水产中氯霉素类药物[17]、气相色谱-串联质谱法检测动物源性食品中的氯霉素类[18];飞行时间质谱检测猪肉中抗生素[19]和液相色谱-串联质谱法检测畜禽产品和奶制品中的氯霉素类、磺胺类和四环素类药物[20-23]等。其中,酶联免疫法操作简单、检测成本低,但是检测结果假阳性率高;气相色谱法和液相色谱法灵敏度高、定量准确,但分析时间长,同时定性准确度不高[24]。气相色谱-串联质联法测定兽药时,前处理步骤繁琐、部分兽药需要衍生化、且检测周期长[25]。飞行时间质谱具有分辨力好,扫描速度快但无串级功能,无法进一步定性和检测成本高等特点。液相色谱-串联质谱法具有灵敏度高、操作简单、分析时间短等特点,近年来被广泛应用于兽药残留分析[26-28]。但是现存液相色谱-串联质谱方法检测兽药组分较为单一,目前尚未发现有对卤肉样品中多种兽药残留分析的方法。为把控卤肉制品兽药残留情况,本研究拟通过对仪器条件及前处理进行优化,建立超高效液相色谱-串联质谱测定卤肉中36种兽药残留的方法。
1. 材料与方法
1.1 材料与仪器
乙腈、甲醇 色谱级,美国Fisher公司;甲酸 色谱级,德国CNW公司;16种磺胺类混合标准品 100 μg/mL,购于天津阿尔塔科技有限公司;其他20种兽药标准品 纯度均>98%,购于德国Dr.Ehrenstorfer公司;Oasis Prime HLB固相萃取小柱(3 cc,150 mg) 美国Waters公司;C18固相萃取小柱(3 cc,200 mg) 美国Waters公司;孔径0.22 μm有机相针式滤器 上海安谱实验科技股份有限公司。
TQ-S 液相色谱-串联三重四级杆质谱联用仪(配有电喷雾ESI±离子源) 美国waters公司;BSA4202S-CW电子天平(d=0.01 g) 德国Sartorius公司;BSA224S-CW电子天平(d=0.0001 g) 德国Sartorius公司;Multifuge X4R Pro-MD高速冷冻离心机 美国ThermoFisher公司;R210旋转蒸发仪 瑞士Buchi公司;MS3 Basic涡旋混匀器 德国IKA公司;IQ 7000超纯水净化仪 美国Milli-Q公司。
1.2 实验方法
1.2.1 标准溶液配制
准确称取25 mg氯霉素类、喹诺酮类和金刚烷胺固体标准品于25 mL容量瓶内,加入乙腈溶解后定容至刻线,配制成1000 mg/L的单个标准储备液。取适量的36种兽药单个储备液于10 mL容量瓶中,用乙腈稀释至刻度线,配制成1.0 mg/L混合标准中间液。用空白基质(称取之前检测样品中的阴性样品按照前处理步骤处理所得到的定容液)将中间液逐级稀释成0.5、1.0、2.0、5.0、10.0、20.0 ng/mL的系列混合标准工作液,现用现配。
1.2.2 样品前处理
提取:称取分散均匀的卤肉样品2.00 g(精确至±0.05 g)于50 mL高速离心管中,加入10 mL提取液乙腈:水(V:V=8:2),置于涡旋混匀器上分散2 min,使样品被提取充分,8000 r/min离心5 min,收集上清液于50mL离心管中,残渣重复提取一次,合并两次上清液,涡旋混匀,待净化。
净化:将上清液通过Oasis PRiME HLB固相萃取柱,直接收集于100 mL鸡心瓶中,旋转蒸发,浓缩至近干,用1 mL 0.1%甲酸水溶液:乙腈(V:V=9:1)溶解,过有机相针式滤器,待上机检测分析。
1.2.3 色谱条件
色谱柱:Waters Acquity UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);流动相:0.1%甲酸水溶液(A),甲醇(B);流速0.3 mL/min;柱温 35 ℃;进样量5.0 μL;梯度洗脱程序:0~1 min,98% A;1~2 min,65% A;2~5 min,65% A;5~7 min,98% A;7~15 min,98% A。
1.2.4 质谱条件
离子源:电喷雾离子源(ESI±);扫描模式:MRM离子扫描;毛细管电压:2.5 kV;锥孔流速:50 L/h;离子源温度:150 ℃;脱溶剂气温度:400 ℃;脱溶剂气流速800 L/h。
1.2.5 定性定量方法
定性:根据对应标准物质的保留时间与离子丰度比进行定性。
定量:根据对应标准物质的色谱峰面积进行定量。
1.3 数据处理
使用MassLynx 4.1数据处理软件对数据分析。
2. 结果与分析
2.1 质谱离子源参数的优化
36种兽药标准品分别用乙腈稀释成100 ng/mL的单个标准溶液,分别注入质谱中。根据不同化合物切换离子源模式,找到响应最高母离子和子离子并找到与之相对应的锥孔电压和碰撞能量。36种兽药质谱分析参数如表1所示。
表 1 多反应监测离子对及质谱参数Table 1. Multi reaction monitoring ion pair and mass spectrometry parameters化合物 母离子(m/z) 子离子(m/z) 锥孔电压(V) 碰撞能(eV) 保留时间(min) 金刚烷胺(JGWA)
(Amantadine)152.2 135.2* 40 15 4.24 93.1 24 磺胺吡啶(HABD)
(Sulfapyridine)250.0 156.0* 40 15 3.16 184.0 17 磺胺嘧啶(HAMD)
(Sulfadiazine)251.0 156.0* 40 15 2.80 108.0 23 磺胺甲恶唑(HAJEZ)
(Sulfamethoxazole)254.0 156.0* 40 15 4.15 108.0 22 磺胺噻唑(HASZ)
(Sulfathiazole)256.0 156.0* 40 13 3.01 108.0 20 磺胺甲基嘧啶(HAJJMD)
(Sulfamerazine)265.0 156.0* 40 15 3.32 172.0 16 磺胺二甲异恶唑(HAEJYEZ)
(Sulfisoxazole)268.0 156.0* 40 15 4.36 108.0 16 磺胺甲噻二唑(HAJSEZ)
(Sulfamethizole)271.0 156.0* 40 15 3.70 108.0 20 磺胺二甲基嘧啶(HAEJJMD)
(Sulfamethazine)279.0 186.0* 40 15 2.82 156.0 16 磺胺二甲基异嘧啶(HAEJJYMD)
(Sulfisomidine)279.0 186.0* 40 16 3.77 156.0 16 磺胺对甲氧嘧啶(HADJYMD)
(Sulfameter)281.0 156.0* 40 16 3.64 215.0 12 磺胺间甲氧嘧啶(HAJJYMD)
(Sulfamonomethoxine)281.0 156.0* 40 16 4.22 215.0 12 磺胺甲氧哒嗪(HAJYDQ)
(Sulfamethoxypyridazine)281.0 156.0* 40 16 3.87 215.0 12 磺胺喹恶琳(HAKEL)
(Sulfaquinoxaline)301.0 156.0* 40 17 5.23 108.0 25 磺胺氯哒嗪(HALDQ)
(Sulfachloropyridazine)285.0 156.0* 40 15 4.08 108.0 25 磺胺邻二甲氧嘧(HALEJYMD)
(Sulfadoxine)311.0 156.0* 40 15 4.36 108.0 30 磺胺间二甲氧嘧啶(HAJEJYMD)
(Sulfadimethoxine)311.0 156.0* 40 19 5.05 108.0 29 萘啶酸(NDS)
(Nalidixic acid)233.1 215.0* 40 19 5.96 187.1 25 氟甲喹(FJK)
(Flumequine)262.1 244.0* 40 18 5.19 202.0 33 恶喹酸(EKS)
(Oxolinic Acid)262.1 244.0* 40 17 6.17 216.0 28 诺氟沙星(NFSX)
(Norfloxacin)320.2 276.2* 40 16 3.74 233.2 25 依诺沙星(YNSX)
(Enoxacin)321.1 303.0* 40 33 3.65 232.0 22 环丙沙星(HBSX)
(Ciprofloxacin)322.1 314.2* 40 22 3.83 288.2 17 培氟沙星(PFSX)
(Pefloxacin)334.0 290.1* 40 16 3.64 233.1 25 洛美沙星(LMSX)
(Lomefloxacin)352.1 308.2* 40 16 3.99 265.1 20 达氟沙星(DFSX)
(Danofloxacin)358.2 314.2* 40 18 3.89 96.0 25 恩诺沙星(ENSX)
(Enrofloxacin)360.3 316.2* 40 17 3.87 342.2 20 氧氟沙星(YFSX)
(Ofloxacin)362.2 318.2* 40 18 3.63 261.1 27 麻保沙星(MBSX)
(Marbofloxacin)363.1 320.1* 40 15 3.43 345.0 20 沙拉沙星(SLSX)
(Sarafloxacin)395.6 342.1* 40 19 4.18 299.1 27 司帕沙星(SPSX)
(Sparfloxacin)393.1 349.1* 40 20 4.50 329.1 23 奥比沙星(OBSX)
(Orbifloxacin)396.1 352.1* 40 17 4.04 295.0 24 二氟沙星(EFSX)
(Difloxacin)400.1 356.1* 40 20 4.06 382.0 23 氯霉素(LMS)
(Chloramphenicol)320.9 152.0* −40 −46 5.10 257.0 −12 甲砜霉素(JFMS)
(Thiamphenicol)354.0 185.1* −40 −21 3.59 290.0 −13 氟苯尼考(FBNK)
(Florfenicol)356.2 336.1* −40 −10 4.26 185.1 −18 注:*表示定量离子,谱图中各组分用汉语缩写表示。 2.2 样品前处理的优化
2.2.1 提取液的优化
综合考虑36种兽药的化学性质和其他单一种类兽药的提取办法,比较甲醇、甲醇-水溶液(V:V=5:5)、乙腈、乙腈-水溶液(V:V=5:5)4种提取体系对36种兽药的提取效率。结果表明(见表2),在空白卤肉中添加10.0 μg/kg 36种兽药标准溶液,纯有机溶剂作为提取溶剂时,磺胺类、喹诺酮类和氯霉素类回收率较低,且部分组分回收率低于50%。这是由于纯有机试剂不利于样品的分散,提取不充分。而甲醇-水溶液和乙腈-水溶液作为提取液时,36种兽药的回收率明显提高,这是由于样品能充分溶于提取液中与提取液充分混合,有利于提取。由表2进一步看出当甲醇-水溶液作为提取液时,部分磺胺类和氯霉素类兽药回收率低于70%,而当提取溶液换成乙腈-水溶液时,36种兽药各组分回收率均超过70%。进一步改变乙腈和水的比例,选择合适的比例使各组份回收率达到最优。通过实验发现随着乙腈比例增加所测兽药各组份回收率也随之增加,当乙腈比例为80%时回收率达到最佳,再增加乙腈比例回收率反而下降。原因是乙腈利于所测兽药残留的溶解,但是乙腈含量过大,样品会变性,抱团,不利于提取。所以实验最终选择乙腈-水(V:V=8:2)溶液作为提取液。
表 2 不同提取溶液对卤肉中36种药物的提取效果Table 2. Extraction effects of different extraction solutions on 36 drugs in cooked meat化合物名称 甲醇
回收率(%)乙腈
回收率(%)甲醇-水
回收率(%)乙腈-水
回收率(%)金刚烷胺 60.0~72.2 62.2~75.4 70.5~88.3 83.5~102.2 磺胺类 48.6~62.4 50.5~60.9 67.2~78.5 77.5~91.6 喹诺酮类 23.5~70.9 35.8~66.6 72.6~86.8 73.5~98.1 氯霉素类 35.2~50.5 40.1~65.7 56.8~73.5 71.5~89.8 2.2.2 净化条件的优化
本实验比较了C18固相萃取柱和Prime HLB固相萃取柱对样品的净化效率。在空白卤肉中添加10 μg/kg的36种兽药,分别采用C18固相萃取柱和Prime HLB固相萃取柱进行净化处理。结果表明(见图1),采用C18固相萃取柱净化时,氯霉素类药物均没有保留,磺胺类和喹诺酮类药物保留也相对较差,在废弃液中检出其组分。而采用Prime HLB固相萃取柱净化时,通过固相萃取柱的杂质物质被柱子吸附,目标物流出柱子被回收检测分析,研究的36种兽药通过柱子后回收率均大于70%,能满足本实验对净化效果的要求。
2.3 色谱条件的优化
2.3.1 色谱柱的优化
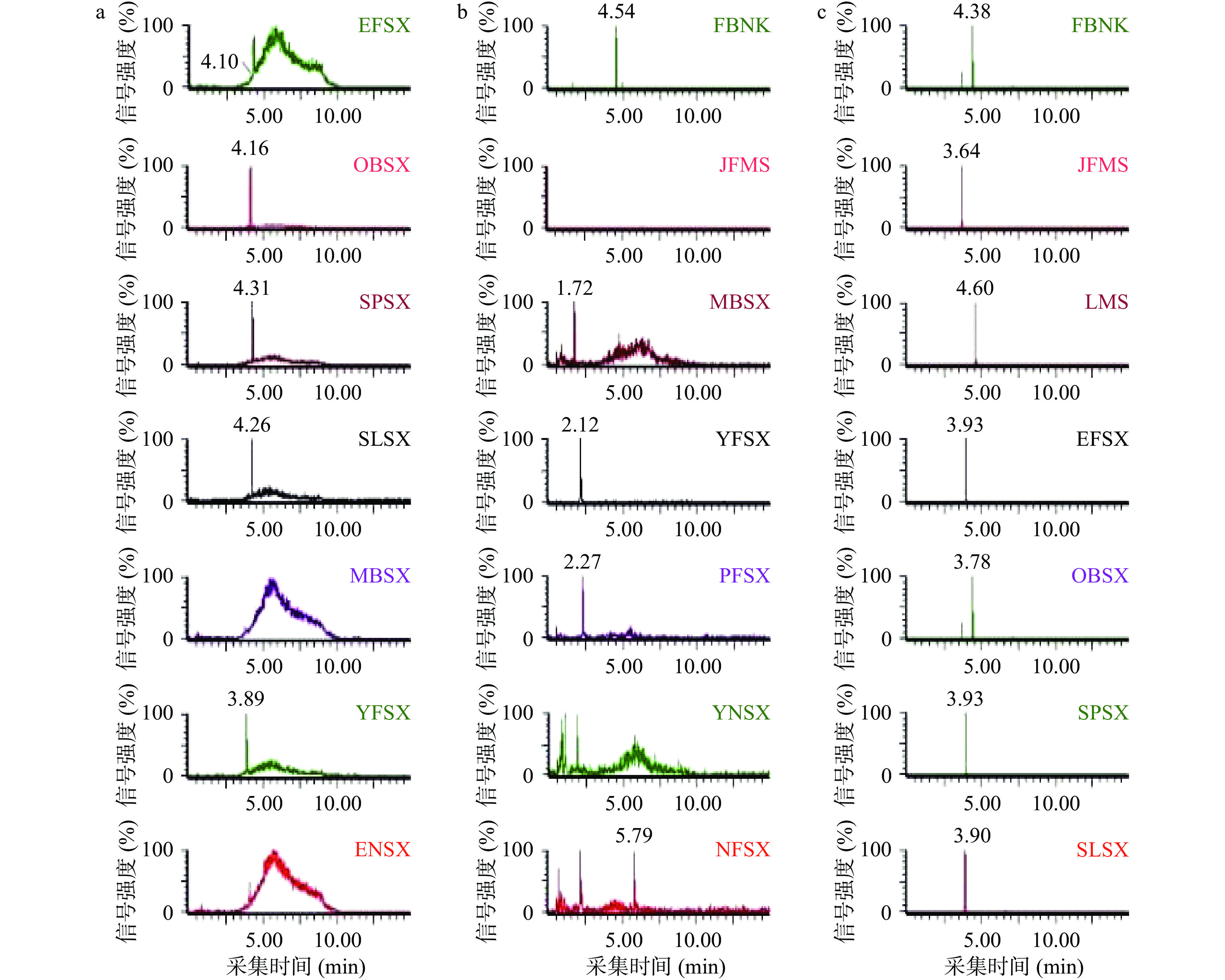
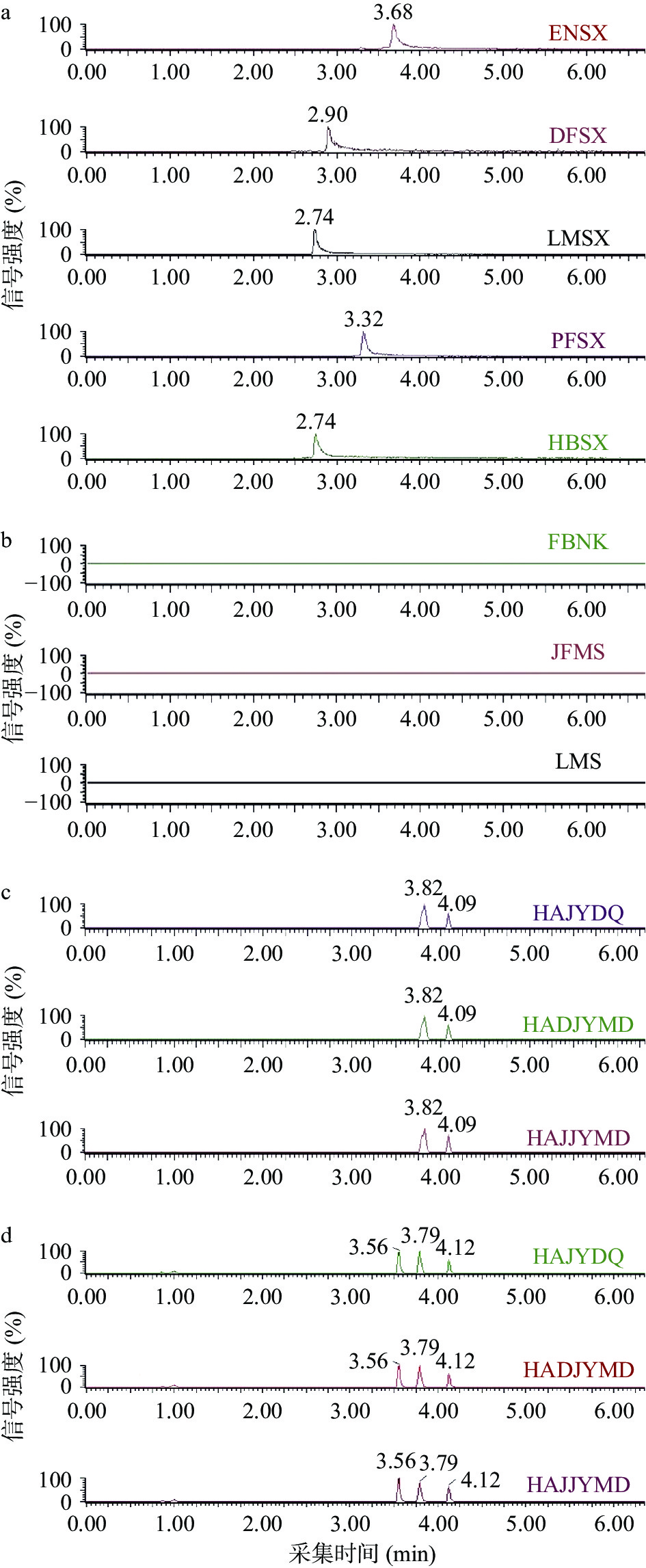
根据36种兽药的结果及化学性质,选择合适的分析色谱柱使各组分的分离及响应达到最优。实验比较了HSS T3(2.1 mm×100 mm, 1.8 μm)、CSH C18(2.1 mm×100 mm, 2.5 μm)和BEH C18(2.1 mm×100 mm, 1.7 μm)3种色谱柱对36种兽药分离和响应的影响。HSS T3色谱柱采用高强度硅胶为填料,对水溶性和极性大的小分子化合物有很好的保留作用,因此HSS T3色谱柱对喹诺酮类药物分离效果不太理想,其中麻保沙星没有响应,恩诺沙星、沙拉沙星、氧氟沙星和二氟沙星虽然有出峰但峰型较差且响应较低(如图2 a所示)。CSH C18色谱柱采用表面带电杂化颗粒为填料,对碱性化合物有很好的保留效果,因此CSH C18色谱柱对氯霉素类和部分喹诺酮类保留效果较差,其中甲砜霉素没有响应,麻保沙星、依诺沙星、诺氟沙星和培氟沙星分离效果差且响应较低(如图2 b所示)。而BEH C18色谱柱采用三官能键合BEH颗粒作为填料,能利用pH对各种化合物有很好的保留和分离作用,当使用BEH C18色谱柱分析时,36种兽药分离度和质谱响应均能满足实验要求(如图2 c所示),因此本实验采用Acquity UPLC BEH C18色谱柱作为分析36种兽药残留的分析柱。
2.3.2 流动相的优化
在优化完色谱柱的基础上,使用BEH C18作为分析柱进一步对色谱条件中流动相进行优化。根据单类化合物的质谱条件分别比较水和甲醇、0.1%甲酸水溶液和甲醇、10 mmol/L的乙酸铵溶液和甲醇3种流动相体系对36种兽药的分离效果和质谱响应情况。结果表明,在ESI源正、负离子同时扫描模式下,水和甲醇作为流动相,喹诺酮类药物分离效果不理想,峰型对称性差(如图3a所示)。10 mmol/L的乙酸铵溶液和甲醇作为流动相时,氯霉素类药物均无响应且喹诺酮类药物分离效果差、响应较低(如图3b所示)。0.1%甲酸水溶液和甲醇作为流动相时,36种兽药各组分均分离度较好且质谱响应高,这是由于在一定的质谱条件下甲酸提供的酸性条件更利于36种兽药的电离。与此同时,也比较了把有机相的甲醇换成乙腈当流动相时,36种兽药的分离效果和质谱响应情况。结果表明,36种兽药除磺胺甲氧哒嗪(SMP)、磺胺对甲氧嘧啶(SMD)和磺胺间甲氧嘧啶(SMM)三个组分外其他各组分均完全分离且质谱响应较好(如图3c所示)。由于这3种磺胺类化合物母离子、子离子信息完全一样,如果不能完全分离,将无法定性定量。而采用极性更强的甲醇和0.1%甲酸水溶液作为流动相,磺胺甲氧哒嗪、磺胺对甲氧嘧啶和磺胺间甲氧嘧啶这三个组分能完全分离(如图3d所示),并且36种兽药各组分均能完全分离、质谱响应较高、峰型对称良好。固实验将采用0.1%甲酸水溶液和甲醇作为流动相来分析36种兽药残留。
2.4 方法学验证
2.4.1 基质效应
影响质谱分析的其中一个因素就是基质效应(Matrix Effect,ME)。卤肉样品中其他干扰离子对目标离子的响应或抑制或增强,本实验通过对空白卤肉样品的基质标液和溶剂标液进行比较,评价其基质效应。ME=(基质标定量离子峰面积-溶剂标定量离子峰面积)/溶剂标峰定量离子面积。当0.2≥ME≥−0.2时,认为基质效应对目标物质谱响应影响低,可忽略;当ME≥0.2时,认为基质效应增强,或ME≤−0.2时,认为基质效应减弱[29]。基质效应对36种兽药的影响见图4。结果表明,36种兽药中有18种组分的ME值大于0.2或小于−0.2,其中磺胺吡啶、萘啶酸、依诺沙星、培氟沙星和达氟沙星5种组分受基质效应的影响较为严重。为了准确定量减少基质效应对36种兽药分析的影响,本实验采用阴性样品配制基质标准曲线的方法来定量。
2.4.2 线性关系、检出限及定量限
以阴性样品基质作为稀释溶剂,分别配制0.5、1.0、2.0、5.0、10.0、20.0 ng/mL系列基质标准溶液,以待测组分的浓度作为横坐标,定量离子对的峰面积作为纵坐标绘制标准曲线。结果表明,36种兽药在0.5~20.0 ng/mL浓度范围内呈良好线性关系(R2>0.999)。使用空白基质对基质标准溶液进行不断逐级稀释,以信噪比(S/N=3)作为方法的检出限,信噪比(S/N=10)作为定量限,计算得到36种兽药的方法检出限均为0.10 μg/kg,定量限均为0.33 μg/kg(见表3)。与姜文华等[30]和李永琴等[31]所建立的兽药残留检测方法比较,检出限或定量限均有所提高。满足实际检测的定性、定量要求。
表 3 36种兽药的添加范围、线性方程、决定系数、检出限和定量限Table 3. Linear ranges, regression equations, determination coefficient, LOD, LOQ of 36 veterinary drugs化合物 浓度范围(ng/mL) 回归方程 决定系数R2 检出限
LOD
(μg/kg)定量限
LOQ
(μg/kg)金刚烷胺 0.50~20.00 y=1.35×104x+3.54×103 0.9996 0.10 0.33 磺胺吡啶 0.50~20.00 y=6.79×104x−1.32×103 0.9993 0.10 0.33 磺胺嘧啶 0.50~20.00 y=5.82×104x+4.60×103 0.9997 0.10 0.33 磺胺甲恶唑 0.50~20.00 y=5.25×104x−1.12×103 0.9994 0.10 0.33 磺胺噻唑 0.50~20.00 y=6.45×104x−7.40×102 0.9993 0.10 0.33 磺胺甲基嘧啶 0.50~20.00 y=5.28×104x+7.41×103 0.9991 0.10 0.33 磺胺二甲异恶唑 0.50~20.00 y=3.61×104x+5.40×103 0.9991 0.10 0.33 磺胺甲噻二唑 0.50~20.00 y=3.86×104x+2.58×103 0.9991 0.10 0.33 磺胺二甲基嘧啶 0.50~20.00 y=6.24×104x+3.71×103 0.9996 0.10 0.33 磺胺二甲基异嘧啶 0.50~20.00 y=8.90×104x+9.78×102 0.9992 0.10 0.33 磺胺间甲氧嘧啶 0.50~20.00 y=2.80×104x−2.54×103 0.9995 0.10 0.33 磺胺对甲氧嘧啶 0.50~20.00 y=3.84×104x+8.08×103 0.9993 0.10 0.33 磺胺甲氧哒嗪 0.50~20.00 y=6.34×104x+3.42×103 0.9992 0.10 0.33 磺胺氯哒嗪 0.50~20.00 y=3.34×104x+1.01×104 0.9996 0.10 0.33 磺胺喹噁啉 0.50~20.00 y=3.73×104x+2.62×103 0.9992 0.10 0.33 磺胺邻二甲氧嘧啶 0.50~20.00 y=1.47×105x+5.10×103 0.9993 0.10 0.33 磺胺间二甲氧嘧啶 0.50~20.00 y=9.90×104x+5.40×104 0.9993 0.10 0.33 萘啶酸 0.50~20.00 y=3.51×105x+1.92×104 0.9992 0.10 0.33 氟甲喹 0.50~20.00 y=3.39×105x+5.57×104 0.9994 0.10 0.33 恶喹酸 0.50~20.00 y=3.32×105x+4.38×104 0.9997 0.10 0.33 诺氟沙星 0.50~20.00 y=3.44×104x+3.97×103 0.9992 0.10 0.33 依诺沙星 0.50~20.00 y=1.58×105x+7.23×103 0.9997 0.10 0.33 环丙沙星 0.50~20.00 y=1.28×105x+5.40×104 0.9993 0.10 0.33 培氟沙星 0.50~20.00 y=6.67×104x+1.12×104 0.9990 0.10 0.33 洛美沙星 0.50~20.00 y=9.38×104x−1.15×103 0.9992 0.10 0.33 达氟沙星 0.50~20.00 y=1.76×104x−2.59×102 0.9995 0.10 0.33 恩诺沙星 0.50~20.00 y=7.61×104x+2.11×105 0.9996 0.10 0.33 氧氟沙星 0.50~20.00 y=1.94×105x+5.72×105 0.9991 0.10 0.33 麻保沙星 0.50~20.00 y=3.97×104x+1.69×103 0.9996 0.10 0.33 沙拉沙星 0.50~20.00 y=4.32×104x+5.97×102 0.9997 0.10 0.33 司帕沙星 0.50~20.00 y=9.03×104x+7.42×103 0.9994 0.10 0.33 奥比沙星 0.50~20.00 y=1.05×105x+8.59×103 0.9992 0.10 0.33 二氟沙星 0.50~20.00 y=1.02×105x+5.22×103 0.9992 0.10 0.33 氯霉素 0.50~20.00 y=6.59×104x−1.59×102 0.9993 0.10 0.33 甲砜霉素 0.50~20.00 y=5.54×104x+4.82×103 0.9996 0.10 0.33 氟苯尼考 0.50~20.00 y=1.09×104x+3.25×102 0.9995 0.10 0.33 2.4.3 准确度及精密度
称取2.00 g不含36种兽药的卤肉,分别添加0.5、1.0、5.0 μg/kg 3个不同浓度的标准物质。在前面条件都优化完成的基础上处理分析,对每一浓度样同时处理分析6个样品。结果表明卤肉中36种兽药的平均回收率在70.8%~106.9%之间,相对标准偏差(RSD,n=6)在0.2%~6.2%之间(见表4)。
表 4 卤肉中36种兽药的加标回收率及精密度(n=6)Table 4. Recovery and precision of 36 veterinary drugs in cooked meat (n=6)化合物名称 0.5 μg/kg 1.0 μg/kg 5.0 μg/kg 回收率
(%)RSD
(%)回收率
(%)RSD
(%)回收率
(%)RSD
(%)金刚烷胺 89.3~95.5 0.7~2.4 86.2~97.3 0.2~4.2 85.8~106.9 0.2~2.2 磺胺类 76.2~89.8 1.3~4.0 72.5~90.6 0.9~3.8 75.5~94.3 1.3~4.5 喹诺酮类 82.0~93.1 0.8~5.0 85.5~92.9 0.3~2.9 81.2~97.7 0.3~3.5 氯霉素类 70.8~81.2 1.2~6.2 74.4~83.3 0.9~4.6 72.2~86.9 1.0~5.3 2.5 实际样品测定
利用建立的超高效液相色谱-串联质谱法检测卤肉中36种兽药残留的方法,随机对本市超市,卤肉店等销售的50份猪肉卤肉样品及实验室的质控样品进行36种兽药残留检测与分析,结果显示,质控样品各组分的回收率均大于70%满足实验要求,所测卤肉样品中均未检出36种兽药。
3. 结论
通过对流动相、色谱柱、提取溶液及净化柱等条件的优化,建立了卤肉中磺胺类、喹诺酮类、氯霉素类及金刚烷胺等36种兽药残留的超高效液相色谱-串联质谱检测方法。样品经乙腈:水(V:V=8:2)重复提取,PRiME HLB固相萃取柱净化,基质匹配标准曲线定量。结果表明,36种兽药在0.50~20.00 ng/mL浓度范围内呈良好线性关系(R2>0.999),方法检测限均为0.10 μg/kg,定量限均为0.33 μg/kg。在中高低三个不同浓度的添加范围下,36种兽药的收回率在70.8%~106.9%之间,相对标准偏差RSD均小于6.2%。该方法灵敏度高、前处理简单、准确度和重现性好,能满足卤肉中36种兽药残留的检测,可用于大批量样品中兽药残留的分析检测。
-
表 1 多反应监测离子对及质谱参数
Table 1 Multi reaction monitoring ion pair and mass spectrometry parameters
化合物 母离子(m/z) 子离子(m/z) 锥孔电压(V) 碰撞能(eV) 保留时间(min) 金刚烷胺(JGWA)
(Amantadine)152.2 135.2* 40 15 4.24 93.1 24 磺胺吡啶(HABD)
(Sulfapyridine)250.0 156.0* 40 15 3.16 184.0 17 磺胺嘧啶(HAMD)
(Sulfadiazine)251.0 156.0* 40 15 2.80 108.0 23 磺胺甲恶唑(HAJEZ)
(Sulfamethoxazole)254.0 156.0* 40 15 4.15 108.0 22 磺胺噻唑(HASZ)
(Sulfathiazole)256.0 156.0* 40 13 3.01 108.0 20 磺胺甲基嘧啶(HAJJMD)
(Sulfamerazine)265.0 156.0* 40 15 3.32 172.0 16 磺胺二甲异恶唑(HAEJYEZ)
(Sulfisoxazole)268.0 156.0* 40 15 4.36 108.0 16 磺胺甲噻二唑(HAJSEZ)
(Sulfamethizole)271.0 156.0* 40 15 3.70 108.0 20 磺胺二甲基嘧啶(HAEJJMD)
(Sulfamethazine)279.0 186.0* 40 15 2.82 156.0 16 磺胺二甲基异嘧啶(HAEJJYMD)
(Sulfisomidine)279.0 186.0* 40 16 3.77 156.0 16 磺胺对甲氧嘧啶(HADJYMD)
(Sulfameter)281.0 156.0* 40 16 3.64 215.0 12 磺胺间甲氧嘧啶(HAJJYMD)
(Sulfamonomethoxine)281.0 156.0* 40 16 4.22 215.0 12 磺胺甲氧哒嗪(HAJYDQ)
(Sulfamethoxypyridazine)281.0 156.0* 40 16 3.87 215.0 12 磺胺喹恶琳(HAKEL)
(Sulfaquinoxaline)301.0 156.0* 40 17 5.23 108.0 25 磺胺氯哒嗪(HALDQ)
(Sulfachloropyridazine)285.0 156.0* 40 15 4.08 108.0 25 磺胺邻二甲氧嘧(HALEJYMD)
(Sulfadoxine)311.0 156.0* 40 15 4.36 108.0 30 磺胺间二甲氧嘧啶(HAJEJYMD)
(Sulfadimethoxine)311.0 156.0* 40 19 5.05 108.0 29 萘啶酸(NDS)
(Nalidixic acid)233.1 215.0* 40 19 5.96 187.1 25 氟甲喹(FJK)
(Flumequine)262.1 244.0* 40 18 5.19 202.0 33 恶喹酸(EKS)
(Oxolinic Acid)262.1 244.0* 40 17 6.17 216.0 28 诺氟沙星(NFSX)
(Norfloxacin)320.2 276.2* 40 16 3.74 233.2 25 依诺沙星(YNSX)
(Enoxacin)321.1 303.0* 40 33 3.65 232.0 22 环丙沙星(HBSX)
(Ciprofloxacin)322.1 314.2* 40 22 3.83 288.2 17 培氟沙星(PFSX)
(Pefloxacin)334.0 290.1* 40 16 3.64 233.1 25 洛美沙星(LMSX)
(Lomefloxacin)352.1 308.2* 40 16 3.99 265.1 20 达氟沙星(DFSX)
(Danofloxacin)358.2 314.2* 40 18 3.89 96.0 25 恩诺沙星(ENSX)
(Enrofloxacin)360.3 316.2* 40 17 3.87 342.2 20 氧氟沙星(YFSX)
(Ofloxacin)362.2 318.2* 40 18 3.63 261.1 27 麻保沙星(MBSX)
(Marbofloxacin)363.1 320.1* 40 15 3.43 345.0 20 沙拉沙星(SLSX)
(Sarafloxacin)395.6 342.1* 40 19 4.18 299.1 27 司帕沙星(SPSX)
(Sparfloxacin)393.1 349.1* 40 20 4.50 329.1 23 奥比沙星(OBSX)
(Orbifloxacin)396.1 352.1* 40 17 4.04 295.0 24 二氟沙星(EFSX)
(Difloxacin)400.1 356.1* 40 20 4.06 382.0 23 氯霉素(LMS)
(Chloramphenicol)320.9 152.0* −40 −46 5.10 257.0 −12 甲砜霉素(JFMS)
(Thiamphenicol)354.0 185.1* −40 −21 3.59 290.0 −13 氟苯尼考(FBNK)
(Florfenicol)356.2 336.1* −40 −10 4.26 185.1 −18 注:*表示定量离子,谱图中各组分用汉语缩写表示。 表 2 不同提取溶液对卤肉中36种药物的提取效果
Table 2 Extraction effects of different extraction solutions on 36 drugs in cooked meat
化合物名称 甲醇
回收率(%)乙腈
回收率(%)甲醇-水
回收率(%)乙腈-水
回收率(%)金刚烷胺 60.0~72.2 62.2~75.4 70.5~88.3 83.5~102.2 磺胺类 48.6~62.4 50.5~60.9 67.2~78.5 77.5~91.6 喹诺酮类 23.5~70.9 35.8~66.6 72.6~86.8 73.5~98.1 氯霉素类 35.2~50.5 40.1~65.7 56.8~73.5 71.5~89.8 表 3 36种兽药的添加范围、线性方程、决定系数、检出限和定量限
Table 3 Linear ranges, regression equations, determination coefficient, LOD, LOQ of 36 veterinary drugs
化合物 浓度范围(ng/mL) 回归方程 决定系数R2 检出限
LOD
(μg/kg)定量限
LOQ
(μg/kg)金刚烷胺 0.50~20.00 y=1.35×104x+3.54×103 0.9996 0.10 0.33 磺胺吡啶 0.50~20.00 y=6.79×104x−1.32×103 0.9993 0.10 0.33 磺胺嘧啶 0.50~20.00 y=5.82×104x+4.60×103 0.9997 0.10 0.33 磺胺甲恶唑 0.50~20.00 y=5.25×104x−1.12×103 0.9994 0.10 0.33 磺胺噻唑 0.50~20.00 y=6.45×104x−7.40×102 0.9993 0.10 0.33 磺胺甲基嘧啶 0.50~20.00 y=5.28×104x+7.41×103 0.9991 0.10 0.33 磺胺二甲异恶唑 0.50~20.00 y=3.61×104x+5.40×103 0.9991 0.10 0.33 磺胺甲噻二唑 0.50~20.00 y=3.86×104x+2.58×103 0.9991 0.10 0.33 磺胺二甲基嘧啶 0.50~20.00 y=6.24×104x+3.71×103 0.9996 0.10 0.33 磺胺二甲基异嘧啶 0.50~20.00 y=8.90×104x+9.78×102 0.9992 0.10 0.33 磺胺间甲氧嘧啶 0.50~20.00 y=2.80×104x−2.54×103 0.9995 0.10 0.33 磺胺对甲氧嘧啶 0.50~20.00 y=3.84×104x+8.08×103 0.9993 0.10 0.33 磺胺甲氧哒嗪 0.50~20.00 y=6.34×104x+3.42×103 0.9992 0.10 0.33 磺胺氯哒嗪 0.50~20.00 y=3.34×104x+1.01×104 0.9996 0.10 0.33 磺胺喹噁啉 0.50~20.00 y=3.73×104x+2.62×103 0.9992 0.10 0.33 磺胺邻二甲氧嘧啶 0.50~20.00 y=1.47×105x+5.10×103 0.9993 0.10 0.33 磺胺间二甲氧嘧啶 0.50~20.00 y=9.90×104x+5.40×104 0.9993 0.10 0.33 萘啶酸 0.50~20.00 y=3.51×105x+1.92×104 0.9992 0.10 0.33 氟甲喹 0.50~20.00 y=3.39×105x+5.57×104 0.9994 0.10 0.33 恶喹酸 0.50~20.00 y=3.32×105x+4.38×104 0.9997 0.10 0.33 诺氟沙星 0.50~20.00 y=3.44×104x+3.97×103 0.9992 0.10 0.33 依诺沙星 0.50~20.00 y=1.58×105x+7.23×103 0.9997 0.10 0.33 环丙沙星 0.50~20.00 y=1.28×105x+5.40×104 0.9993 0.10 0.33 培氟沙星 0.50~20.00 y=6.67×104x+1.12×104 0.9990 0.10 0.33 洛美沙星 0.50~20.00 y=9.38×104x−1.15×103 0.9992 0.10 0.33 达氟沙星 0.50~20.00 y=1.76×104x−2.59×102 0.9995 0.10 0.33 恩诺沙星 0.50~20.00 y=7.61×104x+2.11×105 0.9996 0.10 0.33 氧氟沙星 0.50~20.00 y=1.94×105x+5.72×105 0.9991 0.10 0.33 麻保沙星 0.50~20.00 y=3.97×104x+1.69×103 0.9996 0.10 0.33 沙拉沙星 0.50~20.00 y=4.32×104x+5.97×102 0.9997 0.10 0.33 司帕沙星 0.50~20.00 y=9.03×104x+7.42×103 0.9994 0.10 0.33 奥比沙星 0.50~20.00 y=1.05×105x+8.59×103 0.9992 0.10 0.33 二氟沙星 0.50~20.00 y=1.02×105x+5.22×103 0.9992 0.10 0.33 氯霉素 0.50~20.00 y=6.59×104x−1.59×102 0.9993 0.10 0.33 甲砜霉素 0.50~20.00 y=5.54×104x+4.82×103 0.9996 0.10 0.33 氟苯尼考 0.50~20.00 y=1.09×104x+3.25×102 0.9995 0.10 0.33 表 4 卤肉中36种兽药的加标回收率及精密度(n=6)
Table 4 Recovery and precision of 36 veterinary drugs in cooked meat (n=6)
化合物名称 0.5 μg/kg 1.0 μg/kg 5.0 μg/kg 回收率
(%)RSD
(%)回收率
(%)RSD
(%)回收率
(%)RSD
(%)金刚烷胺 89.3~95.5 0.7~2.4 86.2~97.3 0.2~4.2 85.8~106.9 0.2~2.2 磺胺类 76.2~89.8 1.3~4.0 72.5~90.6 0.9~3.8 75.5~94.3 1.3~4.5 喹诺酮类 82.0~93.1 0.8~5.0 85.5~92.9 0.3~2.9 81.2~97.7 0.3~3.5 氯霉素类 70.8~81.2 1.2~6.2 74.4~83.3 0.9~4.6 72.2~86.9 1.0~5.3 -
[1] 段玉林, 陈栎岩, 宁方尧. 肉制品中重金属及兽药残留现状研究[J]. 食品安全质量检测学报,2021,12(8):3008−3015. [DUAN Y L, CHEN L Y, NING F Y. Study on residues of heavy metals and veterinary drugs in meat products[J]. Journal of Food Safety & Quality,2021,12(8):3008−3015. DUAN Y L, CHEN L Y, NING F Y. Study on residues of heavy metals and veterinary drugs in meat products[J]. Journal of Food Safety & Quality, 2021, 12(8): 3008-3015.
[2] 张秋霞, 张涛, 韩瑾瑾. 兽药残留的种类及检测方法[J]. 畜禽业,2019,30(9):33. [ZHANG Q X, ZHANG T, HAN J J. Types and detection methods of veterinary drug residues[J]. Livestock and Poultry Industry,2019,30(9):33. ZHANG Q X, ZHANG T, HAN J J. Types and detection methods of veterinary drug residues[J]. Livestock and Poultry Industry, 2019, 30(9): 33.
[3] 马芳. 兽药残留种类及检测方法[J]. 畜牧兽医科学,2020,15(5):30−31. [MA F. Types and detection methods of veterinary drug residues[J]. Graziery Veterinary Sciences,2020,15(5):30−31. MA F. Types and detection methods of veterinary drug residues[J]. Graziery Veterinary Sciences, 2020, 15(5): 30-31.
[4] ZHANG H, CHEN Q, NIU B. Risk assessment of veterinary drug residues in meat products[J]. Current Drug Metabolism,2020,21:779−789. doi: 10.2174/1389200221999200820164650
[5] 高金芳, 岳婷婷, 赵祎, 等. 兽药多残留样品前处理技术研究进展[J]. 畜牧兽医学报,2017,48(1):8−22. [GAO J F, YUE T T, ZHAO Y, et al. Research progress on pretreatment of multi-residue samples of veterinary drugs[J]. Chinese Journal of Animal and Veterinary Sciences,2017,48(1):8−22. GAO J F, YUE T T, ZHAO Y, et al. Research progress on pretreatment of multi-residue samples of veterinary drugs[J]. Chinese Journal of Animal and Veterinary Sciences, 2017, 48(1): 8-22.
[6] 蒋磊, 苏绍辉. 动物性食品中兽药残留的危害及预防措施[J]. 现代畜牧科学,2021,5:10−11. [JIANG L, SU S H. Hazards and preventive of veterinary drug residues in animal food[J]. Modern Animal Husbandry Science,2021,5:10−11. JIANG L, SU S H. Hazards and preventive of veterinary drug residues in animal food[J]. Modern Animal Husbandry Science, 2021, 05: 10-11.
[7] 阿力腾才斯克, 萨仁高娃. 动物性食品中兽药残留危害及成因[J]. 畜牧兽医科学,2020,14(14):156−157. [ALIT Z, SAREN G. Effects of residues drugs on animal food[J]. Graziery Veterinary Sciences,2020,14(14):156−157. ALIT Z, SAREN G. Effects of residues drugs on animal food[J]. Graziery Veterinary Sciences, 2020, 14: 156-157.
[8] 郭莉. 畜禽产品兽药残留危害的现状与分析[J]. 畜牧兽医科技信息,2019,43(3):130−134. [GUO L. Present situation and analysis of veterinary drug residue harm in livestock and poultry products[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine,2019,43(3):130−134. GUO L. Present situation and analysis of veterinary drug residue harm in livestock and poultry products[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2019, 43(3): 130-134.
[9] 张根生, 王军茹, 岳晓霞, 等. 卤肉制品加工过程中风味物质形成机理和变化研究过程[J]. 中国调味品,2021,11:195−200. [ZHANG G S, WANG J R, YUE X X, et al. Study on the formation mechanism and change of flavor substances in the processing of halogen meat products[J]. China Condiment,2021,11:195−200. ZHANG G S, WANG J R, YUE X X, et al. Study on the formation mechanism and change of flavor substances in the processing of halogen meat products[J]. China Condiment, 2021, 11: 195-200.
[10] 朱平, 张秀宇, 何涛, 等. 2016-2019年国家肉制品监督检验结果分析[J]. 食品安全检测学报,2020,11(16):5594−5600. [ZHU P, ZHANG X Y, He T, et al. Analysis of national meat product supervision on inspection results from 2016 to 2019[J]. Journal of Food Safety & Quality,2020,11(16):5594−5600. ZHU P, ZHANG X Y, He T, et al. Analysis of national meat product supervision on inspection results from 2016 to 2019[J]. Journal of Food Safety & Quality, 2020, 11(16): 5594-5600.
[11] YANG Y, YE Y F, PAN D D, et al. Meta bonomics profiling of marinated meat in soy sauce during processing[J]. Science of Food and Agriculture,2017,98(4):1325−1331.
[12] 李燕君, 谭梅, 岳秀英, 等. 牛奶中氟喹诺酮类药物残留同步快速检测的酶联免疫吸附法研究[J]. 中国兽药杂志,2020,54(1):46−52. [LI Y J, TAN M, YUE X Y, et al. Simultaneous and rapid detection of fluoroquinolone residues in milk by enzyme-linked immunosorbent assay[J]. Chinese Journal of Veterinary Drug,2020,54(1):46−52. LI Y J, TAN M, YUE X Y, et al. Simultaneous and rapid detection of fluoroquinolone residues in milk by enzyme-linked immunosorbent assay[J]. Chinese Journal of Veterinary Drug, 2020, 54(1): 46-52.
[13] 李然, 李泽佳, 杨金易, 等. 酶联免疫法检测动物组织及尿液中氟苯尼考与甲砜霉素的残留[J]. 分析化学,2018,46(8):1321−1328. [LI R, LI Z J, YANG J Y, et al. The residues of florfenicol and thiamphenicol in animal tissue were detected by enzyme-linked immunosorbent assay[J]. Chinese Journal of Analytical Chemistry,2018,46(8):1321−1328. doi: 10.1016/S1872-2040(18)61104-1 LI R, LI Z J, YANG J Y, et al. The residues of florfenicol and thiamphenicol in animal tissue were detected by enzyme-linked immunosorbent assay[J]. Chinese Journal of Analytical Chemistry, 2018, 46(8): 1321-1328. doi: 10.1016/S1872-2040(18)61104-1
[14] WANG G, ZHANG H C, LIU J, et al. A receptor-based chemiluminescence enzyme linked immunosorbent assay for determination of tetracyclines in milk[J]. Analytical Biochemistry,2019,40(46):564−565.
[15] 滕爽, 吕青骎, 沈娟, 等. 超高效液相色谱法检测猪肉及其制品中的磺胺类及氟喹诺酮类兽药残留[J]. 食品与发酵工业,2018,44(7):263−268. [TENG S, LÜ Q Q, SHEN J, et al. Determination of sulfonamides and fluoroquinolones in pork and its products ultra-high performance liquid chromatography[J]. Food and Fermentation Industries,2018,44(7):263−268. TENG S, LÜ Q Q, SHEN J, et al. Determination of sulfonamides and fluoroquinolones in pork and its products ultra-high performance liquid chromatography[J]. Food and Fermentation Industries, 2018, 44(7): 263-268.
[16] AGADELLS E, TARTAGLIA A, LOCATELLI M, et al. Mixed-mode fabric phase sorptive extraction of multiple tetracycline residues from milk samples prior to high performance liquid chromatography-ultraviolet analysis[J]. Micrechemical Journal,2020,159:105437. doi: 10.1016/j.microc.2020.105437
[17] 符靖雯, 黄子敬, 陈孟君, 等. 气相色谱-电子捕获检测器快速测定水产品中多种农药及兽药残留[J]. 理化检验-化学分册,2018,54(9):1015−1019. [FU J W, HUANG Z J, CHEN M J. et al. Rapid determination of pesticide and veterinary drug residues in aquatic products by gas chromatography-electron capture detector[J]. PhyTestChem Anal Part B,2018,54(9):1015−1019. FU J W, HUANG Z J, CHEN M J. et al. Rapid determination of pesticide and veterinary drug residues in aquatic products by gas chromatography-electron capture detector[J]. PhyTestChem Anal Part B, 2018, 54(9): 1015-1019.
[18] 张春辉. 气相色谱质谱法测定动物源性食品中氯霉素[J]. 分析实验室,2020,39(6):726−730. [ZHANG C H. Determination of chloramphenicol in food of animal origin by gas chromatography-mass spectrometry[J]. Chinese Journal of Analysis Laboratory,2020,39(6):726−730. ZHANG C H. Determination of chloramphenicol in food of animal origin by gas chromatography-mass spectrometry[J]. Chinese Journal of Analysis Laboratory, 2020, 39(6): 726-730.
[19] 裴雯, 韩萍, 王杰, 等. 基于UHPLC-Q-TOF/MS法同时检测猪肉中主要抗生素类兽药残留[J]. 食品工业科技,2022,43(10):298−304. [PEI W, HAN P, WANG J, et al. UHPLC-Q-TOF/MS was uesd to detect the residues of major antibiotics in pork[J]. Science and Technology of Food Industry,2022,43(10):298−304. PEI W, HAN P, WANG J, et al. UHPLC-Q-TOF/MS was uesd to detect the residues of major antibiotics in pork[J]. Science and Technology of Food Industry, 2022, 43(10): 298-304.
[20] REZENDE D R, FILHO N L, ROCHA G L, et al. Simultaneous determination of chloramphenicol and florfenicol in liquid milk, milk powder and bovine muscle by LC-MS/MS[J]. Food Additives & Contaminants:Part A,2012,45:559−570.
[21] 吴明, 徐飞. 液相色谱-串联质谱法测定鸡蛋中的喹诺酮类和四环素类抗生素[J]. 食品工业科技,2019,40(3):249−254. [WU M, XU F. Determination of quinolones and tetracycline antibiotics in eggs by liquid chromatography tandem mass spectrometry[J]. Science and Technology of Food Industry,2019,40(3):249−254. WU M, XU F. Determination of quinolones and tetracycline antibiotics in eggs by liquid chromatography tandem mass spectrometry[J]. Science and Technology of Food Industry, 2019, 40(3): 249-254.
[22] LI J, REN X L, DIAO Y Y, et al. Multiclass analysis of 25 veterinary drugs in milk by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry,2018,257:259−264. doi: 10.1016/j.foodchem.2018.02.144
[23] 马俊美, 何亮娜, 孙磊, 等. 在线固相萃取-液相色谱-串联质谱法测定鸡肉和鸡蛋中5种抗病毒类药物残留量[J]. 食品科学,2021,42(10):305−310. [MA J M, HE L N, SUN L, et al. Determination of residues of 5 antiviral drugs in chicken and egg liquid chromatography tandem mass spectrometry[J]. Food Science,2021,42(10):305−310. MA J M, HE L N, SUN L, et al. Determination of residues of 5 antiviral drugs in chicken and egg liquid chromatography tandem mass spectrometry[J]. Food Science, 2021, 42(10): 305-310.
[24] 蔡雪, 周川, 杨淑芬, 等. 大米中黄曲霉毒素B1酶联免疫法与液相色谱-柱后衍生法的比对探讨[J]. 分析检测,2019,11:186−189. [CAI X, ZHOU C, YANG S F, et al. Comparison of aflatoxin B1 in rice by enzyme-linked immunoassay and liquid chromatography-post column derivation[J]. Journal of Instrumental Analysis,2019,11:186−189. CAI X, ZHOU C, YANG S F, et al. Comparison of aflatoxin B1 in rice by enzyme-linked immunoassay and liquid chromatography-post column derivation[J]. Journal of Instrumental Analysis, 2019, 11: 186-189.
[25] 邓高琼, 陈亨业, 刘瑞, 等. 气相色谱-质谱联用技术在食药检测中的应用与发展[J]. 化学试剂,2021,43(5):555−562. [DENG G Q, CHEN H Y, LIU R, et al. Application and development of gas chromatography-mass spectrometry in food and drug detection[J]. Chemical Reagents,2021,43(5):555−562. DENG G Q, CHEN H Y, LIU R, et al. Application and development of gas chromatography-mass spectrometry in food and drug detection[J]. Chemical Reagents, 2021, 43(5): 555-562.
[26] AN H, PARRALES L, WANG K, et al. Quantitative analysis of nitrofuran metabolites and chloramphenicol in shrimp using acetonitrile extraction and liquid chromatograph-tandem mass spectrometric detection: a single laboratory validation[J]. Journal of AOAC International,2019,98(3):602−608.
[27] GUO P, WAN J C, ZHAN C R, et al. A simplified sample pretreatment for the rapid determination of 22 β-agonist residues in swine muscle and liver tissues by ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B,2018,1096:122−134. doi: 10.1016/j.jchromb.2018.07.038
[28] 张敏, 王鸽, 马晓冲. 等. 高效液相色谱-串联质谱法测定牛乳中6中兽药残留[J]. 食品工业科技,2022,43(5):255−260. [ZHANG M, WANG G, MA X C, et al. Determination of 6 veterinary drug residues in milk by high performance liquid chromatography-tandem mass spectrometry[J]. Science and Technology of Food Industry,2022,43(5):255−260. ZHANG M, WANG G, MA X C, et al. Determination of 6 veterinary drug residues in milk by high performance liquid chromatography-tandem mass spectrometry[J]. Science and Technology of Food Industry, 2022, 43(5): 255-260.
[29] 陈兴连, 林涛, 刘兴勇, 等. 超高效液相色谱-串联质谱法快速测定鱼和虾中多类禁、限用兽药残留[J]. 色谱,2020,47(8):538−546. [CHEN X L, LIN T, LIU X Y, et al. Rapid determination of multiple and restricted veterinary drug residues in fish and shrimp by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2020,47(8):538−546. CHEN X L, LIN T, LIU X Y, et al. Rapid determination of multiple and restricted veterinary drug residues in fish and shrimp by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2020, 47(8): 538-546.
[30] 姜文华, 韦立毅, 邱晋, 等. 超高效液相色谱-串联质谱测定猪肉中93种兽药和违禁化合物[J]. 实验技术及其应用,2020,47(8):1477−1483. [JIANG W H, WEI L Y, QIU J, et al. Determination of 93 veterinary drugsand prohibited chemicals in pork by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Modem Preventive Medicine,2020,47(8):1477−1483. JIANG W H, WEI L Y, QIU J, et al. Determination of 93 veterinary drugsand prohibited chemicals in pork by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Modem Preventive Medicine, 2020, 47(8): 1477-1483.
[31] 李永琴, 卜宁霞, 陈娟, 等. HPLC-MS/MS法同时测定牛肉中80中兽药及其代谢物[J]. 食品科学科技学报,2022,40(1):140−149. [LI Y Q, BO N X, CHEN J, et al. Determination of 80 veterinary drug residues and their metabolites in beef by HPLC-MS/MS[J]. Journal of Food Science and Technology,2022,40(1):140−149. LIYQ, BONX, CHENJ, et al. Determination of 80 veterinary drug residues and their metabolites in beef by HPLC-MS/MS[J], Journal of Food Science and Technology, 2022, 40(1): 140-149.
-
期刊类型引用(12)
1. 李敏晶,李丹阳,范梓伊. 响应面优化海星肽-锌螯合物的制备. 农产品加工. 2025(04): 11-14+19 .  百度学术
百度学术
2. 张迎阳,董亚云,邹平,郑文武. 橄榄仁抗氧化肽的分离鉴定及分子对接. 食品与发酵工业. 2024(05): 189-198 .  百度学术
百度学术
3. 王扬铎,苏永昌,王晓燕,施文正,刘智禹. 仿刺参不同部位ACE抑制活性分析及活性肽制备工艺优化. 食品工业科技. 2024(10): 187-197 .  本站查看
本站查看
4. 张薇,李爱琳,李书国. 超声辅助酶解制备大米蛋白黄嘌呤氧化酶活性抑制肽的工艺条件优化. 中国粮油学报. 2024(06): 51-58 .  百度学术
百度学术
5. 叶灏铎,管晓盛,马凤,毛远辉,孙世利,曹庸,苗建银. 英红九号茶蛋白降尿酸肽的酶解制备及不同分子量组分的活性对比. 现代食品科技. 2023(03): 147-155 .  百度学术
百度学术
6. 沈畅华,杨娟,张远红,曾晓房. 双酶酶解鸽胸肉工艺优化及抗氧化性评价. 食品与机械. 2023(04): 163-169 .  百度学术
百度学术
7. 杨宝强,刘生杰. 响应面法优化猴头菇蛋白抗氧化肽工艺及抗运动疲劳活性研究. 粮食与油脂. 2023(05): 142-147 .  百度学术
百度学术
8. 牛金鸽,吴海玥,马世科,闫忠心,王学江,李婧,胡蓉,祁全青. 响应面优化藏羊皮胶原蛋白肽超声辅助提取工艺及其体内抗氧化活性分析. 食品工业科技. 2023(11): 163-170 .  本站查看
本站查看
9. 马凤,叶灏铎,夏珍,徐燕,孙世利,曹庸,苗建银. 英红九号茶蛋白ACE抑制肽的制备、氨基酸组成及不同超滤组分的活性评价. 现代食品科技. 2023(07): 237-245 .  百度学术
百度学术
10. 张艳,江波涛,李莉,王佳辉,王爽,李平,徐婷婷,刘雪松,薛沾枚,吴宪,邱景会. 驴血血红蛋白肽的制备工艺研究. 黑龙江畜牧兽医. 2023(17): 134-138+142 .  百度学术
百度学术
11. 张恒慧,张志军,陈士国,叶兴乾,张国华. 紫苏粕蛋白抗氧化活性肽的制备、分离纯化及序列鉴定. 中国食品学报. 2023(09): 347-355 .  百度学术
百度学术
12. 孙雪芹,廖彭莹,刘华宇,韦金锐,刘舒凌,陈俊,林燕媚,李锦清. 中华鳖肉水溶蛋白酶解工艺优化. 食品科技. 2022(11): 121-128 .  百度学术
百度学术
其他类型引用(2)





 下载:
下载:


 下载:
下载:



