Alleviating Effect of Millet Products on Diarrhea Induced by Senna Leaf in Mice
-
摘要: 探讨不同小米制品对番泻叶致小鼠腹泻的缓解作用。84只昆明小鼠随机分为7组:正常对照组、模型组、阳性对照组、发酵小米组(6.16 g/kg)、发酵米糠组(2.05 g/kg)、小米粥油组(10.27 g/kg)、米糠粥油组(10.27 g/kg)。采用番泻叶建立小鼠腹泻模型,造模7 d后,除模型组外,其它各组开始为期7 d的治疗,以腹泻指数、脏器指数、血清炎症因子、分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)水平为指标,并通过小肠切片观察来评价小米制品对腹泻小鼠的影响。结果表明,与模型组相比,小米制品组第13 d小鼠体重显著增加(P<0.05),腹泻指数显著降低(P<0.05),发酵米糠、发酵小米和小米粥油组血清炎症因子含量显著降低(P<0.05),肠粘膜分泌型免疫球蛋白A含量显著升高(P<0.05),小肠组织切片观察完整程度较好。小米制品中发酵米糠、发酵小米和小米粥油对番泻叶诱导小鼠腹泻有一定的缓解作用,但治疗作用机制及肠道菌群变化仍有待进一步探讨。Abstract: To study the alleviating effect of different millet products on diarrhea caused by senna leaf in mice. Eighty-four KM mice were randomly divided into 7 groups: Normal control group, model group, positive control group, fermented millet group (6.16 g/kg), ferment millet bran group (2.05 g/kg), millet gruel oil group (10.27 g/kg), and millet bran porridge oil group (10.27 g/kg). Senna leaf was used to establish a diarrhea model in mice. After 7 days of modeling, except for the model group, the other groups were treated for 7 days. The diarrhea index, viscera index, serum inflammatory factors, secretory immunoglobulin A (SIgA) levels, and small intestine section observation were used to evaluate the effects of millet products on diarrhea mice. Compared with the model group, the weight of mice in the millet product group increased significantly on the 13th day (P<0.05), the diarrhea index was significantly decreased (P<0.05), the contents of serum inflammatory factors in ferment millet bran group, fermented millet group, and millet porridge oil group were significantly decreased (P<0.05), the content of secreted immunoglobulin A in intestinal mucosa was significantly increased (P<0.05), small intestine tissue section observation integrity was good. Fermented millet bran, fermented millet, and millet porridge oil in millet products could alleviate diarrhea induced by senna leaf in mice, but the therapeutic mechanism and the changes of intestinal flora in them remain to be further explored.
-
腹泻是一种胃肠道疾病,也是多种疾病的常见症状。腹泻会导致肠道功能衰退,影响肠道消化吸收,从而导致营养不良,影响身体健康,严重者甚至影响生命安全[1]。其主要症状为排便次数增加,粪质变稀,甚至泻下如水样[2]。腹泻病由于发病率高已成为世界性公共卫生问题,因此寻找一种具有抗腹泻作用的天然植物成为目前亟待解决的问题。
小米作为一种传统医药原料被广泛消费,因其含有维生素、酚类物质、类黄酮、糖苷、叶酸、β-葡聚糖、酯醇、色素、植酸盐、类胡萝卜素、高发酵纤维等生物活性化合物,已成为重要的养生食品[3-6]。有研究报道,小米米汤对番泻叶致小鼠急性腹泻也有一定的缓解作用[7]。曾蓁等[8]探讨了小米米汤对番泻叶致小鼠急性腹泻的止泻作用,结果表明小米米汤能减少小鼠腹泻次数,有一定的止泻作用。陈树俊等[9]进行了小米粥油粉的抑菌实验和吸附内毒素实验,结果发现小米粥油对金黄色葡萄球菌、痢疾志贺菌、肺炎克雷伯有很好的抑制作用,并且对内毒素也有一定的吸附作用,保证了肠细胞的吸收和分泌功能。目前尚未研究小米粥油对腹泻小鼠炎症反应和肠道损伤的影响。
有研究发现食用小米发酵产品,有利于治疗小儿腹泻[10]。发酵米糠和益生菌都是天然产物,已被证明对人类和动物的疫病预防和治疗有各种健康益处[11]。已有发酵谷物的体外研究表明,发酵食品在预防腹泻和改善营养健康方面是有效的[12]。Islam等[13]用川曲霉和乳酸菌混合发酵米糠已被证明能够预防葡聚糖硫酸钠引起的有害肠道炎症。Alauddin的研究表明[14],发酵提高了米糠中总酚和色氨酸的含量,其中色氨酸可改善肠道炎症。纳豆芽孢杆菌作为一种益生菌,被用于多种功能性食品开发。其能够分泌各种促进营养物质消化吸收的酶类,如淀粉酶、蛋白酶、脂肪酶、纤维素酶等。有研究表明,纳豆芽孢杆菌能刺激淋巴细胞增殖,调节肠道菌群,其芽孢能够直接与肠上皮细胞和免疫系统相互作用。这种作用能够阻止白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症介质的激活[15]。赵会利等[16]证实补充纳豆芽孢杆菌可以提高犊牛断奶后饲料采食量和日增重量,显著降低犊牛的腹泻率,与纳豆芽孢杆菌可以维持肠绒毛形态的完整性,促进仔猪消化吸收有关。因此发酵米糠补充不仅可以作为一种预防措施,还可以作为一种治疗药物来对抗持续的肠道炎症[17]。
本研究通过建立番泻叶腹泻小鼠模型,分别以发酵米糠、发酵小米、小米粥油、米糠粥油为原料灌胃小鼠,通过观察小鼠腹泻情况及细胞炎症因子水平来分析不同小米制品对小鼠的肠道疗养作用,为小米功能食品的开发利用和临床治疗腹泻提供科学依据。
1. 材料与方法
1.1 材料与仪器
小米、小米谷糠 晋中市丰谷源种植专业合作社;纳豆芽孢杆菌(CICC 10453) 中国菌种保藏中心;番泻叶 亳州市鸣淘生物有限公司;盐酸洛哌丁胺胶囊(2 mg/粒) 批号KIJ09E6,西安杨森制药有限公司;小鼠白细胞介素-6(Interleukin-6,IL-6)试剂盒、小鼠白细胞介素-12(Interleukin-12,IL-12)试剂盒、小鼠肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)试剂盒、分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)试剂盒 上海爱萌优宁生物技术有限公司;其他试剂均为分析级试剂;雄性健康昆明小鼠 SPF级,84只,体重18~22 g,购于北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2021-0011;基础饲料(碳水化合物、蛋白质和脂肪供能比分别是65%、22%和13%) 斯贝福(北京)生物技术有限公司。本实验方案已获得中国辐射防护研究院实验动物管理和使用伦理委员会的审查认可,受理编号:CIRP-IACUC-(R)2021028。饲养条件:温度(25±2)℃,湿度60%±5%。
JA1203N精密电子天平 上海良平仪器仪表有限公司;TSP90搁架式速冻机 烟台中孚冷链设备有限公司;高速多功粉碎机 永康市铂欧五金制品有限公司;HPS-250生化培养箱 哈尔滨市东明医疗仪器厂;超净工作台 苏净集团安泰公司;SC-3614离心机 安徽中科科学仪器有限公司;奥林巴斯BX53生物显微镜 上海土森视觉科技有限公司。
1.2 实验方法
1.2.1 样品制备
番泻叶水煎剂:精确称取50 g,加入300 mL沸蒸馏水中煎煮20 min,过滤残渣后获得的番泻叶混合液,蒸发浓缩至1 g/mL,4 ℃保存,使用时25 ℃水浴加热[18]。
盐酸洛哌丁胺悬浮液:去除胶囊内容物,加入10 mL蒸馏水,制成0.2 g/mL浓度,为阳性对照组。
纳豆芽孢杆菌悬液:将纳豆芽孢杆菌冻干粉溶解于无菌水中,转移至液体培养基中,在37 ℃恒温培养箱中培养48 h,制得菌悬液。
课题组前期以发酵液中活菌数和可溶性膳食纤维含量为评价指标进行发酵小米、发酵米糠制备工艺优化实验,以水溶性指数和吸水性指数为评价指标进行小米粥油制备工艺优化实验,分别得到最佳工艺条件。
发酵小米:以6.5%的接种量接纳豆芽孢杆菌于含小米10.00 g、葡萄糖1%、氯化钠5%、蒸馏水100 mL的小米浆培养基中,在39 ℃恒温培养箱中培养51 h。发酵结束后,将发酵液离心(3500 r/min,10 min),取上清液冻干。
发酵米糠:以7.5%的接种量接纳豆芽孢杆菌于含脱脂小米糠10.00 g,葡萄糖1%,氯化钠5%,蒸馏水100 mL的培养基中,在36 ℃恒温培养箱中培养47 h。发酵结束后,将发酵液离心(3500 r/min,10 min),取上清液冻干。
小米粥油:称取小米50 g,浸泡40 min,滤水,以料液比1:25加入纯化水,倒入锅内,电磁炉1200 W下蒸煮25 min,过滤米渣,得到的即为小米粥油,冻干备用。
米糠粥油:称取小米谷糠50 g,浸泡40 min,滤水,以料液比1:25加入纯化水,倒入锅内,电磁炉1200 W下蒸煮25 min,过滤米渣,得到的即为小米糠粥油,冻干备用。
1.2.2 分组、造模、治疗
适应性饲养结束后,按体重随机分为正常对照组(normal control,NC)、模型对照组(model control,MC)、阳性对照组(positive control,PC)、发酵小米组(fermented millet,FM)、发酵米糠组(fermented millet bran,FMB)、小米粥油组(millet gruel oil,MGO)、米糠粥油组(millet bran porridge oil,MBPO),每组12只。实验前小鼠禁食12 h,自由饮水,除正常对照组灌胃生理盐水外(20 mL/kg),其他组均灌胃1 g/mL的番泻叶水煎剂(20 mL/kg),连续灌胃7 d。第7 d灌胃完番泻叶水煎剂后,隔2 h后进行给药,即从第7 d开始给药治疗。
发酵小米冻干粉质量与发酵小米发酵液体积比为1:10(g/mL),发酵米糠冻干粉质量与发酵米糠发酵液体积比为1:30(g/mL)。根据美国食品药品管理局的公式,选取成年人300 mL/60 kg为发酵小米和发酵米糠摄入量,以发酵小米冻干粉的质量和小鼠体重的重量换算,得到发酵小米灌胃剂量为6.16 g/kg,以发酵米糠冻干粉的质量和小鼠体重的重量换算,得到发酵米糠灌胃剂量为2.05 g/kg。国际标准推荐谷物的摄入量为每个健康成年人50 g/d,即50 g/60 kg。根据人与小鼠剂量折算系数12.33,将其转化为小鼠每天的灌胃量,计算得出小米粥油及米糠粥油灌胃剂量为10.27 g/kg,实验分组和灌胃剂量见表1。
表 1 动物实验分组及灌胃剂量Table 1. Grouping and process of animal experiments组别 造模期(7 d) 治疗期(7 d) 正常对照组(NC) 生理盐水(20 mL/kg) 生理盐水(20 mL/kg) 模型对照组(MC) 番泻叶水煎剂(1 g/mL,20 mL/kg) 生理盐水(20 mL/kg) 阳性对照组(PC) 番泻叶水煎剂(1 g/mL,20 mL/kg) 盐酸洛哌丁胺悬液(0.2 g/mL,20 mL/kg) 发酵小米组(FM) 番泻叶水煎剂(1 g/mL,20 mL/kg) 发酵小米提取液冻干粉溶液(6.16 g/kg) 发酵米糠组(FMB) 番泻叶水煎剂(1 g/mL,20 mL/kg) 发酵米糠提取液冻干粉溶液(2.05 g/kg) 小米粥油组(MGO) 番泻叶水煎剂(1 g/mL,20 mL/kg) 小米粥油冻干粉溶液(10.27 g/kg) 米糠粥油组(MBPO) 番泻叶水煎剂(1 g/mL,20 mL/kg) 米糠粥油冻干粉溶液(10.27 g/kg) 1.2.3 一般观察
实验期间观察各组小鼠精神状况、进食量状况。小鼠灌胃期间,每天定时称量小鼠体重及当日饲料剩余量,记录其变化。
1.2.4 小鼠腹泻指数的测定
每只小鼠开始出现皮毛无光泽,排便量多,稀薄,便水的现象,腹泻指数与正常对照组相比具有显著性差异(P<0.05),说明造模成功。腹泻模型建立后,间隔0.5 h观察并记录排便情况。将小鼠分置不同笼内,笼底铺白色吸墨纸,上面放置细铁丝网架,将小鼠置细铁丝网架上,与吸墨纸分开,避免小鼠吸纸和踩踏粪便。每隔1 h更换一次滤纸,观察记录4 h内小鼠稀便数和稀便级[19]。分别在饲养第7、10、13 d测定。腹泻指数:稀便率与稀便级的乘积。
1.2.5 小鼠血清IL-6、IL-12、TNF-α水平测定
第13 d给药完成后,空腹处理12 h,眼球取血,收集全血,4 ℃,12000 r/min冷冻离心15 min,收集血清并做好标记,−80 ℃保存备用。
1.2.6 胸腺、脾脏指数测定
取血后的小鼠颈椎脱臼处死,立即解剖,采集小鼠胸腺、脾脏,用生理盐水冲洗,滤纸吸干表面水分,计算其脏器指数。计算公式:
脏器指数(mg/g)=脏器重量(mg)体重(g) 1.2.7 小肠黏膜SIgA含量测定
小鼠无菌取近回盲部小肠10 cm,纵向剖开,除去肠道内粪便,刮取肠粘膜组织表面1 g,收集于离心管中,加入0.01 mol/L的PBS 1 mL,充分溶解1 h,以2000 r/min离心10 min,取上清用SIgA试剂盒测定其含量[20]。
1.2.8 小肠组织切片观察
取出靠近盲肠段的回肠约3 cm于10%的中性甲醛固定,常规脱水,石蜡包埋,切片,HE染色,于奥林巴斯BX53光镜下(200×)观察小鼠小肠组织变化。
1.3 数据处理
实验数据以平均值±标准差(
¯x ±s)表示,应用SPSS25.0统计软件进行统计学分析,采用单因素方差分析(ANOVA)进行显著性检验,P<0.05为差异有统计学意义。所有的图形都使用Origin 2018软件可视化。2. 结果与分析
2.1 一般情况观察
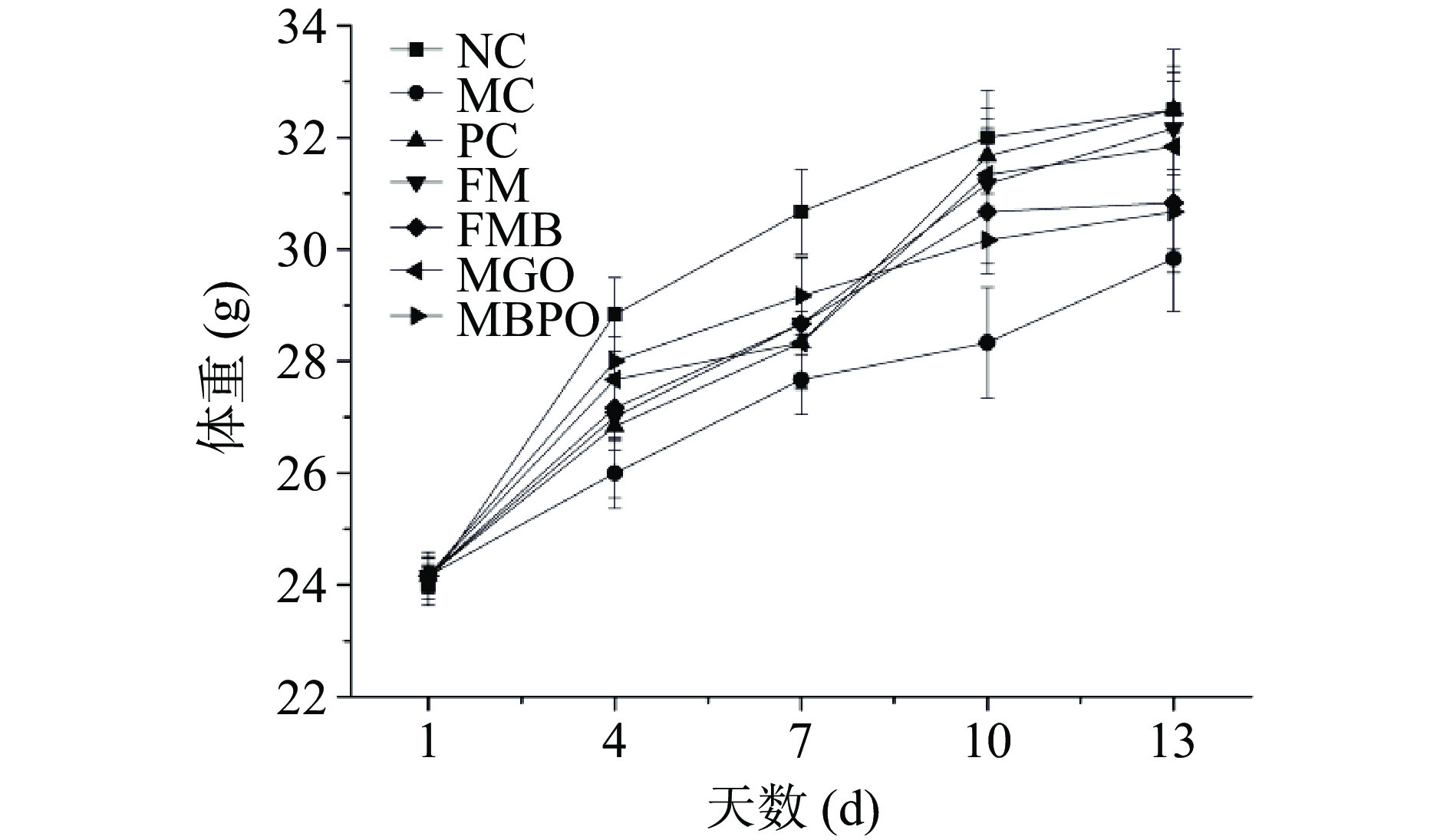
由图1可知,各组小鼠初始体重接近,前7 d为造模期,第7 d进入治疗期。在造模4 d时,NC组体重增长幅度高于其它各组,在造模7 d时,NC组体重显著高于其它各组(P<0.05)。第7 d造模成功后,开始给药治疗。在第10 d时,除MC组外,其它各组小鼠体重增加较快,在第13 d时,各组小鼠体重均显著高于MC组(P<0.05),治疗阶段,小米各制品组相比较,MGO组和FM组体重增长较快(P<0.05)。
2.2 小鼠腹泻指数测定
腹泻指数测定方法参考吴蕊等[21]方法,表2显示,NC组腹泻指数7 d内均为0,而MC组与NC组相比,腹泻指数差异显著,具有统计学意义(P<0.05),说明造模成功。第13 d时,小米制品组腹泻指数均显著低于模型组(P<0.05),说明四种小米制品均可以降低小鼠腹泻指数,起到一定改善作用,其中发酵小米组腹泻指数最低,效果最佳。
表 2 小鼠腹泻指数的变化Table 2. Changes of diarrhea index in mice组别 腹泻指数 第7 d 第10 d 第13 d 正常对照组(NC) 0b 0e 0d 模型对照组(MC) 2.04±0.43a 1.67±0.25a 0.84±0.14a 阳性对照组(PC) 1.67±0.24a 0.84±0.15d 0.21±0.08cd 发酵小米组(FM) 1.78±0.13a 1.14±0.11bcd 0.36±0.19bc 发酵米糠组(FMB) 1.70±0.27a 1.28±0.26bc 0.40±0.11bc 小米粥油组(MGO) 1.65±0.14a 0.97±0.15cd 0.38±0.18bc 米糠粥油组(MBPO) 1.88±0.18a 1.41±0.22ab 0.54±0.14b 注:同一列中,小写字母完全不同表示具有显著性差异,P<0.05。 2.3 血清炎症因子比较
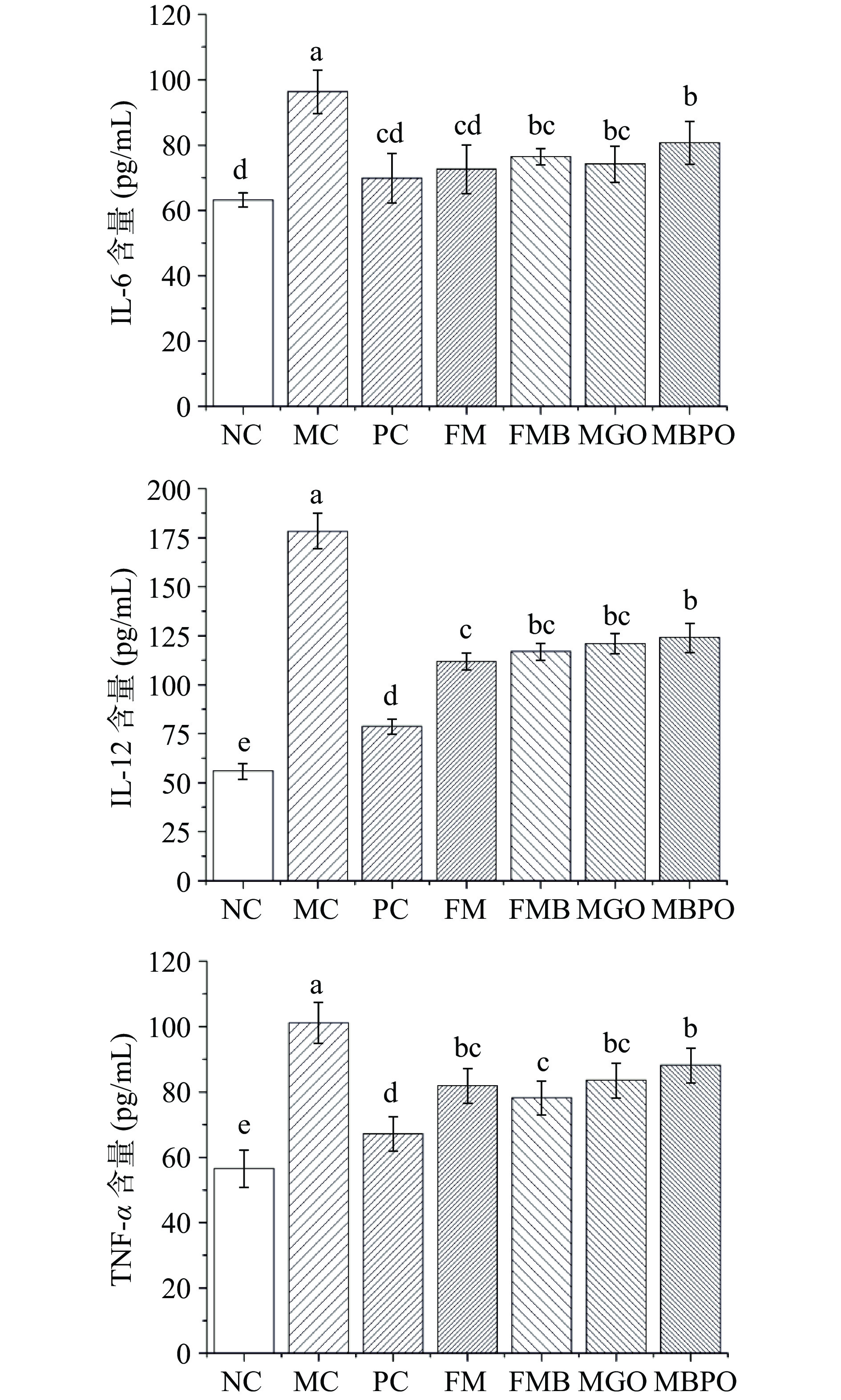
如图2,与NC组比较,MC组IL-6、IL-12、TNF-α 浓度均显著升高,具有统计学意义(P<0.05)。与MC组比较,FM组、FMB组、MGO组的IL-6、IL-12、TNF-α浓度均显著降低(P<0.05),其中发酵小米及发酵米糠效果优于小米粥油。相关研究表明,发酵米糠可显著降低血清中促炎细胞因子TNF-α和IL-6含量,从而改善复发性结肠炎,对治疗结肠炎症有明显的保护作用[22]。发酵米糠补充不仅限于预防炎症,而且还有助于持续结肠炎的肠道修复[23]。
2.4 脏器指数比较
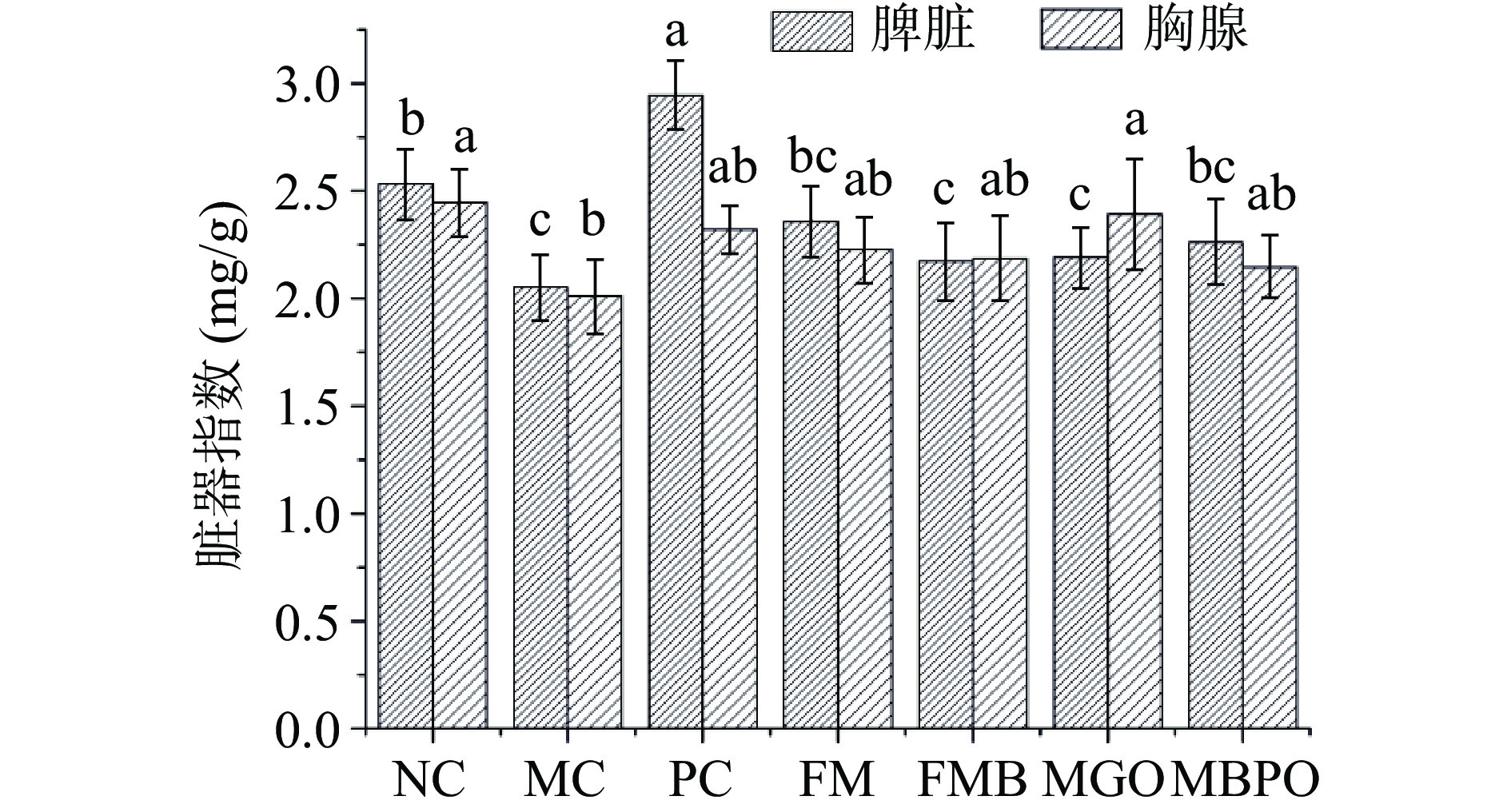
由图3可知,与NC组比较,MC组小鼠脾脏和胸腺指数均显著降低(P<0.05)。而各小米制品组脾脏指数与MC组相比无显著性变化。MGO组胸腺指数与MC组相比,具有显著性差异(P<0.05)。小米制品各组之间脏器指数无显著性差异,表明短期治疗内,四种小米制品难以修复小鼠脏器损伤。
2.5 肠粘膜SIgA含量比较
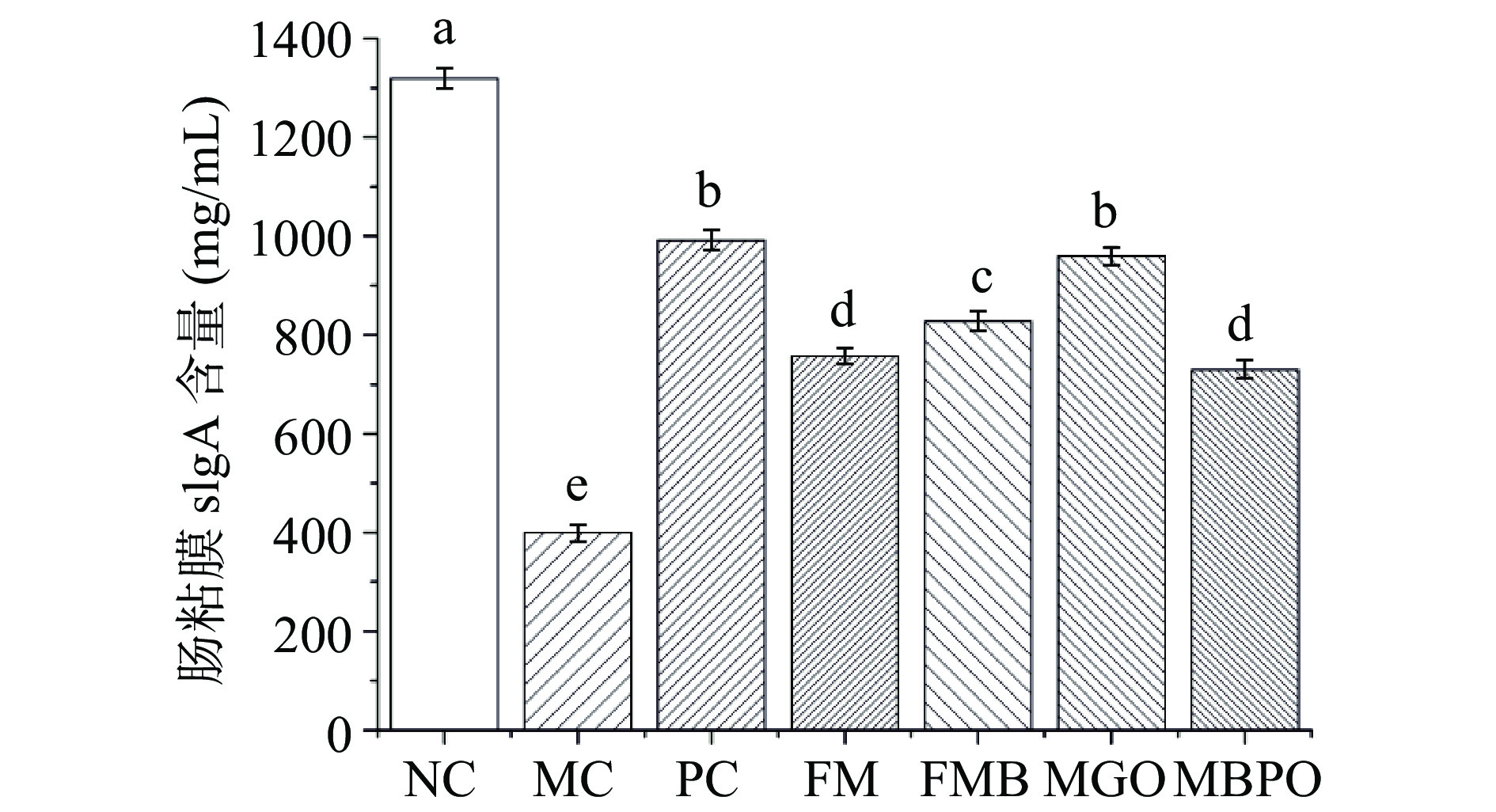
由图4可知,MC组中SIgA含量显著低于NC组(P<0.05),小米制品各组SIgA浓度均显著高于MC组(P<0.05)。其中发酵米糠和小米粥油效果优于其他两种小米制品,这可能与米糠经发酵后谷物的功能活性有所提升有关。相关研究表明,发酵米糠中的有益菌能够防止正常黏膜细胞和杯状细胞萎缩,保护肠黏膜屏障,保证肠黏膜SIgA的正常分泌[24]。
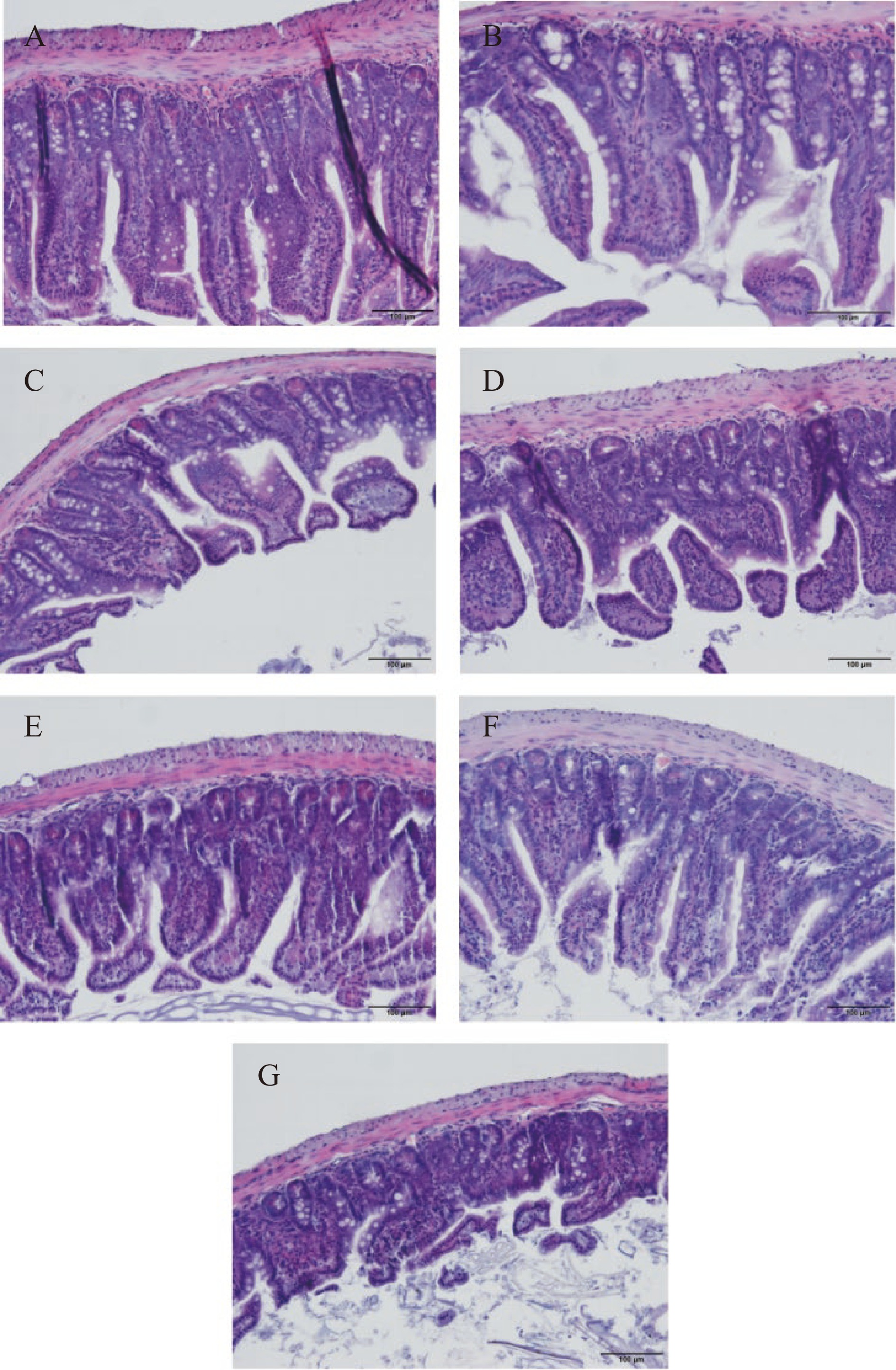
2.6 小肠切片观察
如图5,HE染色结果显示,NC组的小肠组织结构完整清晰,黏膜排列规整,未见炎症反应。MC组小鼠小肠黏膜绒毛脱落,长短不一且紊乱,细胞间连接结构出现缺损,失去小肠正常结构,有炎症细胞浸润。与MC组相比,PC组、FM组和FMB组小鼠小肠黏膜组织损伤得到不同程度的改善,小肠黏膜绒毛脱落较少,炎症细胞浸润程度较模型组减轻。
3. 讨论与结论
番泻叶水煎剂造成腹泻模型的机制是番泻叶进入肠道后,小肠不会吸收,进入大肠后一些番泻叶有效成分在大肠中发生反应,反作用于小肠,影响小肠上皮细胞钠钾泵,使产生炎症因子发生腹泻。肠道作为机体与外界接触紧密的部位之一,其富集有大量的淋巴组织、淋巴细胞和细胞因子,这些物质通过抵抗入侵肠道的细菌、病毒、毒素等有害物质来维持肠道的稳定[25]。
IL-6、IL-12、TNF-α均是细胞炎症因子的代表,TNF-α在一定程度上可以反映肠壁通透性,当TNF-α过高时肠壁通透性增加,会引起腹泻相关症状发生[26]。IL-6能诱导B细胞和T细胞分化,参与机体的免疫应答,加快炎症反应的发生[27]。IL-12是能独立诱导Th1细胞分化与增殖的细胞因子,它能促进中性粒细胞脱颗粒、释放弹性蛋白酶,损伤内皮细胞,使微循环血流淤滞,组织坏死,造成器官功能损伤[28]。补充发酵米糠可减少结肠炎的一般观察和肠道促炎细胞因子含量。发酵米糠还增加了抗炎细胞因子、紧密连接和抗微生物蛋白的肠道mRNA水平。米糠对炎症性疾病如炎症性肠病和Ⅰ型糖尿病的有益作用,为研究膳食米糠对这些营养相关疾病的免疫增强作用提供了独特的研究途径[29]。王菁[30]的实验结果表明全谷物小米可有效降低IL-6和TNF-α浓度,减轻炎症状态。陈博睿等[31]研究了不同摄入量小米对肠道菌群和短链脂肪酸的影响,结果发现20%小米摄入量可有效调节小鼠肠道菌群,增加有益菌的定殖,80%小米摄入量增加了小鼠肠道中丙酸、丁酸、异丁酸和戊酸的含量。本研究表明,番泻叶诱导后小鼠血清中IL-6、IL-12、TNF-α含量升高;经盐酸洛哌丁胺胶囊和小米制品干预后,IL-6、IL-12、TNF-α含量均较模型组降低,说明小米制品具有调控促炎因子的作用,并在一定程度上可以缓解小鼠腹泻情况。
SIgA作为机体内分泌量最多的免疫球蛋白,对于维持肠道内环境稳态有一定的作用[32]。SIgA部分缺失会增加黏膜感染的风险,现已成为多种黏膜疾病的诊断和预后评价的重要指标。有研究发现全膳食米糠摄入对黏膜免疫系统的影响是诱导IgA和增强先天免疫反应[33]。脾脏和胸腺作为机体主要的免疫器调节器官[34],它们的相对重量大小与机体免疫力的高低有很大的关系[35]。有研究表明全饲料米糠具有调节免疫系统和促进肠道乳酸杆菌生长的能力,为预防肠道病原菌和调节慢性炎症疾病提供了新思路[36]。林莹等[37]研究米油对急性腹泻患儿大便中SIgA含量的影响,发现米油可以促进肠道SIgA分泌,对治疗儿童急性腹泻有一定的疗效。本研究经盐酸洛哌丁胺胶囊和小米制品干预后,小鼠肠粘膜SIgA含量较模型组增加。其中米糠发酵和小米粥油效果相对高于小米发酵和米糠粥油,与先前研究一致。
本实验通过小鼠一般状态观察、血清炎症因子及肠粘膜SIgA含量、病理切片观察来评价四种小米制品对番泻叶诱导的腹泻小鼠的止泻作用。四种小米制品能显著降低血清炎症因子水平和提高肠粘膜SIgA水平,缓解腹泻引起的小肠组织损伤及体重减轻情况。通过发酵和蒸煮加工方式,提高小米及小米糠的生物活性,为小米及其副产品的深加工和高效利用奠定基础,为小米抗腹泻产品开发提供理论依据。但对四种小米制品中主要止泻成分及作用机理和对小鼠肠道菌群变化的影响有待进一步探讨。
-
表 1 动物实验分组及灌胃剂量
Table 1 Grouping and process of animal experiments
组别 造模期(7 d) 治疗期(7 d) 正常对照组(NC) 生理盐水(20 mL/kg) 生理盐水(20 mL/kg) 模型对照组(MC) 番泻叶水煎剂(1 g/mL,20 mL/kg) 生理盐水(20 mL/kg) 阳性对照组(PC) 番泻叶水煎剂(1 g/mL,20 mL/kg) 盐酸洛哌丁胺悬液(0.2 g/mL,20 mL/kg) 发酵小米组(FM) 番泻叶水煎剂(1 g/mL,20 mL/kg) 发酵小米提取液冻干粉溶液(6.16 g/kg) 发酵米糠组(FMB) 番泻叶水煎剂(1 g/mL,20 mL/kg) 发酵米糠提取液冻干粉溶液(2.05 g/kg) 小米粥油组(MGO) 番泻叶水煎剂(1 g/mL,20 mL/kg) 小米粥油冻干粉溶液(10.27 g/kg) 米糠粥油组(MBPO) 番泻叶水煎剂(1 g/mL,20 mL/kg) 米糠粥油冻干粉溶液(10.27 g/kg) 表 2 小鼠腹泻指数的变化
Table 2 Changes of diarrhea index in mice
组别 腹泻指数 第7 d 第10 d 第13 d 正常对照组(NC) 0b 0e 0d 模型对照组(MC) 2.04±0.43a 1.67±0.25a 0.84±0.14a 阳性对照组(PC) 1.67±0.24a 0.84±0.15d 0.21±0.08cd 发酵小米组(FM) 1.78±0.13a 1.14±0.11bcd 0.36±0.19bc 发酵米糠组(FMB) 1.70±0.27a 1.28±0.26bc 0.40±0.11bc 小米粥油组(MGO) 1.65±0.14a 0.97±0.15cd 0.38±0.18bc 米糠粥油组(MBPO) 1.88±0.18a 1.41±0.22ab 0.54±0.14b 注:同一列中,小写字母完全不同表示具有显著性差异,P<0.05。 -
[1] 景亚凤, 吴玉良, 吴纯洁, 等. 焦米对番泻叶所致腹泻小鼠的止泻及肠道菌群影响研究[J]. 中国微生态学杂志,2012,24(4):321−323. [JING Y F, WU Y L, WU C J, et al. Antidiarrhea effect of cooked rice and its influence on intestinal tract bacteria in mice with senna leaf resulted diarrhea[J]. Chinese Journal of Microecology,2012,24(4):321−323. doi: 10.13381/j.cnki.cjm.2012.04.010 [2] 郑鹏飞. 大黄炭的止泻作用及其物质基础研究[D]. 北京: 北京中医药大学, 2018. ZHENG P F. Study on antidiarrheal effect and material basis of Rhubarb charcoal[D]. Beijing: Beijing University of Chinese Medicine, 2018.
[3] DYKES L, ROONEY L W. Phenolic compounds in cereal grains and their health benefits[J]. Cereal Foods World,2008,52(3):105−111.
[4] YADAV N, CHAUDHARY K, SINGH A, et al. Evaluation of hypoglycemic properties of kodo millet based food products in healthy subjects[J]. IOSR Journal of Pharmacy,2013,3(2):14−20.
[5] VISWANATH V, UROOJ A, MALLESHI N G. Evaluation of antioxidant and antimicrobial properties of finger millet polyphenols (Eleusine coracana)[J]. Food Chemistry,2008,114(1):340−346.
[6] AMIR G, ROMEE J, GULZAR A, et al. Significance of finger millet in nutrition, health and value added products: A review[J]. Journal of Environmental Science, Computer Science and Engineering & Technology,2014,3(3):1601−1608.
[7] 郑向华, 叶宁, 洪春燕, 等. 米汤的营养保健功能[J]. 福建稻麦科技,2011,29(3):77−79. [ZHENG X H, YE N, HONG C Y, et al. Health and nutrition function of rice water[J]. Fujian Rice and Wheat Science and Technology,2011,29(3):77−79. doi: 10.3969/j.issn.1008-9799.2011.03.035 [8] 曾蓁, 杨丽萍, 胡瑶, 等. 米汤止泻作用及其机制[J]. 医药导报,2015,34(2):170−173. [ZENG Z, YANG L P, HU Y, et al. Antidiarrheal effect of rice soup and related mechanism[J]. Chinese Journal of Medicine,2015,34(2):170−173. doi: 10.3870/yydb.2015.02.008 [9] 陈树俊, 郭琪, 杨宝. 小米粥油制备及抑菌和吸附内毒素作用的研究[J]. 中国粮油学报,2021,36(2):102−108. [CHEN S J, GUO Q, YANG B. Preparation of millet porridge oil and its antibacterial and endotoxin adsorption effects[J]. Journal of the Chinese Cereals and Oils Association,2021,36(2):102−108. doi: 10.3969/j.issn.1003-0174.2021.02.017 [10] NDUTI N, MCMILLAN A, SENEY S, et al. Investigating probiotic yoghurt to reduce an aflatoxin B1 biomarker among school children in Eastern Kenya: Preliminary study[J]. International Dairy Journal,2016,63:124−129. doi: 10.1016/j.idairyj.2016.07.014
[11] YANG X D, ERICA T, LI G H, et al. High protective efficacy of rice bran against human rotavirus diarrhea via enhancing probiotic growth, gut barrier function, and innate immunity[J]. Scientific Reports,2015,5:15004. doi: 10.1038/srep15004
[12] VICKI L, HENRIK F, KIM F M. Spontaneously fermented millet product as a natural probiotic treatment for diarrhoea in young children: An intervention study in Northern Ghana[J]. International Journal of Food Microbiology,2006,110(3):246−253. doi: 10.1016/j.ijfoodmicro.2006.04.022
[13] ISLAM J, KOSEKI T, WATANABE K, et al. Dietary supplementation of fermented rice bran effectively alleviates dextran sodium sulfate-induced colitis in mice[J]. Nutrients,2017,9(7):747. doi: 10.3390/nu9070747
[14] ALAUDDIN M, SHIRAKAWA H, KOSEKI T, et al. Fermented rice bran supplementation mitigates metabolic syndrome in stroke-prone spontaneously hypertensive rats[J]. BMC Complement Altern Med,2016,16(1):442. doi: 10.1186/s12906-016-1427-z
[15] AZIMIRAD M, ALEBOUYEH M, NAJI T. Inhibition of lipopolysaccharide-induced interleukin 8 in human adenocarcinoma cell line HT-29 by spore probiotics: B. coagulans and B. subtilis (natto)[J]. Probiotics & Antimicrobial Proteins, 2017, 9(1): 56-63.
[16] 赵会利, 曹玉凤, 高艳霞, 等. 纳豆芽孢杆菌对断奶犊牛生长性能和血液生化指标的影响[J]. 中国畜牧杂志,2013,49(17):66−69. [ZHAO H L, CAO T F, GAO Y X, et al. Effects of Bacillus natto on growth performance and blood biochemical indices of weaned calves[J]. Chinese Journal of Animal Science,2013,49(17):66−69. doi: 10.3969/j.issn.0258-7033.2013.17.016 [17] ISLAM J, SATO S, WATANABE K, et al. Dietary tryptophan alleviates dextran sodium sulfate-induced colitis through aryl hydrocarbon receptor in mice[J]. The Journal of Nutritional Biochemistry,2017,42:43−50. doi: 10.1016/j.jnutbio.2016.12.019
[18] 陈秋三, 夏宝莹, 韦建缘, 等. 番泻叶对小鼠粪便的影响[J]. 世界最新医学信息文摘,2018,18(2):86−87,174. [CHEN Q S, XIA B Y, WEI J Y, et al. Effects of senna leaves on feces in mice[J]. World Latest Medical Information,2018,18(2):86−87,174. doi: 10.19613/j.cnki.1671-3141.2018.02.065 [19] 周干南, 胡芝华, 汪亚先, 等. 小鼠腹泻模型的制备与腹泻指数的应用[J]. 中草药,1994,25(4):195−196,199,223−224. [ZHOU G N, HU Z H, WANG Y X, et al. An inquiry into preparing diarrhea model of mice and application of diarrhea index[J]. Chinese Traditional and Herbal Medicines,1994,25(4):195−196,199,223−224. [20] 王雪, 张圣方, 赵龙玉, 等. 长根菇多糖对小鼠肠道菌群及分泌型IgA的影响[J]. 食品工业科技,2015,36(13):376−379,384. [WANG X, ZHANG S F, ZHAO Y L, et al. Effect of Collybia radiata polysaccharides on intestinal flora and secretory immunoglobulin A in mice[J]. Science and Technology of Food Industry,2015,36(13):376−379,384. doi: 10.13386/j.issn1002-0306.2015.13.071 [21] 吴蕊, 余新超. 苦参提取液对肠致病性大肠杆菌感染小鼠的疗效研究[J]. 现代医药卫生,2015,31(5):665−667. [WU X, YU X C. Curative effect of sophora flavescens extraction in treatment of enteropathogenic E. coli of infected mice[J]. Modern Medical Health,2015,31(5):665−667. doi: 10.3969/j.issn.1009-5519.2015.05.010 [22] JAHIDUL I, AFIFIFAH Z A, KOUICHI W, et al. Fermented rice bran supplementation attenuates chronic colitis-associated extraintestinal manifestations in female C57BL/6N mice[J]. The Journal of Nutritional Biochemistry,2021,99:108855.
[23] AGISTA A Z, RUSBANA T B, ISLAMJ, et al. Fermented rice bran supplementation prevents the development of intestinal fibrosis due to DSS-Induced inflammation in mice[J]. Nutrients,2021,13(6):1869. doi: 10.3390/nu13061869
[24] 王广. 党参多糖对肠道菌群失调小鼠的调整作用机制的初步研究[D]. 佳木斯: 佳木斯大学, 2010. WANG G. Preliminary study on the regulatory mechanism of Codonopsis pilosula polysaccharide on intestinal microflora disorder mice[D]. Jiamusi: Jiamusi University, 2010.
[25] HAN B, LIU Y H, QIU Z Q, et al. Secretory immunoglobulin A and intestinal diseases[J]. Shijie Huaren Xiaohua Zazhi,2017,25(19):1757−1763.
[26] 孙博云, 王师英, 胡鸿毅. 肠黏膜通透性改变与炎症性肠病关系的研究进展[J]. 中国中西医结合消化杂志,2016,24(11):891−894. [SUN B Y, WANG S Y, HU H Y. Research progress on the relationship between intestinal permeability changes and inflammatory bowel disease[J]. Chinese Journal of Integrated Traditional and Western Medicine Digestion,2016,24(11):891−894. [27] ZHOU L, IVANOV I I, SPOLSKI R, et al. IL-6 programs TH-17 cell differentiation by promoting sequential engagement of the IL-21 and IL-23 pathways[J]. Nature Immunology,2007,8:967−974. doi: 10.1038/ni1488
[28] HUNTER C A. New IL-12-family members: IL-23 and IL-27, cytokines with divergent functions[J]. Nature Reviews Immunology,2005,5:521−531. doi: 10.1038/nri1648
[29] KOMIYAMA Y, ANDOH A, FUJIWARA D, et al. New prebiotics from rice bran ameliorate inflflammation in murine colitis models through the modulation of intestinal homeostasis and the mucosal immune system[J]. Scand J Gastroenterol,2011,46:40−52. doi: 10.3109/00365521.2010.513062
[30] 王菁. 不同种类及剂量全谷物对糖脂代谢及相关机制的研究[D]. 南京: 东南大学, 2019 WANG J. Study on different kinds and doses of whole grains on glucolipid metabolism and its mechanism[D]. Nanjing: Southeast University, 2019.
[31] 陈博睿, 付永霞, 侯殿志, 等. 不同摄入量小米对小鼠肠道菌群和短链脂肪酸的影响[J]. 食品科学技术学报,2022,40(3):56−67. [CHEN B R, FU Y X, HOU D Z, et al. Effects of different foxtail millet intake on gut microbiota and short chain fatty acids in mice[J]. Journal of Food Science and Technology,2022,40(3):56−67. doi: 10.12301/spxb202100871 [32] HONDA K, LITTMAN D R. The microbiota in adaptive immune homeostasis and disease[J]. Nature,2016,535:75−84. doi: 10.1038/nature18848
[33] RYAN E P. Bioactive food components and health properties of rice bran[J]. J Am Vet Med Assoc,2011,238:593−600. doi: 10.2460/javma.238.5.593
[34] 于健康. 复方白头翁散对小鼠的止泻作用研究[D]. 雅安: 四川农业大学, 2018. YU J K. Study on antidiarrheal effect of Compound Baitouweng Powder on mice[D]. Yaan: Sichuan Agricultural University, 2018.
[35] GUO L, SUN Y L, WANG A H, et al. Effect of polysaccharides extract of Rhizoma atractylodis macrocephalae on thymus, spleen and cardiac indexes, caspase-3 activity ratio, Smac/DIABLO and HtrA2/Omi protein and mRNA expression levels in aged rats[J]. Molecular Biology Reports,2012,39(10):9285−9290. doi: 10.1007/s11033-012-1677-x
[36] ANGELA J H, STEVEN W D, ELIZABETH P R, et al. Consumption of rice bran increases mucosal immunoglobulin A concentrations and numbers of intestinal Lactobacillus spp[J]. Journal of Medicinal Food,2012,15(5):469−475. doi: 10.1089/jmf.2011.0213
[37] 林莹, 杨军红, 陈颖新, 等. 米油对急性腹泻患儿大便分泌型免疫球蛋白A含量及疾病转归的影响[J]. 中华临床营养杂志,2015,23(4):214−218. [LIN Y, YANG J H, CHEN Y X, et al. Effect of millet oil on fecal secreted immunoglobulin A content and disease outcome in children with acute diarrhea[J]. Chinese Journal of Clinical Nutrition,2015,23(4):214−218. doi: 10.3760/cma.j.issn.1674-635X.2015.04.004 -
期刊类型引用(2)
1. 王秋月,靳攀,蒲锐. 运动干预与细胞焦亡在骨关节炎中的作用. 中国组织工程研究. 2025(08): 1667-1675 .  百度学术
百度学术
2. 朱悦,张蒙,张源源,牛梦竹,张宝文,寇现娟. 跑台运动通过下调p38MAPK信号抑制细胞焦亡改善2型糖尿病小鼠心肌纤维化的研究. 中国康复医学杂志. 2024(10): 1417-1429 .  百度学术
百度学术
其他类型引用(4)





 下载:
下载:


 下载:
下载:



