Construction of MnO2/ZnO/GCE Electrochemical Sensor and the Detection of Sulfamethoxazole in Honey
-
摘要: 为快速检测蜂蜜中磺胺甲恶唑(sulfamethoxazole,SMZ)的残留,将水热法制备的氧化锌(ZnO)及共沉淀法制备的二氧化锰(MnO2)材料复合于玻碳电极(GCE)上,构建了MnO2/ZnO/GCE电化学传感器用于检测SMZ。采用扫描电镜(SEM)及红外光谱(FT-IR)对复合材料的形貌、结构进行表征。利用差分脉冲伏安法(DPV)对复合材料的比例、修饰量进行探究,从而对传感器的构建条件进行优化。并采用差分脉冲伏安法(DPV)及循环伏安法(CV)对缓冲溶液pH、扫描速率等检测条件进行考察。结果表明,当m(ZnO):m(MnO2)质量比为1:0.6、MnO2/ZnO复合材料修饰量为1.7×10−3 mg/mm2、缓冲溶液pH为8、扫描速率为30 mV/s时,该传感器对SMZ具有良好的检测效果。在0.3~100 μmol/L范围内,峰电流与SMZ浓度呈良好的线性关系,其线性方程为Ip=0.0843 c+4.5168(R2=0.9916),检测限为0.39 μmol/L,定量限为1.30 μmol/L。将传感器用于蜂蜜样品的检测,加标回收率为95.5%~102.6%,相对标准偏差(RSD)为0.68%~2.55%。表明该传感器能够实现对SMZ含量的准确检测,对于蜂蜜样品SMZ残留量的检测方面具有一定的应用价值。Abstract: In order to rapidly detect sulfamethoxazole (SMZ) residues in honey, zinc oxide (ZnO) prepared by hydrothermal method and manganese dioxide (MnO2) prepared by co-precipitation method were compounded on glassy carbon electrode (GCE) to construct MnO2/ZnO/GCE electrochemical sensor for the detection of SMZ. The morphology and structure of the composites were characterized by scanning electron microscopy (SEM) and Fourier transform infrared spectroscopy (FT-IR). Differential pulse voltammetry (DPV) was used to explore the ratio and modification amount of the composite material to optimize the construction conditions of the sensor. DPV and cyclic voltammetry (CV) were used to investigate the detection conditions such as buffer solution pH and scanning rate. The results showed that when the mass ratio of m(ZnO):m(MnO2) was 1:0.6, the addition amount of MnO2/ZnO composite was 1.7×10−3 mg/mm2, the pH was 8 and the scanning rate was 30 mV/s, the sensor had a good detection effect on SMZ. In the range of 0.3~100 μmol/L, the peak current of SMZ had a good linear relationship with the concentration, the linear equation was Ip=0.0843c+4.5168 (R2=0.9916), the limit of detection was 0.39 μmol/L and the limit of quantification was 1.30 μmol/L. The sensor was applied to the determination of honey sample, with a recovery of 95.5%~102.6% and a relative standard deviation (RSD) of 0.68%~2.55%. It shows that the sensor can realize the accurate detection of SMZ content. It has certain application value for the detection of SMZ residues in honey samples.
-
Keywords:
- zinc oxide (ZnO) /
- manganese dioxide (MnO2) /
- sulfamethoxazole /
- honey /
- electrochemical detection
-
磺胺类(SAs)抗生素为人工合成抗生素,因具有优良的抗菌和杀菌作用而受到广泛关注[1-3]。其中磺胺甲恶唑(sulfamethoxazole, SMZ)对革兰氏阴性和阳性细菌均有抗菌活性[4-5],并且将其用于动物养殖中能够预防和治疗多种动物疾病[6],因此它被部分蜂农用来防治蜜蜂感染的多种细菌病症[7]。SMZ在蜜蜂体内代谢缓慢,若过量使用则会导致其在蜜蜂体内的残留从而转移至蜂蜜产品中,长期食用含有SMZ的蜂蜜产品会引发人体过敏反应[8]、耐药性甚至致癌,引发多种风险[9],对人体健康存在很大的潜在危险[10],因此,对于蜂蜜中SMZ残留的检测十分必要。目前,国标中采用液相色谱-串联质谱法来检测蜂蜜中磺胺类物质的残留量[11],其他用于检测SMZ的方法有高效液相色谱法[12]、分光光度法[13]、毛细管电泳法[14]等。但这些方法存在操作繁杂、仪器设备昂贵等问题[15],与传统方法相比,电化学检测法因具备操作简便、成本较低且灵敏度高等优点[16],同时其设备较小,可以实现快速现场检测[17],因此该方法适用于蜂蜜中SMZ残留的快速灵敏检测。
为了增强传感器的检测信号,研究者经常选择具有催化活性的材料用于修饰电极。金属氧化物因具备优良的电催化性能,且价格低廉、稳定性好等优势在电化学传感器的构建中备受关注[18]。其中ZnO是一种成本低廉、无毒、热稳定好的半导体材料[19],同时它因具备优良的电子传输能力和电催化活性[20],且形貌、尺寸易于调控,现已被广泛用作电极的修饰材料[21-22]。已有研究者利用ZnO掺杂石墨烯所构成的纳米复合材料对SMZ进行检测[23],该传感器虽具有良好的稳定性,但其检出限相对较高。已有相关研究表明将ZnO与金属氧化物相结合能够提高传感器的电催化性能[24]。在诸多金属氧化物中,MnO2因其无毒、稳定性好且电催化性能优异,而被认为是较有前途的电化学传感器修饰材料之一[25-26]。目前,将ZnO与MnO2复合用于测定SMZ的研究未见报道。
本实验将ZnO和MnO2复合用于电化学传感器的构建,以期可以起到放大电信号、提升电子转移能力的作用,从而提高传感器的电化学性能。采用水热法来制备纳米棒状ZnO,并将其与MnO2相复合,将复合材料滴涂在玻碳电极(GCE)表面对SMZ进行电化学检测。通过对复合电极的修饰材料比例、修饰量进行优化,从而构建一种用于检测SMZ的MnO2/ZnO/GCE电化学传感器。并且探究了缓冲溶液pH、扫描速率对于传感器在检测中影响,而后将其应用于蜂蜜样品的检测。以期为蜂蜜中SMZ的残留检测提供一种高效、高灵敏度的检测方法。
1. 材料与方法
1.1 材料与仪器
磺胺甲恶唑(98%)、磺胺二甲基嘧啶(98%)、氧氟沙星(98%)、奥硝唑(98%)、氯霉素(98%) 阿拉丁公司;乙酸锌 福晨精细化工;高锰酸钾、硫酸锰、氢氧化钠、N,N-二甲基甲酰胺 登峰精细化工;市售蜂蜜 超市购买;散装蜂蜜 农户处购买;所有有机试剂均为分析纯。
S-3400N扫描电子显微镜 日立有限公司;Spectrum型傅里叶变换红外光谱仪 铂金埃尔默有限公司;KH-50 mL水热合成反应釜 西安正仪仪器有限公司;ZKXF型真空干燥箱 上海树立仪器仪表有限公司;KQ-250DE型数控超声波清洗器 昆山市超声仪器有限公司;玻碳电极、铂电极、甘汞电极 上海越磁电子科技有限公司;CHI660E型电化学工作站 上海辰华仪器公司。
1.2 实验方法
1.2.1 MnO2/ZnO复合材料的制备及表征
称取1.5 g乙酸锌及4.0 g氢氧化钠溶于40 mL去离子水中,再加入25 mL无水乙醇[23],搅拌均匀后将得到的溶液转移至水热反应釜中,在真空干燥箱中120 ℃反应8 h,冷却后分别使用去离子水、无水乙醇反复洗涤。在真空干燥箱中保持60 ℃干燥12 h,最后置于马弗炉中500 ℃焙烧2 h,研磨后得到棒状ZnO样品。
分别配制0.4 mol/L高锰酸钾溶液及0.6 mol/L硫酸锰溶液,将二者混合后进行磁力搅拌[27],常温下搅拌8 h后,将其转移至离心机中离心(5000 r/min,20 min),弃去上清液后将沉淀物质用去离子水反复洗涤后烘干得到MnO2。按照m(ZnO):m(MnO2)质量比为1:0.6称取材料,将其溶于去离子水中制备成浓度为1 mg/mL的溶液,超声分散均匀后干燥得到MnO2/ZnO复合物。
利用红外光谱(FT-IR)对MnO2/ZnO复合材料进行分析,于400~4000 cm−1波数范围内观察其特征峰。利用扫描电镜(SEM)在电压为10 kV、放大倍数为10万倍的测试条件下,对复合材料的形貌及分布进行表征分析。
1.2.2 电化学传感器的构建
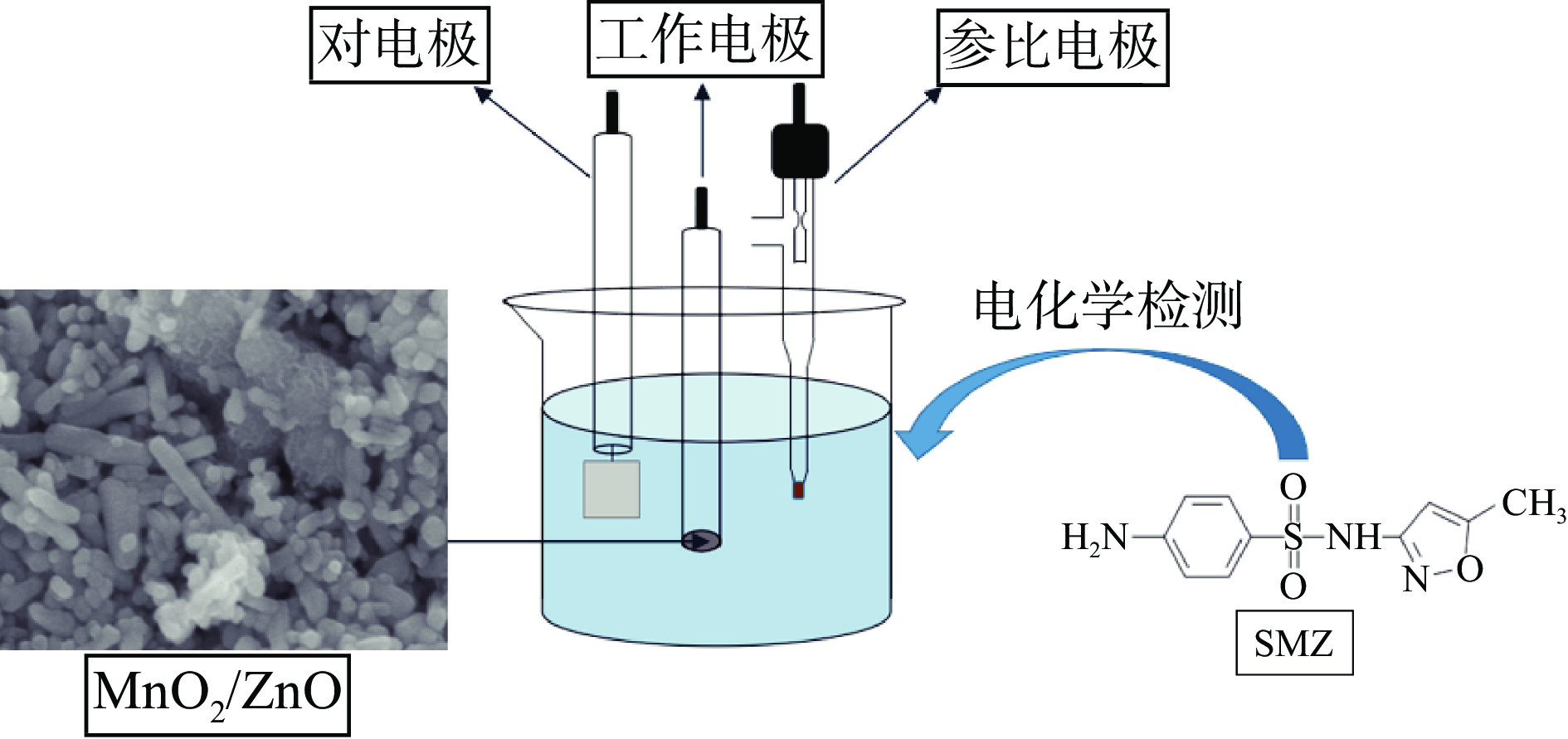
电化学测试采用三电极体系,以玻碳电极为工作电极,铂片电极为对电极,饱和甘汞电极为参比电极。将玻碳电极(直径为3 mm)用氧化铝粉末打磨光滑,依次用去离子水、无水乙醇反复清洗干净。将MnO2/ZnO复合材料溶解于N,N-二甲基甲酰胺中配制成浓度为1 mg/mL的溶液,超声分散40 min,将分散均匀的MnO2/ZnO复合材料滴涂至处理干净后的GCE电极上干燥,即成功制备MnO2/ZnO/GCE复合电极,并用同样的方法制备ZnO/GCE电极,将两种修饰电极与GCE电极作为对比实验对SMZ进行检测,其检测示意图如图1所示。
1.2.3 电化学传感器测试
实验以铂片为对电极,饱和甘汞电极为参比电极,GCE、ZnO/GCE、MnO2/ZnO/GCE分别为工作电极,在含有0.1 mol/L氯化钾、1 mmol/L的铁氰化钾/亚铁氰化钾溶液中进行电化学阻抗(EIS)测试,从而考察传感器的电化学性能。并且实验利用DPV法在电位范围0.2~1.1 V、振幅0.05 V、脉冲周期0.2 s、静置时间5 s的测试参数及缓冲溶液pH为8,SMZ添加浓度为6 μmol/L的检测条件下,通过比较氧化峰响应电流的大小从而对GCE、ZnO/GCE及MnO2/ZnO/GCE的电化学行为进行测试。
1.2.4 MnO2/ZnO/GCE传感器的构建及测试方法
以MnO2/ZnO/GCE为工作电极,磷酸盐缓冲溶液作为电解液,在电位范围0.2~1.1 V、振幅0.05 V、脉冲周期0.2 s、静置时间5 s的条件下,利用DPV法探究电极的修饰材料比例、修饰量(电极单位面积修饰量(mg/cm2)=(滴涂量(μL)×材料浓度(mg/mL)/电极面积(mm2))对SMZ检测的影响。实验在电极修饰量为1.1×10−3 mg/mm2、缓冲溶液pH为8、SMZ浓度为6 μmol/L的条件下,分别将m(ZnO):m(MnO2)质量比为1:0.2、1:0.4、1:0.6、1:0.8及1:1的复合材料制备成浓度为1.0 mg/mL的混合溶液滴涂于GCE表面,利用DPV法探究修饰材料比例不同的情况下对SMZ的催化效果。同时,在m(ZnO):m(MnO2)质量比1:0.6、缓冲溶液pH8、SMZ浓度为6 μmol/L的条件下,分别将修饰量为8.5×10−4、1.1×10−3、1.4×10−3、1.7×10−3、2.0×10−3 mg/mm2的复合材料滴涂于GCE表面,利用DPV法探究不同修饰量对SMZ的催化效果。
为确定最佳测试条件,实验在相同的DPV测试参数、m(ZnO):m(MnO2)质量比为1:0.6、电极修饰量为1.7×10−3 mg/mm2、SMZ浓度为6 μmol/L的条件下,将缓冲溶液pH设置为5.0、6.0、7.0、8.0、9.0,通过改变缓冲溶液的pH探究其对SMZ响应峰电流及电位的变化。并且在电位范围为0.2~1.1 V、m(ZnO):m(MnO2)质量比为1:0.6、电极修饰量为1.7×10−3 mg/mm2、缓冲溶液pH为8、SMZ浓度为6 μmol/L的条件下,利用循环伏安法(CV)探究了MnO2/ZnO/GCE电化学传感器在10、20、30、40、50、60、70 mV/s的扫描速率下对测试体系的影响。
1.2.5 MnO2/ZnO/GCE传感器对SMZ的电化学检测
在m(ZnO):m(MnO2)质量比为1:0.6、电极修饰量为1.7×10−3 mg/mm2、缓冲溶液pH为8的测试条件下,配制0.3、1、3、5、20、35、55、75、100 μmol/L浓度的SMZ标准品溶液,并用DPV法对其进行测定,根据不同SMZ浓度与氧化峰电流值绘制工作曲线,并确定检测范围及计算检测限(LOD)与定量限(LOQ),根据公式(1)计算检测限,根据公式(2)计算定量限:
LOD=3σ/S (1) LOQ=10σ/S (2) 式中:S为函数方程的斜率;σ表示空白样品的标准偏差
1.2.6 MnO2/ZnO/GCE传感器重现性、稳定性及抗干扰性测试
在相同检测条件下,利用3支复合电极检测同一浓度下的SMZ,并且将同一电极进行重复测试3次以及观察电极储存5 d前后的检测电流变化从而判断复合电极的稳定性。将最佳检测条件下的MnO2/ZnO/GCE电极置于pH为8的磷酸盐缓冲溶液中,分别加入一定浓度的SMZ以及浓度为SMZ 5倍的磺胺二甲基嘧啶(sulfamethazine, SMT)、氧氟沙星(ofloxacin, OFX)、奥硝唑(ornidazole, ONZ)、氯霉素(chloramphenicol, CAP)溶液,通过观察其氧化峰电流值的变化,探究本实验所构建的传感器的抗干扰性能。
1.2.7 加标回收试验
称取5 g经检测SMZ未检出的蜂蜜样品(空白样品)于锥形瓶中,加入5 mL 0.2 mol/L PBS溶液(pH 8.0)用于稀释样品,并在室温下超声后离心15 min,取上清液分别加入5、10、15 μmol/L的SMZ标准溶液,并且每个浓度重复试验3次,通过添加不同浓度SMZ的氧化峰响应电流值计算其加标回收率。
1.2.8 实际样品检测
为探究本实验构建的MnO2/ZnO/GCE传感器在实际蜂蜜样品中的可应用性,选择市售及散装蜂蜜进行实际样品检测,按1.2.7中方法对蜂蜜进行前处理,在蜂蜜样品中添加2、5、10 μmol/L的SMZ进行实际样品分析。
1.3 数据处理
试验均进行3次平行实验,采用Origin 2018软件进行数据处理及绘图,采用SPSS 25.0统计软件进行显著性分析,显著性水平设置为P<0.05。
2. 结果与分析
2.1 MnO2/ZnO复合材料的表征
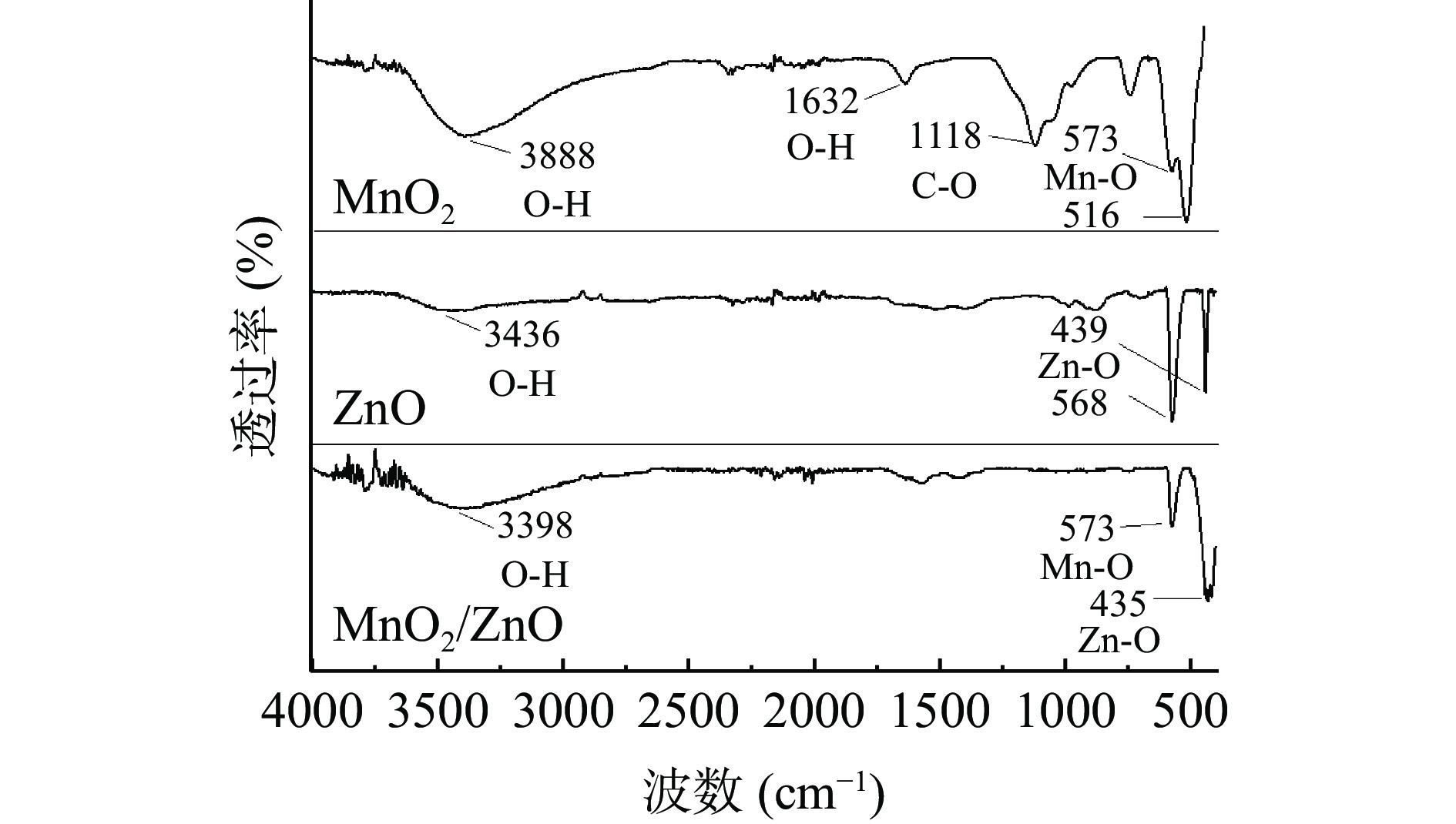
采用SEM以及FT-IR对MnO2/ZnO复合材料进行表征。图2(a)为ZnO形貌图,可以看出ZnO呈纳米棒状结构,其分布较为均匀,棒的直径在60 nm左右,长度约为100~400 nm。图2(b)为MnO2/ZnO复合材料形貌图,可以看出有团聚的球状MnO2嵌入在棒状结构的ZnO中,说明二者已进行成功复合。图3为不同材料的FT-IR图,由图可以看出,MnO2在516 cm−1和573 cm−1处的特征峰是由Mn-O键引起的[28],ZnO在568 cm−1及439 cm−1处的吸收峰对应于Zn-O键的振动[29]。在MnO2/ZnO复合材料中,3398 cm−1处较宽的吸收峰是由于样品表面吸附的水的O-H伸缩振动引起的[30],位于573 cm−1处的特征峰是由Mn-O键引起的,这与MnO2红外图的吸收峰相符,在435 cm−1处为氧化锌的Zn-O振动峰[31],结果表明,MnO2/ZnO复合材料已制备成功。
2.2 MnO2/ZnO/GCE传感器测试
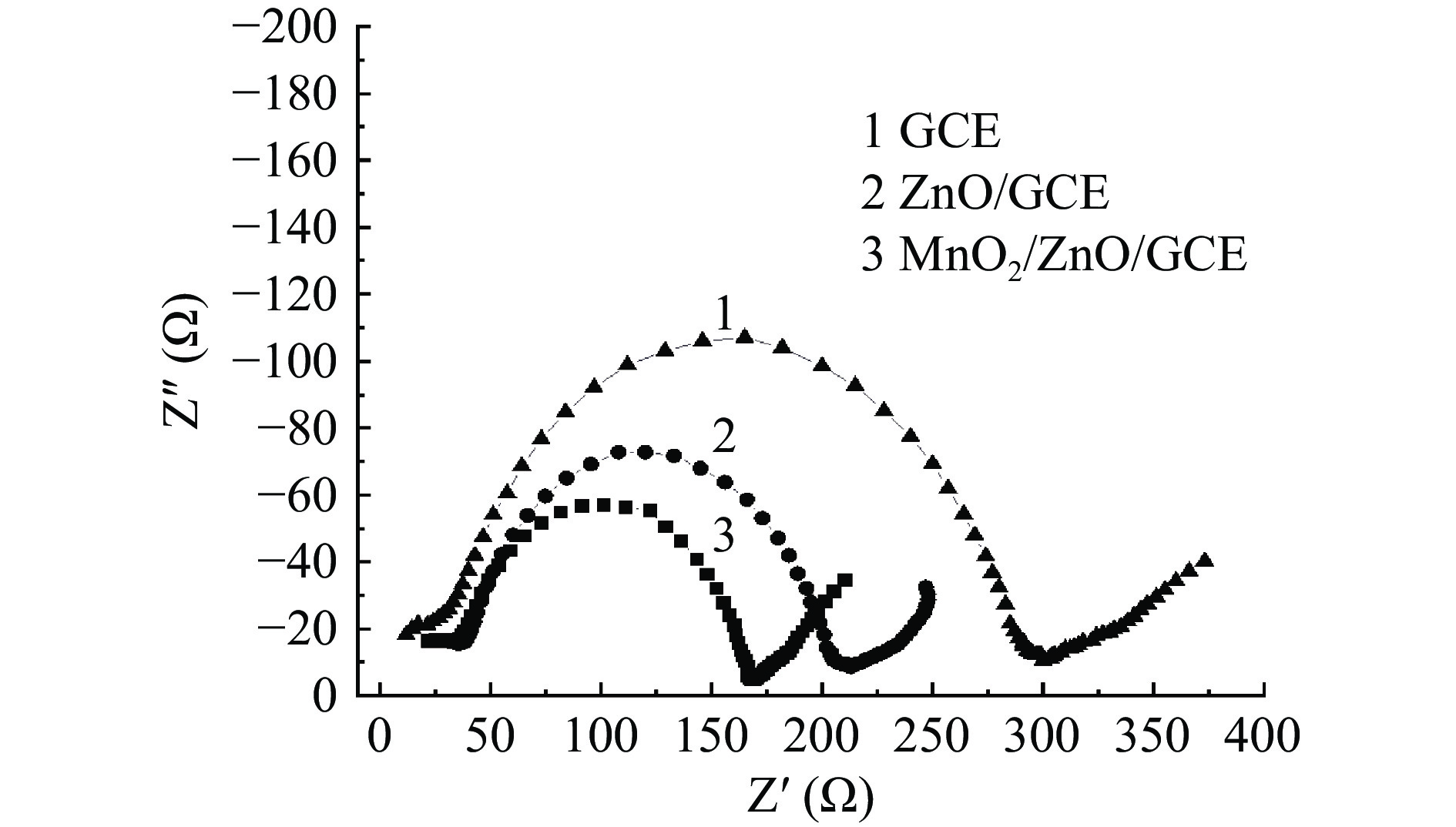
为考察不同修饰电极的电化学性能,本实验在含有0.1 mol/L氯化钾、1 mmol/L的铁氰化钾/亚铁氰化钾溶液中进行了电化学阻抗(EIS)测试。图4为三种电极的Nyquist图,其高频处的半圆形部分与电子转移过程相对应,半圆区域直径大小与电荷转移阻力有关,直径越大,其电阻也越高[32]。由图可以看出GCE电极半圆直径最大,ZnO/GCE、MnO2/ZnO/GCE的半圆直径依次减小,其中MnO2/ZnO/GCE的半圆直径最小,说明MnO2/ZnO复合材料能够降低传荷电阻,提高电子转移能力。
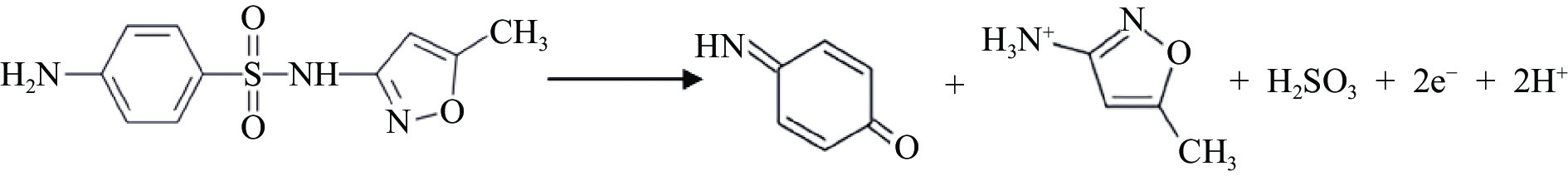
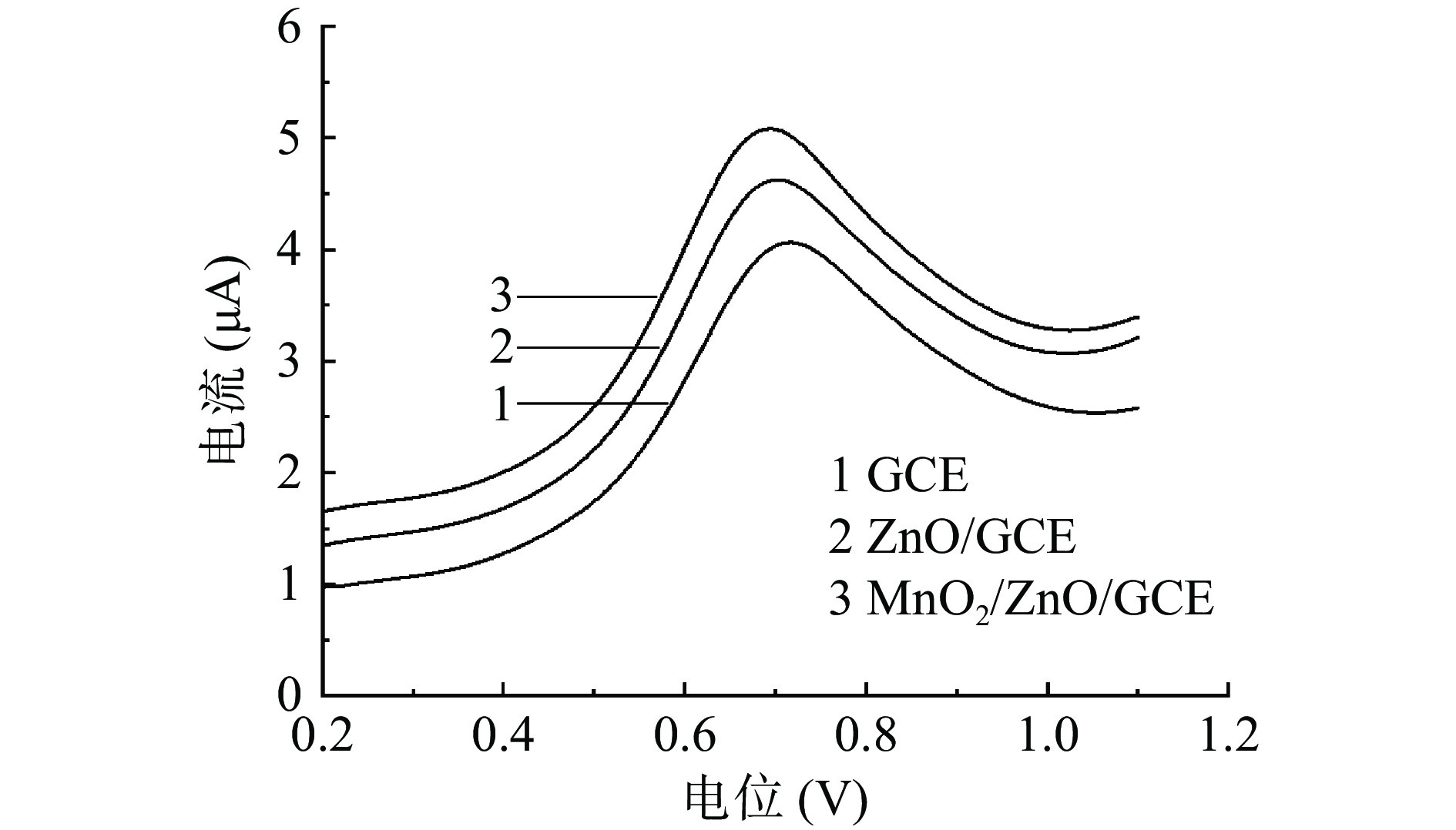
SMZ的电化学反应包含两个质子及两个电子的反应,反应机理如图5所示。首先是在氨基基团上发生单电子氧化反应,在氮上形成阳离子自由基,然后第二个电子又快速失去,形成了亚氨基苯醌,从而在电化学检测反应中形成氧化峰[33]。本实验利用DPV法在pH为8、SMZ浓度为6 μmol/L的检测条件下对GCE、ZnO/GCE及MnO2/ZnO/GCE的电化学行为进行了比较。DPV法检测结果如图6所示,GCE电极对于SMZ在电位为0.72 V处出现氧化峰响应电流,用ZnO进行电极修饰后在电位为0.7 V处出现响应电流,且电流值有所增高,这是因为纳米ZnO具有快速的电子转移能力,能够提高催化反应活性,增大反应电流[34]。当采用MnO2/ZnO二元复合材料修饰电极时其响应电流对应的电位最小,氧化峰电流值为最大,这表明ZnO和MnO2的复合能够增强电子转移能力,使传感器具有更好的灵敏度,这与EIS测试结果相符合,因此本实验选择MnO2/ZnO/GCE传感器进行后续试验。
2.3 MnO2/ZnO/GCE传感器的构建条件及测试条件优化结果
2.3.1 修饰材料比例对传感器的影响
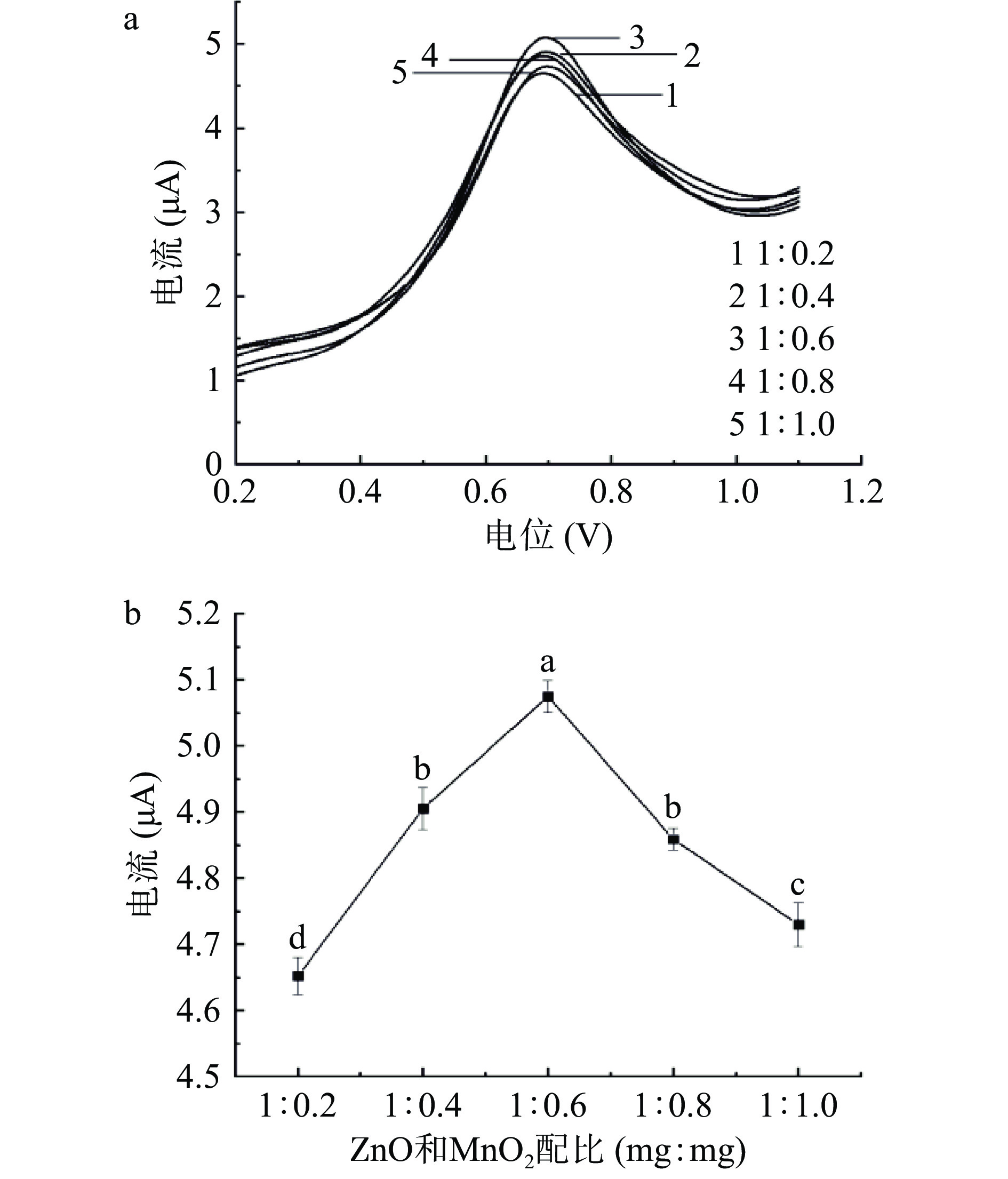
本实验在电极修饰量为1.1×10−3 mg/mm2、缓冲溶液pH为8、SMZ浓度为6 μmol/L的检测条件下,利用DPV法探究了修饰材料比例不同的情况下MnO2/ZnO/GCE电极对SMZ的催化效果。将m(ZnO):m(MnO2)质量比为1:0.2、1:0.4、1:0.6、1:0.8及1:1.0的复合材料制备成浓度为1.0 mg/mL的混合溶液,将其分别滴涂于GCE电极表面。检测结果如图7(a)、7(b)所示,不同修饰材料比例检测SMZ电流存在显著性差异(P<0.05),并且随着二元复合材料比例的增加,其响应峰电流值逐渐升高,当修饰材料质量比例为1:0.6时峰电流响应达到最高点,当修饰材料比例加大时,其峰电流值呈下降趋势,这可能是因为复合材料比例过高会阻碍其电活性位点的反应,从而降低电子传输效率[35],其响应峰电流值将不会继续增高,因此确定出本实验修饰材料的最佳质量比例为1:0.6。
2.3.2 复合材料修饰量对传感器的影响
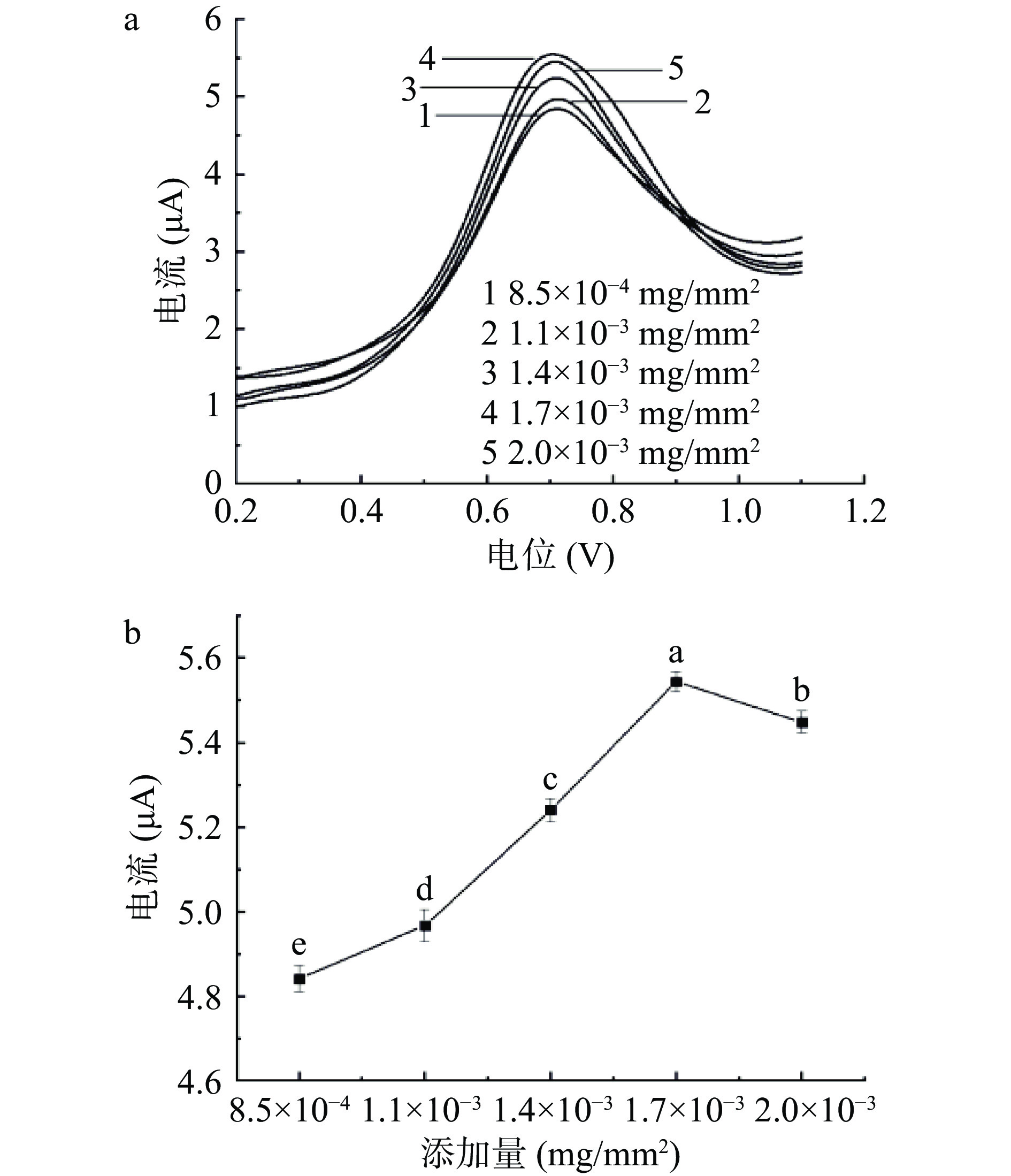
在m(ZnO):m(MnO2)质量比为1:0.6、缓冲溶液pH为8、SMZ浓度为6 μmol/L的条件下,利用DPV法探究了MnO2/ZnO复合材料不同修饰量对SMZ峰电流值的变化情况。将浓度为1.0 mg/mL的复合材料滴涂于GCE表面,经计算复合材料在电极上的单位面积修饰量分别为8.5×10−4、1.1×10−3、1.4×10−3、1.7×10−3、2.0×10−3 mg/mm2。其检测结果如图8(a)及8(b)所示,不同复合材料修饰量检测SMZ电流存在显著性差异(P<0.05),当修饰量较小时其提供的反应催化活性位点较少,随着MnO2/ZnO复合材料修饰量的不断增加,峰电流值明显逐步增大,当电极表面添加量为1.7×10−3 mg/mm2时其响应峰电流达到最大值,继续增大修饰量时其响应峰电流逐渐降低,这可能是因为过量的复合材料会使得修饰层变厚,导致部分活性位点被掩盖从而达不到有效传递电子的目的[36]。因此确定出本实验中修饰材料的电极单位面积修饰量为1.7×10−3 mg/mm2。
2.3.3 pH对传感器的影响
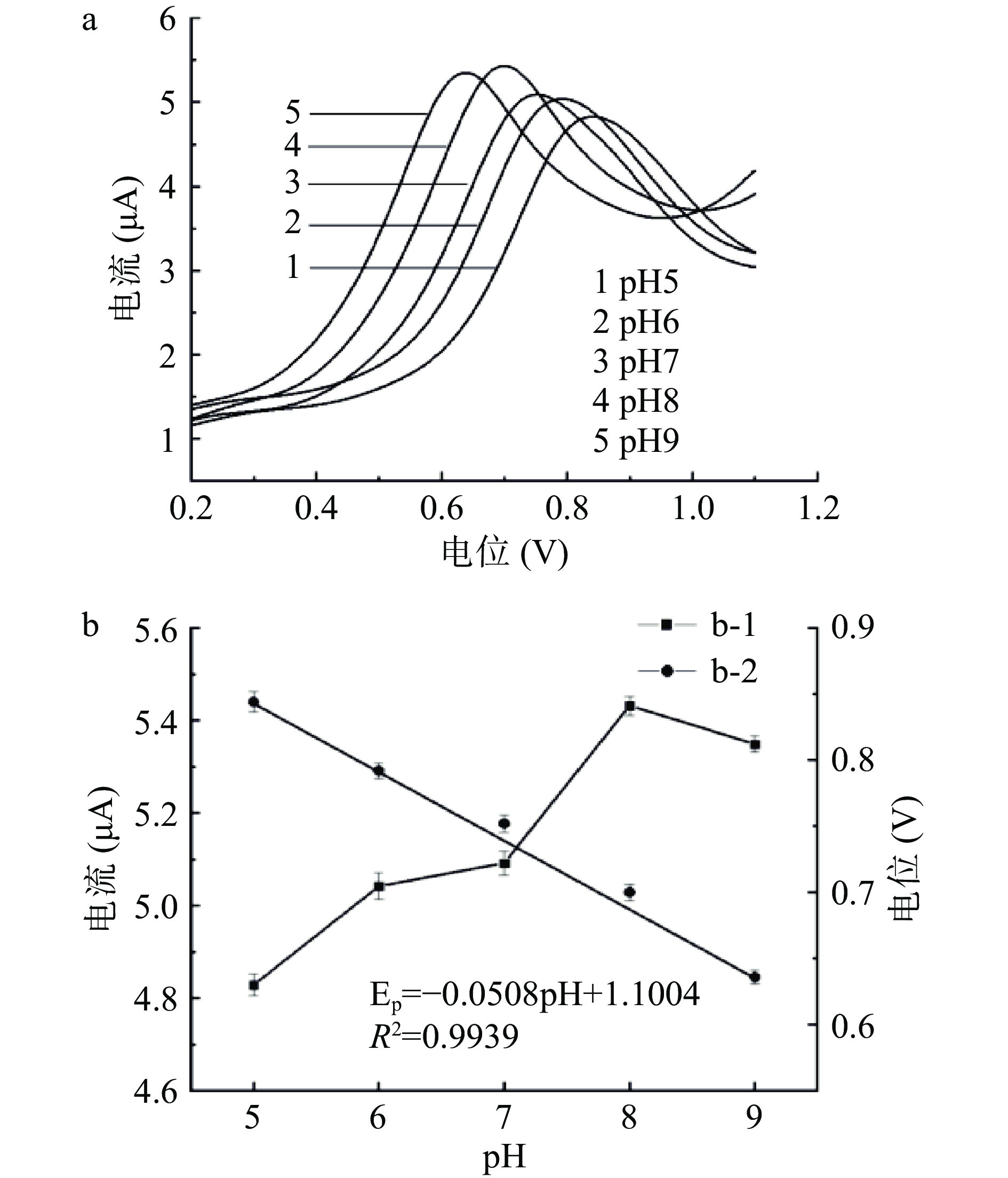
本实验以磷酸缓冲溶液为电解质,在m(ZnO):m(MnO2)质量比为1:0.6,修饰量为1.7×10−3 mg/mm2、SMZ浓度为6 μmol/L的条件下,通过改变缓冲溶液的pH对SMZ响应峰电流及电位的变化进行研究。由图9(a)可知,pH对SMZ的氧化过程有着较为显著的影响,在pH为5.0~9.0范围内,当pH为8.0时更有利于其氧化反应的发生,其氧化峰响应电流达到最高,并且其氧化峰电位随着pH增大逐渐向正电位较低的值偏移,这是由于SMZ在缓冲溶液pH较高的情况下发生了去质子化反应[37]。如图9(b)中b-2所示,pH与其氧化峰电位存在线性关系,线性回归方程为Ep=−0.0508pH+1.1004,R2=0.9939,斜率与理论值−59 mV/pH较为接近,说明SMZ的电化学反应是等电子等质子过程[38]。因pH为8.0时其氧化峰响应电流最高,因此本实验确定所使用的缓冲溶液pH为8.0。
2.3.4 扫描速率对传感器的影响
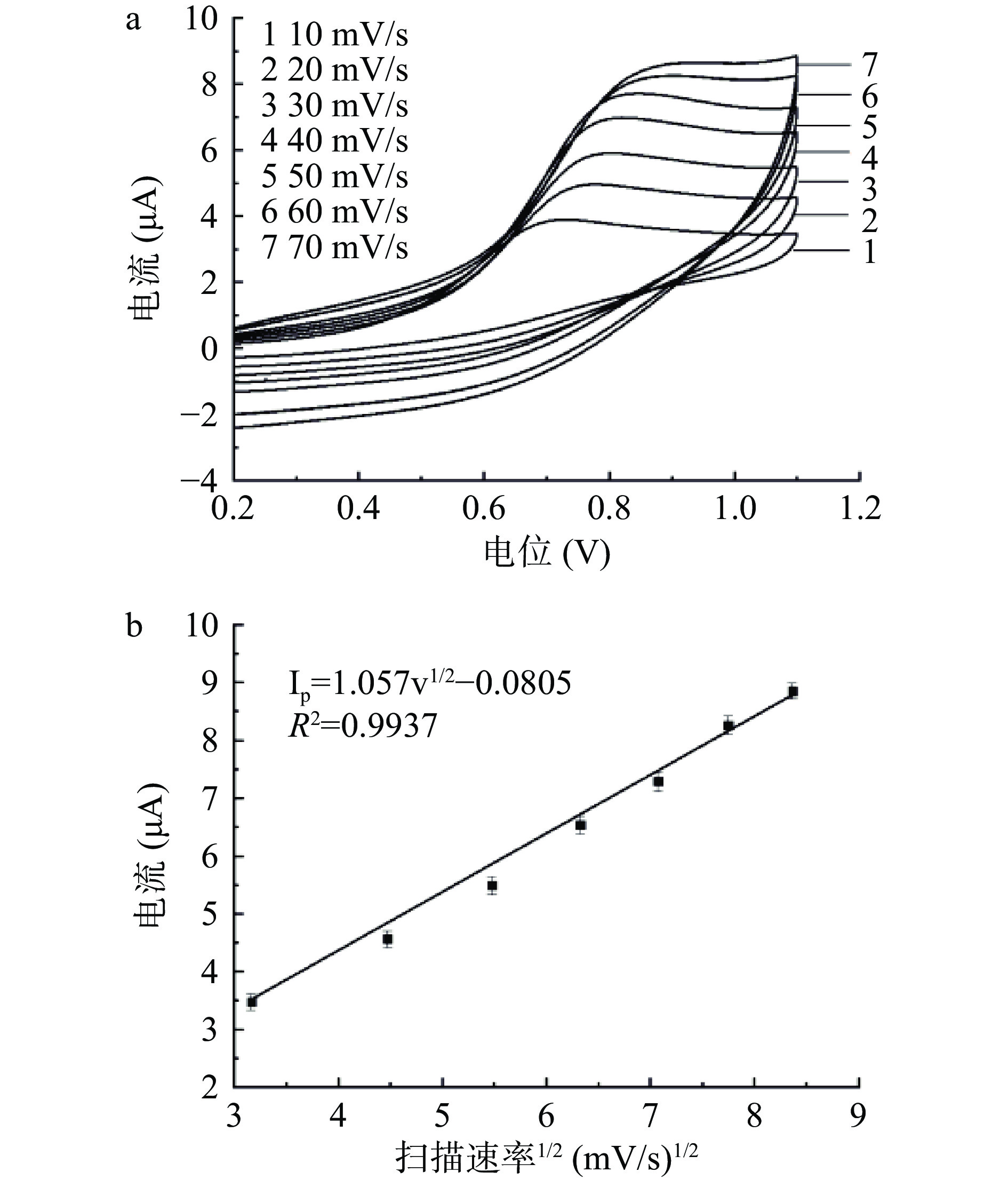
本实验探究了在10~70 mV/s扫描速率范围内MnO2/ZnO/GCE电极在6 μmol/L SMZ溶液中的CV响应。扫描速率对MnO2/ZnO/GCE电化学传感器检测影响结果如图10(a)所示,在10~70 mV/s范围内,其氧化峰电流值随扫速增加而增大,且均产生了SMZ氧化的阳极电流,在反向扫描中未观察到明显的还原电流,表明SMZ在电极上发生的为不可逆氧化反应[39]。由图10(b)可以看出其电流响应值与扫描速率的平方根呈良好的线性关系,回归方程为Ip=1.057 v1/2 −0.0805,R2=0.9937,表明SMZ在该电极的反应受表面扩散过程控制[40]。随着扫描速率的增加,其氧化峰电流与背景电流均会随之增大[41],为确保试验结果的准确性,因此选择30 mV/s作为扫描速率。
2.4 MnO2/ZnO/GCE对SMZ的检测
在最佳检测条件下,本实验利用DPV法在磷酸缓冲溶液中对不同浓度的SMZ进行检测,观察其氧化峰电流响应值。由图11(a)及11(b)可知,在0.3~100 μmol/L浓度范围内,其电流值随浓度增加而增大,且峰电流值与SMZ浓度呈较好的线性关系,其回归方程为Ip=0.0843c+4.5168,R2=0.9916,MnO2/ZnO/GCE电化学传感器的检测范围为0.3~100 μmol/L,以3倍信噪比(S/N=3)计算检测限为0.39 μmol/L,以10倍信噪比计算定量限为1.30 μmol/L。将本实验的检测限与其他文献进行比较(表1),结果说明本实验构建的传感器检测限较低,具有较好的灵敏度。
2.5 MnO2/ZnO/GCE重现性、稳定性及抗干扰能力测试
在相同条件下制备3支同样的MnO2/ZnO/GC复合电极,在含有同一SMZ浓度的电解质溶液中进行测定。结果显示3支电极的峰电流值RSD为4.12%。并且将同一支电极在相同检测环境下测试3次,其电流值变化较小,RSD为2.55%。将复合电极置于4 ℃冰箱中保存5 d后再次进行测试,其电流值相比于储存前的初始电流值仅下降2.91%,说明MnO2和ZnO材料化学稳定性均较好。三种研究结果表明,本实验所制备的MnO2/ZnO/GCE传感器对于SMZ的检测具有良好的可重现性及稳定性。
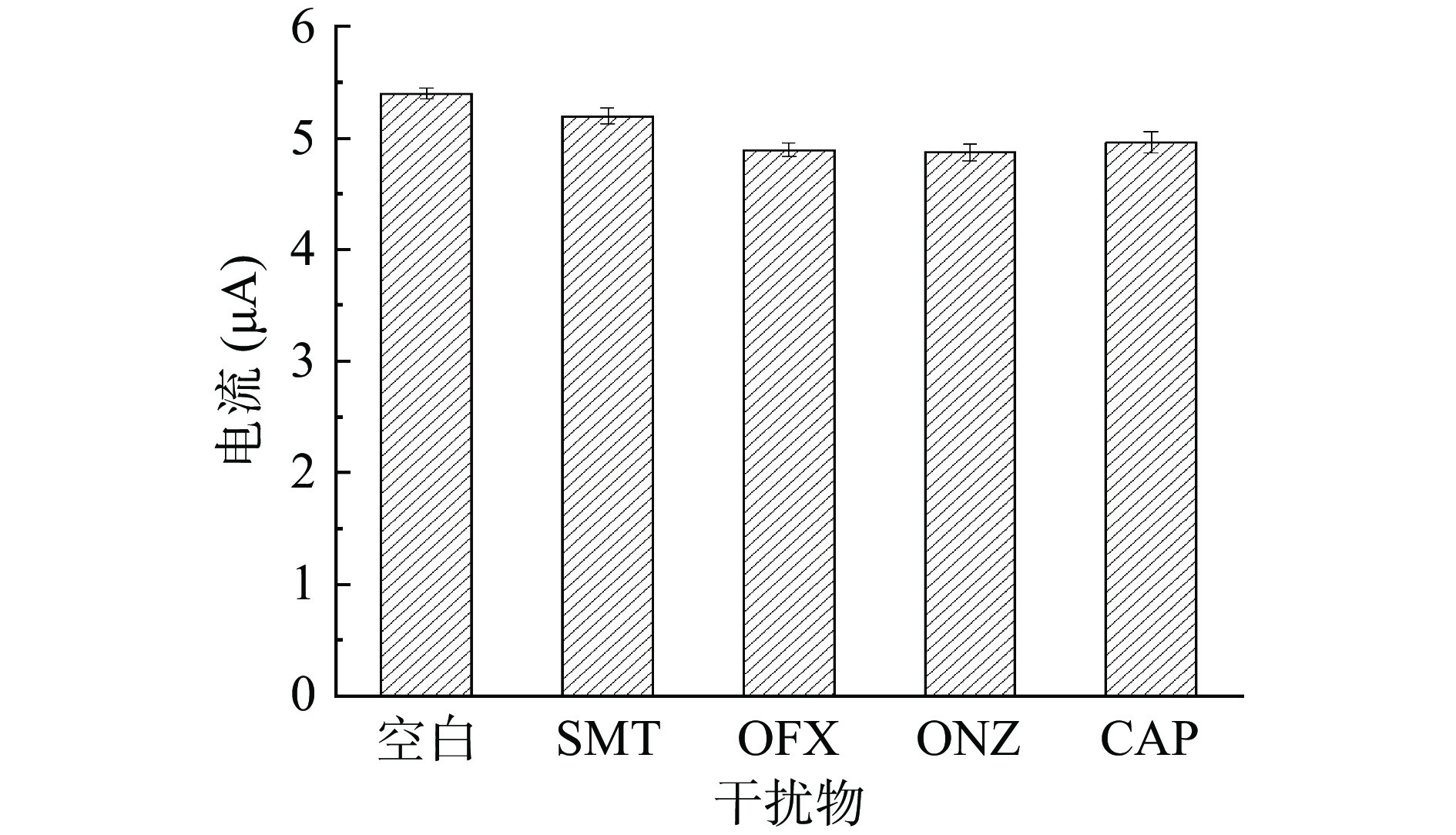
在对蜂蜜的检测中,由于蜂蜜的基质较为复杂,因此对于复合电极的抗干扰能力测试较为关键。考虑到蜂蜜中可能含有其他类型的抗生素,因此本实验以含有6 μmol/L SMZ溶液的检测电流值为空白参照,在含有6 μmol/L SMZ的缓冲溶液中分别添加SMZ浓度5倍的SMT、OFX、ONZ、CAP四种抗生素,通过其氧化峰响应电流值考察MnO2/ZnO/GCE的抗干扰能力。如图12可知,在其他抗生素存在的情况下,并未对SMZ的电信号产生较大影响,这表明MnO2/ZnO/GCE传感器抗干扰能力较好,对SMZ具有较高的选择性。
2.6 加标回收试验结果
将浓度为5、10、15 μmol/L的SMZ溶液分别加入处理后的空白蜂蜜样品溶液中,在MnO2/ZnO/GCE复合电极的最优检测条件下进行测试,每组试验重复3次,将其测定的氧化峰电流响应值带入相应回归方程,计算其加标回收率。结果如表2所示,SMZ的加标回收率在95.3%~98.1%之间,RSD均小于3%,由此可知本实验所构建的电化学传感器具有较好的加标回收率及精密度。
表 2 磺胺甲恶唑的加标回收率及相对标准偏差Table 2. Spiked recoveries and RSD of SMZ检测物 加标量(μmol/L) 测得量(μmol/L) 回收率(%) 相对标准偏差(%) 5 4.90 98.1 0.85 SMZ 10 9.53 95.3 2.48 15 14.33 95.5 2.72 2.7 实际样品检测结果
为了评估所建方法在实际蜂蜜样品中的应用性,将其用于市售及散装蜂蜜的测定。结果显示,市售蜂蜜及散装蜂蜜样品均未检到SMZ残留,符合GB 31650-2019《食品安全国家标准食品中兽药最大残留限量》的标准[45]。对其进行加标回收测定,每组实验平行测定3次,结果如表3所示。实际蜂蜜样品中SMZ的加标回收率在95.5%~102.6%之间,RSD均小于3%。本实验所构建的电化学传感器具有一定的实用性,有望应用于实际蜂蜜样品中SMZ的检测。
表 3 实际样品中不同浓度磺胺甲恶唑的加标回收率及相对标准偏差Table 3. Spiked recoveries and RSD of real sample on different concentration of SMZ样品 加标量
(μmol/L)测得量
(μmol/L)回收率
(%)相对标准偏差
(%)市售蜂蜜 2 1.93 96.5 0.79 5 4.89 97.8 0.82 10 9.55 95.5 2.22 散装蜂蜜 2 1.97 98.5 2.55 5 5.13 102.6 1.03 10 10.13 101.3 0.68 3. 结论
本研究通过制备MnO2/ZnO二元复合材料,构建了一种能够快速、准确、灵敏地检测SMZ含量的MnO2/ZnO/GCE电化学传感器,实现了增大电化学响应信号的效果。该传感器检测SMZ的线性范围为0.3~100 μmol/L,检测限为0.39 μmol/L,定量限为1.30 μmol/L。将其应用于实际蜂蜜样品的检测,其加标回收率可达95.5%~102.6%,RSD为0.68%~2.55%,说明该传感器具有良好的灵敏度与精确度。本实验中两种电极材料均具备价格低廉、无毒、稳定性好的优点,所构建的电化学传感器具有较好的重现性、稳定性和抗干扰性,对于蜂蜜中SMZ残留量的检测具有可实际应用性。
-
表 1 不同修饰电极检测磺胺甲恶唑的性能对比(n=3)
Table 1 Comparison of the performance of different chemically modified electrodes for detecting SMZ (n=3)
表 2 磺胺甲恶唑的加标回收率及相对标准偏差
Table 2 Spiked recoveries and RSD of SMZ
检测物 加标量(μmol/L) 测得量(μmol/L) 回收率(%) 相对标准偏差(%) 5 4.90 98.1 0.85 SMZ 10 9.53 95.3 2.48 15 14.33 95.5 2.72 表 3 实际样品中不同浓度磺胺甲恶唑的加标回收率及相对标准偏差
Table 3 Spiked recoveries and RSD of real sample on different concentration of SMZ
样品 加标量
(μmol/L)测得量
(μmol/L)回收率
(%)相对标准偏差
(%)市售蜂蜜 2 1.93 96.5 0.79 5 4.89 97.8 0.82 10 9.55 95.5 2.22 散装蜂蜜 2 1.97 98.5 2.55 5 5.13 102.6 1.03 10 10.13 101.3 0.68 -
[1] LUO B, HUANG G H, YAO Y, et al. Investigation into the influencing factors and adsorption characteristics in the removal of sulfonamide antibiotics by carbonaceous materials[J]. Journal of Cleaner Production,2021,319(15):128692.
[2] LI X H, YANG Y Q, MIAO J J, et al. Determination of sulfa antibiotic residues in river and particulate matter by field-amplified sample injection-capillary zone electrophoresis[J]. Electrophoresis,2020,41(18-19):1584−1591. doi: 10.1002/elps.202000122
[3] LIU Y C, LIU Y J, LIU Z M, et al. Ultra-durable, multi-template molecularly imprinted polymers for ultrasensitive monitoring and multicomponent quantification of trace sulfa antibiotics[J]. Journal of Materials Chemistry: B,2021,9(14):3192−3199. doi: 10.1039/D1TB00091H
[4] LI L, ZHU Y, ZHANG F Y, et al. Rapid detection of sulfamethoxazole in plasma and food samples with in-syringe membrane SPE coupled with solid-phase fluorescence spectrometry[J]. Food Chemistry,2020,320(1):126612.
[5] KURC O, TURKMEN D. Molecularly imprinted polymers based surface plasmon resonance sensor for sulfamethoxazole detection[J]. Photonic Sensors,2022,12(4):1−15.
[6] SONG R, CHEN Q C, YAN L L, et al. Response surface optimization of an extraction method for the simultaneous detection of sulfamethoxazole and 17 β-estradiol in soil[J]. Molecules,2020,25(6):1415. doi: 10.3390/molecules25061415
[7] SANDRA D I B, LENKA K, LENKA V, et al. Sulfonamide residues: Honey quality in the czech market[J]. Journal of Food Quality,2018,2018(1):1−7.
[8] TURCO A, CORVAGLIA S, MAZZOTTA E, et al. Preparation and characterization of molecularly imprinted mussel inspired film as antifouling and selective layer for electrochemical detection of sulfamethoxazole[J]. Sensors and Actuators: B Chemical,2018,255(3):3374−3383.
[9] HUANG W H, SI H J, QING Y J, et al. A magnetic, core-shell structured, pH-responsive molecularly imprinted polymers for the selective detection of sulfamethoxazole[J]. Journal of Inorganic and Organometallic Polymers and Materials,2021,31(5):2054−2062. doi: 10.1007/s10904-021-01893-7
[10] JIN Y, ZHANG J Z, ZHAO W, et al. Development and validation of a multiclass method for the quantification of veterinary drug residues in honey and royal jelly by liquid chromatography-tandem mass spectrometry[J]. Food Chemistry,2017,221(15):1298−1307.
[11] 中华人民共和国国家质量监督检验检疫总局. GB/T 18932.17-2003 蜂蜜中16种磺胺残留量的测定方法液相色谱-串联质谱法[S]. 北京: 中国标准出版社, 2003. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 18932.17-2003 Method for the determination of sixteen sulfonamides residues in honey-LC-MS-MS method[S]. Beijing: National Standards Press, 2003.
[12] 蔡亮亮, 林昕, 倪荣华, 等. HPLC法同时测定磺胺止咳口服液中4个成分的含量[J]. 药学与临床研究,2022,30(3):217−220. [CAI L L, LIN X, NI R H, et al. Simultaneous determination of four components in sulfanilamide cough oral suspensions by HPLC[J]. Pharmaceutical and Clinical Research,2022,30(3):217−220. doi: 10.11881/j.issn.1673-7806.2022.3.jsyxylcyj202203005 [13] ERRAYESS S A, LAHCEN A A, IDRISSI L, et al. A sensitive method for the determination of sulfonamides in seawater samples by solid phase extraction and UV-Visible spectrophotometry[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2017,181(15):276−285.
[14] ISLAS G, RODRIGUEZ J A, HERNANDEZ M E P, et al. Dispersive solid-phase extraction based on butylamide silica for the determination of sulfamethoxazole in milk samples by capillary electrophoresis[J]. Journal of Liquid Chromatography & Related Technologies,2016,39(14):658−665.
[15] 赵玲钰, 秦思楠, 高林, 等. 磺胺嘧啶分子印迹电化学传感器的制备及其快速检测食品中磺胺嘧啶药物残留[J]. 食品科学,2018,39(22):319−327. [ZHAO L Y, QIN S N, GAO L, et al. Preparation and application of molecularly imprinted electrochemical sensor for rapid detection of sulfadiazine residues in foods[J]. Food Science,2018,39(22):319−327. doi: 10.7506/spkx1002-6630-201822048 [16] 徐军军, 吴甜甜, 席慧婷, 等. 一种新型过氧化氢传感器的构建及其在牛奶中的应用[J]. 食品工业科技,2020,41(22):253−259. [XU J J, WU T T, XI H T, et al. Construction of a novel hydrogen peroxide sensor and its application in milk[J]. Science and Technology of Food Industry,2020,41(22):253−259. doi: 10.13386/j.issn1002-0306.2020020082 [17] GUO S F, CHEN X Y, WANG P, et al. Preparation of molecularly imprinted composites initiated by hemin/graphene hybrid nanosheets and its application in detection of sulfamethoxazole[J]. Current Medical Science,2019,39(1):159−165. doi: 10.1007/s11596-019-2014-6
[18] MOHAMMED M R. Efficient formaldehyde sensor development based on Cu-codoped ZnO nanomaterial by an electrochemical approach[J]. Sensors and Actuators: B Chemical,2020,305(3):127541.
[19] MAMBO M, LEHUTSO R F, JONATHAN O O. Improved electro-oxidation of triclosan at nano-zinc oxide-multiwalled carbon nanotube modified glassy carbon electrode[J]. Sensors & Actuators: B Chemical,2015,209(3):898−905.
[20] CAO M C, ZHENG L T, GU Y F, et al. Electrostatic self-assembly to fabricate ZnO nanoparticles/reduced graphene oxide composites for hypersensitivity detection of dopamine[J]. Microchemical Journal,2020,159(7):105465.
[21] ZHENG R J, ZHAO C H, ZHONG J H, et al. Determination of epinephrine using a novel sensitive electrochemiluminescence sensor based on ZnO nanoparticles modified pencil graphite electrode[J]. International Journal of Electrochemical Science,2019,14(9):9380−9390.
[22] JANDAGHI N, JAHANI S, FOROUGHI M M, et al. Cerium-doped flower-shaped ZnO nano-crystallites as a sensing component for simultaneous electrochemical determination of epirubicin and methotrexate[J]. Mikrochimica Acta,2019,187(1):24.
[23] YUE X Z, LI Z Y, ZHAO S. A new electrochemical sensor for simultaneous detection of sulfamethoxazole and trimethoprim antibiotics based on graphene and ZnO nanorods modified glassy carbon electrode[J]. Microchemical Journal,2020,159(2):105440.
[24] ANSARI S, ANSARI M S, SOAMI P S, et al. Bi2O3/ZnO nanocomposite: Synthesis, characterizations and its application in electrochemical detection of balofloxacin as an antibiotic drug[J]. Journal of Pharmaceutical Analysis,2021,11(1):57−67. doi: 10.1016/j.jpha.2020.03.013
[25] HE Q G, LIU J, LIU X P, et al. Manganese dioxide nanorods/electrochemically reduced graphene oxide nanocomposites modified electrodes for cost-effective and ultrasensitive detection of Amaranth[J]. Colloids and Surfaces B: Biointerfaces,2018,172(1):565−572.
[26] ZHANG L, YUAN S M, YANG L M, et al. An enzymatic glucose biosensor based on a glassy carbon electrode modified with manganese dioxide nanowires[J]. Mikrochimica Acta: An International Journal for Physical and Chemical Methods of Analysis,2013,180(7-8):627−633.
[27] 贾丽芳, 李梅, 王国平. 二氧化锰修饰电极在甲硝唑检测中的应用[J]. 山东化工, 2021, 50(2): 105−107. JIA L F, LI M, WANG G P. Application of manganese dioxide modified electrode in metronidazole detection[J]. Shandong Chemical Industry 2021, 50(2): 105−107.
[28] 韩哲, 俞天寿, 柳宛彤, 等. 不同晶型二氧化锰的制备、表征及甲醛降解性能研究[J]. 中国计量大学学报,2021,32(1):124−131. [HAN Z, YU T S, LIU W T, et al. Preparation, characterization and catalytic degradation performance of formaldehyde of different manganese dioxide[J]. Journal of China University of Metrology,2021,32(1):124−131. doi: 10.3969/j.issn.2096-2835.2021.01.017 [29] ZHONG L L, SAMAL M, YUN K. Synthesis, characterization and electrochemical properties of different morphological ZnO anchored on graphene oxide sheets[J]. Materials Chemistry and Physics,2018,204(2):315−322.
[30] AIBITER E, MERLANO A S, ROJAS E, et al. Synthesis, characterization, and photocatalytic performance of ZnO-Graphene nanocomposites: A review[J]. Journal of Composites Science,2020,5(1):4. doi: 10.3390/jcs5010004
[31] 刘美琪, 陈学青, 王志彦, 等. 铁、钴掺杂氧化锌纳米材料及其红外吸波性能研究[J]. 人工晶体学报,2016,45(12):2785−2789. [LIU M Q, CHEN X Q, WANG Z Y, et al. Preparation and infrared wave absorbing properties of Fe, Co-doped nano-ZnO material[J]. Journal of Synthetic Crystals,2016,45(12):2785−2789. doi: 10.3969/j.issn.1000-985X.2016.12.008 [32] HAMID H H, MOHAMED H E, ELSHAER A M, et al. Electrochemical preparation and electrical characterization of polyaniline as a sensitive biosensor[J]. Microsystem Technologies,2018,24(4):1775−1781. doi: 10.1007/s00542-018-3793-6
[33] HENRIQUE M J, ROCHA C J, GABRIEL O G, et al. Disposable electrochemical sensor based on shellac and graphite for sulfamethoxazole detection[J]. Microchemical Journal,2021,170(5):106701.
[34] TASHKHOURIAN J, HEMMATEENEJAD B, BEIGIZADEH H, et al. ZnO nanoparticles and multiwalled carbon nanotubes modified carbon paste electrode for determination of naproxen using electrochemical techniques[J]. Journal of Electroanalytical Chemistry,2014,174(1):103−108.
[35] 常凤霞, 尚宗毅, 董清, 等. 纳米氧化铜-碳纳米管修饰玻碳电极同时检测邻、对苯二酚[J]. 应用化学,2020,37(10):1195−1202. [CHANG F X, SHANG Z Y, DONG Q, et al. Simultaneous determination of catechol and hydroquinone by copper oxide nanoparticles and carbon nanotubes modified glassy carbon electrode[J]. Chinese Journal of Applied Chemistry,2020,37(10):1195−1202. doi: 10.11944/j.issn.1000-0518.2020.10.200048 [36] YI W W, LI Z P, DONG C, et al. Electrochemical detection of chloramphenicol using palladium nanoparticles decorated reduced graphene oxide[J]. Microchemical Journal,2019,148(3):774−783.
[37] TURCO A, CORVAGLIA S, POMAP P P, et al. An innovative and simple all electrochemical approach to functionalize electrodes with a carbon nanotubes/polypyrrole molecularly imprinted nanocomposite and its application for sulfamethoxazole analysis[J]. Journal of Colloid and Interface Science,2021,599(1):676−685.
[38] BALASUBRAMANIAN P, SETTU R, CHEN S M, et al. Voltammetric sensing of sulfamethoxazole using a glassy carbon electrode modified with a graphitic carbon nitride and zinc oxide nanocomposite[J]. Microchimica Acta,2018,185(8):1−9.
[39] KOKULNATHAN T, KUAMR E A, WANG T J, et al. Strontium tungstate-modified disposable strip for electrochemical detection of sulfadiazine in environmental samples[J]. Ecotoxicology and Environmental Safety,2021,208(3):111516−111516.
[40] ARVAND M, ANSARI R, HEYDARI L. Electrocatalytic oxidation and differential pulse voltammetric determination of sulfamethoxazole using carbon nanotube paste electrode[J]. Materials Science & Engineering C,2011,31(8):1819−1825.
[41] 贺全国, 李广利, 刘军, 等. 纳米Cu2O-还原石墨烯复合修饰玻碳电极用于多巴胺的检测[J]. 食品科学,2018,39(20):308−314. [HE Q G, LI G L, LIU J, et al. Preparation of Cu2O-reduced graphene nanocomposite-modified electrodes and their application in detection of dopamine[J]. Food Science,2018,39(20):308−314. doi: 10.7506/spkx1002-6630-201820044 [42] ISSAC S, GIRISH K K. Voltammetric determination of sulfamethoxazole at a multiwalled carbon nanotube modified glassy carbon sensor and its application studies[J]. Drug Testing and Analysis,2009,1(7):350−354. doi: 10.1002/dta.69
[43] LORENA T R, ASUNCION M A L, OLGA D R, et al. Tyrosinase based biosensor for the electrochemical determination of sulfamethoxazole[J]. Sensors and Actuators: B Chemical,2016,227(1):48−53.
[44] DIEGO L C, GOLINELLI, SERGIO A S, et al. Synthesis of silver nanoparticle graphene composites for electroanalysis applications using chemical and electrochemical methods[J]. Electroanalysis,2017,29(4):1014−1021. doi: 10.1002/elan.201600669
[45] 国家市场监督管理总局, 国家卫生健康委员会, 农业农村部. GB 31650-2019 食品安全国家标准食品中兽药最大残留限量[S]. 北京: 中国标准出版社, 2019. State Administration for Market Regulation, National Health Commission, Ministry of Agriculture and Rural Affairs Announcement. GB 31650-2019 Naional food safety standard maximum residue limits for veterinary drugs in foods[S]. Beijing: National Standards Press, 2019.
-
期刊类型引用(2)
1. 伍蓉,贺灵芝,谭美玲,张华,阎睿. 重庆市蜂产品中31种农兽药残留检测方法开发及其膳食暴露风险评估. 中国酿造. 2025(02): 273-280 .  百度学术
百度学术
2. 蒋昆,余义冉,张雯雯,阮靖轩,石玉,陈雨,白红艳. 磺胺甲嗪(口恶)唑电化学检测方法的研究进展. 印染助剂. 2024(11): 13-16 .  百度学术
百度学术
其他类型引用(1)





 下载:
下载:




 下载:
下载:



